Method Article
Polydimethylsiloxane-פוליקרבונט התקני microfluidic הכימי בניצב תחת מחקרי נדידת תאים והדרגות חמצן
In This Article
Summary
The control of chemical and oxygen gradients is essential for cell cultures. This paper reports a polydimethylsiloxane-polycarbonate (PDMS-PC) microfluidic device capable of reliably generating combinations of chemical and oxygen gradients for cell migration studies, which can be practically utilized in biological labs without sophisticated instrumentation.
Abstract
מאמר זה מדווח על המכשיר microfluidic עשוי polydimethylsiloxane (PDMS) עם פוליקרבונט מוטבע (PC) סרט דק ללמוד נדידת תאים תחת שילובים של הדרגתיים כימיים וחמצן. שני מילויים הכימיים וחמצן יכולים להשפיע נדידת תאים מאוד in vivo; עם זאת, עקב מגבלות טכניות, מעט מאוד מחקר שבוצע לחקור התופעות שלהם במבחנה. המכשיר שפותח במחקר זה מנצל סדרה של תעלות בצורה מתפתלות כדי ליצור ההדרגתיים הכימי הרצויה ומנצל שיטת תגובה הכימית מוגבלת מרחבית עבור דור שיפוע חמצן. הכיוונים של הדרגתיים הכימיים וחמצן הם ניצבים זה לזה כדי לאפשר פרשנות תוצאת הגירה פשוטה. על מנת לייצר הדרגתיים החמצן ביעילות עם צריכה כימית מינימאלית, הסרט הדק PC המשובץ מנוצל כמחסום דיפוזיה גז. מכשיר microfluidic פתחניתן ומונע משאבה מזרק והניח לתוך תא חממה קונבנציונלית במהלך ניסויי נדידת תאים כדי לאפשר פישוט התקנה ותנאי תרבית תאים מותאמים. בניסויי תא, השתמשנו במכשיר ללמוד הגירות של תאי אפיתל בסיס המכתשית אדם adenocarcinomic, A549, תחת שילובים הכמוקין (גורם תאים שמקורם סטרומה, SDF-1α) והדרגות חמצן. תוצאות הניסוי הראו כי המכשיר יכול ליצור הדרגתיים chemokine וחמצן בניצב ביציבות והוא תואם עם תאים. תוצאות המחקר מצביעות על כך הגירה הדרגתית חמצן עשוי לשחק תפקיד חיוני המנחה נדידת תאים, והתנהגות הסלולר תחת שילובים של הדרגתיים לא ניתן לחזות מאלה תחת הדרגתיים יחידים. המכשיר מספק כלי רב עצמה ומעשית לחוקרים ללמוד אינטראקציות בין הדרגתיים הכימיים חמצן תרבית תאים, אשר יכול לקדם מחקרי נדידת תאים טובים יותר in vivo-כמו microenvironments.
Introduction
ההתפלגות המרחבית של גורמים מסיסים מתח החמצן יכול לווסת מספר תפקודים תאיים חשובים in vivo 1, 2, 3, 4. כדי לחדד לחקור את השפיעו על תאים, פלטפורמת תרבית תאים במבחנה מסוגלת לייצר ביציבות הדרגתית כימי וחמצן היא מאוד רצויה. גורמים מסיסים שונים ממלאים תפקידים מרכזיים פעילויות ביולוגיות ולהשפיע התנהגות הסלולר. לאחרונה, בשל לקידום טכניקות microfluidic, מספר מכשירי microfluidic מסוגלים הדרגתיים כימי ליצירה ביציבות פותח כדי ללמוד תא גירה 5. יתר על כן, מספר מחקרים הראו גם את הצורך של מתח חמצן עבור בתרביות תאים במבחנה 6, 7, 8. למרות זאת,השליטה של מתח חמצן עבור תרבית תאים בעיקר מסתמכת על כן כימי ישירים עבור חממות הדחה או תא חמצן עם בלוני גז בלחץ. בנוסף כימי ישיר משנה את תרבית תאים בינוניים ומשפיע על התגובות הסלולר. חממות מלאות חמצן דורשות עיצוב חממה מיוחד, בקרת זרימת גז מדויקת, כמויות גדולות של גז חנקן על מנת להשיג תנאים היפוקסיה. יתר על כן, הוא מעשי לשלוט הפריסה המרחבית של חמצן באמצעות התקנה זו, אשר מפגרת במחקר התנהגות הסלולר תחת מתחים והדרגות חמצן שונים. כדי להתגבר על המגבלות האלה, מספר מכשירי microfluidic פותח כדי ליצור הדרגתיים חמצן עבור יישומי תרבית תאים 9. עם זאת, רובם מופעלים באמצעות גזים בלחץ, והדבר עלול לגרום לבעיות אידוי בועה הדור. לכן, לעתים קרובות הם דורשים מכשור מתוחכם ולא יכול להיות אמין עבור studie תרבית תאים לטווח ארוךים.
כדי להתגבר על האתגרים ולהמשיך ללמוד את יחסי הגומלין בין הדרגתיים כימיים וחמצן עבור נדידת תאים, פיתחנו מכשיר תרבית תאים microfluidic עשוי polydimethylsiloxane (PDMS) עם פוליקרבונט מוטבע (PC) סרט דק 10. המכשיר מורכב משתי שכבות ערוץ microfluidic מופרדים על ידי קרום PDMS. השכבה העליונה היא שכבת PDMS-PC עבור דור שיפוע חמצן; השכבה בתחתית עשויה PDMS עבור דור שיפוע כימי תרבית תאים. המכשיר יכול בו זמנית לייצר הדרגתי כימית וחמצן בניצב ללא שימוש בלוני גז ומערכות בקרת זרימה מתוחכמות. במכשיר, PDMS מספק שקיפות אופטית גדולה, חדירות גז, תאימות ביולוגית לתרבות הדמיה תא. סרט PC מוטבע משמש כמחסום דיפוזיה גז לבקרת מתח חמצן יעיל. באפיק microfluidic, השתמשנו בסדרה של ערוץ בצורת עקלתוןים כדי ליצור הדרגתיים כימיים. העיצוב נוצל בצורה רחבה כדי ליצור הדרגתיים כימי מכשירי microfluidic עבור יישומים שונים בשל האמינות שלה ועל הגדרת ניסוי קלה. יתר על כן, את פרופילי השיפוע הכימי יכולים להיות מתוכנן על ידי שינוי גיאומטריות הערוץ מראש עם סימולציה נומרית. עבור דור שיפוע חמצן, לקחנו את היתרון של שיטת התגובה הכימית המוגבלת מרחבית אשר פותחה בעבר במעבדה שלנו 10, 11, 12. החמצן ניתן שנלקח מן השטחים המיועדים בלי הקאת חנקן. לשימוש מעשי במעבדות ביולוגיות, הגדרת הניסוי כולו תואמת חממות תרבית תאים קונבנציונליות. על ידי שילוב שיטות אלה, אנחנו יכולים בו זמנית לייצר הדרגתיים כימיים וחמצן יציב ללא בלוני גז בצובר מכשור מתוחכם כדי ללמוד נדידת תאים.
Protocol
ייצור 1. של המכשיר microfluidic
הערה: מכשיר microfluidic כולו מפוברק באמצעות תהליך הדפוס העתק ליתוגרפיה הרך 13.
- ייצור של תבניות עבור שכבות PDMS במכשיר microfluidic
- עיצוב דפוסי הערוץ microfluidic באמצעות המחשה זמינה מסחרי או ציור תוכנה. שלח את הקובץ לחברה עבור photomask שקיפות ברזולוציה גבוהה הדפסת 14.
- פרוסות סיליקון נקי עם אצטון (≥99.5%), אלכוהול איזופרופיל (IPA; ≥99.9%), ו לחרוט תחמוצת שנאגרו (BOE; 6: 1 NH 4 F.HF). לשטוף עם deionized (DI) מים מייבשים את פרוסות עם אקדח חנקן.
- ספין מעיל המשוער 20 גרם של photoresist הטון השלילי, SU-8 2050, על ופלים ב 500 סל"ד במשך 15 שניות ולאחר מכן 2,000 סל"ד למשך 30 שניות.
הערה: תנאי ציפוי הספין אמור להניב SU-8 2050 צילוםלהתנגד שכבות בעובי של כ 75 מיקרומטר על הוופלים לאחר ליתוגרפיה אופטית. - לאפות Soft הוופלים על פלטה חמה C 65 מעלות במשך 3 דקות ולאחר מכן ב 95 מעלות צלזיוס במשך 9 דקות. לאחר לאפות הרכים, לחשוף את הפרוסות באמצעות aligner מסכה עם מסכות השקיפות עוצבו תחת אור UV; האנרגיה סך החשיפה צריך להיות בערך 300 mJ / 2 ס"מ. לאפות לאחר חשיפה (PEB) ופלים ב 65 מעלות צלזיוס למשך 2 דקות ולאחר מכן ב 95 מעלות צלזיוס למשך 7 דקות.
- לאחר PEB, לטבול את הפרוסות ב מפתח SU-8 עם תסיסה חזקה או באמבטיה קולית (37 קילוהרץ ו -180 כוח קולי יעיל W) עבור 7 דקות. שוטפים את פרוסות סיליקון עם אצטון IPA להסיר את SU-8 שיורית.
- מניחים את פרוסות ו 100 μl של silane (1H, 1H, 2H, 2H-perfluorooctyltrichlorosilane) לתוך צלחת 6 ס"מ קוטר פטרי ייבוש הקשורים משאבת ואקום הסרעפת עבור silanization משטח רקיק כדי למנוע מליטה רצויים. הפעל את המשאבה במשך 15 דקות, לכבות אותו, ולאטום את הייבוש עם ואקום למשך 30 דקות.
- קח את פרוסות silanized מתוך ייבוש ואת קלטת אותם ל -15 מנות ס"מ קוטר פטרי לתהליך ליתוגרפיה רך הבאים:
- ייצור והרכבה של שכבות PDMS
- הכנת הפולימר מראש PDMS
- מערבבים מונומר PDMS (בסיס) ואת סוכן ריפוי בכל 10: 1 יחס (v / v). דג את תערובת התקנת הייבוש למשך 60 דקות.
- המצאה של שכבת PC-מוטבע העליונה
- העברת 2 גרם של PDMS מראש פולימר על התבנית עם דפוסי ערוץ fluidic-השכבה העליונה כדי ליצור שכבה דקה של PDMS. מניחים את התבנית בתוך ההתקנה ייבוש דגה את PDMS למשך 60 דקות.
- מניחים את לילה עובש בתנור 60 מעלות צלזיוס במשך ריפוי PDMS. ודא כי העובש הוא על משטח אופקי.
- לצנן את התבנית לטמפרטורת החדר. יוצק -13 גרם נוסף של מראש פולימר PDMS על התבנית ודג את PDMS ב הדואר התקנת ייבוש למשך 60 דקות.
- לאט להטביע סרט PC בעובי 1 מ"מ לתוך שכבת PDMS הטריה כמחסום דיפוזיה גז; לגרש כל בועות במידת הצורך.
- שים את לילה עובש בתנור 60 מעלות צלזיוס, ולוודא שזה על משטח אופקי.
- לצנן את PDMS נרפא לטמפרטורת החדר. חותכים את המכשיר עם אזמל על שטח של כ 5.5 x 5 ס"מ 2, אשר יכול לכסות את כל דפוסי ערוץ, לקלף את לוח PDMS מהתבנית.
- פונץ 'חורים עבור צריכת האוויר של שקעים באמצעות אגרוף ביופסיה 2 מ"מ בקוטר. אחסן את שכבת PDMS-PC העליונה המפוברקת הרחק אבק הסביבה להרכבה מאוחר יותר.
- המצאה של שכבת PDMS התחתונה
- יוצקים 11 גרם של מראש פולימר PDMS על עובש על השכבה התחתונה. מניחים את התבנית בתוך ייבוש דגה את PDMS למשך 60 דקות. שמור על לילה עובש בתנור C 60 ° כדי לרפא את PDMS. ודא כי הוא שוכב על משטח אופקי.
- להתקרר הPDMS דואר לטמפרטורת החדר. חותכים את המכשיר על שטח של כ 5.5 x 5 ס"מ 2, אשר יכול לכסות את כל דפוסי הערוץ, לקלף אותו של עובש. אחסן את שכבת PDMS התחתונה המפוברקת הרחק אבק הסביבה להרכבה מאוחר יותר.
- המצאה של הממברנה PDMS
- ספין מעייל 4 גרם משוער של טרום פולימר PDMS על גבי פרוסות ריקות silanized ב 100 סל"ד במשך 90 שניות ולאחר מכן 3,000 סל"ד במשך 4 שניות. אופים את פרוסות סיליקון מצופה ספין בתוך 60 ° C בתנור למשך הלילה.
- ההרכבה של המכשיר
- מניח את השכבה העליונה PDMS-PC מפוברק רקיק עם קרום PDMS מצופה ספין במכונת טיפול פני שטח O 2 פלזמה עם המשטחים המליטים הפונים כלפי מעלה. פנק את משטחי PDMS עם 90 ואט של פלזמת O 2 במשך 40 שניות.
- איגרות החוב השכבה העליונה על הממברנה PDMS מיד לאחר הטיפול משטח פלזמה O 2. מניחים משקל (כ -600 גר ') על גבי שכבות מלוכדות ולשים אותם בתוך60 ° C בתנור למשך הלילה כדי לקדם מליטה.
- לצנן את השכבות המלוכדות לטמפרטורת חדר וחותך את הקרום מלוכד אל השכבה העליונה עם אזמל על שטח של כ 5.5 x 5 סנטימטר 2, אשר יכול לכסות את כל דפוסי הערוץ. לקלף את המבנה מלוכד מן פרוסות סיליקון ו מחורר על פתחי הכניסה והיציאה של ערוץ השיפוע הכימי באמצעות אגרוף ביופסיה 2 מ"מ בקוטר.
- מניח את שכבת מלוכדות הקרום העליונה ואת השכבה התחתונה PDMS מפוברק במכונה משטח טיפול O 2 פלזמה, עם המשטחים המליטים פונה כלפי מעלה, כדי להפעיל את משטחי PDMS באמצעות הפלזמה ב 90 ואט במשך 40 שניות.
- צרף השכבות העליונות ותחתונות יחד מליט מייד לאחר טיפול פני השטח. מניחי משקל (כ -600 גר ') על גבי המכשיר מלוכד כולו לשים אותו בתוך 60 ° C בתנור למשך לילה.
- קח את התקן מפוברק כולו מהתנור להתקרר אותו לטמפרטורת החדר.
- הכנת הפולימר מראש PDMS
2. Assay נדידת תאים Microfluidic
הערה: במאמר זה, אנו משתמשים שורת תאים נפוץ, תא אפיתל הבסיס המכתשית האדם adenocarcinomic (A549), וכן chemokine, תא סטרומה גורם נגזר (SDF-1α), כדוגמאות. חוקרים העובדים על תאים אחרים וכמוקינים, בבקשה להתאים את תהליכי הניסוי בהתאם.
- יום 0: תא הכנה
- תרבות המנייה של תאי A549 במדיום גידול מלא המכילים DMEM F12 תחליף L- גלוטמין, 10% (V / V) בסרום שור עוברי (FBS), ו -1% (v / v) פתרון antimycotic antimicrob. תת-תרבות על ידי ניתוק עם 0.25% טריפסין- EDTA.
- כן השעיות תא עבור הניסויים על ידי צנטריפוגה תאים ניתקו ב 140 XG במשך 3 דקות בטמפרטורת חדר. עבור הניסויים המכשיר microfluidic, לספור את התאים באמצעות hemocytometer וזרעי לפחות 1 x 10 6 תאים בבקבוק T75 עם 10 מ"ל של שלמהמדיום גידול.
הערה: כל תהליכי תרבית תאים מבוצעים באינקובטור עם 37 מעלות צלזיוס, 5% CO 2 אווירה.
- יום 1: הכנת התקן
- מניחים את המכשיר למכונת פלזמה O 2 ומתייחסים אליה פלזמה O 2 ב 90 וואט במשך 40 שניות כדי להבהיר את ערוץ microfluidic משטחים הידרופילי.
- מייד לאחר טיפול פני השטח, להתקין שתי 14 G מחטים בוטות על ידי החדרת המחטים ישירות לתוך החורים בקוטר 2 מ"מ אגרוף לתוך שכבת PDMS על צריכת האוויר של ערוץ השיפוע הכימי. ודא כי המחטים אינם חוסמים את ערוצי microfluidic. צייר 0.8 מ"ל של DDH 2 O באמצעות מזרק 1 מ"ל עם מחט 14 G בוטה. להזריק את DDH 2 O לתוך תעלת השיפוע הכימי משקע עד שהמים זורמים החוצה משתי המחטים על צריכת האוויר.
- הכן 1 מ"ל של 50 מיקרוגרם / מ"ל פתרון פיברונקטין ידי דילול המניות פיברונקטין עם Dulbecco & #39; s פוספט-בופר (DPBS).
- להשרות פתרון פיברונקטין המשקע של ערוץ השיפוע הכימי באמצעות מזרק 1 מיליליטר עם מחט 14 G בוטה עד הפתרון זורם החוצה משתי המחטים על צריכת האוויר.
- דגירת לילה המכשיר כולו בתוך תרבית תאי חממה קונבנציונלית.
- הדמית זריעת תאים במיקרוסקופ: יום 2
- זריעת תאים
- לשאוב את המדיום מתאי כי היו בתרבית מאז יום 0 לשטוף את התאים עם 5 מ"ל של DPBS 2 פעמים. לשאוב DPBS, להוסיף 2 מ"ל של טריפסין-EDTA, דגירה התאים בחממה במשך 5 דקות כדי לנתק את התאים מפני השטח הבקבוק.
- המתן עד תאים מנותקים ותלויה הפתרון ולהוסיף 8 מ"ל של מדיום סרום ללא (DMEM F12 + 1% (v / v) antimicrob-antimycotic פתרון) אל הבקבוק. להעביר את כל הנוזל לתוך צינור חרוטי 15 מ"ל ו צנטריפוגות אותו ב 140 XG במשך 5 דקות בטמפרטורת החדר.
- לשאוב supernatant לאחר צנטריפוגה ולהוסיף כמות מתאימה של המדיום סרום חופשיים להפיק את צפיפות התאים הסופי 1 x 10 6 תאים / מ"ל. קח את המכשיר microfluidic מוכן ביום 1. ספירת התאים באמצעות hemocytometer או מכשיר אחר ספירת תאים אוטומטי.
- להזריק סרום ללא בינוני משקע של ערוץ שיפוע כימיים באמצעות מזרק 1 מ"ל עם מחט 14 G בוטה עד בינוני זורם החוצה משני מחטים על צריכת האוויר. להזריק 200 μl של השעית התא המשקע של ערוץ השיפוע הכימי.
- שים את תא תרבית תאים במכשיר תחת מיקרוסקופ כדי לאשר כי התאים הוכנסו לערוץ microfluidic. מניחים את המכשיר לתוך מיכל לח (למשל, קופסת פלסטיק עם DDH 2 O בפנים) ולשמור אותו בתוך חממה תרבית תאים עבור 5 שעות כדי לקדם את הידבקות של תאים על פני השטח את המכשיר.
- הכנת reagהמציג לייצור שיפוע כימי
- הכן את כימיים (-1α SDF) בריכוז הרצוי (100 ng / ml) במדיום סרום ללא. צייר את סרום ללא בינוני עם ובלי כימי לשני מזרקים נפרד 3 מ"ל מחובר צינורות טוהר גבוהה. הגדר את המזרקים על משאבת מזרק עם קצב זרימה של 1 μl / min לשימוש מאוחר יותר.
- הכנת ריאגנטים עבור דור שיפוע חמצן
- הפוך 15 מ"ל של 1 פתרון M NaOH ו -15 מ"ל של 200 מ"ג / מ"ל pyrogallol פתרון. צייר את NaOH ופתרונות pyrogallol לשני מזרקים נפרד 15 מ"ל מחובר צינורות PTFE טוהר גבוהה צינורות טוהר גבוהה, בהתאמה. הגדר את המזרקים על משאבת מזרק עם קצב זרימה של 5 μl / min לשימוש מאוחר יותר.
- הגדרת המכשיר microfluidic
- לאחר דגירה 5 שעות, לקחת את המכשיר כולו החוצה והנח אותה על צלחת פטרי בקוטר 15 ס"מ. תקן את המכשיר בצלחת פטרי באמצעות מרק דבק. מעביר אתצלחת פטרי כדי מיקרוסקופ הדמיה תא חי באינקובטור.
- חבר את הצינורות מן המזרקים עבור דור השיפוע הכימי אל פתחי הכניסה של ערוץ השיפוע הכימי. חבר היציאה אל צינורות המובילים למאגר פסולת. הפעל את משאבת המזרק עם המזרקים עבור דור שיפוע כימי.
- חבר את הצינורות הטוהרים הגבוהה מן המזרקים המכילים NaOH ו pyrogallol אל פתחי הכניסה של ערוץ שיפוע חמצן. חיבור צינורות לשקע כדי לאסוף את הפסולת. הפעל את משאבת המזרק עם המזרקים עבור דור שיפוע חמצן.
- מוסיף כ 15 מיליליטר של DDH 2 O כדי בצלחת פטרי כדי להרחיק את המכשיר הלח. הגדר את המיקרוסקופ הדמיה תא חי עבור לכידת תמונה-שפקע הזמן, ולקחת תמונה כל 15 דק '.
- זריעת תאים
- יום 3: איסוף נתונים וניתוח
- העבר את קובצי התמונה שצולמה למחשב. לנתח את התמונות באמצעות דימוי קוד פתוחalysis תוכנה, ImageJ, עם תוסף קוד פתוח עבור מעקב ידני (https://imagej.nih.gov/ij/plugins/track/track.html) ומתוכנת Chemotaxis כלי חינם (http://ibidi.com/xtproducts / he / תוכנה-ו-תמונה-ניתוח / ידני-תמונה-ניתוח / Chemotaxis-ו-הגירה-כלי) 15, 16.
אפיון 3. ההדרגתיים
הערה: ההדרגתיים הכימית וחמצן ניתן לאפיין לפני או אחרי ניסויי התא.
- סימולציה נומרית של השיפוע הכימי
- להעריך את אופי הזרימה למינרית של מיקרופלואידיקה באמצעות דינמיקה fluidic חישובית סימולציה (CFD).
- אפיון ניסיוני של שיפוע חמצן
- כן צבע פלואורסצנטי רגיש חמצן, טריס (2,2'-bipyridyl) רותניום (III) כלוריד hexahydrate, פתרון במים בריכוז של 5מ"ג / מ"ל.
- צייר את הפתרון לצבוע רגישים-חמצן לשני מזרקים נפרד 3 מ"ל מחובר צינורות טוהר גבוהה. הגדר את המזרקים על משאבת מזרק עם קצב זרימה של 1 μl / min (זהה הספיקות המשמשות דור השיפוע הכימי).
- חבר את הצינורות מן המזרקים אל פתחי הכניסה של ערוץ השיפוע הכימי. חבר היציאה אל צינורות המובילים למאגר פסולת. הפעל את משאבת המזרק עם המזרקים עבור דור שיפוע כימי.
- למדוד את עוצמת הקרינה באמצעות מיקרוסקופ פלואורסצנטי הפוך עם אור העירור עובר דרך מסנן אופטי ננומטר 470 ± 20. אסוף את אור הפליטה דרך פילטר פליטה 515 ננומטר ארוך לעבור באמצעות מצלמת CCD מגניבה.
- חבר את הצינורות הטוהרים הגבוהה מן המזרקים המכילים NaOH ו pyrogallol אל פתחי הכניסה של ערוץ שיפוע חמצן. חיבור צינורות לשקע כדי לאסוף את הפסולת. הפעל את משאבת מזרק עם מזרקים עבור חמצןדור שיפוע.
- אסוף את תמונות הקרינה של צבע החמצן רגיש זורם בתא תרבית תאים.
- עצור את הזרימה לייצור שיפוע חמצן וניתקת את כל הצינורות לערוץ דור חמצן. חיבור צינורות-טוהר גבוה מן בלוני גז לשקע של ערוץ שיפוע חמצן.
- אסוף את התמונות הקרינה של צבע חמצן רגיש זורם בתא תרבית תאים כאשר זורם אוויר, חנקן טהור, וחמצן טהור לתוך צינורות המחובר לערוץ שיפוע חמצן.
- להעריך את הדרגתיים חמצן על ידי ניתוח תמונות הקרינה באמצעות המשוואה שטרן-Volmer פי הפניות 10 ו -11.
תוצאות
PDMS-PC מפוברק מכשיר תרבית תאים microfluidic היברידית. תאנה. 1 מציג תמונה להמחשה בלבד של מכשיר microfluidic. השכבה התחתונה מכילה ארבע רמות של תעלות בצורה מתפתלות כדי לייצר פתרונות מ ריאגנטים הציג שני פתחי כניסה מופרדים עם שישה יחסי ערבוב שונים. באופן תיאורטי, את ששת יחסי ערבוב שונים 1: 0, 4: 1, 3: 2, 2: 3, 1: 4, ו -0: 1 (משמאל: מימין) בין שני הפתרונות הציג פתחי הכניסה. ההדרגתיים הכימי נבנה על ידי ששת פתרונות ערבוב היחס השונים יכול להיות שנוצר בתא תרבית תאים, ממוקם במורד זרם. השכבות העליונות ותחתונות מופרדות על ידי קרום PDMS. בשכבה העליונה, ריאגנטים עבור התגובה הכימית הדחת החמצן מוכנסים ערוץ microfluidic משתי צריכת אוויר נפרדת. ריאגנטים מעורבבים זה בזה על התגובה מיד לפני זורם על גבי תא תרבית תאים כדיscavenge החמצן מהערוץ התחתון, ללא קשר כימי ישיר. סרט PC המוטבע, עם מקדם דיפוזיה גז קטן יותר בהשוואת PDMS, משמש כמחסום דיפוזיה שגורם הדחת חמצן יעילה יותר. חמצן בהדרגה מפזר בחזרה לתא תרבית תאים באמצעות PDMS באזור במורד הזרם כדי ליצור שיפוע חמצן לאורך כיוון הזרימה. מאז התגובה הכימית הדחת חמצן מוגבלת מרחבית, מתחי חמצן מקומיים בלבד מושפעים. כתוצאה מכך, המכשיר יכול להיות מנוצל תא חממה קונבנציונלית ללא שינוי מתח החמצן הגלובלי שלה. בניסויי ההגירה, תאים הם זורעים בתוך חדר תרבית תאים לצורך ההשגחה. מדיום הצמיחה ריאגנטים כימי פוגשים את המכשיר באמצעות משאבות מזרק עם ספיקות לשלוט באופן מדויק.
אפיון של הדרגתיים כימיים וחמצן שנוצר בתוך המכשיר. בשל tהוא למינרית לזרום אופי מיקרופלואידיקה, התנהגויות זרימת ניתן לחזות באמצעות דינמיקה fluidic חישובית סימולציה (CFD). במאמר זה, בנינו מודל 3D ובצעו הסימולציה באמצעות תוכנת מודלי multiphysics זמינה מסחרי. תאנה. 2 (א) מציג השוואה בין פרופילי ריכוז והעמסת מאופיין ניסיוני לרוחב חדר תרבית תאים בהתבסס על מדידות עוצמת קרינה ואת תוצאות הסימולציה נומרית. ההסכם בין תוצאות סימולציה והניסיוניות עולה כי מודל CFD יכול גם להעריך את הדרגתיים הכימיים שנוצרו בתוך המכשיר. תאנה. 2 (ב) מגרש שיפוע SDF-1α המדומה שנוצר בתא תרבית תאים. תאנה. 3 מציגים את תוצאות אפיון שיפוע חמצן על ידי זורם לצבוע קרינה רגישה-חמצן בתוך תא תרבית תאים לפני ניסויי התא. התוצאה מעידה כי gradi חמצןאף אוזן גרון, החל בערך 1 ל -16%, ניתן לקבוע באמצעות הפרוטוקול הנ"ל.
תוצאות נדידת תאים. כמו הפגנה, ביצענו מחקרים נדידת תאים A549 מתחת לגיל 4 שילובים הכמוקין (-1α SDF) והדרגות חמצן: (1) לא chemokine ולא הדרגתיים חמצן כביקורת, (2) עם שיפוע chemokine וללא שיפוע חמצן, (3) עם שיפוע חמצן וללא שיפוע chemokine, ו- (4) עם שני chemokine והדרגות חמצן. תאנה. 4 מראה את התמונה של הגדרת הניסוי כולו. הניסויים כל בוצעו בתוך תרבית תאי חממה קונבנציונלית עם ההתקנה כולה (כולל מכשירי microfluidic, משאבות מזרק, ומיקרוסקופי הדמית תא חיים) להציב בתוכו. תוצאות נדידת תאים מוצגות בתרשים. 5. תאנה. 5 (א) מציג את התמונות שנאספו במהלך הניסויים באמצעות הדמיה תא חי ana Lyzer, ו איור. 5 (ב) ו- (ג) מגרשים מסלולי נדידת תאים ותנועות ממוצעים לפי ארבעה שילובים ונותחו על ידי תוכנת ImageJ עם התוספים. התוצאות מראות כי מרחק נדידת תאים הממוצע בבקרה שואף לאפס, אשר טוענת תנועה אקראית של התאים בניסוי. לעומת זאת, עם שיפוע chemokine בלבד, התנועה הממוצעת של התאים הוא פונה לצד השמאלי, שבו הריכוז-1α SDF גבוה. התוצאות מצביעות על התנהגות chemotaxis SDF-1α של תאי A549, אשר דווח בעבר. בניסוי עם מילויי חמצן בלבד, התנועה הממוצעת של התאים היא כלפי מעלה, שבו מתח החמצן נמוך. עוד מעניין, בניסוי עם מילויי chemokine וחמצן בניצב, התנועה הממוצעת של התאים היא כלפי מעלה ללא כל תנועה ברורה בכיוון האופקי (כיוון שיפוע chemokine).
together.within-page = "1"> 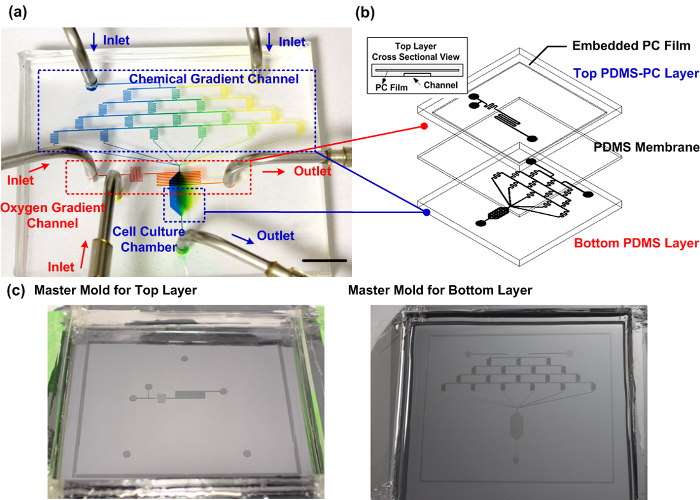
איור 1: התקן תרבית תאים microfluidic מפוברק PDMS-PC. (א) צילום הניסיון של המכשיר המפוברק מסוגל לייצר הדרגתי כימית וחמצן בניצב מהימן ללימודי נדידת תאים. ערוץ השיפוע הכימי מלא צבעי מאכל כחולים וצהובים כדי להדגים את דור השיפוע בתוך חדר תרבית תאים. ערוץ שיפוע החמצן מלא צבע מאכל אדום. הבר קנה המידה הוא 1 ס"מ. (ב) סכמטי של המכשיר microfluidic. השכבה העליונה היא מפוברקת באמצעות PDMS עם שכבת PC מוטבעת כמחסום דיפוזיה גז לבקרת שיפוע חמצן יעיל בתוך חדר תרבית תאים. (ג) תבניות ההורים עבור הייצור של שכבות העליונות ותחתונות. אנא לחץ כאן כדילצפות בגרסה גדולה יותר של דמות זו.
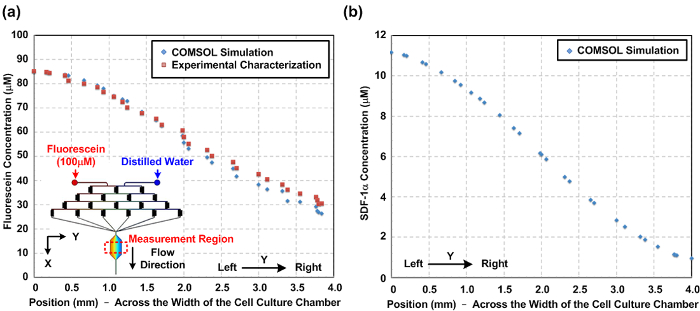
איור 2: שיפוע כימי בתוך המכשיר סלולארי התרבות microfluidic. (א) מדומה מספרי ניסיוני מאופיין מפל ריכוזים והעמסה בתוך חדר תרבית תאים לרוחב חדר תרבית תאים (בכיוון Y). הדמיון בין הדרגתיים נמדדו המדומים בניסוי עולה כי הסימולציה יכולה גם לחזות את השיפוע הכימי. הבלעת האיור מציגה את המודל תלת-ממדי (3D) שנבנה הסימולציה. (ב) תוצאת סימולציה נומרית של שיפוע chemokine-1α SDF לרוחב חדר תרבית תאים ללימודי נדידת תאים. אנא לחץ כאן כדי להציגגרסה גדולה יותר של דמות זו.
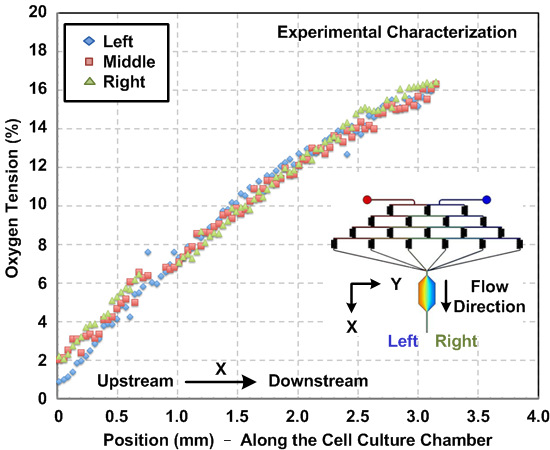
איור 3: שיפוע חמצן בתוך מכשיר תרבית תאי microfluidic. ניסיוני נמדד הדרגתי חמצן בתוך תא תרבית תאים לאורך כיוון הזרימה. ההדרגתיים נאמדו באמצעות צבע פלואורסצנטי ניתוח תמונה רגיש-חמצן. הדרגתיים, משמאל לימין של החדר, מאופיינים, ואת התוצאות מראות פרופילים שיפוע עקבי לרוחב של החדר.

איור 4: תמונות של הגדרת הניסוי. ההתקנה כולה, כולל מכשירי microfluidic, משאבות מזרק, ו מיקרוסקופ הדמית תא חי, ממוקמת בתוך תרבית תאי חממה קונבנציונלית עבור אופטימיזציהתנאי תרבית תאים במהלך הניסויים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
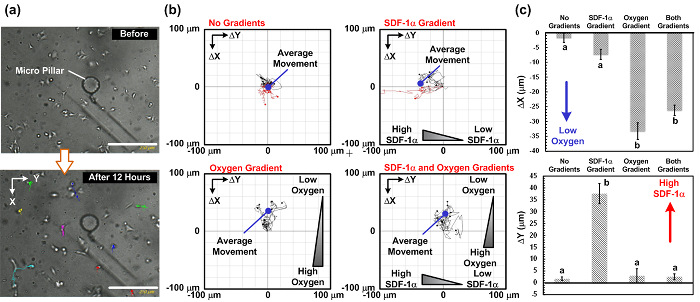
איור 5: נדידת תאים תוצאות המחקר תחת הדרגתיים SDF-1α וחמצן בניצב. (א) תמונות שנתפסו לפני ואחרי מחקר נדידת תאי 12 שעות. שבילי נדידת תאים ניתן לנתח מתמונות הזמן שפקע שנתפסו באמצעות מיקרוסקופ הדמית תא החי. (ב) שבילי נדידת תאים ותנועת ההגירה הממוצעת נתחה מן התמונות שנתפסו תחת 4 שילובי שיפוע שונים: אין שיפוע, שיפוע chemokine בלבד, שיפוע חמצן בלבד, ושניהם הדרגתיים chemokine וחמצן. התמונות נתפסו כל 15 דק '. סרגל הסולם הוא 250 מיקרומטר. (ג) מגרשים של מרחקי נדידת תאים הממוצעים (שיפוע חמצן) בניצב ואופקי (שיפוע chemokine) הוראות לפי ארבעה שילובי שיפוע שונים. הנתונים באים לידי ביטוי כממוצע ± סטיית תקן, המתקבל שלושה סטים ניסיוני עצמאי, ו -10 תאים נותחו בכל ניסוי. הסטטיסטיות משמעותי השונות (מבחן t המזווג, p <0.01) התוצאות מיועדות על ידי אותיות שונות (A ו- B). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
השלבים הקריטיים ביותר לפברק את PDMS מכשיר microfluidic עם סרט דק PC משובץ: (1) גירוש כל הבועות בעת הכנסת סרט PC לתוך PDMS מראש פולימר תוך בודה את שכבת PDMS-PC העליונה (2) ולוודא כל PDMS ריפוי תהליכים מבוצעים על משטח אופקי מפולס היטב. בניסויי נדידת תאים, השלבים הקריטיים ביותר הם: (1) ביטול הבועות בתוך המכשיר microfluidic, צינורות, משאבות מזרק במהלך הניסויים; (2) על מנת להבטיח כי המכשיר microfluidic מושם על משטח אופקי מפולס היטב במהלך ההדמיה תא חי עבור תצפית נדידת תאים; ו (3) שמירה על מכשיר לחות על ידי הוספת DDH 2 O כדי בצלחת פטרי במהלך הניסויים ולוודא כי המים לא התייבש.
כדי לפברק את PDMS-PC ההיברידי microfluidic המכשיר בהצלחה ללא delamination, חשוב להסיר את כל הבועות במהלך fi PCכניסת lm. סרט PC יכול להיות מוכנס לאט מזווית (כ -15 עד 30 מעלות מן PDMS שטח מראש פולימר) כדי למנוע דור בועות במהלך ההחדרה של סרט PC לתוך PDMS מראש הפולימר. במידת צורך, הפולימר מראש PDMS כולו עם סרט PC המוטבע יכול להיות ממוקם בתוך תא הייבוש מחובר משאבת הוואקום במשך 10 דקות כדי להרחיק את בועות לכודים. אם הסרט PC צף למעלה לאחר תהליך ואקום, קצה פיפטה ניתן להשתמש כדי ללחוץ על הסרט PC למטה על שכבת PDMS נרפא. חזור על תהליכי הוואקום ולחץ במידת צורך.
עבור ניסויי התא, חוסר בועות אוויר הוא קריטי עבור תרבית תאי microfluidic. יש לוודא שאין בועות אוויר מוכנסי התקנת microfluidic כולו (כולל משאבות מזרק, צינורות, ואת מכשיר microfluidic) בעת ביצוע חיבורים. אם בועות אוויר נוצרות בתוך ההתקנה microfluidic כתוצאה מהירידה של מסיסות גז תחת הטמפרטורה הגבוהה של experiments בתוך האינקובטור, כל הרכיבים הניסוי (כולל מזרקים צינורות) ריאגנטים (כולל את מדיום הגידול, pyrogallol, ו NaOH) ניתן להציב לתוך החממה מראש (לפחות 20 דקות לפני השימוש) שמטרתן לצמצם את השוני הטמפרטורה . מזרק משאבות לעתים קרובות לייצר חום מהפעלת המנועים בתוך המשאבות. זה בדרך כלל מקובל לפעול משאבות מזרק בתוך חממות; עם זאת, לעשות לבדוק את הטמפרטורה בחממה במהלך הניסויים. אם הטמפרטורה מרוממת במהלך הניסויים, נהלי קירור נוספים צריכות להתבצע. כמה שיטות קירור ריאליות יכולות להיות מועסקות, כגון הצבת קופסא הקרח לתוך החממה, צמצום מספר משאבות מזרק להציב בתוך האינקובטור, או באמצעות באינקובטור עם מערכת קירור כוח.
מכשיר תרבית תאי microfluidic PDMS-המחשב שפותח במאמר זה הוא מסוגל לייצר הדרגתי כימי וחמצן בניצב מהימן FOמחקרי נדידת תאי r. המגבלה של המכשיר שפותח היא כי פרופילי שיפוע חמצן שנוצרו תלוי האיזון בין שטף חמצן, מונע על ידי הדחת תגובה כימית, ודיפוזיה חמצן מאטמוספרת הסביבה, דרך המכשיר, ועל המדיום. כתוצאה מכך, את פרופילי שיפוע חמצן לא ניתן לשלוט באופן שרירותי בתוך המכשיר. בהשוואה לפלטפורמות תרבית תאי microfluidic קיימים, המכשיר שפותח במאמר זה הוא הראשון מסוגל לבצע מחקרי תרבית תאים תחת שילובים של הדרגתיים כימיים וחמצן. המכשיר כולו יכול להיות מפוברק באמצעות תהליך הדפוס העתק ליתוגרפיה הרך הקונבנציונלי, ללא יישור מייגע ומכשור יקר. ההדרגתיים ניתן לדמות מספרי ומאופיין ניסיוני לספק תנאי microenvironment דמוי פיסיולוגיים יותר ללימודי תאים במבחנה. באמצעות שיטת תגובה הכימית מוגבלת מרחבית עם סרט PC בתור די גזמחסום ffusion, שיפוע החמצן יכול להיוצר ללא שימוש בלוני גז דחוסים ויחידות בקרת זרימת גז מתוחכמות. בנוסף, תוכנית ההתקנה דורשת רק כמויות קטנות של כימיקלים (פחות מ -10 מ"ל ליום) כדי לשמור על הדרגתיים חמצן. מאז מתח שליטת חמצן מוגבלת מקומית סביב ערוץ microfluidic, ואינה להפריע את ריכוז חמצן הסביבה, ההתקנה כולו יכולה להיות ממוקמת בתוך תרבית תאי חממה קונבנציונלית ללא טמפרטורה נוספת, לחות, ומכשור בקרה 2 CO. כתוצאה מכך, המכשיר שפותח יש פוטנציאל גדול לשמש כמעט במעבדות ביולוגיות.
בשל מגבלות טכניות, התנהגויות הסלולר תחת מתחי חמצן נחקרו לעתים רחוקות בספרות הקיימת. בעזרת המכשיר שפותח במאמר זה, תרבית תאים תחת הדרגתיים חמצן יכולה להתבצע באופן קליל שמקדם מחקרי תא מאוד תחת הדרגתיים חמצן. Furthermore, עיקרון פעולה דומה ניתן ליישם כדי ליצור הדרגתיים גזי אחרים רלוונטיים מבחינה פיזיולוגית, כמו פחמן דו חמצני ותחמוצת חנקן, על תרבית תאים במבחנה במחקרי 17. יכולות אלו מראות כי מכשיר microfluidic PDMS-PC מראה פוטנציאל גדול עבור יישומי תרבית תאים שונים, כוללים בדיקות סמים ובחלוקה של תאי מבחני הגירה, לקדם במחקרי תרבית תאים במבחנה.
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
This paper is based on work supported by the National Health Research Institutes (NHRI) in Taiwan under the Innovative Research Grant (IRG) (EX105-10523EI), the Taiwan Ministry of Science and Technology (MOST 103-2221-E-001-001-MY2, 104-2221-E-001-015-MY3, 105-2221-E-001-002-MY2), the Academia Sinica Thematic Project (AS-105-TP-A06), and the Research Program in Nanoscience and Nanotechnology. The authors would like to thank Ms. Rachel A. Lucas for proofreading the manuscript.
Materials
| Name | Company | Catalog Number | Comments |
| 1 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302104 | |
| 1.5 ml Microcentrifuge Tube | Smartgene | 6011-000 | |
| 10 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302151 | |
| 15 ml Centrifuge Tube | ThermoFisher Scientific,Waltham, MA | Falcon 352096 | |
| 150 mm Petri dish | Dogger Science | DP-43151 | |
| 1H,1H,2H,2H-Perfluorooctyltrichlorosilane | Alfa Aesar, Ward Hill, MA | 78560-45-9 | |
| 3 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302118 | |
| 4'' Silicon Dummy Wafer | Wollemi Technical, Taoyuan, Taiwan | ||
| Acetone | ECHO Chemical, Miaoli, Taiwan | AH3102-000000-72EC | |
| AG Double Expose Mask Aligner | M&R Nano Technology, Taoyuan, Taiwan | AG500-4D-D-V-S-H | |
| Antibiotic-Antimyotic solution | ThermoFisher Scientific,Waltham, MA | GIBCO 15240-062 | |
| Biopsy punch | Miltex, Plainsboro, NJ | 33-31 | |
| Blunt needle | JensenGlobal, Santa Barbara, CA | Gauge 14 | |
| Bright-Line Hemocytometer | Sigma-Aldrich, St. Louis, MO | Z359629 | for cell counting |
| Buffered Oxide Etch | ECHO Chemical, Miaoli, Taiwan | PH3101-000000-72EC | |
| Cell Culture Incubator | Caron, Marietta, OH | 6016-1 | |
| COMSOL Multiphysics | COMSOL, Burlington, MA | Ver. 4.3b | for numerical simulation of chemical gradients in the device |
| D-PBS | ThermoFisher Scientific,Waltham, MA | GIBCO 14190-144 | |
| Desicattor | A-VAC Industries, Anaheim, CA | 35.10001.01 | |
| DMEM/F12+GlutaMax-1 | ThermoFisher Scientific,Waltham, MA | GIBCO 10565-018 | |
| Fetal Bovine Serum | ThermoFisher Scientific,Waltham, MA | GIBCO 10082 | |
| Fibronectin from Human Plasma | Sigma-Aldrich, St. Louis, MO | F2006 | |
| Inverted Fluorescence Microscope | Leica Microsystems, Wetzlar, Germany | DMIL LED | |
| Isopropyl Alcohol (IPA) | ECHO Chemical, Miaoli, Taiwan | CMOS112-00000-72EC | |
| JuLi Smart Fluorescence Cell Imager | NanoEnTek, Seoul, Korea | DBJ01B | |
| Mechanical Convention Oven | ThermoFisher Scientific,Waltham, MA | Lindberg Blue M MO1450C | |
| NaOH | Showa Chemical Industry, Tokyo, Japan | 1943-0150 | |
| Plasma tretment system | Nordson MARCH, Concord CA | PX-250 | for oxygen plasma surface treatment |
| Polycarbonate (PC) film | Quantum Beam Technologies, Tainan Taiwan | ||
| Polydimehtylsiloxane (PDMS) | Dow Corning, Midland, MI | SYLGARD 184 | |
| Pyrogallol | Alfa Aesar, Ward Hill, MA | A13405 | |
| Removable Adhesive Putty | 3M | 860 | |
| Sorvall Legend Mach 1.6R Tabletop Centrifuge | ThermoFisher Scientific,Waltham, MA | ||
| Spin Coater | ELS Technology, Hsinchu, Taiwan | ELS 306MA | |
| SU-8 2050 | MicroChem, Westborough, MA | SU-8 2050 | |
| SU-8 Developer | MicroChem, Westborough, MA | Y020100 | |
| Surgical blade | Feather, Osaka, Japan | 5005093 | for PDMS cutting |
| Syringe Pump | Chemyx, Houston, TX | Fusion 400 | |
| T75 Cell Culture Flask | ThermoFisher Scientific,Waltham, MA | Nunc 156367 | |
| Trypan Blue Solution, 0.4% | ThermoFisher Scientific,Waltham, MA | 15250061 | |
| Trypsin-EDTA | ThermoFisher Scientific,Waltham, MA | GIBCO 25200 | |
| Tygon PTFE Tubing | Saint-Gobain Performance Plastics, Akron, OH | ||
| Tygon Tubing | Saint-Gobain Performance Plastics, Akron, OH | 621 |
References
- Phillips, J. E., Burns, K. L., Le Doux, J. M., Guldberg, R. E., García, A. J. Engineering graded tissue interfaces. Proc. Natl. Acad. Sci. USA. 105 (34), 12170-12175 (2008).
- Wang, F. The signaling mechanisms underlying polarity and chemotaxis. Cold Spring Harb. Perspect Biol. 1 (4), 1-16 (2009).
- Oh, S. H., Ward, C. L., Atala, A., Yoo, J. J., Harrison, B. S. Oxygen generating scaffolds for enhancing engineering tissue survival. Biomaterials. 30 (5), 757-762 (2009).
- Decaris, M. L., Lee, C. I., Yoder, M. C., Tarantal, A. F., Leach, J. K. Influence of the oxygen microenvironment on the proangiogenic potential of human endothelial colony forming cells. Angiogenesis. 12, 303-311 (2009).
- Chung, B. G., et al. Human neural stem cell growth and differentiation in a gradient-generating microfluidic device. Lab Chip. 5 (4), 401-406 (2005).
- Harris, A. L. Hypoxia - a key regulatory factor in tumor growth. Nat. Rev. Cancer. 2 (1), 38-47 (2002).
- Allen, J. W., Bhatia, S. N. Formation of steady-state oxygen gradients in vitro: application to liver zonation. Biotechnol. Bioeng. 82 (3), 253-262 (2003).
- McCord, A. M., Jamal, M., Shankavaram, U. T., Lang, F. F., Camphausen, K., Tofilon, P. J. Physiologic oxygen concentration enhances the stem-like properties of CD133+ human glioblastoma cells in vitro. Mol. Cancer Res. 7 (4), 489-497 (2009).
- Lo, J. F., Sinkala, E., Eddington, D. T. Oxygen gradients for open well cellular cultures via microfluidic substrates. Lab Chip. 10 (18), 2394-2401 (2010).
- Chang, C. W., et al. A polydimethylsiloxane-polycarbonate hybrid microfluidic device capable of generating perpendicular chemical and oxygen gradients for cell culture studies. Lab Chip. 14 (19), 3762-3772 (2014).
- Chen, Y. A., et al. Generation of oxygen gradients in microfluidic devices for cell culture using spatially confined chemical reactions. Lab Chip. 11 (21), 3626-3633 (2011).
- Peng, C. C., Liao, W. H., Chen, Y. H., Wu, C. Y., Tung, Y. C. A microfluidic cell culture array with various oxygen tensions. Lab Chip. 13 (16), 3239-3245 (2013).
- Xia, Y., Whitesides, G. M. Soft Lithography. Ann. Rev. Mate. Sci. 28, 153-184 (1998).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502 (2010).
- Cordelières, F. P. . Manual Tracking. , (2005).
- Asano, Y., Horn, E. . Instructions Chemotaxis and Migration Tool 2.0. , (2013).
- Chen, Y. H., Peng, C. C., Cheng, Y. J., Wu, J. G., Tung, Y. C. Generation of nitric oxide gradients in microfluidic devices for cell culture using spatially controlled chemical reactions. Biomicrofluidics. 7 (6), 064104 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved