Method Article
Polydiméthylsiloxane-polycarbonate dispositifs microfluidiques pour cellulaire Migration Studies Sous Perpendiculaire chimique et Dégradés d'oxygène
Dans cet article
Résumé
The control of chemical and oxygen gradients is essential for cell cultures. This paper reports a polydimethylsiloxane-polycarbonate (PDMS-PC) microfluidic device capable of reliably generating combinations of chemical and oxygen gradients for cell migration studies, which can be practically utilized in biological labs without sophisticated instrumentation.
Résumé
Cet article présente un dispositif microfluidique en polydiméthylsiloxane (PDMS) avec un polycarbonate intégré (PC) à film mince pour étudier la migration cellulaire dans des combinaisons de gradients chimiques et d'oxygène. Les deux gradients chimiques et d' oxygène peuvent grandement affecter la migration des cellules in vivo; cependant, en raison de limitations techniques, très peu de recherches ont été effectuées pour étudier leurs effets in vitro. Le dispositif développé dans cette recherche tire profit d'une série de canaux en forme de serpentins pour générer les gradients chimiques souhaités et exploite un procédé de réaction chimique dans l'espace confiné pour la production d'un gradient d'oxygène. Les directions des gradients chimiques et d'oxygène sont perpendiculaires l'une à l'autre pour permettre la migration simple résultat de l'interprétation. Afin de générer efficacement les gradients d'oxygène avec un minimum de consommation de produits chimiques, le PC intégré à film mince est utilisé comme une barrière de diffusion gazeuse. Le dispositif microfluidique développépeuvent être actionnés par des pompes à seringue et placée dans un incubateur de cellules conventionnelles au cours des expériences de migration cellulaire pour permettre une simplification de l'installation et les conditions de culture de cellules optimisées. Dans les expériences cellulaires, nous avons utilisé le dispositif pour étudier les migrations de cellules humaines adenocarcinomic alvéolaires basales épithéliales, A549, sous des combinaisons de chimiokine (facteur dérivé des cellules stromales, SDF-1α) et des gradients d'oxygène. Les résultats expérimentaux montrent que le dispositif peut générer de façon stable chimiokines et d'oxygène gradients perpendiculaires et est compatible avec les cellules. Les résultats de l'étude de la migration indiquent que les gradients d'oxygène peuvent jouer un rôle essentiel dans l'orientation de la migration cellulaire, et le comportement cellulaire sous des combinaisons de gradients ne peuvent pas être prédits de ceux sous gradients simples. Le dispositif fournit un outil puissant et pratique pour les chercheurs d'étudier les interactions entre les gradients chimiques et d' oxygène dans la culture cellulaire, qui peut promouvoir de meilleures études sur la migration des cellules dans plus in vivo -comme microenvironnements.
Introduction
La répartition spatiale des facteurs solubles et la tension d'oxygène peut régler un certain nombre de fonctions cellulaires importantes in vivo 1, 2, 3, 4. Afin de mieux étudier leur effet sur les cellules, in vitro d' une cellule plate - forme de culture capable de produire de manière stable des gradients chimiques et d' oxygène est fortement souhaitée. Divers facteurs solubles jouent un rôle clé dans les activités biologiques et influent sur le comportement cellulaire. Récemment, en raison de l'avancement des techniques microfluidiques, un certain nombre de dispositifs microfluidiques capable de générer de manière stable des gradients chimiques ont été développées pour étudier la migration des cellules 5. En outre, plusieurs études ont également mis en évidence la nécessité d' une tension d'oxygène pour les cultures cellulaires in vitro , 6, 7, 8. cependant,le contrôle de la tension d'oxygène pour la culture cellulaire repose principalement sur addition chimique directe pour élimination de l'oxygène ou de cellules incubateurs avec des bouteilles de gaz sous pression. L'addition directe chimique modifie le milieu de culture cellulaire et affecte les réponses cellulaires. incubateurs de contrôle d'oxygène nécessitent une conception particulière de l'incubateur, le contrôle de flux de gaz précis, et un grand volume de gaz d'azote afin d'obtenir des conditions d'hypoxie. De plus, il est impossible de contrôler la distribution spatiale de l'oxygène en utilisant cette configuration, ce qui retarde l'étude du comportement cellulaire sous différentes tensions d'oxygène et les gradients. Pour surmonter ces limitations, un certain nombre de dispositifs microfluidiques ont été mis au point pour générer des gradients d'oxygène pour des applications de culture cellulaire 9. Cependant, la plupart d'entre eux fonctionnent à l'aide de gaz sous pression, ce qui peut provoquer l'évaporation et de génération de bulle problèmes. Par conséquent, ils nécessitent souvent une instrumentation sophistiquée et peuvent ne pas être fiables à long terme de la culture cellulaire studies.
Pour surmonter les défis et continuer à étudier les interactions entre les gradients chimiques et d' oxygène pour la migration des cellules, nous avons développé un dispositif de culture cellulaire microfluidique en polydiméthylsiloxane (PDMS) avec un polycarbonate intégré (PC) de film mince 10. Le dispositif est composé de deux couches de canaux microfluidiques séparés par une membrane PDMS. La couche supérieure est une couche de PDMS-PC pour la production d'un gradient d'oxygène; la couche inférieure est constituée de PDMS pour la production d'un gradient chimique et de la culture cellulaire. Le dispositif peut simultanément générer des produits chimiques et d'oxygène gradients perpendiculaires sans utiliser les bouteilles de gaz et des systèmes de contrôle de flux sophistiqués. Dans le dispositif, le PDMS offre une grande transparence optique, la perméabilité aux gaz, et la compatibilité biologique pour la culture cellulaire et l'imagerie. Le film de PC intégré sert de barrière de diffusion de gaz pour un contrôle efficace de la tension d'oxygène. Dans le canal microfluidique, nous avons utilisé une série de canaux en forme de serpentins pour générer des gradients chimiques. La conception a été largement exploitée pour générer des gradients chimiques dans des dispositifs microfluidiques pour diverses applications en raison de sa fiabilité et de montage expérimental facile. En outre, les profils de gradient chimique peut être conçu en faisant varier la géométrie des canaux préalablement à la simulation numérique. Pour la génération de gradient d'oxygène, nous avons profité de la méthode de réaction chimique spatialement confinée qui a déjà été mis au point dans notre laboratoire 10, 11, 12. L'oxygène peut être récupéré dans les zones désignées sans purge d'azote. Pour une utilisation pratique dans les laboratoires biologiques, l'ensemble du dispositif expérimental est compatible avec les incubateurs de culture cellulaire classiques. En intégrant ces méthodes, nous pouvons générer simultanément stables chimiques et d'oxygène gradients sans bouteilles de gaz en vrac et des instruments sophistiqués pour étudier la migration cellulaire.
Protocole
1. Fabrication du dispositif microfluidique
NOTE: L'ensemble du dispositif microfluidique est fabriqué en utilisant le procédé de moulage lithographie réplique douce 13.
- Fabrication de moules pour les couches PDMS dans le dispositif microfluidique
- Concevoir des modèles de canaux microfluidiques utilisant commercialement disponibles illustration ou logiciel de dessin. Soumettre le dossier à une société à haute résolution transparence photomasque impression 14.
- Wafers propres de silicium avec de l' acétone (≥99.5%), l' alcool isopropylique (IPA; ≥99.9%) et gravure d'oxyde tamponné (BOE; 6: 1 NH 4 F.HF). Rincer à l'eau désionisée (DI) et déshydrater la plaquette avec un pistolet d'azote.
- manteau de Spin environ 20 g de ton négatif photoresist, SU-8 2050, sur les plaquettes à 500 tours par minute pendant 15 secondes, puis 2.000 tours par minute pendant 30 secondes.
NOTE: La condition de revêtement par centrifugation devrait donner SU-8 2050 photorésister à des couches ayant une épaisseur d'environ 75 um sur les plaquettes après la lithographie optique. - cuire au four doux les gaufrettes sur une C plaque 65 ° pendant 3 min, puis à 95 ° C pendant 9 min. Après la cuisson douce, exposer les plaquettes en utilisant un aligneur de masque avec les masques de transparence conçus sous la lumière UV; l'énergie d'exposition totale devrait être d' environ 300 mJ / cm 2. cuisson post-exposition (PEB) les plaquettes à 65 ° C pendant 2 min, puis à 95 ° C pendant 7 min.
- Après la PEB, plonger les tranches dans SU-8 développeur avec une forte agitation ou dans un bain à ultrasons (37 kHz et 180 W de puissance ultrasonore utile) pendant 7 min. Rincer la tranche avec de l'acétone et de l'IPA pour enlever le SU-8 résiduel.
- Placer la plaquette et 100 ul de silane (1H, 1H, 2H, 2H-perfluorooctyltrichlorosilane) dans un plat de diamètre 6 cm de Pétri dans un dessiccateur relié à une pompe à vide à membrane pour la tranche de surface silanisation afin d'éviter le collage indésirable. Mettez la pompe pendant 15 minutes, éteignezEt sceller le dessicateur à vide pendant 30 min.
- Prenez les plaquettes silanisées du dessiccateur et les scotcher à 15 cm de diamètre plats de Pétri pour le processus de lithographie douce qui suit:
- Fabrication et assemblage de couches PDMS
- Préparation du pré-polymère PDMS
- Mélanger PDMS monomère (base) et l'agent de durcissement dans un rapport de 10: 1 (v / v). Dégazer le mélange dans la configuration de dessicateur pendant 60 min.
- Fabrication de la couche supérieure PC-embedded
- Transfert 2 g du PDMS pré-polymère sur le moule avec les modèles de canaux fluidiques couche supérieure pour faire une fine couche de PDMS. Placer le moule dans la configuration du dessiccateur pour dégazer les PDMS pendant 60 min.
- Placez la nuit de moule dans un four à 60 ° pour PDMS durcissement. Assurez-vous que le moule est sur un plan horizontal.
- Refroidir le moule à la température ambiante. Versez un 13 g supplémentaire de PDMS pré-polymère sur le moule et dégazer les PDMS dans ee configuration de dessiccateur pendant 60 min.
- Incorporer lentement un film PC 1 mm d'épaisseur dans la couche fraîche de PDMS comme une barrière de diffusion gazeuse; expulser les bulles si nécessaire.
- Mettez la nuit de la moisissure dans la 60 ° C four, et assurez-vous que ce soit sur un plan horizontal.
- Refroidir les PDMS durcis à la température ambiante. Couper l'appareil avec un scalpel pour une superficie d'environ 5,5 x 5 cm 2, qui peut couvrir tous les modèles de canal, et de décoller la dalle PDMS du moule.
- Percez des trous pour les entrées et sorties en utilisant une biopsie poinçon 2 mm de diamètre. Rangez la couche supérieure PDMS-PC fabriqués loin de la poussière ambiante pour le montage ultérieur.
- Fabrication de la couche inférieure PDMS
- Verser 11 g de la pré-polymère PDMS sur le moule pour la couche inférieure. Placer le moule dans le dessicateur pour dégazer le PDMS pendant 60 min. Gardez la nuit de moule dans un four à 60 ° pour guérir les PDMS. Assurez-vous qu'il est couché sur un plan horizontal.
- Refroidir ee PDMS à la température ambiante. Couper l'appareil à une surface d'environ 5,5 x 5 cm 2, qui peut couvrir tous les modèles de canal, et le retirer du moule. Rangez la couche inférieure de PDMS fabriqués loin de la poussière ambiante pour le montage ultérieur.
- La fabrication de la membrane PDMS
- manteau de Spin environ 4 g de PDMS pré-polymère sur une plaquette vierge silanisé à 100 rpm pendant 90 secondes, puis 3000 tours par minute pendant 4 sec. Cuire la tranche de spin-revêtu d'une C 60 ° four pendant la nuit.
- Assemblée du dispositif
- Placer la couche supérieure PDMS-PC et la plaquette fabriquée avec la membrane PDMS déposée par centrifugation dans un plasma O 2 machine de traitement de surface avec des surfaces de liaison vers le haut. Traiter les surfaces PDMS avec 90 W de plasma O 2 pendant 40 secondes.
- Bond la couche supérieure sur la membrane PDMS juste après le traitement O 2 de surface par plasma. Placez un poids (environ 600 g) au-dessus des couches liées et les mettre dans un60 ° C pendant la nuit du four pour favoriser la liaison.
- Refroidir les couches liées à la température ambiante et couper la membrane liée à la couche supérieure avec un scalpel pour une superficie d'environ 5,5 x 5 cm 2, qui peut couvrir tous les modèles de canal. Décoller la structure collée de la plaquette de silicium et percer des trous au niveau des orifices d'entrée et de sortie du canal de gradient chimique en utilisant un poinçon de biopsie de 2 mm de diamètre.
- Placer la couche supérieure de membrane collée et la couche inférieure PDMS fabriqués dans le plasma O 2 machine de traitement de surface, les surfaces de liaison vers le haut, pour activer les surfaces PDMS en utilisant le plasma à 90 W pendant 40 secondes.
- Fixer les couches supérieure et inférieure ensemble pour lier immédiatement après le traitement de surface. Placez un poids (environ 600 g) sur le dessus de l'appareil lié ensemble et le mettre dans un C 60 ° four pendant la nuit.
- Prenez le dispositif fabriqué toute la sortie du four et laisser refroidir à température ambiante.
- Préparation du pré-polymère PDMS
2. microfluidique Assay migration cellulaire
NOTE: Dans cet article, nous utilisons une ligne couramment utilisée cellulaire, cellule adenocarcinomic humaine alvéolaire épithéliale basale (A549), et une chimiokine, le facteur cellules stromales dérivées (SDF-1α), à titre d'exemples. Pour les chercheurs travaillant sur d'autres cellules et les chimiokines, s'il vous plaît ajuster les processus expérimentaux en conséquence.
- Jour 0: Préparation de cellules
- Culture du stock de cellules A549 en milieu de croissance complet contenant DMEM F12 L-glutamine substitut, 10% (v / v) de sérum de veau fœtal (FBS), et 1% (v / v) solution Antimicrob-antimycosique. Sous-culture par dissociation avec 0,25% de trypsine-EDTA.
- Préparer des suspensions de cellules pour les expériences en centrifugeant les cellules dissociées à 140 x g pendant 3 min à température ambiante. Pour les expériences de dispositif microfluidique, compter les cellules en utilisant un hémocytomètre et la graine d' au moins 1 x 10 6 cellules dans un flacon T75 avec 10 ml d'completun milieu de croissance.
Remarque: Tous les processus de culture de cellules sont réalisées en un incubateur avec 37 ° C et 5% de CO 2 atmosphère.
- Jour 1: Préparation de l' appareil
- Placez le dispositif dans la machine à plasma O 2 et le traiter avec plasma O 2 à 90 W pendant 40 secondes pour rendre le canal microfluidique surfaces hydrophiles.
- Immédiatement après le traitement de surface, d'installer deux 14 aiguilles émoussées G en insérant directement les aiguilles dans les trous de 2 mm de diamètre percés dans la couche de PDMS au niveau des entrées de canal de gradient chimique. Assurez-vous que les aiguilles ne bloquent pas les canaux microfluidiques. Dessinez 0,8 ml de ddH 2 O en utilisant une seringue de 1 ml avec une aiguille 14 G émoussée. Injecter DDH 2 O dans le canal de gradient chimique depuis la sortie jusqu'à ce que l'eau coule à partir des deux aiguilles au niveau des orifices d' entrée.
- Préparer 1 ml de 50 pg / ml solution fibronectine en diluant fibronectine stock chez Dulbecco & #39; solution saline tamponnée au phosphate de (DPBS).
- Perfuser la solution de fibronectine à partir de la sortie du canal à gradient chimique en utilisant une seringue de 1 ml avec une aiguille 14 G émoussée jusqu'à ce que la solution circule à partir des deux aiguilles au niveau des orifices d'entrée.
- Incuber l'ensemble de l'appareil pendant une nuit dans un incubateur de culture cellulaire classique.
- Jour 2: Cellule ensemencement et imagerie par microscopie
- cellule ensemencement
- Aspirer le milieu des cellules qui ont été cultivées depuis le jour 0 et laver les cellules avec 5 ml de DPBS 2 fois. Aspirer le DPBS, ajouter 2 ml de trypsine-EDTA, et on incube les cellules dans l'incubateur pendant 5 minutes pour détacher les cellules de la surface du flacon.
- Attendre jusqu'à ce que les cellules sont décollées et mises en suspension dans la solution et on ajoute 8 ml de milieu sans sérum (DMEM F12 + 1% (v / v) Antimicrob-antimycotique solution) dans le ballon. Transférer la totalité du liquide dans un tube conique de 15 ml et centrifuger à 140 g pendant 5 min à température ambiante.
- Aspirer le surnageant après centrifugation et ajouter une quantité appropriée du milieu sans sérum pour rendre la densité cellulaire finale 1 x 10 6 cellules / ml. Sortez le dispositif microfluidique préparé le jour 1. Compter les cellules en utilisant un hémocytomètre ou un autre instrument de comptage automatique des cellules.
- Injecter un milieu sans sérum à partir de la sortie du canal à gradient chimique en utilisant une seringue de 1 ml avec une aiguille 14 G émoussée jusqu'à ce que le fluide circule à partir des deux aiguilles au niveau des orifices d'entrée. Injecter 200 ul de la suspension cellulaire à partir de la sortie du canal à gradient chimique.
- Observer la chambre de culture cellulaire dans le dispositif sous un microscope afin de confirmer que les cellules ont été introduites dans le canal microfluidique. Placez le dispositif dans un récipient humide (par exemple, une boîte en plastique avec ddH 2 O à l' intérieur) et le maintenir dans un incubateur de culture cellulaire pendant 5 heures pour favoriser l'adhérence des cellules sur la surface du dispositif.
- Préparation de REAGents pour la génération de gradient chimique
- Préparer le (SDF-1α) chimique à la concentration désirée (100 ng / ml) dans du milieu exempt de sérum. Dessinez le milieu sans sérum avec et sans le produit chimique en deux séparés 3 ml seringues reliées à des tubes de haute pureté. Mettre en place la seringue dans une pompe seringue avec un débit de 1 pl / min pour une utilisation ultérieure.
- Préparation des réactifs pour la production d'un gradient d'oxygène
- Faire 15 ml d'une solution 1 M de NaOH et 15 ml de 200 mg / ml de solution pyrogallol. Dessinez le NaOH et des solutions de pyrogallol en deux séparés 15 ml seringues connectées à haute pureté tube de PTFE et de tubes de haute pureté, respectivement. Mettre en place la seringue dans une pompe seringue à débit de 5 ul / min pour une utilisation ultérieure débit.
- configuration de l'appareil microfluidique
- Après l'incubation de 5 heures, prendre l'ensemble du dispositif et placez-le sur un diamètre boîte de Pétri de 15 cm. Fixer le dispositif dans la boîte de Pétri en utilisant du mastic adhésif. Transférer laBoîte de Pétri à un microscope d'imagerie de cellules vivantes dans un incubateur.
- Raccorder le tuyau à partir des seringues pour la génération du gradient chimique aux entrées du canal de gradient chimique. Branchez la sortie au tube menant à un réservoir de déchets. Mettre en marche la pompe à seringue avec des seringues pour la production d'un gradient chimique.
- Raccorder le tuyau de haute pureté à partir des seringues contenant NaOH et pyrogallol aux entrées du canal à gradient d'oxygène. Connecter le tuyau à la sortie pour recueillir les déchets. Mettre en marche la pompe à seringue avec des seringues pour la production d'un gradient d'oxygène.
- Ajouter environ 15 ml de ddH 2 O à la boîte de Pétri pour maintenir le dispositif hydratées. Mettre en place le microscope d'imagerie cellulaire en direct pour le temps écoulé de capture d'image, et de prendre une image toutes les 15 min.
- cellule ensemencement
- Jour 3: collecte et analyse des données
- Transférer les fichiers d'image capturées à un ordinateur. Analyser les images à l'aide d'un open source d'image d'unlogiciel alyse, ImageJ, avec un plugin open source pour le suivi manuel (https://imagej.nih.gov/ij/plugins/track/track.html) et un logiciel gratuit chimiotactisme Tool (http://ibidi.com/xtproducts / fr / Software-et-image-Analyse / Manuel-image-Analyse / chimiotactisme-and-migration Tool) 15, 16.
3. Caractérisation des gradients
REMARQUE: Les gradients chimiques et de l'oxygène peuvent être caractérisées, avant ou après les expériences cellulaires.
- Simulation numérique du gradient chimique
- Estimer la nature de l'écoulement laminaire de la microfluidique en utilisant la dynamique fluidiques de calcul (CFD).
- La caractérisation expérimentale du gradient d'oxygène
- Préparer un colorant fluorescent sensible à l'oxygène, le tris (2,2'-bipyridyle) ruthénium (III) hexahydraté, d'une solution dans l'eau à une concentration de 5mg / ml.
- Dessinez la solution de colorant sensible à l'oxygène en deux séparés 3 ml seringues reliées à des tubes de haute pureté. Mettre en place la seringue dans une pompe seringue à raison de 1 ul / min (identiques aux débits utilisés pour la génération du gradient chimique) d'écoulement.
- Branchez le tuyau des seringues aux entrées du canal de gradient chimique. Branchez la sortie au tube menant à un réservoir de déchets. Mettre en marche la pompe à seringue avec des seringues pour la production d'un gradient chimique.
- Mesurer l'intensité de fluorescence en utilisant un microscope inversé à fluorescence avec une lumière d'excitation passant à travers un filtre optique à 470 nm ± 20. Collecter la lumière d'émission à travers un filtre d'émission passe-haut 515 nm à l'aide d'une caméra CCD fraîche.
- Raccorder le tuyau de haute pureté à partir des seringues contenant NaOH et pyrogallol aux entrées du canal à gradient d'oxygène. Connecter le tuyau à la sortie pour recueillir les déchets. Tournez sur la pompe à seringue avec les seringues pour l'oxygènegénération de gradient.
- Recueillir les images de fluorescence du colorant sensible à l'oxygène qui circule dans la chambre de culture cellulaire.
- Arrêter l'écoulement de génération de gradient d'oxygène et débrancher tous les tuyaux dans le canal de génération d'oxygène. Connecter un tube de grande pureté à partir de bouteilles de gaz à la sortie du canal à gradient d'oxygène.
- Recueillir les images de fluorescence du colorant sensible à l'oxygène qui circule dans la chambre de culture cellulaire lors de l'écoulement de l'air, de l'azote pur et de l'oxygène pur dans la tubulure reliée au canal du gradient d'oxygène.
- Estimer les gradients d'oxygène en analysant les images de fluorescence en utilisant l'équation de Stern-Volmer selon les références 10 et 11.
Résultats
Fabricated PDMS-PC de l' appareil de culture cellulaire microfluidique hybride. Figue. La figure 1 montre une photo et une illustration du dispositif microfluidique. La couche inférieure contient quatre niveaux de canaux en forme de serpentins pour générer des solutions de réactifs introduits à partir de deux entrées séparées avec six rapports de mélange différents. Théoriquement, les six rapports de mélange différents sont 1: 0, 4: 1, 3: 2, 2: 3, 1: 4, et 0: 1 (à gauche: à droite) entre les deux solutions introduites à partir des entrées. Les gradients chimiques construits par les six différentes solutions rapport de mélange peut être généré dans la chambre de culture cellulaire, située en aval. Les couches supérieure et inférieure sont séparées par une membrane PDMS. Dans la couche supérieure, les réactifs pour la réaction chimique piégeur d'oxygène sont introduits dans le canal microfluidique à partir de deux entrées séparées. Les réactifs sont mélangés entre eux pour la réaction immédiatement avant de déboucher sur le dessus de la chambre de culture cellulaire àpiéger l'oxygène à partir du canal inférieur, sans contact chimique directe. Le film de PC intégré, avec un coefficient de diffusion de gaz inférieure par rapport au PDMS, agit comme une barrière de diffusion qui rend désoxygénante plus efficace. L'oxygène se diffuse progressivement vers la chambre de culture cellulaire à travers le PDMS dans la zone en aval pour former un gradient d'oxygène le long de la direction d'écoulement. Etant donné que la réaction chimique de piégeage d'oxygène dans l'espace confiné est, seules les tensions locales de l'oxygène sont affectés. Par conséquent, le dispositif peut être utilisé dans un incubateur de cellules classique, sans altérer la tension globale d'oxygène. Dans les expériences de migration, les cellules sont ensemencées dans la chambre de culture cellulaire pour l'observation. Le milieu de croissance et les réactifs chimiques sont introduits dans l'appareil à l'aide de pompes à seringue avec des débits contrôlés avec précision.
Caractérisation des gradients d' oxygène chimique et généré à l' intérieur du dispositif. En raison de til flux laminaire nature de la microfluidique, les comportements d'écoulement peuvent être prédits en utilisant la dynamique fluidiques de calcul (CFD). Dans cet article, nous avons construit un modèle 3D et effectué la simulation à l'aide d'un logiciel de modélisation multiphysique disponible dans le commerce. Figue. 2 (a) montre une comparaison entre les profils de concentration fluorescéine expérimentalement caractérisé toute la largeur de la chambre de culture cellulaire sur la base des mesures d'intensité de fluorescence et les résultats de la simulation numérique. L'accord entre les résultats expérimentaux et de simulation suggère que le modèle CFD peut ainsi estimer les gradients chimiques générées à l'intérieur du dispositif. Figue. 2 (b) trace le gradient simulé SDF-1α générée dans la chambre de culture cellulaire. Figue. La figure 3 représente le gradient d'oxygène résultats de caractérisation de l' écoulement du colorant fluorescent sensible à l'oxygène dans la chambre de culture cellulaire avant les expériences cellulaires. Le résultat indique qu'une Gradi d'oxygèneent, allant d'environ 1 à 16%, peut être établie en utilisant le protocole mentionné ci-dessus.
Les résultats de la migration cellulaire. En guise de démonstration, nous avons effectué des études sur la migration des cellules A549 de moins de 4 combinaisons de chimiokine (SDF-1alpha) et des gradients d'oxygène: (1) pas de chimiokine et pas de gradients d'oxygène comme un contrôle, (2) avec un gradient de chimiokines et sans un gradient d'oxygène, (3) avec un gradient d'oxygène et sans gradient de chimiokine, et (4) à la fois avec la chimiokine et les gradients d'oxygène. Figue. La figure 4 montre la photo de l'ensemble du dispositif expérimental. Les expériences ont été toutes effectuées dans un incubateur de culture cellulaire classique avec l'ensemble de l'installation (y compris les dispositifs microfluidiques, pompes à seringues, et en direct des microscopes d'imagerie cellulaire) placés à l'intérieur. Les résultats de la migration cellulaire sont représentés sur la Fig. 5. Figue. 5 (a) montre les images recueillies au cours des expériences en utilisant l'imagerie des cellules vivantes analyzer et Fig. 5 (b) et (c) les parcelles les trajectoires de migration cellulaire et les mouvements moyens au titre des quatre combinaisons analysées par le logiciel ImageJ avec les plugins. Les résultats montrent que la distance moyenne de la migration des cellules dans le contrôle se rapproche de zéro, ce qui suggère un mouvement aléatoire des cellules dans l'expérience. En revanche, seul le gradient de chimiokine, le mouvement moyen des cellules est vers la gauche, où la concentration de SDF-1α est plus élevée. Les résultats suggèrent que le comportement de la chimiotaxie SDF-1α de cellules A549, qui ont été signalés précédemment. Dans l'expérience, avec seulement des gradients d'oxygène, le mouvement moyen des cellules est vers le haut, lorsque la tension d'oxygène est plus faible. Plus intéressant encore, dans l'expérience avec les chimiokines et d'oxygène gradients perpendiculaires, le mouvement moyen des cellules est vers le haut et sans mouvement évident dans la direction horizontale (direction de gradient de chimiokine).
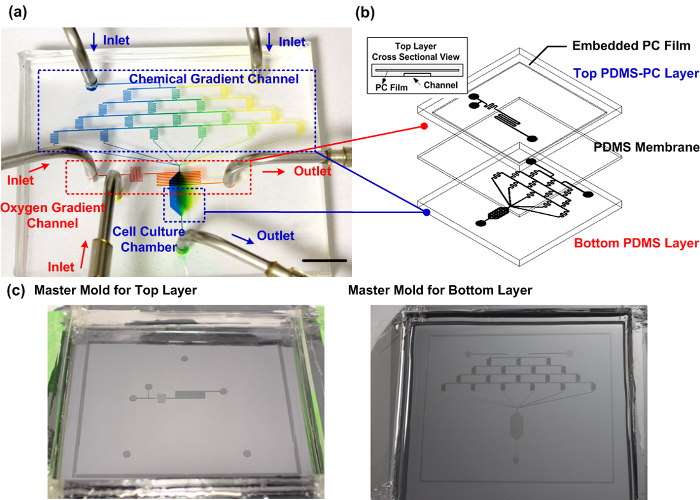
Figure 1: Fabricated PDMS-PC dispositif de culture cellulaire microfluidique. (A) la photo expérimentale du dispositif fabriqué de manière fiable capable de générer des gradients chimiques et d' oxygène perpendiculaires pour les études de la migration cellulaire. Le canal de gradient chimique est rempli avec des colorants alimentaires bleu et jaune pour démontrer la génération de gradient à l'intérieur de la chambre de culture cellulaire. Le canal de gradient d'oxygène est rempli avec un colorant alimentaire rouge. La barre d'échelle est de 1 cm. (B) Le schéma du dispositif microfluidique. La couche supérieure est fabriquée à l'aide de PDMS avec une couche de PC intégré comme une barrière de diffusion de gaz pour un contrôle efficace du gradient d'oxygène à l'intérieur de la chambre de culture cellulaire. (C) Les moules maîtres pour la fabrication des couches supérieure et inférieure. S'il vous plaît cliquer ici pourvoir une version plus grande de cette figure.
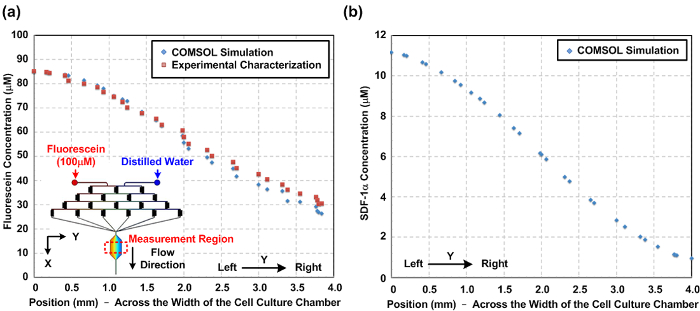
Figure 2: gradient chimique à l' intérieur du dispositif de culture cellulaire microfluidique. (A) Numériquement simulé et expérimentalement caractérisé fluorescéine gradient de concentration dans la chambre de culture de cellules à travers la largeur de la chambre de culture cellulaire (direction Y). La similitude entre les gradients simulées et mesurées expérimentalement indique que la simulation peut bien prédire le gradient chimique. La figure encart montre le modèle en trois dimensions (3D) construit pour la simulation. (B) les résultats de la simulation numérique du gradient de chimiokine SDF-1α sur toute la largeur de la chambre de culture de cellules pour des études de la migration cellulaire. S'il vous plaît cliquer ici pour voir uneune plus grande version de ce chiffre.
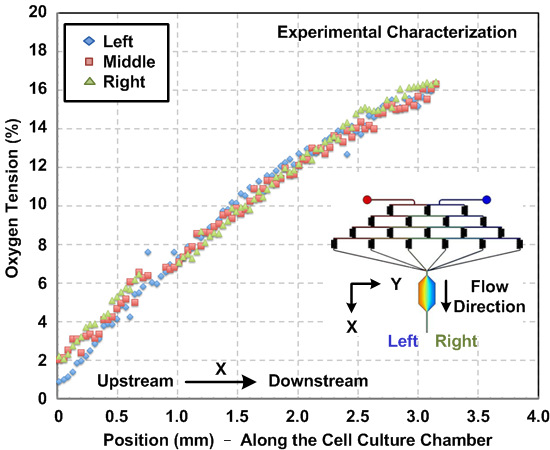
Figure 3: gradient d'oxygène à l' intérieur du dispositif de culture cellulaire microfluidique. Mesuré expérimentalement les gradients d'oxygène dans la chambre de culture cellulaire le long de la direction d'écoulement. Les gradients ont été estimés en utilisant le colorant fluorescent sensible à l'oxygène et à l'analyse de l'image. Les gradients, de gauche à droite de la chambre, sont caractérisées, et les résultats montrent des profils de gradient uniformes sur toute la largeur de la chambre.

Figure 4: Photos du montage expérimental. L'ensemble de l'installation, y compris les dispositifs microfluidiques, pompes à seringue, et une imagerie cellulaire microscope en direct, est placé dans un incubateur de culture cellulaire classique pour optimiserdes conditions de culture cellulaire au cours des expériences. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
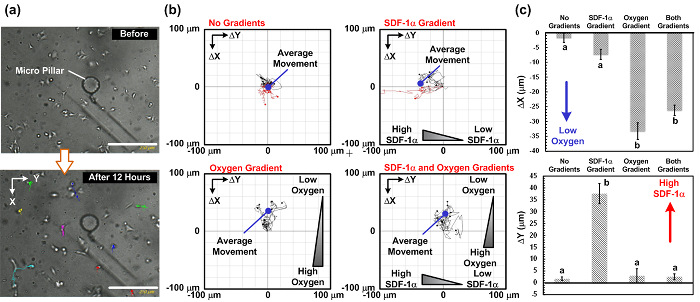
Figure 5: La migration cellulaire résultats de l' étude dans le cadre du SDF-1alpha et d' oxygène gradients perpendiculaires. (A) Les images capturées avant et après l'étude de la migration des cellules de 12 h. Les voies de migration des cellules peuvent être analysées à partir des images du temps écoulé capturés à l'aide de l'imagerie cellulaire en direct microscope. (B) Les voies de migration cellulaire et le mouvement de migration moyenne analysé des images capturées sous 4 combinaisons différentes de gradient: pas de gradient, seul gradient de chimiokine, seul gradient d'oxygène, et les deux gradients de chimiokines et d' oxygène. Les images ont été capturées toutes les 15 min. La barre d'échelle est de 250 um. (C) Terrains des distances moyennes de migration cellulaire dans la perpendiculaire (gradient d'oxygène) et horizontale (gradient de chimiokine) directions sous quatre combinaisons différentes de gradient. Les données sont exprimées sous forme de moyenne ± écart-type, obtenu à partir de trois séries expérimentales indépendantes et de 10 cellules ont été analysées dans chaque expérience. Les significativement différents (test t de Student non apparié, p <0,01) les résultats statistiques sont désignés par des lettres différentes (a et b). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Les étapes les plus critiques pour fabriquer le PDMS dispositif microfluidique avec un film mince de PC intégré sont: (1) expulsant toutes les bulles lors de l'insertion du film de PC dans les PDMS pré-polymère tout en fabrication de la couche supérieure PDMS-PC et (2) en veillant tous les PDMS processus de durcissement sont effectués sur un plan horizontal bien nivelé. Pour les expériences de migration cellulaire, les étapes les plus critiques sont les suivantes: (1) éliminer les bulles dans le dispositif microfluidique, tubes et pompes à seringues pendant les expériences; (2) veiller à ce que le dispositif microfluidique est placé sur un plan horizontal bien nivelé lors de l'imagerie de cellules vivantes pour l'observation de la migration cellulaire; et (3) maintenant le dispositif hydratées en ajoutant ddH 2 O à la boîte de Pétri pendant les expériences et faire en sorte que l'eau ne soit pas sèche.
Pour réussir à fabriquer le dispositif microfluidique PDMS-PC hybride sans délaminage, il est essentiel d'éliminer toutes les bulles pendant la fi PCinsertion de film. Le film de PC peut être introduit lentement à partir d'un angle (d'environ 15 à 30 degrés par rapport à la surface du PDMS de pré-polymère) afin d'empêcher la génération de bulles lors de l'insertion du film de PC dans le PDMS pré-polymère. Si nécessaire, la totalité PDMS de pré-polymère avec le film de PC intégré peut être placé dans un dessiccateur relié à la pompe à vide pendant 10 minutes pour chasser les bulles piégées. Si le film de PC flotte après le processus de vide, une pointe de pipette peut être utilisé pour presser le film de PC vers le bas sur la couche de PDMS durcie. Répétez les processus de vide et de la presse si nécessaire.
Pour les expériences cellulaires, l'absence de bulles d'air est essentielle pour la culture cellulaire microfluidique. Assurez-vous que les bulles d'air sont introduits dans l'ensemble de la configuration microfluidique (y compris les pompes à seringues, des tubes, et le dispositif microfluidique) lors des raccordements. Si des bulles d'air sont créés dans la configuration microfluidique en raison de la diminution de la solubilité des gaz sous la température élevée de l'expép é riences à l'intérieur de l'incubateur, tous les composants de laboratoire (y compris des seringues et des tubes) et de réactifs (y compris le milieu de croissance, le pyrogallol, et NaOH) peuvent être placées dans l'incubateur au préalable (au moins 20 minutes avant l'utilisation) afin de minimiser la variation de température . Seringue pompes souvent produire de la chaleur à partir du fonctionnement des moteurs dans les pompes. Il est généralement acceptable pour faire fonctionner les pompes à seringues à l'intérieur des incubateurs; cependant, faire vérifier la température de l'incubateur pendant les expériences. Si la température élève au cours des expériences, les procédures de refroidissement supplémentaires doivent être réalisées. Plusieurs méthodes de refroidissement possibles peuvent être utilisés, par exemple, placer une boîte de glace dans l'incubateur, ce qui réduit le nombre de pompes à seringue placée à l'intérieur de l'incubateur, ou à l'aide d'un incubateur avec un système de refroidissement de la force.
Le dispositif de culture cellulaire microfluidique PDMS-PC développé dans le présent document est capable de générer de manière fiable perpendiculaires chimiques et d'oxygène gradients foétudes sur la migration des cellules de r. La limitation du dispositif développé est que les profils de gradient d'oxygène générés dépendent de l'équilibre entre les flux d'oxygène, entraîné par balayage d'une réaction chimique, et la diffusion d'oxygène de l'atmosphère ambiante, à travers le dispositif, et dans le milieu. Par conséquent, les profils de gradient d'oxygène ne peuvent pas être contrôlés de manière arbitraire à l'intérieur de l'appareil. Par rapport aux plates-formes de culture cellulaire existants microfluidique, le dispositif développé dans ce document est une première capable d'effectuer des études de culture cellulaire dans des combinaisons de produits chimiques et des gradients d'oxygène. L'ensemble du dispositif peut être fabriqué en utilisant le procédé classique de moulage lithographie réplique douce, sans alignement fastidieux et instrumentation coûteuse. Les gradients peuvent être simulés numériquement et expérimentalement caractérisées pour fournir des conditions de microenvironnement comme plus physiologiques pour les études in vitro de cellules. En utilisant un procédé de réaction chimique dans l'espace confiné avec un film de PC en tant que gaz diFFusion barrière, le gradient d'oxygène peut être produit sans utiliser les bouteilles de gaz sous pression et sophistiqués unités de commande d'écoulement de gaz. En outre, l'installation ne nécessite que de petites quantités de produits chimiques (moins de 10 ml par jour) pour maintenir les gradients d'oxygène. Étant donné que le contrôle de la tension d'oxygène est limitée localement autour du canal microfluidique, et ne perturbe pas la concentration en oxygène ambiant, l'ensemble de l' installation peut être placée à l' intérieur d' un incubateur de culture cellulaire classique sans température supplémentaire, l' humidité et le CO 2 instrumentation de contrôle. Par conséquent, le dispositif mis au point un grand potentiel pour être utilisé en pratique dans les laboratoires biologiques.
En raison de limitations techniques, les comportements cellulaires sous tensions d'oxygène ont rarement été étudiés dans la littérature existante. Avec l'aide du dispositif mis au point dans le présent document, la culture cellulaire dans des gradients d'oxygène peut être effectuée d'une manière facile qui favorise grandement les études cellulaires sous gradients d'oxygène. Furthermore, un principe de fonctionnement similaire peut être appliquée pour générer des gradients d' autres gaz physiologiquement pertinents, tels que le dioxyde de carbone et de l' oxyde nitrique, pour des études in vitro en culture cellulaire 17. Ces fonctions montrent que le PDMS-PC dispositif microfluidique présente un grand potentiel pour diverses applications de culture cellulaire, y compris le dépistage des drogues et de la prolifération cellulaire et des essais de migration pour faire avancer dans les études de culture cellulaire in vitro.
Déclarations de divulgation
Les auteurs déclarent qu'ils ont aucun intérêt financier concurrents.
Remerciements
This paper is based on work supported by the National Health Research Institutes (NHRI) in Taiwan under the Innovative Research Grant (IRG) (EX105-10523EI), the Taiwan Ministry of Science and Technology (MOST 103-2221-E-001-001-MY2, 104-2221-E-001-015-MY3, 105-2221-E-001-002-MY2), the Academia Sinica Thematic Project (AS-105-TP-A06), and the Research Program in Nanoscience and Nanotechnology. The authors would like to thank Ms. Rachel A. Lucas for proofreading the manuscript.
matériels
| Name | Company | Catalog Number | Comments |
| 1 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302104 | |
| 1.5 ml Microcentrifuge Tube | Smartgene | 6011-000 | |
| 10 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302151 | |
| 15 ml Centrifuge Tube | ThermoFisher Scientific,Waltham, MA | Falcon 352096 | |
| 150 mm Petri dish | Dogger Science | DP-43151 | |
| 1H,1H,2H,2H-Perfluorooctyltrichlorosilane | Alfa Aesar, Ward Hill, MA | 78560-45-9 | |
| 3 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302118 | |
| 4'' Silicon Dummy Wafer | Wollemi Technical, Taoyuan, Taiwan | ||
| Acetone | ECHO Chemical, Miaoli, Taiwan | AH3102-000000-72EC | |
| AG Double Expose Mask Aligner | M&R Nano Technology, Taoyuan, Taiwan | AG500-4D-D-V-S-H | |
| Antibiotic-Antimyotic solution | ThermoFisher Scientific,Waltham, MA | GIBCO 15240-062 | |
| Biopsy punch | Miltex, Plainsboro, NJ | 33-31 | |
| Blunt needle | JensenGlobal, Santa Barbara, CA | Gauge 14 | |
| Bright-Line Hemocytometer | Sigma-Aldrich, St. Louis, MO | Z359629 | for cell counting |
| Buffered Oxide Etch | ECHO Chemical, Miaoli, Taiwan | PH3101-000000-72EC | |
| Cell Culture Incubator | Caron, Marietta, OH | 6016-1 | |
| COMSOL Multiphysics | COMSOL, Burlington, MA | Ver. 4.3b | for numerical simulation of chemical gradients in the device |
| D-PBS | ThermoFisher Scientific,Waltham, MA | GIBCO 14190-144 | |
| Desicattor | A-VAC Industries, Anaheim, CA | 35.10001.01 | |
| DMEM/F12+GlutaMax-1 | ThermoFisher Scientific,Waltham, MA | GIBCO 10565-018 | |
| Fetal Bovine Serum | ThermoFisher Scientific,Waltham, MA | GIBCO 10082 | |
| Fibronectin from Human Plasma | Sigma-Aldrich, St. Louis, MO | F2006 | |
| Inverted Fluorescence Microscope | Leica Microsystems, Wetzlar, Germany | DMIL LED | |
| Isopropyl Alcohol (IPA) | ECHO Chemical, Miaoli, Taiwan | CMOS112-00000-72EC | |
| JuLi Smart Fluorescence Cell Imager | NanoEnTek, Seoul, Korea | DBJ01B | |
| Mechanical Convention Oven | ThermoFisher Scientific,Waltham, MA | Lindberg Blue M MO1450C | |
| NaOH | Showa Chemical Industry, Tokyo, Japan | 1943-0150 | |
| Plasma tretment system | Nordson MARCH, Concord CA | PX-250 | for oxygen plasma surface treatment |
| Polycarbonate (PC) film | Quantum Beam Technologies, Tainan Taiwan | ||
| Polydimehtylsiloxane (PDMS) | Dow Corning, Midland, MI | SYLGARD 184 | |
| Pyrogallol | Alfa Aesar, Ward Hill, MA | A13405 | |
| Removable Adhesive Putty | 3M | 860 | |
| Sorvall Legend Mach 1.6R Tabletop Centrifuge | ThermoFisher Scientific,Waltham, MA | ||
| Spin Coater | ELS Technology, Hsinchu, Taiwan | ELS 306MA | |
| SU-8 2050 | MicroChem, Westborough, MA | SU-8 2050 | |
| SU-8 Developer | MicroChem, Westborough, MA | Y020100 | |
| Surgical blade | Feather, Osaka, Japan | 5005093 | for PDMS cutting |
| Syringe Pump | Chemyx, Houston, TX | Fusion 400 | |
| T75 Cell Culture Flask | ThermoFisher Scientific,Waltham, MA | Nunc 156367 | |
| Trypan Blue Solution, 0.4% | ThermoFisher Scientific,Waltham, MA | 15250061 | |
| Trypsin-EDTA | ThermoFisher Scientific,Waltham, MA | GIBCO 25200 | |
| Tygon PTFE Tubing | Saint-Gobain Performance Plastics, Akron, OH | ||
| Tygon Tubing | Saint-Gobain Performance Plastics, Akron, OH | 621 |
Références
- Phillips, J. E., Burns, K. L., Le Doux, J. M., Guldberg, R. E., García, A. J. Engineering graded tissue interfaces. Proc. Natl. Acad. Sci. USA. 105 (34), 12170-12175 (2008).
- Wang, F. The signaling mechanisms underlying polarity and chemotaxis. Cold Spring Harb. Perspect Biol. 1 (4), 1-16 (2009).
- Oh, S. H., Ward, C. L., Atala, A., Yoo, J. J., Harrison, B. S. Oxygen generating scaffolds for enhancing engineering tissue survival. Biomaterials. 30 (5), 757-762 (2009).
- Decaris, M. L., Lee, C. I., Yoder, M. C., Tarantal, A. F., Leach, J. K. Influence of the oxygen microenvironment on the proangiogenic potential of human endothelial colony forming cells. Angiogenesis. 12, 303-311 (2009).
- Chung, B. G., et al. Human neural stem cell growth and differentiation in a gradient-generating microfluidic device. Lab Chip. 5 (4), 401-406 (2005).
- Harris, A. L. Hypoxia - a key regulatory factor in tumor growth. Nat. Rev. Cancer. 2 (1), 38-47 (2002).
- Allen, J. W., Bhatia, S. N. Formation of steady-state oxygen gradients in vitro: application to liver zonation. Biotechnol. Bioeng. 82 (3), 253-262 (2003).
- McCord, A. M., Jamal, M., Shankavaram, U. T., Lang, F. F., Camphausen, K., Tofilon, P. J. Physiologic oxygen concentration enhances the stem-like properties of CD133+ human glioblastoma cells in vitro. Mol. Cancer Res. 7 (4), 489-497 (2009).
- Lo, J. F., Sinkala, E., Eddington, D. T. Oxygen gradients for open well cellular cultures via microfluidic substrates. Lab Chip. 10 (18), 2394-2401 (2010).
- Chang, C. W., et al. A polydimethylsiloxane-polycarbonate hybrid microfluidic device capable of generating perpendicular chemical and oxygen gradients for cell culture studies. Lab Chip. 14 (19), 3762-3772 (2014).
- Chen, Y. A., et al. Generation of oxygen gradients in microfluidic devices for cell culture using spatially confined chemical reactions. Lab Chip. 11 (21), 3626-3633 (2011).
- Peng, C. C., Liao, W. H., Chen, Y. H., Wu, C. Y., Tung, Y. C. A microfluidic cell culture array with various oxygen tensions. Lab Chip. 13 (16), 3239-3245 (2013).
- Xia, Y., Whitesides, G. M. Soft Lithography. Ann. Rev. Mate. Sci. 28, 153-184 (1998).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502 (2010).
- Cordelières, F. P. . Manual Tracking. , (2005).
- Asano, Y., Horn, E. . Instructions Chemotaxis and Migration Tool 2.0. , (2013).
- Chen, Y. H., Peng, C. C., Cheng, Y. J., Wu, J. G., Tung, Y. C. Generation of nitric oxide gradients in microfluidic devices for cell culture using spatially controlled chemical reactions. Biomicrofluidics. 7 (6), 064104 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon