Method Article
垂直化学的酸素勾配の下で細胞移動研究のためのポリジメチルシロキサン - ポリカーボネートマイクロ流体デバイス
要約
The control of chemical and oxygen gradients is essential for cell cultures. This paper reports a polydimethylsiloxane-polycarbonate (PDMS-PC) microfluidic device capable of reliably generating combinations of chemical and oxygen gradients for cell migration studies, which can be practically utilized in biological labs without sophisticated instrumentation.
要約
本論文では、埋め込まれたポリカーボネート(PC)、化学的酸素勾配の組み合わせの下で細胞遊走を研究するための薄膜とポリジメチルシロキサン(PDMS)製のマイクロ流体デバイスを報告します。両方の化学的酸素勾配が大きく、インビボでの細胞遊走に影響を与えることができます。しかしながら、技術的な制限のため、非常に少ない研究は、 インビトロでそれらの効果を調べるために行われています。本研究で開発した装置は、所望の化学勾配を生成するために、蛇行状チャネルの一連の利点を受け取り、酸素勾配の生成のための空間的に閉じ込められた化学反応方法を利用します。化学的酸素勾配の方向は、単純な移行結果の解釈を可能にするために互いに直交しています。効率的に最小限の化学的消費酸素勾配を生成するために、埋め込まれたPC薄膜は、ガス拡散障壁として利用されます。開発したマイクロ流体デバイスシリンジポンプによって作動し、設定の簡素化と最適化された細胞培養条件を可能にするために、細胞遊走実験中、従来の細胞培養器内に配置することができます。細胞実験では、我々は、ケモカインの組み合わせ(間質細胞由来因子、SDF-1α)と酸素勾配の下で、adenocarcinomicヒト肺胞の基底上皮細胞、A549の移行を検討するために、デバイスを使用していました。実験結果は、デバイスが安定垂直ケモカインおよび酸素勾配を生成し、細胞と互換性があることを示します。マイグレーション試験の結果は、酸素勾配は、細胞移動をガイドに重要な役割を果たし得ることを示し、勾配の組み合わせの下で細胞の挙動は、単一の勾配下のものから予測することができません。デバイスは、より多くのインビボ様microenviでより良い細胞遊走の研究を促進することができる細胞培養における化学物質と酸素勾配との間の相互作用を研究する研究者のための強力かつ実用的なツールを提供し、ronments。
概要
可溶性因子および酸素圧の空間分布は、 生体 1、2、3、4 において重要な細胞機能の数を調節することができます。より良好な細胞に対するそれらの効果を調べるために、安定して化学的酸素勾配を生成することができるin vitro細胞培養プラットフォームは、非常に望まれています。様々な可溶性因子は、生物学的活性において重要な役割を果たし、細胞挙動に影響を与えます。近年、マイクロ流体技術の進歩には、安定し化学的勾配を生成することができるマイクロ流体デバイスの数は、細胞遊走5を研究するために開発されてきました。さらに、いくつかの研究はまた、インビトロ細胞培養6、7、8のための酸素圧の必要性を明らかにしました。しかしながら、細胞培養用の酸素分圧の制御は、主に、加圧ガスシリンダーと酸素捕捉または細胞インキュベーターのための直接的な化学的付加に依存しています。直接的な化学添加は、細胞培養培地を変え、細胞応答に影響を与えます。酸素制御インキュベータは、低酸素条件を達成するために、特別な培養器の設計、正確なガス流量制御、および窒素ガスの大容量を必要とします。また、種々の酸素圧及び勾配下の細胞挙動の研究を遅らせるこのセットアップを使用して酸素の空間分布を制御することが不可能です。これらの制限を克服するために、マイクロ流体デバイスの数は、細胞培養用途9酸素勾配を生成するために開発されてきました。しかし、それらのほとんどが蒸発し、気泡発生の問題を引き起こす可能性が、加圧されたガスを使用して操作されます。したがって、それらは多くの場合、高度な機器を必要とし、長期間の細胞培養studieために信頼できない可能性があります秒。
課題を克服するために、さらに、細胞移動のための化学的および酸素勾配との間の相互作用を研究するために、我々は、埋め込まれたポリカーボネート(PC)薄膜10とポリジメチルシロキサン(PDMS)製のマイクロ流体細胞培養装置を開発しました。デバイスは、PDMS膜によって分離された2つのマイクロ流体チャネルの層から構成されています。最上層は、酸素勾配の生成のためのPDMS-PC層です。底部層は、化学的勾配の生成および細胞培養PDMSで形成されています。デバイスは、同時に、ガスシリンダーと洗練されたフロー制御システムを使用することなく、垂直化学的酸素勾配を生成することができます。デバイスでは、PDMSは偉大な光透過性、ガス透過性、および細胞培養およびイメージングのための生物学的な互換性を提供します。埋め込まれたPCフィルムは、効率的な酸素圧を制御するためのガス拡散障壁として作用します。マイクロ流体チャネルでは、蛇行状のチャネルのシリーズを使用しました化学勾配を生成することです。デザインは広く、その信頼性と簡単な実験に様々なアプリケーションのためのマイクロ流体デバイスにおける化学勾配を生成するために利用されてきました。また、化学勾配プロファイルは、数値シミュレーションを用いて、予めチャネルの形状を変えることによって設計することができます。酸素勾配の生成のために、我々は以前に私たちの研究室10、11、12で開発された空間的に閉じ込められた化学反応法を利用しました。酸素は、窒素パージせずに指定された場所から清掃することができます。生物学研究室での実践的な使用法については、全体の実験では、従来の細胞培養インキュベーターと互換性があります。これらのメソッドを統合することにより、我々は同時に、細胞遊走を研究するために、バルクガスボンベと洗練されたインスツルメンテーションのない安定した化学的酸素勾配を生成することができます。
プロトコル
マイクロ流体デバイスの1製作
注:全体のマイクロ流体デバイスは、ソフトリソグラフィーレプリカ成形工程13を用いて製造されます。
- マイクロ流体デバイス内のPDMS層のための金型の作製
- 市販されているイラストや描画ソフトを使用して、マイクロ流体チャネルのパターンを設計します。 14を印刷する高解像度の透明フォトマスクのために会社にファイルを提出してください。
- アセトン(≥99.5%)、イソプロピルアルコールで清浄なシリコンウェハ(IPA;≥99.9%)、および緩衝酸化物エッチング(BOE; 6:1 NH 4 F・HF)。脱イオン(DI)水ですすぎ、窒素銃でウェーハを脱水。
- ネガ型フォトレジストのスピンコートおおよそ20グラム、SU-8 2050、15秒間500rpmでウエハー上に、その後、2,000rpmで30秒間。
注:スピンコート条件は、SU-8 2050の写真が得られるはずです光リソグラフィ後のウェハ上に約75ミクロンの厚さのレジスト層を。 - ソフトベーク65℃のホットプレート上でウェーハ3分間、その後、9分間95℃。ソフトベーク後、UV光の下で設計された透明マスクを持つマスクアライナを使用してウェーハを露出させます。総露光エネルギーは約300ミリジュール/ cm 2であるべきです。露光後ベーク(PEB)65℃でのウエハ2分間、その後7分間95℃。
- PEB後、強い攪拌しながらまたは7分間超音波浴(37 kHzから180 W効果的な超音波パワー)でSU-8現像液にウェハを浸します。残留SU-8を除去するために、アセトン及びIPAでウェハをすすぎます。
- 望ましくない結合を防止するために、ウエハ表面のシラン化のためのダイヤフラム真空ポンプに接続されたデシケータ内の直径6cmのペトリ皿にウェハシランを100μl(1H、1H、2H、2H- perfluorooctyltrichlorosilane)を置きます。 15分間のポンプの電源をオンにし、それをオフに、30分間真空でデシケータを密封します。
- デシケーターのうちシラン化ウェハを取ると、次のソフトリソグラフィ・プロセスのために直径15cmのペトリ皿にそれらをテープ:
- PDMS層の作製とアセンブリ
- PDMSプレポリマーの調製
- 10でPDMSモノマー(ベース)と硬化剤を混合:1の比(v / v)です。 60分間デシケーターセットアップ中の混合物を脱気。
- PC-埋め込みトップ層の作製
- PDMSの薄層を作るために、トップ層流体チャネルパターンを持つ金型の上にPDMSプレポリマーの転送2グラム。 60分間脱気にPDMSをデシケーターセットアップで金型を配置します。
- PDMS硬化のための60℃のオーブンで金型の一晩を置きます。金型は、水平面上にあることを確認してください。
- 室温に金型を冷却。金型にPDMSプレポリマーの追加の13グラムを注ぎ、目にPDMSを脱気60分間の電子デシケーターのセットアップ。
- 徐々にガス拡散バリアとして新鮮PDMS層に厚さ1mm PC膜を埋め込みます。必要に応じて任意の気泡を追い出します。
- 60℃のオーブンで金型の一夜を入れて、それが水平面上にあることを確認してください。
- 室温に硬化PDMSをクールダウン。すべてのチャネルのパターンをカバーすることができ、約5.5×5 cm 2の領域にメスでデバイスを切断し、鋳型からPDMSスラブをはがします。
- 直径2mmの生検パンチを使用して、入口と出口のための穴を開ける。離れた後にアセンブリのための周囲の埃から製作トップPDMS-PC層を保管してください。
- 底部PDMS層の作製
- 底層のための金型上に、PDMSプレポリマーの11グラムを注ぎます。 60分間脱気にPDMSをデシケーター中で金型を配置します。 PDMSを硬化させるために60℃のオーブンで金型一夜にしてください。それは水平面上に横たわっていることを確認してください。
- 目をクールダウン室温に電子のPDMS。すべてのチャネルのパターンをカバーし、金型のオフにそれを剥離することができ、約5.5×5 cm 2の領域にデバイスをカットします。離れた後にアセンブリのための周囲の埃から製作底PDMS層を保管してください。
- PDMS膜の製造
- 90秒、4秒後、3000 rpmで100 rpmでシラン化ブランクウェハ上にPDMSプレポリマーのスピンコートおおよそ4グラム。オーブンで一晩60°Cでスピンコートされたウェハを焼きます。
- 装置の組み立て
- 作製したPDMS-PCのトップ層との接合面を上に向けて、O 2プラズマ表面処理機でスピンコートしたPDMS膜付きウェハを置きます。 40秒間O 2プラズマの90 WとPDMSの表面を処理します。
- 右O 2プラズマ表面処理後のPDMS膜上に上部層を結合。接合層の上に重量(約600グラム)を配置し、それらを置きます接着を促進するために、60℃のオーブンで一晩。
- 室温に結合された層を冷却し、すべてのチャネルのパターンをカバーすることができ、約5.5×5 cm 2の領域にメスでトップ層に接合膜をカット。 2mmの直径の生検パンチを使用して、化学勾配のチャンネルの入口と出口のシリコンウェハとパンチ孔から結合構造剥がし。
- 40秒90 Wのプラズマを用いて、PDMSの表面を活性化するために、接合面を上に向けて、O 2プラズマ表面処理機で膜に結合したトップ層と製作PDMS底層を配置します。
- 表面処理の直後に接着するために一緒にトップとボトム層を取り付けます。全体結合したデバイスの上に重量(約600グラム)を配置し、60℃のオーブンで一晩にそれを置きます。
- オーブンから全体製造されたデバイスを取り出し、室温まで冷却します。
- PDMSプレポリマーの調製
2.マイクロ流体細胞遊走アッセイ
注:本稿では、例として、一般的に使用される細胞株、adenocarcinomicヒト肺胞の基底上皮細胞(A549)、およびケモカイン、間質細胞由来因子(SDF-1α)を使用します。他の細胞およびケモカインに取り組んで研究者のために、それに応じて実験的なプロセスを調整してください。
- 0日目:細胞調製
- 培養するDMEM F12 L-グルタミン代替、10%(v / v)のウシ胎児血清(FBS)、1%(v / v)のantimicrob - 抗真菌溶液を含む完全増殖培地でA549細胞のストック。 0.25%トリプシンEDTAで解離することにより、サブカルチャー。
- 室温で3分間、140×gで分離した細胞を遠心分離することにより、実験用の細胞懸濁液を準備します。マイクロ流体デバイスの実験のために、血球計数器を用いて細胞をカウントし、完全10mlでT75フラスコ中に少なくとも1×10 6個の細胞を播種増殖培地。
注:すべての細胞培養プロセスは、37℃、5%CO 2雰囲気のインキュベーター中で行われます。
- 1日目:デバイスの準備
- O 2プラズママシンにデバイスを配置し、親水性のマイクロ流体チャネルの表面をレンダリングするために40秒間90 WでO 2プラズマでそれを扱います。
- すぐに表面処理した後、直接化学勾配路入口におけるPDMS層に打ち抜い直径2mmの穴に針を挿入することにより、2つの14 G鈍い針を取り付けます。針はマイクロ流体チャネルをブロックしないことを確認します。ブラント14 G針で1mlシリンジを使用してのddH 2 Oの0.8ミリリットルを描画します。水が注入口の両方で針から流出するまで、コンセントからの化学勾配路へのddH 2 Oを注入します。
- ダルベッコ&#とフィブロネクチンの株式を希釈して50μg/ mlのフィブロネクチン溶液1mlを準備39; sのリン酸緩衝生理食塩水(DPBS)。
- 溶液は入口の両方で針から流出するまで鈍14 G針を有する1mLの注射器を使用して、化学勾配路の出口からフィブロネクチン溶液を注入します。
- 従来の細胞培養インキュベーター中で、装置全体の一晩インキュベートします。
- 2日目:細胞の播種および顕微鏡イメージング
- 細胞播種
- 0日目以降、培養した細胞からの培地を吸引し、DPBS 5mlの2回で細胞を洗浄。 、DPBSを吸引トリプシンEDTAの2ミリリットルを追加し、フラスコ表面から細胞を分離するために5分間インキュベーター中で細胞をインキュベートします。
- フラスコに細胞が分離し、溶液中に懸濁されるまで待ってから、無血清培地の8ミリリットルを追加(DMEMのF12 + 1%(v / v)のantimicrob - 抗真菌溶液)。 15ミリリットルコニカルチューブに液体のすべてを転送し、室温下で5分間、140×gで、それを遠心します。
- 遠心分離後、上清を吸引し、最終細胞密度を1×10 6細胞/ mlを作製するために、無血清培地を適量加えます。 1日目に調製したマイクロ流体デバイスを取り出し、血球計数器または別の自動細胞計数器を用いて細胞を数えます。
- 媒体は入口の両方で針から流出するまで鈍14 G針を有する1mLの注射器を使用して、化学勾配路の出口から無血清培地を注入します。化学勾配路の出口からの細胞懸濁液200μlを注入します。
- 細胞がマイクロ流体チャネルに導入されていることを確認するために顕微鏡下でデバイス内の細胞培養室を守ってください。湿度の高い容器( 例えば、のddH 2 O内側にプラスチック製の箱)にデバイスを配置し、デバイス表面上に細胞の接着を促進するために5時間細胞培養インキュベーターに保管してください。
- REAGの調製化学勾配の生成のためのエント
- 無血清培地中で所望の濃度(100ng / mlの)で化学(SDF-1α)を準備します。高純度のチューブに接続された2つの別々の3ミリリットルシリンジに薬液でとすることなく、無血清培地を描画します。後で使用するために1μL/分の流量でシリンジポンプにシリンジを設定します。
- 酸素勾配の生成のための試薬の調製
- 1 M NaOH溶液の15ミリリットルと200 mg / mlでピロガロール溶液15mlを加えます。それぞれ、高純度のPTFEチューブと高純度のチューブに接続された2つの独立した15ミリリットルの注射器にNaOHおよびピロガロールソリューションを描画します。後で使用するために5μL/分の流量でシリンジポンプにシリンジを設定します。
- マイクロ流体デバイスのセットアップ
- 5時間インキュベートした後、デバイス全体を取り出し、直径15cmのペトリ皿の上に置きます。接着剤パテを使用して、ペトリ皿にデバイスを修正しました。転送インキュベーターでのライブセルイメージング顕微鏡にペトリ皿。
- 化学勾配路の流入口に化学的勾配を生成するための注射器からチューブを接続します。廃棄物容器につながる配管にコンセントを接続します。化学勾配を生成するためのシリンジとシリンジポンプをオンにします。
- 酸素勾配路の流入口にNaOHを含むシリンジおよびピロガロールから高純度のチューブを接続します。廃棄物を収集するためにコンセントにチューブを接続します。酸素勾配を生成するためのシリンジとシリンジポンプをオンにします。
- しっとりデバイスを維持するためにペトリ皿にのddH 2 Oの約15ミリリットルを追加します。時間経過画像キャプチャのためのライブセルイメージング顕微鏡を設定し、画像ごとに15分を取ります。
- 細胞播種
- 3日目:データ収集と分析
- パソコンに取り込んだ画像ファイルを転送します。オープンソースの画像ANを使用して画像を分析alysisソフトウェア、マニュアルトラッキング(https://imagej.nih.gov/ij/plugins/track/track.html)のためのオープンソースのプラグインとフリー走化性ToolソフトウェアとImageJの、(http://ibidi.com/xtproducts / EN /ソフトウェア・アンド・画像解析/マニュアル-画像解析/走化性・アンド・マイグレーション・ツール)15、16。
グラデーションの3キャラクタリゼーション
注:化学的酸素勾配は、細胞実験の前または後に特徴づけることができます。
- 化学勾配の数値シミュレーション
- 計算流体力学(CFD)シミュレーションを用いて、マイクロ流体の層流の性質を推定します。
- 酸素勾配の実験的特性評価
- 酸素感受性蛍光色素、トリス(2,2'-ビピリジル)ルテニウム(III)六水和物、5の濃度で水に溶液を調製しますミリグラム/ mlです。
- 高純度のチューブに接続された2つの別々の3ミリリットルシリンジ中に酸素感受性色素溶液を描画します。 (化学勾配の生成に使用される流量と同じ)1μL/分の流量でシリンジポンプにシリンジを設定します。
- 化学勾配チャネルの注入口に注射器からチューブを接続します。廃棄物容器につながる配管にコンセントを接続します。化学勾配を生成するためのシリンジとシリンジポンプをオンにします。
- 470±20nmの光フィルタを通過した励起光を倒立蛍光顕微鏡を用いて蛍光強度を測定します。クールCCDカメラを使用して515 nmのロングパス発光フィルターを通して発光を収集します。
- 酸素勾配路の流入口にNaOHを含むシリンジおよびピロガロールから高純度のチューブを接続します。廃棄物を収集するためにコンセントにチューブを接続します。酸素用シリンジとシリンジポンプをオンにします勾配の世代。
- 細胞培養チャンバ内を流れる酸素感受性色素の蛍光画像を収集します。
- 酸素勾配の生成のためのフローを停止し、酸素発生チャネルにすべてのチューブを外します。酸素勾配チャネルの出口にガスボンベから高純度のチューブを接続します。
- 酸素勾配路に接続されたチューブ内に空気、純窒素、純酸素を流したときに、細胞培養チャンバ内に流入する酸素感受性色素の蛍光画像を収集します。
- 参考文献10および11に記載のシュテルン - フォルマーの式を用いて蛍光画像を解析することにより、酸素の勾配を推定します。
結果
作製したPDMS-PCハイブリッドマイクロ流体細胞培養装置。イチジク。図1は、写真やマイクロ流体デバイスの実例を示しています。底層は、6つの異なる混合比を持つ2つの別々の入口から導入された試薬からソリューションを生成するために、蛇行状のチャネルの4つのレベルが含まれています。導入口から導入された2つの溶液の間で0,4:1,3:2,2:3,1:4、および0:1(右から左)、理論的に、6の異なる混合比は1です。 6の異なる混合比ソリューションによって構築化学勾配は、下流に位置する、細胞培養チャンバ内に発生させることができます。頂部および底部層は、PDMS膜によって分離されています。最上層は、酸素捕捉化学反応のための試薬は、2つの別々の入口からマイクロ流体チャネルに導入されます。試薬は、すぐに細胞培養室の上部に流入する前に、反応のために互いに混合されています直接的な化学接触することなく、底部チャネルから酸素を除去。 PDMSと比較して小さいガス拡散係数を有する埋め込みPCフィルムは、脱酸素をより効率的に拡散障壁として作用します。酸素が徐々に流れ方向に沿って酸素勾配を形成するために、下流領域でPDMSを介して細胞培養室に戻って拡散します。酸素除去化学反応が空間的に限定されているので、唯一の地元の酸素圧が影響を受けます。その結果、デバイスは、そのグローバルな酸素分圧を変更することなく、通常の細胞培養器で利用することができます。遊走実験において、細胞を観察するための細胞培養チャンバの内部に播種されます。増殖培地および化学試薬を正確に制御流量でシリンジポンプを使用してデバイスに導入されます。
デバイス内部で発生した化学的酸素勾配のキャラクタリゼーション。トンのために彼は流れの挙動は、計算流体力学(CFD)シミュレーションを用いて予測することができ、マイクロフルイディクスの性質を流れる層流。本稿では、3Dモデルを構築し、市販のマルチフィジックスモデリングソフトウェアを使用してシミュレーションを行いました。 イチジク。図2(a)蛍光強度の測定と数値シミュレーションの結果に基づいて、細胞培養チャンバの幅にわたって実験的に特徴付けフルオレセイン濃度プロファイルの比較を示します。実験とシミュレーション結果との間の合意は、CFDモデルがよく、デバイス内部で発生した化学勾配を推定することができることを示唆しています。 イチジク。図2(b)の細胞培養チャンバ内で生成されたシミュレートされたSDF-1αの勾配をプロットします。 イチジク。図3は、細胞実験の前に細胞培養室の内部に酸素感受性蛍光色素を流すことによって、酸素勾配の特性評価結果を示します。その結果、酸素gradiことを示しENTは、約1〜16%の範囲、上記のプロトコルを用いて確立することができます。
細胞遊走をもたらします。デモンストレーションとして、我々は4ケモカインの組み合わせ(SDF-1α)と酸素勾配の下でA549細胞移動の研究を行った:(1)無ケモカインおよび制御などの無酸素勾配、(2)ケモカイン勾配を有すると酸素勾配のありません、 (3)酸素勾配およびケモカイン勾配なし、および(4)ケモカインおよび酸素勾配の両方を有します。 イチジク。図4は、全体の実験の写真を示しています。実験は全てその中に配置され(マイクロ流体デバイス、シリンジポンプ、および生細胞イメージング顕微鏡を含む)全体のセットアップを有する従来の細胞培養インキュベーター中で行いました。細胞遊走の結果を図5に示します。 5。 イチジク。図5(a)生細胞イメージングANAを用いた実験中に収集された画像を示しますlyzer、および図。図5(b)及び(c)は、プラグインでImageJソフトウェアによって分析4つの組み合わせの下で細胞遊走軌道と平均動きをプロットします。結果は、実験中の細胞のランダムな動きを示唆している、コントロールの平均細胞遊走距離はゼロに近づくことを示しています。対照的に、唯一のケモカイン勾配で、細胞の移動平均は、SDF-1αの濃度が高い左に向かっています。結果は、以前に報告されたA549細胞のSDF-1αの化学走性の動作を示唆する。酸素圧が低い場合にのみ酸素勾配を用いた実験では、細胞の移動平均は、上向きです。さらに興味深いことに、垂直ケモカインおよび酸素勾配を用いた実験では、細胞の移動平均を上と横方向(ケモカイン勾配方向)の任意の明白な動きなしです。
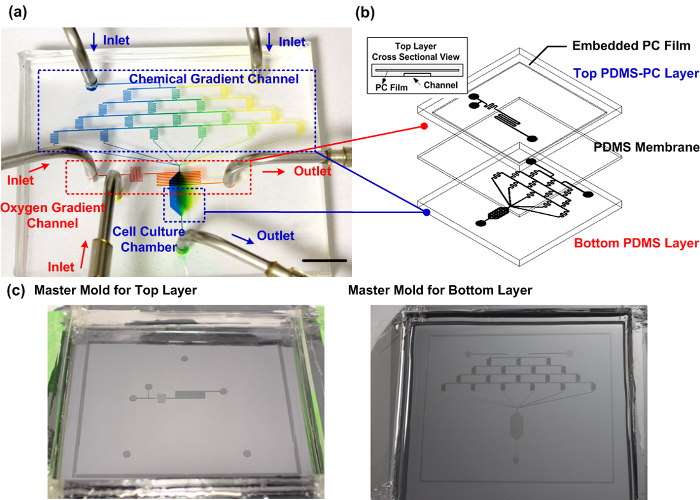
図1:製造さPDMS-PCマイクロ流体細胞培養装置。 (a)は、確実に細胞移動の研究のために垂直化学的酸素勾配を生成することが可能な作製装置の実験的な写真。化学勾配チャネルは、細胞培養チャンバの内部に勾配の生成を実証するために、青色と黄色の食用色素が充填されています。酸素勾配チャネルは赤色食用色素が充填されています。スケールバーは1cmです。 (b)は、マイクロ流体デバイスの概略図。最上層は、細胞培養チャンバ内の効率的な酸素勾配を制御するためのガス拡散バリアとして埋め込まれたPC層とPDMSを用いて製造されます。 (c)の頂部および底部層の製造のためのマスターモールド。 にはこちらをクリックしてくださいこの図の拡大版を表示します。
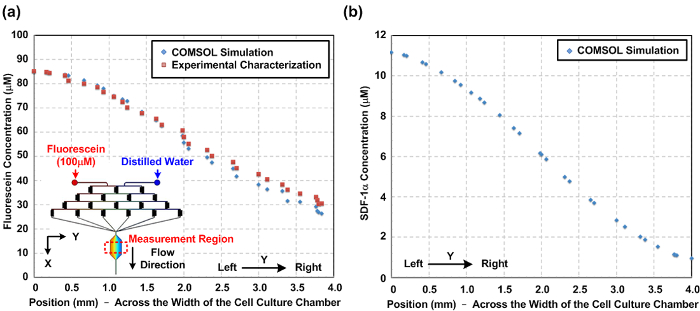
図2: マイクロ流体細胞培養装置内の化学勾配。 (a)は、数値的にシミュレートし、実験的に細胞培養室(Y方向)の幅を横切って細胞培養チャンバー内のフルオレセイン濃度勾配を特徴とします。シミュレートし、実験的に測定された勾配との間の類似性は、シミュレーションは、化学勾配を予測することができることを示しています。図の挿入図は、シミュレーションのために構築された三次元(3D)モデルを示しています。 (b)細胞の遊走試験のための細胞培養チャンバの幅にわたってSDF-1αケモカイン勾配の数値シミュレーション結果を。 ご覧になるにはこちらをクリックしてください。この図の拡大版。
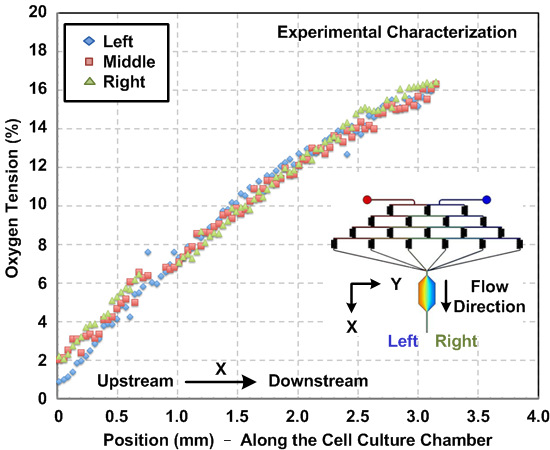
図3: マイクロ流体細胞培養装置内の酸素勾配。実験的に流れ方向に沿って細胞培養チャンバー内の酸素勾配を測定しました。勾配は、酸素感受性蛍光色素および画像解析を用いて推定しました。勾配は、チャンバーの左から右に、特徴付けられ、その結果、チャンバの幅にわたって一貫した勾配プロファイルを示します。

図4: 実験の写真。マイクロ流体デバイス、シリンジポンプ、および生細胞イメージング顕微鏡を含む全体のセットアップは、最適化のための従来の細胞培養インキュベーター内に配置され実験中の細胞培養条件。 この図の拡大版をご覧になるにはこちらをクリックしてください。
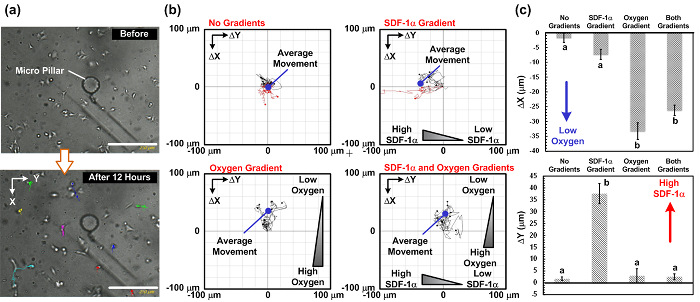
図5: 垂直SDF-1αおよび酸素勾配下での細胞遊走試験の結果。 (a)は、画像は12時間細胞遊走試験前後の捕捉します。細胞移動経路は、ライブセルイメージング顕微鏡を用いて撮影時間経過画像から解析することができます。 (b)細胞の移行パスと4つの異なる勾配の組み合わせの下で撮影した画像から解析し、平均の移行の動き:無勾配、唯一のケモカイン勾配、唯一の酸素勾配、および両方のケモカインと酸素勾配を。画像は15分ごとに捕獲されました。スケールバーは250μmであります。四つの異なる勾配の組み合わせの下で垂直の平均細胞遊走距離の(c)のプロット(酸素勾配)および水平(ケモカイン勾配)方向。データは、3つの独立した実験のセットから得られた平均±SDとして表され、そして10個の細胞を、各実験で分析しました。統計的有意差が(対応のないスチューデントt検定、p <0.01)の結果は、異なる文字(AおよびB)で示されています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
組み込みPC薄膜をPDMSマイクロ流体デバイスを作製するための最も重要な手順は次のとおりです。PDMS-PCのトップ層を製造しながら、PDMSプレポリマーにPCフィルムを挿入し、(2)を確認したときに(1)すべての気泡を追い出します硬化プロセスのすべてのPDMSはよく水平に水平面上で実行されます。細胞遊走実験のために、最も重要なステップは次のとおりです。(1)実験中のマイクロ流体デバイス、チューブ、シリンジポンプ内の気泡を除去すること; (2)マイクロ流体デバイスは、細胞遊走観察用生細胞イメージングの間に十分に水平に水平面上に配置されることを保証します。 (3)実験中のペトリ皿にのddH 2 Oを添加し、必ず水が乾いていないことを行うことで、加湿装置を保持します。
正常に剥離することなく、PDMS-PCハイブリッドマイクロ流体デバイスを製造するためには、PC Fiの中にすべての気泡を除去することが重要ですLM挿入。 PCフィルムはゆっくりPDMSプレポリマーへのPCフィルムの挿入中の気泡発生を防止する(約15〜30度離れたPDMSプレポリマー表面)からの角度から挿入することができます。必要であれば、埋め込まれたPCフィルムで全体PDMSプレポリマーは、捕捉された気泡を排出するために10分間真空ポンプに接続されたデシケーターに配置することができます。 PCフィルムは、真空処理後に浮上する場合、ピペットチップは、硬化したPDMS層上にPC膜を押下するために使用することができます。必要に応じて真空プレスのプロセスを繰り返します。
細胞実験のために、気泡の欠如は、マイクロ流体細胞培養のために重要です。空気の泡が接続を行う(シリンジポンプ、チューブ、およびマイクロ流体デバイスを含む)全体のマイクロ流体セットアップに導入されていないことを確認します。気泡がEXPEの高温下でのガス溶解度の減少によるマイクロ流体セットアップ内で作成された場合温度変化を最小限に抑えるためにインキュベーター内部riments、すべての実験(シリンジ及びチューブを含む)成分と(増殖培地、ピロガロール、およびNaOHなど)の試薬を予めインキュベーターに置くことができる(使用前に少なくとも20分) 。注射器は、多くの場合、ポンプ内のモータの動作から熱を発生させるポンプ。インキュベータの内側にシリンジポンプを作動させるために、通常は許容可能です。しかし、実験中にインキュベーターの温度をチェックします。温度は、実験中に上昇した場合、追加の冷却手続を行う必要があります。いくつかの実現可能な冷却方法は、例えば、インキュベーターに氷のボックスを配置するインキュベータの内側に配置され、シリンジポンプの数を減らす、または強制冷却システムを有するインキュベータを使用するなど、使用することができます。
本論文で開発したPDMS-PCマイクロ流体細胞培養装置は、確実にfoの垂直化学的酸素勾配を生成することができますR細胞遊走試験。開発された装置の制限は、生成された酸素勾配プロファイルは、周囲の大気から、装置を介して、媒体中に化学反応掃気によって駆動される酸素流量、および酸素の拡散との間のバランスに依存することです。その結果、酸素勾配プロファイルは、任意に装置内に制御することができません。既存のマイクロ流体細胞培養プラットフォームと比較すると、この論文で開発したデバイスは、化学的酸素勾配の組み合わせの下で細胞培養研究を行うことができる最初のものです。装置全体は、面倒な位置合わせや高価な計測することなく、従来のソフトリソグラフィレプリカ成形プロセスを用いて製造することができます。勾配は、数値的にシミュレートし、実験的に、インビトロ細胞試験のための複数の生理的微小環境のような条件を提供するように特徴付けることができます。ガスジPC膜を空間的に閉じ込められた化学反応法を用いてffusionバリア、酸素勾配は、加圧ガスシリンダーと洗練されたガス流量制御装置を用いることなく生成することができます。また、セットアップは酸素勾配を維持するために、化学物質の少量のみ(1日未満10ミリリットル)が必要です。酸素分圧の制御は、マイクロ流体チャネルの周りに局所的に閉じ込められ、周囲の酸素濃度に影響を与えないので、全体のセットアップは追加の温度、湿度のない従来の細胞培養インキュベーターの内部に配置され、かつCO 2制御計測することができます。結果として、開発したデバイスは、実質的に生物学的な研究室で使用される大きな可能性を秘めています。
技術的な制限により、酸素圧の下での細胞の挙動はほとんど既存の文献で研究されていません。本論文で開発したデバイスの助けを借りて、酸素勾配の下で細胞培養を大幅に酸素勾配の下で細胞研究を促進する容易な方法で行うことができます。 Furthermore、同様の動作原理は、 インビトロ細胞培養は、17の研究のために、例えば二酸化炭素や窒素酸化物などの他の生理的に適切な気体勾配を生成するために適用することができます。これらの機能は、PDMS-PCマイクロ流体デバイスは、 インビトロ細胞培養研究に進めるために、薬物検査と細胞増殖と遊走のアッセイを含む種々の細胞培養用途のための大きな可能性を示していることを示しています。
開示事項
著者は、彼らが競合する金融利害関係を持たないことを宣言します。
謝辞
This paper is based on work supported by the National Health Research Institutes (NHRI) in Taiwan under the Innovative Research Grant (IRG) (EX105-10523EI), the Taiwan Ministry of Science and Technology (MOST 103-2221-E-001-001-MY2, 104-2221-E-001-015-MY3, 105-2221-E-001-002-MY2), the Academia Sinica Thematic Project (AS-105-TP-A06), and the Research Program in Nanoscience and Nanotechnology. The authors would like to thank Ms. Rachel A. Lucas for proofreading the manuscript.
資料
| Name | Company | Catalog Number | Comments |
| 1 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302104 | |
| 1.5 ml Microcentrifuge Tube | Smartgene | 6011-000 | |
| 10 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302151 | |
| 15 ml Centrifuge Tube | ThermoFisher Scientific,Waltham, MA | Falcon 352096 | |
| 150 mm Petri dish | Dogger Science | DP-43151 | |
| 1H,1H,2H,2H-Perfluorooctyltrichlorosilane | Alfa Aesar, Ward Hill, MA | 78560-45-9 | |
| 3 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302118 | |
| 4'' Silicon Dummy Wafer | Wollemi Technical, Taoyuan, Taiwan | ||
| Acetone | ECHO Chemical, Miaoli, Taiwan | AH3102-000000-72EC | |
| AG Double Expose Mask Aligner | M&R Nano Technology, Taoyuan, Taiwan | AG500-4D-D-V-S-H | |
| Antibiotic-Antimyotic solution | ThermoFisher Scientific,Waltham, MA | GIBCO 15240-062 | |
| Biopsy punch | Miltex, Plainsboro, NJ | 33-31 | |
| Blunt needle | JensenGlobal, Santa Barbara, CA | Gauge 14 | |
| Bright-Line Hemocytometer | Sigma-Aldrich, St. Louis, MO | Z359629 | for cell counting |
| Buffered Oxide Etch | ECHO Chemical, Miaoli, Taiwan | PH3101-000000-72EC | |
| Cell Culture Incubator | Caron, Marietta, OH | 6016-1 | |
| COMSOL Multiphysics | COMSOL, Burlington, MA | Ver. 4.3b | for numerical simulation of chemical gradients in the device |
| D-PBS | ThermoFisher Scientific,Waltham, MA | GIBCO 14190-144 | |
| Desicattor | A-VAC Industries, Anaheim, CA | 35.10001.01 | |
| DMEM/F12+GlutaMax-1 | ThermoFisher Scientific,Waltham, MA | GIBCO 10565-018 | |
| Fetal Bovine Serum | ThermoFisher Scientific,Waltham, MA | GIBCO 10082 | |
| Fibronectin from Human Plasma | Sigma-Aldrich, St. Louis, MO | F2006 | |
| Inverted Fluorescence Microscope | Leica Microsystems, Wetzlar, Germany | DMIL LED | |
| Isopropyl Alcohol (IPA) | ECHO Chemical, Miaoli, Taiwan | CMOS112-00000-72EC | |
| JuLi Smart Fluorescence Cell Imager | NanoEnTek, Seoul, Korea | DBJ01B | |
| Mechanical Convention Oven | ThermoFisher Scientific,Waltham, MA | Lindberg Blue M MO1450C | |
| NaOH | Showa Chemical Industry, Tokyo, Japan | 1943-0150 | |
| Plasma tretment system | Nordson MARCH, Concord CA | PX-250 | for oxygen plasma surface treatment |
| Polycarbonate (PC) film | Quantum Beam Technologies, Tainan Taiwan | ||
| Polydimehtylsiloxane (PDMS) | Dow Corning, Midland, MI | SYLGARD 184 | |
| Pyrogallol | Alfa Aesar, Ward Hill, MA | A13405 | |
| Removable Adhesive Putty | 3M | 860 | |
| Sorvall Legend Mach 1.6R Tabletop Centrifuge | ThermoFisher Scientific,Waltham, MA | ||
| Spin Coater | ELS Technology, Hsinchu, Taiwan | ELS 306MA | |
| SU-8 2050 | MicroChem, Westborough, MA | SU-8 2050 | |
| SU-8 Developer | MicroChem, Westborough, MA | Y020100 | |
| Surgical blade | Feather, Osaka, Japan | 5005093 | for PDMS cutting |
| Syringe Pump | Chemyx, Houston, TX | Fusion 400 | |
| T75 Cell Culture Flask | ThermoFisher Scientific,Waltham, MA | Nunc 156367 | |
| Trypan Blue Solution, 0.4% | ThermoFisher Scientific,Waltham, MA | 15250061 | |
| Trypsin-EDTA | ThermoFisher Scientific,Waltham, MA | GIBCO 25200 | |
| Tygon PTFE Tubing | Saint-Gobain Performance Plastics, Akron, OH | ||
| Tygon Tubing | Saint-Gobain Performance Plastics, Akron, OH | 621 |
参考文献
- Phillips, J. E., Burns, K. L., Le Doux, J. M., Guldberg, R. E., García, A. J. Engineering graded tissue interfaces. Proc. Natl. Acad. Sci. USA. 105 (34), 12170-12175 (2008).
- Wang, F. The signaling mechanisms underlying polarity and chemotaxis. Cold Spring Harb. Perspect Biol. 1 (4), 1-16 (2009).
- Oh, S. H., Ward, C. L., Atala, A., Yoo, J. J., Harrison, B. S. Oxygen generating scaffolds for enhancing engineering tissue survival. Biomaterials. 30 (5), 757-762 (2009).
- Decaris, M. L., Lee, C. I., Yoder, M. C., Tarantal, A. F., Leach, J. K. Influence of the oxygen microenvironment on the proangiogenic potential of human endothelial colony forming cells. Angiogenesis. 12, 303-311 (2009).
- Chung, B. G., et al. Human neural stem cell growth and differentiation in a gradient-generating microfluidic device. Lab Chip. 5 (4), 401-406 (2005).
- Harris, A. L. Hypoxia - a key regulatory factor in tumor growth. Nat. Rev. Cancer. 2 (1), 38-47 (2002).
- Allen, J. W., Bhatia, S. N. Formation of steady-state oxygen gradients in vitro: application to liver zonation. Biotechnol. Bioeng. 82 (3), 253-262 (2003).
- McCord, A. M., Jamal, M., Shankavaram, U. T., Lang, F. F., Camphausen, K., Tofilon, P. J. Physiologic oxygen concentration enhances the stem-like properties of CD133+ human glioblastoma cells in vitro. Mol. Cancer Res. 7 (4), 489-497 (2009).
- Lo, J. F., Sinkala, E., Eddington, D. T. Oxygen gradients for open well cellular cultures via microfluidic substrates. Lab Chip. 10 (18), 2394-2401 (2010).
- Chang, C. W., et al. A polydimethylsiloxane-polycarbonate hybrid microfluidic device capable of generating perpendicular chemical and oxygen gradients for cell culture studies. Lab Chip. 14 (19), 3762-3772 (2014).
- Chen, Y. A., et al. Generation of oxygen gradients in microfluidic devices for cell culture using spatially confined chemical reactions. Lab Chip. 11 (21), 3626-3633 (2011).
- Peng, C. C., Liao, W. H., Chen, Y. H., Wu, C. Y., Tung, Y. C. A microfluidic cell culture array with various oxygen tensions. Lab Chip. 13 (16), 3239-3245 (2013).
- Xia, Y., Whitesides, G. M. Soft Lithography. Ann. Rev. Mate. Sci. 28, 153-184 (1998).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502 (2010).
- Cordelières, F. P. . Manual Tracking. , (2005).
- Asano, Y., Horn, E. . Instructions Chemotaxis and Migration Tool 2.0. , (2013).
- Chen, Y. H., Peng, C. C., Cheng, Y. J., Wu, J. G., Tung, Y. C. Generation of nitric oxide gradients in microfluidic devices for cell culture using spatially controlled chemical reactions. Biomicrofluidics. 7 (6), 064104 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved