Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Inyección hidrodinámica la Pelvis Renal para la no expresión de proteínas en el riñón
En este artículo
Resumen
Este protocolo describe un método para inyectar ADN plásmido en el riñón de ratón a través de la pelvis renal para producir la expresión del transgen específicamente en el riñón.
Resumen
Inyección hidrodinámica crea un ambiente local, alta presión para transfectar varios tejidos con ADN plasmídico y otras sustancias. Inyección en la vena hidrodinámica cola, por ejemplo, es un método bien establecido de que el hígado puede ser transfectado. Este manuscrito describe una aplicación de los principios hidrodinámicos por inyección del riñón de ratón directamente con ADN de plásmido de expresión génica específicos de riñón. Ratones son anestesiados y se expone el riñón por una incisión flanco seguida de una inyección rápida de un plásmido que contiene el ADN de la solución directamente en la pelvis renal. La aguja se mantiene en el lugar durante diez segundos y el sitio de la incisión es suturado. Al día siguiente, en vivo la proyección de imagen animal, Western blot o inmunohistoquímica puede utilizarse para análisis de expresión génica, u otros ensayos para el transgén de la opción se utilizan para la detección de la proteína de interés. Métodos publicados para prolongar la expresión de genes incluyen el transgén mediada por transposones integración y ciclofosfamida tratamiento para inhibir la respuesta inmune a la transgénica.
Introducción
La técnica de inyección hidrodinámica cola vena se ha convertido en una forma comúnmente usada para alcanzar altos niveles de expresión génica en mouse de hígado1,2. Los riñones también son transfectados por esta técnica en un nivel mucho más bajo, aproximadamente 100-fold menos3. La inyección hidrodinámica renal pelvis descrita aquí proporciona una manera simple para controlar la especificidad de la expresión del órgano a través de medios físicos, utilizando los mismos principios hidrodinámicos que se han establecido previamente en el hígado4,5 , músculo6y otros órganos7,8. Este método transfects las células de animales vivos en vivo mediante el uso de presión y velocidad para forzar fluido que contienen ADN en las células, induciendo simultáneamente daño al órgano que es rápidamente resueltos9. Usando técnicas quirúrgicas bien establecidas para visualizar el riñón a través de una incisión de flanco10 junto con una sola inyección de la jeringuilla de la insulina, hemos encontrado exitosa transfección de varios tipos de células del riñón, principalmente fibroblastos intersticiales, túbulos y conductos que recoge11. La disección de estos ratones ha demostrado que otros órganos no son transfectados en niveles suficientemente altos como para visualizar por luciferase imágenes técnicas11. Ya que la técnica es no-viral, uso de ADN plásmido para transfección permite fácil y rápida preparación de los reactivos necesarios para la inyección.
Hemos utilizado las inyecciones localizadas de hidrodinámicas para expresar el antioxidante glutatión S-transferasa A4, el receptor de factor de crecimiento 1 similar a la insulina y la hormona eritropoyetina en el riñón, con los esperados efectos biológicos11, 12 , 13. evaluación detallada de la ruta de administración, volumen de inyección, dosis de ADN y elección del promotor ha sido realizado11. Además, tanto en el piggyBac transposon sistema o ciclofosfamida tratamiento para suprimir la reacción inmune a la transgénica han demostrado para mejorar a largo plazo de los resultados de expresión génica11. Otros investigadores han utilizado un enfoque de la vena renal en rata con éxito, logrando eficiencia de transfección alta durante períodos de tiempo de más de un mes14. Sin embargo, la corrección genética de fenotipos mímico enfermedad humana se realizan generalmente en ratones primero como una prueba de concepto ya que los modelos genéticos más mamíferos son modelos de ratón. En comparación con la inyección en la vena renal a la inyección de la pelvis renal y encontraron que la inyección en la pelvis renal es superior a la vena renal para la expresión de genes (aproximadamente diez veces mayor) y supervivencia11. La pelvis renal es la vía ideal de entrada en el riñón porque es lo suficientemente flexible para tolerar fluctuaciones en la producción de orina y a menudo es capaz de mantener su integridad estructural, incluso cuando se dilatan durante la hidronefrosis. Adicionalmente, la inyección en la pelvis renal permite acceso al riñón sin perforación de la cápsula del riñón, permitiendo que el líquido inyectado para conservarse visiblemente por el riñón mejor que la inyección de la intraparenchymal. Otros órganos de ratón no tiene una ruta de entrada distinta a la vasculatura y el espacio urinario del riñón es un sitio ideal de la inyección. Además, la inyección en la vena renal dio lugar a la salida de sangre en la cavidad abdominal. El volumen total renal de riñones de tipo salvaje ratón ha estimado la proyección de imagen de resonancia magnética a ser aproximadamente de 0,2 cm3, por lo que el volumen de un solo riñón es aproximadamente igual a la cantidad de líquido inyectado por la hidrodinámica de la pelvis renal inyección (100 μL)15. En este documento, nos hemos puesto a disposición todos los matices detallados del Protocolo de inyección hidrodinámica la pelvis renal para lograr reproducible de la transfección del riñón.
Protocolo
Todos los métodos aquí descritos han sido aprobados por el cuidado institucional de Animal y comités de uso (IACUCs) de la Baylor College of Medicine y Vanderbilt University Medical Center.
1. prepare la solución de ADN para la inyección
- Seleccione plasmid(s) para expresar el transgene(s) cuidadosamente para maximizar las características deseables para mejorar la eficiencia de transfección y expresión del transgén.
Nota: Pelvis renal hidrodinámico inyección de plásmidos que expresan el marcador fluorescente TdTomato, la hormona eritropoyetina (Epo) y luciferasa de luciérnaga han sido previamente descritos11. Si no es un análisis bien desarrollado para eficiencia de transfección para el transgen, realizar proyección de imagen de animal vivo de luciferase introduciendo 10 μg de plásmido de expresión de luciferasa como luciferasa de luciérnaga mejorada del ADN diluido para la inyección.- Elegir el plásmido más práctico a la aplicación.
Nota: Pequeños plásmidos generalmente transfectar las células más grandes plásmidos. Por ejemplo, el gen de resistencia zeomycin y R6K origen de replicación son pequeños, por lo que utilizando estos elementos en la columna vertebral del plásmido disminuye tamaño del plásmido. - Expresan el transgén de un promotor de mamífero.
Nota: El riñón tipo de células transfectado, longitud de la expresión génica y la fuerza de la expresión génica todo afectará a la elección del promotor. Ver Woodard et al. para una comparación de citomegalovirus (CMV; constitutivo viral), alfa del factor 1 de elongación (EF-1α; constitutivos endógenos), gamma-glutamil transferasa (γGT, túbulo-específica) y podocin (NPHS2; Podocito-específica)11. - Emplear un sistema de integración no virales como transposones si mayores niveles de expresión génica a largo plazo están deseable11,16. Para estudios con lecturas tempranas menos de inyección después de 5 días, integración del transgén es innecesario.
- Elegir el plásmido más práctico a la aplicación.
- Preparar DNA plasmídico para inyección utilizando un método comercial como un kit de maxiprep libre de endotoxinas. Evitar cuidadosamente la introducción de endotoxinas a través de material de laboratorio.
Nota: Presencia de endotoxinas en la solución de ADN elicite una severa respuesta inmune en el animal sujeto, comprometer el experimento y posiblemente matar al animal.- Después de completar el último paso de lavado de aislamiento de ADN, no Asegúrese que etanol es por el olor y la inspección visual. Utilizar puntas de carga de gel para eliminar las gotas visibles. Secar los tubos que contiene el precipitado de ADN boca abajo sobre los tejidos limpiador de la delicada tarea de laboratorio a temperatura ambiente o en un horno de 37-60 ° C con una supervisión constante. Resuspender el precipitado inmediatamente después de etanol residual se evapore para evitar un secado excesivo de la pelotilla.
Nota: Etanol Residual interfiere con la lectura del espectrofotómetro de la concentración de ADN e Introducción al riñón no es deseable. - Resuspender el precipitado de DNA en el mismo buffer que se utilizará para la inyección (amortiguamiento hidrodinámico entrega; 100-300 μL) para limitar la variación en la composición química de la solución tampón de ADN entre los grupos.
Nota: No Resuspender el precipitado de DNA en la solución de tampón de elución que viene con el kit. El agente quelante EDTA comúnmente en preparaciones de búfer "TE" puede afectar a riñones y la función cardiovascular. Dependiendo del tamaño del pellet, procederá a la elución de 100-300 μL de tampón de hidrodinámica entrega para alcanzar una alta concentración. La concentración final de ADN diluido será entre 100 ng/μl (dosis de 10 μg/ratón) y 500 ng/μl (dosis de 50 μg/ratón) para que la concentración de ADN común debe superar esto. - Totalmente Resuspender el precipitado de DNA en solución tampón. Dejar el pellet en buffer de entrega hidrodinámico en el tubo original a temperatura ambiente durante al menos una hora o durante la noche a 4 ° C antes de transferir a un tubo de microcentrífuga estéril para asegurar que el ADN se haya disuelto completamente.
- Leer la concentración de DNA de plásmido en un espectrofotómetro o por otro método establecido.
Nota: Las lecturas deben hacerse por duplicado con repeticiones adicionales si es necesario. Si la relación 260/280 está por debajo de 1.8, la preparación está contaminada con ARN u otra sustancia tan descartarlo y prepare el ADN otra vez. - Tienda plásmido ADN resuspendió en buffer de inyección a-20 ° C dentro de una caja en un manual de descongelación congelador para evitar la degradación del ADN.
Nota: Almacenar de esta forma, la preparación de ADN tendrá una duración de muchos años. Comprobar la integridad del ADN por restricción recopilación y agarosa electroforesis del gel. ADN que es manchada por el camino se ha degradado y no se puede utilizar mientras que la DNA que produce bandas nítidas del tamaño correcto puede ser utilizado para la inyección.
- Después de completar el último paso de lavado de aislamiento de ADN, no Asegúrese que etanol es por el olor y la inspección visual. Utilizar puntas de carga de gel para eliminar las gotas visibles. Secar los tubos que contiene el precipitado de ADN boca abajo sobre los tejidos limpiador de la delicada tarea de laboratorio a temperatura ambiente o en un horno de 37-60 ° C con una supervisión constante. Resuspender el precipitado inmediatamente después de etanol residual se evapore para evitar un secado excesivo de la pelotilla.
- Preparar la solución de ADN de plásmido diluido para su inyección en la pelvis renal.
Nota: Considerar el control de grupos con cuidado. Para muchos estudios, ingenuo y buffer inyectado sólo controles están incluidos porque la inyección sí mismo causa daño y puede afectar los resultados experimentales11.- Descongelar el ADN libre de endotoxina eluido en amortiguamiento hidrodinámico entrega a temperatura ambiente en el Banco.
- Calcular la cantidad de ADN necesaria para las inyecciones y preparar el ADN diluido para cada grupo. Administrar 10-50 μg de plásmido ADN llevó a un volumen total de 100 μl con tampón entrega hidrodinámico por ratón.
Nota: Por ejemplo, los cálculos para inyectar 3 ratones con 10 μg/ratón de un plásmido de ADN que tiene una concentración de 0,5 μg/μl son como sigue.- Prepare suficiente solución de ADN para tener aproximadamente un 20% extra para cargar las jeringas y el dead space en la aguja. Para los 3 ratones, preparar una mezcla a 3.5 x. Calcular la masa de ADN en μg que deberían estar en la solución. Aquí sería 10 μg x 3.5 = 35 μg.
- Calcular el volumen total de solución para inyección 100 μl por ratón. En este caso, sería 100 μl x 3.5 = 350 volumen total μl.
- Calcular el volumen de stock plásmido ADN para añadir a la solución. En este caso, sería de 35 μg / 0,5 μg/μl = 70 μl de ADN de plásmido stock.
- Calcular el volumen de tampón para agregar a la solución diluida de ADN restando el volumen de stock ADN añadido (paso 1.3.2.3) del volumen total de ADN diluido que es deseada (paso 1.3.2.2). En este caso, sería 350 μl - 70 μl = 280 μl de tampón de hidrodinámica de la entrega.
- Preparar soluciones en tubos de microcentrífuga estéril utilizando pipetas filtros comercialmente disponibles con técnica estéril en la mesa de laboratorio.
Nota: Soluciones ADN pueden ser preparadas y almacenadas a temperatura ambiente para inyecciones a ocurrir ese día. No inyecte ratones con una solución fría, esto reducirá la temperatura del cuerpo, pero el calentamiento es innecesaria.
2. realizar la cirugía de inyección hidrodinámica la pelvis renal
- Seleccione ratones cuidadosamente para la cirugía.
Nota: Diferencias específicas de cepa aún no se han observado pero pueden ser posibles. La mayoría de las inyecciones han sido la C57BL/6 o fondos de la FVB. Pelvis renal inyecciones funcionan mejor en los ratones que son 6-12 semanas de edad. En los ratones más de 16 semanas, hasta una tasa de fracaso de 50% por luciferase proyección de imagen es posible por razones claro. La misma tasa de error relacionado con la edad se ha observado para las inyecciones de vena de hidrodinámica cola al hígado así que esto puede ser una limitación general relacionadas con el principio de inyección hidrodinámica. En la misma línea, otros han demostrado que la inyección en la vena hidrodinámica cola en hígado de rata fibrótico no es tan eficaz como el hígado sano, así que puede ser posible que en la configuración de la fibrosis renal la inyección hidrodinámica de la pelvis renal no será tan eficaz, pero Esto no ha sido probada directamente17. - Preparar ratones y jeringas de ADN para la cirugía.
- Anestesiar los ratones con ketamina y xilacina.
- Poner en la correcta equipos de protección personal requerido por las instalaciones de animales, como delantal de laboratorio desechables, mascarilla quirúrgica, guantes de nitrilo.
- Trabajando con ratones de 2-4 a la vez, pesan cada ratón en un vaso de plástico de 500 mL en una escala de precisión de 0.1 g. calcular la cantidad correcta de 24 mg/mL de ketamina y 2 mg/mL xilacina diluida en suero fisiológico de 0.9% para administrar a cada ratón por inyección intraperitoneal (ver video de referencia para más información sobre la inyección intraperitoneal) 18. utilizar la fórmula (50 μl + ((5 µL) x (peso (g))), o alternativamente calcular según otra fórmula previa consulta con el veterinario local equipo y IACUC.
- Inyectar al ratón por inyección intraperitoneal por técnicas estándar. Coloque el ratón en un cubo de papel hasta que el ratón está inmóvil.
Nota: Los ratones son preparados para la cirugía cuando ya no responden a la prueba del pellizco del dedo del pie. Dan los ratones que siguen respondiendo a la pizca del dedo del pie prueba 20-30 min después de la inyección inicial de 20-60 μL más anestésico, dependiendo de la intensidad de la respuesta. - Lugar el ratón sobre una almohadilla de calor con circulación de agua cubierto con un cojín azul y lugar veterinario ungüento en ambos ojos para evitar la desecación corneal.
- Afeitado la parte izquierda de la parte posterior del ratón del hombro a la grupa y del flanco a la columna vertebral con una máquina de afeitar diseñada para el aseo de mascotas. Eliminar los residuos y el cabello suelto.
- Preparar una jeringa separada con 100 μl del ADN diluido para cada ratón anestesiado, asegurándose de que no hay burbujas de aire.
- Utilice una jeringa de insulina estéril 29 x ½" U-100 de 0.5 mL con una aguja fija sin una seguridad.
Nota: El tipo de jeringa es de importancia crítica. Este indicador permite una inyección rápida. La aguja fija impide la solución de escaparse hacia fuera. Presencia de una seguridad impedirá el acceso a la pelvis renal. Las jeringas especificadas en la tabla de materiales se deslizan más uniformemente durante la inyección que otras marcas probadas. - Cargue la jeringa a ~ 120 μl y tire el émbolo hacia abajo para crear un espacio en la parte superior. Golpee suavemente con un lápiz hasta aire burbujas subida a la cima. Sosteniendo la aguja con cuidado Presione el émbolo para quitar todo el aire hasta que forme una gota en la punta de la aguja. No debe ser cualquier burbujas visibles presentes, ya que estos pueden causar una embolia de aire que maten al animal.
- Finalizar presionando el émbolo hasta que haya 100 μL en la jeringa por vaciar el exceso de solución de ADN en el tubo de microcentrífuga original. Cuidadosamente la etiqueta si es necesario y coloque las jeringas cargadas sobre un paño estéril para mantener la esterilidad si las instalaciones donde se realiza el trabajo no permiten el cubrimiento de agujas.
- Utilice una jeringa de insulina estéril 29 x ½" U-100 de 0.5 mL con una aguja fija sin una seguridad.
- Anestesiar los ratones con ketamina y xilacina.
- Realizar cirugía de inyección.
- Preparar el sitio para la cirugía. Coloque un paño estéril sobre la almohadilla de calor y herramientas quirúrgicas estériles vacías sobre el cobertor esterilizado sin tocarlas. Coge el ratón y colocar en el campo de visión. Ajuste la iluminación para iluminar la zona.
- Quitar tres 3.15% clorhexidina gluconato y el 70% alcohol isopropílico piel antisépticas hisopos de los paquetes y coloque cerca de los animales.
- Cambiar a guantes quirúrgicos estériles. Trabajo en un principio de movimiento circular en el sitio de la incisión, hisopo el animal con una nueva esponja de clorhexidina/alcohol tres veces.
- Localizar el sitio de la incisión como se muestra en la figura 1A. Pellizcando la piel con pinzas, utilice tijeras para hacer un corte en la piel capa de aproximadamente 1 cm de la columna vertebral y por debajo de la caja torácica. Una vez que el sitio de corte aproximadamente 1 cm de largo, hacer un sitio de corte similar a continuación, en la capa muscular.
Nota: Hacer la incisión la longitud adecuada para permitir que el riñón apenas a través de la incisión y luego conservarse en lugar de la incisión de sí mismo. Una incisión muy pequeña y el riñón no pueden ser expuestos; demasiado grande y que el riñón continuamente se deslizará hacia atrás en la cavidad abdominal. - Localizar el riñón.
Nota: Puede ser visible entre tejido adiposo blanco. El bazo también se encuentra en el lado izquierdo del animal. El color de estos órganos puede ser visualmente distinguido, como el bazo es un marrón oscuro, mientras que el riñón es una naranja rojizo oscurezca. No es conveniente manipular el bazo como puede ser fácilmente roto. - Sin tocar el riñón, suavemente exponga de la cavidad abdominal colocando presión constante y suave en el abdomen con los dedos (figura 2). Utilice unas pinzas cerradas suavemente rechazar órganos no deseados en el abdomen si es necesario. No utilice pinzas abiertas ya que podría dañar el riñón u otros órganos.
- Una vez que el riñón está fuera del abdomen, ligeramente separado de los alrededores de grasa lo suficiente como para visualizar la pelvis renal, un pequeño punto blanco (figura 1B). Empujar el exceso de grasa a un lado o eliminar si es necesario. Asegúrese de no extirpar la glándula suprarrenal, situada cerca del polo superior del riñón, o la cápsula del riñón.
- Con cerrado pinzas Presione hacia abajo a la derecha del riñón para que la pelvis renal permanece a la vista, tome la jeringa de insulina cargada con la mano derecha y sostenga paralela a la superficie de trabajo con la aguja apuntada a la pelvis renal (Figura 2E). Inserte la aguja con cuidado en la pelvis renal del riñón inmovilizado como se muestra en la figura 1B.
- Inyecte la solución rápidamente dentro de s tres. Un tercio del riñón puede borrar y cambian de color a blanco.
Nota: Es común observar la acumulación de líquido en el riñón cápsula que seguía la inyección así como la formación de un hematoma. Son necesario para alcanzar un nivel suficiente de la transfección de la DNA para la detección de algunos daños. - Mantener la aguja en el lugar para aproximadamente 10 s para evitar el reflujo de la solución. Luego lenta y cuidadosamente retire la aguja. Regresar el órgano a la cavidad abdominal suavemente estirando la zona de la incisión y utilizando cerrar pinzas.
- Sutura la capa del músculo del animal con suturas absorbibles 5-0, poniendo el 2-4 nudos independientes.
- Sutura la capa de la piel del animal con suturas de nylon no absorbible 5-0 o 6-0, colocando el 2-4 nudos independientes.
Nota: Herramientas quirúrgicas pueden ser reutilizados después de colocar en un baño de grano estéril y enfriados.
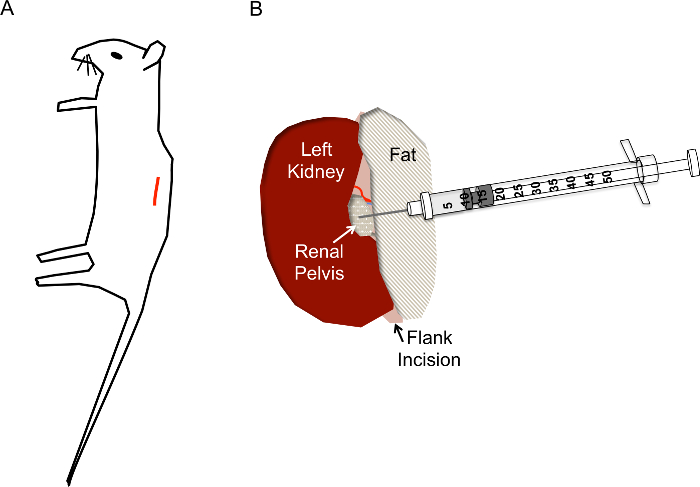
Figura 1. Colocación de sitio y aguja de incisión correcta hidrodinámica renal pelvis inyecciones. A) debe ser la incisión (línea roja) situada aproximadamente 1 cm de la columna vertebral y aproximadamente 1 cm por debajo de la caja torácica del ratón. B) después de que el riñón está expuesto a través de la incisión del flanco, la pelvis renal debe estar ubicada como una mitad de punto pequeño de claro/blanco amarillento por el riñón. La inyección no debe molestar la vena renal, arteria renal o uréter. La aguja de la jeringa de insulina se inserta directamente en la pelvis renal como se muestra a una profundidad de aproximadamente 0,5 cm y presionada rápidamente en 2-3 s. haga clic aquí para ver una versión más grande de esta figura.
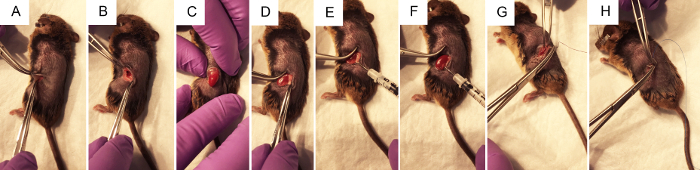
Figura 2. Los pasos quirúrgicos para realizar inyección hidrodinámica de la pelvis renal de ADN plásmido. A) fórceps de pellizcarán la piel para permitir que el cirujano realice una incisión de flanco de ~ 1 cm con un bisturí, primero a través de la capa de la piel, luego a través de la capa muscular. B) usando dos pares de pinzas cerradas para abrir la herida quirúrgica, el riñón se visualiza dentro del abdomen si es posible. C) con una ligera presión en el abdomen, sin tocar ninguna órganos directamente, se expone el riñón a través de la incisión del flanco. D) grasa suavemente se diseca del riñón, molestar lo menos posible lograr el acceso a la pelvis renal. E) presionando en el lado derecho del riñón izquierdo para mejor visualizar la pelvis renal, se celebra la jeringa con el pulgar el depresor y la aguja se coloca con cuidado pero firmemente en la pelvis renal. F) siguiente el < 3 inyección de s, claro se puede observar en las zonas del riñón que recibió la mayor parte de la inyección. G) se utilizan suturas absorbibles vicryl púrpura estéril hacer nudos independiente 2-4 en la capa muscular. H) suturas no absorbibles nylon azul estériles se usan para hacer 2-4 nudos independientes en la capa de la piel. Haga clic aquí para ver una versión más grande de esta figura.
- Recuperación de la cirugía y control postoperatorio.
- Proporcionar ratones con analgésico según requisitos de la institución IACUC para controlar el dolor. Por ejemplo, administre buprenorfina por inyección subcutánea cada 8-12 h durante 48 h postoperatorio si daño renal relacionada con AINES debe ser evitado para el estudio.
- Mantener los ratones en un calor pad y acompañados por el investigador hasta que totalmente móvil de recumbency esternal. Cuando se recuperó completamente, volver a los ratones a una jaula limpia que contiene una pequeña cantidad de ropa de cama de su jaula casera para reducir el estrés. No no casa ratones sometidos a cirugía con ratones ingenuos.
Nota: La condición de los ratones mejorará rápidamente, parecen tener un comportamiento normal dentro de las 24-48 h. - Dar líquidos salinos y analgesia creciente a los ratones que aparecen tensionados para mejorar su condición. Si los ratones no se recuperan rápidamente, medir el peso del ratón y eutanasia a los ratones que han perdido más de 20% de su peso corporal inicial. Eutanasia a ratones que aparecen urémico o de lo contrario moribundo. Problemas de salud se detallan en la tabla 1.
Nota: Los ratones a veces quitar sus suturas externas o las suturas soltarse antes de encierro de la herida. Pobre la sutura de la capa muscular con una capa de la piel intacta puede provocar una hernia en el sitio de incisión, indicado por Pando. En estos casos, coloque el ratón bajo anestesia (isoflurano es más rápido que la ketamina/xilacina) y reparar el sitio quirúrgico con suturas de nuevo tan pronto como sea posible. Si las suturas no absorbibles piel permanecen después de 10-14 días, retírelas. En ocasiones ratones pueden quitar las suturas de sus compañeros de jaula o luchar. Eliminar ratones del agresor en su propia jaula con enriquecimiento para evitar lastimar a los otros ratones tan pronto como se identifica este tipo de comportamiento. - Cuando salud o experimentales extremos son alcanzados, los ratones por inhalación de dióxido de carbono o por sobredosis de isoflurano, seguido por un método secundario de la eutanasia como la dislocación cervical según el procedimiento operativo estándar para eutanasia en eutanasia lugar en la institución
| Causa | Inicio | Número de ratones afectados | Síntomas | Acción inmediata | Solución a largo plazo | ||
| Endotoxinas de ADN contenida | después de la inyección 6-40 h. | Que puedan afectar a cada ratón dado la preparación de ADN contaminada. | Problemas respiratorios, signos de dolor severo, insuficiencia de órganos, muerte. | Eutanasia a los ratones afectados. Probar cada componente inyectado para endotoxinas con lisado de amebocitos de Limulus. | Use kits maxiprep libre de endotoxinas y material de laboratorio sólo estéril y nuevo o tratados con NaOH. Use un buffer comercialmente comprado, prueba de endotoxina para diluir el ADN. | ||
| Sobredosis de anestesia | Durante la cirugía, ya sea antes o después de la inyección de ADN. | Puede afectar solamente los ratones más jóvenes, más pequeños o más delgados. | Cesar la respiración en la almohada, al orinar. | Disminución de la anestesia para los ratones restantes. | Comprobar la preparación y el protocolo de precisión de dosis. Excluir "parones". Consultar a veterinario si se usó la dosis apropiada. | ||
| Burbuja de aire en la jeringa o aguja utilizada para la inyección | Inmediatamente después de la inyección de la pelvis renal. | A menos que todas las jeringas fueron cargadas con cuidado, esto sólo afecta a un ratón. | Jadear para la respiración. | Compruebe las jeringas restantes signos de burbujas de aire. | Preparar las jeringuillas con cuidado, golpear ligeramente la jeringa para eliminar burbujas en la parte inferior. Mejorar las condiciones de iluminación para visualizar mejor las burbujas. | ||
| Apertura de sitio quirúrgico | después de la inyección 12-72 h | Uno o más ratones. A veces la jaula entera. | Herida abierta, generalmente ninguna otra señal de socorro | Repita la sutura para reparar la herida cuidadosamente bajo anestesia isoflurano con técnica estéril. Puede necesitar irrigar con solución salina o quitar bordes de herida con unas tijeras. | Si todos los ratones tienen suturas muy corta o falta, puede ser un ratón sacarlos, así que los ratones pueden ser separados. Mejorar la técnica de sutura. Utilice nudos independientes. | ||
| Hernia en el sitio quirúrgico | + 48 h después de la inyección | Uno o más ratones. | Montículo es visible en el sitio quirúrgico. | Bajo anestesia isoflurano con técnica estéril, cortar la piel curada para revelar la hernia de la capa muscular. Vuelva a colocar los órganos en el peritoneo, capa muscular con suturas absorbibles de reparación y cerrar el sitio. | Esto indica mala sutura de capa muscular. Mejorar la técnica de sutura. Utilice nudos independientes. | ||
| Insuficiencia renal | + 48 h después de la inyección | Uno o más ratones. | Pérdida de peso > 20%, posiblemente, convertirse en urémico, encorvada postura | Proporcionar una solución salina y aumentar o prolongar la analgesia. Si se constata ninguna mejoría, sacrificar a los ratones afectados. | Alterar el estado de enfermedad del animal para que sea menos severa. Alterar el transgén para ser menos fuerte o inducible. Inyectar a ratones en un punto anterior en la progresión de la enfermedad. | ||
| Absceso o infección | Días a semanas después de la cirugía | Uno o más ratones. | Absceso palpable o signos de sepsis | Eutanasia a los ratones afectados. Solicitud de autopsia para confirmar la sospecha de infección. | Esto puede ocurrir cuando las condiciones quirúrgicas y las inyecciones no son suficientemente estériles. El procedimiento que se muestra es para ratones con un sistema inmunitario normal pero además deben tomar precauciones en el ajuste de animales inmunocomprometidos, como aquellos tratados con ciclofosfamida. | ||
Tabla 1. Tabla de posibles problemas de salud encontrados durante el protocolo de inyección de la pelvis renal. Aunque no son comunes los problemas de salud mencionados, existen una serie de errores relacionados con el investigador que pueden ocurrir durante el curso del procedimiento. Esta tabla puede ser de ayuda en la prevención y el diagnóstico de los problemas de salud, así como para la aplicación de remedios potenciales para impedir este tipo de problemas en el futuro. Con la práctica, los investigadores deben esperar problemas de salud poco frecuentes y la mortalidad por el procedimiento.
3. evaluar efectos de eficiencia y transgén de inyección
- Utilice un análisis bien desarrollado para el transgen deseado para evaluar la eficiencia de transfección. Utilizar controles positivos y negativos con cuidado para asegurarse de que el ensayo es específico.
Nota: Dependiendo de la elección del promotor, ratones probablemente tendrá la más fuerte expresión del transgén en 1 día; siempre dentro de la primera semana después de la inyección. - Realizar proyección de imagen de animal vivo de luciferase introduciendo 10 μg de plásmido de expresión de luciferasa como luciferasa de luciérnaga mejorada del ADN diluido para la inyección.
- Limpie todas las superficies expuestas a los ratones. Lugar la primera jaula de ratones en la cámara y el sello que cierre. Asegúrese de hay suficiente isoflurano para el experimento controlando el gage; Si no, añadir isoflurano hasta que el nivel llegue a la línea "max". Iniciar el flujo de isoflurano girando el dial de isoflurano a 3,5 y el oxígeno a 2.
- Inyectar cada ratón por inyección intraperitoneal con 100 μl de luciferin descongeladas 30 mg/mL. Registrar el tiempo.
- Abra el software para controlar la máquina de proyección de imagen haciendo clic en el icono del ratón naranja y amarillo. En "Select/Add User ID," elija las iniciales correcto en el menú desplegable junto a "Seudónimo" Haga clic en "Aceptar". En la barra de menú superior, haga clic en "Adquisición" y seleccione "Autoguardar para..." en el menú desplegable. Seleccione la carpeta o crear una nueva carpeta para guardar los datos.
- Ir a la caja de adquisición de imagen en la esquina inferior derecha. Compruebe que la configuración automática es los siguientes: Binning, medio; F/Stop, 1 para 8 luminiscente, fotografía; Filtro de emisión, abierto; Modo de imagen, controles luminiscente, fotografía, superposición y alineación sólo. Haga clic en "iniciar" para inicializar el sistema y esperar para que la inicialización hasta el final, luego cambiar el "campo de visión" a "E" imagen de cinco ratones.
- Gire la válvula para el tubo de anestesia que los nosecones dentro de la máquina estén administrando isoflurano. Coloque los animales dentro de la máquina de proyección de imagen en el orden deseado en sus estómagos con la espalda hacia la cámara anterior para visualizar el riñón. Si más de una jaula debe ser reflejada, coloque la jaula próxima en la cámara de isoflurano.
- 5-10 min después de la inyección de luciferin, presione "Adquirir" a la imagen.
- En la "paleta" en el lado derecho, haga clic en "Ajustar imagen." En "Escala de Color," disminuir la barra de "Min" hasta que expresión es evidente en todos los ratones que, visualizados como púrpura sobre cada riñón de ratón. Si cualquier ratones no muestran expresión, reinyectar los ratones con 100 μl de luciferin y esperar al menos 3 minutos antes de readquirir.
- Si la imagen satura pixeles, disminuir el tiempo de exposición y adquirir para obtener una imagen cuantitativa ya que la presencia de píxeles saturados en subestimar la eficacia de transfección. El tiempo de exposición posible más baja es de 0,5 s.
- Si la imagen muestra débiles genes en el primer tiempo de exposición, aumentar el tiempo de exposición hasta 2 min y a adquirir. Cada vez que es retomada la imagen, los datos son restaura en la carpeta seleccionada para que todas las imágenes están disponibles para su posterior análisis más adelante.
- Repita los pasos de imágenes para posterior jaulas de ratones.
- Eliminar los ratones de la máquina de proyección de imagen. Cierre el gas. Limpie la cámara nosecones y etapa de proyección de imagen. Cierre el programa de computadora.
Nota: El software le preguntará para "Salvar el conjunto de datos". Esto se refiere a las manipulaciones para el conjunto de datos, no los datos sí mismo.- Haga clic en "Sí" para guardar los cambios a la escala y las regiones de interés (ROIs). Haga clic en "No" para volver a la configuración original de las imágenes.
- Para el análisis de datos, abra el software. En la "paleta de herramientas" haga clic en "Herramientas de ROI". Haga clic en el icono de círculo y haga clic en "1" en el menú desplegable para colocar un nuevo retorno de la inversión en la ventana de la imagen como se indica por un óvalo rojo con cuatro cuadrados alrededor de él. Ajustar el tamaño del ROI colocando el cursor del ratón sobre un cuadrado rojo y arrastrando para cercar el área púrpura superponer el riñón inyectado.
- Con el cursor sobre un cuadrado rojo en el retorno de la inversión, con el botón derecho y seleccione "Duplicar ROI" para crear un nuevo retorno de la inversión en la ventana de la imagen y mueva el ratón próximo. Repita el procedimiento hasta que todos los ratones en la imagen tienen un ROI sobre el riñón inyectado.
- En el menú directamente sobre la imagen, cambiar "Unidades" de "Cuenta" "Radiante (fotones)." Para exportar los datos de retorno de la inversión, en la "paleta", "Herramientas de ROI" haga clic en el icono de lápiz/regla para crear una hoja de cálculo de las mediciones. Use la medición "Avg Radiance" en análisis adicional en el programa de estadísticas y análisis de datos de elección.
- Realizar tinción de secciones como se describe11.
Nota: La inyección no transfectar el riñón entero igualmente para que diferentes secciones capturará de eficacias de transfección diferentes11. Coinyección de granos tales como fluorescente látex microesferas pueden ayudar a identificar las regiones espera transgen-positivos (figura 3D)11. Optimización del Protocolo de tinción es muy importante. - Realizar el Western blot para identificar el gen de interés en el riñón transfected.
Nota: Cosecha de órganos para los extractos de proteína debe realizarse en hielo. Otra vez, no use una rebanada pequeña del órgano ya que esta área puede no haber sido transfectado bien. Transfección se distribuye de forma desigual en todo el órgano así que combinar diferentes áreas y de la piscina les. Pelvis renal inyección hidrodinámica de un plásmido produce la hormona eritropoyetina produjo un modesto aumento en el hematocrito, por lo que se espera que transgén secretado productos deben encontrarse en la circulación11. - Para la expresión de alto nivel a largo plazo de los transgenes, combinan un sistema de vectores de integración con agentes inmunosupresores como la ciclofosfamida. La respuesta inmune al transgén ocurre durante la primera varias semanas después de la inyección y es robusto11.
Resultados
La técnica de la cirugía y la inyección son sencillas para llevar a cabo una vez dominado, que no requiere equipos o materiales costosos. Si a la cirugía de incisión flanco renal, se debe un día de entrenamiento en varios ratones programados para eutanasia en que los ratones no son recuperados después de la cirugía porque el primer intento de esta cirugía puede tomar mucho más tiempo de lo normal. Alternativamente, los investigadores familiarizados con las técnicas similares pu...
Discusión
En este protocolo se describe un método robusto para alcanzar expresión génica reproducible específicamente en el riñón. En manos de un cirujano experimentado moderado encontramos el porcentaje de ratones transfectadas por esta técnica en el rango de 50-100%, dependiendo de la edad del ratón y la sensibilidad de la lectura del transgén. El nivel de expresión del gen de luciferasa fue sobre el fondo durante varios meses en ratones recibiendo transposones piggyBac y totalmente mantenida durante varias se...
Divulgaciones
Los autores no tienen nada que revelar y no declarar ningún conflicto de interés.
Agradecimientos
Un premio de desarrollo de carrera del Departamento de Asuntos Veteranos [BX002797] apoyó L.E.W. y los institutos nacionales de salud [R01-DK095867] y Asociación Americana del corazón [15GRNT25700209] apoyado J.C. Los institutos nacionales de salud [DK093660], Departamento de asuntos de veteranos [BX002190] y el centro de Vanderbilt para enfermedad renal compatible M.H.W. Este material es el resultado del trabajo apoyado con recursos y uso de instalaciones en el sistema de Healthcare del Valle de Tennessee de VA.
Materiales
| Name | Company | Catalog Number | Comments |
| AnaSed Xylazine | Patterson Veterinary | 07-808-1947 | Anesthetic - Not controlled substance |
| BD Insulin Syringe 0.5 mL 29G 1/2 Inch | Cardinal Health | 309306 | Required syringes |
| Buprenex | Pharmacist/Veterinarian | Analgesia - Controlled Substance | |
| Dynarex Disposable Towel Drape | Thermo Fisher Scientific | 19-310-671 | Place over heat pad |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | Use only endotoxin-free plasmid DNA |
| Endosafe Gel-Clot LAL Rapid Positive Control | Charles River | PC200 | Positive control for endotoxin test |
| Endosafe Gel-Clot LAL Rapid Single Test Vial | Charles River | R13500 | Endotoxin test |
| Extra Fine Micro Dissecting Scissors | Roboz Surgical Instrument | RS-5882 | Surgical tool |
| Fisherbrand Instant Sealing Sterilization Pouch - 9" | Thermo Fisher Scientific | 01-812-51 | For autoclaving surgical tools |
| Gaymar Heat Pump | Paragon Medical | TP-700 | Water-circulating heat pump |
| Germinator 500 | Roboz Surgical Instrument | DS-401 | To reuse surgical tools during surgery |
| Graefe Forceps | Roboz Surgical Instrument | RS-5136 | Surgical tool |
| Graefe Tissue Forceps | Roboz Surgical Instrument | RS-5153 | Surgical tool |
| Halsey Needle Holder, 5" Length | Roboz Surgical Instrument | RS-7841 | Surgical tool |
| Heat pads - 15" x 21" - need at least 3 | Paragon Medical | TP22G | For use with Gaymar Heat Pump |
| IsoFlo (Isoflurane, USP) | Abbott Animal Health | 5260-04-05 | For imaging and euthanasia |
| Isotec Isoflurane Delivery System Vaporizor | Smiths Medical | VCT3K2 | For imaging and euthanasia |
| Ketamine | Pharmacist/Veterinarian | Anesthetic - Controlled Substance | |
| Kimwipes | Kimberly-Clark Professional | 34120 | Laboratory tissues |
| Living Image software | Caliper Life Sciences | For live animal imaging | |
| Luciferin | Perkin Elmer | 122796 | For live animal imaging |
| Nanodrop 2000 | Thermo Scientific | ND-2000-US-CAN | Spectrophotometer for DNA measurement |
| Prevantics Swabs | Thermo Fisher Scientific | 23-100-110 | For skin surgery prep |
| Prolene 5-0 sutures Taper 30" | Thermo Fisher Scientific | NC0256891 | Non-absorbable sutures for skin |
| Puralube Brand Opthalmic Ointment | Patterson Veterinary | 07-888-2572 | To keep eyes moist during surgery |
| Trans IT - QR Hydrodynamic Delivery Solution | Mirus Bio | MIR-5240 | Hydrodynamic delivery buffer for diluting DNA |
| Vicryl 5-0 Sutures J303H | Thermo Fisher Scientific | NC9816710 | Absorbable sutures for muscle layer |
| Wahl Mini Arco Clipper | Med-Vet International | 8787-1550 | Shaver for skin prep |
| Xenogen IVIS 200 | Caliper Life Sciences | For live animal imaging |
Referencias
- Liu, F., Song, Y., Liu, D. Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA. Gene Ther. 6 (7), 1258-1266 (1999).
- Zhang, G., Budker, V., Wolff, J. A. High levels of foreign gene expression in hepatocytes after tail vein injections of naked plasmid DNA. Human Gene Therapy. 10, 1735-1737 (1999).
- Fumoto, S., Nishimura, K., Nishida, K., Kawakami, S. Three-Dimensional Imaging of the Intracellular Fate of Plasmid DNA and Transgene Expression: ZsGreen1 and Tissue Clearing Method CUBIC Are an Optimal Combination for Multicolor Deep Imaging in Murine Tissues. PLoS One. 11 (1), e0148233 (2016).
- Yoshino, H., Hashizume, K., Kobayashi, E. Naked plasmid DNA transfer to the porcine liver using rapid injection with large volume. Gene Ther. 13 (24), 1696-1702 (2006).
- Kamimura, K., Suda, T., Xu, W., Zhang, G., Liu, D. Image-guided, lobe-specific hydrodynamic gene delivery to swine liver. Mol Ther. 17 (3), 491-499 (2009).
- Kamimura, K., Zhang, G., Liu, D. Image-guided,intravascular hydrodynamic gene delivery to skeletal muscle in pigs. Mol Ther. 18 (1), 93-100 (2010).
- Suda, T., Liu, D. Hydrodynamic gene delivery: its principles and applications. Mol.Ther. 15 (12), 2063-2069 (2007).
- Alino, S. F., et al. Naked DNA delivery to whole pig cardiac tissue by coronary sinus retrograde injection employing non-invasive catheterization. J Gene Med. 12 (11), 920-926 (2010).
- Suda, T., Gao, X., Stolz, D. B., Liu, D. Structural impact of hydrodynamic injection on mouse liver. Gene Ther. 14 (2), 129-137 (2007).
- Skrypnyk, N. I., Harris, R. C., de Caestecker, M. P. Ischemia-reperfusion model of acute kidney injury and post injury fibrosis in mice. J Vis Exp. (78), (2013).
- Woodard, L. E., et al. Kidney-specific transposon-mediated gene transfer in vivo. Sci Rep. 7, 44904 (2017).
- Liang, A., et al. Loss of glutathione S-transferase A4 accelerates obstruction-induced tubule damage and renal fibrosis. Journal of Pathology. 228 (4), 448-458 (2012).
- Liang, M., et al. Protective role of insulin-like growth factor-1 receptor in endothelial cells against unilateral ureteral obstruction-induced renal fibrosis. Am J Pathol. 185 (5), 1234-1250 (2015).
- Corridon, P. R., et al. A method to facilitate and monitor expression of exogenous genes in the rat kidney using plasmid and viral vectors. Am J Physiol Renal Physiol. 304 (9), F1217-F1229 (2013).
- Wallace, D. P., et al. Tracking kidney volume in mice with polycystic kidney disease by magnetic resonance imaging. Kidney Int. 73 (6), 778-781 (2008).
- Woodard, L. E., Wilson, M. H. piggyBac-ing models and new therapeutic strategies. Trends Biotechnol. 33 (9), 525-533 (2015).
- Yeikilis, R., et al. Hydrodynamics based transfection in normal and fibrotic rats. World J Gastroenterol. 12 (38), 6149-6155 (2006).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. (41), (2010).
- Wooddell, C. I., et al. Muscle damage after delivery of naked plasmid DNA into skeletal muscles is batch dependent. Hum Gene Ther. 22 (2), 225-235 (2011).
- Crespo, A., et al. Hydrodynamic liver gene transfer mechanism involves transient sinusoidal blood stasis and massive hepatocyte endocytic vesicles. Gene Ther. 12 (11), 927-935 (2005).
- Rocca, C. J., Ur, S. N., Harrison, F., Cherqui, S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Ther. 21 (6), 618-628 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados