Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Hydrodynamische Nierenbecken Injektion für nicht-virale Expression von Proteinen in der Niere
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine Methode zum Injizieren von Plasmid DNA in der Mausniere über das Nierenbecken, Transgene Ausdruck speziell in der Niere zu produzieren.
Zusammenfassung
Hydrodynamische Injektion schafft eine lokale, Hochdruck-Umfeld, um verschiedenen Geweben mit Plasmid-DNA und anderen Substanzen zu transfizieren. Hydrodynamische Schweif Vene Injektion, ist zum Beispiel eine etablierte Methode, die durch die Leber transfiziert werden kann. Dieses Manuskript beschreibt eine Anwendung der hydrodynamischen Prinzipien durch Injektion von der Mausniere direkt mit Plasmid DNA für Nieren-spezifische Genexpression. Mäuse werden betäubt und die Niere durch eine Flanke Inzision, gefolgt von einer schnellen Injektion ein Plasmid DNA-haltigen Lösung direkt in das Nierenbecken ausgesetzt ist. Die Nadel ist für zehn Sekunden gehalten und Ortsbild Einschnitt vernäht. Am nächsten Tag live Animal Imaging, Western-Blot oder Immunohistochemistry, Genexpression assay verwendet werden oder anderen Assays geeignet, um das Transgen Wahl dienen zur Erkennung des Proteins des Interesses. Veröffentlichten Methoden der Genexpression zu verlängern zählen Transposon-vermittelten Transgen Integration und Cyclophosphamid behandelt, um die Immunantwort auf das Transgen hemmen.
Einleitung
Die hydrodynamischen Schweif Vene Injektionstechnik ist eine häufig verwendete Möglichkeit, hohe Genexpression in Maus Leber1,2geworden. Die Nieren sind auch durch diese Technik auf einem viel niedrigeren Niveau, etwa 100-fold weniger3transfiziert. Die hydrodynamischen Nierenbecken-Injektion, die hier beschriebenen bietet eine einfache Möglichkeit zu steuern, die Besonderheit der Orgel Ausdruck durch physische Mittel nach den gleichen hydrodynamischen Grundsätzen, die zuvor in Leber,4,5 festgelegt wurden , Muskel-6und andere Organe7,8. Diese Methode transfects Zellen in lebenden Tieren in Vivo durch Druck und Geschwindigkeit zwingen Flüssigkeit enthaltende DNA in die Zellen gleichzeitig induzieren Schäden an das Organ, das schnell gelöst9. Mit etablierten Operationstechniken, um die Niere über eine Flanke Schnitt10 zusammen mit einer einzigen Injektion von Insulin Spritze zu visualisieren, haben wir erfolgreiche Transfektion von verschiedenen Arten von Nierenzellen, vor allem interstitielle Fibroblasten gefunden, Tubuli und sammeln Kanal11. Sezieren von diesen Mäusen haben gezeigt, dass andere Organe nicht auf Ebenen hoch genug, um durch Luciferase bildgebende Techniken11visualisieren transfiziert sind. Da die Technik nicht-viralen ist, gestattet die Verwendung von Plasmid DNA zur Transfektion schnelle und einfache Zubereitung der Reagenzien zur Injektion erforderlich.
Wir haben lokalisierte hydrodynamische Injektionen verwendet, um auszudrücken das Antioxidans Glutathion S-Transferase A4, der Insulin-ähnliche Wachstumsfaktor-1 Rezeptor und das Hormon Erythropoietin in der Niere, alle mit der erwarteten biologischen Wirkungen11, 12 , 13. detaillierte Auswertung der Route der Verwaltung, Einspritzmenge, DNA-Dosierung und Projektträger Wahl wurde durchgeführt11. Darüber hinaus sowohl die PiggyBac Transposon System- und/oder Cyclophosphamid Behandlung unterdrücken die Immunreaktion auf das Transgen haben gezeigt, dass langfristige gen Ausdruck Ergebnisse11zu verbessern. Andere Forscher haben einen renale Vene Ansatz in der Ratte mit Erfolg, eine hohe Transfektion Effizienz für Zeiträume von mehr als einem Monat14verwendet. Genetische Korrektur der Phänotypen imitiert menschlichen Krankheiten werden jedoch in der Regel durchgeführt bei Mäusen zuerst als ein Proof-of-Concept da am meisten Säugetieren genetische Modelle Mausmodellen. Wir renal Vene Injektion zu Nierenbecken Injektion verglichen und festgestellt, dass die Injektion in das Nierenbecken, die renal Vene für die Genexpression (etwa um das zehnfache höher) und überleben11überlegen war. Das Nierenbecken ist eine ideale Route für die Einreise in die Niere, weil es flexibel genug, um Schwankungen in der Urinproduktion zu tolerieren ist und ist oft in der Lage, seine strukturelle Integrität auch wenn während Hydronephrose geweitet. Injektion in das Nierenbecken erlaubt darüber hinaus Zugriff auf die Niere ohne piercing die Niere Kapsel, so dass die eingespritzte Flüssigkeit sichtbar durch die Nieren besser als Intraparenchymal Injektion erhalten bleiben soll. Andere Maus Organe haben keine Route Eintrag nicht das Gefäßsystem, aber der Harn Raum der Niere ist eine ideale Injektionsstelle. Darüber hinaus führte in der renalen Vene Austritt von Blut in die Bauchhöhle. Das gesamte Niere Volumen der Wildtyp Maus Nieren ist geschätzt worden, durch Magnetresonanz-Bildgebung zu ca. 0,2 cm3, so ist das Volumen einer einzelnen Niere annähernd gleich die Menge der Flüssigkeit injiziert durch hydrodynamische Nierenbecken Injektion (100 µL)15. Hier haben wir all die detaillierten Nuancen des hydrodynamischen Nierenbecken Injektion Protokolls, reproduzierbare Transfektion der Niere zu erreichen zur Verfügung.
Protokoll
Alle hier beschriebene Methoden wurden von den institutionellen Animal Care und Nutzung Ausschüsse (IACUCs) des Baylor College of Medicine und Vanderbilt University Medical Center genehmigt.
1. bereiten Sie die DNA-Lösung zur Injektion
- Wählen Sie die Plasmid(s) der transgene sorgfältig, um zu maximieren die wünschenswerten Eigenschaften zur Verbesserung der Effizienz der Transfektion und Transgene Ausdruck zum Ausdruck bringen.
Hinweis: Hydrodynamische Nierenbecken Injektion von Plasmiden, die fluoreszierenden Marker TdTomato, das Hormon Erythropoietin (Epo) und Firefly Luciferase auszudrücken wurden zuvor beschriebenen11. Wenn nicht gibt es eine gut entwickelte Test zur Transfektion Effizienz für das Transgen, führen Sie live Animal Imaging der Luciferase durch die Einführung von 10 µg Luciferase exprimierenden Plasmids wie verbesserte Firefly Luciferase an die verdünnte DNA für die Injektion.- Wählen Sie das kleinste Plasmid, das praktisch zur Anwendung.
Hinweis: Kleine Plasmide transfizieren im Allgemeinen Zellen besser als große Plasmide. Beispielsweise sind die Zeomycin-Resistenz-Gen und R6K Herkunft der Replikation klein, so nutzt diese Elemente in das Plasmid Rückgrat Plasmid verkleinern wird. - Drücken Sie das Transgen von Säugetieren Förderer.
Hinweis: Die Niere Zelltyp transfiziert, Länge der Genexpression und Stärke der Genexpression wird alle durch die Projektträger Wahl betroffen sein. Sehen Sie Woodard Et Al. für einen Vergleich von Cytomegalovirus (CMV; konstitutive virale), Dehnung Faktor-1 Alpha (EF-1α; konstitutive endogenen), Gamma-Glutamyl-Transferase (γGT, Röhrchen-spezifische) und Podocin (NPHS2; hemolytic-spezifischen)11. - Ein nicht-viralen Integration System wie Transposons zu beschäftigen, wenn höhere langfristige gen Ausdruck wünschenswert11,16sind. Für Studien mit weniger als 5 Tage nach der Injektion frühen anzeigen ist die Integration des Transgens unnötig.
- Wählen Sie das kleinste Plasmid, das praktisch zur Anwendung.
- Bereiten Sie Plasmid-DNA für die Injektion mit einer kommerziellen Methode wie z. B. ein Endotoxin-freie Maxiprep-Kit. Sorgfältig zu vermeiden, Einführung von Endotoxinen über Labware.
Hinweis: Anwesenheit von Endotoxinen in die DNA-Lösung wird eine starke Immunantwort im Thema Tier, entlocken, das Experiment zu beeinträchtigen und möglicherweise das Tier zu töten.- Nach dem letzten Waschschritt DNA-Isolierung abgeschlossen ist, stellen Sie sicher, dass kein Ethanol durch Sichtprüfung und Geruch übrig bleibt. Verwenden Sie Gel-Loading Tipps um zu sichtbare Tropfen zu entfernen. Trocknen Sie die Röhrchen mit den DNA-Pellet kopfüber auf Labor heikle Aufgabe Wischer Gewebe bei Raumtemperatur oder in einem 37-60 ° C Ofen mit ständige Überwachung. Aufzuwirbeln Sie das Pellet, unmittelbar nach restlichen Ethanol verdampft ist, um zu verhindern, dass die Pellets Übertrocknetes.
Hinweis: Passives Ethanol stört das Spektralphotometer Lesen der DNA-Konzentration und Einführung in die Niere ist nicht wünschenswert. - Aufschwemmen Sie das DNA-Pellet in den gleichen Puffer als Injektionslösung (hydrodynamische Lieferung Puffer; 100-300 µL), Variation der chemischen Zusammensetzung der DNA-Pufferlösung zwischen Gruppen zu begrenzen verwendet wird.
Hinweis: Aufschwemmen Sie das DNA-Pellet nicht in der Elution Pufferlösung, die mit dem Kit kommt. Chelatbildner EDTA üblicherweise in "TE" Puffer Vorbereitungen kann Nieren- und Herz-Kreislauf-Funktion beeinträchtigen. Je nach Größe der Pellets eluieren Sie in 100-300 µL Puffer hydrodynamischen Lieferung, eine hohe Konzentration zu erreichen. Die Endkonzentration der verwässerten DNA werden zwischen 100 ng/µL (10 µg/Maus Dosis) und 500 ng/µL (50 µg/Maus Dosis) so dass die Lager DNA-Konzentration das überschreiten sollte. - Aufschwemmen Sie voll das DNA-Pellet im Puffer. Lassen Sie das Pellet in hydrodynamischen Lieferung Puffer in der ursprünglichen Röhre bei Raumtemperatur für mindestens eine Stunde oder über Nacht bei 4 ° C vor der Übertragung auf eine sterile Microfuge Röhre um sicherzustellen, dass die DNA vollständig gelöst ist.
- Lesen Sie die Plasmid-DNA-Konzentration auf ein Spektralphotometer oder durch eine weitere etablierte Methode.
Hinweis: Lesungen sollte in zweifacher Ausfertigung mit zusätzlichen Wiederholungen bei Bedarf durchgeführt werden. Wenn das 260/280 Verhältnis unter 1,8 liegt, die Vorbereitung ist verseucht mit RNA oder eine andere Substanz so entsorgen Sie sie und bereiten Sie die DNA erneut. - Shop-Plasmid DNA Nukleinsäuretablette in Injektion Puffer bei-20 ° C in einem Karton in einem Handbuch Abtauung Gefrierschrank, um Abbau der DNA zu vermeiden.
Hinweis: Diese Weise gespeichert, wird die DNA-Vorbereitung für viele Jahre dauern. Überprüfen Sie die Integrität der DNA durch Einschränkung Digest und Agarose-Gelelektrophorese. DNA, die durch die Gasse verschmiert hat abgebaut und kann nicht verwendet werden, während DNA, die knackige Bands der richtigen Größe produziert für die Injektion verwendet werden kann.
- Nach dem letzten Waschschritt DNA-Isolierung abgeschlossen ist, stellen Sie sicher, dass kein Ethanol durch Sichtprüfung und Geruch übrig bleibt. Verwenden Sie Gel-Loading Tipps um zu sichtbare Tropfen zu entfernen. Trocknen Sie die Röhrchen mit den DNA-Pellet kopfüber auf Labor heikle Aufgabe Wischer Gewebe bei Raumtemperatur oder in einem 37-60 ° C Ofen mit ständige Überwachung. Aufzuwirbeln Sie das Pellet, unmittelbar nach restlichen Ethanol verdampft ist, um zu verhindern, dass die Pellets Übertrocknetes.
- Bereiten Sie die verdünnte Plasmid-DNA-Lösung für die Injektion in das Nierenbecken.
Bitte beachten Kontrolle Gruppen sorgfältig. Für viele Studien sind naiv und Puffer nur injiziert Steuerelemente enthalten, weil die Injektion selbst führt zu Schäden und die experimentellen Ergebnisse11 beeinträchtigen.- Tauen Sie die Endotoxin-freie DNA eluiert in hydrodynamischen Lieferung Puffer bei Raumtemperatur auf der Bank.
- Berechnen Sie die Menge der DNA für die Injektionen nötig und bereiten Sie die verdünnte DNA für jede Gruppe. 10-50 µg von Plasmid DNA brachte ein Gesamtvolumen von 100 µL mit Puffer hydrodynamischen Lieferung per Mausklick zu verwalten.
Hinweis: Ein Beispiel sind die Berechnungen, 3 Mäuse mit 10 µg/Maus von einem Plasmid DNA zu injizieren, die eine Konzentration von 0,5 µg/µL hat wie folgt.- Bereiten Sie genügend DNA-Lösung um etwa 20 % extra für Laden der Spritzen und Totraum in der Nadel haben. Für 3 Mäuse, bereiten eine Mischung zu 3.5 X. Berechnen Sie die Masse der DNA in µg, die in der Lösung sein sollte. Hier wäre es 10 µg x 3,5 = 35 µg.
- Berechnen Sie das Gesamtvolumen der Lösung zur Injektion 100 µL pro Maus gewünscht. In diesem Fall wäre es 100 µL x 3,5 = 350 µL Gesamtvolumen.
- Berechnen Sie das Volumen der Lager Plasmid DNA der Projektmappe hinzu. In diesem Fall wäre es 35 µg / 0,5 µg/µL = 70 µL Lager Plasmid DNA.
- Berechnen Sie das Volumen des Puffers, die verdünnte Lösung der DNA durch Subtraktion der Lagervolumen DNA hinzugefügt (Schritt 1.3.2.3.) aus das Gesamtvolumen der verdünnten DNA, die gewünschte (Schritt 1.3.2.2) ist hinzuzufügen. In diesem Fall wäre es 350 µL - 70 µL = 280 µL hydrodynamischen Lieferung Puffer.
- Bereiten Sie Lösungen in sterilen Microfuge Röhren mit handelsüblichen Filter Pipettenspitzen mit steriler Technik auf dem Labortisch.
Hinweis: DNA-Lösungen können vorbereitet und gespeichert bei Raumtemperatur für Injektionen an diesem Tag statt. Injizieren Sie Mäuse nicht mit einer kalten Lösung, wie dies wird ihre Körpertemperatur senken, aber Erwärmung nicht erforderlich ist.
2. führen Sie die hydrodynamischen Nierenbecken Injektion Chirurgie
- Mäuse für Operation sorgfältig auswählen.
Hinweis: Stamm-spezifische Unterschiede noch nicht beobachtet worden aber eventuell möglich. Die meisten Injektionen wurden auf dem C57BL/6 oder FVB Hintergründe. Nierenbecken Injektionen funktionieren am besten bei Mäusen, die 6-12 Wochen alt sind. Bei Mäusen, die größer als 16 Wochen kann bis zu einer 50 % Ausfallrate von Luciferase Bildgebung aus unklaren Gründen. Die gleichen altersbedingten Ausfallrate ist für hydrodynamische Schweif Vene Injektionen in die Leber beobachtet worden, so kann dies eine allgemeine Einschränkung in Bezug auf das Prinzip der hydrodynamischen Injektion. In die gleiche Richtung, andere haben gezeigt, dass hydrodynamische Schweif Vene Injektion fibrotische Ratte-Leber nicht so effektiv wie gesunde Leber, so kann es möglich sein, die in den Einstellungen der renalen Fibrose der Nierenbecken hydrodynamische Injektion nicht so effektiv, können aber Dies wurde nicht getestet direkt17. - Mäuse und DNA-Spritzen für die Operation vorbereiten.
- Die Mäuse mit Ketamin und Xylazin zu betäuben.
- Setzen Sie auf die korrekte persönliche Schutzausrüstung erforderlich durch die Tierhaltung, wie Einweg-Laborkittel, chirurgische Maske und Nitril-Handschuhe.
- Mit 2-4 Mäuse gleichzeitig arbeiten, wiegen jeder Maus in einen 500 mL Kunststoffbecher auf einer Skala, die genau auf 0,1 g. berechnen die richtige Menge an 24 mg/mL Ketamin und 2 mg/mL Xylazin in normalen 0,9 % Kochsalzlösung, um jedem Mausklick verwalten durch intraperitoneale Injektion verdünnt (siehe referenzierten Video mehr über intraperitoneale Injektion) 18. verwenden Sie die Formel (50 µL + ((5 µL) x (Gewicht (g))), oder alternativ nach einer anderen Formel berechnen, nach Rücksprache mit dem örtlichen Tierarzt Team und IACUC.
- Injizieren Sie die Maus durch intraperitoneale Injektion mittels standardisierter Techniken. Platzieren Sie den Mauszeiger in einem Papier-Eimer, bis die Maus unbeweglich ist.
Hinweis: Mäuse sind bereit für die Operation, wenn sie nicht mehr auf die Zehe-Prise Probe reagieren. Geben Sie Mäuse, die weiterhin auf die Zehe-Prise testen 20-30 min nach der ersten Injektion 20-60 µL mehr Narkose, abhängig von der Stärke der Reaktion. - Ort der Maus auf eine Wasser-Umlauf Wärmekissen bedeckt mit blauem Pad und Ort Tierarzt Salbe auf beiden Augen, Hornhaut Austrocknung zu verhindern.
- Rasieren Sie links an der Rückseite der Maus von Schulter, Rumpf und Flanken an Wirbelsäule mit einem Rasierer für Hundesalon konzipiert. Entfernen Sie lose Haare und Schmutz.
- Bereiten Sie eine separate Spritze mit 100 µL verdünnter DNA für jede narkotisierten Maus dafür, dass keine Luftblasen vorhanden sind.
- Verwenden Sie eine sterile 29 x ½" 0,5 mL U-100-Insulin-Spritze mit einer fest angebrachten Nadel ohne eine Sicherheit.
Hinweis: Die Spritze ist von entscheidender Bedeutung. Dieses Messgerät ermöglicht ein schnelles einspritzen. Die fest angebrachten Nadel wird verhindert, dass die Lösung austreten. Vorhandensein einer Sicherheit wird Zugriff auf das Nierenbecken behindern. Die Spritzen in der Materialtabelle angegebenen gleiten gleichmäßiger während der Injektion als andere Marken getestet. - Laden Sie die Spritze zu ~ 120 µL und ziehen Sie den Kolben nach unten, um einen Raum zu schaffen, an der Spitze. Tippen Sie mit einem Stift, bis alle Bläschen Aufstieg an die Spitze Luft. Halten die Nadel, sorgfältig drücken Sie den Kolben um alle Luft zu entfernen, bis ein Tropfen an der Spitze der Nadel bildet. Es sollte eventuell sichtbaren Luftblasen vorhanden, da diese eine Luft-Embolie führen können, die das Tier zu töten.
- Beenden Sie deprimierend den Kolben bis 100 µL gibt es in der Spritze entleeren überschüssige DNA-Lösung in das ursprüngliche Microfuge Rohr. Sorgfältig beschriften Sie, wenn notwendig und die geladenen Spritzen auf ein steriles Tuch, Sterilität beizubehalten, wenn die Anlage dem Arbeit ausgeführt werden soll nicht zulässt Wiederverschließen von Nadeln.
- Verwenden Sie eine sterile 29 x ½" 0,5 mL U-100-Insulin-Spritze mit einer fest angebrachten Nadel ohne eine Sicherheit.
- Die Mäuse mit Ketamin und Xylazin zu betäuben.
- Injektion zu operieren.
- Vorbereiten der Site für die Chirurgie. Legen Sie ein steriles Tuch über die Wärmekissen und leere sterile chirurgische Instrumente auf steriles Tuch ohne sie zu berühren. Heben Sie die Maus, und legen Sie sie in das Blickfeld. Passen Sie die Beleuchtung um die Fläche zu beleuchten.
- Die Pakete drei 3,15 % Chlorhexidin Gluconat und 70 % Isopropylalkohol antiseptische Hautputzlappen entnehmen und in der Nähe des Tieres.
- Ändern Sie in sterile OP-Handschuhe. Arbeiten in einer kreisförmigen Bewegung Anfang Einschnitt, Tupfer das Tier mit einem neuen Chlorhexidin/Alkohol-Tupfer dreimal.
- Suchen Sie die Schnitt-Website, wie in Figur 1Adargestellt. Kneifen die Haut mit einer Pinzette, mit einer Schere einen Schnitt an der Haut Schicht ca. 1 cm von der Wirbelsäule und unterhalb des Brustkorbs. Sobald die geschnittene Seite ca. 1 cm lang ist, machen Sie eine ähnliche geschnittenen Seite unten in die Muskelschicht.
Hinweis: Machen Sie dem Schnitt die richtige Länge erlauben die Niere kommen gerade noch durch den Schnitt und dann an Stelle von der Schnitt selbst gehalten werden. Zu klein, ein Schnitt und der Niere können nicht ausgesetzt werden; zu groß und die Niere rutscht immer wieder zurück in die Bauchhöhle. - Suchen Sie die Niere.
Hinweis: Es möglicherweise unter weißen Fettgewebe sichtbar. Die Milz befindet sich ebenfalls auf der linken Seite des Tieres. Die Farbe dieser Organe kann optisch unterschieden werden, da die Milz ein dunkles Kastanienbraun ist, während die Niere ein dunkles rot-Orange ist. Es ist nicht wünschenswert, die Milz zu manipulieren, wie es leicht gebrochen werden kann. - Ohne Berührung der Niere, setzen Sie sanft aus der Bauchhöhle durch stetige, sanften Druck auf den Bauch mit den Fingern (Abbildung 2 aus). Geschlossenen Pinzette sanft unerwünschte Organe in der Bauchhöhle bei Bedarf zurückzudrängen. Verwenden Sie geöffnete Zange nicht, da dies die Nieren oder andere Organe beschädigt werden könnte.
- Sobald die Niere aus dem Bauch ist, sanft getrennte es aus der Umgebung Fett gerade genug, um das Nierenbecken, ein kleiner weißer Punkt (Abbildung 1 b) zu visualisieren. Überschüssiges Fett zur Seite schieben oder ggf. entfernen. Achten Sie darauf, nicht auf die Nebenniere, in der Nähe des oberen Pol der Niere oder der Niere-Kapsel zu entfernen.
- Mit Pinzette auf der rechten Seite der Niere nach unten drücken, so dass das Nierenbecken im Blick bleibt, greifen die geladenen Insulin Spritze mit der rechten Hand geschlossen und halten Sie es parallel zur Arbeitsfläche mit der Nadel auf das Nierenbecken (Abb. 2E) gerichtet. Stechen Sie die Nadel vorsichtig in das Nierenbecken der immobilisierten Niere wie in Abbildung 1 bgezeigt.
- Die Lösung schnell innerhalb von 3 s zu injizieren. Etwa ein Drittel der Niere möglicherweise löschen und ändern Farbe zu weiß.
Hinweis: Es ist üblich, flüssige Ansammlung in der Niere Kapsel folgende Injektion sowie die Bildung von einem Hämatom zu beobachten. Einige Schäden ist notwendig, um ein ausreichendes Maß an DNA-Transfektion zur Erkennung zu erreichen. - Bewahren Sie die Nadel für ca. 10 s, Rückfluss der Lösung zu verhindern. Dann entfernen Sie langsam und vorsichtig die Nadel. Zurück, dass die Orgel in den Bauchraum durch sanft dehnen die Schnitt-Website und mit Zange geschlossen.
- Naht die Muskelschicht des Tieres mit 5-0 resorbierbaren Nähten, 2-4 unabhängige Knoten platzieren.
- Naht die Hautschicht des Tieres mit 5: 0 oder 6: 0 nicht absorbierbare Nylon Nähte, 2-4 unabhängige Knoten platzieren.
Hinweis: Chirurgische Instrumente können nach dem Einfügen in ein steriles Perle Bad wiederverwendet und abgekühlt.
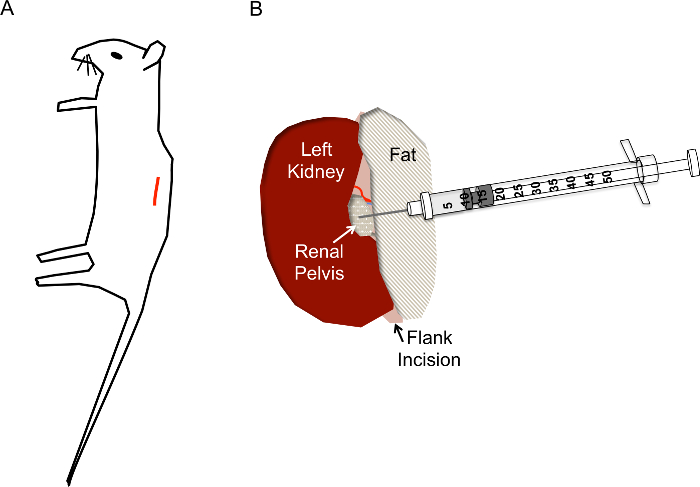
Abbildung 1: Richtigen Schnitt Website und Nadel Platzierung für hydrodynamische Nierenbecken Injektionen. (A) der Schnitt (rote Linie) sollte befindet sich ca. 1 cm von der Wirbelsäule und etwa 1 cm unterhalb des Brustkorbs der Maus. (B) nach die Niere über die Flanke Schnitt ausgesetzt ist, sollte das Nierenbecken als eine kleine gelbliche klare/weiß Punkt Mitte der Niere befinden. Die Injektion sollte die renale Vene, Nierenarterie oder Harnleiter nicht stören. Die Nadel der Spritze Insulin wird direkt in das Nierenbecken eingefügt, wie gezeigt, bis zu einer Tiefe von ca. 0,5 cm und schnell deprimiert in 2-3 s. Klicken Sie bitte hier, um eine größere Version dieser Figur.
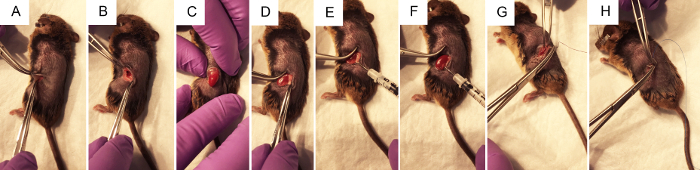
Abbildung 2: Die chirurgische Schritte zum Nierenbecken hydrodynamische Injektion von Plasmid DNA durchführen. (A) Zange drücken Sie die Haut um den Chirurgen zu einem ~ 1 cm Flanke Inzision mit einem Skalpell, zuerst durch die Hautschicht, dann durch die Muskelschicht zu ermöglichen. (B) mit zwei paar geschlossene Zange öffnet der Operationswunde, die Niere wird in den Bauch wenn möglich visualisiert. (C) mit sanftem Druck auf dem Bauch, ohne irgendwelche Organe direkt ist die Niere durch die Flanke Inzision ausgesetzt. (D) Fett ist sanft aus der Niere, seziert, Zugriff auf das Nierenbecken zu erreichen so wenig wie möglich stören. (E) drücken auf der rechten Seite der linken Niere besser visualisieren die Nierenbecken, die Spritze mit dem Daumen auf die Vakuumpumpe findet und die Nadel vorsichtig aber fest in das Nierenbecken gesetzt ist. (F) folgt die < 3 s-Injektion, clearing kann beobachtet werden, in den Bereichen der Niere, die den Großteil der Injektion erhalten. (G) Sterile lila Vicryl resorbierbare Nähte werden verwendet, um 2 bis 4 unabhängige Knoten in die Muskelschicht zu machen. (H) Sterile blaue Nylon nicht resorbierbare Nähte werden verwendet, um 2 bis 4 unabhängige Knoten in die Hautschicht zu machen. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Erholung von der Operation und postoperative Überwachung.
- Bieten Sie Mäuse mit Analgetikum IACUC bedarfsgerecht die Institution zur Schmerzkontrolle. Zum Beispiel verwalten Sie Buprenorphin durch subkutane Injektion alle 8-12 h für 48 h postoperativ wenn NSAR-bezogene Nierenschäden ist für die Untersuchung zu vermeiden.
- Halten Sie die Mäuse bei Hitze pad und nahmen die Ermittler bis voll mobil mit sternalen liegen. Wenn vollständig erholt zurück die Mäuse zu einem sauberen Käfig, enthält eine kleine Menge an Einstreu aus ihrer Heimat Käfig, Stress zu reduzieren. Tun Sie nicht Hausmäuse Chirurgie mit naiven Mäuse ausgesetzt.
Hinweis: Der Zustand der Mäuse werden schnell, verbessern scheinbar normales Verhalten innerhalb von 24-48 h haben. - Geben Sie salzhaltige Flüssigkeiten und erhöhte Analgesie mit Mäusen, die gestresst, um ihren Zustand zu verbessern. Wenn Mäuse nicht schnell erholen, Messen Sie das Gewicht der Maus und einschläfern Sie Mäuse, die größer als 20 % ihres ursprünglichen Körpergewichts verloren haben. Einschläfern Sie Mäuse erscheinen urämische oder sonst moribund. Mögliche gesundheitliche Probleme sind in Tabelle 1aufgeführt.
Hinweis: Mäuse manchmal entfernen Sie die äußeren Nähte oder die Fäden lösen sich vor Wundverschluss. Armen Nähen der Muskelschicht mit einer intakten Hautschicht führt zu einen Leistenbruch am Schnitt Standort, angezeigt durch prall gefüllt. In solchen Fällen, platzieren Sie den Mauszeiger in Narkose (Isofluran ist schneller als Ketamin/Xylazin) und der Operationsstelle mit neuen Nähte so bald wie möglich zu reparieren. Wenn nicht-resorbierbare Hautnähte nach 10-14 Tage bleiben, entfernen Sie diese. Gelegentlich können Mäuse ihren Käfig-Kumpels Fäden zu entfernen oder zu kämpfen. Entfernen Sie Aggressor Mäuse zu ihren eigenen Käfig mit Bereicherung zu verhindern, dass sie die anderen Mäusen zu verletzen, als solches Verhalten identifiziert wird. - Wenn Gesundheit oder experimentelle Endpunkte erreicht werden, einschläfern Sie die Mäuse durch Kohlendioxid einatmen oder Isofluran Überdosierung gefolgt von sekundäre Methode der Sterbehilfe wie zervikale Dislokation nach Standard Operating Procedure für Sterbehilfe in Legen Sie an der Hochschule
| Ursache | Beginn | Anzahl der Mäuse betroffen | Symptome | Sofortiges Handeln | Langfristige Lösung | ||
| DNA enthalten Endotoxine | 6-40 h nach der Injektion. | Jede Maus gegeben die kontaminierten DNA-Vorbereitung zu beeinträchtigen. | Probleme mit der Atmung, Anzeichen von starken Schmerzen, Organversagen und Tod. | Die betroffenen Mäuse einschläfern. Test jeder Komponente für Endotoxine mit Limulus Amebocyte Lysate injiziert. | Verwenden Sie Endotoxin-freie Maxiprep-Kits und nur sterile und neue oder NaOH behandelt Labware. Verwenden Sie einen im Handel gekauften und Endotoxin-geprüfte Puffer, um die DNA zu verdünnen. | ||
| Narkose Überdosierung | Während der Operation, vor oder nach der Injektion von DNA. | Nur die jüngere, kleinere oder schlanker Mäuse beeinträchtigen. | Einstellen Sie Atmung während auf Heizkissen, Wasserlassen. | Anästhesie für die verbleibenden Mäuse zu verringern. | Vorbereitung und ein Protokoll für Dosierungsgenauigkeit zu überprüfen. Schließen Sie aus "Zwerge." Tierarzt zu konsultieren, wenn geeignete Dosis verwendet wurde. | ||
| Luftblase in der Spritze oder Nadel Injektion | Sofort nach der Injektion Nierenbecken. | Es sei denn, alle Spritzen achtlos geladen wurden, betrifft dies nur eine Maus. | Nach Atem ringend. | Überprüfen Sie die verbleibenden Spritzen auf Anzeichen von Luftblasen. | Bereiten Sie Spritzen sorgfältig, klopfen die Spritze um Luftblasen an der Unterseite zu entfernen. Verbesserung der Lichtverhältnisse Luftblasen besser zu visualisieren. | ||
| Eröffnung des Operationssitus | 12-72 h nach der Injektion | Eine oder mehrere Mäuse. Manchmal der gesamte Käfig. | Klaffende Wunde, in der Regel keine anderen not | Wiederholen Sie die Naht die Wunde sorgfältig unter Isofluran-Narkose mit steriler Technik zu reparieren. Spülen mit Kochsalzlösung oder Wunde Grenzen mit der Schere entfernen müssen. | Wenn alle Mäuse sehr kurze oder fehlende Nähte haben, möglicherweise eine Maus herausnehmen, damit Mäuse getrennt werden können. Näht Technik zu verbessern. Verwenden Sie unabhängige Knoten. | ||
| Hernie im Operationsbereich | 48 + h nach der Injektion | Eine oder mehrere Mäuse. | Hügel ist sichtbar im Operationsbereich. | Schneiden Sie unter Isofluran-Narkose mit steriler Technik die geheilte Haut um Hernie der Muskelschicht zu offenbaren. Organe in das Peritoneum zu ersetzen, Muskelschicht mit resorbierbaren Fäden zu reparieren und die Website schließen. | Das bedeutet schlechte Naht der Muskelschicht. Näht Technik zu verbessern. Verwenden Sie unabhängige Knoten. | ||
| Nierenversagen | 48 + h nach der Injektion | Eine oder mehrere Mäuse. | Gewicht-Verlust von > 20 %, vielleicht zu urämischen, gebeugt Haltung | Kochsalzlösung bieten und erhöhen oder Analgesie zu verlängern. Wenn keine Besserung beobachtet wird, Opfern Sie die betroffenen Mäuse. | Der Krankheitszustand des Tieres zu machen, weniger stark zu verändern. Ändern des Transgens um weniger stark oder induzierbaren sein. Mäusen in einer früheren Timepoint im Fortschreiten der Krankheit zu injizieren. | ||
| Abszess oder Infektion | Tage bis Wochen nach der Operation | Eine oder mehrere Mäuse. | Tastbare Abszess oder Zeichen einer sepsis | Die betroffenen Mäuse einschläfern. Anfrage Autopsie vermuteten Infektion zu bestätigen. | Dies kann auftreten, wenn die chirurgische Bedingungen und Injektionen nicht hinreichend steril sind. Das Verfahren gezeigt ist für Mäuse mit einem normalen Immunsystem aber weitere Vorkehrungen getroffen werden müssen, in der Umgebung von immungeschwächten Tieren wie diejenigen mit Cyclophosphamid behandelt. | ||
Tabelle 1. Tabelle der möglichen Gesundheitsprobleme während des Nierenbecken-Injektion-Protokolls. Obwohl die genannten gesundheitlichen Probleme nicht üblich sind, gibt es eine Reihe von Ermittler-bezogene Fehler, die im Laufe des Verfahrens auftreten können. Diese Tabelle kann Hilfe bei der Prävention und Diagnose von gesundheitlichen Problemen sowie für die Umsetzung der möglichen Mittel, um in Zukunft zu verhindern, dass solche Probleme haben. Mit etwas Übung sollte Ermittler selten Gesundheitsprobleme und Sterblichkeit infolge des Verfahrens erwarten.
3. Injektion Effizienz und Transgen Auswirkungen beurteilen
- Verwenden Sie einen gut ausgebauten Assay für die gewünschte Transgen Transfektion Effizienz bewerten. Verwenden Sie positive und negative Kontrollen sorgfältig, um sicherzustellen, dass der Test spezifisch ist.
Hinweis: Je nach Veranstalter, Mäuse wahrscheinlich die stärksten Transgene Ausdruck am 1. Tag müssen; immer innerhalb der ersten Woche nach der Injektion. - Durchführen Sie live Animal Imaging der Luciferase durch Einführung von 10 µg Luciferase exprimierenden Plasmids wie verbesserte Firefly Luciferase, die verdünnte DNA für die Injektion.
- Reinigen Sie alle Oberflächen, die Mäuse ausgesetzt. Legen Sie den ersten Käfig Mäuse in die Kammer und die Dichtung, die es zu schließen. Sicherzustellen Sie, dass genügend Isofluran für das Experiment durch die Überprüfung der Gage; Wenn dies nicht der Fall ist, fügen Sie Isofluran, bis das Niveau die "max" Linie erreicht. Initiieren Sie den Fluss von Isofluran durch Drehen Isofluran Zifferblatt auf 3.5 und der Sauerstoff auf 2.
- Jede Maus durch intraperitoneale Injektion mit 100 µL der aufgetauten 30 mg/mL Luciferin zu injizieren. Notieren Sie die Zeit.
- Öffnen Sie die Software um die Bildgebung Maschine zu steuern, indem Sie auf das orangefarbene und gelbe Maus-Symbol. Wählen Sie unter "Select/Add User ID," die richtige Initialen aus dem Dropdown-Menü neben "User ID" Klicken Sie auf "OK". Klicken Sie auf der oberen Menüleiste auf "Übernahme" und wählen Sie aus "Autosave To..." aus dem Dropdown-Menü. Wählen Sie den Ordner, oder erstellen Sie einen neuen Ordner, um die Daten zu speichern.
- Gehen Sie zu der Image-Erwerb-Box in der rechten unteren Ecke. Kontrollieren, ob die automatischen Einstellungen wie folgt: Binning, Medium; F/Stop, 1 für leuchtende, 8 für Foto; Emission Filter, offen; Imaging-Modus, neben leuchtende, Foto, Overlay und Ausrichtung wird nur überprüft. Klicken Sie auf "Initialisieren", um das System zu initialisieren und Initialisierung abgeschlossen warten, und dann "Field Of View", "E" fünf Mäuse Image zu ändern.
- Drehen Sie das Ventil für die Anästhesie Schläuche, so dass die Nosecones im Inneren der Maschine Isofluran verwalten. Legen Sie die Tiere in der Bildgebung Maschine in der gewünschten Reihenfolge auf dem Bauch mit dem Rücken vor der Kamera oben, um die Niere zu visualisieren. Wenn mehr als ein Käfig werden abgebildet soll, legen Sie den nächsten Käfig in Isofluran-Kammer.
- 5-10 min nach der Injektion von Luciferin, drücken Sie die Taste "Acquire" um das Bild aufzunehmen.
- Klicken Sie auf der "Werkzeugpalette" auf der rechten Seite auf "Bild anpassen." Unter "Farbskala," verringern Sie "Min" Bar bis Ausdruck in alle erwarteten Mäuse, visualisiert wie Purpur über jede Mausniere evident. Wenn keine Mäuse nicht Ausdruck zeigen, Wiedereinleitung der Mäuse mit 100 µL Luciferin und warten Sie mindestens 3 min vor zurückzuerwerben.
- Wenn das Bild Pixel gesättigt hat, verringern Sie die Belichtungszeit und um ein quantitatives Bild zu erhalten, da das Vorhandensein von gesättigten Pixel wird unterschätzt die Transfektion Effizienz zurückzukaufen. Die niedrigste mögliche Belichtungszeit beträgt 0,5 s.
- Wenn das Bild nur schwach Genexpression bei der ersten Belichtung zeigt, erhöhen Sie die Belichtungszeit bis zu 2 min. zurückzukaufen. Jedes Mal, wenn das Bild wiederholt wird, werden die Daten automatisch in den ausgewählten Ordner gespeichert, also alle Bilder später für weitere Analysen zur Verfügung stehen.
- Wiederholen Sie imaging für nachfolgende Käfige von Mäusen.
- Entfernen Sie die Mäuse aus dem bildgebenden Gerät. Das Gas abdrehen. Reinigen Sie die Kammer, Nosecones und bildgebenden Bühne. Schließen Sie das Computerprogramm.
Hinweis: Die Software fragt, "Dataset"zu speichern. Dies bezieht sich auf die Manipulationen unternommen, um das Dataset, nicht die Daten selbst.- Klicken Sie auf "Ja", um Änderungen an der Skala und Regions of Interest (ROI) zu speichern. Klicken Sie auf "Nein", um die ursprünglichen Einstellungen für die Bilder wiederherstellen.
- Öffnen Sie die Software für die Datenanalyse. Klicken Sie auf der "Werkzeugpalette" "ROI-Tools." Klicken Sie auf das Kreissymbol und klicken Sie auf "1" in der Drop-Down-Menü einen neuen ROI im Bildfenster wie durch ein rotes Oval mit vier Quadrate um ihn herum zu platzieren. Passen Sie die Größe des ROI durch den Mauspfeil über ein rotes Quadrat und ziehen, um die lila Fläche überlagern die injizierte Niere umschließen.
- Mit dem Cursor über ein rotes Quadrat auf den ROI mit der rechten Maustaste und wählen Sie dann "ROI duplizieren" einen neuen ROI im Bildfenster erstellen und verschieben Sie sie in der nächsten Maus. Wiederholen Sie den Vorgang, bis alle Mäuse im Bild einen ROI über die injizierten Niere haben.
- Im Menü direkt über dem Bild ändern Sie "Einheiten" von "Zählt" in "Radiance (Photonen)." Um den ROI zu exportieren Daten in der "Werkzeugpalette", "ROI-Tools" klicken Sie auf das Bleistift/Lineal-Symbol, erstellen Sie eine Tabelle mit den Messungen. Verwenden Sie die "Avg Radiance" Messung in weitere Analysen in der Analyse und Statistik-Programm der Wahl.
- Durchführen Sie Färbung von Abschnitten beschriebenen11.
Hinweis: Die Injektion nicht die gesamte Niere ebenso transfizieren so verschiedene Abschnitte unterschiedliche Transfection Effizienz11erfassen werden. Co-Injektion von Perlen wie fluoreszierende Latex Mikrosphären Regionen identifizieren können voraussichtlich Transgen-positiv (Abbildung 3D)11. Optimierung des Protokolls Färbung ist extrem wichtig. - Führen Sie Western-Blot um das gen des Interesses an der transfizierten Niere zu identifizieren.
Hinweis: Ernte von Organen für Protein Extrakte muss auf Eis erfolgen. Verwenden Sie ein kleines Stück der Orgel wieder, nicht, da dieser Bereich nicht gut transfiziert wurden. Transfektion ist ungleichmäßig verteilt die Orgel so kombinieren Sie verschiedene Bereiche und bündeln sie. Nierenbecken hydrodynamische Injektion von einem Plasmid produzieren das Hormon Erythropoietin führte zu einem bescheidenen Anstieg der Hämatokrit, so dass erwartet wird, dass sekretierte Transgen Produkte in Umlauf11zu finden. - Kombinieren Sie für langfristige hochrangige Ausdruck von transgenen eine integrierende Vektorsystem mit immunsuppressiven Wirkstoffen wie Cyclophosphamid. Die Immunantwort auf das Transgen erfolgt über den ersten mehrere Wochen nach der Injektion und ist robust11.
Ergebnisse
Die Chirurgie und Injektion Technik sind einfach durchzuführen, einmal gemeistert, erfordert keine große Ausrüstung oder teuren Materialien. Wenn neue zur Flanke-Schnitt Niere Chirurgie, einen Trainingstag auf mehrere Mäuse geplant für Euthanasie dürfen in denen die Mäuse sind nicht wiederhergestellten nach der Operation, weil der erste Versuch dieser Operation wesentlich länger als normal dauern kann. Alternativ können Forscher mit ähnlichen Techniken vertraut ganz einfach find...
Diskussion
In diesem Protokoll wird eine robuste Methode zur Erreichung reproduzierbare Genexpression speziell in der Niere beschrieben. In den Händen eines mäßig erfahrener Chirurgen fanden wir den Prozentsatz der Mäuse, die durch diese Technik im Bereich von 50-100 %, je nach Alter der Maus und die Empfindlichkeit der Anzeige des Transgens transfiziert. Das Niveau der Luciferase-gen-Expression war über Hintergrund für mehrere Monate in den Mäusen erhalten PiggyBac Transposons und für mehrere Wochen bei immungesch...
Offenlegungen
Die Autoren haben nichts offen zu legen und kein Interessenkonflikt zu erklären.
Danksagungen
Ein Career Development Award vom Department of Veterans Affairs [BX002797] L.E.W. und die National Institutes of Health [R01-DK095867] American Heart Association [15GRNT25700209] unterstützt und j.c. Die National Institutes of Health [DK093660], Department of Veterans Affairs [BX002190] und der Vanderbilt-Zentrum für Nierenerkrankungen unterstützt M.H.W. Dieses Material ist das Ergebnis der Arbeit mit Ressourcen und Nutzung der Einrichtungen im VA Tennessee Valley Healthcare System unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| AnaSed Xylazine | Patterson Veterinary | 07-808-1947 | Anesthetic - Not controlled substance |
| BD Insulin Syringe 0.5 mL 29G 1/2 Inch | Cardinal Health | 309306 | Required syringes |
| Buprenex | Pharmacist/Veterinarian | Analgesia - Controlled Substance | |
| Dynarex Disposable Towel Drape | Thermo Fisher Scientific | 19-310-671 | Place over heat pad |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | Use only endotoxin-free plasmid DNA |
| Endosafe Gel-Clot LAL Rapid Positive Control | Charles River | PC200 | Positive control for endotoxin test |
| Endosafe Gel-Clot LAL Rapid Single Test Vial | Charles River | R13500 | Endotoxin test |
| Extra Fine Micro Dissecting Scissors | Roboz Surgical Instrument | RS-5882 | Surgical tool |
| Fisherbrand Instant Sealing Sterilization Pouch - 9" | Thermo Fisher Scientific | 01-812-51 | For autoclaving surgical tools |
| Gaymar Heat Pump | Paragon Medical | TP-700 | Water-circulating heat pump |
| Germinator 500 | Roboz Surgical Instrument | DS-401 | To reuse surgical tools during surgery |
| Graefe Forceps | Roboz Surgical Instrument | RS-5136 | Surgical tool |
| Graefe Tissue Forceps | Roboz Surgical Instrument | RS-5153 | Surgical tool |
| Halsey Needle Holder, 5" Length | Roboz Surgical Instrument | RS-7841 | Surgical tool |
| Heat pads - 15" x 21" - need at least 3 | Paragon Medical | TP22G | For use with Gaymar Heat Pump |
| IsoFlo (Isoflurane, USP) | Abbott Animal Health | 5260-04-05 | For imaging and euthanasia |
| Isotec Isoflurane Delivery System Vaporizor | Smiths Medical | VCT3K2 | For imaging and euthanasia |
| Ketamine | Pharmacist/Veterinarian | Anesthetic - Controlled Substance | |
| Kimwipes | Kimberly-Clark Professional | 34120 | Laboratory tissues |
| Living Image software | Caliper Life Sciences | For live animal imaging | |
| Luciferin | Perkin Elmer | 122796 | For live animal imaging |
| Nanodrop 2000 | Thermo Scientific | ND-2000-US-CAN | Spectrophotometer for DNA measurement |
| Prevantics Swabs | Thermo Fisher Scientific | 23-100-110 | For skin surgery prep |
| Prolene 5-0 sutures Taper 30" | Thermo Fisher Scientific | NC0256891 | Non-absorbable sutures for skin |
| Puralube Brand Opthalmic Ointment | Patterson Veterinary | 07-888-2572 | To keep eyes moist during surgery |
| Trans IT - QR Hydrodynamic Delivery Solution | Mirus Bio | MIR-5240 | Hydrodynamic delivery buffer for diluting DNA |
| Vicryl 5-0 Sutures J303H | Thermo Fisher Scientific | NC9816710 | Absorbable sutures for muscle layer |
| Wahl Mini Arco Clipper | Med-Vet International | 8787-1550 | Shaver for skin prep |
| Xenogen IVIS 200 | Caliper Life Sciences | For live animal imaging |
Referenzen
- Liu, F., Song, Y., Liu, D. Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA. Gene Ther. 6 (7), 1258-1266 (1999).
- Zhang, G., Budker, V., Wolff, J. A. High levels of foreign gene expression in hepatocytes after tail vein injections of naked plasmid DNA. Human Gene Therapy. 10, 1735-1737 (1999).
- Fumoto, S., Nishimura, K., Nishida, K., Kawakami, S. Three-Dimensional Imaging of the Intracellular Fate of Plasmid DNA and Transgene Expression: ZsGreen1 and Tissue Clearing Method CUBIC Are an Optimal Combination for Multicolor Deep Imaging in Murine Tissues. PLoS One. 11 (1), e0148233 (2016).
- Yoshino, H., Hashizume, K., Kobayashi, E. Naked plasmid DNA transfer to the porcine liver using rapid injection with large volume. Gene Ther. 13 (24), 1696-1702 (2006).
- Kamimura, K., Suda, T., Xu, W., Zhang, G., Liu, D. Image-guided, lobe-specific hydrodynamic gene delivery to swine liver. Mol Ther. 17 (3), 491-499 (2009).
- Kamimura, K., Zhang, G., Liu, D. Image-guided,intravascular hydrodynamic gene delivery to skeletal muscle in pigs. Mol Ther. 18 (1), 93-100 (2010).
- Suda, T., Liu, D. Hydrodynamic gene delivery: its principles and applications. Mol.Ther. 15 (12), 2063-2069 (2007).
- Alino, S. F., et al. Naked DNA delivery to whole pig cardiac tissue by coronary sinus retrograde injection employing non-invasive catheterization. J Gene Med. 12 (11), 920-926 (2010).
- Suda, T., Gao, X., Stolz, D. B., Liu, D. Structural impact of hydrodynamic injection on mouse liver. Gene Ther. 14 (2), 129-137 (2007).
- Skrypnyk, N. I., Harris, R. C., de Caestecker, M. P. Ischemia-reperfusion model of acute kidney injury and post injury fibrosis in mice. J Vis Exp. (78), (2013).
- Woodard, L. E., et al. Kidney-specific transposon-mediated gene transfer in vivo. Sci Rep. 7, 44904 (2017).
- Liang, A., et al. Loss of glutathione S-transferase A4 accelerates obstruction-induced tubule damage and renal fibrosis. Journal of Pathology. 228 (4), 448-458 (2012).
- Liang, M., et al. Protective role of insulin-like growth factor-1 receptor in endothelial cells against unilateral ureteral obstruction-induced renal fibrosis. Am J Pathol. 185 (5), 1234-1250 (2015).
- Corridon, P. R., et al. A method to facilitate and monitor expression of exogenous genes in the rat kidney using plasmid and viral vectors. Am J Physiol Renal Physiol. 304 (9), F1217-F1229 (2013).
- Wallace, D. P., et al. Tracking kidney volume in mice with polycystic kidney disease by magnetic resonance imaging. Kidney Int. 73 (6), 778-781 (2008).
- Woodard, L. E., Wilson, M. H. piggyBac-ing models and new therapeutic strategies. Trends Biotechnol. 33 (9), 525-533 (2015).
- Yeikilis, R., et al. Hydrodynamics based transfection in normal and fibrotic rats. World J Gastroenterol. 12 (38), 6149-6155 (2006).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. (41), (2010).
- Wooddell, C. I., et al. Muscle damage after delivery of naked plasmid DNA into skeletal muscles is batch dependent. Hum Gene Ther. 22 (2), 225-235 (2011).
- Crespo, A., et al. Hydrodynamic liver gene transfer mechanism involves transient sinusoidal blood stasis and massive hepatocyte endocytic vesicles. Gene Ther. 12 (11), 927-935 (2005).
- Rocca, C. J., Ur, S. N., Harrison, F., Cherqui, S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Ther. 21 (6), 618-628 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten