Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Гидродинамические почечной лоханки инъекции для выражения-вирусных белков в почках
В этой статье
Резюме
Этот протокол описывает метод придать плазмидной ДНК в мыши почки через почечной лоханки производить трансген выражение специально в почках.
Аннотация
Гидродинамические инъекции создает местные, высокого давления среды для transfect различных тканей с плазмида ДНК и других веществ. Гидродинамические хвост инъекции Вену, например, является устоявшейся метод, по которому можно transfected печени. Эта рукопись описывает приложение гидродинамических принципов путем инъекций почки мыши непосредственно с плазмидной ДНК для экспрессии генов почек конкретных. Наркоз мышей и почки предоставляемые фланг разрез, следуют быстро инъекции плазмида ДНК содержащих решения непосредственно в почечной лоханки. Игла хранится в месте десять секунд и сайт разрез зашивается. Следующий день, живут животных изображений, Западная помарка, или иммуногистохимия могут использоваться для анализа экспрессии генов, или другие анализы, подходит для трансген выбора используются для обнаружения протеина интереса. Опубликованные методы продлить экспрессии генов включают трансген, transposon опосредованной интеграции и циклофосфамида лечения подавлять иммунный ответ трансген.
Введение
Техника инъекции Вену гидродинамических хвост стал часто используемым способом для достижения высоких уровней экспрессии генов в мыши печени1,2. Почки являются также transfected на этот метод на гораздо более низком уровне, около 100-кратного меньше3. Инъекции гидродинамических почечной лоханки, описанные здесь обеспечивает простой способ для контроля специфика органа выражения через физические средства, используя те же гидродинамических принципы, которые были установлены ранее в печени4,5 , мышцы6и7,других органов8. Этот метод transfects клеток в живых животных в естественных условиях с помощью давления и скорость, чтобы заставить жидкости содержащие ДНК в клетки, одновременно вызывающих повреждения органа, который быстро решены9. Использование устоявшихся хирургические методы для визуализировать почки через разрез фланге10 наряду с одной инъекции инсулина шприц, мы нашли успешных трансфекции различных типов клеток почек, главным образом интерстициальных фибробластов, трубочки и собирая протока11. Рассечение этих мышей показало, что другие органы являются не transfected на уровнях достаточно высока, чтобы визуализировать Люцифераза изображений техники11. Поскольку метод не вирусная, использование плазмидной ДНК для transfection позволяет быстро и легко Подготовка реагентов, необходимых для инъекций.
Мы использовали локализованных гидродинамических инъекции выразить антиоксидант глутатион S-трансферазы A4, инсулин подобный фактор роста-1 рецептор и гормона эритропоэтина в почках, все с ожидаемые биологические эффекты11, 12 , 13. подробную оценку маршрут администрации, объем впрыска, дозировка ДНК и промоутер выбор был выполненных11. Кроме того оба piggyBac transposon системы и/или циклофосфамида лечения для подавления иммунной реакции трансген было показано, улучшить долгосрочные ген выражение результатов11. Другие исследователи использовали подход почечных вен в Крыса с успехом, достижение высоких трансфекции эффективности для периодов времени более чем один месяц14. Однако генетической коррекции фенотипов, имитируя человека болезни обычно выполняются в мышах сначала как доказательства в концепция так как наиболее млекопитающих генетической модели мыши модели. Мы по сравнению почечных вен инъекции инъекции почечной лоханки и обнаружил, что инъекции в почечной лоханки превосходит почечных вен для экспрессии генов (приблизительно в десять раз выше) и выживания11. Почечной лоханки это идеальный маршрут вступления в почках, потому что это достаточно гибким, чтобы терпеть колебания в производство мочи и часто способен поддерживать свою структурную целостность, даже когда расширены во время гидронефроз. Кроме того инъекции в почечной лоханки разрешен доступ к функции почек без пирсинга капсулу почки, позволяя закачиваемой жидкости для удерживаются заметно лучше, чем инъекции intraparenchymal почек. Другие мыши органов не имеют маршрут входа помимо сосудистую, но мочи пространство почек является идеальным укола. Кроме того инъекции в Вену почечной привели к утечки крови в брюшной полости. Объем всего почки почек одичал тип мыши была оценена магнитно-резонансной томографии быть приблизительно 0,2 см3, поэтому объем одной почки примерно равное количество жидкости вводят лоханочных гидродинамических 15инъекций (100 мкл). Здесь мы сделали доступными все подробную нюансы гидродинамических почечной лоханки инъекции протокола для достижения воспроизводимых трансфекции почки.
протокол
Все методы, описанные здесь были одобрены институциональный уход животных и использование комитетов (IACUCs) и колледж Бейлор медицинский центр Университета Вандербильта.
1. Подготовьте ДНК раствор для инъекций
- Выберите plasmid(s) выразить transgene(s) тщательно, чтобы максимизировать желательные характеристики для улучшения эффективности transfection и трансген выражение.
Примечание: Гидродинамическое почечной лоханки инъекции плазмид выразить флуоресцентные маркер TdTomato, гормон эритропоэтин (ЭПО) и Светлячок Люцифераза были ранее описанных11. Если не существует развитая assay для эффективность трансфекции трансген, выполняют живых животных изображений Люцифераза, представляя 10 мкг Люцифераза выражая плазмида, например расширенной Светлячок Люцифераза разреженных ДНК для инъекций.- Выберите наименьший плазмида, что практическое применение.
Примечание: Малые плазмиды обычно transfect клетки лучше, чем большие плазмид. Например zeomycin сопротивление гена и R6K происхождения репликации небольшие, поэтому использование этих элементов в плазмиду позвоночника будет уменьшить размер плазмиды. - Экспресс трансген от промоутера млекопитающих.
Примечание: Почки тип ячейки transfected, длина экспрессии генов и сила выражения гена все зависит от выбора промоутер. Смотрите Вудард и др. для сравнения цитомегаловирус (ЦМВ; учредительный вирусных), удлинение альфа фактор-1 (EF-1α; учредительный эндогенных), гамма глютамил транспептидаза (γGT; трубочка специфические) и podocin (NPHS2; Подоцит специфические)11. - Используют-вирусных интеграции системы например транспозоны, если выше долгосрочных уровни выражения гена желательно11,16. Для исследования с раннего отсчетов меньше, чем 5 дней после инъекции интеграция трансген является ненужным.
- Выберите наименьший плазмида, что практическое применение.
- Подготовьте плазмида ДНК для инъекций с использованием коммерческих метода например эндотоксинов бесплатная maxiprep комплект. Тщательно Избегайте введения эндотоксинов через лабораторное оборудование.
Примечание: Присутствие эндотоксинов в ДНК решение вызовет серьезные иммунный ответ в теме животного, ущерба для эксперимента и возможно убить животное.- После завершения последнего шага мыть изоляции ДНК, убедитесь, что не этанола оставленные визуальный осмотр и запаха. Чтобы удалить видимые капли используйте гель загрузки советы. Сухие пробирки, содержащие ДНК Пелле вниз на лабораторных деликатную задачу стеклоочистителя тканей при комнатной температуре или в 37-60 ° C духовке с постоянным мониторингом. Ресуспензируйте гранулы, сразу же после того, как остаточные этанола испарилась для предотвращения Пересушивание гранул.
Примечание: Остаточные этанола мешает с чтением спектрофотометр концентрации ДНК и введение в почках не является желательным. - Ресуспензируйте Пелле ДНК в тот же буфер, как будет использоваться для инъекций (гидродинамические доставки буфер; 100-300 мкл) ограничить изменения в химическом составе ДНК буферного раствора между группами.
Примечание: Не Ресуспензируйте Пелле ДНК в решении Элюирующий буфер, который поставляется с комплектом. Комплексон ЭДТА, обычно встречаются в «TE» буфера препаратов может повлиять на функции почек и сердечно-сосудистой функции. В зависимости от размера гранул элюировать в 100-300 мкл буфера гидродинамических доставки для достижения высокой концентрации. Конечная концентрация полностью Разводненная ДНК будет между 100 нг/мкл (10 мкг/мыши дозы) и 500 нг/мкл (50 мкг/мыши доза) поэтому штока концентрации ДНК должен превышать это. - Полностью Ресуспензируйте Пелле ДНК в буфере. Оставьте гранулы в буфере гидродинамических доставки в оригинальной трубку при комнатной температуре по крайней мере один час, или на ночь при 4 ° C до перевода в стерильных отцентрифугировать трубку для обеспечения что ДНК полностью не растворится.
- Читайте концентрации ДНК плазмиды на спектрофотометре или другим установленным методом.
Примечание: Чтение должно быть сделано в двух экземплярах с дополнительным реплицирует при необходимости. Если коэффициент 260/280 ниже 1.8, подготовка загрязнена РНК или другое вещество поэтому отменить его и подготовить ДНК снова. - Магазин плазмидной ДНК высокомобильна в буфере инъекций при-20 ° C внутри коробки в руководстве размораживание морозильной камеры, чтобы избежать деградации ДНК.
Примечание: Хранятся таким образом, подготовка ДНК будет длиться на протяжении многих лет. Проверьте целостность ДНК, электрофорез геля агарозы и дайджест ограничения. ДНК, что намазывается вниз по переулку деградированных и не может использоваться в то время как ДНК, которая производит четкие полосы правильного размера может использоваться для инъекций.
- После завершения последнего шага мыть изоляции ДНК, убедитесь, что не этанола оставленные визуальный осмотр и запаха. Чтобы удалить видимые капли используйте гель загрузки советы. Сухие пробирки, содержащие ДНК Пелле вниз на лабораторных деликатную задачу стеклоочистителя тканей при комнатной температуре или в 37-60 ° C духовке с постоянным мониторингом. Ресуспензируйте гранулы, сразу же после того, как остаточные этанола испарилась для предотвращения Пересушивание гранул.
- Подготовьте разреженных плазмида ДНК раствор для инъекций в почечной лоханки.
Примечание: Рассмотрим управления группы тщательно. Для многих исследований наивно и буфера вводят только элементы управления включены потому, что инъекции себе наносит ущерб и может повлиять на экспериментальный результат11.- Размораживание эндотоксинов свободной ДНК этого eluted в буфере гидродинамических доставки при комнатной температуре на скамейке.
- Рассчитать количество ДНК, необходимых для инъекций и подготовить разреженных ДНК для каждой группы. Управление 10-50 мкг плазмидной ДНК, привели суммарный объем 100 мкл с буфером гидродинамических доставки на мышь.
Примечание: Например, расчеты придать 3 мышей с 10 мкг/мыши плазмидной ДНК, которая имеет концентрацию 0,5 мкг/мкл являются следующие.- Готовят раствор достаточно ДНК иметь приблизительно 20% дополнительно для загрузки Мертвое пространство в иглы и шприцы. Для 3 мышей, готовят смесь на 3.5 x. Вычислите массу ДНК в мкг, что должно быть в решении. Здесь было бы 10 мкг x 3.5 = 35 мкг.
- Вычислите общий объем раствора для инъекций 100 мкл на мышь. В этом случае было бы 100 мкл x 3.5 = 350 мкл общий объем.
- Рассчитайте объем запасов плазмида ДНК, чтобы добавить в решение. В этом случае было бы 35 мкг / 0,5 мкг/мкл = 70 мкл запасов плазмидной ДНК.
- Рассчитайте объем буфера для добавления в разбавленный раствор ДНК путем вычитания объем запасов ДНК добавил (шаг 1.3.2.3) от общего объема разреженных ДНК, что желаемый (шаг 1.3.2.2). В этом случае было бы 350 мкл - 70 мкл = 280 мкл буфера гидродинамических доставки.
- Подготовка решений в стерильных отцентрифугировать трубы, использование коммерчески доступных фильтров наконечники с стерильных на стенде лаборатории.
Примечание: Решения ДНК может подготовлены и хранятся при комнатной температуре для инъекций, равным происходят в тот день. Не вводить мышей с раствором холодной, как это будет ниже температура их тела, но потепление является ненужным.
2. Выполните гидродинамические почечной лоханки инъекции хирургии
- Выберите мышь тщательно для хирургии.
Примечание: Штаммоспецифических различия пока не наблюдается, но возможно. Большинство инъекции были C57BL/6 или FVB стола. Инъекции почечной лоханки работают лучше всего в мышей, которые являются 6-12 недель. У мышей, больше чем через 16 недель до 50% отказов по Люцифераза изображений возможен по неясным причинам. Же возрастных отказов наблюдается для инъекции Вену гидродинамических хвост печени так что это может быть общего ограничения, связанные с принципом гидродинамических инъекции. В том же ключе, другие показали, что инъекции Вену гидродинамических хвост в печени крыс фиброзных не является столь эффективным, как здоровая печень, поэтому он может быть возможно, что в настройках фиброза почек почечной лоханки гидродинамических инъекции не будет столь же эффективным, но Это не было протестировано непосредственно17. - Подготовьте мышей и ДНК шприцы для хирургии.
- Анестезировать мышей с кетамином и ксилазина.
- Поставьте на правильную средств индивидуальной защиты, требуемые фондом животных, такие как одноразовые лаборатории фартук, Xирургическая маска и перчатки нитриловые.
- Работая с мышами, 2-4 в одно время, вес каждой мыши в 500 мл пластиковый стакан в масштабе, который с точностью до 0,1 г. рассчитать правильное количество кетамина и 2 мг/мл Ксилазина 24 мг/мл разбавленной в физиологический 0,9% для администрирования каждой мыши внутрибрюшинной инъекции (см. ссылки на видео для более на внутрибрюшинной инъекции) 18. Используйте формулу (50 мкл + ((5 µL) x (вес (г))), или альтернативно вычисления по другой формуле после консультаций с местным ветеринаром команды и IACUC.
- Привнести мыши внутрибрюшинной инъекцией, стандартных методов. Поместите курсор мыши в документе ведро, до тех пор, пока мышь неподвижной.
Примечание: Мышей готовы для хирургии, когда они больше не реагируют на мыс щепотка тест. Дайте мышей, которые продолжают отвечать на мыс щепотка испытания 20-30 мин после первоначального введения 20-60 мкл более цистит, в зависимости от ответа. - Место мыши на площадку воды распространены тепла покрыта синей колодки и мазь ветеринара место в оба глаза, чтобы предотвратить истощение роговицы.
- Бритье левой задней части мыши от плеча до крестца и фланга позвоночника с бритвы, предназначенные для ПЭТ ухаживание. Удаление распущенные волосы и мусор.
- Подготовьте отдельный шприц, содержащей 100 мкл разбавленного ДНК для каждой наркотизированных мыши, убедившись, что нет пузырьков воздуха.
- Используйте стерильные сметы x ½" 0,5 мл U-100 инсулина шприц с иглой постоянно прилагаемый без безопасности.
Примечание: Шприц тип имеет решающее значение. Этот датчик позволяет для быстрый инъекций. Постоянно прилагаемый иглы предотвращает решение от утечки. Присутствие безопасности будет затруднять доступ к почечной лоханки. Шприцы, указанного в таблице материалы более равномерно скольжения во время инъекции, чем другие бренды испытания. - Загрузить шприца до ~ 120 мкл и потяните поршень вниз для создания пространства в верхней части. Коснитесь пером, до тех пор, пока все воздушные пузырьки подняться на вершину. Тщательно держа иглу, отпустите поршень, чтобы удалить весь воздух, пока капельку образует на кончике иглы. Не должно быть каких-либо видимых пузыри присутствуют, как это может привести к эмболии, которая будет убить животное.
- Отделка, угнетающие поршень до тех пор, пока существует 100 мкл в шприц путем очистки излишки раствора ДНК в оригинальной отцентрифугировать трубку. Тщательно ярлык при необходимости и загружен шприцы на стерильную Пелерина для поддержания стерильности, если объект, где работа выполняется не позволяют наложения игл.
- Используйте стерильные сметы x ½" 0,5 мл U-100 инсулина шприц с иглой постоянно прилагаемый без безопасности.
- Анестезировать мышей с кетамином и ксилазина.
- Выполнение инъекции хирургии.
- Подготовка сайта для хирургии. Место стерильным драпировка над тепла pad и пустые стерильные хирургические инструменты на стерильную драпировка не касаясь их. Возьмите мышь и поместите его в поле зрения. Отрегулируйте освещение для освещения зоны.
- Извлеките три 3,15% хлоргексидин глюконат и 70% изопропиловый спирт кожи антисептические тампоны из пакетов и место вблизи животного.
- Изменения в стерильные хирургические перчатки. Работа в начале круговое движение на участке разреза, тампоном животное с новым тампоном Спирт хлоргексидиновый три раза.
- Найдите на сайте разрез, как показано на рисунке 1A. Щипал кожу с помощью пинцета, используйте ножницы, чтобы сделать разрез кожи слой около 1 см от позвоночника и ниже грудной клетки. Как только вырезать сайт примерно 1 см длиной, сделайте аналогичные отрезока сайт ниже, в слой мышц.
Примечание: Сделать разрез нужной длины, чтобы позволить почки едва прийти через разрез и затем храниться в месте разреза, сам. Слишком маленький надрез и почки не могут быть предоставлены; слишком большой и почки будет постоянно скольжения обратно в брюшной полости. - Найдите почки.
Примечание: Это может быть видна среди белой жировой ткани. Селезенки также расположен на левой стороне животного. Цвет этих органов можно визуально различить, как селезенка находится темно бордовые почки темные красно оранжевый. Не желательно, чтобы манипулировать селезенки, как она может быть легко разрыв. - Не касаясь почки, нежно разоблачить его из брюшной полости, поставив устойчивый, нежное давление на живот с пальцами (рис. 2 c). Используйте закрытый пинцет аккуратно отодвинуть нежелательных органов в брюшную полость при необходимости. Не используйте открытые щипцы, как это может повредить почки или других органов.
- Когда почки из живота, нежно отдельных его от окружающих жир просто достаточно, чтобы визуализировать почечной лоханки, маленькой белой точки (рис. 1B). Толкать лишний жир в одну сторону или удалить при необходимости. Убедитесь в том, чтобы не удалить надпочечников, расположенные возле верхнего полюса почки, или капсулу почки.
- С помощью закрыт щипцы надавите на правой стороне почки, так что почечной лоханки остается в представлении, возьмите шприц загруженного инсулина с правой рукой и держать его параллельно на рабочей поверхности с иглой, указал на почечной лоханки (Рисунок 2E). Вставьте иглу осторожно в почечной лоханки подвижности почки, как показано на рисунке 1B.
- Внедрять решение быстро в течение трех s. Около одной трети почки может очистить и изменить цвет на белый.
Примечание: Это часто наблюдать за накопление жидкости в капсулы следующей инъекции почек, а также образование гематом. Некоторые повреждения является необходимым для достижения достаточного уровня трансфекции ДНК для обнаружения. - Храните иглу в месте для приблизительно 10 s для предотвращения обратного потока раствора. Затем тщательно и медленно снимите иглу. Вернуться закрытой орган в брюшной полости, нежно растяжения разрез сайт и используя пинцет.
- Шов мышцы слой животного с 5-0 рассасывающиеся швы, размещения 2-4 независимых knots.
- Шовные слой кожи животного с 5-0 или 6-0 нейлон не рассасывающиеся швы, размещения 2-4 независимых knots.
Примечание: Хирургические инструменты могут повторно использоваться после размещения в ванну стерильный шарик и охлаждается.
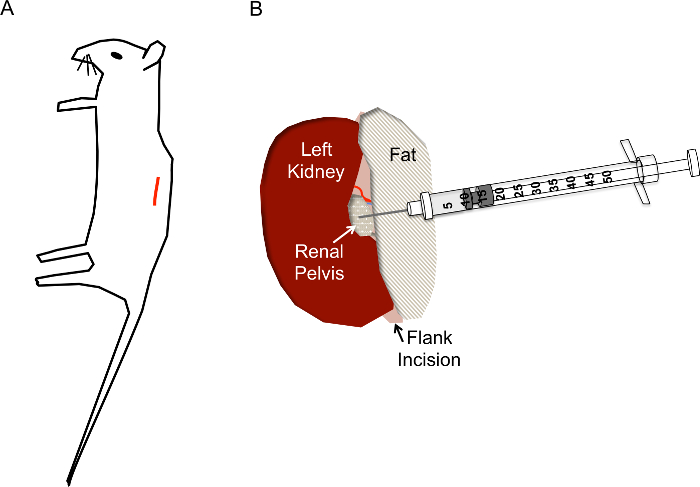
Рисунок 1. Сайт и иглы размещения правильный разрез для гидродинамических почечной лоханки инъекции. A) разрез (красная линия) должен быть расположен примерно в 1 см от позвоночника и приблизительно на 1 см ниже грудной клетки мыши. B) после через разрез фланка подвергается почек, почечной лоханки должен быть расположен как небольшой желтоватый прозрачный/белый точка полпути вниз почки. Инъекции не должны мешать почечных вен, почечной артерии или мочеточника. Иглу шприца инсулина вставляется непосредственно в почечной лоханки, как показано на глубину примерно 0,5 см и быстро подавлен в 2-3 s. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
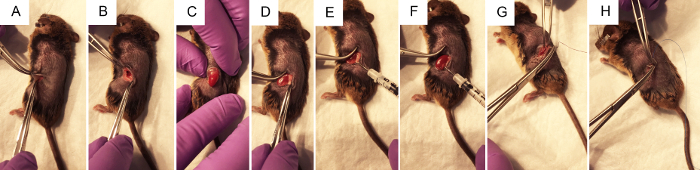
Рисунок 2. Хирургические шаги для выполнения почечной лоханки гидродинамических инъекции плазмидной ДНК. A) щипцов ущипнуть кожу, чтобы позволить хирургу сделать разрез фланг ~ 1 см с помощью скальпеля, сначала через слой кожи, затем через слой мышц. B) использование две пары закрытых щипцов, чтобы открыть хирургической раны, почки визуализируется внутри живота, если это возможно. C) с нежным давлением на животе, не затрагивая любые органы напрямую через разрез фланка подвергается почки. D) жира нежно расчлененный из почек, нарушая его как можно меньше для обеспечения доступа к почечной лоханки. E) нажатие на правой стороне левой почки лучше визуализировать почечной лоханки, шприц проводится с большой палец на депрессорные и иглу осторожно, но твердо помещаются в почечной лоханки. F) следующие < 3 s инъекций, очистка может наблюдаться в области почек, который получил большую часть инъекции. G) стерильные Викрил фиолетовый рассасывающиеся шовные материалы используются для 2-4 независимых knots в слой мышц. H) стерильные синий нейлон не рассасывающиеся шовные материалы используются для 2-4 независимых knots в слой кожи. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Восстановление после операции и послеоперационного мониторинга.
- Обеспечивают мышей с обезболивающим согласно требованиям IACUC учреждения для контроля боли. Например администрировать бупренорфин подкожной инъекции каждые 8-12 ч в течение 48 часов постоперационно если повреждение почек, связанных с НПВП следует избегать для изучения.
- Держать мышь на огне площадку и присутствовали следователь пока полностью мобильная с грудной recumbency. Когда полностью восстановился, возвращение мышей в клетку чистой, содержащие небольшое количество кроватей из их дома клетке, чтобы уменьшить стресс. Сделать не домовых мышей подвергали хирургии с наивными мышей.
Примечание: Состояние мышей будут быстро улучшить, появляясь иметь нормальное поведение в течение 24-48 ч. - Дать соленой жидкости и увеличение анальгезии мышей, которые появляются подчеркнул для улучшения их состояния. Если мышь не быстро восстановиться, измерить вес мыши и усыпить мышей, которые потеряли больше, чем 20% от их первоначального веса. Усыпить мышей появляются уремический или иным образом умирающей. Проблемы со здоровьем можно подробно изложены в таблице 1.
Примечание: Мышь иногда удалить их внешние швы или швы соскользнул до закрытия раны. Бедные ушивание мышечных слоя с неповрежденной кожи слой может привести к грыжи на участке разреза, обозначается выпуклые. В таких случаях, поместите курсор мыши под наркозом (изофлюрановая быстрее, чем кетамин/Ксилазина) и ремонт хирургического сайт с новым швы как можно скорее. Если кожа не рассасывающиеся швы остаются после 10-14 дней, удалите их. Иногда мышей может удалить их клетке товарищей швами или бороться. Удаление агрессора мышей к их клетке с обогащением для предотвращения их от причинения вреда другим мышей, как только такое поведение определяется. - По достижении здоровья или экспериментальных конечные точки усыпить мышей Вдыхание углекислого газа или передозировки изофлюрановая следуют вторичный метод эвтаназии как шейки матки дислокации согласно Стандартная операционная процедура эвтаназии в место в учреждении
| Причина | Начало | Количество пострадавших мышей | Симптомы | Незамедлительных действий | Долгосрочное решение | ||
| ДНК содержится эндотоксинов | 6-40 ч после инъекции. | Может повлиять на каждой мыши, загрязненных подготовки ДНК. | Проблемы с дыханием, признаки полиорганной недостаточности, смерть, сильная боль. | Усыпить пострадавших мышей. Проверьте каждый введенный компонент для эндотоксинов с Limulus амебоцит Lysate. | Используйте бесплатно эндотоксинов maxiprep комплекты и только стерильные и новой или NaOH рассматриваться лабораторное оборудование. Используйте коммерчески приобретенных, эндотоксинов тестирование буфер для разбавления ДНК. | ||
| Передозировки анестезии | Во время операции, либо до, либо после инъекции ДНК. | Может повлиять только младший, меньших или компактной мыши. | Прекратить дыхания на грелку, мочеиспускание. | Снижение анестезии для остальных мышей. | Перепроверить подготовка и протокол для точности дозировки. Исключить «runts.» Проконсультироваться с ветеринаром, если соответствующие дозы. | ||
| Воздушный пузырь в шприц или иглы, используемые для инъекций | Сразу же после инъекции почечной лоханки. | Если все шприцы были загружены небрежно, это влияет только на один мышь. | Задыхаясь. | Проверьте остальные шприцы для признаков воздушных пузырьков. | Подготовьте шприцы тщательно, выстукивать шприц для удаления пузырьков в нижней части. Улучшение условий освещения лучше визуализировать пузыри. | ||
| Открытие хирургической сайта | 12-72 ч после инъекции | Один или несколько мышей. Иногда вся клетка. | Зияющую рану, обычно не другие бедствия | Повторите, сшивающие для ремонта раны тщательно под изофлюрановая наркозом с стерильных. Может потребоваться орошения с соленой или удалить границы раны с ножницами. | Если все мыши имеют очень короткий или отсутствуют швы, может быть один мышь, удаляя их, так что мыши могут быть разделены. Совершенствовать технику наложения шва. Использование независимых knots. | ||
| Грыжа в месте операции | 48 + h впрыск | Один или несколько мышей. | Курган видна в месте операции. | Под изофлюрановая наркозом с стерильных вырежьте исцелил кожа раскрыть грыжа мышц слоя. Заменить органов брюшины, ремонт мышцы слой с рассасывающиеся швы и закрыть сайт. | Это указывает на бедных ушивание мышц слоя. Совершенствовать технику наложения шва. Использование независимых knots. | ||
| Почечная недостаточность | 48 + h впрыск | Один или несколько мышей. | Вес Потеря > 20%, возможно стать уремический, сгорбившись осанки | Предоставить физиологического раствора и увеличить или продлить анальгезии. Если улучшения не наблюдается, пожертвуйте пострадавших мышей. | Изменять состояние болезни животных, чтобы сделать его менее серьезными. Измените трансген менее сильным или индуцибельной. Придать мышей на ранее timepoint в прогрессирования заболевания. | ||
| Нарыв или инфекции | Дней до нескольких недель после операции | Один или несколько мышей. | Ощутимая нарыв или признаков сепсиса | Усыпить пострадавших мышей. Вскрытие запрос для подтверждения подозреваемых инфекции. | Это может произойти, когда хирургические условия и инъекции стерильны не достаточно. Процедура показана для мышей с нормальной иммунной системой, но далее должны приниматься меры предосторожности в параметре ослабленным животных таких лечить с циклофосфамидом. | ||
Таблицы 1. Таблица потенциальных проблем здравоохранения, возникающих во время инъекции протокол почечной лоханки. Хотя перечисленные заболевания не являются общими, существует ряд ошибок, связанных с следователя, которые могут возникнуть в ходе процедуры. Эта таблица может быть помощь в профилактике и диагностике проблем здравоохранения, а также для осуществления возможных средств правовой защиты для предотвращения подобных проблем в будущем. С практикой следователи должны ожидать проблемы редко здоровья и смертности вследствие процедуры.
3. оценить эффективность и трансген эффекты инъекций
- Используйте развитую assay для желаемого трансген оценить эффективность трансфекции. Используйте положительной и отрицательной контроля внимательно, чтобы убедиться, что анализ конкретных.
Примечание: В зависимости от выбора промоутер, мышей вероятно, будет иметь сильные трансген выражение на 1 день; всегда в течение первой недели после инъекции. - Выполните живых животных изображений Люцифераза, представляя 10 мкг Люцифераза выражая плазмида, например расширенной Светлячок Люцифераза разреженных ДНК для инъекций.
- Очистите все поверхности подвергаются мышей. Первые клетки мышей в камеру и печать он закрыт. Убедитесь, что есть достаточно изофлюрановая для эксперимента, проверяя Гейдж; Если нет, добавьте изофлюрановая до тех пор, пока уровень достигает линии «Макс». Инициировать процесс изофлюрановая, повернув ручку изофлюрановая 3.5 и кислорода к 2.
- Придать каждой мыши внутрибрюшинной инъекцией с 100 мкл люциферин талой 30 мг/мл. Рекордное время.
- Открытое программное обеспечение для управления машиной изображений, нажав на значок мыши оранжевый и желтый. В разделе «Выберите/Add User ID,» выберите правильный инициалы из в раскрывающемся меню рядом с «Имя пользователя» Нажмите кнопку «ОК». На верхней строке меню нажмите кнопку «Приобретения» и выберите из раскрывающегося меню «Автосохранение для...». Выберите папку или создайте новую папку для сохранения данных.
- Перейти в поле приобретения изображения в правом нижнем углу. Убедитесь, что автоматические настройки следующим образом: биннинга, средний; F/Stop, 1 для люминесцентных, 8 для фотографий; Фильтр выбросов, открытым; Режим визуализации, проверяет рядом с люминесцентные, фотография, оверлея и выравнивание только. Выберите «инициализировать» для инициализации системы и ожидания инициализации до конца, а затем изменить «Поле зрения» на «E» для изображений пять мышей.
- Поверните клапан для анестезии трубки, таким образом, что nosecones внутри машины управляющими изофлюрановая. Место животных внутри изображений машины в нужном порядке на их желудки с их спиной, стоящих перед камерой, чтобы визуализировать почки. Если более чем одна клетка должна быть imaged, поместите следующий Кейдж в изофлюрановая камеру.
- 5-10 мин после инъекции люциферин, нажмите «Получить» взять образ.
- На «Палитре» на правой стороне нажмите «Настроить изображение.» Под «Цветовая шкала,» уменьшите панель «Min» до тех пор, пока выражение проявляется в всех ожидаемых мышей, визуализируется как фиолетовый над каждой мыши почки. Если любой мышей не показывать выражение, reinject мышей с 100 мкл люциферин и ждать нового получения по крайней мере 3 мин.
- Если изображение имеет насыщенный пикселей, уменьшить время экспозиции и обрести для получения количественных изображения, как присутствие насыщенных пикселей приведет к недооценке эффективность трансфекции. Самые низкие возможные Выдержка составляет 0,5 s.
- Если на изображении показана только слабый ген выражение на первое время экспозиции, увеличьте время экспозиции до 2 мин и reacquire. Каждый раз, когда изображение будет отбит, данные являются autosaved в выбранной папке, поэтому все изображения доступны для дальнейшего анализа позже.
- Повторите шаги с изображения для последующего клетки мышей.
- Удаление мышей из изображений машины. Выключите газ. Очистки камеры, nosecones и визуализации стадии. Закройте в компьютерную программу.
Примечание: Программа будет просить, чтобы «Сохранить набор данных». Это относится к манипуляции, внесенных в dataset, не сами данные.- Нажмите «Да», чтобы сохранить изменения в масштабах и регионы интереса (ROI). Нажмите кнопку «Нет», чтобы вернуться к исходные параметры для изображений.
- Для анализа данных откройте программное обеспечение. На палитре «Инструмент» нажмите «ROI инструменты.» Щелкните значок круга и нажмите «1» в раскрывающемся меню разместить новый ROI в окне изображения, как указано в красный овал с четырех квадратов вокруг него. Отрегулируйте размер Руа, поместив курсор мыши над Красной площади и перетащив препроводить фиолетовый зона, наложение вводят почек.
- С помощью курсора над Красной площади на ROI щелкните правой кнопкой мыши, а затем выберите «Дублировать ROI» для создания новой ROI в окне изображения и переместить его к следующему мыши. Повторите процедуру до тех пор, пока все мыши на изображении имеют ROI вводят почек.
- В меню изображение выше измените «Единицы» от «Счетчиков» на «Сияние (фотонов).» Чтобы экспортировать данные ROI, в палитре «Инструмент» нажмите «ROI инструменты», а затем нажмите на значок карандаша/правитель для создания таблицы измерений. Используйте «Avg сияние» измерение дальнейшего анализа в программе статистики и анализа данных по выбору.
- Выполняют окрашивание участков как описано11.
Примечание: Инъекции не transfect весь почка одинаково так различные разделы будет захватить различные трансфекции эффективность11. Совместное инъекций бисера как флуоресцентные Латексные микросферы может помочь определить регионы, как ожидается, будет трансген позитивные (рис. 3D)11. Оптимизации окрашивание протокола является чрезвычайно важным. - Выполняйте западную помарку для идентификации гена интереса в transfected почек.
Примечание: Урожай органов для выдержки белка должно быть сделано на льду. Опять же не использовать небольшой кусочек органа в этой области может не было transfected хорошо. Трансфекция распределяется неравномерно по всей орган так объединить различные области и объединить их. Почечной лоханки гидродинамических инъекции плазмида производит гормон эритропоэтин привели к скромным увеличением гематокрита, поэтому ожидается, что выделяется трансген продукции должно быть найдено в циркуляции11. - Для долгосрочной высокого уровня выражения трансгенов объединить систему интеграции вектор с иммуносупрессивные агентов, таких как циклофосфамид. Иммунный ответ на трансген происходит в течение первых нескольких недель после инъекции и надежные11.
Результаты
Хирургии и инъекций техника просты для выполнения как только освоил, требуя не основного оборудования или дорогостоящих материалов. Если новой для операцию почки фланг разрез, один учебный день на нескольких мышей, запланированных для эвтаназии должны быть разрешены...
Обсуждение
В этом протоколе описывается надежный метод для достижения экспрессии генов воспроизводимые специально в почках. В руках умеренно опытный хирург мы нашли процент transfected на эту технику, чтобы быть в диапазоне 50-100%, в зависимости от возраста мыши и чувствительность индикация трансген мы?...
Раскрытие информации
Авторы не имеют ничего раскрывать и объявить никакого конфликта интересов.
Благодарности
Премию развития карьеры от Департамента по делам ветеранов [BX002797] поддерживает L.E.W. и национальных институтов здравоохранения [R01-DK095867] и Американской ассоциации сердца [15GRNT25700209] ж.к. Поддержка национальных институтов здравоохранения [DK093660], Департамент по делам ветеранов [BX002190] и Вандербильта центр по болезни почек M.H.W. Этот материал является результатом работы поддерживаемых ресурсов и использования объектов в системе здравоохранения долины ва Теннесси.
Материалы
| Name | Company | Catalog Number | Comments |
| AnaSed Xylazine | Patterson Veterinary | 07-808-1947 | Anesthetic - Not controlled substance |
| BD Insulin Syringe 0.5 mL 29G 1/2 Inch | Cardinal Health | 309306 | Required syringes |
| Buprenex | Pharmacist/Veterinarian | Analgesia - Controlled Substance | |
| Dynarex Disposable Towel Drape | Thermo Fisher Scientific | 19-310-671 | Place over heat pad |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | Use only endotoxin-free plasmid DNA |
| Endosafe Gel-Clot LAL Rapid Positive Control | Charles River | PC200 | Positive control for endotoxin test |
| Endosafe Gel-Clot LAL Rapid Single Test Vial | Charles River | R13500 | Endotoxin test |
| Extra Fine Micro Dissecting Scissors | Roboz Surgical Instrument | RS-5882 | Surgical tool |
| Fisherbrand Instant Sealing Sterilization Pouch - 9" | Thermo Fisher Scientific | 01-812-51 | For autoclaving surgical tools |
| Gaymar Heat Pump | Paragon Medical | TP-700 | Water-circulating heat pump |
| Germinator 500 | Roboz Surgical Instrument | DS-401 | To reuse surgical tools during surgery |
| Graefe Forceps | Roboz Surgical Instrument | RS-5136 | Surgical tool |
| Graefe Tissue Forceps | Roboz Surgical Instrument | RS-5153 | Surgical tool |
| Halsey Needle Holder, 5" Length | Roboz Surgical Instrument | RS-7841 | Surgical tool |
| Heat pads - 15" x 21" - need at least 3 | Paragon Medical | TP22G | For use with Gaymar Heat Pump |
| IsoFlo (Isoflurane, USP) | Abbott Animal Health | 5260-04-05 | For imaging and euthanasia |
| Isotec Isoflurane Delivery System Vaporizor | Smiths Medical | VCT3K2 | For imaging and euthanasia |
| Ketamine | Pharmacist/Veterinarian | Anesthetic - Controlled Substance | |
| Kimwipes | Kimberly-Clark Professional | 34120 | Laboratory tissues |
| Living Image software | Caliper Life Sciences | For live animal imaging | |
| Luciferin | Perkin Elmer | 122796 | For live animal imaging |
| Nanodrop 2000 | Thermo Scientific | ND-2000-US-CAN | Spectrophotometer for DNA measurement |
| Prevantics Swabs | Thermo Fisher Scientific | 23-100-110 | For skin surgery prep |
| Prolene 5-0 sutures Taper 30" | Thermo Fisher Scientific | NC0256891 | Non-absorbable sutures for skin |
| Puralube Brand Opthalmic Ointment | Patterson Veterinary | 07-888-2572 | To keep eyes moist during surgery |
| Trans IT - QR Hydrodynamic Delivery Solution | Mirus Bio | MIR-5240 | Hydrodynamic delivery buffer for diluting DNA |
| Vicryl 5-0 Sutures J303H | Thermo Fisher Scientific | NC9816710 | Absorbable sutures for muscle layer |
| Wahl Mini Arco Clipper | Med-Vet International | 8787-1550 | Shaver for skin prep |
| Xenogen IVIS 200 | Caliper Life Sciences | For live animal imaging |
Ссылки
- Liu, F., Song, Y., Liu, D. Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA. Gene Ther. 6 (7), 1258-1266 (1999).
- Zhang, G., Budker, V., Wolff, J. A. High levels of foreign gene expression in hepatocytes after tail vein injections of naked plasmid DNA. Human Gene Therapy. 10, 1735-1737 (1999).
- Fumoto, S., Nishimura, K., Nishida, K., Kawakami, S. Three-Dimensional Imaging of the Intracellular Fate of Plasmid DNA and Transgene Expression: ZsGreen1 and Tissue Clearing Method CUBIC Are an Optimal Combination for Multicolor Deep Imaging in Murine Tissues. PLoS One. 11 (1), e0148233 (2016).
- Yoshino, H., Hashizume, K., Kobayashi, E. Naked plasmid DNA transfer to the porcine liver using rapid injection with large volume. Gene Ther. 13 (24), 1696-1702 (2006).
- Kamimura, K., Suda, T., Xu, W., Zhang, G., Liu, D. Image-guided, lobe-specific hydrodynamic gene delivery to swine liver. Mol Ther. 17 (3), 491-499 (2009).
- Kamimura, K., Zhang, G., Liu, D. Image-guided,intravascular hydrodynamic gene delivery to skeletal muscle in pigs. Mol Ther. 18 (1), 93-100 (2010).
- Suda, T., Liu, D. Hydrodynamic gene delivery: its principles and applications. Mol.Ther. 15 (12), 2063-2069 (2007).
- Alino, S. F., et al. Naked DNA delivery to whole pig cardiac tissue by coronary sinus retrograde injection employing non-invasive catheterization. J Gene Med. 12 (11), 920-926 (2010).
- Suda, T., Gao, X., Stolz, D. B., Liu, D. Structural impact of hydrodynamic injection on mouse liver. Gene Ther. 14 (2), 129-137 (2007).
- Skrypnyk, N. I., Harris, R. C., de Caestecker, M. P. Ischemia-reperfusion model of acute kidney injury and post injury fibrosis in mice. J Vis Exp. (78), (2013).
- Woodard, L. E., et al. Kidney-specific transposon-mediated gene transfer in vivo. Sci Rep. 7, 44904 (2017).
- Liang, A., et al. Loss of glutathione S-transferase A4 accelerates obstruction-induced tubule damage and renal fibrosis. Journal of Pathology. 228 (4), 448-458 (2012).
- Liang, M., et al. Protective role of insulin-like growth factor-1 receptor in endothelial cells against unilateral ureteral obstruction-induced renal fibrosis. Am J Pathol. 185 (5), 1234-1250 (2015).
- Corridon, P. R., et al. A method to facilitate and monitor expression of exogenous genes in the rat kidney using plasmid and viral vectors. Am J Physiol Renal Physiol. 304 (9), F1217-F1229 (2013).
- Wallace, D. P., et al. Tracking kidney volume in mice with polycystic kidney disease by magnetic resonance imaging. Kidney Int. 73 (6), 778-781 (2008).
- Woodard, L. E., Wilson, M. H. piggyBac-ing models and new therapeutic strategies. Trends Biotechnol. 33 (9), 525-533 (2015).
- Yeikilis, R., et al. Hydrodynamics based transfection in normal and fibrotic rats. World J Gastroenterol. 12 (38), 6149-6155 (2006).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. (41), (2010).
- Wooddell, C. I., et al. Muscle damage after delivery of naked plasmid DNA into skeletal muscles is batch dependent. Hum Gene Ther. 22 (2), 225-235 (2011).
- Crespo, A., et al. Hydrodynamic liver gene transfer mechanism involves transient sinusoidal blood stasis and massive hepatocyte endocytic vesicles. Gene Ther. 12 (11), 927-935 (2005).
- Rocca, C. J., Ur, S. N., Harrison, F., Cherqui, S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Ther. 21 (6), 618-628 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены