A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הזרקת hydrodynamic אגן הכליה נגיפי ביטוי של חלבונים בתוך הכליה.
In This Article
Summary
פרוטוקול זה מתאר שיטה להחדיר פלסמיד DNA לתוך הכליה העכבר באמצעות אגן הכליה כדי לייצר transgene ביטוי במיוחד בתוך הכליה.
Abstract
הזרקת hydrodynamic יוצר סביבה מקומיים, בלחץ גבוה כדי transfect רקמות שונות עם דנ א פלסמיד וחומרים אחרים. הזרקת וריד הזנב hydrodynamic, לדוגמה, היא שיטה ומבוססת שבאמצעותו יכול להיות transfected הכבד. כתב יד זה מתאר יישום של עקרונות hydrodynamic על ידי הזרקה של הכליה העכבר ישירות עם פלסמיד הדנ א על ביטוי גנים ספציפיים כליות. עכברים הם מרדימים, הכליה נחשף על ידי חתך האגף ולאחריה זריקה מהירה של פלסמיד פתרון ה-DNA המכיל ישירות לתוך אגן הכליה. המחט הוא שמר על המקום לעשר שניות, מקום החתך מאוחה. למחרת, לחיות הדמיה בעלי חיים, תספיג או אימונוהיסטוכימיה עשוי לשמש assay ביטוי גנים או אחרים מבחני מתאים את transgene של בחירה משמשים לגילוי של החלבון עניין. שיטות שפורסמו להאריך ביטוי גנים כוללים אינטגרציה transgene בתיווך transposon וטיפול ציקלופוספמיד כדי לעכב את התגובה החיסונית כדי transgene.
Introduction
טכניקת ההזרקה של וריד הזנב hydrodynamic הפך נפוץ דרך כדי להשיג רמות גבוהות של ביטוי גנים העכבר הכבד1,2. הכליות הן גם transfected באמצעות הטכניקה הזו ברמה יותר נמוכה, כ 100-fold פחות3. הזרקת hydrodynamic אגן הכליה המתוארים כאן מספק דרך פשוטה כדי לשלוט יחודיות של איברים ביטוי באמצעים פיזיים, באמצעות אותם עקרונות hydrodynamic שהוקמו בעבר כבד4,5 , שרירים6ו-7,8אחרים איברים. שיטה זו transfects תאים בעלי חיים ויוו באמצעות לחץ ותוקנו מהירות כדי לאלץ את ה-DNA המכיל נוזל לתוך התאים, בו זמנית גרימת נזק לאיבר זה במהירות9. באמצעות טכניקות ניתוחיות ומבוססת להמחיש את הכליה דרך החתך האגף10 יחד עם זריקה אחת על ידי מזרק אינסולין, מצאנו תקנים מוצלחת של סוגים שונים של תאי הכליה, בעיקר interstitial fibroblasts, בקוריאנית, צינור איסוף11. דיסקציה של עכברים אלה הראו כי איברים אחרים הם לא transfected ברמה גבוהה מספיק כדי להמחיש מאת לוציפראז הדמיה טכניקות11. מאז הטכניקה היא נגיפי, השימוש פלסמיד DNA עבור תרביות תאים מאפשרת הכנה קלה ומהירה של ריאגנטים הנדרש להזרקה.
השתמשנו זריקות hydrodynamic מקומי להביע גלוטתיון נוגד חמצון S-טרנספראז A4 הקולטן 1 פקטורי גדילה דמויי אינסולין, את אריתרופויאטין ההורמון בכליה, כולם בעלי השפעות ביולוגיות הצפוי11, 12 , 13. הערכה מפורטת של התוואי של המינהל, נפח הזרקה, מינון ה-DNA, יזם הבחירה היה שבוצעו11. בנוסף, שתי piggyBac transposon מערכת ו/או ציקלופוספמיד הטיפול לדכא את התגובה החיסונית transgene כבר הראו לשפר לטווח ארוך ג'ין ביטוי תוצאות11. חוקרים אחרים יש להשתמש בגישה וריד הכליה לעכבר עם הצלחה, השגת יעילות גבוהה תקנים עבור פרקי זמן של יותר מ חודש14. עם זאת, תיקון גנטי של פנוטיפים מחקה מחלות אנושיות בדרך כלל מבוצעות בעכברים לראשונה כמושג הוכחה-של-מאחר ביותר בתרבית של דגמים גנטיים הם מודלים העכבר. אנו לעומת הזרקה וריד הכליה אל אגן הכליה הזרקה, נמצא כי הזרקה לתוך האגן הכליה סופריור לוריד הכליה על ביטוי גנים (כ כוחנו גבוה) והישרדות11. אגן הכליה הוא מסלול אידיאלי של הערך לתוך הכליה כי זה גמיש מספיק לסבול תנודות ייצור השתן, והוא לעיתים קרובות מסוגל לשמור המבנית שלו גם כאשר התרחבו במהלך hydronephrosis. בנוסף, הזרקה לתוך האגן הכליה איפשרה גישה הכליה ללא פירסינג הקפסולה כליות, המאפשר את הנוזלים מוזרק בעליל יישמרו על ידי הכליות טוב יותר intraparenchymal הזרקת. איברים אחרים העכבר אין מסלול של ערך אחר מאשר להערכת, אבל המרחב השתן של הכליה הוא אתר אידיאלי הזרקה. בנוסף, זריקה לווריד כליות כתוצאה דליפה של דם לתוך חלל הבטן. עוצמת כליות מוחלטת פראי-סוג העכבר הכליות הוערך על ידי תהודה מגנטית יהיה כ 0.2 ס מ3, אז הנפח של כליה אחת שווה בקירוב כמות הנוזלים מוזרק על ידי רופא אגן הכליה hydrodynamic הזרקה (100 µL)15. במסמך זה, עשינו זמין לכל הניואנסים מפורט של פרוטוקול הזרקת hydrodynamic אגן הכליה להשגת תקנים לשחזור של הכליה.
Protocol
כל השיטות המתוארות כאן אושרו על ידי טיפול בעלי חיים מוסדיים ו שימוש ועדות (IACUCs) של ביילור לרפואה, המרכז הרפואי של אוניברסיטת ונדרבילט.
1. מכינים את הפתרון DNA להזרקה
- בחר את plasmid(s) כדי לבטא את transgene(s) בקפידה כדי למקסם את מאפייני רצוי לשפר את יעילות תרביות תאים transgene הביטוי.
הערה: אגן הכליה Hydrodynamic הזרקה של פלסמידים לבטא את סמן פלורסנט TdTomato, הורמון אריתרופויאטין (Epo) ו גחלילית לוציפראז כבר שתואר לעיל11. אם לא וזמינותו מפותח ליעילות תקנים עבור transgene, לבצע הדמיה בעלי חיים חיים של לוציפראז על ידי החדרת µg 10 של הבעת לוציפראז פלסמיד כגון משופרת גחלילית לוציפראז הדי מדולל להזרקה.- בחר את פלסמיד הקטן ביותר זה מעשי ליישום.
הערה: פלסמידים קטן transfect בדרך כלל התאים יותר גדול פלסמידים. לדוגמה, ג'ין ההתנגדות zeomycin R6K מקור שכפול הם קטנים, כך ניצול אלה רכיבי עמוד השדרה פלסמיד תגרום להקטנת גודל פלסמיד. - לבטא את transgene של מקדם יונקים.
הערה: כליה סוג התא transfected, אורך של ביטוי גנים, והעוצמה של ביטוי גנים כל יושפעו על-ידי בחירת יזם. ראה וודוורד ואח. להשוואה של cytomegalovirus (CMV; מכוננת ויראלי), התארכות מקדם-1 אלפא (EF-1α; מכוננת אנדוגני), טרנספראז גמא-glutamyl (γGT; צנורית ספציפי) ו- podocin (NPHS2; podocyte ספציפי)11. - מעסיקים מערכת שילוב נגיפי כגון טרנספוזונים אם גבוה יותר רמות ביטוי גנים לטווח הארוך רצוי11,16. ללימודים עם מוקדם המפרט פחות מ- 5 ימים לאחר ההזרקה, שילוב transgene אינה נחוצה.
- בחר את פלסמיד הקטן ביותר זה מעשי ליישום.
- להכין דנ א פלסמיד הזרקת באמצעות שיטה מסחרי כגון ערכת אנדוטוקסין ללא maxiprep. בזהירות להימנע מהחדרה endotoxins באמצעות מכשור מעבדתי.
הערה: נוכחות של endotoxins בפתרון ה-DNA מביאות לתגובה החיסונית חמורה בהחיה הנושא, להתפשר על הניסוי, אולי הרגו את החיה.- בתום השלב האחרון של שטיפת בידוד ה-DNA, ודא שאתנול לא נשאר על ידי בדיקה ויזואלית של ריח. השתמש בעצות העמסה ג'ל להסרת טיפות לעין. יבש הצינורות המכילים בגדר DNA במהופך על מעבדה רקמות של מגב המשימה העדינה בטמפרטורת החדר או בתנור שחומם 37-60 מעלות עם ניטור מתמיד. Resuspend בגדר מיד לאחר אתנול שיורית התאדו כדי למנוע overdrying של בגדר.
הערה: אתנול שיורית משבשת קריאת ספקטרופוטומטרים ריכוז הדנ א, מבוא הכליה אינו רצוי. - Resuspend בגדר DNA במאגר אותו כפי לצרכי בהזרקה (מאגר משלוח hydrodynamic; µL 100-300) כדי להגביל את הוריאציה ההרכב הכימי של הפתרון מאגר ה-DNA בין קבוצות.
הערה: לא resuspend בגדר DNA בפתרון מאגר • תנאי שמגיע עם הקיט. מכלט EDTA נפוץ למצוא "טה" מאגר ההכנות עשוי להשפיע על הכליה ותפקוד הלב וכלי הדם. תלוי בגודל גלולה, elute ב 100-300 µL משלוח hydrodynamic מאגר להשגת ריכוז גבוה. הריכוז הסופי של ה-DNA בדילול מלא יהיה בין 100 ng/µL (מנה µg/עכבר 10) ל 500 ng/µL (מנה µg/עכבר 50) אז ריכוז הדנ א המניה יעלה את זה. - מלא resuspend בגדר DNA במאגר. השאירו את צניפה משלוח hydrodynamic מאגר של הצינור המקורי בטמפרטורת החדר במשך לפחות שעה או ללילה ב 4 ° C לפני העברת צינור microfuge סטרילי כדי להבטיח כי ה-DNA היא התפרקה לחלוטין.
- קרא את ריכוז הדנ א פלסמיד ספקטרופוטומטרים או בשיטה ותיקה אחרת.
הערה: קריאות צריך להיעשות על כפילות עם משכפל נוסף במידת הצורך. אם היחס 260/280 מתחת 1.8, הכנת מזוהם עם RNA או חומר אחר אז למחוק אותו, להכין את ה-DNA. - חנות פלסמיד DNA resuspended במאגר הזרקת ב-20 ° C בתוך קופסא ב מדריך מפשירים למקפיא כדי למנוע השפלה של ה-DNA.
הערה: המאוחסנים בדרך זו, הכנת ה-DNA יחזיק מעמד במשך שנים רבות. לבדוק את תקינות ה-DNA על ידי הגבלת agarose ושל תקציר בג'ל. הדנ א הוא מרוח במורד הסמטה פחתה ולא ניתן להשתמש בעוד DNA מפיקה חדות להקות של הגודל הנכון ניתן תמורת הזרקת.
- בתום השלב האחרון של שטיפת בידוד ה-DNA, ודא שאתנול לא נשאר על ידי בדיקה ויזואלית של ריח. השתמש בעצות העמסה ג'ל להסרת טיפות לעין. יבש הצינורות המכילים בגדר DNA במהופך על מעבדה רקמות של מגב המשימה העדינה בטמפרטורת החדר או בתנור שחומם 37-60 מעלות עם ניטור מתמיד. Resuspend בגדר מיד לאחר אתנול שיורית התאדו כדי למנוע overdrying של בגדר.
- להכין את פתרון ה-DNA פלסמיד מדולל להזרקה לתוך האגן הכליה.
הערה: שקול שליטה קבוצות בקפידה. למחקרים רבים, תמים ומאגר מוזרק בלבד הפקדים הינם כלולים כי הזריקה עצמה גורמת נזק עלול להשפיע על תוצאות הניסוי11.- מפשירים את הדנ א. ללא אנדוטוקסין eluted במאגר משלוח hydrodynamic בטמפרטורת החדר על הספסל.
- חישוב הסכום של ה-DNA לצורך הזריקות ולהכין את ה-DNA מדולל עבור כל קבוצה. לנהל 10-50 µg של פלסמיד דנ א הביא הנפח הכולל של 100 µL עם משלוח hydrodynamic מאגר לכל העכבר.
הערה: לדוגמה, החישובים להחדיר 3 עכברים µg 10/עכבר של פלסמיד ה-DNA זה יש ריכוז של µg 0.5/µL הם כדלקמן.- להכין מספיק פתרון ה-DNA יש נוספת עבור טעינת מזרקים של שטח מת במחט כ- 20%. עבור 3 עכברים, להכין תערובת 3.5 x. לחשב את המסה של הדנ א ב µg זה צריך להיות הפתרון. כאן זה יהיה µg 10 x 3.5 = 35 µg.
- לחשב את הנפח הכולל של הפתרון הרצוי עבור שהזרקת µL 100 לכל העכבר. במקרה זה, זה יהיה µL 100 x 3.5 = 350 µL הנפח הכולל.
- חישוב הנפח של מניות פלסמיד דנ א כדי להוסיף הפתרון. במקרה זה, זה יהיה 35 µg / 0.5 µg/µL = 70 µL של מניות פלסמיד ה-DNA.
- חישוב הנפח של המאגר כדי להוסיף פתרון ה-DNA מדולל על-ידי הפחתת כמות מניות דנ א הוסיף (שלב 1.3.2.3) מ הנפח הכולל של מדולל הדנ א הרצוי (שלב 1.3.2.2). במקרה זה, זה יהיה µL 350 - 70 µL = 280 מאגר משלוח hydrodynamic µL.
- להכין פתרונות צינורות סטרילי microfuge באמצעות המסנן זמין מסחרית פיפטה טיפים סטרילי טכניקה על הספסל מעבדה.
הערה: פתרונות ה-DNA עשוי להיות מוכן ומאוחסנים בטמפרטורת החדר לזריקות מוגדר להתרחש באותו היום. לא להחדיר את עכברים עם פתרון קר כמו זה יוריד לך את טמפרטורת הגוף שלהם, אבל ההתחממות היא מיותרת.
2. לבצע את הניתוח הזרקת hydrodynamic אגן הכליה
- בחר עכברים בקפידה לניתוח.
הערה: זן ספציפי הבדלים עדיין לא נצפו אך ייתכן שניתן. רוב זריקות כבר על C57BL/6 או רקעים FVB. זריקות אגן הכליה פועלות בצורה הטובה ביותר בעכברים כי הם בני 6-12 שבועות. בעכברים גדול מ- 16 שבועות, עד שיעור של 50% כישלון מאת לוציפראז הדמיה אפשרי מסיבות לא ברורות. באותו קצב הקשורות לגיל כשל נצפתה לזריקות וריד הזנב hydrodynamic אל הכבד, אז זה יכול להיות מגבלה כללית הנוגעים לעקרון של הזרקת hydrodynamic. ובאותו עניין, אחרים הראו כי הזרקת וריד הזנב hydrodynamic לתוך הכבד עכברוש שהותירה אינה יעילה כמו בכבד, ולכן יהיה אפשרי זה בהגדרות של כליות פיברוזיס הזריקה hydrodynamic אגן הכליה לא יהיה יעיל, אבל זה לא היה נבדק ישירות17. - להתכונן לניתוח עכברים ומזרקים הדנ א.
- עזים ומתנגד העכברים עם קטמין, חריגות השירותים הווטרינריים.
- לשים על ציוד מגן אישי המתאים הנדרש על-ידי המתקן בעלי חיים, כגון סינר חד פעמי מעבדה, מסיכת פנים כירורגית nitrile כפפות.
- עבודה עם 2-4 עכברים בבת אחת, שוקלים כל עכבר ב גביע פלסטיק 500 מ"ל בקנה מידה מדויקת כדי 0.1 g. לחשב את הסכום הנכון של 24 מ"ג/מ"ל קטמין ו- 2 מ"ג/מ"ל חריגות השירותים הווטרינריים מדולל ב- 0.9% תמיסת כדי לנהל את כל העכבר באמצעות הזרקת בקרום הבטן (ראה וידאו שאליו בוצעה הפניה למידע נוסף על הזרקת בקרום הבטן) 18. להשתמש בנוסחה (50 µL + ((5 µL) x (משקל (g))), או לחלופין לחשב לפי נוסחה אחרת לאחר התייעצות עם הווטרינר הצוות והן IACUC.
- להזריק את העכבר באמצעות הזרקת בקרום הבטן על ידי טכניקות סטנדרטי. הנח את העכבר בדלי נייר עד העכבר יהיה משותק.
הערה: עכברים הם מוכן לניתוח כאשר הם כבר לא להגיב כדי לבדוק את הבוהן-קורט. עכברים לתת ממשיכים להגיב על הבוהן-בלחץ מבחן 20-30 דקות אחרי הזריקה הראשונית 20-60 µL הרדמה יותר, בהתאם לעוצמת התגובה. - המקום העכבר על משטח חום מים-שהופץ מכוסה עם משטח כחול, המקום משחה הוטרינר בשתי העיניים כדי למנוע לייבוש הקרנית.
- לגלח בצד שמאל של הגב של העכבר מהכתפיים ועד עכוז האגף לעמוד השדרה מכונת הגילוח המיועדת לטפח לחיות מחמד. הסרת שיער חופשי ופסולת.
- להכין מזרק נפרד המכיל 100 µL של DNA מדולל על העכבר anesthetized כל, לוודא שאין אין בועות אוויר.
- השתמש 29G סטרילי x ½" 0.5 mL U-100 אינסולין מזרק עם מחט לצמיתות המצורפים ללא ביטחון.
הערה: הסוג המזרק יש חשיבות קריטית. מד זה מאפשר זריקה מהירה. המחט לצמיתות המצורפים מונעת את הפתרון דולף החוצה. נוכחות של ביטחון לעכב גישה אגן הכליה. תארגן את הדברים שצוינו בטבלה חומרים החליקו באופן אחיד יותר במהלך ההזרקה מאשר מותגים אחרים שנבדקו. - לטעון את המזרק כדי µL ~ 120, לנתץ את הבוכנה ליצור מרחב בחלק העליון. הקש על עט עד כל אוויר בועות העלייה לפסגה. מעכב את המחט בקפידה את הבוכנה כדי להסיר את כל האוויר עד droplet טפסים בקצה המחט. שם לא צריך להיות נוכח, בועות גלוי כמו אלה עלול לגרום סבל מתסחיף אוויר שיהרוג את החיה.
- סיום מדכא על הבוכנה עד שיש 100 µL במזרק המרוקן את פתרון ה-DNA עודף לתוך הצינור microfuge המקורי. בזהירות תווית במידת הצורך ומניחים את מזרקים טעון על תלוי סטרילי כדי לשמור על עקרות אם המתקן שבו מתבצעת העבודה אינו מאפשר נסכם את מחטים.
- השתמש 29G סטרילי x ½" 0.5 mL U-100 אינסולין מזרק עם מחט לצמיתות המצורפים ללא ביטחון.
- עזים ומתנגד העכברים עם קטמין, חריגות השירותים הווטרינריים.
- לבצע ניתוח הזרקה.
- הכינו את האתר לניתוח. המקום סטרילי תלוי על משטח חום ועל כלי ניתוח סטרילי ריק על גבי הכיסוי ותאבטחי סטרילי מבלי לגעת בהם. הרם את העכבר ולמקם אותו שדה הראייה. להתאים את התאורה להאיר את האזור.
- שלושה 3.15% chlorhexidine gluconate ו- 70% אלכוהול איזופרופיל העור מחטא מטליות להסיר החבילות ומניחים ליד החיה.
- לשנות לתוך כפפות כירורגי סטרילי. עובד התחלה תנועה מעגלית באתר החתך, ספוגית החיה עם מקלון חדש chlorhexidine/אלכוהול שלוש פעמים.
- אתר מקום החתך כפי שמוצג באיור 1A. צובט את העור עם פינצטה, להשתמש במספריים לעשות חתך על העור שכבה כ 1 ס מ מעמוד השדרה ומתחת קשת הצלעות. לאחר האתר לחתוך כ 1 ס"מ, להפוך אתר לחתוך דומה להלן, לשכבת השריר.
הערה: לבצע החתך באורך המתאים כדי לאפשר את הכליה בקושי לבוא דרך החתך, ואז ניתן לשמור במקום על ידי החתך עצמו. אפשרות לחשוף קטן מדי חתך של הכליה; גדול מדי, הכליה ללא הרף יגלוש בחזרה לתוך חלל הבטן. - אתר הכליה.
הערה: יתכן גלוי בין שומן לבן. הטחול נמצא גם על הצד השמאלי של החיה. הצבע של האיברים האלה יכול להיות מובחן מבחינה ויזואלית, כמו הטחול הוא בגוון חום-ערמוני כהה בעוד הכליה אדום כהה, כתום. לא רצוי לטפל הטחול כמו זה יכול להיות נקרע בקלות. - בלי לגעת הכליה, בעדינות לחשוף אותם של חלל הבטן, על ידי הפעלת לחץ יציב, עדין על הבטן עם האצבעות (איור 2C). השתמש פינצטה סגור לדחוף בעדינות איברים בלתי רצויה בחזרה לתוך. חלל הבטן במידת הצורך. אל תשתמש/י מלקחיים פתוחים כמו זה עלול לגרום נזק הכליה או איברים אחרים.
- כאשר הכליה מתוך הבטן, בעדינות נפרד ממנו שמסביב שמן מספיק כדי להמחיש את אגן הכליה, נקודה קטנה לבנה (איור 1B). לדחוף עודף שומן לצד אחד או להסיר במידת הצורך. הקפד להסיר את בלוטת יותרת הכליה, הממוקמים על יד הקוטב העליון של הכליה, או הקפסולה כליות.
- באמצעות סגור מלקחיים לדחוף בצד ימין של הכליה כך אגן הכליה נשאר בתצוגה, תופסים את המזרק אינסולין טעון עם יד ימין והחזק אותו במקביל משטח העבודה עם מחט מכוון את אגן הכליה (2E איור). מכניס את המחט בקפידה אגן הכליה קיבוע כפי שמוצג באיור 1B.
- להזריק את הפתרון במהירות בתוך שלושה s. כשליש הכליה יכול לנקות, לשנות צבע לבן.
הערה: נהוג להתבונן הצטברות נוזלים הזרקת הבאים קפסולה בכליות, כמו גם היווצרות שטף דם. איזה נזק יש צורך להשיג רמה מספקת של תרביות תאים DNA לצורך זיהוי. - שמור את המחט במקום במשך כ 10 s כדי למנוע זרם אחורי של הפתרון. ואז לאט ובזהירות הסר את המחט. להחזיר האיבר אל חלל הבטן על ידי בעדינות מתיחה באזור הניתוח באמצעות סגור מלקחיים.
- תפר את שכבת השריר של החיה בתפרים נספגים 5-0, הנחת 2-4 קשרים עצמאיים.
- תפר את שכבת העור של החיה עם תפרים נספגים ניילון 5-0 או 6-0, הנחת 2-4 קשרים עצמאיים.
הערה: כלי ניתוח עשוי להיות לאחר הצבת באמבט חרוז סטרילי, התקררה.
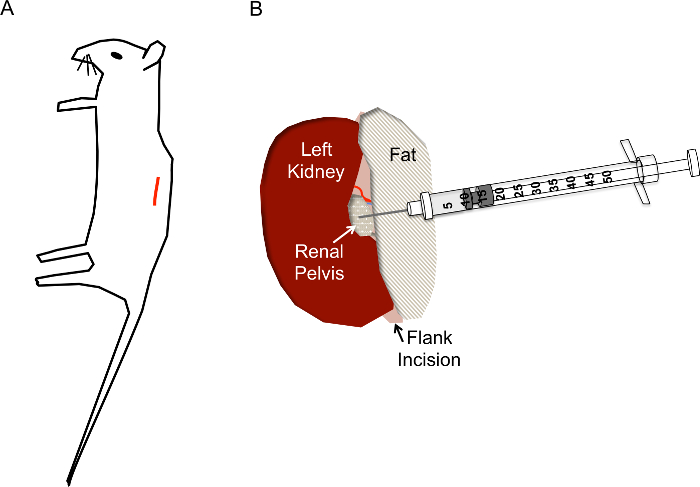
איור 1. האתר הנכון החתך והשמת המחט לזריקות אגן הכליה hydrodynamic. א) החתך (הקו האדום) צריך להיות ממוקם כ 1 ס מ חוט השדרה של 1 ס מ מתחת הצלעות של העכבר. B) לאחר הכליה נחשף דרך החתך האגף, אגן הכליה אמור להימצא כמו נקודה קטנה שקוף/לבן צהבהב לאופק הכליה. הזריקה צריך לא להפריע את וריד הכליה, עורק הכליה או שופכן. המחט של מזרק אינסולין מוכנס ישירות לתוך אגן הכליה כמוצג עד לעומק של 0.5 ס מ ומדוכא במהירות בס' 2-3 אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
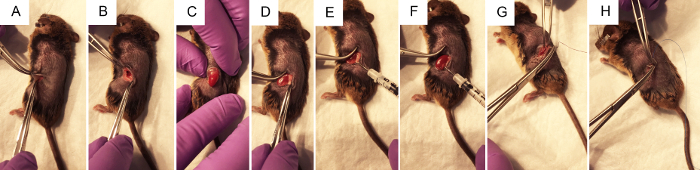
באיור 2. הפעולות כירורגית לביצוע הזרקה hydrodynamic אגן הכליה של פלסמיד דנ א. א) מלקחיים צובטים את העור כדי לאפשר המנתח לעשות חתך האגף ~ 1 ס מ עם איזמל, קודם דרך לשכבת העור, לאחר מכן דרך השכבה שריר. B) באמצעות שני זוגות מלקחיים סגור לפתוח את הפצע כירורגי, הכליה הוא מדמיין בתוך הבטן במידת האפשר. ג) עם לחץ עדין על הבטן, מבלי לגעת בכל האיברים ישירות, הכליה נחשף דרך החתך האגף. ד) שומן הוא בעדינות גזור מן הכליה, מפריע זה מעט ככל האפשר להשיג גישה אגן הכליה. ה) לחיצה על הצד הימני של הכליה השמאלית טוב יותר להמחיש את אגן הכליה, מתקיים עם האגודל על לוחץ המזרק, המחט בזהירות אך בנחישות ימוקם של אגן הכליה. F) להלן < 3 זריקה s, ניקוי ייבחנו באזורים של הכליה אשר קיבל את עיקר הזריקה. ז) איחוי סגול סטרילי נספגים משמשות ליצירת קשרים עצמאיים 2-4 לשכבת השריר. ח) תפרים נספגים ניילון כחולים סטרילית משמשות ליצירת קשרים עצמאיים 2-4 לשכבת העור. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- ההחלמה מן הניתוח וניטור שלאחר הניתוח.
- מספקים עכברים עם שיכוך כאב על פי דרישות IACUC של המוסד לבקרת כאב. לדוגמה, לנהל הבופרנורפין בזריקה תת עורית כל ה 8-12 עבור 48 שעות וכאב לאחר הניתוח, אם נזק לכליות הקשורות NSAID יש להימנע לצורך המחקר.
- שמור העכברים על חום פאד, נכחו החוקר עד מלא הנייד עם recumbency בחזה ובצלעות. כאשר החלימו לחלוטין, להחזיר את העכברים כלוב נקי המכיל כמות קטנה של מצעים מהכלוב בבית שלהם כדי להפחית את הלחץ. האם לא עכברים בבית נתון לניתוח עם עכברים תמים.
הערה: המצב של העכברים תשפר במהירות, המופיעים יש התנהגות נורמלית בתוך 24-48 שעות. - לתת נוזלים מלוחים, שיכוך כאבים מוגברת עכברים המופיעות לחוץ כדי לשפר את מצבם. אם עכברים במהירות לא לשחזר, מודדים את משקל העכבר, המתת חסד עכברים שאיבדו יותר מ 20% ממשקל גופם הראשונית. המתת חסד עכברים המופיעים uremic או אחרת הגוססת. בעיות בריאותיות אפשרי מפורטים בטבלה1.
הערה: עכברים לפעמים להסיר את התפרים החיצוניים שלהם או התפרים ממקומו לפני סגירת הפצע. תפירת המסכן של שכבת השריר עם שכבת העור שלם יכול לגרום בקע באתר החתך, המצוין על-ידי בולטות. במקרים כאלה, מקם את העכבר בהרדמה (איזופלוריין הוא מהיר יותר חריגות קטמין/השירותים הווטרינריים) ותיקון באתר כירורגית עם התפרים חדש בהקדם האפשרי. אם התפרים נספגים בעור נשארים אחרי 10-14 ימים, להסיר אותם. מדי פעם עכברים להסיר את התפרים הכלוב-של בן זוגם או להילחם. הסר את התוקפן עכברים לכלוב משלהם עם העשרה כדי למנוע מהם לפגוע העכברים האחרים ברגע התנהגות כזו מזוהה. - כאשר בריאות או נקודות קצה ניסיוני נגישים, המתת חסד העכברים על ידי שאיפת פחמן דו-חמצני או איזופלוריין יתר ואחריו שיטה המשני של המתת חסד כמו נקע בצוואר הרחם על פי סטנדרטי המתת חסד ב מקום במוסד
| הסיבה | התפרצות | מספר עכברים מושפעות | סימפטומים | פעולה מיידית | פתרון לטווח ארוך | ||
| Endotoxins-DNA המצוי | 6-40 h שלאחר ההזרקה. | קרוב לוודאי שישפיע על כל עכבר בהתחשב ההכנה DNA מזוהמים. | בעיות נשימה, סימנים של כאב חמור, אי ספיקת איברים, מוות. | המתת חסד העכברים המושפעת. לבדוק כל רכיב מוזרק עבור endotoxins עם Limulus Amebocyte Lysate. | השתמש maxiprep נטולת אנדוטוקסין ערכות מכשור מעבדתי סטרילי, חדש או שטופלו NaOH בלבד. השתמש מאגר מסחרי שנרכש, אנדוטוקסין-נבדק כדי לדלל את ה-DNA. | ||
| הרדמה יתר | במהלך הניתוח, לפני או אחרי הזרקת הדנ א. | עשוי להשפיע רק העכברים צעיר, קטן יותר או רזה. | הפסקת נשימה בזמן כרית החימום, הטלת שתן. | ירידה הרדמה עבור עכברים הנותרים. | בדוק היטב פרוטוקול על דיוק המינון והכנה. אל תכלול "שפגשתי." להתייעץ עם וטרינר אם המינון המתאים. | ||
| בועת אוויר במזרק או מחט בשימוש להזרקה | מיד לאחר ההזרקה אגן הכליה. | אלא אם כן כל מזרקים היו טעונים ברישול, הדבר משפיע רק על עכבר אחד. | מתנשף. | בדוק מזרקים הנותרים סימנים של בועות אוויר. | הכנת מזרקים בקפידה, הקשה על המזרק כדי להסיר בועות בחלק התחתון. לשפר את תנאי תאורה משופרת של בועות. | ||
| הפתיחה של האתר כירורגית | הזרקת שלאחר 12-72 h | עכברים אחת או יותר. לפעמים כל הכלוב. | פצע פעור, בדרך כלל אין מצוקה אחרים | חזור על תפירת לתקן את הפצע בקפידה תחת הרדמה איזופלוריין עם סטרילי טכניקה. ייתכן שתצטרך להשקיית עם מי מלח או להסיר גבולות הפצע עם מספריים. | אם עכברים כל התפרים קצר מאוד או חסר, ייתכנו עכבר אחד הסרתם, אז עכברים עשוי להיות נפרד. לשפר את הטכניקה הפתולוגיים. השתמש קשרים עצמאיים. | ||
| בקע באתר כירורגית | 48 + פוסט-הזרקת h | עכברים אחת או יותר. | התל מוצגת באתר כירורגית. | תחת הרדמה איזופלוריין עם סטרילי טכניקה, לחתוך את העור נרפא לחשוף בקע של שכבת השריר. להחליף את האיברים הצפק, לתקן את שכבת השריר בתפרים נספגים, לסגור את האתר. | הדבר מעיד על תפירת המסכן של שכבת השריר. לשפר את הטכניקה הפתולוגיים. השתמש קשרים עצמאיים. | ||
| אי ספיקת כליות | 48 + פוסט-הזרקת h | עכברים אחת או יותר. | הרזיה של > 20%, יכול להפוך uremic, מגובנן יציבה | לספק תמיסת מלח ו הגדל או להאריך את שיכוך כאבים. אם אין שיפור נצפית, להקריב את העכברים המושפעת. | לשנות מצב מחלת החיה כדי שיהיה פחות חמור. לשנות את transgene יהיה פחות חזק או inducible. להזריק עכברים בבית timepoint מוקדמת יותר בהתקדמות המחלה. | ||
| דב פינקלקראוט או זיהום | ימים עד שבועות לאחר הניתוח | עכברים אחת או יותר. | דב פינקלקראוט מוחשי או סימנים של אלח דם | המתת חסד העכברים המושפעת. Necropsy בקשה לאשר חשד לזיהום. | זה עלול להתרחש כאשר התנאים כירורגי של זריקות אינן מספיק סטרילי. ההליך המוצג עבור עכברים עם מערכת החיסון הרגיל אבל עוד יותר לנקוט בסביבה של חיות immunocompromised כגון אלה שטופלו ציקלופוספמיד. | ||
טבלה 1. טבלה של בעיות בריאותיות פוטנציאליות נתקלה במהלך פרוטוקול הזרקת אגן הכליה. למרות הבעיות המפורטות הבריאות אינן נפוצות, ישנם מספר שגיאות הקשורות החוקר יכולות להתרחש במהלך ההליך. טבלה זו ייתכן סיוע למניעה, אבחון של בעיות בריאות, כמו גם ליישום של תרופות פוטנציאליות כדי למנוע בעיות כאלה המתרחשים בעתיד. עם התרגול, חוקרים צריך לצפות בעיות בריאות שכיחות ותמותה בעקבות ההליך.
3. להעריך את יעילות הזרקת ואפקטים transgene
- השתמש וזמינותו מפותח עבור transgene הרצוי כדי להעריך את היעילות של תרביות תאים. השתמש בפקדי חיוביים ושליליים בקפידה כדי לוודא שוזמינותו היא ספציפית.
הערה: בהתאם הבחירה יזם, עכברים סביר יהיה הביטוי החזק ביותר transgene על יום 1; תמיד בתוך השבוע הראשון לאחר ההזרקה. - לבצע הדמיה בעלי חיים חיים של לוציפראז על ידי החדרת µg 10 של הבעת לוציפראז פלסמיד כגון משופרת גחלילית לוציפראז הדי מדולל להזרקה.
- נקה כל משטחי נחשפים עכברים. למקם את הכלוב הראשון של עכברים הקאמרית של חותם שזה סגור. וודאו כי אין מספיק איזופלוריין לניסוי. על-ידי בדיקה של gage; אם לא, הוסף איזופלוריין עד רמת מגיע לקו "מקסימום". ליזום את הזרימה של איזופלוריין על-ידי הפעלת חיוג איזופלוריין ל 3.5 והחמצן 2.
- להזריק כל העכבר באמצעות הזרקת בקרום הבטן 100 µL של luciferin המופשרים 30 מ"ג/מ"ל. רשום את הזמן.
- פתח את התוכנה כדי לשלוט במכונה הדמיה על ידי לחיצה על סמל העכבר כתום וצהוב. תחת "בחר/הוסף מזהה המשתמש," לבחור את ראשי התיבות הנכונה מתוך התפריט הנפתח לצד "מזהה" לחץ על "אישור." בשורת התפריטים העליון, לחץ על "רכישת" ובחר "שמירה אוטומטית כדי..." מתוך התפריט הנפתח. בחר את התיקיה או ליצור תיקיה חדשה כדי לשמור את הנתונים.
- ללכת תיבת רכישת התמונה בפינה הימנית התחתונה. בדוק הגדרות אוטומטית הם כדלקמן: Binning, מדיום; F/להפסיק, 1 עבור 8 זורח, עבור התצלום; מסנן פליטה, פתוחה; הדמיה מצב, בודק ליד Luminescent, תצלום, כיסוי ויישור בלבד. לחץ על "אתחול" לאתחל את המערכת, לחכות אתחול לסיים, ואז לשנות את "שדה הראיה" "E" לשיקוף החמישה העכברים.
- להפוך את השסתום עבור ההרדמה, אבובים כזה nosecones בתוך המכונה מנהל איזופלוריין. מקום החיות בתוך המכונה הדמיה לפי הסדר הרצוי על בטנם עם גבם מול המצלמה לעיל כדי להמחיש את הכליה. אם כלוב אחד או יותר ליצירת תמונה, מקם את הכלוב הבא אל החדר איזופלוריין.
- 5-10 דקות לאחר ההזרקה luciferin, לחץ על "ייבוא" כדי לקחת את התמונה.
- "כלי הצבעים" בצד ימין, לחץ על "התאם תמונה." תחת "סולם צבעים," ירידה הבר "מין" עד ביטוי ברור בעכברים הצפוי כל, דמיינו כמו סגול מעל כל כליה העכבר. אם עכברים כל ביטוי, מזריק העכברים עם 100 µL של luciferin ולא לחכות לפחות 3 דקות לפני ויש לנו שוב.
- אם התמונה יש רוויה פיקסלים, להקטין את זמן החשיפה והשג כדי לקבל תמונה כמותית כמו הנוכחות של פיקסלים רווי תגרום ממעיט את היעילות תרביות תאים. הזמן מאפשרים חשיפה הנמוך הוא 0.5 s.
- אם התמונה מציגה רק ביטוי גנים להתעלף בזמן החשיפה הראשונה, להגדיל את זמן החשיפה עד 2 דקות, רכוש מחדש. בכל פעם שהתמונה. זה לקחת, הנתונים הם אותה בתיקיה שבחרת כך כל התמונות זמינים עבור ניתוח נוסף מאוחר יותר.
- חזור על הצעדים הדמיה הכלובים עוקבות של עכברים.
- הסר את העכברים מהמכונה הדמיה. לכבות את הגז. נקו את החדר nosecones, שלב ההדמיה. לסגור את התוכנית במחשב.
הערה: התוכנה יבקש "שמירת הנתונים (dataset)." זו מתייחסת המניפולציות שבוצעו את ערכת הנתונים, לא הנתונים עצמם.- לחץ על 'כן' כדי לשמור את השינויים הסולם ואת אזורי עניין (ROIs). לחץ על 'לא' כדי לחזור למצב ההגדרות המקוריות לתמונות.
- עבור ניתוח נתונים, פתח את התוכנה. לחץ על הצבעים"כלי" ""רועי כלים. לחץ על הסמל מעגל ולחץ על "1" בתפריט הנפתח למקום של רועי חדשה בחלון התמונה כמצוין על-ידי אליפסה אדום עם ארבעה ריבועים סביבו. להתאים את גודל ההחזר על-ידי הצבת סמן העכבר על ריבוע אדום וגרירה כדי להקיף את האזור סגול שכיסה את הכליה מוזרק.
- עם הסמן מעל ריבוע אדום על ההחזר, באמצעות לחצן העכבר הימני ולאחר מכן בחר 'שכפל רועי"כדי ליצור ROI חדש בחלון התמונה, להזיז את העכבר הבאה. חזור על התהליך עד עכברים כל בתמונה יש רועי מעל הכליה מוזרק.
- בתפריט ישירות מעל לתמונה, לשנות "יחידות" מ "ספירות" ל- "Radiance (פוטונים)." כדי לייצא את הנתונים רועי, "הצבעים כלי," לחץ "רועי כלים" ואז ללחוץ על סמל העיפרון/סרגל כדי ליצור גיליון אלקטרוני של המדידות. השתמש המדידה "Avg Radiance" ניתוח נוסף בתוכנית נתונים אנליזה וסטטיסטיקות של בחירה.
- לבצע צביעת סעיפים כמו שמתואר11.
הערה: הזריקה לא transfect הכליה כולו באופן שווה כך מקטעים שונים ללכוד תקנים שונים היעילות11. הזרקת שיתוף של חרוזים כגון פלורסנט latex microspheres עשוי לעזור לזהות את האזורים צפוי להיות transgene-חיוביות (איור 3D)11. אופטימיזציה של פרוטוקול מכתימים חשוב מאוד. - תספיג חלבון כדי לזהות את הגן עניין בכליה transfected לבצע.
הערה: קציר האיברים על תמציות חלבונים חייב להתבצע על קרח. שוב, אין להשתמש פרוסה קטנה של האיבר כמו אזור זה עשוי לא יש כבר transfected טוב. תרביות תאים לצר מפוזרים לאורך איבר המין אז לשלב אזורים שונים, בריכה אותם. הזרקת hydrodynamic אגן הכליה פלסמיד לייצר את הורמון אריתרופויאטין הביאה לעלייה צנוע המטוקריט, אז הוא צפוי כי מוצרים המופרש transgene צריך למצוא את מחזור11. - ביטוי ברמה גבוהה לטווח ארוך של transgenes, לשלב מערכת וקטור שילוב עם סוכנים לדיכוי המערכת החיסונית כגון ציקלופוספאמיד. התגובה החיסונית transgene מתרחשת מעל הראשונה מספר שבועות לאחר ההזרקה, חזקים11.
תוצאות
טכניקת הניתוח, הזרקת פשוטים לביצוע נשכחו, הדורשים לא הציוד העיקרי או בחומרים יקרים. אם חדש האגף-חתך ניתוח בכליה, יום הדרכה אחד על מספר עכברים מתוכננת המתת חסד אסור שבו העכברים אינם התאושש הניתוח הבא כי הניסיון הראשון-ניתוח זה עשוי לארוך זמן רב יותר מהרגיל. לחלופין, חוקרים ?...
Discussion
ב פרוטוקול זה מתוארת שיטה חזקה להשגת ביטוי גנים לשחזור באופן ספציפי בתוך הכליה. בידי מנתח מנוסה בינוני מצאנו האחוז של עכברים transfected באמצעות הטכניקה הזו להיות בטווח של 50-100%, בהתאם לגיל העכבר ואת הרגישות של המדידה של transgene. הרמה של ביטוי גנים לוציפראז היה מעל רקע במשך מספר חודשים בעכברים שקיב?...
Disclosures
המחברים אין לחשוף ולהצהיר אין ניגוד אינטרסים.
Acknowledgements
פרס פיתוח הקריירה של המחלקה ותיקי לענייני [BX002797] תמך L.E.W. מכוני הבריאות הלאומיים [R01-DK095867] ונתמך American Heart Association [15GRNT25700209] ג'יי מכוני הבריאות הלאומיים [DK093660], המחלקה לענייני חיילים משוחררים [BX002190] ואנדרבילט לחקר מחלת כליות תמיכה, M.H.W. חומר זה הוא התוצאה של עבודה נתמכת עם משאבים ושימוש במתקני במערכת הבריאות VA עמק טנסי.
Materials
| Name | Company | Catalog Number | Comments |
| AnaSed Xylazine | Patterson Veterinary | 07-808-1947 | Anesthetic - Not controlled substance |
| BD Insulin Syringe 0.5 mL 29G 1/2 Inch | Cardinal Health | 309306 | Required syringes |
| Buprenex | Pharmacist/Veterinarian | Analgesia - Controlled Substance | |
| Dynarex Disposable Towel Drape | Thermo Fisher Scientific | 19-310-671 | Place over heat pad |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | Use only endotoxin-free plasmid DNA |
| Endosafe Gel-Clot LAL Rapid Positive Control | Charles River | PC200 | Positive control for endotoxin test |
| Endosafe Gel-Clot LAL Rapid Single Test Vial | Charles River | R13500 | Endotoxin test |
| Extra Fine Micro Dissecting Scissors | Roboz Surgical Instrument | RS-5882 | Surgical tool |
| Fisherbrand Instant Sealing Sterilization Pouch - 9" | Thermo Fisher Scientific | 01-812-51 | For autoclaving surgical tools |
| Gaymar Heat Pump | Paragon Medical | TP-700 | Water-circulating heat pump |
| Germinator 500 | Roboz Surgical Instrument | DS-401 | To reuse surgical tools during surgery |
| Graefe Forceps | Roboz Surgical Instrument | RS-5136 | Surgical tool |
| Graefe Tissue Forceps | Roboz Surgical Instrument | RS-5153 | Surgical tool |
| Halsey Needle Holder, 5" Length | Roboz Surgical Instrument | RS-7841 | Surgical tool |
| Heat pads - 15" x 21" - need at least 3 | Paragon Medical | TP22G | For use with Gaymar Heat Pump |
| IsoFlo (Isoflurane, USP) | Abbott Animal Health | 5260-04-05 | For imaging and euthanasia |
| Isotec Isoflurane Delivery System Vaporizor | Smiths Medical | VCT3K2 | For imaging and euthanasia |
| Ketamine | Pharmacist/Veterinarian | Anesthetic - Controlled Substance | |
| Kimwipes | Kimberly-Clark Professional | 34120 | Laboratory tissues |
| Living Image software | Caliper Life Sciences | For live animal imaging | |
| Luciferin | Perkin Elmer | 122796 | For live animal imaging |
| Nanodrop 2000 | Thermo Scientific | ND-2000-US-CAN | Spectrophotometer for DNA measurement |
| Prevantics Swabs | Thermo Fisher Scientific | 23-100-110 | For skin surgery prep |
| Prolene 5-0 sutures Taper 30" | Thermo Fisher Scientific | NC0256891 | Non-absorbable sutures for skin |
| Puralube Brand Opthalmic Ointment | Patterson Veterinary | 07-888-2572 | To keep eyes moist during surgery |
| Trans IT - QR Hydrodynamic Delivery Solution | Mirus Bio | MIR-5240 | Hydrodynamic delivery buffer for diluting DNA |
| Vicryl 5-0 Sutures J303H | Thermo Fisher Scientific | NC9816710 | Absorbable sutures for muscle layer |
| Wahl Mini Arco Clipper | Med-Vet International | 8787-1550 | Shaver for skin prep |
| Xenogen IVIS 200 | Caliper Life Sciences | For live animal imaging |
References
- Liu, F., Song, Y., Liu, D. Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA. Gene Ther. 6 (7), 1258-1266 (1999).
- Zhang, G., Budker, V., Wolff, J. A. High levels of foreign gene expression in hepatocytes after tail vein injections of naked plasmid DNA. Human Gene Therapy. 10, 1735-1737 (1999).
- Fumoto, S., Nishimura, K., Nishida, K., Kawakami, S. Three-Dimensional Imaging of the Intracellular Fate of Plasmid DNA and Transgene Expression: ZsGreen1 and Tissue Clearing Method CUBIC Are an Optimal Combination for Multicolor Deep Imaging in Murine Tissues. PLoS One. 11 (1), e0148233 (2016).
- Yoshino, H., Hashizume, K., Kobayashi, E. Naked plasmid DNA transfer to the porcine liver using rapid injection with large volume. Gene Ther. 13 (24), 1696-1702 (2006).
- Kamimura, K., Suda, T., Xu, W., Zhang, G., Liu, D. Image-guided, lobe-specific hydrodynamic gene delivery to swine liver. Mol Ther. 17 (3), 491-499 (2009).
- Kamimura, K., Zhang, G., Liu, D. Image-guided,intravascular hydrodynamic gene delivery to skeletal muscle in pigs. Mol Ther. 18 (1), 93-100 (2010).
- Suda, T., Liu, D. Hydrodynamic gene delivery: its principles and applications. Mol.Ther. 15 (12), 2063-2069 (2007).
- Alino, S. F., et al. Naked DNA delivery to whole pig cardiac tissue by coronary sinus retrograde injection employing non-invasive catheterization. J Gene Med. 12 (11), 920-926 (2010).
- Suda, T., Gao, X., Stolz, D. B., Liu, D. Structural impact of hydrodynamic injection on mouse liver. Gene Ther. 14 (2), 129-137 (2007).
- Skrypnyk, N. I., Harris, R. C., de Caestecker, M. P. Ischemia-reperfusion model of acute kidney injury and post injury fibrosis in mice. J Vis Exp. (78), (2013).
- Woodard, L. E., et al. Kidney-specific transposon-mediated gene transfer in vivo. Sci Rep. 7, 44904 (2017).
- Liang, A., et al. Loss of glutathione S-transferase A4 accelerates obstruction-induced tubule damage and renal fibrosis. Journal of Pathology. 228 (4), 448-458 (2012).
- Liang, M., et al. Protective role of insulin-like growth factor-1 receptor in endothelial cells against unilateral ureteral obstruction-induced renal fibrosis. Am J Pathol. 185 (5), 1234-1250 (2015).
- Corridon, P. R., et al. A method to facilitate and monitor expression of exogenous genes in the rat kidney using plasmid and viral vectors. Am J Physiol Renal Physiol. 304 (9), F1217-F1229 (2013).
- Wallace, D. P., et al. Tracking kidney volume in mice with polycystic kidney disease by magnetic resonance imaging. Kidney Int. 73 (6), 778-781 (2008).
- Woodard, L. E., Wilson, M. H. piggyBac-ing models and new therapeutic strategies. Trends Biotechnol. 33 (9), 525-533 (2015).
- Yeikilis, R., et al. Hydrodynamics based transfection in normal and fibrotic rats. World J Gastroenterol. 12 (38), 6149-6155 (2006).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. (41), (2010).
- Wooddell, C. I., et al. Muscle damage after delivery of naked plasmid DNA into skeletal muscles is batch dependent. Hum Gene Ther. 22 (2), 225-235 (2011).
- Crespo, A., et al. Hydrodynamic liver gene transfer mechanism involves transient sinusoidal blood stasis and massive hepatocyte endocytic vesicles. Gene Ther. 12 (11), 927-935 (2005).
- Rocca, C. J., Ur, S. N., Harrison, F., Cherqui, S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Ther. 21 (6), 618-628 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved