É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Injeção hidrodinâmica pelve Renal para a expressão não-virais de proteínas no rim
Neste Artigo
Resumo
Este protocolo descreve um método para injetar plasmídeo no rim do rato através da pelve renal para produzir a expressão do transgene especificamente no rim.
Resumo
Injeção hidrodinâmica cria um ambiente local, de alta pressão para transfect vários tecidos com o Plasmídeo e outras substâncias. Injeção de veia de cauda hidrodinâmica, por exemplo, é um método bem estabelecido, pelo qual o fígado pode ser transfectado. Este manuscrito descreve uma aplicação dos princípios hidrodinâmicos pela injeção do rim do mouse diretamente com plasmídeo para expressão de genes específicos do rim. Os ratos são anestesiados e o rim é exposto através de uma incisão de flanco, seguida por uma injeção rápida de um plasmídeo que contém ADN solução diretamente na pelve renal. A agulha é mantida no lugar por 10 segundos e o local da incisão é suturado. No dia seguinte, ao vivo de imagem animal, borrão ocidental, ou imuno-histoquímica pode ser utilizado para ensaiar a expressão do gene ou outros ensaios adequados para o transgene de escolha são utilizados para a detecção da proteína de interesse. Métodos publicados para prolongar a expressão gênica incluem tratamento de integração e ciclofosfamida mediada por transposon transgene para inibir a resposta imune para o transgene.
Introdução
A técnica de injeção de veia de cauda hidrodinâmica tornou-se uma forma comumente usada para alcançar altos níveis de expressão gênica em rato fígado1,2. Os rins também são transfectados por esta técnica em um nível muito inferior, aproximadamente 100 vezes menos3. A injeção hidrodinâmica pelve renal descrita aqui fornece uma maneira simples de controlar a especificidade da expressão do órgão através de meios físicos, usando os mesmos princípios hidrodinâmicos que foram criados anteriormente no fígado4,5 , músculo6e outros órgãos de7,8. Esse método transfects células em animais vivos na vivo por meio de pressão e velocidade para forçar o fluido contendo DNA dentro das células, induzindo simultaneamente danos ao órgão que é rapidamente resolvido9. Usando técnicas cirúrgicas bem estabelecidas para visualizar o rim através de uma incisão de flanco10 juntamente com uma única injeção por seringa de insulina, temos encontrado sucesso transfeccao de vários tipos de células de rim, principalmente fibroblastos intersticiais, túbulos e coleta de duto de11. Dissecação destes ratos mostrou que outros órgãos não são transfectados em níveis altos o suficiente para visualizar por luciferase de imagem técnicas11. Uma vez que a técnica é não-virais, uso do plasmídeo para transfeccao permite rápida e fácil a preparação dos reagentes necessários para a injeção.
Nós usamos injeções localizadas de hidrodinâmicas para expressar a antioxidante Glutationa S-transferase A4, o receptor de fator de crescimento 1 semelhante à insulina e a eritropoetina hormônio nos rins, tudo com os esperados efeitos biológicos11, 12 , 13. uma avaliação detalhada da via de administração, o volume de injeção, dosagem de DNA e escolha do promotor tem sido realizadas11. Além disso, ambos o piggyBac transposon sistema e/ou ciclofosfamida tratamento para suprimir a reação imune para o transgene foram mostrados para melhorar a longo prazo gene expressão resultados11. Outros pesquisadores usaram uma abordagem da veia renal em ratos com sucesso, alcançar a eficiência elevada do transfection por períodos de tempo superiores a um mês14. No entanto, correção genética dos fenótipos imitando doenças humanas geralmente são realizadas em ratos primeiro como um prova de conceito desde modelos genéticos mais mamíferos são modelos de rato. Nós em comparação a veia renal de injeção para injeção da pelve renal e descobriu que a injeção na pelve renal era superior da veia renal para expressão gênica (aproximadamente dez vezes maior) e sobrevivência11. A pelve renal é uma rota ideal de entrada para o rim porque é flexível o suficiente para tolerar variações de produção de urina e muitas vezes é capaz de manter sua integridade estrutural, mesmo quando dilatadas durante hidronefrose. Além disso, injeção na pelve renal permitiu acesso ao rim sem perfurar a cápsula renal, permitindo que o fluido injetado ser visivelmente mantido pelo rim melhor que injeção difuso. Outros órgãos do rato não tem uma rota de entrada diferente da vasculatura, mas o espaço urinário do rim é um local de injeção ideal. Além disso, a injeção na veia renal resultou em vazamento de sangue na cavidade abdominal. Estimou-se o volume total do rim dos rins do selvagem-tipo rato por ressonância magnética para ser aproximadamente 0,2 cm3, então o volume de um único rim é aproximadamente igual à quantidade de fluido injetado pela pelve renal hidrodinâmico injeção (100 µ l)15. Aqui, disponibilizamos todas as nuances detalhadas do protocolo de injeção hidrodinâmica pelve renal para alcançar a transfeccao reprodutível do rim.
Protocolo
Todos os métodos descritos aqui foram aprovados pelo cuidado institucional do Animal e uso de comitês (IACUCs) da Baylor College of Medicine e Vanderbilt University Medical Center.
1. preparar a solução de DNA para injeção
- Selecione o plasmid(s) expressar o transgene cuidadosamente para maximizar as características desejáveis para melhorar a eficiência da transfecção e expressão do transgene.
Nota: Injeção hidrodinâmica pelve renal de plasmídeos de expressar o marcador fluorescente TdTomato, a eritropoietina hormônio (Epo) e luciferase de vaga-lume tem sido descrito anteriormente11. Se não houver um ensaio bem desenvolvido para eficiência de Transfeccao para o transgene, execute ao vivo de imagem animal de luciferase introduzindo 10 µ g de luciferase-expressando de shRNA como luciferase de vaga-lume reforçada ao DNA diluído para injeção.- Escolha o plasmídeo menor que é prático para o aplicativo.
Nota: Pequenos plasmídeos geralmente transfect melhor do que grandes plasmídeos de células. Por exemplo, o gene de resistência de zeomycin e R6K de origem de replicação são pequenas, então utilizar esses elementos na espinha dorsal do plasmídeo irá diminuir o tamanho do plasmídeo. - Expresse o transgene de um promotor de mamíferos.
Nota: O tipo de célula renal transfectado, comprimento da expressão do gene e a força da expressão do gene serão todos afetado pela escolha promotor. Ver Woodard et al. para uma comparação de citomegalovírus (CMV; constitutiva viral), alfa do fator 1 do alongamento (EF-1 α; constitutiva endógena), gama-glutamil transferase (γGT; túbulo-específico) e podocin (NPHS2; podocyte-específica)11. - Emprega um sistema de integração não-virais como transposons se maiores níveis de expressão de gene a longo prazo são desejáveis11,16. De estudos com início leituras menos do que a injeção após 5 dias, a integração do transgene é desnecessária.
- Escolha o plasmídeo menor que é prático para o aplicativo.
- Prepare o Plasmídeo para injeção usando um método comercial como um kit de maxiprep livre de endotoxinas. Cuidadosamente Evite a introdução de endotoxinas através de materiais de laboratório.
Nota: Presença de endotoxinas na solução de DNA irá provocar uma resposta imune severa no animal assunto, comprometer o experimento e possivelmente matar o animal.- Após a última etapa de lavagem de isolamento de DNA está completa, certifique-se de que o etanol não é deixado pelo odor e inspeção visual. Use gel de carregamento dicas para remover gotas visíveis. Seque os tubos contendo o pellet de DNA de cabeça para baixo em tecidos de limpador de delicada tarefa de laboratório à temperatura ambiente ou em um forno de 37-60 ° C, com monitoramento constante. Resuspenda o pellet imediatamente depois de etanol residual tenha evaporado para evitar excessos da pelota.
Nota: Etanol Residual interfere com a leitura de espectrofotômetro da concentração de DNA e introdução no rim não é desejável. - Resuspenda o pellet de DNA a mesma reserva que será utilizado para injeção (buffer de entrega hidrodinâmica; 100-300 µ l) para limitar a variação na composição química da solução-tampão de DNA entre grupos.
Nota: Não Ressuspender o DNA em solução-tampão de eluição que vem com o kit. O agente quelante EDTA comumente encontrado em "TE" tampão preparações pode afetar a função cardiovascular e renal. Dependendo do tamanho da pelota, eluir em 100-300 µ l de buffer de entrega hidrodinâmico para alcançar uma alta concentração. A concentração final do DNA totalmente diluído será entre 100 ng / µ l (dose de 10 µ g/rato) e 500 ng / µ l (dose de 50 µ g/rato) para que a concentração de DNA estoque deve ultrapassar isto. - Totalmente resuspenda o pellet de DNA no buffer. Deixe a pelota no buffer de hidrodinâmica entrega no tubo original em temperatura ambiente pelo menos uma hora ou durante a noite a 4 ° C antes de transferir para um tubo de microcentrífuga estéril para garantir que o DNA é completamente dissolvido.
- Leia a concentração de DNA de plasmídeo em um espectrofotômetro ou por outro método estabelecido.
Nota: As leituras devem ser feitas em duplicado, com repetições adicionais se necessário. Se a proporção de 260/280 for abaixo de 1.8, a preparação está contaminada com RNA ou outra substância, então, descartá-lo e prepare o DNA novamente. - Loja plasmídeo resuspended no buffer de injeção a-20 º C dentro de uma caixa em um manual de descongelar o congelador para evitar a degradação do DNA.
Nota: Armazenados desta forma, a preparação de DNA irá durar por muitos anos. Verificar a integridade do DNA por eletroforese em gel de restrição digest e agarose. DNA que é manchada pela rua tem degradado e não pode ser usado enquanto o ADN que produz bandas nítidas do tamanho correto pode ser usado para a injeção.
- Após a última etapa de lavagem de isolamento de DNA está completa, certifique-se de que o etanol não é deixado pelo odor e inspeção visual. Use gel de carregamento dicas para remover gotas visíveis. Seque os tubos contendo o pellet de DNA de cabeça para baixo em tecidos de limpador de delicada tarefa de laboratório à temperatura ambiente ou em um forno de 37-60 ° C, com monitoramento constante. Resuspenda o pellet imediatamente depois de etanol residual tenha evaporado para evitar excessos da pelota.
- Prepare a solução de DNA de plasmídeo diluídos para injeção na pelve renal.
Nota: Considere o controle grupos cuidadosamente. Para muitos estudos, ingênuo e buffer injetado somente controles estão incluídos porque a injeção em si causa danos e pode afetar o resultado experimental11.- Degele o DNA livre de endotoxinas eluído no buffer de hidrodinâmica entrega à temperatura no banco.
- Calcular a quantidade de DNA necessária para as injeções e preparar o DNA diluído para cada grupo. Administre 10-50 µ g de Plasmideo DNA trouxe para um volume total de 100 µ l com buffer de hidrodinâmica entrega por rato.
Nota: Para obter um exemplo, os cálculos para injetar 3 ratos com 10 µ g/mouse de um plasmídeo de DNA que tem uma concentração de 0,5 µ g / µ l são como segue.- Prepare-se bastante solução de DNA para ter cerca de 20% extra para carregar as seringas e espaço morto na agulha. Para os 3 ratos, preparar uma mistura em 3.5 x. Calcule a massa de DNA em µ g que deve estar na solução. Aqui seria 10 µ g x 3.5 = 35 µ g.
- Calcule o volume total da solução desejada para injetar 100 µ l por rato. Neste caso, seria 100 µ l x 3.5 = 350 volume total µ l.
- Calcule o volume de estoque plasmídeo para adicionar à solução. Neste caso, seria 35 µ g / 0,5 µ g / µ l = 70 µ l de estoque do ADN do plasmídeo.
- Calcule o volume de tampão para adicionar a solução diluída DNA subtraindo-se o volume de estoque DNA adicionado (etapa 1.3.2.3) do volume total de DNA diluído que é desejado (passo 1.3.2.2). Neste caso, seria de 350 µ l - 70 µ l = buffer de hidrodinâmica entrega 280 µ l.
- Prepare soluções em tubos de microcentrífuga estéril usando pontas de pipetas de filtro disponíveis comercialmente com técnica estéril na bancada do laboratório.
Nota: Soluções de DNA podem ser preparadas e armazenadas à temperatura ambiente para injeções definida para ocorrer naquele dia. Não Injecte ratos com uma solução fria como isto irá diminuir a temperatura corporal, mas o aquecimento é desnecessário.
2. realizar a cirurgia de injeção hidrodinâmica pelve renal
- Selecione os ratos cuidadosamente para a cirurgia.
Nota: Diferenças de tensão específicas ainda não foram observadas, mas podem ser possíveis. A maioria das injeções foram sobre o C57BL/6 ou FVB fundos. Pelve renal injeções funcionam melhor em ratos que são 6-12 semanas de idade. Em ratos maiores que 16 semanas, até a taxa de falha de 50% por luciferase imagem é possível por razões pouco claras. A mesma taxa de falha relacionada à idade tem sido observada para injeções de veia cauda hidrodinâmica para o fígado, por isso pode ser uma limitação geral relativa ao princípio da injeção hidrodinâmica. Na mesma linha, outros têm demonstrado que a injeção de veia cauda hidrodinâmica no fígado de rato fibrótico não é tão eficaz quanto o fígado saudável, por isso pode ser possível que, nas configurações de fibrose renal a injeção hidrodinâmica da pelve renal, não será tão eficaz, mas Isto não foi testado diretamente17. - Prepare os ratos e seringas de DNA para a cirurgia.
- Anestesia os ratos com ketamina e xilazina.
- Coloque o equipamento de protecção pessoal correto exigido pela facilidade de animais, tais como avental de laboratório descartável, máscara cirúrgica e luvas de nitrila.
- Trabalhando com ratos de 2-4 de uma só vez, pesar cada rato num copo de plástico de 500 mL em uma escala que tem a precisa de 0,1 g. calcular a quantidade correta de 24mg/mL diluída em solução salina 0,9% normal para ministrar a cada rato por injeção intraperitoneal de xilazina ketamina e 2 mg/mL (Veja o vídeo referenciado para saber mais sobre injeção intraperitoneal) 18. use a fórmula (50 µ l + ((5 µL) x (peso (g))), ou alternativamente, calcular de acordo com outra fórmula após consulta com o veterinário local equipe e IACUC.
- Injete o mouse pela injeção intraperitoneal técnicas padrão. Coloque o mouse em um balde de papel até que o mouse está imóvel.
Nota: Os ratos estão prontos para cirurgia quando eles já não respondem para o teste do beliscão-dedo do pé. Dar ratos que continuam a responder para o dedo-pinch teste 20-30 min após a injeção inicial 20-60 µ l mais anestésico, dependendo da força da resposta. - Lugar o mouse sobre uma almofada de calor água-circulado coberto com um bloco azul e lugar vet pomada em ambos os olhos para evitar a dessecação da córnea.
- Raspe o lado esquerdo da parte traseira do mouse do ombro de alcatra e flanco a espinha com uma máquina projetada para o grooming do animal de estimação. Remova os detritos e cabelo solto.
- Prepare uma seringa separada contendo 100 µ l de DNA diluído para cada mouse anestesiado, certificando-se que há nenhuma bolha de ar.
- Utilize uma seringa de insulina de 0,5 mL U-100 estéril 29 x ½" com uma agulha fixa sem um segurança.
Nota: O tipo de seringa é de importância crítica. Este indicador permite uma injeção rápida. A agulha fixa impede a solução de vazar. Presença de uma segurança impedirá o acesso para a pelve renal. As seringas especificadas na tabela de materiais deslizam mais uniformemente durante a injeção do que outras marcas testadas. - Carregar a seringa para ~ 120 µ l e puxar o êmbolo para baixo para criar um espaço no topo. Bata com uma caneta até que todas as ar bolhas ascensão até ao topo. Segurando a agulha, cuidadosamente pressione o êmbolo para remover todo o ar até a forma de uma gota na ponta da agulha. Não deve haver quaisquer bolhas visíveis presentes, como estas podem causar uma embolia aérea que vai matar o animal.
- Acabamento deprimente o êmbolo até que haja 100 µ l na seringa, esvaziando-se solução de DNA em excesso dentro do tubo de microcentrífuga original. Cuidadosamente o rótulo se necessário e coloque as seringas carregadas sobre um pano estéril para manter a esterilidade se as instalações onde o trabalho está sendo realizado não permitir recapeamento de agulhas.
- Utilize uma seringa de insulina de 0,5 mL U-100 estéril 29 x ½" com uma agulha fixa sem um segurança.
- Anestesia os ratos com ketamina e xilazina.
- Realizar a cirurgia de injeção.
- Prepare o local para a cirurgia. Coloque um pano estéril sobre a almofada do calor e vazios estéril instrumentos cirúrgicos para a cortina estéril sem tocá-los. Pegar o mouse e colocá-lo no campo de visão. Ajuste a iluminação para iluminar a área.
- Remova os pacotes três 3,15% clorexidina gluconato e 70% álcool isopropílico pele anti-séptico cotonetes e coloque perto do animal.
- Vestir as luvas cirúrgicas estéreis. Trabalhando em um início de movimento circular no local da incisão, cotonete o animal com uma nova amostra de clorexidina/álcool três vezes.
- Localize o local da incisão, como mostrado na figura 1A. Beliscar a pele com uma pinça, tesoura de uso para fazer um corte na pele camada de aproximadamente 1 cm da coluna vertebral e abaixo da caixa torácica. Uma vez que a corte local é aproximadamente de 1 cm de comprimento, fazer um site de corte semelhante abaixo, na camada muscular.
Nota: Fazer a incisão o comprimento certo para permitir que a rim apenas mal vir através da incisão e então ser mantido no lugar pela incisão em si. Uma incisão muito pequena e o rim não podem ser expostos; muito grande e o rim continuamente deslizarão volta na cavidade abdominal. - Localize o rim.
Nota: Pode ser visível entre o tecido adiposo branco. O baço também está localizado no lado esquerdo do animal. A cor destes órgãos pode ser visualmente diferenciada, como o baço é um marrom escuro, enquanto o rim é um vermelho-laranja-escuro. Não é desejável para manipular o baço como isso pode ser facilmente rompido. - Sem tocar o rim, delicadamente expô-la da cavidade abdominal, colocando uma pressão constante e suave no abdômen com os dedos (Figura 2). Use uma pinça fechada para empurre suavemente órgãos indesejados volta no abdómen se necessário. Não use pinça aberta como isto pode danificar os rins ou outros órgãos.
- Uma vez que o rim está fora do abdômen, delicadamente separadas de ao redor gordo o suficiente para visualizar a pelve renal, um pequeno ponto branco (figura 1B). Empurre o excesso de gordura para um lado ou remover se necessário. Não se esqueça de remover a glândula adrenal, localizada perto do polo superior do rim, ou a cápsula renal.
- Usando fechado fórceps para empurrar para baixo do lado direito do rim para que a pelve renal permanece no modo de exibição, segure a seringa de insulina carregado com a mão direita e segurar a paralela à superfície de trabalho com a agulha apontada para a pelve renal (Figura 2E). Insira a agulha cuidadosamente a pelve renal do rim imobilizado como mostrado na figura 1B.
- Injete a solução rapidamente dentro de três s. Cerca de um terço do rim pode limpar e mudar a cor para branco.
Nota: É comum observar o acúmulo de líquido na injeção seguinte cápsula do rim, bem como a formação de um hematoma. Algum dano é necessário para atingir um nível suficiente de Transfeccao de DNA para a deteção. - Mantenha a agulha no lugar por aproximadamente 10 s para evitar o refluxo da solução. Então, lentamente e com cuidado retire a agulha. Devolva o órgão para a cavidade abdominal delicadamente esticando o local da incisão e usando fechado fórceps.
- A camada muscular do animal de sutura com 5-0 reabsorvível, colocação knots independentes 2-4.
- A camada de pele do animal de sutura com suturas não absorvíveis de nylon 5-0 ou 6-0, colocação knots independentes 2-4.
Nota: Instrumentos cirúrgicos podem ser reutilizados após a colocação em um banho de grânulo estéril e arrefecidos.
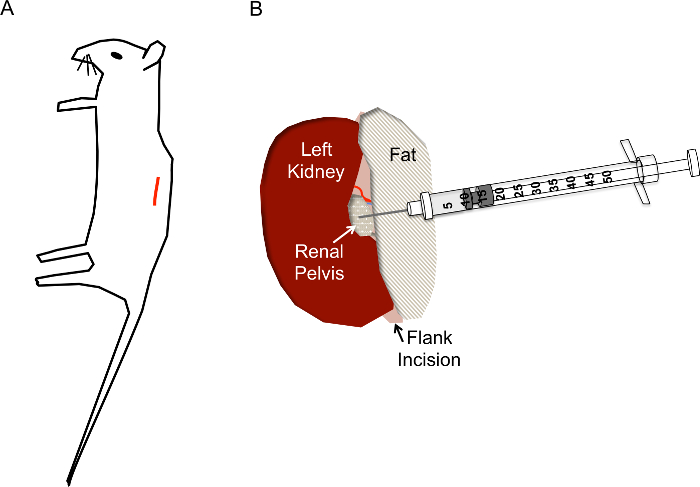
Figura 1. Posicionamento do site e agulha incisão correta para injeções de hidrodinâmica pelve renal. A) a incisão (linha vermelha) deve ser localizado aproximadamente 1 cm da coluna vertebral e cerca de 1 cm abaixo da caixa torácica do mouse. B) depois que o rim é exposto através da incisão do flanco, a pelve renal deve ser localizada como um meio de pequeno amarelado claro/branco ponto abaixo do rim. A injeção não deve incomodar a veia renal, artéria renal ou ureter. A agulha da seringa de insulina é inserida diretamente na pelve renal, conforme mostrado a uma profundidade de cerca de 0,5 cm e rapidamente deprimida em 2-3 s. , por favor clique aqui para ver uma versão maior desta figura.
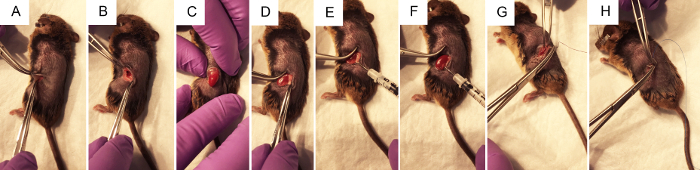
Figura 2. Os passos cirúrgicos para executar a injeção hidrodinâmica de pelve renal de Plasmideo DNA. A) fórceps beliscar a pele para permitir que o cirurgião fazer uma incisão do flanco ~ 1 cm com um bisturi, primeiro através da camada de pele, depois através da camada muscular. B) usando dois pares de pinças fechadas para abrir a ferida operatória, o rim é visualizado dentro do abdômen, se possível. C) com uma pressão suave sobre o abdome, sem tocar em nenhum órgão diretamente, o rim é exposto através da incisão do flanco. D) gordura é suavemente dissecada do rim, perturbá-la o menos possível para conseguir o acesso para a pelve renal. E) prensagem no lado direito do rim esquerdo para melhor Visualizar a pelve renal, a seringa é realizada com o polegar sobre o depressor e a agulha é colocada com cuidado mas com firmeza para a pelve renal. F) seguir o < 3 injeção de s, de compensação pode ser observadas nas áreas do rim que recebeu o grosso da injeção. G) sutura absorvível vicryl roxo estéreis é usada para fazer nós independentes de 2-4 na camada muscular. H) suturas não absorvíveis de nylon azul estéreis são usadas para fazer nós independentes de 2-4 na camada de pele. Clique aqui para ver uma versão maior desta figura.
- Recuperação da cirurgia e acompanhamento pós-operatório.
- Fornece os ratos com analgésico, de acordo com exigências de IACUC da instituição para controle da dor. Por exemplo, administre buprenorfina por via subcutânea cada 8-12 h por 48 h post-operatively se dano renal relacionados com AINE é deve ser evitada para o estudo.
- Manter os ratos em um calor pad e participaram pelo investigador até totalmente móvel com prostração esternal. Quando totalmente recuperado, retorne os ratos para uma gaiola limpa, contendo uma pequena quantidade de roupa de cama de sua gaiola em casa para reduzir o stress. Fazer não casa de ratos submetidos a cirurgia com ratos ingênuos.
Nota: A condição dos ratos vai melhorar rapidamente, aparecendo por ter um comportamento normal dentro de 24-48 h. - Dar fluidos salinos e analgesia aumento de ratos que aparecem estressados para melhorar sua condição. Se os ratos não recuperar rapidamente, medir o peso do rato e eutanásia em ratos que perderam maior que 20% do seu peso corporal inicial. Eutanásia em ratos aparecendo urêmica ou caso contrário moribundo. Possíveis problemas de saúde são detalhados na tabela 1.
Nota: Os ratos às vezes remover suas suturas externas ou as suturas se soltado antes da sutura da ferida. Pobre sutura da camada muscular com uma camada de pele intacta pode resultar em uma hérnia no local da incisão, indicado pelo abaulamento. Em tais casos, colocar o rato sob anestesia (isoflurano é mais rápido que a xilazina/cetamina) e reparar o local cirúrgico com suturas novos logo que possível. Se as suturas não absorvíveis pele permanecerem após 10-14 dias, removê-los. Ocasionalmente os ratos podem remover suturas de seus companheiros gaiola ou lutar. Remova os ratos agressor de sua própria jaula com enriquecimento para impedi-los de magoar os outros ratos, logo que tal comportamento é identificado. - Quando atingem-se saúde ou pontos de extremidade experimentais, eutanásia nos ratos, por inalação de dióxido de carbono ou overdose de isoflurano, seguido por um método secundário de eutanásia como deslocamento cervical de acordo com o procedimento operacional padrão para eutanásia em Coloque na instituição
| Causa | Início | Número de ratos afetados | Sintomas | Ação imediata | Solução a longo prazo | ||
| Endotoxinas DNA contido | pós-injeção de 6-40 h. | Susceptíveis de afectar cada rato dado a preparação de DNA contaminada. | Problemas respiratórios, sinais de dor intensa, falência de órgãos, morte. | Eutanásia nos ratos afetados. Teste cada componente injetado de endotoxinas com lisado de Limulus métodos. | Use kits de maxiprep livre de endotoxinas e apenas labware estéril e nova ou tratada com NaOH. Use um buffer adquirido comercialmente, endotoxinas-testado para diluir o DNA. | ||
| Overdose de anestesia | Durante a cirurgia, antes ou após a injeção de DNA. | Pode afetar apenas os ratos mais jovens, menores ou mais magros. | Cesse a respiração enquanto na almofada de aquecimento, micção. | Diminua a anestesia para ratos restantes. | Verifique o protocolo para precisão de dosagem e preparação. Excluir "moleques". Consulte o veterinário se utilizou a dose adequada. | ||
| Bolha de ar na seringa ou agulha usada para a injeção | Imediatamente após a injeção da pelve renal. | A menos que todas as seringas foram carregadas descuidadamente, isso afeta somente um rato. | Falta de ar. | Verifique o restantes seringas para sinais de bolhas de ar. | Seringas de preparar cuidadosamente, tocando a seringa para remover as bolhas no fundo. Melhora as condições de iluminação para visualizar melhor as bolhas. | ||
| Abertura do local cirúrgico | pós-injeção de 12-72 h | Um ou mais ratos. Às vezes a cela toda. | Ferida aberta, normalmente nenhum outro perigo | Repita a suturas para reparar a ferida cuidadosamente sob anestesia de isoflurano com técnica estéril. Pode ser necessário irrigar com soro fisiológico ou remover bordas de ferida com uma tesoura. | Se todos os ratos têm suturas muito curtas ou ausentes, pode haver um rato removê-los, para que os ratos podem ser separados. Melhore a técnica de sutura. Use knots independentes. | ||
| Hérnia no local da cirurgia | 48 + h pós-injeção | Um ou mais ratos. | Monte está visível no local cirúrgico. | Sob anestesia isoflurano com técnica estéril, corte a pele curada para revelar hérnia da camada muscular. Substituir os órgãos no peritônio, reparar a camada muscular com suturas absorvíveis e fechar o site. | Isso indica que o pobre sutura da camada muscular. Melhore a técnica de sutura. Use knots independentes. | ||
| Insuficiência renal | 48 + h pós-injeção | Um ou mais ratos. | Perda de peso > 20%, tornando-se possivelmente urêmica, debruçado postura | Fornecer a solução salina e aumentar ou prolongar a analgesia. Se nenhuma melhora for observada, sacrifica os ratos afetados. | Altere o estado de doença do animal para torná-lo menos grave. Altere o transgene para ser menos forte ou inducible. Injecte ratos em um Commit anterior na progressão da doença. | ||
| Abcesso ou infecção | Dias ou semanas após a cirurgia | Um ou mais ratos. | Abcesso palpável ou sinais de sepse | Eutanásia nos ratos afetados. Solicitação de necropsia para confirmar a suspeita de infecção. | Isso pode ocorrer quando as condições cirúrgicas e injeções não são suficientemente estéril. O procedimento mostrado é para ratos com um sistema imunológico normal, mas ainda devem ser tomadas precauções na fixação dos animais imunocomprometidos, tais como aqueles tratados com ciclofosfamida. | ||
Tabela 1. Tabela de potenciais problemas de saúde encontrados durante o protocolo de injeção de pelve renal. Embora os problemas de saúde listados não são comuns, há um número de erros relacionados ao investigador que podem ocorrer durante o curso do procedimento. Esta tabela pode ser de ajuda na prevenção e diagnóstico dos problemas de saúde, bem como para a implementação de possíveis soluções para evitar que tais problemas ocorram no futuro. Com a prática, os investigadores devem esperar problemas de saúde pouco frequentes e mortalidade devido ao processo.
3. avaliar a eficiência e o transgene efeitos de injeção
- Use um ensaio bem desenvolvido para o transgene desejado para avaliar a eficiência do transfection. Use controles positivos e negativos com cuidado para certificar-se de que o ensaio é específico.
Nota: Dependendo da escolha do promotor, ratos provavelmente terá a mais forte expressão do transgene em 1 dia; sempre na primeira semana depois da injeção. - Execute ao vivo de imagem animal de luciferase introduzindo 10 µ g de luciferase-expressando de shRNA como luciferase de vaga-lume reforçada ao DNA diluído para injeção.
- Limpe todas as superfícies expostas aos ratos. Coloque a primeira cela de ratos para a câmara e o selo fechada. Certifique-se de não há suficiente isoflurano para o experimento, verificando o gage; Se não, adicione isoflurano até o nível atingir a linha de "máxima". Inicie o fluxo de isoflurano, girando o dial de isoflurano para 3.5 e o oxigênio para 2.
- Injete cada rato por injeção intraperitoneal com 100 µ l de luciferina descongeladas 30 mg/mL. Registre o tempo.
- Abra o software para controlar a máquina de imagem clicando no ícone do rato laranja e amarelo. Em "Select/Add User ID", escolha as iniciais corretas no menu suspenso ao lado de "ID de usuário". Clique em "Okey". Na barra de menu superior, clique em "Aquisição" e selecione "Autosave para..." do menu drop-down. Selecione a pasta ou crie uma nova pasta para salvar os dados.
- Vá para a caixa de aquisição de imagem no canto inferior direito. Verifique se as configurações automáticas são como segue: Binning, médio; F/Stop, 1 para 8 luminescentes, para fotografia; Filtro de emissão, aberto; Modo de imagem, verifica apenas ao lado Luminescent, fotografia, sobreposição e alinhamento. Clique em "inicializar" para inicializar o sistema e aguarde a inicialização terminar e, em seguida, alterar o "campo de visão" para "E" para cinco ratos de imagem.
- Gire a válvula para a tubagem de anestesia, tais que o nosecones dentro da máquina estão administrando o isoflurano. Coloca os animais dentro da máquina de imagens na ordem desejada em seus estômagos com as costas virada para a câmera acima para visualizar os rins. Se mais do que uma gaiola é para ser fotografada, coloca a gaiola próxima na câmara de isoflurano.
- 5-10 min após injeção de luciferina, pressione "Adquirir" para levar a imagem.
- Na "Paleta de ferramentas" no lado direito, clique em "Ajustar imagem." Sob a "Escala de cores," diminua a barra de "Min" até expressão é evidente em todos os mouses esperados, visualizados como roxo sobre cada rim de rato. Se algum rato não mostram expressão, reinjeção os ratos com 100 µ l de luciferina e esperar pelo menos 3 min antes de readquirir.
- Se a imagem tem saturado pixéis, diminuir o tempo de exposição e readquirir para obter uma imagem quantitativa, como a presença de pixels saturados resultará em subestimar a eficiência do transfection. O menor tempo de exposição possível é 0,5 s.
- Se a imagem mostra apenas expressão do gene fraco na primeira vez de exposição, aumente o tempo de exposição até 2 min e readquirir. Cada vez que a imagem é retomada, os dados são nenhuma na pasta escolhida para que todas as imagens estão disponíveis para uma análise mais adicional mais tarde.
- Repita as etapas de imagem para gaiolas subsequentes de ratos.
- Retire os ratos da máquina da imagem latente. Desligue o gás. Limpe a câmara, nosecones e transferência de imagem. Feche o programa de computador.
Nota: O software irá pedir para "Salvar o conjunto de dados." Isto refere-se a manipulações feitas para o dataset, não os dados em si.- Clique em "Sim" para salvar as alterações para as regiões de interesse (ROIs) e escala. Clique em "Não" para reverter para as configurações originais para as imagens.
- Para análise de dados, abra o software. Na "Paleta de ferramentas" clique em "Ferramentas ROI". Clique no ícone de círculo e clique em "1" no menu drop-down para colocar um ROI de novo na janela da imagem conforme indicado por um oval vermelho com quatro quadrados em torno dele. Ajuste o tamanho do ROI, colocando o cursor do mouse sobre um quadrado vermelho e arrastando para delimitar a área roxa, sobrepondo o rim injetado.
- Com o cursor sobre um quadrado vermelho sobre o ROI, botão direito do mouse e selecione "Duplicate ROI" para criar um novo ROI na janela de imagem e movê-lo para o mouse próximo. Repita o procedimento até que todos os ratos na imagem tem um ROI sobre o rim injetado.
- No menu diretamente acima da imagem, alterar "Unidades" de "Conta" para "Radiance (fótons)." Para exportar os dados ROI, em "Paleta de ferramentas", clique em "Ferramentas de ROI", em seguida, clique no ícone do lápis/régua para criar uma folha de cálculo das medições. Use a medida de "Avg Radiance" em uma análise mais aprofundada no programa de análise e estatísticas de dados de escolha.
- Realize a coloração das seções como descrito11.
Nota: A injeção não transfect o rim todo igualmente para que seções diferentes irão capturar a transfeccao diferentes eficiências11. Injeção de co de grânulos como o látex fluorescente microesferas podem ajudar a identificar as regiões deverá ser transgene-positivo (Figura 3D)11. Otimização do protocolo de coloração é extremamente importante. - Execute o borrão ocidental para identificar o gene de interesse no rim transfectado.
Nota: A colheita de órgãos para extratos de proteína deve ser feita no gelo. Novamente, não use uma fatia pequena do órgão como esta área pode não ter sido transfectada bem. Transfecção é desigualmente distribuída por todo o órgão então combinar diferentes áreas e piscina-los. Pelve renal injeção hidrodinâmica de um plasmídeo produzir eritropoietina o hormônio resultou em um aumento modesto do hematócrito, então espera-se que produtos secretados transgene devem ser encontrados na circulação11. - Para expressão de alto nível a longo prazo dos transgenes, combine um sistema de vetor a integração com agentes imunossupressores como a ciclofosfamida. A resposta imune para o transgene ocorre sobre o primeiro, várias semanas depois da injeção e é robusto11.
Resultados
A técnica de cirurgia e injeção são simples para executar uma vez dominado, exigindo sem grandes equipamentos ou materiais caros. Se novo para cirurgia de rim de flanco-incisão, um dia de treinamento em vários ratos agendada para eutanásia devem em que os ratos não são recuperados de cirurgia seguir porque a primeira tentativa desta cirurgia pode levar muito mais tempo do que o normal. Alternativamente, os investigadores familiarizados com técnicas similares podem achar bastante...
Discussão
Neste protocolo é descrito um método robusto para atingir a expressão do gene pode ser reproduzido especificamente no rim. Nas mãos de um cirurgião experiente moderadamente encontramos a porcentagem de ratos transfectadas por esta técnica para estar na faixa de 50-100%, dependendo da idade do rato e a sensibilidade da leitura do transgene. O nível de expressão do gene do luciferase foi acima do fundo por vários meses em ratos recebendo piggyBac transposões e completamente mantido por várias semanas em...
Divulgações
Os autores não têm nada para divulgar e não declarar nenhum conflito de interesses.
Agradecimentos
American Heart Association [15GRNT25700209] suporte J.C. e com um prêmio de desenvolvimento de carreira do departamento de assuntos de veteranos [BX002797] suporte L.E.W. e o National Institutes of Health [R01-DK095867] O National Institutes of Health [DK093660], departamento de assuntos de veteranos [BX002190] e o centro de Vanderbilt para doença renal com suporte M.H.W. Este material é o resultado de trabalho apoiado com recursos e utilização das instalações do sistema de cuidados de saúde VA Tennessee Valley.
Materiais
| Name | Company | Catalog Number | Comments |
| AnaSed Xylazine | Patterson Veterinary | 07-808-1947 | Anesthetic - Not controlled substance |
| BD Insulin Syringe 0.5 mL 29G 1/2 Inch | Cardinal Health | 309306 | Required syringes |
| Buprenex | Pharmacist/Veterinarian | Analgesia - Controlled Substance | |
| Dynarex Disposable Towel Drape | Thermo Fisher Scientific | 19-310-671 | Place over heat pad |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | Use only endotoxin-free plasmid DNA |
| Endosafe Gel-Clot LAL Rapid Positive Control | Charles River | PC200 | Positive control for endotoxin test |
| Endosafe Gel-Clot LAL Rapid Single Test Vial | Charles River | R13500 | Endotoxin test |
| Extra Fine Micro Dissecting Scissors | Roboz Surgical Instrument | RS-5882 | Surgical tool |
| Fisherbrand Instant Sealing Sterilization Pouch - 9" | Thermo Fisher Scientific | 01-812-51 | For autoclaving surgical tools |
| Gaymar Heat Pump | Paragon Medical | TP-700 | Water-circulating heat pump |
| Germinator 500 | Roboz Surgical Instrument | DS-401 | To reuse surgical tools during surgery |
| Graefe Forceps | Roboz Surgical Instrument | RS-5136 | Surgical tool |
| Graefe Tissue Forceps | Roboz Surgical Instrument | RS-5153 | Surgical tool |
| Halsey Needle Holder, 5" Length | Roboz Surgical Instrument | RS-7841 | Surgical tool |
| Heat pads - 15" x 21" - need at least 3 | Paragon Medical | TP22G | For use with Gaymar Heat Pump |
| IsoFlo (Isoflurane, USP) | Abbott Animal Health | 5260-04-05 | For imaging and euthanasia |
| Isotec Isoflurane Delivery System Vaporizor | Smiths Medical | VCT3K2 | For imaging and euthanasia |
| Ketamine | Pharmacist/Veterinarian | Anesthetic - Controlled Substance | |
| Kimwipes | Kimberly-Clark Professional | 34120 | Laboratory tissues |
| Living Image software | Caliper Life Sciences | For live animal imaging | |
| Luciferin | Perkin Elmer | 122796 | For live animal imaging |
| Nanodrop 2000 | Thermo Scientific | ND-2000-US-CAN | Spectrophotometer for DNA measurement |
| Prevantics Swabs | Thermo Fisher Scientific | 23-100-110 | For skin surgery prep |
| Prolene 5-0 sutures Taper 30" | Thermo Fisher Scientific | NC0256891 | Non-absorbable sutures for skin |
| Puralube Brand Opthalmic Ointment | Patterson Veterinary | 07-888-2572 | To keep eyes moist during surgery |
| Trans IT - QR Hydrodynamic Delivery Solution | Mirus Bio | MIR-5240 | Hydrodynamic delivery buffer for diluting DNA |
| Vicryl 5-0 Sutures J303H | Thermo Fisher Scientific | NC9816710 | Absorbable sutures for muscle layer |
| Wahl Mini Arco Clipper | Med-Vet International | 8787-1550 | Shaver for skin prep |
| Xenogen IVIS 200 | Caliper Life Sciences | For live animal imaging |
Referências
- Liu, F., Song, Y., Liu, D. Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA. Gene Ther. 6 (7), 1258-1266 (1999).
- Zhang, G., Budker, V., Wolff, J. A. High levels of foreign gene expression in hepatocytes after tail vein injections of naked plasmid DNA. Human Gene Therapy. 10, 1735-1737 (1999).
- Fumoto, S., Nishimura, K., Nishida, K., Kawakami, S. Three-Dimensional Imaging of the Intracellular Fate of Plasmid DNA and Transgene Expression: ZsGreen1 and Tissue Clearing Method CUBIC Are an Optimal Combination for Multicolor Deep Imaging in Murine Tissues. PLoS One. 11 (1), e0148233 (2016).
- Yoshino, H., Hashizume, K., Kobayashi, E. Naked plasmid DNA transfer to the porcine liver using rapid injection with large volume. Gene Ther. 13 (24), 1696-1702 (2006).
- Kamimura, K., Suda, T., Xu, W., Zhang, G., Liu, D. Image-guided, lobe-specific hydrodynamic gene delivery to swine liver. Mol Ther. 17 (3), 491-499 (2009).
- Kamimura, K., Zhang, G., Liu, D. Image-guided,intravascular hydrodynamic gene delivery to skeletal muscle in pigs. Mol Ther. 18 (1), 93-100 (2010).
- Suda, T., Liu, D. Hydrodynamic gene delivery: its principles and applications. Mol.Ther. 15 (12), 2063-2069 (2007).
- Alino, S. F., et al. Naked DNA delivery to whole pig cardiac tissue by coronary sinus retrograde injection employing non-invasive catheterization. J Gene Med. 12 (11), 920-926 (2010).
- Suda, T., Gao, X., Stolz, D. B., Liu, D. Structural impact of hydrodynamic injection on mouse liver. Gene Ther. 14 (2), 129-137 (2007).
- Skrypnyk, N. I., Harris, R. C., de Caestecker, M. P. Ischemia-reperfusion model of acute kidney injury and post injury fibrosis in mice. J Vis Exp. (78), (2013).
- Woodard, L. E., et al. Kidney-specific transposon-mediated gene transfer in vivo. Sci Rep. 7, 44904 (2017).
- Liang, A., et al. Loss of glutathione S-transferase A4 accelerates obstruction-induced tubule damage and renal fibrosis. Journal of Pathology. 228 (4), 448-458 (2012).
- Liang, M., et al. Protective role of insulin-like growth factor-1 receptor in endothelial cells against unilateral ureteral obstruction-induced renal fibrosis. Am J Pathol. 185 (5), 1234-1250 (2015).
- Corridon, P. R., et al. A method to facilitate and monitor expression of exogenous genes in the rat kidney using plasmid and viral vectors. Am J Physiol Renal Physiol. 304 (9), F1217-F1229 (2013).
- Wallace, D. P., et al. Tracking kidney volume in mice with polycystic kidney disease by magnetic resonance imaging. Kidney Int. 73 (6), 778-781 (2008).
- Woodard, L. E., Wilson, M. H. piggyBac-ing models and new therapeutic strategies. Trends Biotechnol. 33 (9), 525-533 (2015).
- Yeikilis, R., et al. Hydrodynamics based transfection in normal and fibrotic rats. World J Gastroenterol. 12 (38), 6149-6155 (2006).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. (41), (2010).
- Wooddell, C. I., et al. Muscle damage after delivery of naked plasmid DNA into skeletal muscles is batch dependent. Hum Gene Ther. 22 (2), 225-235 (2011).
- Crespo, A., et al. Hydrodynamic liver gene transfer mechanism involves transient sinusoidal blood stasis and massive hepatocyte endocytic vesicles. Gene Ther. 12 (11), 927-935 (2005).
- Rocca, C. J., Ur, S. N., Harrison, F., Cherqui, S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Ther. 21 (6), 618-628 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados