Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cinemática ocular midiendo In Vitro la estimulación de los nervios craneales en la tortuga
En este artículo
Resumen
Este protocolo describe cómo utilizar una en vitro aislado tortuga cabeza preparación para medir la cinemática de los movimientos del ojo. Después del retiro del cerebro del cráneo, los nervios craneales pueden ser estimulados con corrientes cuantificar rotaciones y cambios en el tamaño de la pupila.
Resumen
Después de que los animales son sacrificados, los tejidos comienzan a morir. Las tortugas ofrecen una ventaja debido a un tiempo de supervivencia de sus tejidos, especialmente en comparación con los vertebrados de sangre caliente. Debido a esto, se pueden realizar experimentos en vitro en tortugas para largos períodos de tiempo para investigar las señales neuronales y control de sus acciones de blanco. Con una preparación aislada de cabeza, medimos la cinemática de los movimientos oculares en tortugas, y su modulación por señales eléctricas por los nervios craneales. Después de que el cerebro fue quitado del cráneo, dejando intactos los nervios craneales la cabeza disecada fue colocada en un cardán para calibrar los movimientos de los ojos. Electrodos de vidrio fueron atados a los nervios craneales (oculomotor, trochlear y abducens) y estimulada con corrientes para evocar los movimientos de los ojos. Nos vigila movimientos de los ojos con un video infrarrojo de seguimiento sistema y cuantificada de rotación de los ojos. Corriente de pulsos con una gama de amplitudes, frecuencias, y las duraciones del tren fueron utilizadas para observar efectos sobre las respuestas. Porque la preparación se separa del cerebro, la vía eferente va a objetivos musculares puede examinarse aisladamente para investigar señales neuronales en ausencia de la información sensorial procesada centralmente.
Introducción
Justificación para el uso de las tortugas de orejas rojas Slider en experimentos electrofisiológicos:
Resbalador Rojo-espigado tortugas (Trachemys scripta elegans), son considerados uno de los peores de las especies invasoras del mundo1 y puede indicar que un ecosistema está en problemas. La razón de por qué tienen tanto éxito las tortugas resbalador Rojo-espigado es mal entendida pero en parte puede ser debido a su fisiología tolerante y posesión de los tejidos nerviosos que pueden sobrevivir bajo condiciones hipóxicas2,3,4 . Uso para experimentación no amenaza a sus números y con esfuerzos mínimos, preparaciones electrofisiológicas pueden permanecer viables sobre duraciones extendidas, tanto como 18 horas5,6. El beneficio es similar a la ventaja de usar animales invertebrados como cangrejos7, que también tienen la capacidad de resistir bajos niveles de oxígeno8.
Técnicas para la medición de movimientos de los ojos:
Enfoques para medir los movimientos oculares en animales frontal-eyed con primates no humanos han sido bien desarrolladas9. El ojo gira en la órbita alrededor de tres ejes: horizontal, vertical y torsional. El método de la bobina de búsqueda magnético se considera generalmente el más confiable para medirlas rotaciones, pero es invasivo, que requiere pequeñas bobinas para ser insertado en el scleras de animales10,11. Sistemas de video también pueden medir rotaciones y tienen la ventaja de ser no invasivo. El desarrollo de mejores cámaras con procesamiento de imágenes innovadoras han mejorado su funcionalidad hacer sistemas basados en vídeo una alternativa atractiva al considerar12,13,14.
Las técnicas desarrolladas para la medición de movimientos de los ojos en nonmammals han sido mucho menos importantes. Las medidas son cualquiera baja resolución o describen sólo algunas de las rotaciones15,16,17,18. La falta de desarrollo puede ser parcialmente atribuyó a la dificultad de nonmammals de formación a seguir objetivos visuales. Aunque los movimientos de los ojos han sido bien estudiados en el resbalador Rojo-espigado tortugas19,20,21,22,23,24,25 ,26,27,28,29,30, debido al desafío en animales del entrenamiento para realizar un seguimiento de objetivos, la cinemática exacta de sus movimientos del ojo está mal entendido.
Tortugas resbalador Rojo-espigado generalmente son considerados como vertebrados con ojos laterales, pero porque puede retraer completamente su cabeza en su concha31, obstrucción significativa de los campos de visión lateral por el caparazón produce32. El resultado es que su línea de vista visual es forzado hacia el frente, haciendo que se comporte más como mamíferos frontal-eyed. Por lo tanto, su uso como un modelo para el desarrollo de enfoques para la medición de movimientos de los ojos también ofrece una perspectiva evolutiva única.
El protocolo descrito en este trabajo utiliza una preparación de cabeza en vitro aislado para identificar la cinemática de los movimientos del ojo en las tortugas de orejas rojas slider. Se disecan los cerebros de los cráneos dejando intactos los nervios craneales. Las cabezas se colocan en un cardán para calibrar los movimientos de los ojos y evocar respuestas por estimulación eléctrica de los nervios craneales inervan los músculos del ojo. Medidas de rotaciones por los ojos se realizan mediante un sistema basado en el video, usando algoritmos de software, que la pista la pupila oscura y las manchas del iris. La preparación proporciona la oportunidad de medir cinemática de ambos extraocular (es decir, rotación horizontal, vertical o torsional)32 y intraocular (es decir, cambios de la pupila)33 movimientos.
Sistema modelo para el análisis de vías nerviosas eferentes:
Más generalmente, el enfoque proporciona a los investigadores la oportunidad para estudiar señales neuronales eferentes cómo generar movimientos de los ojos cuando los músculos de sus Estados relajados y en la ausencia de información sensorial integrada, procesada por el cerebro32, 33. Por lo tanto, la cinemática del ojo puede ser examinada en un sistema modelo en el que únicamente son procesados por la vía neural eferente dejando el cerebro y conectado a los músculos.
Protocolo
Nota: Las tortugas resbalador Rojo-espigado, machos y hembras, fueron compradas de un vendedor. Las tortugas fueron alojadas en una suite de animal caliente que contiene dos tinas de 60 galones equipados con islas de ladrillo para asolearse bajo luces infrarrojos 250 W. El ambiente se mantuvo en un ciclo de luz/oscuridad de 14/10-h con la temperatura del agua a 22 ° C. Luces se enciende a las 6:00 y apagar en 20:00. Los tanques equipados con sistemas de filtración se limpiaron semanalmente y tortugas fueron alimentadas ad libitum con cada otro día. El cuidado del resbalador Rojo-espigado tortugas y todos los siguientes procedimientos experimentales descritos aquí32,33 fueron aprobados por el cuidado Animal institucional y Comité uso (IACUC) en Lafayette College.
1. equipo instalación
- Preparar solución de Ringer de tortuga. Agregue lo siguiente al agua destilada en este orden: cloruro de sodio 96,5 mM (58.44 g/mol), cloruro de potasio 2,6 mM (74.56 g/mol), cloruro de magnesio 2,0 mM (203.31 g/mol), bicarbonato de sodio 31,5 mM (84.01 g/mol), dextrosa 20,0 mM (180.16 g/mol), concentrado ácido clorhídrico para ajustar el pH a 7.51 y cloruro de calcio 4.0 mM (110.98 g/mol) (véase Tabla de materiales). Mezcle la solución añadiendo cada sal.
PRECAUCIÓN: El HCl concentrado es peligrosa (piel, ojos, inhalación e ingestión peligros). - Hacer sugerencias para los electrodos de succión de 5 cm de largo tubo capilar de vidrio (véase Tabla de materiales), por el fuego-pulido a diferentes tamaños de diámetro interior para dar cabida a los nervios craneales de espesor variable.
- Utilice una lima pequeña para grabar una línea a través de un pedazo de vidrio capilar. Colocar en papel de seda y romper por la mitad.
- Poco a poco rodar uno de los extremos del vaso capilar en la llama de un mechero de Bunsen. Examinar periódicamente la punta para el tamaño, la suavidad y la simetría con una disección alcance y una luz de fibra óptica de la fuente (véase Tabla de materiales).
Nota: Para las tortugas de cabeza anchura entre 20 y 30 mm, diámetro interior óptimo ajuste tamaños generalmente rango de 0,4 a 0,8 mm para el nervio oculomotor (nIII), 0.3 a 0.6 para el nervio troclear (nIV) y 0,2 a 0,4 mm para el nervio abducens (nVI).
- Limpiar y organizar gubias, una sonda de disección Roma, microscissors, pinzas finas, pinzas curvas y un mango de bisturí con hojas (véase Tabla de materiales) para la disección.
Nota: La esterilización de los instrumentos es opcional.
2. anestesia y eutanasia
- Lugar la tortuga en un hielo del cubo durante 60 min a cryoanesthetize lo.
- Eutanasia a la tortuga por decapitación con una pequeña guillotina animal (véase Tabla de materiales).
- Levante suavemente las mandíbulas del animal abierto con una pequeña espátula de pesaje para que un gancho se introduce y se dio vuelta para quedar bajo la punta de la mandíbula superior.
- Tire con constante presión para extender la cabeza del animal a través de la guillotina. Decapita rápidamente a los animales.
- Coloque la cabeza en un plato de disección. Tiene solución de Ringer de suficiente tortuga para irrigar el tejido. Oxigena la solución con 95/5 O2/CO2 (véase Tabla de materiales).
- Mantener el tejido en 4 ° C mediante la colocación de hielo en el exterior del plato.
3. disección
- Utilice el alcance de la disección con una fuente de luz óptica de fibra para llevar a cabo la disección.
- Retire la mandíbula inferior. Coloque una sonda de disección Roma a través de la boca para proporcionar una dirección más fácil de la cabeza. Corte de la articulación que conecta el hueso dental al cráneo con un bisturí. Uso gubias para tirar de la quijada más baja del cráneo. Usar gubias para quitar la piel y los músculos de sus accesorios en las regiones dorsales y laterales del cráneo.
- Quitar la columna vertebral.
- Identificar la columna vertebral en el extremo caudal del cráneo. Doblar la columna vertebral ventral para exponer la médula espinal. Utilice microscissors para cortar la médula espinal. Utilizar gubias para quitar la columna vertebral y otros tejidos de cráneo tirando caudalmente.
- Extraer el cerebro del cráneo después de cortar los nervios craneales.
- A partir de la botella doble de agujero, utilizar gubias para cortar dos incisiones en el cráneo dorsal. Hacer cortes superficiales para evitar daños en el cerebro por debajo.
- Usar gubias para sacar cuidadosamente el cráneo dorsal. Utilice microscissors para quitar el meninx para exponer al resto del cerebro. Retire suficiente meninx hasta los bulbos olfativos, en la cavidad craneal anterior, se puede identificar (ver figura 1A). Seguir irrigar el cerebro con solución de Ringer de tortuga, como sea necesario.
- Uso de fórceps curvado suavemente tirar caudalmente el cerebro y producir leve tensión sobre los nervios craneales. Cuidadosamente corte y retire los bulbos olfativos y cerebro con fórceps curvado.
- Use microscissors para empujar suavemente el midbrain hacia la línea media para exponer los nervios craneales; nIII, se observan unos 0,6 mm, frente a nIV, y el diámetro de la VNI será ligeramente inferior a la nIII. Corte nIII y nIV donde unen al cerebro medio (ver figura 1B). Repetir este proceso en el otro lado.
- Corte del izquierda y derecho del nervio óptico (nII) con microscissors. Luego incline el tronco encefálico hacia un lado. Observar nVI emergiendo de la superficie ventral cerca del cruce del puente de Varolio y la médula (véase figura 1); el diámetro de la nVI es pequeño y aproximadamente 0,3 mm. cortar tanto la nVI izquierdo y derecho.
- Quitar las partes restantes del médula oblonga de la tortuga con microscissors y pinzas finas. Una vez vaciado el cráneo, examinar el piso de la cavidad craneal. Identificar nIII, nIV y nVI.
- Retire los párpados superiores e inferiores con pinzas finas y microscissors.
4. calibración de los movimientos de los ojos
- Utilice una tabla rígida (véase Tabla de materiales) para apoyar la colocación del cardán y otros instrumentos. Coloque la cabeza de la tortuga en el mandril de cardán para que la superficie dorsal de la cabeza es paralela al horizonte con un pequeño nivel de burbuja de descanso a través del cráneo. Aproximadamente, coloque uno de los ojos en el centro de rotación horizontal y vertical de cardán.
- Coloque la cámara infrarroja, con una luz infrarroja diodo (LED), que forma parte del sistema de seguimiento de ojo basado en video (véase Tabla de materiales), en una distancia de aproximadamente 12 cm de ojo de la tortuga.
- Ángulo de la cámara 45 grados por encima de la línea de visión del ojo. El LED debe estar en la posición de 11:00 en la lente de la cámara. Centro el LED a lo largo del eje óptico del ojo. La cámara será ligeramente fuera de eje (como vista desde arriba del ojo).
- Ajustar la distancia de la cámara del ojo para que la vista de cámara es llenada máximo por el globo ocular. Asegurar que las esquinas de los ojos (canthi) en los bordes de la vista horizontal.
- Conecte la cámara al ojo basado en video sistema para procesar los datos de seguimiento. Dividir la señal a un DVD-grabador para capturar el vídeo sin procesar. Enfoque la cámara para obtener una imagen clara del ojo. Tenga cuidado de multa-posición del ojo en el centro de la vista de cámara mediante los tres grados de ajuste lineal (x, y, z) proporcionado con el cardán.
- Detectar a la pupila oscura estableciendo el umbral y el contraste apropiadamente usando el programa con el ojo de vídeo sistema de seguimiento.
- Con el ratón, haga clic en el menú "Video" y en "Mode" seleccione "Alta precisión" para capturar imágenes a una velocidad de muestreo de 30 Hz (resolución de 640 píxeles x 480 líneas). También en "Video", seleccione a "Pupila oscura" para "Alumno tipo" y "Elipse (elipse rotada)" para "Método de segmentación de alumno".
- En la ventana "EyeCamera", pinche en el icono del alumno buscar área «ajuste» (pequeño rectángulo vertical con un punto en el centro). Utilice el ratón para arrastrar a un rectángulo que limita un área alrededor de la pupila. Evitar las zonas oscuras que podrían confundirse con la pupila.
- En la ventana de "Controles", confirman que cajas para "Auto imagen" y el "umbral de bloqueo positivo-seguimiento" estén marcadas. Haga clic en "Auto-umbral" para optimizar la densidad de exploración, que se muestra como puntos verdes sobre la pupila oscura.
- Calibrar la pantalla de video del ojo basado en video programa de seguimiento a las rotaciones de la cardán 12,5 ° (+-) alrededor de su eje horizontal y 10 ° (+-) alrededor de su eje vertical.
- En la ventana de "Control", haga clic en "Pantalla". Marque las casillas debajo de "Mirada" y "Stim" para "Punto de mira", "Calib región" y "Geometría de la red". Después de comprobar las casillas debajo de "Geometría Grid", una ventana se el pop y el decir, "la geometría de la pantalla de estímulo se medirá antes de que puede visualizarse la cuadrícula de la geometría. ¿Desea hacerlo ahora?" Seleccione "Y" para sí.
- Con el ratón, haga clic en el menú "Windows" y seleccionar "Estímulo". Abrirá la ventana de "Estímulo" que muestra un cruce de la línea vertical y horizontal en el centro de la pantalla. Medir las longitudes de las líneas al mm más cercano. Pulse "Esc" del teclado para salir de la ventana de "Estímulo".
- Con el ratón, haga clic en el menú de "Estímulo" y seleccione "Configuración de la geometría". Las longitudes de las líneas que se midieron a la entrada. Ajustar la distancia de visualización para que la línea de grados igual a 25 ° de la línea horizontal y 20 ° de la línea vertical. Haga clic en el botón "Store" y cerrar la ventana.
- En la ventana "EyeSpace", seleccione el número de calibración "Datos punto" a "9". Con el ojo de la tortuga situado en el centro, haga clic en el centro de datos de punto y haga clic en el botón "Volver a presentar".
Nota: Se abrirá la ventana de "Estímulo" y "Get Ready" aparece en el centro de la pantalla. Un cuadro aparecerá en la ubicación del centro y luego desaparecer. Sobre su desaparición, se cerrará la ventana de "Estímulo". Ahora se deberá calibrar la posición central. - Repetir la operación girando el Stick derecha/izquierda,-12,50 °, +12,5 ° y arriba/abajo + 10 /-10 ° a calibrar los puntos restantes.
- Para calibrar la rotación torsional, utilice la plantilla de montaje de algoritmo con el ojo basado en video programa de seguimiento. El algoritmo establece una posición cero basada en las marcas del iris y calcula un ángulo de rotación cuando las marcas se convierten en un desvío desde el centroide de la pupila.
- Con el puntero del mouse, haga clic en el menú "Windows" y seleccione "Torsión". Haga clic en el botón "Inicio" en la ventana de "Torsión". En la ventana "EyeCamera", un arco aparecerá sobre la imagen del ojo.
- Ajustar el radio, el ángulo y la longitud del arco con el cursor en un lugar donde las marcas irregulares están presentes en el iris. Active las casillas de "Gráficos en tiempo real" y "Auto-Set después de ajuste". Si es necesario, ajustar el brillo y el contraste en la ventana de controles y re-umbral la pupila oscura (ver paso 4). Haga clic en el botón "Set plantilla".
- Coloque una regla en el mismo plano focal como la pupila y registre el ancho de la vista de cámara completo. El valor se utilizará más adelante para determinar la anchura real de la pupila.
5. colocación de electrodo de succión en nervio craneal para evocar movimientos oculares
- Coloque con cuidado un electrodo de referencia del pin en el tejido conectivo o muscular restante en la cabeza.
- Coloque el electrodo de succión (véase Tabla de materiales) en el nervio craneal usando un micromanipulador y disección alcance montado en un brazo. Utilice una fuente de luz óptica de fibra para ver y la colocación de la guía.
- Coincide con el tamaño de un nervio a una punta de vidrio capilares. Ensayo y error es necesario para obtener un mejor ajuste en el diámetro de un nervio (ver paso 1.2 para recomendaciones de tamaño). Coloque la punta del cristal hacia el electrodo de succión. Rellenar el electrodo de succión con solución de Ringer y ajustar el volumen dentro de la jeringa aproximadamente la mitad de su capacidad.
- Mueva con cuidado la punta de vidrio del electrodo con el instrumental quirúrgico para una posición por encima del extremo cortado del nervio seleccionado. Asegúrese de que solución de Ringer llena el cráneo y la punta está por debajo de su superficie. Si es necesario, utilizar la arcilla de modelado a la presa hasta lugares donde solución de Ringer es que sale del cráneo.
- Tire el émbolo de la jeringa.
Nota: El vacío extrae el nervio en el extremo de la punta del capilar. El nervio queda dentro de la punta con poco o ningún vacío adicional aplicado indica un buen ajuste.
6. estimulación del nervio craneal y análisis de movimientos del ojo
- Usar un estimulador de nervio/músculo de propósito general con un dispositivo de aislamiento actual (véase Tabla de materiales) para estimular el nervio craneal mediante el electrodo de succión.
- Conectar el electrodo de succión con el actual dispositivo de aislamiento utilizando un cable. Conecte el cable del electrodo de referencia del pin para la conexión a tierra del dispositivo de aislamiento.
- Seleccionar los parámetros de las corrientes de los selectores y enciende el dispositivo estimulador y el aislamiento. Utilizar una gama de corrientes de 1 a 100 mA, con frecuencia de 10 a 400 que Hz. Use 1 o 2 ms impulsos en duración 100, 500 o 1.000 ms trenes.
- Registro de la sincronización de estímulos.
Nota: Los pulsos Transistor-transistor-logic (TTL) se sincronizan con las entregas de las corrientes del estimulador y comunicarse en tiempo real mediante un cable a los canales de entrada del sistema de seguimiento de ojo basado en video. Un módulo de software proporcionado con el ojo basado en video, controles de programa de seguimiento de la comunicación.- Para visualizar el calendario de las aplicaciones actuales y su influencia en los movimientos de ojo, haga clic en el menú de "PenPlots". Selecciona "Posición de la mirada de X", "Posición de la mirada Y", "Torsión" y "Ancho de la pupila" para mostrar en tiempo real datos parcelas X y Y los ojos puestos, torsión y ancho de la pupila. Seleccione también los "segundos & marcadores" del menú "PenPlots" para mostrar una parcela de distribución con marcas, que aparecen a intervalos de 1 s.
Nota: Una letra "T" aparecerá marcado el inicio del pulso TTL, que ocurre simultáneamente con la aplicación actual. - Para almacenar los datos de movimientos del ojo evocados por las corrientes, haga clic en el menú "Archivo" y seleccione "Nuevo archivo de datos" debajo de "Datos". Introduzca un nombre de archivo y pulse «Enter». Datos de ahorro pueden hacer una pausa y luego reinicie utilizando la combinación de comandos de teclas "Ctrl" + "p". Cuando una sesión experimental haya finalizado, seleccione "Cerrar fichero de datos" menú "Archivo" en "Datos".
- Para ayudar a mantener un registro de tipo de corrientes aplicadas, haga clic en el menú "Windows" y selecciona "Datos Pad". Aparecerá la ventana de "Teclado/DataMarker". Haga clic en una letra o un número para identificar los parámetros de los estímulos actuales siendo entregados al nervio.
Nota: por ejemplo, "X" podría estar parado de 10 μA. clic en "X" almacena su entrada en el archivo de datos en tiempo real para el análisis post hoc . También aparece en el "PenPlot" para los "Segundos & marcadores" para la observación continua.
- Para visualizar el calendario de las aplicaciones actuales y su influencia en los movimientos de ojo, haga clic en el menú de "PenPlots". Selecciona "Posición de la mirada de X", "Posición de la mirada Y", "Torsión" y "Ancho de la pupila" para mostrar en tiempo real datos parcelas X y Y los ojos puestos, torsión y ancho de la pupila. Seleccione también los "segundos & marcadores" del menú "PenPlots" para mostrar una parcela de distribución con marcas, que aparecen a intervalos de 1 s.
- Analizar los datos del sistema de seguimiento del ojo.
- Abra el archivo de datos guardados, que está en un formato de texto delimitado, en un programa de hoja de extensión de la opción para organizar los datos y realizar análisis estadístico.
- Convertir los valores de ancho de pupila almacenados en el archivo a tamaño real en mm.
- Convertir los valores de X y Y ojos posiciones y torsiones a las unidades de grados y utilizar convenciones para describir los movimientos de los ojos; por lo tanto, las direcciones positivas de rotaciones: intorsion, elevación y aducción; y la negativa de las direcciones de rotaciones: secuestro, extorsión y depresión.
- Copiar la información de encabezado en una hoja nueva. Se incluirán los valores para el tamaño de pantalla (ancho y alto) y la distancia de la visión. Ocho columnas de los datos recopilados a una frecuencia de 30 Hz a seguir a continuación la información del encabezado.
- Volver a la hoja de cálculo que contiene los datos crudos. Hacer un "hallazgo" por "X" en la última columna titulada "Marcador" para localizar donde se aplicó estimulación con 10 μA. incidencia del hallazgo de "T", marca el comienzo de la estimulación actual. Copiar 15 filas (0,5 s) de datos que ocurre antes de "T" y 90 Marcos después de "T" (3.0 s); es decir, 3,5 total s. Pegar los datos en la hoja de cálculo nueva debajo de la información del encabezado.
- Insertar una columna en blanco después de "PupilWidth". En la columna en blanco, pasar a la dimensión de calibrado en mm:
Diámetro de la pupila horizontal = × "PupilWidth" la dimensión de la anchura de la vista de cámara - Insertar 2 columnas en blanco después de "X_Gaze" y "Y_Gaze". Normalizar las posiciones para las dimensiones de la pantalla de visualización: coordenadas (0, 0) en la parte superior izquierda de la pantalla que se extiende a (1, 1) en la parte inferior derecha. En la primera columna en blanco, traducir posiciones contar con un sistema de coordenadas (0, 0) en el centro de la pantalla. Incluyen la conversión a las dimensiones de la pantalla en mm:
X = (0.5 × ancho) – (× width del "X_Gaze"); Y = (0.5 x altura) – (altura del × del "Y_Gaze")
Nota: La secuencia de operación es para el ojo izquierdo. La secuencia deberá invertirse para el ojo derecho con el fin de seguir la Convención de negatividad para el secuestro y la positividad para la aducción. - En las columnas segunda, utilizar funciones de trigonometría para convertir (°) ángulos de rotación:
rotación horizontal = arctan (Xla distancia de windonw); rotación vertical = arctan (Ydistancia de windonw) - Torsión se muestra ya en unidades de grados, pero para conformarse con Convención de positividad para el intorsion, si la medición se realiza en el ojo izquierdo, multiplicar por -1. Para el ojo derecho, no multiplicación es necesario. El programa códigos de rotación en sentido horario como positivo.
- Trazar el diámetro de la pupila y rotaciones en función del tiempo.
- Abra el archivo de datos guardados, que está en un formato de texto delimitado, en un programa de hoja de extensión de la opción para organizar los datos y realizar análisis estadístico.
Resultados
La figura 1 muestra imágenes fijas de imágenes tomadas de un video que describe la disección. Imágenes ofrecen localizaciones típicas de los nervios antes de cortar el cerebro.
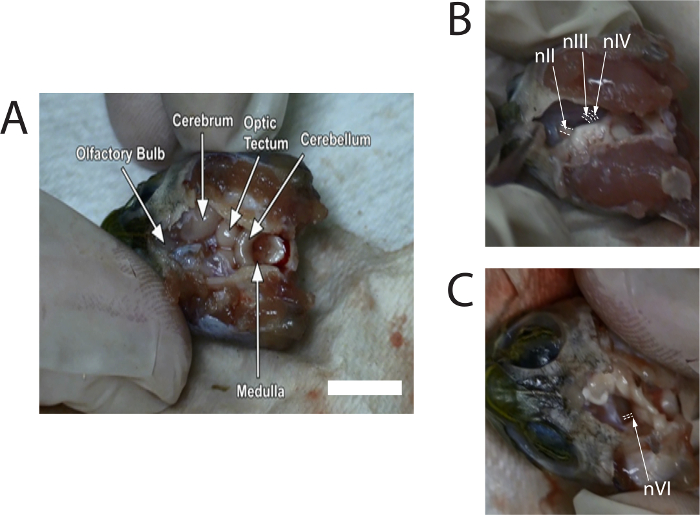
Figura 1: imágenes de imágenes capturadas del vídeo de la disección para mostrar ubicaciones del nervio óptico (nII), nervi...
Discusión
Pasos críticos:
Los pasos críticos en este protocolo son los siguientes: 1) la disección y el cuidado para mantener la viabilidad de los nervios seccionados; 2) la correspondencia de los tamaños de los electrodos de succión para los nervios craneales para proporcionar respuestas coherentes; y 3) la colocación de la cabeza en el cardán para proporcionar la calibración adecuada de la rotación del ojo.
Solución de problemas:
La disecció...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a la Sra. Paulette McKenna y Lisa Pezzino en este estudio para apoyo secretarial y Sr. Phil Auerbach para soporte técnico. Los autores también agradecen los Drs. Michael Ariel y Michael S. Jones (Saint Louis University School of Medicine) para introducirnos a la preparación principal en vitro aislado. Fondos para apoyo de esta colaboración fue proporcionada por el Departamento de Biología (Robert S. Chase fondo), la Comisión de investigación académica y el programa de Neurociencia en la Universidad de Lafayette. Por último, este trabajo está dedicado al Sr. Phil Auerbach, quien falleció el 28 de septiembre de 2016; había desarmado de un microscopio electrónico de barrido y reconoce la utilidad de su etapa de 5 ejes para el uso de este protocolo. Su amistad y su ingenio se echará de menos enormemente.
Materiales
| Name | Company | Catalog Number | Comments |
| Red-eared slider turtles | Kons Scientific | Trachemys scripta elegans | Large size (carapace length 15-20 cm) |
| Sodium chloride | Sigma-Aldrich Co. LLC. | S5886 | |
| Potassium chloride | Sigma-Aldrich Co. LLC. | P5405 | |
| Magnesium choride | Sigma-Aldrich Co. LLC. | M7304 | |
| Sodium bicarbonate | Sigma-Aldrich Co. LLC. | S5761 | |
| Dextrose | Sigma-Aldrich Co. LLC. | C5767 | |
| Concentrated hydrochloric acid | Sigma-Aldrich Co. LLC. | H7020 | |
| Calcium chloride | Sigma-Aldrich Co. LLC. | C7902 | |
| pH meter | Oakton | pH 6+ | |
| Suction stimulation electrode | A-M Systems | 573000 | Bipolar suction electrode. Note that 573000 has been replaced with 573050. |
| Capillary glass | A-M systems | 626000 | Single-barrel borosilicate capillary glass without microfilament, length 10 cm, outside diameter 1.0 mm, inner diameter 0.50 mm |
| Alternative suction stimulation electrode | A-M Systems | 573050 | Bipolar suction electrode. Requires larger diameter capillary glass: 627000, outside diameter 1.2 mm, inner diameter 0.68 mm |
| Stereoscope | Lieca | GZ7 | Magnification range, 10x – 70x |
| Fiber optic light source | Amscope | HL250-A | 150W Fiber optical microscope illuminator light box |
| Rongeurs | Carolina Biological Supply Company | 625654 | stainless steel, straight spring, 5.25" |
| Blunt dissection probe | Carolina Biological Supply Company | 627405 | Huber mall probe, double-ended probe and seeker, 6" |
| Microscissors | Carolina Biological Supply Company | 623555 | Iris microdissecting scissors, stainless steel, 0.5" blades, 4.75" long |
| Fine forceps | Sigma-Aldrich Co. LLC. | F6521 | Jewelers forceps, dumont No. 5, inox alloy, 4.25" |
| Curved forceps | Sigma-Aldrich Co. LLC. | Z168696 | Medium tip, curved forceps, stainless steel, 4" |
| Scalpel handle | Sigma-Aldrich Co. LLC. | S2896 | Scalpel handles, No. 3, stainless steel |
| Scalpel blade | Sigma-Aldrich Co. LLC. | S2771 | Scalpel blades, No. 11, steel |
| Guillotine | Harvard Apparatus | 73-1918 | Kleine guillotine type 7575 |
| Spatula | Sigma | Z648299 | Micro spoon and spatula weighing set. Use small spatula: 5.9” long x 0.07” diameter handle with square end: 0.17” x 1.3” long, other end round: 0.17” x 1.27” long |
| Hook | Autozone | 98069 | SureBilt hook and pick set. Use grinder to dull sharp points of hook to prevent injury to animals mouth. |
| 95/5% O2/CO2 | Airgas, Inc. | X02OX95C2003102 | 5% Carbon dioxide balance oxygen certified standard gas mixture, size 200 Cylinder, CGA-296 |
| Regulator | Airgas, Inc. | Y11244D296-AG | Single stage brass 0-100 psi analytical cylinder regulator CGA-296 with needle outlet. Use brass adjustable airline pipe valve to go from 3/8", inner diameter, vinyl airline tubing connected to regulator to a 3/16", inner diameter, airline connection going to airstone or glass pasteur pipette. |
| Adjustable airline pipe valve | Doctors Foster and Smith | CD-12061 | Brass valve |
| Rigid table | Unknown | Unknown | Auto-clave door laid on top of a sturdy table. Nine 5" diameter tennis balls isolate vibrations from the top surface of the table. |
| 5" tennis ball | Petco Animal Supplies, Inc. | 712868 | Petco Jumbo Pet Tennis Ball: balls are unsliced and held within an integrated frame on the underside part of the autoclave door. |
| Alternative vibration isolation table | Newport Corporation | INT1-36-6-N | Rigid vibration control system, integrity 1: Surface dimensions, 3' x 6' |
| Gimbal | ISI, International Scientific Instruments, Inc. | Stage from SUPER III-A Scanning EM | 5-axis eucentric stage: X, Y, and Z linear movements, ±20 mm, 0.1 mm precision; Rotations, vertical, ±10°, and horizontal, ±12.5°, with 1.25° precision. Note: from decommission instrument. |
| Chuck for gimbal | Unknown | Unknown | Chuck from an old microtome of unknown manufacture was machined to fit the shaft of the specimen holder of the Scanning EM stage |
| Alternative gimbal | ThorLabs, Inc. | GN2/M with MBT602/M | Dual-axis goniometer (GN2/M) mounted on 3-axis microblock stage with thumbscrew adjusters (MBT602/M): design a chuck to hold turtle head with eye at 12.7 mm above top surface of goniometer (distance to point of rotation) |
| Video-based eye tracking system | Arrington Research, Inc. | ViewPoint EyeTracker, PC-60 | Tracking method: Infrared video by dark pupil; Black and white camera (Item BC02): 30 Hz, 640 x 480; System requirements: Windows 2000, XP, 7, 8, 8.1, 10; Visual range: Horizontal +/- 44°; vertical +/- 20°; Accuracy ~0.5°; Spatial resolution ~0.15°; Pupil size resolution ~0.03 mm; Eye data: X, Y position of gaze, pupil height and width, torsion, delta time, total time, and regions of interest (ROI); Real-time communication (Item 0022): 4-Channel AnalogOut with eight TTL input channels to mark codes into the data file |
| Multi-position magnetic base | Harbor Freight Tools | Pittsburg, item #5645 | Magnetic holder reaches up to 12" and produces 45 lbs. of magnetic pull. Use to position camera. Machine thread holes onto the end of the rod to mount cameras. |
| Micromanipulator | Kopf | 900 | 5 axis manipulation for mount of suction electrode: X, Y, Z linear travel, 2 axis of rotation |
| Dissection scope on boom | Lieca | GZ6 | Magnification range, 6.7x – 40x |
| Nerve/muscle stimulator | Astro-Med Grass Telefactor | Grass S88 | Dual pulse voltage stimulator: two output channels that can be operated independently or synchronized to generate non-isolated constant voltage pulses (10 mv to 150 V). Pulses can be single (10 μsec to 10 sec), repetitive (0.01 Hz to 1 KHz), and trains (1 ms to 10 s) and synchronized with TTL inputs and output. Send TTL outputs via the output channels of a DB25 connector to the TTL input channels of the ViewPoint EyeTracker. Note: Astro-Med Grass Telefactor is no longer in business. |
| Current isolation device | Astro-Med Grass Telefactor | PSIU6 | Current stimulus isolation unit: enables safe delivery of constant currents by the S88 to the preparation. The PSIU6 connects by a BNC cable to one of the output channels of the S88. Multiplier switches on the PSIU6 allow the S88 to generate a wide array of current amplitudes ranging from 0.1 µA to 15 mA. |
| Alternative nerve/muscle stimulator with isolation | A-M Systems | 2100 | Isolated Pulse Stimulator: Unit has built-in isolator to produce constant currents. |
Referencias
- Kikillus, K. H., Hare, K. M., Hartley, S. Minimizing false-negatives when predicting the potential distribution of an invasive species: A bioclimatic envelope for the red-eared slider at global and regional scales. Anim Conserv. 13, 5-15 (2010).
- Lutz, P. L., Rosenthal, M., Sick, T. J. Living without oxygen: turtle brain as a model of anaerobic metabolism. Mol Physiol. 8, 411-425 (1985).
- Lutz, P. L., Milton, S. L. Negotiating brain anoxia survival in the turtle. J Exp Biol. 207, 3141-3147 (2004).
- Storey, K. B. Anoxia tolerance in turtles: Metabolic regulation and gene expression. Comp Biochem Physiol A-Mol Integr Physiol. 147 (2), 263-276 (2007).
- Granda, A. M., Dearworth, J. R., Subramaniam, B. Balanced interactions in ganglion-cell receptive fields. Vis Neurosci. 16, 319-332 (1999).
- Dearworth, J. R., Granda, A. M. Multiplied functions unify shapes of ganglion-cell receptive fields in retina of turtle. J Vis. 2 (3), 204-217 (2002).
- Nesbit, S. C., Van Hoof, A. G., Le, C. C., Dearworth Jr, J. R. Extracellular recording of light responses from optic nerve fibers and the caudal photoreceptor in the crayfish. J Undergrad Neurosci Educ. 14 (1), A29-A38 (2015).
- McMahon, B. R. Respiratory and circulatory compensation to hypoxia in crustaceans. Resp Phsiol. 128 (3), 349-364 (2001).
- Leigh, R. J., Zee, D. S. . The neurology of eye movements. , (1999).
- Robinson, D. A. A method of measuring eye movement using a scleral search coil in a magnetic field. IEEE Trans Biomed Eng. 10, 137-145 (1963).
- Judge, S. J., Richmond, B. J., Chu, F. C. Implantation of magnetic search coils for measurement of eye position: an improved method. Vis Res. 20, 535-538 (1980).
- Ong, J. K. Y., Halswanter, T. Measuring torsional eye movements by tracking stable iris features. J Neurosci Meth. 192, 261-267 (2010).
- Kimmel, D. L., Mammo, D., Newsome, W. T. Tracking the eye non-invasively: simultaneous comparison of the scleral search coil and optical tracking techniques in the macaque monkey. Front Behav Neurosci. 6 (49), 1-17 (2012).
- Otero-Millan, J., Roberts, D. C., Lasker, A., Zee, D. S., Kheradmand, A. Knowing what the brain is seeing in three dimensions: A novel, noninvasive, sensitive, accurate, and low-noise technique for measuring ocular torsion. J Vis. 15 (14), 1-15 (2015).
- Demski, L. S., Bauer, D. H. Eye movements evoked by electrical stimulation of the brain in anesthetized fishes. Brain Behav Evol. 11, 109-129 (1975).
- Gioanni, H., Bennis, M., Sansonetti, A. Visual and vestibular reflexes that stabilize gaze in the chameleon. Vis Neurosci. 10, 947-956 (1993).
- Straka, H., Dieringer, N. Basic organization principles of the VOR: lessons from frogs. Prog Neurobio. 73 (4), 259-309 (2004).
- Voss, J., Bischof, H. -. J. Eye movements of laterally eyed birds are not independent. J Exp Biol. 212 (10), 1568-1575 (2009).
- Ariel, M. Independent eye movements in the turtle. Vis Neurosci. 5, 29-41 (1990).
- Ariel, M., Rosenberg, A. F. Effects of synaptic drugs on turtle optokinetic nystagmus and the spike responses of the basal optic nucleus. Vis Neurosci. 7, 431-440 (1991).
- Balaban, C. D., Ariel, M. A "beat-to-beat" interval generator for optokinetic nystagmus. Biol Cybern. 66, 203-216 (1992).
- Keifer, J. In vitro eye-blink reflex model: Role of excitatory amino acid receptors and labeling of network activity with sulforhodamine. Exp Brain Res. 97, 239-253 (1993).
- Keifer, J., Armstrong, K. E., Houk, J. C. In vitro classical conditioning of abducens nerve discharge in turtles. J Neurosci. 15, 5036-5048 (1995).
- Rosenberg, A. F., Ariel, M. A model for optokinetic eye movements in turtles that incorporates properties of retinal slip neurons. Vis Neurosci. 13, 375-383 (1996).
- Ariel, M. Open-loop optokinetic responses of the turtle. Vis Res. 37, 925-933 (1997).
- Anderson, C. W., Keifer, J. Properties of conditioned abducens nerve responses in a highly reduced in vitro brainstem preparation from the turtle. J Neurophysiol. 81, 1242-1250 (1999).
- Keifer, J. In vitro classical conditioning of the turtle eyeblink reflex: Approaching cellular mechanisms of acquisition. Cerebell. 2, 55-61 (2003).
- Zhu, D., Keifer, J. Pathways controlling trigeminal and auditory nerve-evoked abducens eyeblink reflexes in pond turtles. Brain Behav Evol. 64, 207-222 (2004).
- Jones, M. S., Ariel, M. The effects of unilateral eighth nerve block on fictive VOR in the turtle. Br Res. 1094, 149-162 (2006).
- Jones, M. S., Ariel, M. Morphology, intrinsic membrane properties, and rotation-evoked responses of trochlear motoneurons in the turtle. J Neurophysiol. 99 (3), 1187-1200 (2008).
- Krenz, J. G., Naylor, G. J. P., Shaffer, H. B., Janzen, F. J. Molecular phylogenetics and evolution of turtles. Mol Phylogenet Evol. 37 (1), 178-191 (2005).
- Dearworth, J. R., et al. Role of the trochlear nerve in eye abduction and frontal vision of the red-eared slider turtle (Trachemys scripta elegans). J Comp Neur. 52, 3464-3477 (2013).
- Dearworth, J. R., et al. Pupil constriction evoked in vitro by stimulation of the oculomotor nerve in the turtle (Trachemys scripta elegans). Vis Neurosci. 26, 309-318 (2009).
- Mead, K., et al. IFEL TOUR: a description of the introduction to FUN electrophysiology labs workshop at Bowdoin College, July 27-30, and the resultant faculty learning community. J Undergrad Neurosci Educ. 5, A42-A48 (2007).
- Jackson, D. C., Ultsch, G. R. Physiology of hibernation under the ice by turtles and frogs. J Exp Zool A Ecol Genet Physiol. 313 (6), 311-327 (2010).
- Romano, J. M., Dearworth, J. R. Pupil constriction evoked by stimulation of the ciliary nerve in the red-eared slider turtle (Trachemys scripta elegans). J Penns Acad Sci. 85, 4-8 (2011).
- Miller, J. M., Robins, D. Extraocular-muscle forces in alert monkey. Vis Res. 32, 1099-1113 (1992).
- Gamlin, P. D., Miller, J. M. Extraocular muscle motor units characterized by spike-triggered averaging in alert monkey. J Neurosci Meth. 204, 159-167 (2011).
- Quaia, C., Ying, H. S., Optican, L. M. The Viscoelastic properties of passive eye muscle in primates. III: Force elicited by natural elongations. PLOS ONE. 5, A236-A254 (2010).
- Anderson, S. R., et al. Dynamics of primate oculomotor plant revealed by effects of abducens microstimulation. J Neurophys. 101, 2907-2923 (2009).
- Maxwell, J. H., Harless, M., Morlock, H. Anesthesia and surgery. Turtles: Perspective and Research. , 127-152 (1979).
- AVMA Panel on Euthanasia. American Veterinary Medical Association. J Am Vet Med Assoc. 218 (5), 669-696 (2001).
- Clarke, R. J. Shaping the pupil's response to light in the hooded rat. Exp Br Res. 176, 641-651 (2007).
- Bennett, R. A. A review of anesthesia and chemical restraint in reptiles. J Zoo Wild Med. 22 (3), 282-303 (1991).
- Bickler, P. E., Buck, L. T. Hypoxia Tolerance in Reptiles, Amphibians, and Fishes: Life with Variable Oxygen Availability. Ann Rev Physiol. 69, 145-170 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados