È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Oculare cinematica misurata dalla stimolazione In Vitro dei nervi cranici in tartaruga
In questo articolo
Riepilogo
Questo protocollo viene descritto come utilizzare una preparazione testa in vitro isolato tartaruga per misurare la cinematica dei loro movimenti oculari. Dopo la rimozione del cervello dal cranio, nervi cranici può essere stimolati con correnti a quantificare le rotazioni dell'occhio e cambiamenti nelle dimensioni della pupilla.
Abstract
Dopo che gli animali sono euthanized, loro tessuti cominciano a morire. Le tartarughe offrono un vantaggio a causa di un più lungo periodo di sopravvivenza dei loro tessuti, soprattutto se paragonato ai vertebrati a sangue caldo. Per questo motivo, gli esperimenti in vitro in tartarughe possono essere eseguiti per lunghi periodi di tempo per studiare i segnali neurali e il controllo delle loro azioni mirate. Usando una preparazione testa isolata, abbiamo misurato la cinematica dei movimenti oculari in tartarughe, e loro modulazione di segnali elettrici trasportati dai nervi cranici. Dopo che il cervello è stato rimosso dal cranio, intatti i nervi cranici, la testa dissecata fu posto in un giunto cardanico per calibrare i movimenti oculari. Elettrodi di vetro sono stati fissati ai nervi cranici (oculomotore, trocleare e abducente) e stimolato con correnti di evocare movimenti oculari. Abbiamo monitorato i movimenti di occhio con un video a infrarossi tracking system e quantificati rotazioni degli occhi. Impulsi di corrente con una gamma di ampiezze, frequenze, e treno durate venivano utilizzate per osservare gli effetti sulle risposte. Perché la preparazione è separata dal cervello, la via efferente che va agli obiettivi del muscolo può essere esaminata isolatamente per studiare segnalazione neurale in assenza di informazioni sensoriali centralmente elaborate.
Introduzione
Spiegazione razionale per usando il cursore rosso-eared tartarughe in esperimenti elettrofisiologici:
Le tartarughe dalle orecchie rosse (Trachemys scripta elegans), sono considerati uno dei peggiore specie invasive1 del mondo e può indicare che un ecosistema è nei guai. Il motivo per cui sono tanto successo tartarughe cursore rosso-eared è capito male ma può essere in parte dovuto la loro fisiologia tollerante e possesso di tessuti nervosi che può sopravvivere in condizioni di ipossia2,3,4 . Li utilizzano per sperimentazione non minacciano i loro numeri e con sforzi minimi, preparazioni elettrofisiologici possono rimanere vitali sopra le durate estese, fino a 18 ore5,6. Il vantaggio è simile al vantaggio dell'utilizzo di animali invertebrati quali gamberi7, che hanno anche la capacità di sopportare i bassi livelli di ossigeno8.
Tecniche per misurare movimenti oculari:
Approcci per misurare movimenti oculari negli animali dagli occhi frontali, uso di primati non umani sono stati ben sviluppato9. L'occhio ruota in orbita intorno a tre assi: orizzontale, verticale e torsionale. Il metodo di ricerca magnetico della bobina è generalmente considerato il più affidabile per la misura di rotazioni, ma è invasivo, che richiedono piccole bobine da inserire le sclere di animali10,11. Sistemi basati su video possono anche misurare rotazioni e hanno il vantaggio di essere non invasivo. Lo sviluppo delle meglio fotocamere con elaborazione immagine innovativa hanno migliorato la loro funzionalità, rendendo i sistemi basati su video alternativa da considerare12,13,14.
Le tecniche sviluppate per misurare i movimenti di occhio in nonmammals sono state molto meno significative. Misure sono entrambi bassa risoluzione o descrivono solo alcune delle rotazioni15,16,17,18. La mancanza di sviluppo può essere parzialmente imputata sulla difficoltà nel nonmammals di formazione da seguire obiettivi visual. Anche se i movimenti oculari sono state ben studiati in cursore rosso-eared tartarughe19,20,21,22,23,24,25 ,26,27,28,29,30, a causa della sfida in addestramento di animali per tenere traccia degli obiettivi, la cinematica precisa dei loro movimenti oculari è scarsamente capito.
Tartarughe del cursore rosso-eared sono generalmente considerate vertebrati laterale-eyed, ma perché essi possono ritirare completamente le loro teste nel loro guscio31, occlusione significativa dei campi visivi laterali dal carapace si verifica32. Il risultato è che la loro linea di vista visivo è costretto verso la parte anteriore, che li rende si comportano più come mammiferi frontale-eyed. Di conseguenza, loro uso come modello per lo sviluppo di approcci per misurare movimenti oculari offre anche una prospettiva evolutiva unica.
Il protocollo descritto in questo lavoro utilizza una preparazione della testa in vitro isolato per identificare la cinematica dei movimenti dell'occhio in tartarughe cursore rosso-eared. Cervelli vengono sezionati dai teschi intatti i nervi cranici. Teste sono inserite in un giunto cardanico per calibrare i movimenti oculari ed evocano risposte da stimolazione elettrica dei nervi cranici che innervano i muscoli oculari. Misure delle rotazioni degli occhi sono fatte da un sistema basato su video, utilizzando algoritmi software, che traccia la pupilla scura e le marcature dell'iride. La preparazione prevede l'opportunità di misurare cinematica di entrambi extraoculare (cioè, orizzontale, verticale e torsionale rotazioni)32 e intraoculare (cioè, modifiche alla pupilla)33 movimenti.
Sistema modello per l'analisi delle vie neurali efferente:
Più in generale, l'approccio fornisce la possibilità di studiare come efferenti segnali neurali generare movimenti oculari quando muscoli iniziano da loro state rilassate e in assenza di informazioni sensoriali integrate elaborate dal cervello32, gli investigatori 33. Di conseguenza, la cinematica di occhio può essere esaminata in un sistema di modello in cui vengono elaborati esclusivamente dal percorso neurale efferente lasciando il cervello e synapsing sui muscoli.
Protocollo
Nota: Le tartarughe cursore rosso-eared sia maschile che femminile, sono state acquistate da un fornitore. Le tartarughe sono state alloggiate in una suite di animale calda contenente due 60-gallone vasche dotate di isole di mattoni per prendere il sole sotto le luci a infrarossi 250-W. L'ambiente è stato effettuato su un ciclo di luce/buio 14/10-h con la temperatura dell'acqua a 22 ° C. Luci erano acceso alle 6:00 e spento alle 20:00. I serbatoi dotati di sistemi di filtraggio sono stati puliti settimanalmente e tartarughe sono state alimentate ad libitum ogni altro giorno. La cura del cursore rosso-eared tartarughe e tutte le seguenti procedure sperimentali descritti qui32,33 sono state approvate dalla istituzionale animale cura ed uso Committee (IACUC) al Lafayette College.
1. installazione dell'apparecchiatura
- Preparare la soluzione di Ringer lattato tartaruga. Aggiungere quanto segue all'acqua distillata in questo ordine: cloruro di sodio 96,5 mM (58.44 g/mol), cloruro di potassio 2,6 mM (74,56 g/mol), cloruro di magnesio 2,0 mM (203,31 g/mol), bicarbonato di sodio 31,5 mM (84.01 g/mol), destrosio 20,0 mM (180.16 g/mol), concentrato acido cloridrico per aggiustare il pH a 7,51 e cloruro di calcio 4,0 mM (110.98 g/mol) (Vedi Tabella materiali). Miscelare la soluzione durante l'aggiunta di ogni sale.
Attenzione: HCl concentrato è pericolosa (pelle, occhi, inalazione e ingestione rischi). - Fare consigli per gli elettrodi aspirazione dal capillare 5 cm-lungo (Vedi Tabella materiali), di vetro di lucidatura a fuoco a diverse taglie di diametri interni al fine di ospitare i nervi cranici di vario spessore.
- Utilizzare un file di piccole dimensioni per incidere una linea attraverso un pezzo di vetro capillare. Mettere in carta velina e rompere in mezzo.
- Lentamente e stendere una delle estremità del vetro capillare nella fiamma di un becco Bunsen. Esaminare periodicamente la punta per dimensione, scorrevolezza e simmetria utilizzando una dissezione ambito e una luce a fibre ottiche di origine (Vedi Tabella materiali).
Nota: Per le tartarughe con testa larghezze comprese tra 20 e 30 mm, diametro interno raccordo ottimale dimensioni in genere vanno da 0,4 a 0,8 mm per il nervo oculomotore (nIII), 0,3 e 0,6 mm per il nervo trocleare (nIV) e 0,2-0,4 mm per il nervo abducente (nVI).
- Pulire e organizzare Pinze ossivore, una sonda di dissezione smussa, microforbici, una pinzetta, pinzetta e un manico per bisturi con lame (Vedi Tabella materiali) per la dissezione.
Nota: La sterilizzazione degli strumenti è facoltativo.
2. l'anestesia e l'eutanasia
- Posto la tartaruga in un ghiaccio secchio per 60 min a cryoanesthetize esso.
- Eutanasia la tartaruga per decapitazione usando una piccola ghigliottina animale (Vedi Tabella materiali).
- Sollevare delicatamente le mascelle dell'animale aperto con una spatolina di pesatura affinché un gancio può essere inserito e girato per adattarsi sotto la punta della mascella superiore.
- Tirare con una pressione costante per estendere la testa dell'animale attraverso la ghigliottina. Rapidamente di decapitare l'animale.
- Posizionare la testa di tartaruga in un piatto di dissezione. Hanno lattato abbastanza turtle Ringer a disposizione per irrigare il tessuto. Ossigenare la soluzione con 95/5 O2Co2 (Vedi Tabella materiali).
- Mantenere il tessuto a 4 ° C mettendo ghiaccio intorno alla parte esterna del piatto.
3. dissezione
- Utilizzare l'ambito di dissezione con una sorgente di luce in fibra ottica per eseguire la dissezione.
- Rimuovere la mascella inferiore. Posizionare una sonda di dissezione smussa attraverso la bocca per fornire una più facile gestione della testa. Tagliare il giunto di collegamento l'osso mandibola al cranio con un bisturi. Utilizzare Pinze ossivore per tirare la mandibola dal cranio. Usare Pinze ossivore per tirare fuori la pelle e muscoli da loro attaccamenti alle regioni dorsale e laterale del cranio.
- Rimuovere la colonna vertebrale.
- Identificare la colonna vertebrale verso l'estremità caudale del cranio. Piegare la colonna vertebrale ventralmente per esporre il midollo spinale. Utilizzare MICROFORBICE per tagliare il midollo spinale. Utilizzare Pinze ossivore per rimuovere la colonna vertebrale e altri tessuti dal cranio tirando caudalmente.
- Rimuovere il cervello dal cranio dopo aver tagliato i nervi cranici.
- A partire dal foro occipitale, utilizzare Pinze ossivore per tagliare due incisioni sul cranio dorsale. Effettuare tagli superficiali per evitare di danneggiare il cervello sotto.
- Utilizzare Pinze ossivore per staccare con cautela il cranio dorsale. Utilizzare MICROFORBICE per rimuovere il meninx per esporre il resto del cervello. Rimuovere abbastanza meninx, fino a quando i bulbi olfattivi, in cavità cranica anteriore, può essere identificati (Vedi Figura 1A). Continuare ad irrigare il cervello con soluzione di Ringer lattato tartaruga, come necessario.
- Utilizzare forcipe curvo per tirare il cervello caudalmente delicatamente e produrre lieve tensione sui nervi cranici. Accuratamente tagliare e rimuovere i bulbi olfattivi e nel cervello con il forcipe curvo.
- Con microforbici per spingere delicatamente il mesencefalo verso la linea mediana per esporre i nervi cranici; nIII, circa 0,6 mm, può essere visto di fronte nIV, e il diametro di nIV sarà leggermente meno di nIII. Tagliare nIII e nIV dove essi attribuiscono alla mesencefalo (cfr. Figura 1B). Ripetere l'operazione su altro lato.
- Tagliare il sinistro e destro del nervo ottico (nII) con microforbici. Poi inclinare il tronco cerebrale ad un lato. Osservare nVI emergenti dalla superficie ventrale nei pressi dello svincolo di ponte e il midollo (Vedi Figura 1); il diametro del nVI è piccolo e circa 0,3 mm. tagliare sia il nVI destro e sinistro.
- Rimuovere le parti restanti del tronco cerebrale dalla tartaruga con microforbici e una pinzetta. Una volta che il cranio è vuoto, è necessario esaminare il pavimento della cavità cranica. Identificare nIII, nIV e nVI.
- Rimuovere le palpebre superiori e inferiori con una pinzetta e microforbici.
4. taratura dei movimenti oculari
- Utilizzare una tabella rigida (Vedi Tabella materiali) per supportare il posizionamento della sospensione cardanica e altri strumenti. Posizionare la testa di tartaruga nel mandrino giunto cardanico in modo che la superficie dorsale della testa è parallela all'orizzonte utilizzando una piccola livella a bolla di riposo attraverso il cranio. All'incirca uno degli occhi di posizionare al centro delle rotazioni orizzontali e verticali di gimbal.
- Posizionare la fotocamera a raggi infrarossi, dotata di una luce a infrarossi diodo (LED), che è parte dell'occhio basati su video sistema di rilevamento (Vedi Tabella materiali), a una distanza di circa 12 cm dall'occhio della tartaruga.
- La fotocamera angolo di 45 gradi di sopra della linea di vista dell'occhio. Il LED deve essere nella posizione di 11 quando guardando l'obiettivo della fotocamera. Il LED centrale lungo l'asse ottico dell'occhio. La fotocamera sarà leggermente fuori asse (come visto da sopra l'occhio).
- Regolare la distanza della telecamera dall'occhio in modo che la vista della videocamera è riempita al massimo dal bulbo oculare. Assicurarsi che gli angoli degli occhi (canthi) sono ai bordi della visualizzazione orizzontale.
- Collegare la fotocamera all'occhio video basati su sistema per elaborare i dati di tracciamento. Dividono il segnale a un DVD-recorder per catturare il video raw. Mettere a fuoco la fotocamera per ottenere un'immagine chiara dell'occhio. Fare attenzione a belle-posizione l'occhio al centro della vista telecamera utilizzando i tre gradi di regolazione lineare (x, y, z) fornito con la sospensione cardanica.
- Rilevare la pupilla scura impostando la soglia e il contrasto in modo appropriato utilizzando il programma fornito con l'occhio di video basati su sistema di tracciamento.
- Utilizzando il mouse, fare clic sul menu "Video" e in "Modalità" selezionare "Alta precisione" per catturare immagini a una frequenza di campionamento di 30 Hz (risoluzione di 640 pixel x 480 linee). Anche in "Video", selezionare "Pupilla scura" per "Tipo di allievo" e "Ellisse (ellisse ruotata)" per "Metodo di segmentazione pupilla".
- Nella finestra "EyeCamera", fare clic sull'icona "Pupilla ricerca Area regolazione" (piccolo rettangolo verticale con un puntino al centro). Utilizzare il mouse per trascinare un rettangolo che limita un'area intorno alla pupilla. Evitare aree scure che potrebbero essere confuso con la pupilla.
- Nella finestra di "Controlli", confermare che caselle per "Auto Image" e "rilevamento soglia positiva-Lock" siano selezionate. Fare clic su "Auto-soglia" per ottimizzare la densità di scansione, che vi mostrerà come puntini verdi sopra la pupilla scura.
- Calibrare l'esposizione di video dell'occhio basati su video programma di monitoraggio per le rotazioni del gimbal 12,5 ° (+ /-) intorno al proprio asse orizzontale e 10 ° (+ /-) attorno al suo asse verticale.
- Nella finestra di "Controlli", fare clic su "Schermo". Seleziona le caselle sotto "Lo sguardo" e "Stim" per "Punto lo sguardo", "Regione Calib" e "Griglia geometrica". Dopo aver controllato le caselle sotto "Griglia geometrica", una finestra pop-up e dire, "la geometria di visualizzazione stimolo deve essere misurata prima la griglia di geometria può essere visualizzata. Vuoi farlo adesso?" Selezionare "Y" per Sì.
- Utilizzando il mouse, fare clic sul menu "Windows" e selezionare "Stimolo". La finestra di "Stimolo" si aprirà mostrando un linea verticale e orizzontale incrocio al centro del display. Misurare le lunghezze delle linee per la più vicina mm. Premere "Esc" sulla tastiera per uscire dalla finestra di "Stimolo".
- Utilizzando il mouse, fare clic sul menu "Stimolo" e selezionare "Impostazione di geometria". Le lunghezze delle linee che sono state misurate solo in ingresso. Regolare la distanza di visualizzazione in modo che i gradi/linea uguale a 25 ° per la linea orizzontale e 20 ° per la linea verticale. Fare clic sul pulsante "Store" e chiudere la finestra.
- Nella finestra "EyeSpace", selezionare il numero di taratura "Dati punto" a "9". Con l'occhio della tartaruga posizionato al centro, clicca sul centro dati punto e fare clic sul pulsante "Ripresentare".
Nota: Verrà aperta la finestra di "Stimolo", e "Get Ready" apparirà al centro dello schermo. Una finestra apparirà nel centro e poi scompaiono. Sulla sua scomparsa, si chiuderà la finestra di "Stimolo". Posizione centrale dovrebbe essere calibrata. - Ripetere la procedura ruotando il gimbal destra/sinistra, +12,5 ° /-12,50 ° e su/giù + 10 ° /-10 ° a calibrare i rimanenti punti di dati.
- Per calibrare la rotazione torsionale, utilizzare il modello di montaggio fornito con l'occhio basati su video programma di rilevamento algoritmo. L'algoritmo imposta posizione zero basata su marcature dell'iride e calcola un angolo di rotazione quando le marcature diventano offset dal centroide della pupilla.
- Utilizzando il puntatore del mouse, fare clic sul menu "Windows" e selezionare "Torsione". Fare clic sul pulsante "START" nella finestra "Torsione". Nella finestra "EyeCamera", un arco apparirà sopra l'immagine dell'occhio.
- Regolare il raggio, l'angolo e la lunghezza dell'arco utilizzando i cursori in un luogo dove le marcature irregolari sono presenti nell'iride. Selezionare le caselle per "Grafica in tempo reale" e "Auto-Set dopo regolare". Se necessario, regolare la luminosità e il contrasto nella finestra controlli e re-soglia pupilla scura (Vedi punto 4). Fare clic sul pulsante "Modello Set".
- Posizionare un righello sullo stesso piano focale come la pupilla e registrare la larghezza della visualizzazione fotocamera completa. Il valore verrà utilizzato in seguito per determinare la larghezza effettiva della pupilla.
5. posizionamento dell'elettrodo aspirazione sul nervo cranico per evocare movimenti oculari
- Posizionare un elettrodo di riferimento di pin nel tessuto connettivo o muscolo restanti sulla testa.
- Posizionare l'elettrodo di aspirazione (Vedi Tabella materiali) sul nervo cranico utilizzando un ambito micromanipolatore e dissezione montato su un braccio. Utilizzare una fonte di luce in fibra ottica per visualizzare e controllare il posizionamento.
- Corrisponde alla dimensione di un nervo per una punta di vetro capillare. Prova ed errore è necessario ottenere una vestibilità migliore intorno al diametro di un nervo (Vedi punto 1.2 per consigli di dimensioni). Posizionare la punta di vetro sull'elettrodo di aspirazione. Riempire l'elettrodo aspirazione con soluzione di Ringer e regolare il volume all'interno della siringa a circa metà della sua capacità.
- Muovere con cautela la punta di vetro dell'elettrodo utilizzando il micromanipolatore in una posizione sopra il taglio fine del nervo selezionato. Assicurarsi che la soluzione di Ringer riempie il cranio e la punta è sotto la superficie. Se necessario, è possibile utilizzare argilla di modellistica per arginare le località dove lattato il Ringer è fuoriuscita del cranio.
- Tirare indietro lo stantuffo della siringa.
Nota: Il vuoto disegnerà il nervo nella parte finale della punta del capillare. Una buona misura è indicata dal nervo restanti entro la punta con poco o nessun ulteriore vuoto applicato.
6. stimolazione del nervo cranico e l'analisi dei movimenti oculari
- Utilizzare uno stimolatore del nervo/muscolo di uso generale con un dispositivo di isolamento corrente (Vedi Tabella materiali) per stimolare il nervo cranico tramite l'elettrodo di aspirazione.
- Collegare l'elettrodo aspirazione al dispositivo di isolamento corrente utilizzando un cavo. Collegare il cavo dell'elettrodo di riferimento di pin per il collegamento a terra del dispositivo di isolamento.
- Selezionare i parametri delle correnti servendosi dei dischi combinatori e si accende il dispositivo di elettrostimolazione e isolamento. Utilizzare una gamma di corrente da 1 a 100 µA, con frequenza di 10 a 400 che Hz. uso 1 o 2 ms impulsi nei treni della durata di 100, 500 o 1.000 ms.
- Registrare il tempo di stimolazioni.
Nota: Gli impulsi Transistor-transistor-logic (TTL) sono sincronizzati con le consegne delle correnti dallo stimolatore e comunicare in tempo reale tramite un cavo di canali di ingresso dell'occhio video basati su sistema di tracciamento. Un modulo del software fornito con l'occhio di video basati su comandi del programma di monitoraggio della comunicazione.- Per visualizzare i tempi delle applicazioni correnti e la loro influenza sui movimenti di occhio, fare clic sul menu "PenPlots". "Selezionare"Posizione lo sguardo X", Y lo sguardo posizione", "Torsione" e "Pupilla larghezza" per mostrare il tempo reale dati grezzi trame per X e Y occhio pupilla larghezza, torsione e posizioni. Inoltre è possibile selezionare i "secondi & marcatori" dal menu "PenPlots" per visualizzare un grafico di temporizzazione con i segni di graduazione, che compaiono a intervalli di 1 s.
Nota: Una lettera maiuscola "T" apparirà segnando l'inizio dell'impulso TTL, che accadono simultaneamente con l'applicazione corrente. - Per memorizzare i dati dei movimenti oculari evocati dalle correnti, fare clic sul menu "File" e selezionare "Nuovo File di dati" sotto "Dati". Immettere un nome file e premere "Invio". Salvataggio dei dati può essere messo in pausa e riavvio utilizzando la combinazione di comandi da tastiera, "Ctrl" + "p". Al termine di una sessione sperimentale, è possibile selezionare "Chiudi File di dati" fuori menù "File" in "Dati".
- Per aiutare a tenere traccia del tipo di correnti applicate, fare clic sul menu "Windows" e selezionare "Dati Pad". Verrà visualizzata la finestra di "Tastiera/DataMarker". Fare clic su una lettera o un numero per identificare i parametri delle stimolazioni corrente vengono recapitati al nervo.
Nota: ad esempio, "X" potrebbe stare per 10 µA. cliccando sulla "X" Archivia la relativa voce nel file di dati in tempo reale per l'analisi post hoc . Appare anche il "PenPlot" per "Secondi & marcatori" per l'osservazione in corso.
- Per visualizzare i tempi delle applicazioni correnti e la loro influenza sui movimenti di occhio, fare clic sul menu "PenPlots". "Selezionare"Posizione lo sguardo X", Y lo sguardo posizione", "Torsione" e "Pupilla larghezza" per mostrare il tempo reale dati grezzi trame per X e Y occhio pupilla larghezza, torsione e posizioni. Inoltre è possibile selezionare i "secondi & marcatori" dal menu "PenPlots" per visualizzare un grafico di temporizzazione con i segni di graduazione, che compaiono a intervalli di 1 s.
- Analizzare i dati dal sistema di eye tracking.
- Aprire il file di dati salvati, che è in un formato di testo delimitato, in un programma di foglio di diffusione di scelta per organizzare i dati ed eseguire analisi statistiche.
- Convertire i valori di larghezza pupilla memorizzati nel file reali dimensioni in mm.
- Convertire i valori di X e Y occhio posizioni e torsioni alle unità di misura e utilizzano convenzioni per descrivere movimenti oculari; di conseguenza, le direzioni positive delle rotazioni: intorsion, elevazione e adduzione; e negativi indicazioni delle rotazioni: estorsioni, depressione e rapimento.
- Copiare le informazioni di intestazione in un nuovo foglio di lavoro. Questo includerà i valori per le dimensioni dello schermo (larghezza e altezza) e la distanza di osservazione. Otto colonne di dati raccolti ad un tasso di 30 Hz seguirà sotto le informazioni di intestazione.
- Tornare al foglio di lavoro contenente i dati non elaborati. Fare una "scoperta" per "X" nell'ultima colonna intitolata "Marker" per individuare dove è stata applicata la stimolazione con 10 µA. incidenza di ritrovamento di "T", segnando l'inizio della stimolazione corrente. Copiare 15 righe (0,5 s) dei dati che si verificano prima "T" e 90 fotogrammi dopo "T" (3.0 s); cioè, totale di 3,5 s. Incollare i dati nel nuovo foglio di lavoro sotto le informazioni di intestazione.
- Inserire una colonna vuota dopo "PupilWidth". Nella colonna vuota, è possibile convertire la dimensione calibrata in mm:
Diametro della pupilla orizzontale = "PupilWidth" × la dimensione della larghezza di visualizzazione della fotocamera - Inserire 2 colonne vuote dopo sia "X_Gaze" e "Y_Gaze". Normalizzare le posizioni per le dimensioni dello schermo di visualizzazione: coordinate (0, 0) nella parte superiore sinistra dello schermo che si estende a (1, 1) in basso a destra. Nella prima colonna vuota, tradurre posizioni ad avere un sistema di coordinate (0, 0) al centro dello schermo. Includono la conversione alle dimensioni dello schermo in mm:
X = (0.5 × larghezza) – ("X_Gaze" × larghezza); Y = (0.5 × altezza) – ("Y_Gaze" × altezza)
Nota: La sequenza di apertura è per l'occhio sinistro. La sequenza sarà necessario essere invertito per l'occhio destro al fine di seguire la convenzione di positività per adduzione e negatività per rapimento. - Nelle colonne seconda, è possibile utilizzare funzioni trigonometriche per convertire in angoli (°) di rotazione:
rotazione orizzontale = arctan (X/viewing distanza); rotazione verticale = arctan (Y/viewing distanza) - Torsione è già visualizzato in unità di gradi, ma per essere conformi alla convenzione di positività per intorsion, se la misurazione avviene sull'occhio sinistro, moltiplicare per -1. Per l'occhio destro, moltiplicazione non è necessario. Il programma codici di rotazione in senso orario come positivo.
- Tracciare il diametro della pupilla e rotazioni come funzione del tempo.
- Aprire il file di dati salvati, che è in un formato di testo delimitato, in un programma di foglio di diffusione di scelta per organizzare i dati ed eseguire analisi statistiche.
Risultati
La figura 1 Mostra stills di immagini tratte da un video che descrive la dissezione. Immagini forniscono posizioni tipiche dei nervi prima del taglio dal cervello.
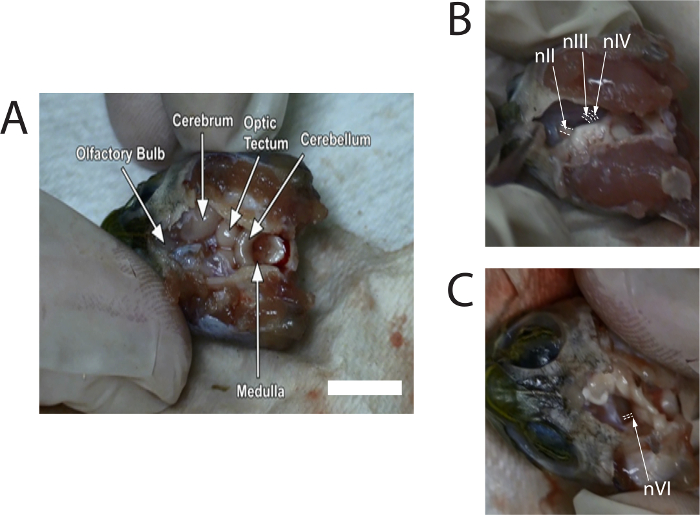
Figura 1: Stills di immagini catturate dal video della dissezione per mostrare la località del nervo ottico (nII), nervo oculomotore (nIII), nerv...
Discussione
Fasi critiche:
I passaggi critici all'interno di questo protocollo sono i seguenti: 1) la dissezione e la cura per mantenere la vitalità dei nervi transected; 2) la corrispondenza di dimensioni dagli elettrodi aspirazione ai nervi cranici di fornire risposte coerenti; e 3) il posizionamento della testa nella sospensione cardanica per fornire un'adeguata calibrazione delle rotazioni dell'occhio.
Risoluzione dei problemi:
La dissezione può esse...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori ringraziano la Signora Paulette McKenna e Lisa Pezzino in questo studio per supporto segretariale e Mr. Phil Auerbach per il supporto tecnico. Gli autori ringraziano anche i dottori Michael Ariel e Michael S. Jones (Saint Louis University School of Medicine) per ci ha spiegato che la preparazione della testa in vitro isolato. Contributi a sostegno di questa collaborazione è stata fornita dal dipartimento di biologia (Robert S. Chase Fund), il comitato accademico di ricerca e il programma di neuroscienze al Lafayette College. Infine, questo lavoro è dedicato a Mr. Phil Auerbach, scomparso 28 settembre 2016; ha un microscopio elettronico a scansione in disuso e riconosciuto l'utilità del suo stadio di 5 assi per l'uso in questo protocollo. L'amicizia e l'intraprendenza ci mancherà enormemente.
Materiali
| Name | Company | Catalog Number | Comments |
| Red-eared slider turtles | Kons Scientific | Trachemys scripta elegans | Large size (carapace length 15-20 cm) |
| Sodium chloride | Sigma-Aldrich Co. LLC. | S5886 | |
| Potassium chloride | Sigma-Aldrich Co. LLC. | P5405 | |
| Magnesium choride | Sigma-Aldrich Co. LLC. | M7304 | |
| Sodium bicarbonate | Sigma-Aldrich Co. LLC. | S5761 | |
| Dextrose | Sigma-Aldrich Co. LLC. | C5767 | |
| Concentrated hydrochloric acid | Sigma-Aldrich Co. LLC. | H7020 | |
| Calcium chloride | Sigma-Aldrich Co. LLC. | C7902 | |
| pH meter | Oakton | pH 6+ | |
| Suction stimulation electrode | A-M Systems | 573000 | Bipolar suction electrode. Note that 573000 has been replaced with 573050. |
| Capillary glass | A-M systems | 626000 | Single-barrel borosilicate capillary glass without microfilament, length 10 cm, outside diameter 1.0 mm, inner diameter 0.50 mm |
| Alternative suction stimulation electrode | A-M Systems | 573050 | Bipolar suction electrode. Requires larger diameter capillary glass: 627000, outside diameter 1.2 mm, inner diameter 0.68 mm |
| Stereoscope | Lieca | GZ7 | Magnification range, 10x – 70x |
| Fiber optic light source | Amscope | HL250-A | 150W Fiber optical microscope illuminator light box |
| Rongeurs | Carolina Biological Supply Company | 625654 | stainless steel, straight spring, 5.25" |
| Blunt dissection probe | Carolina Biological Supply Company | 627405 | Huber mall probe, double-ended probe and seeker, 6" |
| Microscissors | Carolina Biological Supply Company | 623555 | Iris microdissecting scissors, stainless steel, 0.5" blades, 4.75" long |
| Fine forceps | Sigma-Aldrich Co. LLC. | F6521 | Jewelers forceps, dumont No. 5, inox alloy, 4.25" |
| Curved forceps | Sigma-Aldrich Co. LLC. | Z168696 | Medium tip, curved forceps, stainless steel, 4" |
| Scalpel handle | Sigma-Aldrich Co. LLC. | S2896 | Scalpel handles, No. 3, stainless steel |
| Scalpel blade | Sigma-Aldrich Co. LLC. | S2771 | Scalpel blades, No. 11, steel |
| Guillotine | Harvard Apparatus | 73-1918 | Kleine guillotine type 7575 |
| Spatula | Sigma | Z648299 | Micro spoon and spatula weighing set. Use small spatula: 5.9” long x 0.07” diameter handle with square end: 0.17” x 1.3” long, other end round: 0.17” x 1.27” long |
| Hook | Autozone | 98069 | SureBilt hook and pick set. Use grinder to dull sharp points of hook to prevent injury to animals mouth. |
| 95/5% O2/CO2 | Airgas, Inc. | X02OX95C2003102 | 5% Carbon dioxide balance oxygen certified standard gas mixture, size 200 Cylinder, CGA-296 |
| Regulator | Airgas, Inc. | Y11244D296-AG | Single stage brass 0-100 psi analytical cylinder regulator CGA-296 with needle outlet. Use brass adjustable airline pipe valve to go from 3/8", inner diameter, vinyl airline tubing connected to regulator to a 3/16", inner diameter, airline connection going to airstone or glass pasteur pipette. |
| Adjustable airline pipe valve | Doctors Foster and Smith | CD-12061 | Brass valve |
| Rigid table | Unknown | Unknown | Auto-clave door laid on top of a sturdy table. Nine 5" diameter tennis balls isolate vibrations from the top surface of the table. |
| 5" tennis ball | Petco Animal Supplies, Inc. | 712868 | Petco Jumbo Pet Tennis Ball: balls are unsliced and held within an integrated frame on the underside part of the autoclave door. |
| Alternative vibration isolation table | Newport Corporation | INT1-36-6-N | Rigid vibration control system, integrity 1: Surface dimensions, 3' x 6' |
| Gimbal | ISI, International Scientific Instruments, Inc. | Stage from SUPER III-A Scanning EM | 5-axis eucentric stage: X, Y, and Z linear movements, ±20 mm, 0.1 mm precision; Rotations, vertical, ±10°, and horizontal, ±12.5°, with 1.25° precision. Note: from decommission instrument. |
| Chuck for gimbal | Unknown | Unknown | Chuck from an old microtome of unknown manufacture was machined to fit the shaft of the specimen holder of the Scanning EM stage |
| Alternative gimbal | ThorLabs, Inc. | GN2/M with MBT602/M | Dual-axis goniometer (GN2/M) mounted on 3-axis microblock stage with thumbscrew adjusters (MBT602/M): design a chuck to hold turtle head with eye at 12.7 mm above top surface of goniometer (distance to point of rotation) |
| Video-based eye tracking system | Arrington Research, Inc. | ViewPoint EyeTracker, PC-60 | Tracking method: Infrared video by dark pupil; Black and white camera (Item BC02): 30 Hz, 640 x 480; System requirements: Windows 2000, XP, 7, 8, 8.1, 10; Visual range: Horizontal +/- 44°; vertical +/- 20°; Accuracy ~0.5°; Spatial resolution ~0.15°; Pupil size resolution ~0.03 mm; Eye data: X, Y position of gaze, pupil height and width, torsion, delta time, total time, and regions of interest (ROI); Real-time communication (Item 0022): 4-Channel AnalogOut with eight TTL input channels to mark codes into the data file |
| Multi-position magnetic base | Harbor Freight Tools | Pittsburg, item #5645 | Magnetic holder reaches up to 12" and produces 45 lbs. of magnetic pull. Use to position camera. Machine thread holes onto the end of the rod to mount cameras. |
| Micromanipulator | Kopf | 900 | 5 axis manipulation for mount of suction electrode: X, Y, Z linear travel, 2 axis of rotation |
| Dissection scope on boom | Lieca | GZ6 | Magnification range, 6.7x – 40x |
| Nerve/muscle stimulator | Astro-Med Grass Telefactor | Grass S88 | Dual pulse voltage stimulator: two output channels that can be operated independently or synchronized to generate non-isolated constant voltage pulses (10 mv to 150 V). Pulses can be single (10 μsec to 10 sec), repetitive (0.01 Hz to 1 KHz), and trains (1 ms to 10 s) and synchronized with TTL inputs and output. Send TTL outputs via the output channels of a DB25 connector to the TTL input channels of the ViewPoint EyeTracker. Note: Astro-Med Grass Telefactor is no longer in business. |
| Current isolation device | Astro-Med Grass Telefactor | PSIU6 | Current stimulus isolation unit: enables safe delivery of constant currents by the S88 to the preparation. The PSIU6 connects by a BNC cable to one of the output channels of the S88. Multiplier switches on the PSIU6 allow the S88 to generate a wide array of current amplitudes ranging from 0.1 µA to 15 mA. |
| Alternative nerve/muscle stimulator with isolation | A-M Systems | 2100 | Isolated Pulse Stimulator: Unit has built-in isolator to produce constant currents. |
Riferimenti
- Kikillus, K. H., Hare, K. M., Hartley, S. Minimizing false-negatives when predicting the potential distribution of an invasive species: A bioclimatic envelope for the red-eared slider at global and regional scales. Anim Conserv. 13, 5-15 (2010).
- Lutz, P. L., Rosenthal, M., Sick, T. J. Living without oxygen: turtle brain as a model of anaerobic metabolism. Mol Physiol. 8, 411-425 (1985).
- Lutz, P. L., Milton, S. L. Negotiating brain anoxia survival in the turtle. J Exp Biol. 207, 3141-3147 (2004).
- Storey, K. B. Anoxia tolerance in turtles: Metabolic regulation and gene expression. Comp Biochem Physiol A-Mol Integr Physiol. 147 (2), 263-276 (2007).
- Granda, A. M., Dearworth, J. R., Subramaniam, B. Balanced interactions in ganglion-cell receptive fields. Vis Neurosci. 16, 319-332 (1999).
- Dearworth, J. R., Granda, A. M. Multiplied functions unify shapes of ganglion-cell receptive fields in retina of turtle. J Vis. 2 (3), 204-217 (2002).
- Nesbit, S. C., Van Hoof, A. G., Le, C. C., Dearworth Jr, J. R. Extracellular recording of light responses from optic nerve fibers and the caudal photoreceptor in the crayfish. J Undergrad Neurosci Educ. 14 (1), A29-A38 (2015).
- McMahon, B. R. Respiratory and circulatory compensation to hypoxia in crustaceans. Resp Phsiol. 128 (3), 349-364 (2001).
- Leigh, R. J., Zee, D. S. . The neurology of eye movements. , (1999).
- Robinson, D. A. A method of measuring eye movement using a scleral search coil in a magnetic field. IEEE Trans Biomed Eng. 10, 137-145 (1963).
- Judge, S. J., Richmond, B. J., Chu, F. C. Implantation of magnetic search coils for measurement of eye position: an improved method. Vis Res. 20, 535-538 (1980).
- Ong, J. K. Y., Halswanter, T. Measuring torsional eye movements by tracking stable iris features. J Neurosci Meth. 192, 261-267 (2010).
- Kimmel, D. L., Mammo, D., Newsome, W. T. Tracking the eye non-invasively: simultaneous comparison of the scleral search coil and optical tracking techniques in the macaque monkey. Front Behav Neurosci. 6 (49), 1-17 (2012).
- Otero-Millan, J., Roberts, D. C., Lasker, A., Zee, D. S., Kheradmand, A. Knowing what the brain is seeing in three dimensions: A novel, noninvasive, sensitive, accurate, and low-noise technique for measuring ocular torsion. J Vis. 15 (14), 1-15 (2015).
- Demski, L. S., Bauer, D. H. Eye movements evoked by electrical stimulation of the brain in anesthetized fishes. Brain Behav Evol. 11, 109-129 (1975).
- Gioanni, H., Bennis, M., Sansonetti, A. Visual and vestibular reflexes that stabilize gaze in the chameleon. Vis Neurosci. 10, 947-956 (1993).
- Straka, H., Dieringer, N. Basic organization principles of the VOR: lessons from frogs. Prog Neurobio. 73 (4), 259-309 (2004).
- Voss, J., Bischof, H. -. J. Eye movements of laterally eyed birds are not independent. J Exp Biol. 212 (10), 1568-1575 (2009).
- Ariel, M. Independent eye movements in the turtle. Vis Neurosci. 5, 29-41 (1990).
- Ariel, M., Rosenberg, A. F. Effects of synaptic drugs on turtle optokinetic nystagmus and the spike responses of the basal optic nucleus. Vis Neurosci. 7, 431-440 (1991).
- Balaban, C. D., Ariel, M. A "beat-to-beat" interval generator for optokinetic nystagmus. Biol Cybern. 66, 203-216 (1992).
- Keifer, J. In vitro eye-blink reflex model: Role of excitatory amino acid receptors and labeling of network activity with sulforhodamine. Exp Brain Res. 97, 239-253 (1993).
- Keifer, J., Armstrong, K. E., Houk, J. C. In vitro classical conditioning of abducens nerve discharge in turtles. J Neurosci. 15, 5036-5048 (1995).
- Rosenberg, A. F., Ariel, M. A model for optokinetic eye movements in turtles that incorporates properties of retinal slip neurons. Vis Neurosci. 13, 375-383 (1996).
- Ariel, M. Open-loop optokinetic responses of the turtle. Vis Res. 37, 925-933 (1997).
- Anderson, C. W., Keifer, J. Properties of conditioned abducens nerve responses in a highly reduced in vitro brainstem preparation from the turtle. J Neurophysiol. 81, 1242-1250 (1999).
- Keifer, J. In vitro classical conditioning of the turtle eyeblink reflex: Approaching cellular mechanisms of acquisition. Cerebell. 2, 55-61 (2003).
- Zhu, D., Keifer, J. Pathways controlling trigeminal and auditory nerve-evoked abducens eyeblink reflexes in pond turtles. Brain Behav Evol. 64, 207-222 (2004).
- Jones, M. S., Ariel, M. The effects of unilateral eighth nerve block on fictive VOR in the turtle. Br Res. 1094, 149-162 (2006).
- Jones, M. S., Ariel, M. Morphology, intrinsic membrane properties, and rotation-evoked responses of trochlear motoneurons in the turtle. J Neurophysiol. 99 (3), 1187-1200 (2008).
- Krenz, J. G., Naylor, G. J. P., Shaffer, H. B., Janzen, F. J. Molecular phylogenetics and evolution of turtles. Mol Phylogenet Evol. 37 (1), 178-191 (2005).
- Dearworth, J. R., et al. Role of the trochlear nerve in eye abduction and frontal vision of the red-eared slider turtle (Trachemys scripta elegans). J Comp Neur. 52, 3464-3477 (2013).
- Dearworth, J. R., et al. Pupil constriction evoked in vitro by stimulation of the oculomotor nerve in the turtle (Trachemys scripta elegans). Vis Neurosci. 26, 309-318 (2009).
- Mead, K., et al. IFEL TOUR: a description of the introduction to FUN electrophysiology labs workshop at Bowdoin College, July 27-30, and the resultant faculty learning community. J Undergrad Neurosci Educ. 5, A42-A48 (2007).
- Jackson, D. C., Ultsch, G. R. Physiology of hibernation under the ice by turtles and frogs. J Exp Zool A Ecol Genet Physiol. 313 (6), 311-327 (2010).
- Romano, J. M., Dearworth, J. R. Pupil constriction evoked by stimulation of the ciliary nerve in the red-eared slider turtle (Trachemys scripta elegans). J Penns Acad Sci. 85, 4-8 (2011).
- Miller, J. M., Robins, D. Extraocular-muscle forces in alert monkey. Vis Res. 32, 1099-1113 (1992).
- Gamlin, P. D., Miller, J. M. Extraocular muscle motor units characterized by spike-triggered averaging in alert monkey. J Neurosci Meth. 204, 159-167 (2011).
- Quaia, C., Ying, H. S., Optican, L. M. The Viscoelastic properties of passive eye muscle in primates. III: Force elicited by natural elongations. PLOS ONE. 5, A236-A254 (2010).
- Anderson, S. R., et al. Dynamics of primate oculomotor plant revealed by effects of abducens microstimulation. J Neurophys. 101, 2907-2923 (2009).
- Maxwell, J. H., Harless, M., Morlock, H. Anesthesia and surgery. Turtles: Perspective and Research. , 127-152 (1979).
- AVMA Panel on Euthanasia. American Veterinary Medical Association. J Am Vet Med Assoc. 218 (5), 669-696 (2001).
- Clarke, R. J. Shaping the pupil's response to light in the hooded rat. Exp Br Res. 176, 641-651 (2007).
- Bennett, R. A. A review of anesthesia and chemical restraint in reptiles. J Zoo Wild Med. 22 (3), 282-303 (1991).
- Bickler, P. E., Buck, L. T. Hypoxia Tolerance in Reptiles, Amphibians, and Fishes: Life with Variable Oxygen Availability. Ann Rev Physiol. 69, 145-170 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon