A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
קינמטיקה עינית נמדדת במבחנה גירוי עצבי של הצב
In This Article
Summary
פרוטוקול זה מתאר כיצד להשתמש במבחנה מבודד צב ראש הכנה כדי למדוד את קינמטיקה של תנועות עיניים שלהם. לאחר ההסרה של המוח של הגולגולת, עצבי יכול להיות מגורה עם זרמים לכמת סבבים של העין, שינויים במידות האישון.
Abstract
אחרי חיות מורדמים, הרקמות שלהם מתחילים למות. צבי מציעים יתרון בגלל זמן הישרדות ארוך יותר של הרקמות שלהם, במיוחד בהשוואה לבעלי חוליות עם מצלצלים. מסיבה זו, ניתן לבצע ניסויים במבחנה ב צבים ממושכות של זמן כדי לחקור את האותות העצביים ובקרה של פעולות היעד שלהם. שימוש של הכנת ראש מבודד, מדדנו את קינמטיקה של תנועות עיניים בצבים, אפנון שלהם על ידי אותות חשמליים נישא על ידי עצבי. אחרי המוח שהוסר הגולגולת, עוזב את עצבי תקין, בראש ביתור הושם על gimbal לכיול תנועות עיניים. זכוכית אלקטרודות היו קשורות עצבי (תזוזת גלגל העין, מבט, ו- abducens), מגורה עם זרמים לעורר תנועות עיניים. אנחנו במעקב תנועות עיניים עם סרט אינפרא-אדום מעקב המערכת, כימות סבבים של העיניים. זרם פולסים עם מגוון של amplitudes, תדרים, ושימשו הרכבת משכים לבחון השפעות על תגובות. כי ההכנה מופרדת מן המוח, אפשר לבחון מסלול efferent הולך שריר מטרות בבידוד לחקור איתות עצבי, בהעדר מידע חושי מרכזי מעובד.
Introduction
הרציונל לשימוש צבגון אדום-צבים בניסויים אלקטרופיזיולוגיות:
צבגון אדום-צבים (Trachemys scripta elegans), נחשב לאחד מין פולש הכי גרוע בעולם,1 , ניתן לציין כי המערכת האקולוגית היא בצרות. הסיבה למה צבים צבגון אדום-הם כל כך מוצלח הוא ממעטים להבין אבל זה יכול להיות באופן חלקי בגלל שלהם פיזיולוגיה סובלנית ואחזקה של רקמות עצבים שיכולים לשרוד תחת תנאים ובשפתיים2,3,4 . באמצעות אותם ניסויים אינו מאיים על מספרם, עם מאמץ מינימלי, ההכנות אלקטרופיזיולוגיות יכול להישאר בר קיימא על משכים מורחבת, עוד 18 שעות5,6. היתרון הוא דומה היתרון בשימוש בעלי חיים כגון סרטני7, אשר יש גם את היכולת לעמוד רמות נמוכות של חמצן8.
שיטות למדידת תנועות עיניים:
גישות למדידת תנועות עיניים אצל בעלי חיים עם עיניים הקדמית באמצעות קופים כבר מפותח9. העין מסתובב במסלול סביב שלושה צירים: אופקי, אנכי, הכיווניות. השיטה סליל מגנטי חיפוש נחשבת בדרך כלל הכי אמין עבור סבבים מדידה, אבל היא פולשנית, הדורשים סלילים קטן כדי להוסיף את scleras של בעלי חיים10,11. גם מערכות מבוססות וידאו ניתן למדוד סבבים, יש את היתרון של להיות פולשני. התפתחות טוב יותר מצלמות יחד עם עיבוד תמונה חדשני וביצרו את הפונקציונליות שלהם ביצוע מערכות מבוססות וידאו חלופה אטרקטיבית לשקול12,13,14.
בטכניקות שפותחו למדידת תנועות עיניים ב- nonmammals כבר הרבה פחות משמעותי. אמצעים או ברזולוציה נמוכה או לתאר רק חלק17,1816,15,סבבים. חוסר ההתפתחות של אפשר להאשים באופן חלקי על הקושי nonmammals אימונים כדי לעקוב אחר מטרות חזותי. למרות תנועות עיניים נחקרו היטב צבגון אדום-צבי19,20,21,22,23,24,25 ,26,27,28,29,30, בגלל האתגר בבעלי הכשרה כדי לעקוב אחר מטרות, קינמטיקה מדויק של תנועות עיניים שלהם הוא גרוע מובן.
צבגון אדום-צבים נחשבים בדרך כלל חולייתנים לרוחב-עיניים, אך כי הם יכולים באופן מלא משכי ראשם לתוך המעטפת שלהם31, סגר משמעותית של השדות visual לרוחב על ידי השריון מתרחשת32. התוצאה היא כי קו ראיה חזותי שלהם נכפה לעבר החזית, הפיכתם מתנהג יותר. כמו יונקים הקדמית-עיניים. לכן, השימוש בהם כמודל לפיתוח גישות למדידת תנועות עיניים גם מציע נקודת מבט אבולוציונית ייחודית.
הפרוטוקול המתואר בעבודה זו משתמשת במבחנה מבודד ראש הכנה כדי לזהות את קינמטיקה של תנועות העין ב צבגון אדום-צבים. המוח הם גזור מן גולגולות עוזב את עצבי תקין. ראשי ממוקמים בתוך gimbal לכייל תנועות עיניים, לעורר תגובות על ידי גירוי חשמלי של עצבי innervating שרירי העין. מדדים של סיבובים על ידי בעיניים נעשים בעזרת מערכת מבוססת-וידאו, באמצעות אלגוריתמים של התוכנה, אשר המסלול התלמיד כהה, את הסימנים של הקשתית. ההכנה מספקת את ההזדמנות כדי למדוד קינמטיקה של שני extraocular (קרי, אופקי, אנכי, הכיווניות סבבים)32 , תוך-עיני (קרי, שינויים תלמידו)33 תנועות.
מערכת מודל לניתוח של מסלולים עצביים Efferent:
באופן כללי, הגישה מספק חוקרים ההזדמנות ללמוד איך efferent אותות עצביים ליצור תנועות עיניים הפעלת השרירים ממדינות רגועה שלהם, בהיעדר מידע חושי משולב מעובד על ידי המוח32. 33. לכן, קינמטיקה העין יכול להיבדק במערכת מודל שבו הם מעובדים אך ורק על ידי מסלול עצבי efferent עוזב את המוח, synapsing על גבי השרירים.
Protocol
הערה: צבגון אדום-צבים, גם זכר וגם נקבה, נרכשו מיצרן. צבים שוכנו בסוויטה בעלי חיים חמים המכיל שתי אמבטיות 60 ליטר מצויד איים לבנים עבור לשיזוף תחת אורות אינפרא-אדום 250-W. הסביבה נשמר על מחזור 14/10-h/כהה עם טמפרטורת מים 22 מעלות צלזיוס. האורות היו מופעלת ב־6: 00 וכיבה בשעה 8 בערב. הטנקים מצויד עם מערכות סינון נוקו שבועי, צבים הואכלו ad libitum בכל יום אחר. הטיפול של צבגון אדום-צבים, כל המתואר כאן32,בצרות הבאים33 אושרו על ידי טיפול בעלי חיים מוסדיים ועל שימוש הוועדה (IACUC) במכללת לאפייט.
1. ציוד התקנה
- להכין תמיסת רינגר צב. להוסיף מים מזוקקים בצו זה את הדברים הבאים: נתרן כלורי 96.5 מ מ (58.44 g/mol), אשלגן כלורי 2.6 מ מ (74.56 g/mol), מגנזיום כלוריד 2.0 מ מ (203.31 g/mol), סודיום ביקרבונט 31.5 מ"מ (84.01 g/mol), דקסטרוז 20.0 mM (180.16 g/mol), מרוכז חומצת מלח כדי להתאים את ה-pH 7.51 ולאחר סידן כלורי 4.0 מ"מ (110.98 g/mol) (ראה טבלה של חומרים). מערבבים את הפתרון תוך הוספת מלח לכל.
זהירות: HCl מרוכזת היא מסוכנים (עור, עיניים, שאיפה, בליעה מפגעים). - להפוך טיפים האלקטרודות היניקה של 5-ס מארוך נימי זכוכית (ראה טבלה של חומרים), על ידי שיוף אש כדי בגדלים שונים של קטרים הפנימי על מנת להתאים עצבי של עובי שונות.
- השתמש קובץ קטן לחרוט שורה על פני פיסת זכוכית נימי. מניחים נייר טישו ולשבור לשניים.
- לאט לאט לגלגל באחד הקצוות של זכוכית נימי לתוך להבת מבער בונזן. מדי פעם לבחון את עצת עבור גודל חלקות, סימטריה באמצעות ניתוח היקף ואור סיב אופטי סיבים מקור (ראה טבלה של חומרים).
הערה: צבים עם רוחב הראש בין 20 ל 30 מ מ, קוטר פנימי התאמה אופטימלית מידות בדרך כלל נע בין 0.4 ל 0.8 מ מ עבור העצב (nIII), ל- 0.3-0.6 מ מ על העצב הסליל (ניב) ו- 0.2-0.4 מ מ עבור העצב המצדיד (nVI).
- לנקות ולארגן Rongeurs, מכשיר בדיקה עמום, microscissors, מלקחיים בסדר, מלקחיים מעוקל, וידית האזמל עם להבי (ראה טבלה של חומרים) רוברט.
הערה: עיקור המכשירים היא אופציונלית.
2. המתת חסד והרדמה
- המקום הצב בקרח דלי עבור 60 דקות כדי cryoanesthetize זה.
- המתת חסד הצב ע י עריפת ראשו באמצעות גיליוטינה בעלי חיים קטנים (ראה טבלה של חומרים).
- לחטט בעדינות מלתעות הפתוח בעלי חיים עם מרית קטנה במשקל, כך קרס יכול להיות מוכנס פנתה תחת קצה הלסת העליונה.
- משוך עם לחץ אחיד כדי להאריך את ראשה דרך הגיליוטינה. במהירות לערוף את החיה.
- מקום ראש צב תבשיל לנתיחה. יש תמיסת רינגר צב מספיק על היד כדי להרוות את הרקמה. Oxygenize הפתרון ב- 95/5 O2/CO2 (ראה טבלה של חומרים).
- לשמור על הרקמה ב 4 ° C על ידי הנחת קרח סביב החלק החיצוני של המנה.
3. ניתוח
- השתמש הטווח לנתיחה עם מקור אור סיב אופטי סיבים כדי לבצע את הקרע.
- הסר את הלסת התחתונה. במקום בדיקה עמום דרך הפה כדי לספק טיפול קל יותר של הראש. חותכים המפרק המחבר את עצם dentary בגולוגולת עם אזמל. השתמש rongeurs כדי למשוך את הלסת התחתונה מן הגולגולת. השתמש rongeurs כדי לבצע את העור והשרירים מקבצים מצורפים שלהם על האזורים הגבי ו לרוחב של הגולגולת.
- הסר את עמוד השדרה.
- לזהות את עמוד השדרה בקצה סימטרית של הגולגולת. לכופף את עמוד השדרה ventrally לחשוף את חוט השדרה. השתמש microscissors כדי לגזור את חוט השדרה. השתמש rongeurs כדי להסיר את עמוד השדרה ורקמות אחרות הגולגולת על ידי משיכת הקליפה.
- הסר במוח הגולגולת לאחר חיתוך של עצבי.
- החל מ- מאגנום נקב, להשתמש rongeurs כדי לחתוך שני חתכים על הגולגולת הגבי. לעשות חתכים שטחיים כדי למנוע נזק למוח מתחת.
- השתמש rongeurs כדי משוך בזהירות את הגולגולת הגבי. השתמש microscissors כדי להסיר את meninx כדי לחשוף את שאר המוח. להסיר meninx מספיק עד הנורות הריח, בתוך חלל הגולגולת הקדמי, ניתן לזהות (ראה איור 1 א'). המשך להשקיית את המוח עם תמיסת רינגר צב, לפי הצורך.
- להשתמש מלקחיים מעוקל בעדינות למשוך את המוח הגדול. הקליפה ולייצר מתח קלה של עצבי. בזהירות לחתוך ולהסיר את הריח נורות ואת המוח הגדול עם מלקחיים מעוקל.
- השתמש microscissors לדחוף בעדינות את המוח האמצעי לכיוון האמצע לחשוף את עצבי; nIII, כ 0.6 מ מ, ניתן לראות מול ניב, כאשר הקוטר של ניב יהיו קצת פחות nIII. חתך nIII, ניב איפה שהם מייחסים המוח האמצעי (ראה איור 1B). חזור על זה בצד השני.
- חותכים ימינה ושמאלה עצב הראייה (לביטוח לאומי) עם microscissors. לאחר מכן להטות לגזע המוח לצד אחד. לצפות nVI העולה מן השטח הגחון ליד הצומת של פונס ו לשד (ראה איור 1C); הקוטר של nVI הוא קטן ויש כ 0.3 מ"מ. חתך הן nVI על ימין ועל שמאל.
- הסר את החלקים הנותרים של גזע המוח הצב עם מלקחיים בסדר, microscissors. לאחר הגולגולת ריק, לבחון את הרצפה חלל הגולגולת. זהה nIII, ניב, nVI.
- הסר את העפעפיים העליונים והתחתונים העין-עם מלקחיים בסדר, microscissors.
4. כיול של תנועות עיניים
- השתמש בטבלה נוקשה (ראה טבלה של חומרים) כדי לתמוך את המיקום על gimbal ומכשירים אחרים. המקום ראש צב לתוך הצ'אק gimbal כך המשטח הגבי של הראש, הוא מקביל לקו האופק באמצעות מנוחה ברמת בועות קטנות על פני הגולגולת. בערך מקם את אחת העיניים במרכז סבבים של gimbal אופקיים ואנכיים.
- למקם את המצלמה אינפרא-אדום, מצויד של אור אינפרא-אדום דיודה (LED), המהווה חלק של העין מבוססי וידאו מערכת מעקב (ראה טבלה של חומרים), ממרחק הצפייה של-12 ס מ מהעין של הצב.
- זווית המצלמה 45 מעלות מעל לקו הראייה של העין. ה-LED צריכה להיות במיקום בשעה 11, כאשר מסתכלים על עדשת המצלמה. מרכז ה-LED לאורך הציר האופטי של העין. המצלמה תהיה מעט מהציר (כפי צפו ב מעל העין).
- להתאים את המרחק של המצלמה מן העין כך תצוגת המצלמה מתמלא מקסימאלית על ידי גלגל העין. ודא הפינות של העיניים (canthi) בקצוות של התצוגה האופקי.
- לחבר את מצלמת את העין מבוססי וידאו מעקב המערכת כדי לעבד את הנתונים. לפצל את אות צורב-DVD כדי ללכוד את הווידאו raw. למקד את המצלמה כדי לקבל תמונה ברורה של העין. לטפל כדי פיין-מיקום העין במרכז של נקודת המבט של המצלמה באמצעות שלוש דרגות התאמה לינארית (x, y, z) סיפק הרדיו.
- לאתר את התלמיד כהה על-ידי הגדרת את הסף והחדות כראוי באמצעות התוכנית סיפקה עם העין מבוססי וידאו מערכת המעקב.
- באמצעות העכבר, לחץ על תפריט "וידאו", תחת "מוד" בחר "דיוק גבוהה" כדי ללכוד תמונות בקצב דגימה של 30 הרץ (רזולוציה 640 פיקסלים x 480 שורות). גם תחת "וידאו", בחר "תלמיד כהה" עבור "תלמידו סוג" ו- "אליפסה (מסובב אליפסה)" עבור "שיטת פילוח תלמידו".
- בחלון "EyeCamera", לחץ על הסמל "תלמידו חיפוש באזור ההתאמה" (מלבן אנכי קטן עם נקודה במרכז). להשתמש בעכבר כדי לגרור את מלבן המגביל אזור סביב האישון. להימנע אזורים כהים, זה יכול להיות מבולבל עם התלמיד.
- בחלון "שולטת", אשר תיבות של "תמונה אוטומטי" ו- "סף חיובי-Lock-מעקב אחר" נבדקים. לחץ על "Auto-סף" כדי למטב את הצפיפות של סריקה, אשר תציג כנקודות ירוק מעל האישון כהה.
- כיילו את הסרטונים-התצוגה של העין מבוססי וידאו מעקב תוכנית כדי לסיבובים של gimbal 12.5 ° (+ /-) סביב ציר אופקי ו- 10 מעלות (+ /-) סביב הציר האנכי שלה.
- בחלון "שולטת", ללחוץ על "תצוגה". סמן את התיבות תחת "מבט" וגם "סאונד" "נקודת מבט", "אזור כוונון" של "גיאומטריה רשת". לאחר שבדקת את התיבות תחת "גיאומטריה רשת", חלון צצים ואומר "הגיאומטריה הצגת הגירוי חייב למדוד לפני הגיאומטריה הרשת יכולים להיות מוצגים. האם ברצונך לעשות זאת כעת?" בחר "Y" על כן.
- באמצעות העכבר, לחץ על תפריט "חלונות" ובחר "גירוי". חלון "גירוי" ייפתח חציית קו אנכי ואופקי במרכז התצוגה. למדוד את אורך הקווים מ"מ הקרוב. הקש"Esc"בלוח המקשים כדי לצאת מהחלון"גירוי".
- באמצעות העכבר, לחץ על תפריט "גירוי" ובחר "גיאומטריה להגדרת". קלט את אורך השורות נמדדו בדיוק. להתאים את המרחק הצפייה כך הקו/מעלות שווה 25 ° עבור הקו האופקי ו- ° 20 עבור הקו האנכי. לחץ על לחצן "חנות" ולסגור את החלון.
- בחלון "EyeSpace", בחר את מספר כיול "נקודת נתונים" להיות "9". עם העין של הצב ממוקם במרכז, לחץ על מרכז הנתונים הצבע והקלק על כפתור "נוכח מחדש".
הערה: יפתח חלון "גירוי", "להיות מוכן" יופיע במרכז המסך. תיבה שמופיעים במיקום מרכז ונעלמים. על ההיעלמות שלו ייסגר החלון "גירוי". עכשיו צריך להיות מכויל המיקום במרכז. - חזור על הפעולות על-ידי סיבוב על gimbal ימינה/שמאלה, +12.5 ° /-12.5 °, ועל למעלה/למטה +10 ° /-10 ° כדי לכייל את נקודות הנתונים הנותרים.
- כדי לכייל את הסיבוב הכיווניות, השתמש בתבנית הולם אלגוריתם מסופקים עם העין מבוססי וידאו מעקב תוכנית. האלגוריתם קובעת משרה אפס בהתבסס על הסימנים של הקשתית, מחשבת את זווית הסיבוב כאשר הסימנים להפוך מוזחות את centroid של התלמיד.
- באמצעות מצביע העכבר, לחץ על תפריט "חלונות" ובחר "פיתול". לחץ על לחצן "התחל" חלון "פיתול". בחלון "EyeCamera", קשת יופיע מעל לתמונה של העין.
- התאם את הרדיוס הזווית, את אורך הקשת שימוש במחוונים במיקום בו סימנים חריגים נמצאים הקשתית. סמן את התיבות "גרפיקה בזמן אמת", "התאם אוטומטית-Set לאחר". במידת הצורך, לכוונן את הבהירות וחדות החלון בקרות, re-הסף התלמיד כהה (ראה שלב 4). לחץ על לחצן "להגדיר תבנית".
- הנח סרגל באותו מישור מוקד כתלמידם ולהקליט את הרוחב של נקודת המבט של המצלמה מלא. הערך ישמש מאוחר יותר כדי לקבוע את הרוחב בפועל של התלמיד.
5. מיקום של אלקטרודה יניקה על עצבי לעורר תנועות עיניים
- בזהירות המקום אלקטרודה הפניה של סיכה לתוך רקמות החיבור או שריר שנותרו על הראש.
- מקם את האלקטרודות היניקה (ראה טבלה של חומרים) על עצב הגולגולת באמצעות טווח micromanipulator, דיסקציה רכוב על בום. השתמש מקור אור סיב אופטי סיבים כדי להציג ולהדריך את המיקום.
- להתאים את הגודל של חוצפה טיפ נימי זכוכית. ניסוי וטעייה יש צורך להשיג התאמה הטובה ביותר סביב הקוטר של עצב (ראה שלב 1.2 עבור גודל המלצות). מקם קצה זכוכית אל האלקטרודה היניקה. למלא את האלקטרודה יניקה עם תמיסת רינגר ולכוונן את העוצמה בתוך המזרק בערך מחצית הקיבולת שלו.
- הזז בזהירות זכוכית קצה האלקטרודה באמצעות micromanipulator למיקום מעל החתך-הסיום של עצב שנבחרו. ודא כי תמיסת רינגר ממלא את הגולגולת, הטיפ הוא מתחת לפני השטח שלו. במידת הצורך, השתמש דוגמנות קליי לסכור מיקומי שבו תמיסת רינגר דולף החוצה הגולגולת.
- למשוך בחזרה על הבוכנה של המזרק.
הערה: שואב האבק תצייר את העצב בתוך הסוף של קצה נימי. מתאים מסומן על ידי העצב שנותרו בתוך הטיפ עם מעט או ללא אבק נוספים שהוחלו.
6. גירוי עצבי וניתוח של תנועות עיניים
- להשתמש ממריץ עצב/שריר למטרה כללית עם מכשיר בידוד הנוכחי (ראה טבלה של חומרים) כדי לעורר את העצבי דרך האלקטרודה היניקה.
- ןקתהל האלקטרודה היניקה הנוכחי בידוד באמצעות כבל. לחבר את ההובלה של האלקטרודה הפניה pin החיבור לקרקע של המכשיר בידוד.
- בחר פרמטרים של הזרמים באמצעות את החוגה ועובר על המכשיר ממריץ ובידוד. שימוש במגוון של זרמי מ- 1 עד 100 µA, בתדירות של 10 400 ש-hz. שימוש 1 או 2 ms פולסים רכבות שנמשך 100, 500 או 1000 ms.
- להקליט את התזמון של stimulations.
הערה: פולסים טרנזיסטור הטרנזיסטור-לוגיקה (TTL) מסונכרנים עם המשלוחים של הזרמים של ממריץ ולתקשר ב בזמן אמת באמצעות כבל ערוצי קלט של העין מבוססי וידאו מערכת המעקב. מודול התוכנה מסופקים עם העין מבוססי וידאו מעקב תוכנית בקרת התקשורת.- כדי להמחיש את התזמון של היישומים הנוכחי והשפעתם על תנועות עיניים, לחץ על תפריט "PenPlots". בחר "תנוחת להביט X", "תנוחת להביט Y", "פיתול", ורוחב "תלמיד" להראות בזמן אמת נתונים גולמיים חלקות X ו- Y עין עמדות, פיתול, ורוחב האישון. גם לבחור את "סמני שניות &" מתוך תפריט "PenPlots" כדי להראות מגרש תזמון עם סימוני שנתות, אשר יופיעו במרווחי s 1.
הערה: אות רישית "T" יופיע סימון תחילתה של הדופק TTL, המתרחשים בו זמנית עם היישום הנוכחי. - כדי לאחסן את הנתונים של תנועות עיניים עורר על ידי זרמים, לחץ על תפריט "קובץ" ובחר "קובץ הנתונים החדש" תחת "נתונים". קלט שם קובץ ולחץ על "Enter". שמירת נתונים ניתן להשהות ולאחר מכן יופעלו מחדש באמצעות השילוב של פקודות מפתח, "Ctrl" + "p". כאשר הושלם מפגש ניסיוני, בחר "סגור קובץ נתונים" מתפריט "קובץ" תחת "נתונים".
- כדי לסייע לשמור על מעקב אחר של הסוג של זרמי להחיל, לחץ על תפריט "חלונות" ובחר "משטח נתונים". יופיע חלון "מקלדת/DataMarker". לחץ על אות או מספר כדי לזהות את הפרמטרים של stimulations הנוכחי שנגאלו העצב.
הערה: לדוגמה, "X" יכול לסבול עבור 10 µA. לחיצה על "X" מאחסן את הערך שלה לתוך קובץ הנתונים בזמן אמת לצורך ניתוח פוסט הוק . הוא מופיע גם ב- "PenPlot" עבור "שניות & סמני" למעקב שוטף.
- כדי להמחיש את התזמון של היישומים הנוכחי והשפעתם על תנועות עיניים, לחץ על תפריט "PenPlots". בחר "תנוחת להביט X", "תנוחת להביט Y", "פיתול", ורוחב "תלמיד" להראות בזמן אמת נתונים גולמיים חלקות X ו- Y עין עמדות, פיתול, ורוחב האישון. גם לבחור את "סמני שניות &" מתוך תפריט "PenPlots" כדי להראות מגרש תזמון עם סימוני שנתות, אשר יופיעו במרווחי s 1.
- ניתוח נתונים ממערכת המעקב העין.
- פתח את קובץ הנתונים שנשמרו, שהוא בתבנית טקסט מופרד, לתוכנית גיליון התפשטות של בחירה כדי לארגן את הנתונים ולבצע ניתוח סטטיסטי.
- המר את ערכי רוחב תלמידו מאוחסנים בקובץ כדי אמיתי מידות במ מ.
- המר את הערכים של X ו Y עין עמדות ואת torsions ליחידות של מעלות ולהשתמש מוסכמות לתיאור תנועות עיניים; לכן, ההוראות חיובית של סיבובים: intorsion, העלאת ולאחר ההסתמכות; ושלילי הכיוונים של סבבים: extorsion, דיכאון, החטיפה.
- העתק את נתוני כותרת על גליון עבודה חדש. זה יכלול ערכים עבור גודל המסך (רוחב וגובה) ואת המרחק הצפייה. שמונה עמודות של נתונים שנאספו בקצב של 30 הרץ יעברו מתחת שפרטי הכותרת.
- לחזור גליון העבודה המכיל את הנתונים הגולמיים. לעשות "תגלית" עבור "X" מופיע בטור האחרון תחת הכותרת "מרקר" כדי לאתר שבו גירוי הוחלה עם 10 µA. מצא שכיחות של "T", מסמן את תחילת גירוי הנוכחי. העתק שורות 15 (0.5 s) של נתונים המתרחשים לפני "T" ומסגרות 90 לאחר "T" (3.0 s); כלומר, סה כ s 3.5. להדביק את הנתונים בגליון העבודה החדש מתחת שפרטי הכותרת.
- הוספת עמודה ריקה לאחר "PupilWidth". בעמודה הריקה, להמיר הממד מכוילת במ מ:
קוטר האישון אופקי = "PupilWidth" × המימד של המצלמה הצגת רוחב - להוסיף 2 עמודות ריקות לאחר "X_Gaze" וגם "Y_Gaze". לנרמל את עמדות לממדים של המסך הצפייה: קואורדינטות (0, 0) בחלק העליון השמאלי של מסך הרחבת כדי (1, 1) על הימנית התחתונה. בעמודה הריקה הראשונה, לתרגם את העמדות מערכת הקואורדינטות שיש (0, 0) במרכז המסך. כוללים את ההמרה לממדים של המסך במ מ:
X = (רוחב 0.5 ×) – (רוחב × "X_Gaze"); Y = (0.5 × גובה) – ("Y_Gaze" × גובה)
הערה: הרצף של הפעולה היא העין השמאלית. הרצף צריך להיות הפוך עבור העין הימנית לעקוב הכנסים של שליליות על החטיפה, הגישה החיובית על ההסתמכות. - בעמודות השני, השתמש פונקציות טריגונומטריה כדי להמיר זוויות (°) הסיבוב:
סיבוב אופקי = arctan (X/viewing מרחק); סיבוב אנכי = arctan (Y/viewing מרחק) - תסביב כבר מוצגת ביחידות של מעלות, אך כדי להתאים את ועידת חיוביות עבור intorsion, אם המדידה נעשית על העין השמאלית, תכפיל ב-1. עבור העין הימנית, אין כפל הוא הכרחי. התוכנית קודי סיבוב בכיוון השעון כחיובית.
- להתוות את קוטר האישון ואת סבבים כפונקציה של הזמן.
- פתח את קובץ הנתונים שנשמרו, שהוא בתבנית טקסט מופרד, לתוכנית גיליון התפשטות של בחירה כדי לארגן את הנתונים ולבצע ניתוח סטטיסטי.
תוצאות
איור 1 מציג תמונות סטילס של תמונות שנלקחו וידאו המתאר את הקרע. תמונות לספק מיקומים טיפוסיים של העצבים לפני גזירה מן המוח.
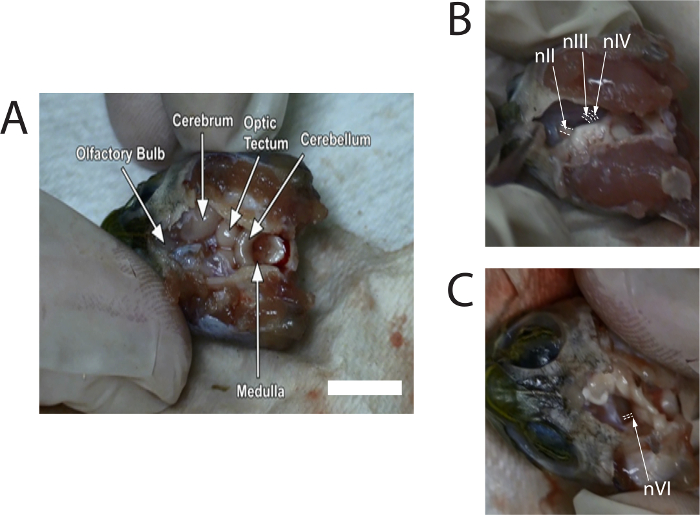
איור 1: סטילס של תמונות שנלכדו מהסרט של הקרע המקומו...
Discussion
שלבים קריטיים:
השלבים הקריטיים בתוך פרוטוקול זה הם הבאים: 1) את הקרע וטיפול לקחת כדי לשמור על הכדאיות של העצבים transected; 2) התאמת גדלים על ידי החקירה היניקה עצבי לספק תגובות עקבי; ו 3) המיקום של הראש, אצל gimbal לספק נאותים וכיול לסיבובים של העין.
פתרון בעיות:
Disclosures
המחברים אין לחשוף.
Acknowledgements
המחברים מודים מק'קנה פולט גברת ליסה Pezzino במחקר זה לתמיכה מזכירות, ואת מר פיל אורבך על תמיכה טכנית. המחברים מודים גם ד"ר מייקל אריאל ו מייקל ס ג'ונס (סנט לואיס אוניברסיטת בית הספר לרפואה) על מציגה לנו במבחנה מבודד הכנת ראש. מימון עבור תמיכה של שיתוף פעולה זה סופק על ידי המחלקה לביולוגיה (רוברט ס קרן צ'ייס), וועדת המחקר האקדמי, התוכנית Neuroscience במכללה לאפייט. לבסוף, עבודה זו מוקדשת מר פיל אוירבך, שהלך לעולמו 2016 28 בספטמבר; הוא הוצא מהשירות מיקרוסקופ אלקטרונים סריקה, זיהה את התועלת בשלב 5-ציר שלה לשימוש בפרוטוקול זה. תושיה וידידות שלו תחסר לנו מאוד
Materials
| Name | Company | Catalog Number | Comments |
| Red-eared slider turtles | Kons Scientific | Trachemys scripta elegans | Large size (carapace length 15-20 cm) |
| Sodium chloride | Sigma-Aldrich Co. LLC. | S5886 | |
| Potassium chloride | Sigma-Aldrich Co. LLC. | P5405 | |
| Magnesium choride | Sigma-Aldrich Co. LLC. | M7304 | |
| Sodium bicarbonate | Sigma-Aldrich Co. LLC. | S5761 | |
| Dextrose | Sigma-Aldrich Co. LLC. | C5767 | |
| Concentrated hydrochloric acid | Sigma-Aldrich Co. LLC. | H7020 | |
| Calcium chloride | Sigma-Aldrich Co. LLC. | C7902 | |
| pH meter | Oakton | pH 6+ | |
| Suction stimulation electrode | A-M Systems | 573000 | Bipolar suction electrode. Note that 573000 has been replaced with 573050. |
| Capillary glass | A-M systems | 626000 | Single-barrel borosilicate capillary glass without microfilament, length 10 cm, outside diameter 1.0 mm, inner diameter 0.50 mm |
| Alternative suction stimulation electrode | A-M Systems | 573050 | Bipolar suction electrode. Requires larger diameter capillary glass: 627000, outside diameter 1.2 mm, inner diameter 0.68 mm |
| Stereoscope | Lieca | GZ7 | Magnification range, 10x – 70x |
| Fiber optic light source | Amscope | HL250-A | 150W Fiber optical microscope illuminator light box |
| Rongeurs | Carolina Biological Supply Company | 625654 | stainless steel, straight spring, 5.25" |
| Blunt dissection probe | Carolina Biological Supply Company | 627405 | Huber mall probe, double-ended probe and seeker, 6" |
| Microscissors | Carolina Biological Supply Company | 623555 | Iris microdissecting scissors, stainless steel, 0.5" blades, 4.75" long |
| Fine forceps | Sigma-Aldrich Co. LLC. | F6521 | Jewelers forceps, dumont No. 5, inox alloy, 4.25" |
| Curved forceps | Sigma-Aldrich Co. LLC. | Z168696 | Medium tip, curved forceps, stainless steel, 4" |
| Scalpel handle | Sigma-Aldrich Co. LLC. | S2896 | Scalpel handles, No. 3, stainless steel |
| Scalpel blade | Sigma-Aldrich Co. LLC. | S2771 | Scalpel blades, No. 11, steel |
| Guillotine | Harvard Apparatus | 73-1918 | Kleine guillotine type 7575 |
| Spatula | Sigma | Z648299 | Micro spoon and spatula weighing set. Use small spatula: 5.9” long x 0.07” diameter handle with square end: 0.17” x 1.3” long, other end round: 0.17” x 1.27” long |
| Hook | Autozone | 98069 | SureBilt hook and pick set. Use grinder to dull sharp points of hook to prevent injury to animals mouth. |
| 95/5% O2/CO2 | Airgas, Inc. | X02OX95C2003102 | 5% Carbon dioxide balance oxygen certified standard gas mixture, size 200 Cylinder, CGA-296 |
| Regulator | Airgas, Inc. | Y11244D296-AG | Single stage brass 0-100 psi analytical cylinder regulator CGA-296 with needle outlet. Use brass adjustable airline pipe valve to go from 3/8", inner diameter, vinyl airline tubing connected to regulator to a 3/16", inner diameter, airline connection going to airstone or glass pasteur pipette. |
| Adjustable airline pipe valve | Doctors Foster and Smith | CD-12061 | Brass valve |
| Rigid table | Unknown | Unknown | Auto-clave door laid on top of a sturdy table. Nine 5" diameter tennis balls isolate vibrations from the top surface of the table. |
| 5" tennis ball | Petco Animal Supplies, Inc. | 712868 | Petco Jumbo Pet Tennis Ball: balls are unsliced and held within an integrated frame on the underside part of the autoclave door. |
| Alternative vibration isolation table | Newport Corporation | INT1-36-6-N | Rigid vibration control system, integrity 1: Surface dimensions, 3' x 6' |
| Gimbal | ISI, International Scientific Instruments, Inc. | Stage from SUPER III-A Scanning EM | 5-axis eucentric stage: X, Y, and Z linear movements, ±20 mm, 0.1 mm precision; Rotations, vertical, ±10°, and horizontal, ±12.5°, with 1.25° precision. Note: from decommission instrument. |
| Chuck for gimbal | Unknown | Unknown | Chuck from an old microtome of unknown manufacture was machined to fit the shaft of the specimen holder of the Scanning EM stage |
| Alternative gimbal | ThorLabs, Inc. | GN2/M with MBT602/M | Dual-axis goniometer (GN2/M) mounted on 3-axis microblock stage with thumbscrew adjusters (MBT602/M): design a chuck to hold turtle head with eye at 12.7 mm above top surface of goniometer (distance to point of rotation) |
| Video-based eye tracking system | Arrington Research, Inc. | ViewPoint EyeTracker, PC-60 | Tracking method: Infrared video by dark pupil; Black and white camera (Item BC02): 30 Hz, 640 x 480; System requirements: Windows 2000, XP, 7, 8, 8.1, 10; Visual range: Horizontal +/- 44°; vertical +/- 20°; Accuracy ~0.5°; Spatial resolution ~0.15°; Pupil size resolution ~0.03 mm; Eye data: X, Y position of gaze, pupil height and width, torsion, delta time, total time, and regions of interest (ROI); Real-time communication (Item 0022): 4-Channel AnalogOut with eight TTL input channels to mark codes into the data file |
| Multi-position magnetic base | Harbor Freight Tools | Pittsburg, item #5645 | Magnetic holder reaches up to 12" and produces 45 lbs. of magnetic pull. Use to position camera. Machine thread holes onto the end of the rod to mount cameras. |
| Micromanipulator | Kopf | 900 | 5 axis manipulation for mount of suction electrode: X, Y, Z linear travel, 2 axis of rotation |
| Dissection scope on boom | Lieca | GZ6 | Magnification range, 6.7x – 40x |
| Nerve/muscle stimulator | Astro-Med Grass Telefactor | Grass S88 | Dual pulse voltage stimulator: two output channels that can be operated independently or synchronized to generate non-isolated constant voltage pulses (10 mv to 150 V). Pulses can be single (10 μsec to 10 sec), repetitive (0.01 Hz to 1 KHz), and trains (1 ms to 10 s) and synchronized with TTL inputs and output. Send TTL outputs via the output channels of a DB25 connector to the TTL input channels of the ViewPoint EyeTracker. Note: Astro-Med Grass Telefactor is no longer in business. |
| Current isolation device | Astro-Med Grass Telefactor | PSIU6 | Current stimulus isolation unit: enables safe delivery of constant currents by the S88 to the preparation. The PSIU6 connects by a BNC cable to one of the output channels of the S88. Multiplier switches on the PSIU6 allow the S88 to generate a wide array of current amplitudes ranging from 0.1 µA to 15 mA. |
| Alternative nerve/muscle stimulator with isolation | A-M Systems | 2100 | Isolated Pulse Stimulator: Unit has built-in isolator to produce constant currents. |
References
- Kikillus, K. H., Hare, K. M., Hartley, S. Minimizing false-negatives when predicting the potential distribution of an invasive species: A bioclimatic envelope for the red-eared slider at global and regional scales. Anim Conserv. 13, 5-15 (2010).
- Lutz, P. L., Rosenthal, M., Sick, T. J. Living without oxygen: turtle brain as a model of anaerobic metabolism. Mol Physiol. 8, 411-425 (1985).
- Lutz, P. L., Milton, S. L. Negotiating brain anoxia survival in the turtle. J Exp Biol. 207, 3141-3147 (2004).
- Storey, K. B. Anoxia tolerance in turtles: Metabolic regulation and gene expression. Comp Biochem Physiol A-Mol Integr Physiol. 147 (2), 263-276 (2007).
- Granda, A. M., Dearworth, J. R., Subramaniam, B. Balanced interactions in ganglion-cell receptive fields. Vis Neurosci. 16, 319-332 (1999).
- Dearworth, J. R., Granda, A. M. Multiplied functions unify shapes of ganglion-cell receptive fields in retina of turtle. J Vis. 2 (3), 204-217 (2002).
- Nesbit, S. C., Van Hoof, A. G., Le, C. C., Dearworth Jr, J. R. Extracellular recording of light responses from optic nerve fibers and the caudal photoreceptor in the crayfish. J Undergrad Neurosci Educ. 14 (1), A29-A38 (2015).
- McMahon, B. R. Respiratory and circulatory compensation to hypoxia in crustaceans. Resp Phsiol. 128 (3), 349-364 (2001).
- Leigh, R. J., Zee, D. S. . The neurology of eye movements. , (1999).
- Robinson, D. A. A method of measuring eye movement using a scleral search coil in a magnetic field. IEEE Trans Biomed Eng. 10, 137-145 (1963).
- Judge, S. J., Richmond, B. J., Chu, F. C. Implantation of magnetic search coils for measurement of eye position: an improved method. Vis Res. 20, 535-538 (1980).
- Ong, J. K. Y., Halswanter, T. Measuring torsional eye movements by tracking stable iris features. J Neurosci Meth. 192, 261-267 (2010).
- Kimmel, D. L., Mammo, D., Newsome, W. T. Tracking the eye non-invasively: simultaneous comparison of the scleral search coil and optical tracking techniques in the macaque monkey. Front Behav Neurosci. 6 (49), 1-17 (2012).
- Otero-Millan, J., Roberts, D. C., Lasker, A., Zee, D. S., Kheradmand, A. Knowing what the brain is seeing in three dimensions: A novel, noninvasive, sensitive, accurate, and low-noise technique for measuring ocular torsion. J Vis. 15 (14), 1-15 (2015).
- Demski, L. S., Bauer, D. H. Eye movements evoked by electrical stimulation of the brain in anesthetized fishes. Brain Behav Evol. 11, 109-129 (1975).
- Gioanni, H., Bennis, M., Sansonetti, A. Visual and vestibular reflexes that stabilize gaze in the chameleon. Vis Neurosci. 10, 947-956 (1993).
- Straka, H., Dieringer, N. Basic organization principles of the VOR: lessons from frogs. Prog Neurobio. 73 (4), 259-309 (2004).
- Voss, J., Bischof, H. -. J. Eye movements of laterally eyed birds are not independent. J Exp Biol. 212 (10), 1568-1575 (2009).
- Ariel, M. Independent eye movements in the turtle. Vis Neurosci. 5, 29-41 (1990).
- Ariel, M., Rosenberg, A. F. Effects of synaptic drugs on turtle optokinetic nystagmus and the spike responses of the basal optic nucleus. Vis Neurosci. 7, 431-440 (1991).
- Balaban, C. D., Ariel, M. A "beat-to-beat" interval generator for optokinetic nystagmus. Biol Cybern. 66, 203-216 (1992).
- Keifer, J. In vitro eye-blink reflex model: Role of excitatory amino acid receptors and labeling of network activity with sulforhodamine. Exp Brain Res. 97, 239-253 (1993).
- Keifer, J., Armstrong, K. E., Houk, J. C. In vitro classical conditioning of abducens nerve discharge in turtles. J Neurosci. 15, 5036-5048 (1995).
- Rosenberg, A. F., Ariel, M. A model for optokinetic eye movements in turtles that incorporates properties of retinal slip neurons. Vis Neurosci. 13, 375-383 (1996).
- Ariel, M. Open-loop optokinetic responses of the turtle. Vis Res. 37, 925-933 (1997).
- Anderson, C. W., Keifer, J. Properties of conditioned abducens nerve responses in a highly reduced in vitro brainstem preparation from the turtle. J Neurophysiol. 81, 1242-1250 (1999).
- Keifer, J. In vitro classical conditioning of the turtle eyeblink reflex: Approaching cellular mechanisms of acquisition. Cerebell. 2, 55-61 (2003).
- Zhu, D., Keifer, J. Pathways controlling trigeminal and auditory nerve-evoked abducens eyeblink reflexes in pond turtles. Brain Behav Evol. 64, 207-222 (2004).
- Jones, M. S., Ariel, M. The effects of unilateral eighth nerve block on fictive VOR in the turtle. Br Res. 1094, 149-162 (2006).
- Jones, M. S., Ariel, M. Morphology, intrinsic membrane properties, and rotation-evoked responses of trochlear motoneurons in the turtle. J Neurophysiol. 99 (3), 1187-1200 (2008).
- Krenz, J. G., Naylor, G. J. P., Shaffer, H. B., Janzen, F. J. Molecular phylogenetics and evolution of turtles. Mol Phylogenet Evol. 37 (1), 178-191 (2005).
- Dearworth, J. R., et al. Role of the trochlear nerve in eye abduction and frontal vision of the red-eared slider turtle (Trachemys scripta elegans). J Comp Neur. 52, 3464-3477 (2013).
- Dearworth, J. R., et al. Pupil constriction evoked in vitro by stimulation of the oculomotor nerve in the turtle (Trachemys scripta elegans). Vis Neurosci. 26, 309-318 (2009).
- Mead, K., et al. IFEL TOUR: a description of the introduction to FUN electrophysiology labs workshop at Bowdoin College, July 27-30, and the resultant faculty learning community. J Undergrad Neurosci Educ. 5, A42-A48 (2007).
- Jackson, D. C., Ultsch, G. R. Physiology of hibernation under the ice by turtles and frogs. J Exp Zool A Ecol Genet Physiol. 313 (6), 311-327 (2010).
- Romano, J. M., Dearworth, J. R. Pupil constriction evoked by stimulation of the ciliary nerve in the red-eared slider turtle (Trachemys scripta elegans). J Penns Acad Sci. 85, 4-8 (2011).
- Miller, J. M., Robins, D. Extraocular-muscle forces in alert monkey. Vis Res. 32, 1099-1113 (1992).
- Gamlin, P. D., Miller, J. M. Extraocular muscle motor units characterized by spike-triggered averaging in alert monkey. J Neurosci Meth. 204, 159-167 (2011).
- Quaia, C., Ying, H. S., Optican, L. M. The Viscoelastic properties of passive eye muscle in primates. III: Force elicited by natural elongations. PLOS ONE. 5, A236-A254 (2010).
- Anderson, S. R., et al. Dynamics of primate oculomotor plant revealed by effects of abducens microstimulation. J Neurophys. 101, 2907-2923 (2009).
- Maxwell, J. H., Harless, M., Morlock, H. Anesthesia and surgery. Turtles: Perspective and Research. , 127-152 (1979).
- AVMA Panel on Euthanasia. American Veterinary Medical Association. J Am Vet Med Assoc. 218 (5), 669-696 (2001).
- Clarke, R. J. Shaping the pupil's response to light in the hooded rat. Exp Br Res. 176, 641-651 (2007).
- Bennett, R. A. A review of anesthesia and chemical restraint in reptiles. J Zoo Wild Med. 22 (3), 282-303 (1991).
- Bickler, P. E., Buck, L. T. Hypoxia Tolerance in Reptiles, Amphibians, and Fishes: Life with Variable Oxygen Availability. Ann Rev Physiol. 69, 145-170 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved