このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
カメの中で脳神経のIn Vitro刺激を用いて眼球運動
要約
このプロトコルでは、目の動きの運動を測定するため体外に分離されたカメ頭の準備を使用する方法について説明します。頭蓋から脳を除去した後回転目と瞳孔径の変化を定量化する電流脳神経を刺激することができます。
要約
動物を安楽死させた後死ぬこと彼らの組織を始めます。温血脊椎動物と比べると、カメは彼らの組織の長期生存時間のため利点を提供しています。このため、彼らのターゲットの行動の神経信号を調査する時間の延長期間のカメでの in vitro実験を実行できます。分離ヘッド準備を使用して、カメ、眼球運動の運動を測定したし、脳神経によって運ばれる電気信号によって彼らの変調。脳が頭蓋骨から削除されたり、脳神経のインスタンスはそのままにして、この切り裂かれた頭は眼球運動を調整するジンバルに置かれました。ガラス電極は、脳神経に接続されていた (眼球運動, 滑車神経, と外転)、眼球運動を喚起する電流で刺激。赤外線ビデオ システムと目の定量化された回転を追跡眼球運動を監視しました。電流パルス振幅、周波数の範囲と、電車の時間が応答に及ぼす影響を観察するために使用されました。準備は脳から切り離されているため筋ターゲットに遠心性経路を一元的に処理された感覚情報の欠如の神経シグナリングを調査する単独で調べることができます。
概要
電気生理学的実験ではミシシッピアカミミガメ カメを使用するための理論的根拠:
ミシシッピアカミミガメ カメ (Trachemys scripta elegans) の世界の最悪の侵略的な種の1つと考えられ、生態系が困っていることを示すことができます。ミシシッピアカミミガメ カメが成功した理由はよくわかっていないが、その耐性の生理と低酸素の条件2,3,4 の下で生き残ることができる神経組織の所有物のための一部ことがあります。.実験は自分の番号を脅かすことはない、最小限の努力、電気生理学的製剤残ることができる実行可能な拡張の期間、18 時間5,6限り上を使用します。メリットは、これも酸素8の低レベルに耐える能力を持っているザリガニ7など無脊椎動物の動物を使用する利点に似ています。
眼球運動の測定方法:
ヒト以外の霊長類を用いた前頭葉目動物の眼球運動を測定する方法は、よく発達した9をされています。3 軸軌道回転目: 水平方向、垂直方向、およびねじり。磁気サーチコイル法は一般的に測定の回転の最も信頼性の高いと見なされますが、動物10,11scleras に挿入される小さなコイルを必要とする侵襲的です。ビデオ ベースのシステムは、回転を測定し、非侵襲的であることの利点を持っていることができます。革新的な画像処理と一緒により良いカメラの開発、拡張、機能12,13,14を考慮する魅力的な代替ビデオ ベースのシステムを作るします。
Nonmammals 中の眼球運動を測定するための技術は大いにより少なく重要なされています。対策は、いずれか低解像度または回転15,16,17,18の一部のみを記述します。開発の欠如は、部分的に視標に従う訓練 nonmammals の難しさのせいにできます。眼球運動はミシシッピアカミミガメ カメ19,20,21,22,23,24,25 でよく研究されているが、26,27,28,29,30、ターゲットを追跡する訓練動物の挑戦のための眼球運動の正確な運動が不十分で理解しました。
ミシシッピアカミミガメのカメでは、脊椎動物の外側眼が考えられているが、甲による横方向の視野の重要な咬合が32を発生します彼らのシェル31に頭完全に撤回することができます、ため。結果は視覚的視界正面目の哺乳類のように動作し、正面に向かってならないこと。したがって、眼球運動を測定するためのアプローチを開発するためのモデルとして使用する際は、独自の進化論的視点を提供しています。
この作品で説明されているプロトコルは、ミシシッピアカミミガメ カメにおける眼球運動の運動学を識別するために培養で分離されたヘッド準備を使用します。脳は脳神経をそのまま頭蓋骨から解剖しました。頭は、目の筋肉を支配する脳神経の電気刺激による眼球運動を調整し、応答を換起するジンバルに配置されます。目の回転の措置は、暗い瞳孔と虹彩のマーキングを追跡、ソフトウェア アルゴリズムを使ってビデオ ベースのシステムによって行われます。(すなわち、水平方向、垂直方向、およびねじり回転) 両方の眼の運動を測定する機会を提供する、32と眼内 (すなわち瞳孔の変化)33動き。
遠心性神経経路の解析のモデル システム:
一般的に、どのように遠心性の神経信号を勉強する機会眼球運動を生成は、筋肉がリラックスした状態から開始脳32、によって処理される統合された感覚情報のない状態で捜査官を提供するアプローチ 33。したがって、のみ残して脳と筋肉に synapsing 遠心性の神経線維によって処理される、モデル系で目の運動を調べることができます。
プロトコル
注: ミシシッピアカミミガメ カメ、両方の男性と女性は、ベンダーから購入しました。カメは、250 W の赤外線ライトの下で日光浴のためレンガ諸島装備 2 つの 60 ガロン浴槽を含む暖かい動物スイートで収容されました。環境は 22 ° C で水の温度を 14/10-h 明暗サイクルで維持されていましたライトは、6:00 時にオンにされ、オフに 20:00。毎週、きれいになったフィルタ リング システム搭載タンク、カメは一日おき、自由を与えられました。ミシシッピアカミミガメのカメし、次の実験手順説明ここで32,33のすべてが施設動物ケアおよび使用委員会 (IACUC) ラファイエット大学によって承認されました。
1. 機器のセットアップ
- 亀リンゲル液を準備します。この順序で蒸留水に以下を追加します: 塩化ナトリウム 96.5 mM (58.44 g/mol)、塩化カリウム 2.6 mM (74.56 g/mol)、塩化マグネシウム 2.0 mM (203.31 g/mol)、重炭酸ナトリウム 31.5 mM (84.01 g/mol)、ブドウ糖 20.0 mM (180.16 g/mol)、集中7.51、塩化カルシウム 4.0 mM (110.98 g/mol) と pH 調整に塩酸 (材料の表を参照してください)。それぞれの塩を追加するとき、ソリューションをミックスします。
注意: 濃塩酸は危険 (皮膚、目、吸入、摂取の危険) です。 - 5 cm 長い毛細血管から吸引電極のためのヒントを確認 (材料の表を参照)、径内径の異なる火災研磨によるさまざまな厚さの脳神経に対応するためにガラスします。
- 小さなファイルを使用すると、毛細血管のガラスの部分にラインをエッチングします。ティッシュ ペーパーに置き、半分に分割します。
- ゆっくりとブンゼン バーナーの炎に毛細管ガラスの両端のいずれかをロールバックします。急性大動脈解離を用いた対称性、滑らかさ、サイズのためのヒントを定期的に調べる範囲と光ファイバー光ファイバー ソース (材料の表を参照してください)。
注: 頭幅の 20 そして 30 の mm 間でカメをとる最適な継手内径サイズ通常範囲 0.4 から動眼神経 (nIII) 0.8 mm 滑車神経節 (nIV) 0.3 〜 0.6 ミリメートルと外転神経 (nVI) の 0.2 から 0.4 mm です。
- 清潔で、解剖用ブレード (材料の表を参照) を Rongeurs、鈍的切離プローブ、刀、微細鉗子、カーブタイプ鉗子、メス ハンドルを整理します。
注: 器具の消毒はオプションです。
2. 麻酔および安楽死
- 氷亀の場所 cryoanesthetize に 60 分間、バケツです。
- 小さな動物のギロチンを使用して斬首でカメを安楽死させる (材料の表を参照してください)。
- 小さいヘラを使って計量動物オープンの顎をバックカバーからフックを挿入して上顎の先端下に収まるようにできるように。
- ギロチンによって動物の頭を拡張する一定の力で引っ張る。迅速、動物の首をはねます。
- 解剖皿に亀の頭を配置します。ティッシュに水を引くために手に十分なカメ リンガーのソリューションを持っています。95/5 O2/CO2ソリューションを oxygenize (材料の表を参照してください)。
- 氷皿の外側のまわりに配置することによって 4 ° C で組織を維持します。
3. 郭清
- 郭清を行う光ファイバー光源を郭清範囲を使用します。
- 下顎を削除します。頭の取り扱いを簡単を提供するために口から鈍的切離プローブを配置します。メスの頭蓋骨に歯の骨を接続するジョイントをカットします。Rongeurs を使用して、頭蓋から下顎をプルします。頭蓋外側および背側領域で皮膚やその添付ファイルから筋肉をやってのける rongeurs を使用します。
- 脊柱を削除します。
- 頭蓋の尾側端で脊柱を識別します。腹側脊髄を公開する脊柱を曲げます。脊髄を切るように刀を使用します。尾を引いて、頭蓋から脊柱および他の組織を削除するのにには、rongeurs を使用します。
- 脳の神経を切断した後、頭蓋から脳を削除します。
- 後頭から、rongeurs を使って背の頭蓋の 2 つの切開をカットします。下に脳の損傷を避けるために表面的な切口を作る。
- Rongeurs を使用して、背側の頭蓋骨を慎重に引き出します。刀を使って、脳の残りの部分を公開する髄膜を外します。前方の頭蓋腔で、嗅球を識別できるまで十分な髄膜を削除 (図 1A参照)。亀リンゲル液で、必要に応じて脳を灌漑し続けます。
- カーブタイプ鉗子を使用して優しく大脳を尾側に引っ張る、脳神経にわずかな緊張を生成します。慎重に切り取る、カーブタイプ鉗子と嗅球と大脳を取り外します。
- 脳神経; を公開するのに正中線に向かって中脳を優しくプッシュするのに刀を使用します。nIII、約 0.6 mm、わたし、目の前で見ることができるし、わたしの直径は nIII より若干少なくなります。カット nIII ・ nIV 中脳に接続する (図 1B参照)。反対側にこの手順を繰り返します。
- 刀で左と右視神経 (nII) をカットします。それから 1 つの側面に脳幹を傾けなさい。NVI の橋と延髄の接合部付近の腹面から新興の観察 (図 1を参照)。nVI の直径が小さいと約 0.3 mm。 両方 nVI の左と右をカットします。
- 微細鉗子と刀亀から脳幹の残りの部分を削除します。頭蓋が空、頭蓋腔の床を調べる。NIII、わたし、nVI を識別します。
- 微細鉗子と刀の上限と下限の眼蓋を取り外します。
4. 眼球運動の校正
- リジッド テーブルを使用 (材料表を参照)、ジンバルと他の楽器の配置をサポートします。頭の背側表面が頭蓋骨全体で休んで小さなバブルのレベルを使用して地平線に平行してジンバル チャックに亀の頭を配置します。大体のジンバルの水平および垂直方向の回転の中心に 1 つ目を配置します。
- 赤外線カメラ、赤外線発光ダイオード (LED)、ビデオベースの目追跡システムの一部である装備を配置 (材料の表を参照)、亀の目から約 12 cm の視距離で。
- カメラ目の視線上に 45 度の角度します。LED は、ときにカメラのレンズを見て 11 位置する必要があります。目の光軸に沿って LED をセンターします。カメラになります (目の上から見て)、軸を少し。
- カメラ ビューは眼球で最大限に塗りつぶされますので目からカメラまでの距離を調整します。水平視野の端目 (canthi) の角が確実します。
- データを処理する追尾ビデオベースの目にカメラを接続します。生のビデオをキャプチャする DVD レコーダーに信号を分割します。目の明確な画像を取得するカメラを焦点します。罰金 - ジンバル付属線形調整 (x、y、z) の 3 度を使用してカメラ ビューの中心に目の位置に注意してください。
- 暗い瞳を検出するには、しきい値とコントラスト ビデオベースの目追跡システムに付属のプログラムを使用して適切に設定。
- マウスを使用して、「ビデオ」メニューをクリックし、[「モード」サンプリング レート 30 Hz (640 ピクセル x 480 ラインの解像度) の画像をキャプチャする「高精度」を選択します。「ビデオ」の下で、「生型」と「楕円 (回転楕円)」のその「瞳分割法」の"暗い瞳孔」を選択します。
- 「アイカメラ」ウィンドウで「生徒検索エリア調整」アイコン (小さなドット中心で垂直四角形) をクリックします。瞳の周囲の領域を制限する四角形をドラッグするマウスを使用します。瞳孔と混同される可能性の暗い部分を避けます。
- 「コントロール」ウィンドウで「自動イメージ」と「肯定的なロックしきい値の追跡」のボックスをチェックすることを確認します。「自動-しきい値」スキャンの密度を最適化するために暗い瞳を緑のドットとして表示されますをクリックします。
- その水平軸と垂直軸の周り (+/-) 10 °、ジンバル (+/-) 12.5 ° の回転を追跡プログラム ビデオ ベースの目のビデオ ディスプレイを調整します。
- 「コントロール」ウィンドウの「表示」をクリックします。「注視点」、「Calib 地域」、および"ジオメトリ グリッド"の"視線"と"スティミュラス"下にあるボックスを確認します。「ジオメトリ グリッド」の下にあるボックスをチェックした後、ウィンドウがポップアップし、言う、「ジオメトリ グリッドを表示することができます前にジオメトリを表示する刺激が測定する必要があります。か? 今やる」[はい] に"Y"を選択します。
- マウスを使用して、「ウィンドウ」メニューをクリックしてし、「刺激」を選択します。「刺激」ウィンドウが開き、ディスプレイの中央に垂直と水平の線の交差を表示します。「刺激」ウィンドウを閉じますキーボード上に最も近いミリメートル。「esc キー」を押します、その線長さを測定します。
- マウスを使用して、「刺激」メニューをクリックし、「ジオメトリ設定」を選択します。だけを測定した線の長さを入力します。度/ライン等しい横の線と縦の線の 20 ° 25 ° 視距離を調整します。「ストア」ボタンをクリックし、ウィンドウを閉じます。
- 「EyeSpace」ウィンドウで校正「9」をする「データ ポイント」の数を選択します。亀の目で中心に位置、センターのデータをポイントし、「再表示」ボタンをクリックしてをクリックしてします。
注: は、「刺激」ウィンドウが開きと「準備」は、画面の中央に表示されます。ボックスがセンターの場所で表示され、消えます。その消失の「刺激」ウィンドウが閉じます。センター位置を校正今する必要があります。 - +12.5 °/-12.50 °、右/左、ジンバルを回転させることにより、アップ/ダウン +10 °/-10 ° 残りのデータ ポイントを調整する手順を繰り返します。
- ねじり回転の調整、フィッティング ・ アルゴリズム ビデオベースの目追跡プログラムで提供されているテンプレートを使用します。アルゴリズムは虹彩のマーキングに基づくゼロ位置を設定し、マーキングは、瞳孔の中心からオフセットになるときの回転角度を計算します。
- マウス ポインターを使用して、「ウィンドウ」メニューをクリックしてし、「ねじり」を選択します。「ねじり」ウィンドウの「スタート」ボタンをクリックします。「アイカメラ」ウィンドウで円弧が目のイメージの上表示されます。
- 半径、角度、および不規則なマーキングがアイリスの存在位置にスライダーを使用して円弧の長さを調整します。「リアルタイム グラフィックス」と「自動設定後の調整」のボックスを確認します。必要に応じて、明るさを調整、コントラスト コントロール ウィンドウと日時しきい値の暗い瞳 (手順 4 を参照)。「テンプレートの設定」ボタンををクリックしてします。
- 生徒と同じ焦点面に定規を置き、フル カメラ ビューの幅を記録します。値は、生の実際の幅を決定する後で使用されます。
5. 脳神経眼球運動を呼び起こすために吸引電極の位置決め
- 慎重に頭に残り、結合や筋肉の組織にピン参照電極を配置します。
- 吸引電極を配置 (材料表参照) 脳神経のマイクロマニピュレーターと郭清範囲を使用してブームにマウントされています。ファイバー光ファイバー光源を使用して、表示および配置をガイドします。
- 毛細管ガラス先端に神経のサイズに一致します。試行錯誤径神経の周りのベスト フィットを取得する必要がある (手順 1.2 サイズの推奨事項を参照してください)。吸引電極上にガラスの先端を配置します。リンゲル液で吸引電極を埋めるし、約シリンジ内で音量を調整するその能力の半分。
- 慎重に選択した神経のカット ・ エンド上の位置にマニピュレーターを用いた電極のガラス先端に移動します。リンゲル液が頭蓋を塗りつぶしますその表面の下に先端があることを確認します。必要な場合は、頭蓋から、リンゲル液の漏れる場所場所をダムにモデリング粘土を使用します。
- 注射器のピストンを引いてください。
注: 真空はキャピラリー先端末に神経を描画します。良いフィットは、ほとんど、あるいはまったく追加真空適用先端の内に残る神経によって示されます。
6. 刺激脳神経と眼球運動の分析
- 現在の免震装置と汎用神経/筋肉刺激装置を使用して (材料の表を参照) 吸引電極を介して脳神経を刺激します。
- 吸引電極をケーブルを使用して現在の免震装置に接続します。免震装置のアース接続するピン参照電極からリードを接続します。
- ダイヤルを使用して電流のパラメーターの選択と刺激装置と分離デバイスにスイッチします。周波数は 400 hz 使用 1 または 2 ms パルス列車 100、500、または 1,000 ms 持続 10 1 から 100 μ A の電流の範囲を使用します。
- 刺激のタイミングを記録します。
注: トランジスタ-トランジスタ ロジック (TTL) パルス電流の刺激からの配達と同期しているし、の通信ビデオ ベースの目追跡システムの入力チャンネルをケーブル経由でリアルタイム。ソフトウェア モジュールは、通信プログラム コントロールの追跡ビデオベースの目で提供。- 現在のアプリケーションと眼球運動への影響のタイミングを視覚化し、"PenPlots"メニューをクリックします。選択「X 視線位置」、「Y 視線位置」、「ねじり」と「生徒幅」X と Y 目の位置、ねじり、および瞳孔幅のリアルタイムの生データのプロットを表示します。また 1 秒間隔で表示される目盛とタイミングのプロットを表示する"PenPlots"メニューから「秒 & マーカー」を選択します。
注: 大文字の"T"が現在のアプリケーションで同時に発生している TTL パルスの始まりをマーク表示されます。 - 電流によって眼球運動のデータを保存するには、「ファイル」メニューをクリックしてし"データ"の下で"新しいデータ ファイル"を選択します。ファイル名を入力し、「Enter」キーを押します。保存データは、一時停止することができますして、"Ctrl"+"p"キーのコマンドの組み合わせを使用してを再開します。実験的セッションが完了したら、「データ」の下の「ファイル」メニューから「データ ファイルを閉じる」を選択します。
- 適用電流の種類を追跡できるようにするため「窓」メニューをクリックしてし「パッドのデータ」を選択します。「キーパッド/DataMarker」ウィンドウが表示されます。手紙や神経に配信される現在の刺激のパラメーターを識別するための番号をクリックします。
メモ: たとえば、"X"は我慢 10 μ A の"X"をクリックするは投稿するアドホック分析のためリアルタイムでデータ ファイルへの参入を格納します。それは、「秒 & マーカー」継続的な観察ための「PenPlot」にも表示されます。
- 現在のアプリケーションと眼球運動への影響のタイミングを視覚化し、"PenPlots"メニューをクリックします。選択「X 視線位置」、「Y 視線位置」、「ねじり」と「生徒幅」X と Y 目の位置、ねじり、および瞳孔幅のリアルタイムの生データのプロットを表示します。また 1 秒間隔で表示される目盛とタイミングのプロットを表示する"PenPlots"メニューから「秒 & マーカー」を選択します。
- 目の追跡者システムからのデータを分析します。
- データを整理し、統計的分析を実施する選択のスプレッド シート プログラムにテキスト区切り形式で、保存されているデータ ファイルを開きます。
- Mm での実質のサイズにファイルに格納されている生徒の幅の値を変換します。
- X の値を変換し、Y 目の位置と程度の単位にねじり、目の動きを記述するため規則を使用そのため、回転の正の方向: 内方捻転、昇格、および内転。回転の方向を負: ゆすり、うつ病と拉致。
- 新しいワークシートにヘッダー情報をコピーします。(幅と高さ)、画面サイズと視聴距離の値が含まれます。ヘッダー情報の下 30 Hz のレートで収集されたデータの 8 つの列が続きます。
- 生データを含むワークシートに戻ります。タイトルの"T"は、現在の刺激の始まりの検索率を 10 μ A で刺激を行ったを検索する「マーカー」最後の列の"X"の"検索"を行います。15 行のコピー (0.5 s)"T"と 90 フレームの前に"T"の後に発生するデータの (3.0 s);すなわち、3.5 の s の合計。ヘッダー情報の下の新しいワークシートにデータを貼り付けます。
- "PupilWidth"の後に、空白列を挿入します。空白の列、mm で校正のディメンションに変換します。
水平瞳孔径 ="PupilWidth"× カメラ ビューの幅の寸法 - "X_Gaze"と"Y_Gaze"の後 2 の空白列を挿入します。表示画面の大きさに位置を正規化: 画面までの左上の座標 (0, 0) (1, 1) 右下にあります。最初の空白列で変換座標系を有する位置 (0, 0)、画面の中心に。Mm の画面寸法に変換を含めます。
X = (0.5 × 幅)-("X_Gaze"× 幅);Y = (0.5 × 高さ)-("Y_Gaze"× 高さ)
注: 操作のシーケンスは、左目用です。シーケンスは、拉致の消極性と内転陽性の条約に従うために右目に逆にする必要があります。 - 2 番目の列で、回転の角度 (°) に変換する三角関数を使用します。
水平方向の回転 = arctan (X/viewing 距離); 垂直回転 = arctan (Y/viewing 距離) - ねじりが既に、度単位で表示されますが、左目の測定が行われる場合、内方捻転、陽性の規約に従う、-1 を掛けます。右目の乗算する必要はありません。プログラム コードを正の値として時計回りに回転。
- 瞳孔径と回転を時間の関数としてプロットします。
- データを整理し、統計的分析を実施する選択のスプレッド シート プログラムにテキスト区切り形式で、保存されているデータ ファイルを開きます。
結果
図 1は、解剖を説明するビデオから撮影した画像の静止画を示しています。画像は、前に切断し、脳からの神経の代表的な場所を提供します。
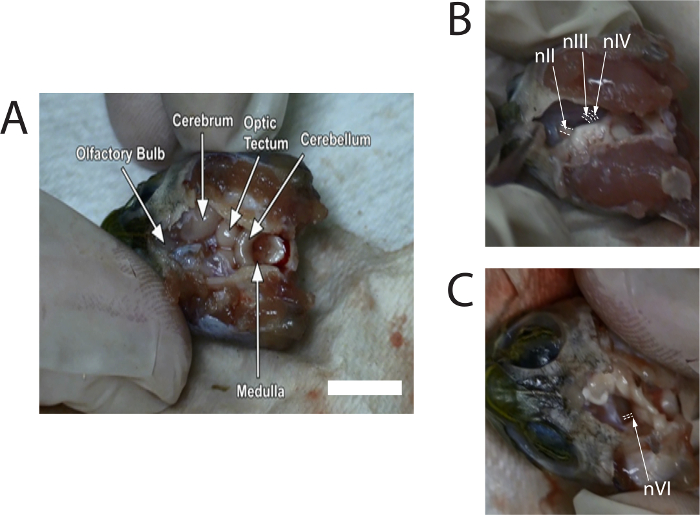
図 1: 解剖のビデオからキャプチャしたイメージの (nII) 視神経、動眼神経 (nIII)、滑車神?...
ディスカッション
重要なステップ:
このプロトコルの中で重要な手順次のとおりです: 1) 解剖および切断の神経の生存を維持するために取られる心配2) 一貫した応答を提供するために脳神経に吸引電極によるサイズのマッチング・ 3) の目の回転の適切な校正を提供するジンバル ヘッドの配置。
トラブルシューティング。
解剖は、挑戦することができ?...
開示事項
著者が明らかに何もありません。
謝辞
著者は、夫人ポーレット ・ マッケナと秘書のサポート、この研究ではリサ Pezzino 氏フィル アウエルバッハをテクニカル サポートありがちましょう。著者も培養で分離されたヘッド準備にご紹介夫妻マイケル アリエルとマイケル ・ s ・ ジョーンズ (セントルイス大学医学部) に感謝します。この共同作業のサポートのための資金は、ラファイエット大学で神経科学プログラム、学術研究委員会生物学科 (ロバート ・ s. チェイス基金) によって提供されました。最後に、この作品は 2016 年 9 月 28 日に亡くなった氏フィル アウエルバッハに捧げられて彼は走査型電子顕微鏡を使用停止し、このプロトコルで使用するため、5 軸ステージの有用性を認識しました。彼の友情と機知を大幅に惜しまれるでしょう。
資料
| Name | Company | Catalog Number | Comments |
| Red-eared slider turtles | Kons Scientific | Trachemys scripta elegans | Large size (carapace length 15-20 cm) |
| Sodium chloride | Sigma-Aldrich Co. LLC. | S5886 | |
| Potassium chloride | Sigma-Aldrich Co. LLC. | P5405 | |
| Magnesium choride | Sigma-Aldrich Co. LLC. | M7304 | |
| Sodium bicarbonate | Sigma-Aldrich Co. LLC. | S5761 | |
| Dextrose | Sigma-Aldrich Co. LLC. | C5767 | |
| Concentrated hydrochloric acid | Sigma-Aldrich Co. LLC. | H7020 | |
| Calcium chloride | Sigma-Aldrich Co. LLC. | C7902 | |
| pH meter | Oakton | pH 6+ | |
| Suction stimulation electrode | A-M Systems | 573000 | Bipolar suction electrode. Note that 573000 has been replaced with 573050. |
| Capillary glass | A-M systems | 626000 | Single-barrel borosilicate capillary glass without microfilament, length 10 cm, outside diameter 1.0 mm, inner diameter 0.50 mm |
| Alternative suction stimulation electrode | A-M Systems | 573050 | Bipolar suction electrode. Requires larger diameter capillary glass: 627000, outside diameter 1.2 mm, inner diameter 0.68 mm |
| Stereoscope | Lieca | GZ7 | Magnification range, 10x – 70x |
| Fiber optic light source | Amscope | HL250-A | 150W Fiber optical microscope illuminator light box |
| Rongeurs | Carolina Biological Supply Company | 625654 | stainless steel, straight spring, 5.25" |
| Blunt dissection probe | Carolina Biological Supply Company | 627405 | Huber mall probe, double-ended probe and seeker, 6" |
| Microscissors | Carolina Biological Supply Company | 623555 | Iris microdissecting scissors, stainless steel, 0.5" blades, 4.75" long |
| Fine forceps | Sigma-Aldrich Co. LLC. | F6521 | Jewelers forceps, dumont No. 5, inox alloy, 4.25" |
| Curved forceps | Sigma-Aldrich Co. LLC. | Z168696 | Medium tip, curved forceps, stainless steel, 4" |
| Scalpel handle | Sigma-Aldrich Co. LLC. | S2896 | Scalpel handles, No. 3, stainless steel |
| Scalpel blade | Sigma-Aldrich Co. LLC. | S2771 | Scalpel blades, No. 11, steel |
| Guillotine | Harvard Apparatus | 73-1918 | Kleine guillotine type 7575 |
| Spatula | Sigma | Z648299 | Micro spoon and spatula weighing set. Use small spatula: 5.9” long x 0.07” diameter handle with square end: 0.17” x 1.3” long, other end round: 0.17” x 1.27” long |
| Hook | Autozone | 98069 | SureBilt hook and pick set. Use grinder to dull sharp points of hook to prevent injury to animals mouth. |
| 95/5% O2/CO2 | Airgas, Inc. | X02OX95C2003102 | 5% Carbon dioxide balance oxygen certified standard gas mixture, size 200 Cylinder, CGA-296 |
| Regulator | Airgas, Inc. | Y11244D296-AG | Single stage brass 0-100 psi analytical cylinder regulator CGA-296 with needle outlet. Use brass adjustable airline pipe valve to go from 3/8", inner diameter, vinyl airline tubing connected to regulator to a 3/16", inner diameter, airline connection going to airstone or glass pasteur pipette. |
| Adjustable airline pipe valve | Doctors Foster and Smith | CD-12061 | Brass valve |
| Rigid table | Unknown | Unknown | Auto-clave door laid on top of a sturdy table. Nine 5" diameter tennis balls isolate vibrations from the top surface of the table. |
| 5" tennis ball | Petco Animal Supplies, Inc. | 712868 | Petco Jumbo Pet Tennis Ball: balls are unsliced and held within an integrated frame on the underside part of the autoclave door. |
| Alternative vibration isolation table | Newport Corporation | INT1-36-6-N | Rigid vibration control system, integrity 1: Surface dimensions, 3' x 6' |
| Gimbal | ISI, International Scientific Instruments, Inc. | Stage from SUPER III-A Scanning EM | 5-axis eucentric stage: X, Y, and Z linear movements, ±20 mm, 0.1 mm precision; Rotations, vertical, ±10°, and horizontal, ±12.5°, with 1.25° precision. Note: from decommission instrument. |
| Chuck for gimbal | Unknown | Unknown | Chuck from an old microtome of unknown manufacture was machined to fit the shaft of the specimen holder of the Scanning EM stage |
| Alternative gimbal | ThorLabs, Inc. | GN2/M with MBT602/M | Dual-axis goniometer (GN2/M) mounted on 3-axis microblock stage with thumbscrew adjusters (MBT602/M): design a chuck to hold turtle head with eye at 12.7 mm above top surface of goniometer (distance to point of rotation) |
| Video-based eye tracking system | Arrington Research, Inc. | ViewPoint EyeTracker, PC-60 | Tracking method: Infrared video by dark pupil; Black and white camera (Item BC02): 30 Hz, 640 x 480; System requirements: Windows 2000, XP, 7, 8, 8.1, 10; Visual range: Horizontal +/- 44°; vertical +/- 20°; Accuracy ~0.5°; Spatial resolution ~0.15°; Pupil size resolution ~0.03 mm; Eye data: X, Y position of gaze, pupil height and width, torsion, delta time, total time, and regions of interest (ROI); Real-time communication (Item 0022): 4-Channel AnalogOut with eight TTL input channels to mark codes into the data file |
| Multi-position magnetic base | Harbor Freight Tools | Pittsburg, item #5645 | Magnetic holder reaches up to 12" and produces 45 lbs. of magnetic pull. Use to position camera. Machine thread holes onto the end of the rod to mount cameras. |
| Micromanipulator | Kopf | 900 | 5 axis manipulation for mount of suction electrode: X, Y, Z linear travel, 2 axis of rotation |
| Dissection scope on boom | Lieca | GZ6 | Magnification range, 6.7x – 40x |
| Nerve/muscle stimulator | Astro-Med Grass Telefactor | Grass S88 | Dual pulse voltage stimulator: two output channels that can be operated independently or synchronized to generate non-isolated constant voltage pulses (10 mv to 150 V). Pulses can be single (10 μsec to 10 sec), repetitive (0.01 Hz to 1 KHz), and trains (1 ms to 10 s) and synchronized with TTL inputs and output. Send TTL outputs via the output channels of a DB25 connector to the TTL input channels of the ViewPoint EyeTracker. Note: Astro-Med Grass Telefactor is no longer in business. |
| Current isolation device | Astro-Med Grass Telefactor | PSIU6 | Current stimulus isolation unit: enables safe delivery of constant currents by the S88 to the preparation. The PSIU6 connects by a BNC cable to one of the output channels of the S88. Multiplier switches on the PSIU6 allow the S88 to generate a wide array of current amplitudes ranging from 0.1 µA to 15 mA. |
| Alternative nerve/muscle stimulator with isolation | A-M Systems | 2100 | Isolated Pulse Stimulator: Unit has built-in isolator to produce constant currents. |
参考文献
- Kikillus, K. H., Hare, K. M., Hartley, S. Minimizing false-negatives when predicting the potential distribution of an invasive species: A bioclimatic envelope for the red-eared slider at global and regional scales. Anim Conserv. 13, 5-15 (2010).
- Lutz, P. L., Rosenthal, M., Sick, T. J. Living without oxygen: turtle brain as a model of anaerobic metabolism. Mol Physiol. 8, 411-425 (1985).
- Lutz, P. L., Milton, S. L. Negotiating brain anoxia survival in the turtle. J Exp Biol. 207, 3141-3147 (2004).
- Storey, K. B. Anoxia tolerance in turtles: Metabolic regulation and gene expression. Comp Biochem Physiol A-Mol Integr Physiol. 147 (2), 263-276 (2007).
- Granda, A. M., Dearworth, J. R., Subramaniam, B. Balanced interactions in ganglion-cell receptive fields. Vis Neurosci. 16, 319-332 (1999).
- Dearworth, J. R., Granda, A. M. Multiplied functions unify shapes of ganglion-cell receptive fields in retina of turtle. J Vis. 2 (3), 204-217 (2002).
- Nesbit, S. C., Van Hoof, A. G., Le, C. C., Dearworth Jr, J. R. Extracellular recording of light responses from optic nerve fibers and the caudal photoreceptor in the crayfish. J Undergrad Neurosci Educ. 14 (1), A29-A38 (2015).
- McMahon, B. R. Respiratory and circulatory compensation to hypoxia in crustaceans. Resp Phsiol. 128 (3), 349-364 (2001).
- Leigh, R. J., Zee, D. S. . The neurology of eye movements. , (1999).
- Robinson, D. A. A method of measuring eye movement using a scleral search coil in a magnetic field. IEEE Trans Biomed Eng. 10, 137-145 (1963).
- Judge, S. J., Richmond, B. J., Chu, F. C. Implantation of magnetic search coils for measurement of eye position: an improved method. Vis Res. 20, 535-538 (1980).
- Ong, J. K. Y., Halswanter, T. Measuring torsional eye movements by tracking stable iris features. J Neurosci Meth. 192, 261-267 (2010).
- Kimmel, D. L., Mammo, D., Newsome, W. T. Tracking the eye non-invasively: simultaneous comparison of the scleral search coil and optical tracking techniques in the macaque monkey. Front Behav Neurosci. 6 (49), 1-17 (2012).
- Otero-Millan, J., Roberts, D. C., Lasker, A., Zee, D. S., Kheradmand, A. Knowing what the brain is seeing in three dimensions: A novel, noninvasive, sensitive, accurate, and low-noise technique for measuring ocular torsion. J Vis. 15 (14), 1-15 (2015).
- Demski, L. S., Bauer, D. H. Eye movements evoked by electrical stimulation of the brain in anesthetized fishes. Brain Behav Evol. 11, 109-129 (1975).
- Gioanni, H., Bennis, M., Sansonetti, A. Visual and vestibular reflexes that stabilize gaze in the chameleon. Vis Neurosci. 10, 947-956 (1993).
- Straka, H., Dieringer, N. Basic organization principles of the VOR: lessons from frogs. Prog Neurobio. 73 (4), 259-309 (2004).
- Voss, J., Bischof, H. -. J. Eye movements of laterally eyed birds are not independent. J Exp Biol. 212 (10), 1568-1575 (2009).
- Ariel, M. Independent eye movements in the turtle. Vis Neurosci. 5, 29-41 (1990).
- Ariel, M., Rosenberg, A. F. Effects of synaptic drugs on turtle optokinetic nystagmus and the spike responses of the basal optic nucleus. Vis Neurosci. 7, 431-440 (1991).
- Balaban, C. D., Ariel, M. A "beat-to-beat" interval generator for optokinetic nystagmus. Biol Cybern. 66, 203-216 (1992).
- Keifer, J. In vitro eye-blink reflex model: Role of excitatory amino acid receptors and labeling of network activity with sulforhodamine. Exp Brain Res. 97, 239-253 (1993).
- Keifer, J., Armstrong, K. E., Houk, J. C. In vitro classical conditioning of abducens nerve discharge in turtles. J Neurosci. 15, 5036-5048 (1995).
- Rosenberg, A. F., Ariel, M. A model for optokinetic eye movements in turtles that incorporates properties of retinal slip neurons. Vis Neurosci. 13, 375-383 (1996).
- Ariel, M. Open-loop optokinetic responses of the turtle. Vis Res. 37, 925-933 (1997).
- Anderson, C. W., Keifer, J. Properties of conditioned abducens nerve responses in a highly reduced in vitro brainstem preparation from the turtle. J Neurophysiol. 81, 1242-1250 (1999).
- Keifer, J. In vitro classical conditioning of the turtle eyeblink reflex: Approaching cellular mechanisms of acquisition. Cerebell. 2, 55-61 (2003).
- Zhu, D., Keifer, J. Pathways controlling trigeminal and auditory nerve-evoked abducens eyeblink reflexes in pond turtles. Brain Behav Evol. 64, 207-222 (2004).
- Jones, M. S., Ariel, M. The effects of unilateral eighth nerve block on fictive VOR in the turtle. Br Res. 1094, 149-162 (2006).
- Jones, M. S., Ariel, M. Morphology, intrinsic membrane properties, and rotation-evoked responses of trochlear motoneurons in the turtle. J Neurophysiol. 99 (3), 1187-1200 (2008).
- Krenz, J. G., Naylor, G. J. P., Shaffer, H. B., Janzen, F. J. Molecular phylogenetics and evolution of turtles. Mol Phylogenet Evol. 37 (1), 178-191 (2005).
- Dearworth, J. R., et al. Role of the trochlear nerve in eye abduction and frontal vision of the red-eared slider turtle (Trachemys scripta elegans). J Comp Neur. 52, 3464-3477 (2013).
- Dearworth, J. R., et al. Pupil constriction evoked in vitro by stimulation of the oculomotor nerve in the turtle (Trachemys scripta elegans). Vis Neurosci. 26, 309-318 (2009).
- Mead, K., et al. IFEL TOUR: a description of the introduction to FUN electrophysiology labs workshop at Bowdoin College, July 27-30, and the resultant faculty learning community. J Undergrad Neurosci Educ. 5, A42-A48 (2007).
- Jackson, D. C., Ultsch, G. R. Physiology of hibernation under the ice by turtles and frogs. J Exp Zool A Ecol Genet Physiol. 313 (6), 311-327 (2010).
- Romano, J. M., Dearworth, J. R. Pupil constriction evoked by stimulation of the ciliary nerve in the red-eared slider turtle (Trachemys scripta elegans). J Penns Acad Sci. 85, 4-8 (2011).
- Miller, J. M., Robins, D. Extraocular-muscle forces in alert monkey. Vis Res. 32, 1099-1113 (1992).
- Gamlin, P. D., Miller, J. M. Extraocular muscle motor units characterized by spike-triggered averaging in alert monkey. J Neurosci Meth. 204, 159-167 (2011).
- Quaia, C., Ying, H. S., Optican, L. M. The Viscoelastic properties of passive eye muscle in primates. III: Force elicited by natural elongations. PLOS ONE. 5, A236-A254 (2010).
- Anderson, S. R., et al. Dynamics of primate oculomotor plant revealed by effects of abducens microstimulation. J Neurophys. 101, 2907-2923 (2009).
- Maxwell, J. H., Harless, M., Morlock, H. Anesthesia and surgery. Turtles: Perspective and Research. , 127-152 (1979).
- AVMA Panel on Euthanasia. American Veterinary Medical Association. J Am Vet Med Assoc. 218 (5), 669-696 (2001).
- Clarke, R. J. Shaping the pupil's response to light in the hooded rat. Exp Br Res. 176, 641-651 (2007).
- Bennett, R. A. A review of anesthesia and chemical restraint in reptiles. J Zoo Wild Med. 22 (3), 282-303 (1991).
- Bickler, P. E., Buck, L. T. Hypoxia Tolerance in Reptiles, Amphibians, and Fishes: Life with Variable Oxygen Availability. Ann Rev Physiol. 69, 145-170 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved