Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Cinématique oculaire mesurée In Vitro la stimulation des nerfs crâniens de la tortue
Dans cet article
Résumé
Ce protocole décrit comment utiliser une in vitro isolé tortue préparation tête pour mesurer la cinématique des mouvements de leurs yeux. Après l’ablation du cerveau de la boîte crânienne, nerfs crâniens peut être stimulées par des courants de quantifier les rotations de le œil et les changements dans la taille de la pupille.
Résumé
Après que les animaux est euthanasiés, leurs tissus commencent à mourir. Tortues d’offrir un avantage en raison d’une plus longue durée de survie de leurs tissus, surtout comparé aux vertébrés à sang chaud. Pour cette raison, des expériences in vitro chez les tortues peuvent être effectuées pour des périodes prolongées de temps pour étudier les signaux neurones et le contrôle de leurs actions de la cible. En utilisant une préparation de tête isolée, nous avons mesuré la cinématique des mouvements oculaires chez les tortues, et leur modulation par des signaux électriques portés par les nerfs crâniens. Après que le cerveau a été supprimé sur le crâne, laissant les nerfs crâniens intact, la tête disséquée a été placée dans un cardan pour calibrer les mouvements des yeux. Électrodes de verre étaient attachés aux nerfs crâniens (oculomoteur, trochléen et abducens) et stimulés par des courants d’évoquer les mouvements des yeux. Nous avons suivi les mouvements des yeux avec une vidéo infrarouge suivi système et quantifiées rotations des yeux. Les impulsions de courant avec une gamme des amplitudes, des fréquences, et durées de train ont été utilisées pour observer les effets sur les réponses. Parce que la préparation est séparée par le cerveau, la voie efférente va cibles musculaires peut être examinée isolément pour étudier la signalisation neuronale en l’absence d’informations sensorielles centralement traitées.
Introduction
Justification de l’utilisation des tortues à oreilles rouges dans des expériences électrophysiologiques :
Tortues à oreilles rouges (Trachemys scripta elegans), sont considérés comme un des pires d’espèces envahissantes du monde1 et peut indiquer qu’un écosystème est en difficulté. Pourquoi les tortues à oreilles rouges sont parvenus est mal comprise, mais elle peut être en partie en raison de leur physiologie tolérante et la possession des tissus nerveux qui peut survivre dans des conditions hypoxiques2,3,4 . Leur utilisation pour l’expérimentation ne menace pas leurs numéros et avec des efforts minimes, préparations électrophysiologiques peuvent demeurer viables sur longues durées, tant que 18 heures5,6. L’avantage est semblable à l’avantage d’utiliser des animaux invertébrés tels que les écrevisses7, qui ont également la capacité de résister à faibles niveaux d’oxygène8.
Techniques de mesure des mouvements oculaires :
Approches pour mesurer les mouvements des yeux chez les animaux aux yeux frontal à l’aide de primates non humains ont été bien développé9. Le œil tourne en orbite autour de trois axes : horizontal, vertical et de torsion. La méthode de bobine magnétique de recherche est généralement considérée comme la plus fiable pour la mesure des rotations, mais est envahissante, exigeant des petites bobines pour être inséré dans les scleras des animaux10,11. Systèmes vidéo peuvent également mesurer des rotations et ont l’avantage d’être non invasive. Le développement de meilleures caméras ainsi que de traitement d’image innovants ont amélioré leurs fonctionnalités rendant les systèmes axés sur la vidéo une alternative intéressante à envisager le12,13,14.
Les techniques développées pour mesurer les mouvements des yeux en nonmammals ont été beaucoup moins importants. Mesures sont soit basse résolution ou décrivent quelques-unes des rotations15,16,17,18. Le manque de développement peut être partiellement attribué à la difficulté de nonmammals de formation pour suivre des cibles visuelles. Bien que les mouvements oculaires ont été bien documentés dans les oreilles rouges tortues19,20,21,22,23,24,25 ,26,27,28,29,30, en raison de la contestation chez les animaux de la formation de suivre les objectifs, la cinématique précise de leurs mouvements oculaires est mal compris.
Tortues à oreilles rouges sont généralement considérés comme vertébrés aux yeux latéraux, mais parce qu’ils peuvent rentrer complètement leurs têtes dans leur coquille31, occlusion significative des champs visual latéraux de la carapace produit32. Le résultat est que leur ligne de mire visuelle est forcé vers l’avant, ce qui les rend se comportent plus comme des mammifères aux yeux frontal. Par conséquent, leur utilisation comme un modèle pour l’élaboration d’approches pour mesurer les mouvements des yeux offre également un point de vue évolutif unique.
Le protocole décrit dans cet ouvrage utilise une préparation in vitro isolés tête pour identifier la cinématique des mouvements oculaires dans les tortues à oreilles rouges. Cerveau est disséqués de crânes laissant les nerfs crâniens intact. Chefs sont placées dans un cardan pour calibrer les mouvements oculaires et évoquent des réponses par stimulation électrique des nerfs crâniens innervant les muscles oculaires. Des rotations par les yeux, les mesures sont faites par un système vidéo, en utilisant des algorithmes logiciels, qui trace la pupille sombre et les marquages de l’iris. L’établissement offre la possibilité de mesurer la cinématique des deux extra-oculaires (c'est-à-direles rotations horizontales, verticales et torsion)32 et intraoculaires (c.-à-d., variations de la pupille)33 mouvements.
Système de modèle pour l’analyse des voies nerveuses efférentes :
Plus généralement, l’approche offre la possibilité d’étudier les signaux neuronaux efférents comment générer des mouvements oculaires lorsque les muscles commencent leurs États détendue et en l’absence d’information sensorielle intégré traitée par le cerveau32, les enquêteurs 33. Par conséquent, la cinématique de le œil peut être examinée dans un système de modèle dans lequel elles sont traitées uniquement par la voie neuronale efférente, laissant le cerveau et synapsing sur les muscles.
Protocole
Remarque : Les tortues tortue à oreilles rouges, hommes et femmes, ont été achetés auprès d’un fournisseur. Les tortues étaient logés dans une suite d’animaux chaude contenant deux cuves de 60 gallons équipés d’îles de brique pour bronzer sous des lampes infrarouges 250 W. L’environnement était entretenu selon un cycle lumière/obscurité de 14/10-h avec la température de l’eau à 22 ° C. Lumières ont été allumés à 06:00 et éteint à 20:00. Les réservoirs équipés de systèmes de filtrage ont été nettoyés toutes les semaines, et tortues ont été nourris ad libitum tous les deux jours. Les soins des oreilles rouges des tortues et tous les suivants procédures expérimentales décrites ici32,33 ont été approuvées par l’animalerie institutionnelle et utilisation Comité (IACUC) au Collège Lafayette.
1. installation de l’équipement
- Préparer une solution de Ringer tortue. Ajoutez le code suivant à l’eau distillée dans l’ordre suivant : chlorure de sodium 96,5 mM (58.44 g/mol), chlorure de potassium 2,6 mM (74,56 g/mol), le chlorure de magnésium 2,0 mM (203.31 g/mol), bicarbonate de sodium 31,5 mM (84,01 g/mol), dextrose 20,0 mM (180.16 g/mol), concentré l’acide chlorhydrique pour ajuster le pH à 7.51 et chlorure de calcium (110.98 g/mol) 4. 0 mM (voir Table des matières). Mélanger la solution lors de l’ajout de chaque sel.
ATTENTION : HCl concentré est dangereux (risques de peau, des yeux, inhalation et ingestion). - Faire des trucs pour les électrodes d’aspiration de 5 cm de longueur capillaire en verre (voir Table des matières), par le feu-polissage aux différentes tailles de diamètres intérieurs afin de tenir compte des nerfs crâniens d’épaisseur variable.
- Utilisez un petit fichier à graver une ligne à travers un morceau de verre capillaire. Placez en papier de soie et briser en deux.
- Rouler lentement une des extrémités du verre capillaire dans la flamme d’un bec Bunsen. Vérifiez périodiquement si la pointe pour la taille, la finesse et symétrie à l’aide d’une dissection étendue et une lumière à fibre optique source (voir la Table des matières).
Remarque : Pour les tortues avec des largeurs de tête entre 20 et 30 mm, diamètre intérieur d’ajustement optimal tailles typiquement varient de 0,4 à 0,8 mm pour le nerf oculomoteur (nIII), 0,3 à 0,6 mm pour le nerf trochléaire (nIV) et 0,2 à 0,4 mm pour le nerf abducens (INB).
- Nettoyez et organisez des pinces-gouges, une sonde de dissection non tranchante, microciseaux, fine pince, pince courbée et un manche de bistouri Swann-Morton avec lames (reportez-vous à la Table des matières) pour la dissection.
Remarque : La stérilisation des instruments est facultative.
2. anesthésie et l’euthanasie
- Place la tortue dans une glace seau pendant 60 min à cryoanesthetize il.
- Euthanasier la tortue par décapitation à l’aide d’une petite guillotine animale (voir la Table des matières).
- Dégager doucement les mâchoires de l’animale ouverte avec une petite spatule de pesage, afin qu’un crochet peut être inséré et se tourna pour se glisser sous la pointe de la mâchoire supérieure.
- Tirer avec une pression constante pour étendre la tête de l’animal par l’intermédiaire de la guillotine. Rapidement décapiter l’animal.
- Placez la tête de tortue dans un plat de dissection. Avoir assez tortue de Ringer pour irriguer les tissus. Oxygenize la solution avec 95/5 O2/co2 (voir la Table des matières).
- Maintenir le tissu à 4 ° C en plaçant la glace autour de l’extérieur du plat.
3. dissection
- Utilisent l’étendue de la dissection avec une source de lumière de fibre optique pour réaliser la dissection.
- Enlever la mâchoire inférieure. Placez une sonde dissection émoussée par la bouche afin de fournir une gestion plus facile de la tête. Couper l’articulation rejoignant l’OS dentaire au crâne avec un scalpel. Pinces-gouges permet de tirer sur la mâchoire inférieure du crâne. Pinces-gouges permet de retirer la peau et les muscles de leurs pièces jointes dans les régions dorsales et latérales du crâne.
- Supprimer la colonne vertébrale.
- Identifiez la colonne vertébrale à l’extrémité caudale du crâne. Courbure de la colonne vertébrale sur le ventre pour exposer la moelle épinière. Microciseaux permet de couper la moelle épinière. Pinces-gouges permet d’enlever la colonne vertébrale et autres tissus du crâne en tirant en direction caudale.
- Retirer le cerveau de la boîte crânienne après avoir coupé les nerfs crâniens.
- À partir de l’occipital, utiliser pinces-gouges pour couper deux incisions sur le crâne de dorsal. Faire des coupes superficielles pour éviter d’endommager le cerveau sous.
- Pinces-gouges permet de retirer soigneusement le crâne dorsal. Utilisez microcisseaux pour supprimer la meninx pour exposer le reste du cerveau. Retirez suffisamment meninx jusqu'à ce que les bulbes olfactifs, dans la cavité crânienne antérieure, peuvent être identifiés (voir la Figure 1 a). Continuer à irriguer le cerveau avec une solution de Ringer de tortue, si nécessaire.
- Pince courbée permet de tirer le cerveau direction caudale délicatement et de produire une tension légère sur les nerfs crâniens. Soigneusement couper et enlever les bulbes olfactifs et le cerveau avec une pince courbe.
- Utilisez microciseaux pour pousser doucement le mésencéphale vers la ligne médiane pour exposer les nerfs crâniens ; nIII, environ 0,6 mm, peut être vu en face de la SEG, et le diamètre du nIV sera légèrement inférieure à nIII. Couper nIII et nIV, où qu’ils attachent au mésencéphale (voir Figure 1 b). Répétez cette opération sur l’autre côté.
- Couper le nerf optique gauche et droit (nII) avec microciseaux. Puis inclinez le tronc cérébral d’un côté. Observer l’INB émergeant de la surface ventrale près du confluent de la protubérance et le bulbe rachidien (voir Figure 1) ; le diamètre de nVI est petit et environ 0,3 mm. couper aussi bien l’INB gauche et droite.
- Supprimer les parties restantes du tronc cérébral de la tortue avec microciseaux et pinces fines. Une fois le crâne vide, examiner le plancher de la cavité crânienne. Identifier les INB nIII et nIV.
- Supprimer les paupières supérieures et inférieures avec pince fine et microciseaux.
4. étalonnage des mouvements oculaires
- Utiliser une table rigide (voir Table des matières) pour appuyer la mise en place d’autres instruments et le cardan. Placez la tête de tortue dans le mandrin de cardan afin que la surface dorsale de la tête est parallèle à l’horizon en utilisant un niveau à bulle petit au repos à travers le crâne. À peu près un des yeux positionner au centre de rotations horizontale et verticale de la cardan.
- Placer la caméra infrarouge, munie d’une lumière infrarouge diode électroluminescente (del), qui fait partie de le œil sur vidéo, système de suivi (voir Table des matières), à une distance d’environ 12 cm de le œil de la tortue.
- Angle 45 degrés au-dessus de la ligne de mire de le œil de la caméra. La LED doit être à la position de 11:00 en regardant la caméra. Centrez la LED sur l’axe optique de le œil. La caméra sera légèrement hors axe (tel que vu par le dessus de le œil).
- Ajuster la distance de la caméra de l’oeil pour que la vue caméra est remplie au maximum par le globe oculaire. Veiller à ce que les coins des yeux (canthi) sont sur les bords de l’affichage horizontal.
- Connectez la caméra à le œil sur vidéo, système pour traiter les données de suivi. Diviser le signal à un graveur de DVD pour capturer la vidéo brute. Concentrer la caméra pour obtenir une image claire de le œil. Faites attention à l’amende-position de le œil au centre de la vue de la caméra en utilisant les trois degrés de l’ajustement linéaire (x, y, z) fourni avec le cardan.
- Détecter la pupille sombre en définissant le seuil et le contraste de façon appropriée en utilisant le programme fourni avec l’oeil sur vidéo, système de suivi.
- À l’aide de la souris, cliquez sur le menu « Vidéo » et sous « Mode » sélectionnez « Haute précision » pour capturer des images à une fréquence d’échantillonnage de 30 Hz (résolution de 640 pixels x 480 lignes). Également rubrique « Vidéo », sélectionnez « Dark élève » pour « Élève Type » et « Ellipse (rotation ellipse) » pour la « Méthode de Segmentation élève ».
- Dans la fenêtre « EyeCamera », cliquez sur l’icône « Élève recherche zone réglage » (petit rectangle vertical avec un point au centre). Utilisez la souris pour traîner un rectangle qui limite une zone autour de la pupille. Éviter les zones sombres qui pourraient être confondus avec l’élève.
- Dans la fenêtre « Commandes », confirment que les cases correspondantes pour « Image Auto » et « seuil autoverrouillage suivi » sont cochées. Cliquez sur « Auto-seuil » à optimiser la densité de la numérisation, qui montrera que les points verts sur la pupille sombre.
- Calibrer l’écran vidéo de l’oeil sur vidéo, programme de suivi pour les rotations de la cardan 12,5 ° (+/-) autour de son axe horizontal et 10 ° (+/-) autour de son axe vertical.
- Dans la fenêtre « Commandes », cliquez sur « Affichage ». Cochez les cases « Regard » et « Stim » pour « Point de Gaze », « Région de Calib » et « Grille de géométrie ». Après avoir vérifié les cases qui figurent sous « Grille de géométrie », une fenêtre pop-up et dire, « la géométrie d’écran de stimulation doit être mesurée avant de pouvoir afficher la grille de la géométrie. Vous souhaitez le faire maintenant ? » Sélectionnez « Y » pour yes.
- À l’aide de la souris, cliquez sur le menu « Fenêtres » et sélectionnez « Stimulus ». La fenêtre « Stimulus » ouvrira montrant un franchissement de la ligne horizontale et verticale au centre de l’écran. Mesurer les longueurs des lignes au mm le plus proche. Appuyez sur « Echap » du clavier pour fermer la fenêtre « Stimulus ».
- À l’aide de la souris, cliquez sur le menu « Stimulation » et sélectionnez « Configuration de géométrie ». Les longueurs des lignes qui ont été mesurées à l’entrée. Ajuster la distance de visualisation afin que la degrés/ligne égale à 25 ° pour la ligne horizontale et 20 ° pour la ligne verticale. Cliquez sur le bouton « Store » et fermez la fenêtre.
- Dans la fenêtre « EyeSpace », sélectionnez le nombre de calibration « Point de données » à « 9 ». Avec les yeux de la tortue positionné au centre, cliquez sur le centre de données, point et cliquez sur le bouton « Re-présenter ».
Remarque : La fenêtre « Stimulus » s’ouvre et « Get Ready » apparaîtra au centre de l’écran. Une boîte apparaît à l’emplacement central et puis disparaissent. Sur sa disparition, on fermera la fenêtre « Stimulus ». La position centrale devrait maintenant être étalonnée. - Répétez l’opération en tournant le cardan droite/gauche, +12,5 ° /-12,50 ° et haut/bas + 10 ° /-10 ° à étalonner les autres points de données.
- Pour calibrer la rotation torsion, utilisez le modèle raccord algorithme fourni avec le œil axée sur la vidéo, programme de suivi. L’algorithme définit une position zéro basée sur les marques de l’iris et calcule l’angle de rotation lorsque les repères deviennent décalage entre le centroïde de la pupille.
- En utilisant le pointeur de la souris, cliquez sur le menu « Fenêtres » et sélectionnez « Torsion ». Cliquez sur le bouton « Démarrer » dans la fenêtre « Torsion ». Dans la fenêtre « EyeCamera », un arc s’affiche sur l’image de le œil.
- Réglez le rayon, l’angle et la longueur de l’arc en utilisant les curseurs à un endroit où les inscriptions irrégulières sont présentes dans l’iris. Cochez les cases « Graphiques en temps réel » et « Auto-Set après ajustement ». Si nécessaire, ajuster la luminosité et de contraste dans la fenêtre de commandes et la re-seuil la pupille sombre (voir étape 4). Cliquez sur le bouton « Définir le modèle ».
- Placez une règle dans le plan focal de l’élève et enregistrer la largeur de la vue caméra full. La valeur est utilisée ultérieurement pour déterminer la largeur réelle de l’élève.
5. positionnement des électrodes d’aspiration sur le nerf crânien pour évoquer les mouvements oculaires
- Placer soigneusement une électrode de référence de broche dans le tissu conjonctif ou muscle restant sur la tête.
- Placer l’électrode d’aspiration (voir Table des matières) sur le nerf crânien à l’aide d’un micromanipulateur et dissection étendue monté sur une perche. Une source de lumière de fibre optique permet d’afficher et de guider la mise en place.
- Correspondre à la taille d’un nerf à un bout de verre capillaire. Essais et erreurs est nécessaire pour obtenir un meilleur ajustement autour du diamètre d’un nerf (Voir l’étape 1.2 pour les recommandations de taille). Placer l’embout de verre sur l’électrode d’aspiration. Remplir l’électrode d’aspiration avec une solution de Ringer et régler le volume dans la seringue à environ la moitié de sa capacité.
- Déplacer délicatement le bout de verre de l’électrode en utilisant le micromanipulateur à un emplacement situé au-dessus de la coupe-fin du nerf sélectionné. Veiller à ce qu’une solution de Ringer remplit le crâne et la pointe est inférieure à sa surface. Si nécessaire, utilisez glaise à modeler pour endiguer les endroits où une solution de Ringer est une fuite hors de la boîte crânienne.
- Tirez sur le piston de la seringue.
Remarque : Le vide entraînera le nerf dans l’extrémité de la pointe capillaire. Un bon ajustement est indiqué par le nerf restant dans la pointe avec peu ou pas vide supplémentaire appliqué.
6. la stimulation des nerfs crâniens et l’analyse des mouvements oculaires
- Utiliser un stimulateur de nerf/muscle généraliste avec un dispositif d’isolement actuel (voir Table des matières) pour stimuler le nerf crânien par l’intermédiaire de l’électrode d’aspiration.
- Connecter l’électrode d’aspiration pour le dispositif d’isolement actuel à l’aide d’un câble. Connectez le fil de l’électrode de référence de broches pour la connexion à la terre de l’appareil de l’isolement.
- Sélectionnez l’onglet Paramètres des courants à l’aide des cadrans et met en marche l’appareil stimulateur et l’isolement. Utilisez une gamme de courants de 1 à 100 µA, avec une fréquence de 10 à 400 que Hz. utilisation 1 - ou 2-ms des impulsions trains durent 100, 500 ou 1 000 ms.
- Enregistrer le minutage des stimulations.
NOTE : Impulsions Transistor-transistor-logique (TTL) sont synchronisées avec les livraisons des courants de stimulateur et de communiquer en temps réel via un câble aux canaux d’entrée de l’oeil sur vidéo, système de suivi. Un module logiciel fourni avec le œil axée sur la vidéo suivi programme contrôles la communication.- Pour visualiser le calendrier des applications actuelles et leur influence sur les mouvements des yeux, cliquez sur le menu « PenPlots ». Sélectionnez « Position de regard de X », « Y contempler la Position », « Torsion » et « Élève Width » de montrer en temps réel des données brutes parcelles pour X et Y des yeux postes, torsion et la largeur de l’élève. Également sélectionner « Secondes & marqueurs » dans le menu « PenPlots » de montrer une parcelle de chronométrage avec les marques de graduation, qui apparaissent à intervalles de 1 s.
NOTE : Une lettre majuscule « T » paraîtra marque le début de l’impulsion TTL, qui se produisent simultanément à l’application actuelle. - Pour stocker les données de mouvements oculaires, évoquées par les courants, cliquez sur le menu « Fichier » et sélectionnez « Nouveau fichier de données » sous « Données ». Saisir un nom de fichier, puis appuyez sur « Enter ». Enregistrement des données peuvent être suspendues et puis redémarrée à l’aide de la combinaison de touches, les touches « Ctrl » + « p ». Quand une session expérimentale est terminée, sélectionnez « Fichier de données étroite » hors menu « Fichier » sous « Données ».
- Afin de garder une trace de type de courants appliqués, cliquez sur le menu « Fenêtres » et sélectionnez « Data Pad ». La fenêtre « Clavier/DataMarker » s’affiche. Cliquez sur une lettre ou un numéro pour identifier les paramètres des stimulations actuelles étant livrées au nerf.
NOTE : par exemple, « X » pouvait supporter pour 10 µA. en cliquant sur « X » stocke son entrée dans le fichier de données en temps réel pour l’analyse post hoc . Il apparaît également sur le « PenPlot » pour les « Secondes & marqueurs » pour l’observation en cours.
- Pour visualiser le calendrier des applications actuelles et leur influence sur les mouvements des yeux, cliquez sur le menu « PenPlots ». Sélectionnez « Position de regard de X », « Y contempler la Position », « Torsion » et « Élève Width » de montrer en temps réel des données brutes parcelles pour X et Y des yeux postes, torsion et la largeur de l’élève. Également sélectionner « Secondes & marqueurs » dans le menu « PenPlots » de montrer une parcelle de chronométrage avec les marques de graduation, qui apparaissent à intervalles de 1 s.
- Analyser les données issues du système de traqueur oculaire.
- Ouvrez le fichier de données enregistrées, qui est au format texte délimité, dans un programme de feuille de diffusion de choix pour organiser les données et effectuer des analyses statistiques.
- Convertir les valeurs de largeur élève stockées dans le fichier à tailles réelles en mm.
- Convertir les valeurs de X et Y des yeux postes et torsions aux unités de mesure et utilisent des conventions pour décrire les mouvements des yeux ; par conséquent, les indications positives de rotations : intorsion, altitude et adduction ; et négatifs des directions des rotations : extorsion, la dépression et l’enlèvement.
- Copiez les informations d’en-tête sur une nouvelle feuille de calcul. Ceci inclura les valeurs pour la taille de l’écran (largeur et hauteur) et la distance de visualisation. Huit colonnes de données recueillies à une fréquence de 30 Hz suivra sous les informations d’en-tête.
- Revenir à la feuille de calcul contenant les données brutes. Faire une « trouvaille » pour « X » dans la dernière colonne intitulée « Marqueur » pour localiser où la stimulation a été appliquée avec 10 µA. incidence de trouver des « T », marquant le début de la stimulation actuelle. Copier les 15 lignes (0,5 s) de données survenant avant le « T » et 90 images après « T » (3.0 s) ; soitau total 3,5 s. Collez les données dans la nouvelle feuille de calcul ci-dessous les informations d’en-tête.
- Insérer une colonne vide après « PupilWidth ». Dans la colonne vide, convertir la dimension calibrée en mm :
Diamètre de la pupille horizontale = « PupilWidth » × la dimension de la largeur de vue caméra - Insérer 2 colonnes vides une fois « X_Gaze » et « Y_Gaze ». Normaliser les postes aux dimensions de l’écran de visualisation : coordonnées (0, 0), en haut à gauche de l’écran, s’étendant à (1, 1) en bas à droite. Dans la première colonne vierge, traduire à un système de coordonnées ayant des positions (0, 0) au centre de l’écran. Inclure la conversion aux dimensions de l’écran en mm :
X = (largeur × 0,5) – (« X_Gaze » × largeur) ; Y = (0,5 × hauteur) – (« Y_Gaze » × hauteur)
Remarque : La séquence d’ouverture est pour le œil gauche. La séquence devra être inversé pour le œil droit afin de suivre la convention de la négativité pour l’enlèvement et la positivité pour adduction. - Dans les colonnes de seconde, utilisez fonctions trigonométriques pour convertir en angle (°) de rotation :
rotation horizontale = arctan (Xà distance /viewing) ; rotation verticale = arctan (Y/viewing distance) - Torsion est déjà indiquée en unités de degrés, mais pour se conformer à la convention de positivité pour intorsion, si la mesure se fait sur le œil gauche, multiplier par -1. Pour le œil droit, aucune multiplication n’est nécessaire. Le programme des codes des aiguilles comme positif.
- Tracer le diamètre de la pupille et les rotations en fonction du temps.
- Ouvrez le fichier de données enregistrées, qui est au format texte délimité, dans un programme de feuille de diffusion de choix pour organiser les données et effectuer des analyses statistiques.
Résultats
La figure 1 illustre les alambics d’images tirées d’une vidéo décrivant la dissection. Images fournissent des endroits typiquement des nerfs avant la Coupe du cerveau.
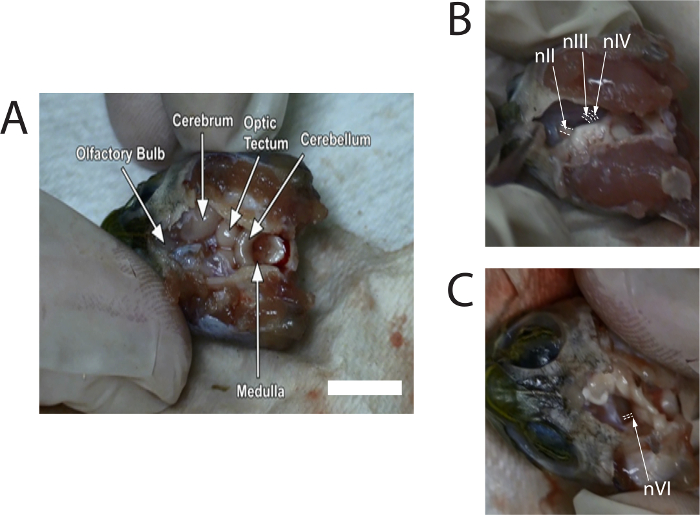
Figure 1 : Stills d’images capturées à partir de la vidéo de la dissection pour montrer les emplacements du nerf optique (nII), n...
Discussion
Étapes essentielles :
Les étapes critiques au sein de ce protocole sont les suivants : 1) la dissection et le soin apporté à maintenir la viabilité des nerfs sectionnées ; 2) la correspondance des tailles par les électrodes d’aspiration aux nerfs crâniens à répondre de manière cohérente ; et 3) le placement de la tête dans le cardan d’étalonnage adéquat des rotations de le œil.
Dépannage :
La dissection peut être diff...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient Mme Paulette McKenna et Lisa Pezzino dans cette étude pour les services de secrétariat et M. Phil Auerbach pour le support technique. Les auteurs remercient également les Drs Michael Ariel et Michael S. Jones (Saint Louis University School of Medicine) pour nous introduire à la préparation de tête en vitro isolé. Prise en charge de cette collaboration a été financé par le département de biologie (Robert S. Chase Fund), le Comité de la recherche universitaire et du programme de neurosciences au Lafayette College. Enfin, cette oeuvre est dédiée à M. Phil Auerbach, qui est décédé le 28 septembre 2016 ; Il a retiré du service en microscopie électronique à balayage et a reconnu l’utilité de son étape 5 axes pour une utilisation dans le présent protocole. Son amitié et l’ingéniosité nous manquera grandement.
matériels
| Name | Company | Catalog Number | Comments |
| Red-eared slider turtles | Kons Scientific | Trachemys scripta elegans | Large size (carapace length 15-20 cm) |
| Sodium chloride | Sigma-Aldrich Co. LLC. | S5886 | |
| Potassium chloride | Sigma-Aldrich Co. LLC. | P5405 | |
| Magnesium choride | Sigma-Aldrich Co. LLC. | M7304 | |
| Sodium bicarbonate | Sigma-Aldrich Co. LLC. | S5761 | |
| Dextrose | Sigma-Aldrich Co. LLC. | C5767 | |
| Concentrated hydrochloric acid | Sigma-Aldrich Co. LLC. | H7020 | |
| Calcium chloride | Sigma-Aldrich Co. LLC. | C7902 | |
| pH meter | Oakton | pH 6+ | |
| Suction stimulation electrode | A-M Systems | 573000 | Bipolar suction electrode. Note that 573000 has been replaced with 573050. |
| Capillary glass | A-M systems | 626000 | Single-barrel borosilicate capillary glass without microfilament, length 10 cm, outside diameter 1.0 mm, inner diameter 0.50 mm |
| Alternative suction stimulation electrode | A-M Systems | 573050 | Bipolar suction electrode. Requires larger diameter capillary glass: 627000, outside diameter 1.2 mm, inner diameter 0.68 mm |
| Stereoscope | Lieca | GZ7 | Magnification range, 10x – 70x |
| Fiber optic light source | Amscope | HL250-A | 150W Fiber optical microscope illuminator light box |
| Rongeurs | Carolina Biological Supply Company | 625654 | stainless steel, straight spring, 5.25" |
| Blunt dissection probe | Carolina Biological Supply Company | 627405 | Huber mall probe, double-ended probe and seeker, 6" |
| Microscissors | Carolina Biological Supply Company | 623555 | Iris microdissecting scissors, stainless steel, 0.5" blades, 4.75" long |
| Fine forceps | Sigma-Aldrich Co. LLC. | F6521 | Jewelers forceps, dumont No. 5, inox alloy, 4.25" |
| Curved forceps | Sigma-Aldrich Co. LLC. | Z168696 | Medium tip, curved forceps, stainless steel, 4" |
| Scalpel handle | Sigma-Aldrich Co. LLC. | S2896 | Scalpel handles, No. 3, stainless steel |
| Scalpel blade | Sigma-Aldrich Co. LLC. | S2771 | Scalpel blades, No. 11, steel |
| Guillotine | Harvard Apparatus | 73-1918 | Kleine guillotine type 7575 |
| Spatula | Sigma | Z648299 | Micro spoon and spatula weighing set. Use small spatula: 5.9” long x 0.07” diameter handle with square end: 0.17” x 1.3” long, other end round: 0.17” x 1.27” long |
| Hook | Autozone | 98069 | SureBilt hook and pick set. Use grinder to dull sharp points of hook to prevent injury to animals mouth. |
| 95/5% O2/CO2 | Airgas, Inc. | X02OX95C2003102 | 5% Carbon dioxide balance oxygen certified standard gas mixture, size 200 Cylinder, CGA-296 |
| Regulator | Airgas, Inc. | Y11244D296-AG | Single stage brass 0-100 psi analytical cylinder regulator CGA-296 with needle outlet. Use brass adjustable airline pipe valve to go from 3/8", inner diameter, vinyl airline tubing connected to regulator to a 3/16", inner diameter, airline connection going to airstone or glass pasteur pipette. |
| Adjustable airline pipe valve | Doctors Foster and Smith | CD-12061 | Brass valve |
| Rigid table | Unknown | Unknown | Auto-clave door laid on top of a sturdy table. Nine 5" diameter tennis balls isolate vibrations from the top surface of the table. |
| 5" tennis ball | Petco Animal Supplies, Inc. | 712868 | Petco Jumbo Pet Tennis Ball: balls are unsliced and held within an integrated frame on the underside part of the autoclave door. |
| Alternative vibration isolation table | Newport Corporation | INT1-36-6-N | Rigid vibration control system, integrity 1: Surface dimensions, 3' x 6' |
| Gimbal | ISI, International Scientific Instruments, Inc. | Stage from SUPER III-A Scanning EM | 5-axis eucentric stage: X, Y, and Z linear movements, ±20 mm, 0.1 mm precision; Rotations, vertical, ±10°, and horizontal, ±12.5°, with 1.25° precision. Note: from decommission instrument. |
| Chuck for gimbal | Unknown | Unknown | Chuck from an old microtome of unknown manufacture was machined to fit the shaft of the specimen holder of the Scanning EM stage |
| Alternative gimbal | ThorLabs, Inc. | GN2/M with MBT602/M | Dual-axis goniometer (GN2/M) mounted on 3-axis microblock stage with thumbscrew adjusters (MBT602/M): design a chuck to hold turtle head with eye at 12.7 mm above top surface of goniometer (distance to point of rotation) |
| Video-based eye tracking system | Arrington Research, Inc. | ViewPoint EyeTracker, PC-60 | Tracking method: Infrared video by dark pupil; Black and white camera (Item BC02): 30 Hz, 640 x 480; System requirements: Windows 2000, XP, 7, 8, 8.1, 10; Visual range: Horizontal +/- 44°; vertical +/- 20°; Accuracy ~0.5°; Spatial resolution ~0.15°; Pupil size resolution ~0.03 mm; Eye data: X, Y position of gaze, pupil height and width, torsion, delta time, total time, and regions of interest (ROI); Real-time communication (Item 0022): 4-Channel AnalogOut with eight TTL input channels to mark codes into the data file |
| Multi-position magnetic base | Harbor Freight Tools | Pittsburg, item #5645 | Magnetic holder reaches up to 12" and produces 45 lbs. of magnetic pull. Use to position camera. Machine thread holes onto the end of the rod to mount cameras. |
| Micromanipulator | Kopf | 900 | 5 axis manipulation for mount of suction electrode: X, Y, Z linear travel, 2 axis of rotation |
| Dissection scope on boom | Lieca | GZ6 | Magnification range, 6.7x – 40x |
| Nerve/muscle stimulator | Astro-Med Grass Telefactor | Grass S88 | Dual pulse voltage stimulator: two output channels that can be operated independently or synchronized to generate non-isolated constant voltage pulses (10 mv to 150 V). Pulses can be single (10 μsec to 10 sec), repetitive (0.01 Hz to 1 KHz), and trains (1 ms to 10 s) and synchronized with TTL inputs and output. Send TTL outputs via the output channels of a DB25 connector to the TTL input channels of the ViewPoint EyeTracker. Note: Astro-Med Grass Telefactor is no longer in business. |
| Current isolation device | Astro-Med Grass Telefactor | PSIU6 | Current stimulus isolation unit: enables safe delivery of constant currents by the S88 to the preparation. The PSIU6 connects by a BNC cable to one of the output channels of the S88. Multiplier switches on the PSIU6 allow the S88 to generate a wide array of current amplitudes ranging from 0.1 µA to 15 mA. |
| Alternative nerve/muscle stimulator with isolation | A-M Systems | 2100 | Isolated Pulse Stimulator: Unit has built-in isolator to produce constant currents. |
Références
- Kikillus, K. H., Hare, K. M., Hartley, S. Minimizing false-negatives when predicting the potential distribution of an invasive species: A bioclimatic envelope for the red-eared slider at global and regional scales. Anim Conserv. 13, 5-15 (2010).
- Lutz, P. L., Rosenthal, M., Sick, T. J. Living without oxygen: turtle brain as a model of anaerobic metabolism. Mol Physiol. 8, 411-425 (1985).
- Lutz, P. L., Milton, S. L. Negotiating brain anoxia survival in the turtle. J Exp Biol. 207, 3141-3147 (2004).
- Storey, K. B. Anoxia tolerance in turtles: Metabolic regulation and gene expression. Comp Biochem Physiol A-Mol Integr Physiol. 147 (2), 263-276 (2007).
- Granda, A. M., Dearworth, J. R., Subramaniam, B. Balanced interactions in ganglion-cell receptive fields. Vis Neurosci. 16, 319-332 (1999).
- Dearworth, J. R., Granda, A. M. Multiplied functions unify shapes of ganglion-cell receptive fields in retina of turtle. J Vis. 2 (3), 204-217 (2002).
- Nesbit, S. C., Van Hoof, A. G., Le, C. C., Dearworth Jr, J. R. Extracellular recording of light responses from optic nerve fibers and the caudal photoreceptor in the crayfish. J Undergrad Neurosci Educ. 14 (1), A29-A38 (2015).
- McMahon, B. R. Respiratory and circulatory compensation to hypoxia in crustaceans. Resp Phsiol. 128 (3), 349-364 (2001).
- Leigh, R. J., Zee, D. S. . The neurology of eye movements. , (1999).
- Robinson, D. A. A method of measuring eye movement using a scleral search coil in a magnetic field. IEEE Trans Biomed Eng. 10, 137-145 (1963).
- Judge, S. J., Richmond, B. J., Chu, F. C. Implantation of magnetic search coils for measurement of eye position: an improved method. Vis Res. 20, 535-538 (1980).
- Ong, J. K. Y., Halswanter, T. Measuring torsional eye movements by tracking stable iris features. J Neurosci Meth. 192, 261-267 (2010).
- Kimmel, D. L., Mammo, D., Newsome, W. T. Tracking the eye non-invasively: simultaneous comparison of the scleral search coil and optical tracking techniques in the macaque monkey. Front Behav Neurosci. 6 (49), 1-17 (2012).
- Otero-Millan, J., Roberts, D. C., Lasker, A., Zee, D. S., Kheradmand, A. Knowing what the brain is seeing in three dimensions: A novel, noninvasive, sensitive, accurate, and low-noise technique for measuring ocular torsion. J Vis. 15 (14), 1-15 (2015).
- Demski, L. S., Bauer, D. H. Eye movements evoked by electrical stimulation of the brain in anesthetized fishes. Brain Behav Evol. 11, 109-129 (1975).
- Gioanni, H., Bennis, M., Sansonetti, A. Visual and vestibular reflexes that stabilize gaze in the chameleon. Vis Neurosci. 10, 947-956 (1993).
- Straka, H., Dieringer, N. Basic organization principles of the VOR: lessons from frogs. Prog Neurobio. 73 (4), 259-309 (2004).
- Voss, J., Bischof, H. -. J. Eye movements of laterally eyed birds are not independent. J Exp Biol. 212 (10), 1568-1575 (2009).
- Ariel, M. Independent eye movements in the turtle. Vis Neurosci. 5, 29-41 (1990).
- Ariel, M., Rosenberg, A. F. Effects of synaptic drugs on turtle optokinetic nystagmus and the spike responses of the basal optic nucleus. Vis Neurosci. 7, 431-440 (1991).
- Balaban, C. D., Ariel, M. A "beat-to-beat" interval generator for optokinetic nystagmus. Biol Cybern. 66, 203-216 (1992).
- Keifer, J. In vitro eye-blink reflex model: Role of excitatory amino acid receptors and labeling of network activity with sulforhodamine. Exp Brain Res. 97, 239-253 (1993).
- Keifer, J., Armstrong, K. E., Houk, J. C. In vitro classical conditioning of abducens nerve discharge in turtles. J Neurosci. 15, 5036-5048 (1995).
- Rosenberg, A. F., Ariel, M. A model for optokinetic eye movements in turtles that incorporates properties of retinal slip neurons. Vis Neurosci. 13, 375-383 (1996).
- Ariel, M. Open-loop optokinetic responses of the turtle. Vis Res. 37, 925-933 (1997).
- Anderson, C. W., Keifer, J. Properties of conditioned abducens nerve responses in a highly reduced in vitro brainstem preparation from the turtle. J Neurophysiol. 81, 1242-1250 (1999).
- Keifer, J. In vitro classical conditioning of the turtle eyeblink reflex: Approaching cellular mechanisms of acquisition. Cerebell. 2, 55-61 (2003).
- Zhu, D., Keifer, J. Pathways controlling trigeminal and auditory nerve-evoked abducens eyeblink reflexes in pond turtles. Brain Behav Evol. 64, 207-222 (2004).
- Jones, M. S., Ariel, M. The effects of unilateral eighth nerve block on fictive VOR in the turtle. Br Res. 1094, 149-162 (2006).
- Jones, M. S., Ariel, M. Morphology, intrinsic membrane properties, and rotation-evoked responses of trochlear motoneurons in the turtle. J Neurophysiol. 99 (3), 1187-1200 (2008).
- Krenz, J. G., Naylor, G. J. P., Shaffer, H. B., Janzen, F. J. Molecular phylogenetics and evolution of turtles. Mol Phylogenet Evol. 37 (1), 178-191 (2005).
- Dearworth, J. R., et al. Role of the trochlear nerve in eye abduction and frontal vision of the red-eared slider turtle (Trachemys scripta elegans). J Comp Neur. 52, 3464-3477 (2013).
- Dearworth, J. R., et al. Pupil constriction evoked in vitro by stimulation of the oculomotor nerve in the turtle (Trachemys scripta elegans). Vis Neurosci. 26, 309-318 (2009).
- Mead, K., et al. IFEL TOUR: a description of the introduction to FUN electrophysiology labs workshop at Bowdoin College, July 27-30, and the resultant faculty learning community. J Undergrad Neurosci Educ. 5, A42-A48 (2007).
- Jackson, D. C., Ultsch, G. R. Physiology of hibernation under the ice by turtles and frogs. J Exp Zool A Ecol Genet Physiol. 313 (6), 311-327 (2010).
- Romano, J. M., Dearworth, J. R. Pupil constriction evoked by stimulation of the ciliary nerve in the red-eared slider turtle (Trachemys scripta elegans). J Penns Acad Sci. 85, 4-8 (2011).
- Miller, J. M., Robins, D. Extraocular-muscle forces in alert monkey. Vis Res. 32, 1099-1113 (1992).
- Gamlin, P. D., Miller, J. M. Extraocular muscle motor units characterized by spike-triggered averaging in alert monkey. J Neurosci Meth. 204, 159-167 (2011).
- Quaia, C., Ying, H. S., Optican, L. M. The Viscoelastic properties of passive eye muscle in primates. III: Force elicited by natural elongations. PLOS ONE. 5, A236-A254 (2010).
- Anderson, S. R., et al. Dynamics of primate oculomotor plant revealed by effects of abducens microstimulation. J Neurophys. 101, 2907-2923 (2009).
- Maxwell, J. H., Harless, M., Morlock, H. Anesthesia and surgery. Turtles: Perspective and Research. , 127-152 (1979).
- AVMA Panel on Euthanasia. American Veterinary Medical Association. J Am Vet Med Assoc. 218 (5), 669-696 (2001).
- Clarke, R. J. Shaping the pupil's response to light in the hooded rat. Exp Br Res. 176, 641-651 (2007).
- Bennett, R. A. A review of anesthesia and chemical restraint in reptiles. J Zoo Wild Med. 22 (3), 282-303 (1991).
- Bickler, P. E., Buck, L. T. Hypoxia Tolerance in Reptiles, Amphibians, and Fishes: Life with Variable Oxygen Availability. Ann Rev Physiol. 69, 145-170 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon