É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Cinemática ocular medida na Vitro estimulação dos nervos cranianos na tartaruga
Neste Artigo
Resumo
Este protocolo descreve como usar uma em vitro isolado Tartaruga cabeça preparação para medir a cinemática dos seus movimentos do olho. Após a remoção do cérebro do crânio, nervos cranianos podem ser estimulados com correntes para quantificar as rotações do olho e alterações no tamanho da pupila.
Resumo
Depois que os animais são sacrificados, os tecidos começam a morrer. Tartarugas oferecem uma vantagem por causa de um maior tempo de sobrevivência de seus tecidos, especialmente quando comparado com animais vertebrados de sangue quente. Por causa disso, experimentos em vitro em tartarugas podem ser executados por longos períodos de tempo para investigar os sinais neurais e controle de suas ações de alvo. Utilizando uma preparação de cabeça isolada, Nós medimos a cinemática dos movimentos oculares em tartarugas, e sua modulação por sinais elétricos transmitido por nervos cranianos. Depois que o cérebro foi removido do crânio, deixando os nervos cranianos intacto, a cabeça dissecada foi colocada em um giroscópio para calibrar os movimentos oculares. Eletrodos de vidro foram anexados aos nervos cranianos (oculomotor, troclear e abducente) e estimulados com correntes para evocar os movimentos oculares. Temos monitorado movimentos oculares com um vídeo infravermelho quantificadas rotações dos olhos e o sistema de rastreamento. Pulsos de corrente com uma gama de amplitudes, frequências, e durações de trem foram usadas para observar efeitos nas respostas. Porque a preparação é separada do cérebro, via eferente para alvos de músculo pode ser examinada isoladamente para investigar a sinalização neural na ausência de informação sensorial centralmente processada.
Introdução
Justificativa para o uso de tartarugas-de-orelha-vermelha Slider em experimentos eletrofisiológicos:
Red-eared slider tartarugas (Trachemys scripta elegans), são considerados um dos piores espécies invasoras1 do mundo e pode indicar que um ecossistema está em apuros. A razão por que as tartarugas-de-orelha-vermelha deslizante são tão bem sucedidas é mal compreendida, mas pode ser em parte devido a sua fisiologia tolerante e posse dos tecidos nervosos que podem sobreviver sob condições de hipóxia,2,3,4 . Usá-los para experimentação não ameaçam seus números e com esforço mínimo, preparações eletrofisiológicas podem permanecer viáveis sobre durações estendidas, contanto que 18 horas5,6. O benefício é semelhante a vantagem de usar animais invertebrados como lagostas7, que também têm a capacidade de suportar níveis baixos de oxigênio8.
Técnicas para medir os movimentos oculares:
Abordagens para medir os movimentos oculares em animais frontal olhos usando primatas não-humanos têm sido bem desenvolvido9. O olho gira na órbita em torno de três eixos: horizontal, vertical e torção. O método de bobina de pesquisa magnética é geralmente considerado o mais confiável para a medição de rotações, mas é invasivo, exigindo pequenas bobinas para ser inserido nos scleras de animais10,11. Sistemas baseados em vídeo também podem medir rotações e tem a vantagem de ser não-invasivo. O desenvolvimento de melhores câmeras junto com processamento de imagem inovadoras melhoraram sua funcionalidade fazendo sistemas baseados em vídeo uma alternativa atraente para considerar12,13,14.
As técnicas desenvolvidas para medir os movimentos oculares em nonmammals foram muito menos significativas. Medidas são também baixa resolução ou descrevem apenas algumas das rotações15,16,17,18. A falta de desenvolvimento pode ser parcialmente culpada sobre a dificuldade de nonmammals de treinamento a seguir alvos visuais. Embora os movimentos oculares têm sido bem estudados em slider vermelho-eared tartarugas19,20,21,22,23,24,25 ,26,27,28,29,30, por causa do desafio em animais do treinamento para rastrear alvos, a precisa cinemática dos seus movimentos de olho é mal Entendido.
Tartarugas-de-orelha-vermelha deslizante são geralmente consideradas vertebrados lateral de olhos, mas porque eles totalmente podem retrair suas cabeças em sua concha31, oclusão significativa dos campos visual laterais por carapaça ocorre32. O resultado é que sua linha de visada visual é forçada em direção à frente, tornando-os se comportar mais como mamíferos olhos frontais. Portanto, seu uso como um modelo para o desenvolvimento de abordagens para medir os movimentos oculares também oferece uma perspectiva evolutiva única.
O protocolo descrito neste trabalho utiliza uma preparação cabeça em vitro isolado para identificar a cinemática do movimento de olho em tartarugas-de-orelha-vermelha deslizante. Cérebros são dissecados de crânios deixando os nervos cranianos intacta. Cabeças são colocadas em um giroscópio para calibrar os movimentos oculares e evocar respostas pela estimulação elétrica dos nervos cranianos que inervam os músculos oculares. Medidas de rotações pelos olhos são feitas por um sistema baseado em vídeo, usando algoritmos de software, que acompanhar a pupila escura e as marcas da íris. A preparação fornece a oportunidade de medir cinemática de ambos extra-oculares (i.e., horizontal, vertical e torcional rotações)32 e intra-ocular (ou seja, alterações de aluno)33 movimentos.
Modelo de sistema para análise de caminhos neurais eferentes:
Em geral, a abordagem fornece os investigadores a oportunidade de estudar os sinais neurais eferentes como gerar movimentos oculares quando os músculos começam de seus Estados descontraídos e na ausência de informações sensoriais integradas processadas pelo cérebro32, 33. Portanto, a cinemática do olho pode ser examinada em um sistema modelo no qual são tratados exclusivamente por via neural eferente, deixando o cérebro e synapsing para os músculos.
Protocolo
Nota: As tartarugas-de-orelha-vermelha deslizante, tanto masculinas como femininas, foram compradas de um fornecedor. As tartarugas foram alojadas em uma suíte de animal quente contendo duas cubas de 60 galões equipadas com ilhas de tijolo para bronzear-se sob luzes infra-vermelhas 250-W. O ambiente manteve-se em um ciclo claro/escuro de 14/10-h com a temperatura da água a 22 ° C. As luzes foram ligadas às 06:00 e desligadas às 20:00. Os tanques equipados com sistemas de filtragem foram limpos semanalmente, e tartarugas foram alimentadas ad libitum com todos os outros dias. Os cuidados de slider vermelho-eared tartarugas e todos os seguintes procedimentos experimentais descritos aqui32,33 foram aprovados pelos cuidados institucionais do Animal e uso Comité (IACUC) na faculdade de Lafayette.
1. equipamento instalação
- Prepare a solução de Ringer de tartaruga. Adicione o seguinte a água destilada, nesta ordem: cloreto de sódio 96,5 mM (58.44 g/mol), cloreto de potássio (74.56 g/mol), de 2,6 mM 2,0 mM (203.31 g/mol), bicarbonato de sódio 31,5 milímetros (84.01 g/mol), dextrose 20,0 mM (180.16 g/mol), do cloreto de magnésio concentrado ácido clorídrico para ajustar o pH a 7.51 e 4,0 mM (110.98 g/mol), de cloreto de cálcio (ver Tabela de materiais). Misture a solução, enquanto a adição de cada sal.
Atenção: O HCl concentrado é perigosos (riscos de pele, olhos, inalação e ingestão). - Fazer dicas para os eletrodos de sucção de 5 cm de comprimento capilar de vidro (veja a Tabela de materiais), por fogo-polimento para diferentes tamanhos de diâmetro interno para acomodar os nervos cranianos de espessura variável.
- Use um pequeno arquivo para gravar uma linha através de uma peça de vidro capilar. Coloque em papel absorvente e quebrar ao meio.
- Lentamente uma das extremidades do vidro capilar entra a chama de um bico de Bunsen. Examinar periodicamente a ponta para tamanho, suavidade e simetria usando uma dissecação do escopo e uma luz de fibra óptica de origem (ver Tabela de materiais).
Nota: Para as tartarugas com larguras de cabeça entre 20 e 30 mm, diâmetro interno de encaixe ideal tamanhos normalmente variam de 0,4 a 0,8 mm para o nervo oculomotor (nIII), 0.3 a 0.6 mm para o nervo troclear (NVI) e 0,2 a 0,4 mm para o nervo abducente (nVI).
- Limpar e organizar ruginas, uma sonda de dissecção romba, micro-tesouras, pinça fina, pinça curvada e uma alça para bisturi com lâminas (ver Tabela de materiais) para a dissecação.
Nota: A esterilização dos instrumentos é opcional.
2. anestesia e eutanásia
- Lugar da tartaruga em um gelo balde para 60 min para cryoanesthetize isso.
- Eutanásia a tartaruga por decapitação usando uma guilhotina de pequena animal (ver Tabela de materiais).
- Separando cuidadosamente as mandíbulas do animal aberto com uma pequena espátula de pesagem para que um gancho pode ser inserido e virou-se para caber sob a ponta da mandíbula superior.
- Puxe com uma pressão constante para estender a cabeça do animal através da guilhotina. Rapidamente decapitar o animal.
- Coloque a cabeça de tartaruga em um prato de dissecação. Tenho solução de Ringer suficiente tartaruga na mão para irrigar os tecidos. Oxigenar a solução com O 95/52/CO2 (ver Tabela de materiais).
- Manter o tecido a 4 ° C, colocando gelo do lado de fora do prato.
3. dissecação
- Use o escopo de dissecação com uma fonte de luz da fibra óptica para realizar a dissecação.
- Remova o maxilar inferior. Coloque uma sonda de dissecção romba através da boca para fornecer mais fácil manipulação da cabeça. Corte a articulação conectando o osso dentário ao crânio com um bisturi. Use ruginas para puxar a mandíbula inferior do crânio. Use ruginas para retirar a pele e os músculos dos seus anexos nas regiões dorsal e lateral do crânio.
- Remova a coluna vertebral.
- Identifica a coluna vertebral na extremidade caudal do crânio. Curvatura da coluna vertebral ventralmente para expor a medula espinhal. Use micro-tesouras para cortar a medula espinhal. Use ruginas para remover a coluna vertebral e outros tecidos de crânio puxando caudalmente.
- Retire o cérebro do crânio depois de cortar os nervos cranianos.
- Começando com o foramen magnum, use ruginas para cortar duas incisões no crânio dorsal. Faça cortes superficiais para não danificar o cérebro abaixo.
- Use ruginas para cuidadosamente Retire o crânio dorsal. Use micro-tesouras para remover o meninx para expor o resto do cérebro. Remover o suficiente meninx até os bulbos olfatórios, na cavidade craniana anterior, pode ser identificados (ver figura 1A). Continue a irrigar o cérebro com solução de Ringer de tartaruga, conforme necessário.
- Use pinça curva suavemente puxe o encéfalo caudalmente e produzir ligeira tensão nos nervos cranianos. Cuidadosamente, corte e retire os bulbos olfatórios e cérebro com pinça curvada.
- Use micro-tesouras para empurrar suavemente o mesencéfalo em direção à linha média para expor os nervos cranianos; nIII, cerca de 0,6 mm, pode ser visto na frente da nIV, e o diâmetro da NVI será ligeiramente inferior a nIII. Corte nIII e nIV onde eles atribuem ao mesencéfalo (ver figura 1B). Repita isto do outro lado.
- Corte o esquerda e direito nervo óptico (nII) com micro-tesouras. Em seguida, incline o tronco cerebral para um lado. Observar a nVI emergindo a superfície ventral perto da junção da ponte e a medula (ver Figura 1); o diâmetro da nVI é pequeno e aproximadamente 0,3 mm... cortar tanto a nVI esquerdo e direito.
- Remova as restantes partes do tronco cerebral a tartaruga com micro-tesouras e pinça fina. Uma vez que o crânio está vazio, examine o assoalho da cavidade craniana. Identifica nIII, nIV e nVI.
- Remova as olho-tampas superiores e inferiores com pinça fina e micro-tesouras.
4. calibração dos movimentos oculares
- Use uma tabela rígida (consulte a Tabela de materiais) para apoiar a colocação do Cardan e outros instrumentos. Coloque a cabeça da tartaruga no mandril gimbal para que a superfície dorsal da cabeça é paralela ao horizonte usando um pequeno nível de bolha repousando sobre o crânio. Mais ou menos posição dentre os olhos no centro das rotações de horizontal e vertical do giroscópio.
- Coloque a câmera infravermelha, equipada com uma luz infravermelha emitida por diodo (LED), que é a parte do olho em vídeo sistema de rastreamento (ver Tabela de materiais), em uma distância de aproximadamente 12 cm do olho da tartaruga.
- Ângulo de 45 graus acima da linha de visão do olho da câmera. O LED deve estar na posição de 11:00 quando se olha para a lente da câmera. Centro do LED ao longo do eixo óptico do olho. A câmera será ligeiramente fora do eixo (como vista de cima do olho).
- Ajuste a distância da câmera do olho para que a visão da câmera é maximamente preenchida pelo globo ocular. Certifique-se de que os cantos dos olhos (canthi) estão nas bordas da vista horizontal.
- Conecte a câmera ao olho em vídeo sistema para processar os dados de rastreamento. Dividi o sinal para um gravador de DVD para capturar o vídeo cru. Foco da câmera para obter uma imagem clara do olho. Cuide-se bem-posição do olho no centro da visão da câmera usando os três graus de ajuste linear (x, y, z) fornecido com o cardan.
- Detecta a pupila escura, definindo o limite e o contraste usando adequadamente o programa fornecido com o olho em vídeo, sistema de rastreamento.
- Usando o mouse, clique no menu "Vídeo" e em "Mode" selecione "Alta precisão" para capturar imagens a uma taxa de amostragem de 30 Hz (resolução de linhas 640 pixéis x 480). Também em "Vídeo", selecione "Aluno negro" para "Tipo de aluno" e "Elipse (elipse girada)" para "Método de segmentação do aluno".
- Na janela "EyeCamera", clique no ícone "Aluno Pesquisar área ajuste" (pequeno retângulo vertical com um ponto no centro). Use o mouse para arrastar um retângulo que limita uma área em torno da pupila. Evite áreas escuras que poderiam ser confundidas com o aluno.
- Na janela de "Controles", confirma que as caixas para "Autoimagem" e "controle de limite de bloqueio positivo" são verificadas. Clique em "Auto-Threshold" para otimizar a densidade de varredura, que mostrará como pontos verdes sobre a pupila escura.
- Calibre o video-display do olho em vídeo programa de rastreamento para as rotações do gimbal 12,5 ° (+ /-), em torno de seu eixo horizontal e 10 ° (+ /-) ao redor de seu eixo vertical.
- Na janela de "Controles", clique em "Exibir". Verifique as caixas em "Olhar" e "Stim" "ponto olhar", "Região de Calib" e "Grade de geometria". Depois de verificar as caixas em "Grade de geometria", uma janela pop-up e dizer, "a geometria do visor de estímulo deve ser medida antes que a grade de geometria pode ser exibida. Deseja fazer isso agora?" Selecione "Y" para Sim.
- Usando o mouse, clique no menu "Windows" e selecione "Estímulo". A janela de "Estímulo" se abrirá, mostrando um cruzamento de linha vertical e horizontal no centro do visor. Medir os comprimentos das linhas para o milímetro mais próximo. Pressione "Esc" no teclado para sair da janela de "Estímulo".
- Usando o mouse, clique no menu "Estímulo" e selecione "Configuração de geometria". Os comprimentos das linhas que foram medidos só de entrada. Ajuste a distância de visualização para que o graus/linha igual a 25 °, para a linha horizontal e 20 ° para a linha vertical. Clique no botão "Loja" e feche a janela.
- Na janela "EyeSpace", selecione o número de calibração "Ponto de dados" para ser "9". Com olhos da tartaruga está posicionado no centro, clique em centro de dados apontam em clique no botão "Re-presente".
Nota: Irá abrir a janela de "Estímulo" e "Get Ready" irá aparecer no centro da tela. Uma caixa irá aparecer no local do centro e depois desaparecem. Sobre seu desaparecimento, irá fechar a janela de "Estímulo". Agora deve ser calibrada a posição central. - Repita o procedimento girando o cardan direita/esquerda, +12,5-12,50% e para cima/para baixo + 10 /-10 ° para calibrar os restantes pontos de dados.
- Para calibrar a rotação torção, utilize o modelo de algoritmo fornecido com o olho em vídeo, programa de controle de encaixe. O algoritmo define uma posição zero com base nas marcações da íris e calcula o ângulo de rotação quando as marcas se tornam offset do centroide da pupila.
- Usando o ponteiro do mouse, clique no menu "Windows" e selecione "Torção". Clique no botão "START" na janela "Torção". Na janela "EyeCamera", um arco aparecerá sobre a imagem do olho.
- Ajuste o ângulo, o raio e o comprimento do arco usando os controles deslizantes em um local onde marcas irregulares estão presentes na íris. Marque as caixas "Gráficos em tempo real" e "Auto-Set após ajustar". Se necessário, ajustar o brilho e contraste na janela de controles e re-limite o aluno escuro (ver passo 4). Clique no botão "Modelo de conjunto".
- Coloque uma régua no mesmo plano focal como a pupila e registre a largura de visão da câmera completo. O valor vai ser usado mais tarde para determinar a largura real da pupila.
5. posicionamento do eletrodo de sucção no nervo craniano para evocar os movimentos oculares
- Cuidadosamente coloque um eléctrodo de referência de pin no tecido conjuntivo ou muscular remanescente na cabeça.
- Coloque o eletrodo de sucção (ver Tabela de materiais) no nervo craniano usando um micromanipulador e dissecação escopo montado em um "boom". Use uma fonte de luz da fibra óptica para visualizar e orientar a colocação.
- Corresponde ao tamanho de uma lata de uma capilar de vidro de ponta. Tentativa e erro é necessário para obter um melhor ajuste ao redor do diâmetro de um nervo (consulte a etapa 1.2 para recomendações de tamanho). Coloque a ponta de vidro para o eletrodo de sucção. Encha o eletrodo de sucção com solução de Ringer e ajustar o volume dentro da seringa para cerca metade da sua capacidade.
- Cuidadosamente, mova a ponta de vidro do eletrodo usando o micromanipulador para uma posição acima da extremidade de corte do nervo selecionado. Certifique-se que a solução de Ringer preenche o crânio e a ponta está abaixo de sua superfície. Se necessário, use argila de modelagem para barragem locais onde solução de Ringer está vazando para fora do crânio.
- Puxe o êmbolo da seringa.
Nota: O vácuo desenhará o nervo na extremidade da ponta do capilar. Um bom ajuste é indicado pelo nervo permanece dentro da ponta com pouco ou nenhum vácuo adicional aplicado.
6. a estimulação dos nervos cranianos e análise dos movimentos oculares
- Use um estimulador de nervo/músculo de propósito geral com um dispositivo de isolamento de corrente (consulte a Tabela de materiais) para estimular o nervo craniano através do eletrodo de sucção.
- Conecte o eletrodo de sucção para o atual dispositivo de isolamento usando um cabo. Ligue a ponta do eléctrodo de referência do pino para a conexão de terra do dispositivo de isolamento.
- Selecione parâmetros das correntes usando os mostradores e interruptores no dispositivo estimulador e isolamento. Use uma variedade de correntes de 1 a 100 µA, com frequência de 10 a 400 que Hz. Use 1 - ou 2-ms pulsa em trens duração de 100, 500 ou 1.000 ms.
- Recorde o timing de estímulos.
Nota: Os pulsos de lógica-Transistor-transistor (TTL) são sincronizados com as entregas das correntes de estimulador e comunicar em tempo real através de um cabo para canais de entrada do olho em vídeo sistema de rastreamento. Um módulo de software fornecido com o olho em vídeo, controles de programa de controle da comunicação.- Para visualizar o calendário das aplicações atuais e sua influência sobre os movimentos oculares, clique no menu "PenPlots". Selecione "Posição X olhar", "Posição de olhar Y", "Torção" e "Aluno largura" para mostrar em tempo real dados brutos parcelas X e Y posições, torsão e largura da pupila do olho. Também selecione os marcadores de &"segundos" do menu "PenPlots" para mostrar uma trama de sincronismo com marcas de escala, que aparecem em intervalos de 1 s.
Nota: A letra maiuscula "T" aparecerá marcando o início do pulso TTL, ocorrendo simultaneamente com o aplicativo atual. - Para armazenar os dados dos movimentos oculares evocados por correntes, clique no menu "Arquivo" e selecione "Novo arquivo de dados" em "Dados". Um nome de arquivo de entrada e pressione "Enter". Salvando dados podem ser pausados e reiniciado usando a combinação de comandos chaves, "Ctrl" + "p". Quando uma sessão experimental é concluída, selecione "Fechar arquivo de dados" do menu "Arquivo" em "Dados".
- Para ajudar a manter o controle do tipo de correntes aplicadas, clique no menu "Windows" e selecione o "Bloco de dados". Aparecerá a janela de "Teclado/DataMarker". Clique em uma letra ou um número para identificar parâmetros das estimulações atuais sendo entregues ao nervo.
Nota: por exemplo, "X" poderia estar para 10 µA. clicar em "X" armazena sua entrada no arquivo de dados em tempo real para análise post hoc . Parece também sobre o "PenPlot" para "Segundos & marcadores" para observação em curso.
- Para visualizar o calendário das aplicações atuais e sua influência sobre os movimentos oculares, clique no menu "PenPlots". Selecione "Posição X olhar", "Posição de olhar Y", "Torção" e "Aluno largura" para mostrar em tempo real dados brutos parcelas X e Y posições, torsão e largura da pupila do olho. Também selecione os marcadores de &"segundos" do menu "PenPlots" para mostrar uma trama de sincronismo com marcas de escala, que aparecem em intervalos de 1 s.
- Analise os dados do sistema de rastreador de olho.
- Abra o arquivo de dados salvos, que está em um formato de texto delimitado, em um programa de folha de propagação de escolha para organizar os dados e realizar análise estatística.
- Converta os valores de largura de aluno armazenados no arquivo real tamanhos em mm.
- Converter os valores de X e Y do olho posições e torções para unidades de grau e use convenções para descrever os movimentos oculares; Portanto, sentidos positivos de rotações: intorsion, elevação e adução; e negativos sentidos de rotações: rapto, extorsão e depressão.
- Copie as informações de cabeçalho para uma nova planilha. Isto irá incluir valores para o tamanho da tela (largura e altura) e a distância de visualização. Oito colunas de dados coletados em uma taxa de 30 Hz seguirá abaixo as informações de cabeçalho.
- Volte para a planilha que contém os dados brutos. Fazer um "achado" por "X" na última coluna intitulada "Marcador" para localizar onde o estímulo foi aplicado com 10 µA. Find incidência de "T", marcando o início da estimulação atual. Copiar de 15 linhas (0,5 s) de dados ocorram antes do "T" e 90 quadros após "T" (3.0 s); ou seja, total de s 3.5. Cole os dados na nova planilha abaixo as informações de cabeçalho.
- Inserir uma coluna em branco depois de "PupilWidth". Na coluna em branco, converta-se à dimensão calibrada em milímetros:
Diâmetro da pupila horizontal = × "PupilWidth" a dimensão da largura de exibição da câmera - Inserir 2 colunas em branco depois de tanto "X_Gaze" e "Y_Gaze". Normalizar as posições para as dimensões da tela de visualização: coordenadas (0, 0), no topo esquerdo de estender a tela (1, 1) no canto inferior direito. Na primeira coluna em branco, traduzir posições para ter um sistema de coordenadas (0, 0) no centro da tela. Incluem a conversão para as dimensões da tela em milímetros:
X = (0,5 × largura) – ("X_Gaze" × largura); Y = (0,5 x altura) – ("Y_Gaze" × altura)
Nota: A sequência de operação é para o olho esquerdo. A sequência precisará ser revertido para o olho direito para seguir a Convenção de negatividade por rapto e positividade para adução. - A segunda colunas, use trigonometria funções para converter para (°) os ângulos de rotação:
rotação horizontal = arctan (Xdistância /viewing); rotação vertical = arctan (Y/viewing distância) - Torsão já é mostrada em unidades de graus, mas para adequar-se à Convenção de positividade para intorsion, se a medição é feita sobre o olho esquerdo, multiplique por -1. Para o olho direito, a multiplicação não é necessária. O programa códigos rotação no sentido horário como positivo.
- Traça o diâmetro da pupila e rotações em função do tempo.
- Abra o arquivo de dados salvos, que está em um formato de texto delimitado, em um programa de folha de propagação de escolha para organizar os dados e realizar análise estatística.
Resultados
A Figura 1 mostra fotografias de imagens tiradas de um vídeo descrevendo a dissecação. Imagens fornecem lugares típicos dos nervos antes da corte do cérebro.
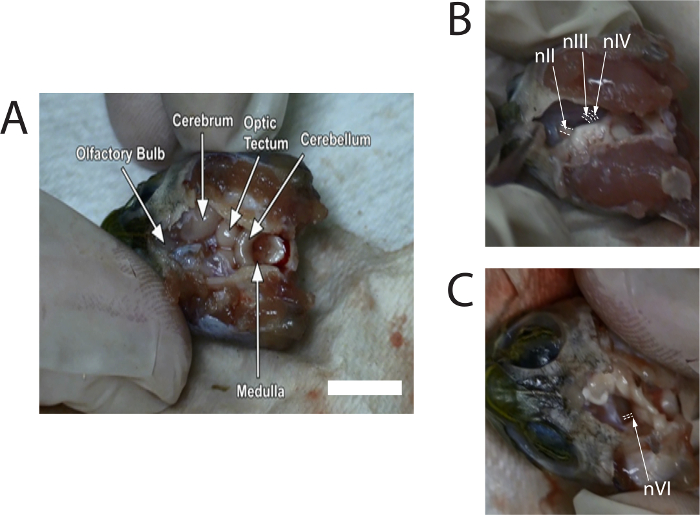
Figura 1: Stills de imagens capturadas do vídeo da dissecação para mostrar a localização do nervo óptico (nII), nervo oculomotor (nIII), nerv...
Discussão
Passos críticos:
Os passos críticos neste protocolo são os seguintes: 1) a dissecção e o cuidado de manter a viabilidade dos nervos necrosante; 2) a correspondência de tamanhos pelos eletrodos de sucção para os nervos cranianos para fornecer respostas consistentes; e 3) o posicionamento da cabeça no cardan para fornecer a calibração adequada das rotações do olho.
Solução de problemas:
A dissecação pode ser desafiador, mas depoi...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores Obrigado Sra. Paulette McKenna e Lisa Pezzino neste estudo para apoio de secretariado e Mr. Phil Auerbach para suporte técnico. Os autores também agradecer os Drs Michael Ariel e Michael S. Jones (Saint Louis University School of Medicine) por nos apresentar a preparação cabeça em vitro isolado. Financiamento apoio desta colaboração foi fornecido pelo departamento de biologia (Robert S. Chase Fund), o Comité de investigação académica e programa de neurociência da faculdade de Lafayette. Por último, este trabalho é dedicado ao Sr. Phil Auerbach, que faleceu a 28 de setembro de 2016; Ele descomissionado um microscópio eletrônico de varredura e reconhecida a utilidade de seu estágio de 5 eixos para uso no presente protocolo. Fará falta muito sua amizade e desenvoltura.
Materiais
| Name | Company | Catalog Number | Comments |
| Red-eared slider turtles | Kons Scientific | Trachemys scripta elegans | Large size (carapace length 15-20 cm) |
| Sodium chloride | Sigma-Aldrich Co. LLC. | S5886 | |
| Potassium chloride | Sigma-Aldrich Co. LLC. | P5405 | |
| Magnesium choride | Sigma-Aldrich Co. LLC. | M7304 | |
| Sodium bicarbonate | Sigma-Aldrich Co. LLC. | S5761 | |
| Dextrose | Sigma-Aldrich Co. LLC. | C5767 | |
| Concentrated hydrochloric acid | Sigma-Aldrich Co. LLC. | H7020 | |
| Calcium chloride | Sigma-Aldrich Co. LLC. | C7902 | |
| pH meter | Oakton | pH 6+ | |
| Suction stimulation electrode | A-M Systems | 573000 | Bipolar suction electrode. Note that 573000 has been replaced with 573050. |
| Capillary glass | A-M systems | 626000 | Single-barrel borosilicate capillary glass without microfilament, length 10 cm, outside diameter 1.0 mm, inner diameter 0.50 mm |
| Alternative suction stimulation electrode | A-M Systems | 573050 | Bipolar suction electrode. Requires larger diameter capillary glass: 627000, outside diameter 1.2 mm, inner diameter 0.68 mm |
| Stereoscope | Lieca | GZ7 | Magnification range, 10x – 70x |
| Fiber optic light source | Amscope | HL250-A | 150W Fiber optical microscope illuminator light box |
| Rongeurs | Carolina Biological Supply Company | 625654 | stainless steel, straight spring, 5.25" |
| Blunt dissection probe | Carolina Biological Supply Company | 627405 | Huber mall probe, double-ended probe and seeker, 6" |
| Microscissors | Carolina Biological Supply Company | 623555 | Iris microdissecting scissors, stainless steel, 0.5" blades, 4.75" long |
| Fine forceps | Sigma-Aldrich Co. LLC. | F6521 | Jewelers forceps, dumont No. 5, inox alloy, 4.25" |
| Curved forceps | Sigma-Aldrich Co. LLC. | Z168696 | Medium tip, curved forceps, stainless steel, 4" |
| Scalpel handle | Sigma-Aldrich Co. LLC. | S2896 | Scalpel handles, No. 3, stainless steel |
| Scalpel blade | Sigma-Aldrich Co. LLC. | S2771 | Scalpel blades, No. 11, steel |
| Guillotine | Harvard Apparatus | 73-1918 | Kleine guillotine type 7575 |
| Spatula | Sigma | Z648299 | Micro spoon and spatula weighing set. Use small spatula: 5.9” long x 0.07” diameter handle with square end: 0.17” x 1.3” long, other end round: 0.17” x 1.27” long |
| Hook | Autozone | 98069 | SureBilt hook and pick set. Use grinder to dull sharp points of hook to prevent injury to animals mouth. |
| 95/5% O2/CO2 | Airgas, Inc. | X02OX95C2003102 | 5% Carbon dioxide balance oxygen certified standard gas mixture, size 200 Cylinder, CGA-296 |
| Regulator | Airgas, Inc. | Y11244D296-AG | Single stage brass 0-100 psi analytical cylinder regulator CGA-296 with needle outlet. Use brass adjustable airline pipe valve to go from 3/8", inner diameter, vinyl airline tubing connected to regulator to a 3/16", inner diameter, airline connection going to airstone or glass pasteur pipette. |
| Adjustable airline pipe valve | Doctors Foster and Smith | CD-12061 | Brass valve |
| Rigid table | Unknown | Unknown | Auto-clave door laid on top of a sturdy table. Nine 5" diameter tennis balls isolate vibrations from the top surface of the table. |
| 5" tennis ball | Petco Animal Supplies, Inc. | 712868 | Petco Jumbo Pet Tennis Ball: balls are unsliced and held within an integrated frame on the underside part of the autoclave door. |
| Alternative vibration isolation table | Newport Corporation | INT1-36-6-N | Rigid vibration control system, integrity 1: Surface dimensions, 3' x 6' |
| Gimbal | ISI, International Scientific Instruments, Inc. | Stage from SUPER III-A Scanning EM | 5-axis eucentric stage: X, Y, and Z linear movements, ±20 mm, 0.1 mm precision; Rotations, vertical, ±10°, and horizontal, ±12.5°, with 1.25° precision. Note: from decommission instrument. |
| Chuck for gimbal | Unknown | Unknown | Chuck from an old microtome of unknown manufacture was machined to fit the shaft of the specimen holder of the Scanning EM stage |
| Alternative gimbal | ThorLabs, Inc. | GN2/M with MBT602/M | Dual-axis goniometer (GN2/M) mounted on 3-axis microblock stage with thumbscrew adjusters (MBT602/M): design a chuck to hold turtle head with eye at 12.7 mm above top surface of goniometer (distance to point of rotation) |
| Video-based eye tracking system | Arrington Research, Inc. | ViewPoint EyeTracker, PC-60 | Tracking method: Infrared video by dark pupil; Black and white camera (Item BC02): 30 Hz, 640 x 480; System requirements: Windows 2000, XP, 7, 8, 8.1, 10; Visual range: Horizontal +/- 44°; vertical +/- 20°; Accuracy ~0.5°; Spatial resolution ~0.15°; Pupil size resolution ~0.03 mm; Eye data: X, Y position of gaze, pupil height and width, torsion, delta time, total time, and regions of interest (ROI); Real-time communication (Item 0022): 4-Channel AnalogOut with eight TTL input channels to mark codes into the data file |
| Multi-position magnetic base | Harbor Freight Tools | Pittsburg, item #5645 | Magnetic holder reaches up to 12" and produces 45 lbs. of magnetic pull. Use to position camera. Machine thread holes onto the end of the rod to mount cameras. |
| Micromanipulator | Kopf | 900 | 5 axis manipulation for mount of suction electrode: X, Y, Z linear travel, 2 axis of rotation |
| Dissection scope on boom | Lieca | GZ6 | Magnification range, 6.7x – 40x |
| Nerve/muscle stimulator | Astro-Med Grass Telefactor | Grass S88 | Dual pulse voltage stimulator: two output channels that can be operated independently or synchronized to generate non-isolated constant voltage pulses (10 mv to 150 V). Pulses can be single (10 μsec to 10 sec), repetitive (0.01 Hz to 1 KHz), and trains (1 ms to 10 s) and synchronized with TTL inputs and output. Send TTL outputs via the output channels of a DB25 connector to the TTL input channels of the ViewPoint EyeTracker. Note: Astro-Med Grass Telefactor is no longer in business. |
| Current isolation device | Astro-Med Grass Telefactor | PSIU6 | Current stimulus isolation unit: enables safe delivery of constant currents by the S88 to the preparation. The PSIU6 connects by a BNC cable to one of the output channels of the S88. Multiplier switches on the PSIU6 allow the S88 to generate a wide array of current amplitudes ranging from 0.1 µA to 15 mA. |
| Alternative nerve/muscle stimulator with isolation | A-M Systems | 2100 | Isolated Pulse Stimulator: Unit has built-in isolator to produce constant currents. |
Referências
- Kikillus, K. H., Hare, K. M., Hartley, S. Minimizing false-negatives when predicting the potential distribution of an invasive species: A bioclimatic envelope for the red-eared slider at global and regional scales. Anim Conserv. 13, 5-15 (2010).
- Lutz, P. L., Rosenthal, M., Sick, T. J. Living without oxygen: turtle brain as a model of anaerobic metabolism. Mol Physiol. 8, 411-425 (1985).
- Lutz, P. L., Milton, S. L. Negotiating brain anoxia survival in the turtle. J Exp Biol. 207, 3141-3147 (2004).
- Storey, K. B. Anoxia tolerance in turtles: Metabolic regulation and gene expression. Comp Biochem Physiol A-Mol Integr Physiol. 147 (2), 263-276 (2007).
- Granda, A. M., Dearworth, J. R., Subramaniam, B. Balanced interactions in ganglion-cell receptive fields. Vis Neurosci. 16, 319-332 (1999).
- Dearworth, J. R., Granda, A. M. Multiplied functions unify shapes of ganglion-cell receptive fields in retina of turtle. J Vis. 2 (3), 204-217 (2002).
- Nesbit, S. C., Van Hoof, A. G., Le, C. C., Dearworth Jr, J. R. Extracellular recording of light responses from optic nerve fibers and the caudal photoreceptor in the crayfish. J Undergrad Neurosci Educ. 14 (1), A29-A38 (2015).
- McMahon, B. R. Respiratory and circulatory compensation to hypoxia in crustaceans. Resp Phsiol. 128 (3), 349-364 (2001).
- Leigh, R. J., Zee, D. S. . The neurology of eye movements. , (1999).
- Robinson, D. A. A method of measuring eye movement using a scleral search coil in a magnetic field. IEEE Trans Biomed Eng. 10, 137-145 (1963).
- Judge, S. J., Richmond, B. J., Chu, F. C. Implantation of magnetic search coils for measurement of eye position: an improved method. Vis Res. 20, 535-538 (1980).
- Ong, J. K. Y., Halswanter, T. Measuring torsional eye movements by tracking stable iris features. J Neurosci Meth. 192, 261-267 (2010).
- Kimmel, D. L., Mammo, D., Newsome, W. T. Tracking the eye non-invasively: simultaneous comparison of the scleral search coil and optical tracking techniques in the macaque monkey. Front Behav Neurosci. 6 (49), 1-17 (2012).
- Otero-Millan, J., Roberts, D. C., Lasker, A., Zee, D. S., Kheradmand, A. Knowing what the brain is seeing in three dimensions: A novel, noninvasive, sensitive, accurate, and low-noise technique for measuring ocular torsion. J Vis. 15 (14), 1-15 (2015).
- Demski, L. S., Bauer, D. H. Eye movements evoked by electrical stimulation of the brain in anesthetized fishes. Brain Behav Evol. 11, 109-129 (1975).
- Gioanni, H., Bennis, M., Sansonetti, A. Visual and vestibular reflexes that stabilize gaze in the chameleon. Vis Neurosci. 10, 947-956 (1993).
- Straka, H., Dieringer, N. Basic organization principles of the VOR: lessons from frogs. Prog Neurobio. 73 (4), 259-309 (2004).
- Voss, J., Bischof, H. -. J. Eye movements of laterally eyed birds are not independent. J Exp Biol. 212 (10), 1568-1575 (2009).
- Ariel, M. Independent eye movements in the turtle. Vis Neurosci. 5, 29-41 (1990).
- Ariel, M., Rosenberg, A. F. Effects of synaptic drugs on turtle optokinetic nystagmus and the spike responses of the basal optic nucleus. Vis Neurosci. 7, 431-440 (1991).
- Balaban, C. D., Ariel, M. A "beat-to-beat" interval generator for optokinetic nystagmus. Biol Cybern. 66, 203-216 (1992).
- Keifer, J. In vitro eye-blink reflex model: Role of excitatory amino acid receptors and labeling of network activity with sulforhodamine. Exp Brain Res. 97, 239-253 (1993).
- Keifer, J., Armstrong, K. E., Houk, J. C. In vitro classical conditioning of abducens nerve discharge in turtles. J Neurosci. 15, 5036-5048 (1995).
- Rosenberg, A. F., Ariel, M. A model for optokinetic eye movements in turtles that incorporates properties of retinal slip neurons. Vis Neurosci. 13, 375-383 (1996).
- Ariel, M. Open-loop optokinetic responses of the turtle. Vis Res. 37, 925-933 (1997).
- Anderson, C. W., Keifer, J. Properties of conditioned abducens nerve responses in a highly reduced in vitro brainstem preparation from the turtle. J Neurophysiol. 81, 1242-1250 (1999).
- Keifer, J. In vitro classical conditioning of the turtle eyeblink reflex: Approaching cellular mechanisms of acquisition. Cerebell. 2, 55-61 (2003).
- Zhu, D., Keifer, J. Pathways controlling trigeminal and auditory nerve-evoked abducens eyeblink reflexes in pond turtles. Brain Behav Evol. 64, 207-222 (2004).
- Jones, M. S., Ariel, M. The effects of unilateral eighth nerve block on fictive VOR in the turtle. Br Res. 1094, 149-162 (2006).
- Jones, M. S., Ariel, M. Morphology, intrinsic membrane properties, and rotation-evoked responses of trochlear motoneurons in the turtle. J Neurophysiol. 99 (3), 1187-1200 (2008).
- Krenz, J. G., Naylor, G. J. P., Shaffer, H. B., Janzen, F. J. Molecular phylogenetics and evolution of turtles. Mol Phylogenet Evol. 37 (1), 178-191 (2005).
- Dearworth, J. R., et al. Role of the trochlear nerve in eye abduction and frontal vision of the red-eared slider turtle (Trachemys scripta elegans). J Comp Neur. 52, 3464-3477 (2013).
- Dearworth, J. R., et al. Pupil constriction evoked in vitro by stimulation of the oculomotor nerve in the turtle (Trachemys scripta elegans). Vis Neurosci. 26, 309-318 (2009).
- Mead, K., et al. IFEL TOUR: a description of the introduction to FUN electrophysiology labs workshop at Bowdoin College, July 27-30, and the resultant faculty learning community. J Undergrad Neurosci Educ. 5, A42-A48 (2007).
- Jackson, D. C., Ultsch, G. R. Physiology of hibernation under the ice by turtles and frogs. J Exp Zool A Ecol Genet Physiol. 313 (6), 311-327 (2010).
- Romano, J. M., Dearworth, J. R. Pupil constriction evoked by stimulation of the ciliary nerve in the red-eared slider turtle (Trachemys scripta elegans). J Penns Acad Sci. 85, 4-8 (2011).
- Miller, J. M., Robins, D. Extraocular-muscle forces in alert monkey. Vis Res. 32, 1099-1113 (1992).
- Gamlin, P. D., Miller, J. M. Extraocular muscle motor units characterized by spike-triggered averaging in alert monkey. J Neurosci Meth. 204, 159-167 (2011).
- Quaia, C., Ying, H. S., Optican, L. M. The Viscoelastic properties of passive eye muscle in primates. III: Force elicited by natural elongations. PLOS ONE. 5, A236-A254 (2010).
- Anderson, S. R., et al. Dynamics of primate oculomotor plant revealed by effects of abducens microstimulation. J Neurophys. 101, 2907-2923 (2009).
- Maxwell, J. H., Harless, M., Morlock, H. Anesthesia and surgery. Turtles: Perspective and Research. , 127-152 (1979).
- AVMA Panel on Euthanasia. American Veterinary Medical Association. J Am Vet Med Assoc. 218 (5), 669-696 (2001).
- Clarke, R. J. Shaping the pupil's response to light in the hooded rat. Exp Br Res. 176, 641-651 (2007).
- Bennett, R. A. A review of anesthesia and chemical restraint in reptiles. J Zoo Wild Med. 22 (3), 282-303 (1991).
- Bickler, P. E., Buck, L. T. Hypoxia Tolerance in Reptiles, Amphibians, and Fishes: Life with Variable Oxygen Availability. Ann Rev Physiol. 69, 145-170 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados