Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Глазной кинематики, измеряется в Vitro стимуляции черепных нервов в черепаха
В этой статье
Резюме
Этот протокол описывает использование головы подготовка в vitro изолированные черепаха для измерения кинематика их движений глаз. После удаления мозга из черепной коробки могут стимулировать черепных нервов с токи для количественного определения поворотов глаз и изменения в размеры зрачка.
Аннотация
После того, как умерщвлены животных, их ткани начинают умирать. Черепахи предлагают преимущество из-за длительного времени выживания их тканей, особенно по сравнению с теплокровных позвоночных. Из-за этого в vitro эксперименты в черепах может выполняться продолжительное время расследовать нервные сигналы и контроля за их целевого действия. Использование изолированных головы подготовки, мы измерили кинематика движения глаз в черепах, и их модуляции электрических сигналов осуществляется черепных нервов. После мозг был удален из черепа, оставляемого черепных нервов, расчлененный головы был помещен в карданов подвес для калибровки движения глаз. Электроды стеклянные были прикреплены к черепных нервов (глазодвигательные, trochlear и отводящего) и стимулировали с токами вызывают движения глаз. Мы наблюдает движения глаз с инфракрасной видео, системы слежения и количественных вращений глаз. Импульсы тока с диапазоном амплитуды, частоты, и поезд длительности были использованы для наблюдения за влияние на ответы. Поскольку подготовка отделены от мозга, эфферентные пути собирается целевых мышц может быть рассмотрен в изоляции расследовать нейронных сигналов в отсутствие централизованной обработки сенсорной информации.
Введение
Обоснование использования Красноухая черепах в электрофизиологических экспериментов:
Красноухая черепахи (Красноухая scripta elegans), считаются одним из худших инвазивных видов в мире1 и может указывать, что экосистема находится в беде. Причина почему настолько успешным Красноухая черепахи плохо понял, но это может быть отчасти из-за их терпимая(ый) физиологии и владение нервной ткани, которые могут выжить в гипоксических условиях2,3,4 . Их использование для экспериментов не угрожают их числа и с минимальными усилиями, электрофизиологических препаратов может оставаться жизнеспособным в течение длительного длительностей, покуда 18 часов5,6. Преимущество похож на преимущество использования беспозвоночных животных, таких как Раки7, которые также имеют способность выдержать низкий уровень кислорода8.
Методы для измерения движений глаз:
Подходы к оценке движения глаз в лобной глазами животных, с использованием не человеческого приматов были хорошо развиты9. Глаз поворачивается на орбите вокруг трех осей: горизонтальные, вертикальные и кручения. Магнитные Поиск катушка метод обычно считается самым надежным для измерения оборотов, но является инвазивным, требующих небольших бухтах вставляется в склер животных10,11. Видео на основе системы также можно измерить вращений и преимущество неинвазивные. Разработка лучше камеры наряду с инновационной обработки повысили их функциональность, делая видео основанных систем привлекательной альтернативой для рассмотрения12,,1314.
Методы, разработанные для измерения движения глаз в nonmammals были гораздо менее значительными. Меры являются либо низким разрешением или описать только некоторые из замен15,16,17,18. Отсутствие развития может быть частично обвинен на трудность в учебных nonmammals следовать визуальных целей. Хотя движения глаз хорошо изучены в Красноухая черепахи19,20,21,,2223,24,25 ,26,27,28,29,30, из-за вызов в обучение животных для отслеживания целей, точные кинематика их движений глаз это плохо понимать.
Красноухая черепах обычно считаются боковых eyed позвоночных, но потому, что они могут полностью отказаться от их головы в их оболочки31, значительные окклюзии бокового поля зрения, панцирь происходит32. В результате получается, что их визуального линии визирования принуждается к передней, делая их ведут себя подобно лобной eyed млекопитающих. Таким образом их использования в качестве модели для разработки подходов для измерения движений глаз также предлагает уникальный эволюционной точки зрения.
Протокол, описанный в этой работе использует в vitro изолированы с головы подготовка для идентификации кинематика движения глаз в Красноухая черепах. Мозги разделяются из черепов, оставляя нетронутыми черепных нервов. Руководители помещаются в карданов подвес для калибровки движений глаз и вызывают ответы по электрической стимуляции черепных нервов, иннервирующих мышцы глаза. Меры вращений глазами выполняются системой на основе видео, используя программные алгоритмы, которые отслеживать темный зрачок и маркировку радужки. Подготовки обеспечивает возможность измерения кинематики обоих экстраокулярных (т.е., горизонтальные, вертикальные и крутильных ротаций)32 и интраокулярные (т.е., ученик изменения)33 движений.
Система модель для анализа эфферентные нервные пути:
В целом подход обеспечивает возможность учиться как эфферентные нервные сигналы генерации движения глаз, когда мышцы начинают от их расслабленной государства и в отсутствие интегрированной сенсорной информации, обработаны мозга32, следователи 33. Таким образом кинематика глаз может быть рассмотрен в модель системы, в которой они обрабатываются исключительно в эфферентной нейронные пути оставляя мозга и synapsing на мышцы.
протокол
Примечание: Красноухая черепахи, как мужчины, так и женщин, были приобретены у поставщиков. Черепахи были размещены в теплой животных люкс, содержащий два 60-галлон ванны оснащены кирпич острова для загорать под 250-W инфракрасный свет. Окружающей среде сохранялся на 14/10-h свет/темно цикла с температурой воды в 22 ° C. Огни были включены в 6:00 утра и выключен в 8:00 вечера. Танки оснащены системы фильтрации были очищены каждую неделю, и черепах кормили ad libitum каждый день. Забота о Красноухая черепах и все из следующих экспериментальных процедур описанных здесь32,33 были утверждены институциональный уход за животными и использования Комитет (IACUC) в Лафайет колледже.
1. Оборудование для установки
- Подготовьте раствор Рингера черепаха. Добавьте следующее к дистиллированной воды в таком порядке: натрия хлорид 96.5 mM (58.44 г/моль), хлорид калия 2.6 мм (74.56 г/моль), магния хлорид 2,0 мм (203.31 г/моль), натрия бикарбонат 31,5 мм (84.01 г/моль), декстроза 20,0 мм (180.16 г/моль), в основном Соляная кислота для регулировки рН 7,51 и хлорида кальция 4,0 мм (110.98 г/моль) (см. Таблицу материалы). Mix решение при добавлении каждого соли.
Предупреждение: Концентрированная HCl является опасной (кожи, глаз, вдыхании и попадании опасности). - Советы для всасывания электродов от 5-cm долго капиллярные стеклянные (см. Таблицу материалы), от пожара шлифовальные для различных размеров внутренних диаметров для того, чтобы вместить черепных нервов различной толщины.
- Используйте небольшой файл для etch линии через кусок капиллярного стекла. Место в папиросную бумагу и разорвать пополам.
- Медленно ролл один из концов капиллярные стеклянные в пламя горелки Бунзена. Периодически проверять подсказка для размера, гладкость и симметрии с помощью рассечение сферы и волоконно-оптический свет источника (см. Таблицу материалы).
Примечание: Для черепах с головы шириной между 20 и 30 мм, внутренний диаметр оптимальную установку размеров обычно колеблется от 0,4 до 0,8 мм для глазодвигательного нерва (НИИИ), 0,3-0,6 мм для Блоковый нерв (nIV) и 0,2 до 0,4 мм для отводящего нерва (НвИ).
- Чистота и организовать Rongeurs, тупым рассечение зонд, microscissors, тонкой щипцы, изогнутый пинцет и дескриптор скальпеля с лезвиями (см. Таблицу материалы) для рассечения.
Примечание: Стерилизации инструментов является необязательным.
2. анестезия и эвтаназии
- Место черепаха в лед ведро за 60 мин до cryoanesthetize его.
- Усыпить черепаха, обезглавливание, с помощью малых животных гильотинные (см. Таблицу материалы).
- Аккуратно извлеките пасть животного открыть с небольшой массой шпателем, чтобы крючок можно вставлять и повернул под конец верхней челюсти.
- Тянуть с устойчивым давлением продлить голова животного через гильотины. Быстро обезглавить животного.
- Место голову черепахи в блюдо рассечение. Иметь достаточно черепаха звонаря решение под рукой, чтобы орошать ткани. Oxygenize раствор с 95/5 O2/CO-2 (см. Таблицу материалы).
- Поддерживайте ткани на 4 ° C, поместив льда вокруг вне блюдо.
3. рассечение
- Используйте область диссекции с источником света оптического волокна провести вскрытие.
- Удаление нижней челюсти. Место тупые рассечение зонд через рот, чтобы облегчить обработку головы. Вырежьте совместное подключение челюсти кости черепа с помощью скальпеля. Используйте rongeurs чтобы вытянуть нижнюю челюсть от черепа. Используйте rongeurs чтобы снять кожу и мышцы от их вложений в спинной и боковых областей черепной коробки.
- Удаление позвоночного столба.
- Идентифицировать позвоночника на хвостовой конец черепной коробки. Изгиб позвоночника вентрально подвергать спинного мозга. Используйте microscissors чтобы СНиП спинного мозга. Используйте rongeurs для удаления позвоночника и других тканей из черепной коробки, потянув каудально.
- Удаление мозга из черепной коробки после резки черепных нервов.
- Начиная затылочного, используйте rongeurs сократить двух разрезов на спинной черепной коробки. Сделать разрезы поверхностные, чтобы избежать повреждения мозга под.
- Используйте rongeurs для тщательно стянуть спинной черепной коробки. Используйте microscissors для удаления серозным подвергать остальная часть мозга. Удалить достаточно серозным, пока обонятельные луковицы, в передней черепной полости, может быть идентифицирован (см. рис. 1A). Продолжать поливать мозга с раствор Рингера черепаха, при необходимости.
- Используйте Изогнутый пинцет для осторожно потяните головного мозга каудально и производить небольшое напряжение на черепных нервов. Тщательно обрежьте и удалить обонятельные луковицы и головного мозга с Изогнутый пинцет.
- Используйте microscissors чтобы аккуратно вставьте мозга к срединной подвергать черепных нервов; НИИИ, около 0,6 мм, можно увидеть перед nIV, и диаметр Нив будет немного меньше, чем НИИИ. Вырезать НИИИ и Нив где они придают мозга (см. рис. 1B). Повторите это на другой стороне.
- Вырежьте левый и правый зрительный нерв (НИИ) с microscissors. Затем наклон ствола мозга в одну сторону. Соблюдать НвИ, возникающие от брюшной поверхности возле пересечения моста и продолговатого мозга (см. рис. 1 c); Диаметр НвИ небольшой и приблизительно 0.3 мм. сократить как левая и правая НвИ.
- Удалите оставшиеся части ствола мозга из черепаха с тонкой щипцы и microscissors. После того, как черепа пуст, осматриваем Пол полость черепа. Идентифицировать НИИИ, Нив и НвИ.
- Удалите верхние и нижние веки с тонкой щипцы и microscissors.
4. Калибровка движений глаз
- Использование жесткой таблицы (см. Таблицу материалы), для поддержки размещения карданного и других инструментов. Место голову черепахи в патрон карданов подвес, так что спинной поверхности головы параллельно горизонт, с помощью небольшой пузырь уровень отдыха через череп. Примерно позиции одного из глаз в центре вращений карданного горизонтальные и вертикальные.
- Место инфракрасные камеры, оснащен инфракрасной Светоиспускающий диод (LED), которая является частью системы отслеживания глаз видео на основе (см. Таблицу материалы), на расстоянии около 12 см от глаз черепаха просмотра.
- Угол камеры 45 градусов выше линии визирования глаза. LED должен быть в положении 11 часов при взгляде на объектив камеры. Центр LED вдоль оптической оси глаза. Камера будет немного от оси (как показано сверху глаз).
- Отрегулируйте расстояние от камеры от глаз, таким образом, чтобы максимально зрения камеры заполняется глазного яблока. Убедитесь, что уголках глаз (canthi) находятся на краях горизонтального представления.
- Подключите камеру к видео на основе глаз слежения системы обработки данных. Разделите сигнал на DVD-рекордер для захвата raw видео. Фокусируем камеру чтобы получить четкое изображение глаз. Позаботьтесь, чтобы штраф положение глаз в центре поля зрения камеры с помощью трех степеней линейного перестройки (x, y, z) обеспечены карданного.
- Обнаружить темный зрачок, установив порог и контраст, надлежащим образом используя программу, поставляемую с видео на основе глаз, системы слежения.
- С помощью мыши, щелкните на меню «Видео» и в разделе «Режим» выберите «Высокой точности» для захвата изображений в дискретизации 30 Гц (резолюция 640 пикселей x 480 линий). Также под «Видео», выберите «Темный ученик» для «Ученик типа» и «Эллипс (повернутый эллипс)» для «Метод сегментации ученик».
- В окне «EyeCamera» нажмите на значок «Ученик Поиск области перестройки» (небольшой вертикальный прямоугольник с точкой в центре). Используйте мышь, чтобы перетащить прямоугольник, ограничивающий область вокруг ученика. Избегайте темных областей, которые могут быть спутаны с учеником.
- В окне «Элементы управления» подтверждают, что для «Auto Image» и «позитивных-Lock порог-отслеживание» установлены флажки. Нажмите на «Auto-порог» для оптимизации плотности сканирования, который покажет как зеленые точки на темный зрачок.
- Калибровка видео отображения видео на основе айтрекинга программы для вращений карданного 12,5 ° (+/-) вокруг горизонтальной оси и 10 ° (+/-) вокруг своей вертикальной оси.
- В окне «Элементы управления» щелкните «Отображение». Установите флажки под «Взгляд» и «СТИМ» для «Взглядом точка», «Calib региона» и «Геометрическая сетка». После проверки поля в группе «Геометрическая сетка», окно будет всплывающее и сказать, «стимул отображения геометрии должен измеряться до геометрии сетки могут отображаться. Вы хотите сделать это сейчас?» Выберите «Y» для да.
- С помощью мыши, щелкните на меню «Окна» и выберите «Стимул». Пересечение вертикальной и горизонтальной линии в центре дисплея откроется окно «Стимул». Измерение длины линии к ближайшей мм. Нажмите клавишу «Esc» на клавиатуре, чтобы закрыть окно «Стимул».
- С помощью мыши, щелкните на меню «Стимул» и выберите пункт «геометрия». Введите длину линий, которые только что были измерены. Отрегулируйте расстояние просмотра, так что линии градуса равна 25 ° для горизонтальной линии и 20 ° для вертикальной линии. Нажмите на кнопку «Store» и закрыть окно.
- В окне «EyeSpace» выберите количество калибровочных «Точки данных» быть «9». С глаз turtle's расположен в центре нажмите на центр данных точки и нажмите кнопку «Вновь представить».
Примечание: Откроется окно «Стимул», и «Get Ready» появится в центре экрана. Коробка появится на участке и затем исчезнет. О его исчезновении «Стимул» окно будет закрыто. Центральное положение теперь должен быть откалиброван. - Повторите процедуру, вращая карданного вправо/влево, + 12,5 ° / -12.5 ° и вверх/вниз + 10 /-10 ° для калибровки оставшихся точек данных.
- Для калибровки при кручении вращение, используйте шаблон фитинг алгоритм с видео на основе глаз слежения программы. Алгоритм устанавливает нулевой позиции, основанной на маркировку радужки и вычисляет угол поворота, когда маркировка стали смещение от центроида ученика.
- С помощью указателя мыши, щелкните на меню «Окна» и выберите «Скручивание». Нажмите кнопку «Пуск» в окне «Скручивание». В окне «EyeCamera» дуга будет отображаться над изображением глаза.
- Отрегулируйте радиус, угол и длина дуги с помощью ползунков в месте, где присутствуют неправильные маркировки в радужной оболочке. Установите флажки для «Графики реального времени» и «Auto-набор после настройки». При необходимости отрегулируйте яркость и контрастность в элементы управления окна и ре порог темный зрачок (см. шаг 4). Нажмите кнопку «Задать шаблон».
- Разместите линейку в одной фокальной плоскости как ученик и записывать ширину полный камеры обзора. Значение будет использоваться позднее для определения фактической ширины зрачка.
5. позиционирование электрода всасывания на черепно-мозгового нерва вызывает движения глаз
- Осторожно поместите электрод сравнения ПИН в соединительной или мышечной ткани, оставшиеся на голове.
- Место всасывания электрода (см. Таблицу материалы) на черепных нервов с использованием микроманипулятор и рассечение области установлен на бум. Используйте источник света оптического волокна для просмотра и указания размещения.
- Совпадает с размером нерва на кончике капиллярные стеклянные. Методом проб и ошибок необходима для получения наилучшего вокруг диаметр нерва (см. шаг 1.2 размер рекомендаций). Поместите кончик стекла на всасывания электрода. Залейте раствор Рингера всасывания электрода и отрегулировать громкость внутри шприца примерно половину своих возможностей.
- Осторожно переместите кончик стекла электрод, используя микроманипулятор для позиции выше вырезать конец выбранного нерва. Убедитесь, что раствор Рингера заполняет черепной коробки и кончик ниже его поверхности. При необходимости, используйте глина моделирования для дам до места, где раствор Рингера протекает из черепной коробки.
- Тяните обратно на поршень шприца.
Примечание: Вакуум привлечет нерва в конце кончика капилляров. Хорошо подходят обозначается нерва, оставаясь в рамках кончик с мало или вообще не дополнительных вакуум применяется.
6. стимуляция черепных нервов и анализа движения глаз
- Использование общего назначения нерва/мышцы стимулятор с текущего устройства изоляции (см. Таблицу материалы) для стимулирования черепных нервов через всасывающий электрода.
- Подключите всасывания электрода к текущему устройству изоляции с помощью кабеля. Подключите провод от электрод сравнения штырь заземления устройства изоляции.
- Выберите параметры течений, используя циферблатов и переключателей на устройстве изоляции и стимулятор. Используйте диапазон токов от 1 до 100 мкА, с частотой от 10 до 400 Гц. Использование 1 - или 2-ms импульсов в поездах прочного 100, 500 или 1000 мс.
- Запись времени стимуляцию.
Примечание: Транзистор транзистор логика (ТТЛ) импульсы синхронизированы с поставки токи от стимулятор и общаться в режиме реального времени через кабель для входных каналов видео на основе глаза, системы слежения. Программный модуль обеспечены на основе видео глаз отслеживания программы управления коммуникационных.- Для визуализации времени текущих приложений и их влияние на движения глаз, щелкните на меню «PenPlots». Выберите «X взгляд позиция», «Позиция Y взглядом», «Скручивание» и «Ученик ширина» Показать реального времени необработанных данных участков для X и Y глаз позиции, кручения и ширина зрачка. Также выберите «Маркеры & секунд» из меню «PenPlots», чтобы показать время участок с делениями, которые появляются промежутки 1 s.
Примечание: Большой буквы «T» появится маркировки начала TTL импульсов, происходящих одновременно с текущим приложением. - Для хранения данных движений глаз, вызванных токами, щелкните на меню «Файл» и выберите «Новый файл данных» в разделе «Данные». Введите имя файла и нажмите кнопку «Enter». Сохранение данных может быть приостановлена и затем заново, используя комбинацию клавиш «Ctrl» + «p». Когда экспериментальная сессия завершится, выберите «Закрыть файл данных» меню «Файл» в разделе «Данные».
- Помогает отслеживать типа токов применяется, щелкните на меню «Окна» и выберите «Панель данных». Появится окно «Клавиатура/DataMarker». Нажмите на букву или цифру для определения параметров текущего стимуляцию, доставляются на нерв.
Примечание: например, «X» может стоять для 10 µA. нажав на «X» хранит его вступления в файл данных в режиме реального времени для пост Специального анализа. Он также появляется на «PenPlot» на «Секунд & маркеры» для постоянного наблюдения.
- Для визуализации времени текущих приложений и их влияние на движения глаз, щелкните на меню «PenPlots». Выберите «X взгляд позиция», «Позиция Y взглядом», «Скручивание» и «Ученик ширина» Показать реального времени необработанных данных участков для X и Y глаз позиции, кручения и ширина зрачка. Также выберите «Маркеры & секунд» из меню «PenPlots», чтобы показать время участок с делениями, которые появляются промежутки 1 s.
- Анализировать данные из системы отслеживания глаз.
- Откройте файл сохраненных данных, который находится в формате текста с разделителями, в программу распространения листа выбора для того чтобы организовать данные и провести статистический анализ.
- Преобразование значения ширины зрачка, хранящиеся в файле реальные размеры в мм.
- Преобразование значений X и Y глаз позиции и скручиваний единиц степени и использовать конвенций для описания движения глаз; Таким образом положительные направления вращений: intorsion, высота и отведения; и отрицательного направления вращений: похищения, вымогательство и депрессии.
- Скопируйте данные заголовка на новый лист. Это будет включать значения для размера экрана (ширина и высота) и дистанции просмотра. Восемь столбцов данных, собранных в размере 30 Гц будет следовать ниже информации заголовка.
- Вернуться на лист, содержащий необработанные данные. Сделайте «Найти» для «X» в последней колонке под названием «Маркер», чтобы найти где стимуляции была применена с 10 µA. найти число «T», положив начало текущего стимуляции. Копирование 15 строк (0.5 s) данных, происходящих перед «T» и 90 кадров после «T» (3.0 s); то есть, всего 3,5 s. Вставьте данные в новый лист ниже информации заголовка.
- Вставьте пустой столбец после «PupilWidth». В пустой столбец преобразуйте в калиброванных размеры в мм:
Диаметр зрачка горизонтальных = × измерения ширины камеры вид «PupilWidth» - Вставка 2 пустые столбцы после «X_Gaze» и «Y_Gaze». Нормализовать позиции в размеры экрана просмотра: координаты (0, 0) в верхней левой части расширения экрана в (1, 1) в правом нижнем углу. В первом пустом столбце, перевод позиции к наличию системы координат (0, 0) в центре экрана. Включите преобразование в размеры экрана в мм:
X = (0.5 × ширина) – («X_Gaze» × ширина); Y = (0.5 × высота) – («Y_Gaze» × высота)
Примечание: Последовательность операции является для левого глаза. Последовательности должны быть отменено для правого глаза для того, чтобы следовать Конвенции негатива для похищения и позитивность для отведения. - В втором столбцах используйте тригонометрические функции для преобразования углов поворота (°):
Горизонтальное вращение = arctan (X/viewing расстояние); вертикальное вращение = arctan (расстояниеY/viewing) - Кручения уже отображается в единицах градусов, но чтобы соответствовать Конвенции позитивность для intorsion, если измерение производится на левый глаз, умножить на -1. Для правого глаза не умножение является необходимым. Программа коды вращение по часовой стрелке как позитивные.
- Участок диаметром зрачка и ротации как функцию от времени.
- Откройте файл сохраненных данных, который находится в формате текста с разделителями, в программу распространения листа выбора для того чтобы организовать данные и провести статистический анализ.
Результаты
Рисунок 1 показывает кадры изображения взяты из видео, описывающих рассечение. Изображения обеспечивают типичные места нервов до резки от мозга.
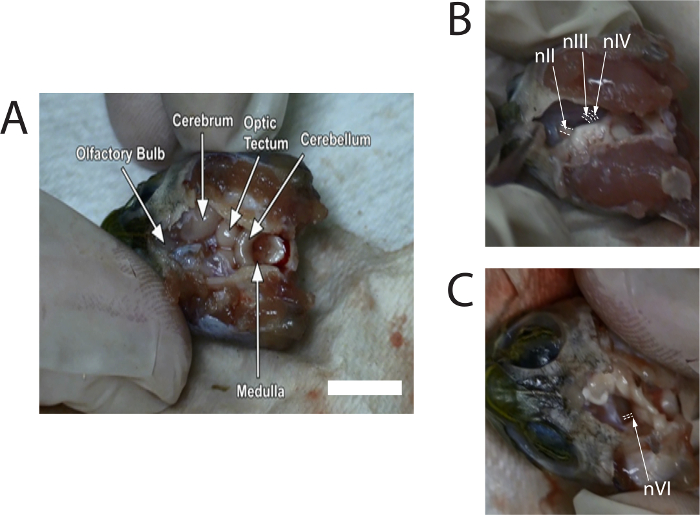
Рисунок 1: кадры изображ...
Обсуждение
Важнейшие шаги:
Важнейшие шаги в рамках этого протокола являются следующие: 1) вскрытие и бережно сохранить жизнеспособность пересекал нервов; 2) соответствие размеров путем всасывания электродов черепных нервов для обеспечения последовательного реагирования; и 3) размещ?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы благодарят г-жи Полетт Мак-Кенна и Лиза Pezzino в этом исследовании для секретариатской поддержки и г-н Фил Ауэрбах для технической поддержки. Авторы также поблагодарить Drs. Майкл Ариэль и Майкл S. Джонс (Сент-Луиса школа медицины при университете) за представление нам подготовить в vitro изолированные головы. Финансирование для поддержки этого сотрудничества было предоставлено кафедра биологии (Роберт S. Чейз фонд), академический научно-исследовательского комитета и программе нейробиологии в Лафайет колледже. Наконец эта работа посвящена г-н Фил Auerbach, который скончался 28 сентября 2016 гг.; он выведен сканирующий электронный микроскоп и признала полезность его стадии 5-оси для использования в настоящем Протоколе. Значительно будет недоставать его дружбе и находчивость.
Материалы
| Name | Company | Catalog Number | Comments |
| Red-eared slider turtles | Kons Scientific | Trachemys scripta elegans | Large size (carapace length 15-20 cm) |
| Sodium chloride | Sigma-Aldrich Co. LLC. | S5886 | |
| Potassium chloride | Sigma-Aldrich Co. LLC. | P5405 | |
| Magnesium choride | Sigma-Aldrich Co. LLC. | M7304 | |
| Sodium bicarbonate | Sigma-Aldrich Co. LLC. | S5761 | |
| Dextrose | Sigma-Aldrich Co. LLC. | C5767 | |
| Concentrated hydrochloric acid | Sigma-Aldrich Co. LLC. | H7020 | |
| Calcium chloride | Sigma-Aldrich Co. LLC. | C7902 | |
| pH meter | Oakton | pH 6+ | |
| Suction stimulation electrode | A-M Systems | 573000 | Bipolar suction electrode. Note that 573000 has been replaced with 573050. |
| Capillary glass | A-M systems | 626000 | Single-barrel borosilicate capillary glass without microfilament, length 10 cm, outside diameter 1.0 mm, inner diameter 0.50 mm |
| Alternative suction stimulation electrode | A-M Systems | 573050 | Bipolar suction electrode. Requires larger diameter capillary glass: 627000, outside diameter 1.2 mm, inner diameter 0.68 mm |
| Stereoscope | Lieca | GZ7 | Magnification range, 10x – 70x |
| Fiber optic light source | Amscope | HL250-A | 150W Fiber optical microscope illuminator light box |
| Rongeurs | Carolina Biological Supply Company | 625654 | stainless steel, straight spring, 5.25" |
| Blunt dissection probe | Carolina Biological Supply Company | 627405 | Huber mall probe, double-ended probe and seeker, 6" |
| Microscissors | Carolina Biological Supply Company | 623555 | Iris microdissecting scissors, stainless steel, 0.5" blades, 4.75" long |
| Fine forceps | Sigma-Aldrich Co. LLC. | F6521 | Jewelers forceps, dumont No. 5, inox alloy, 4.25" |
| Curved forceps | Sigma-Aldrich Co. LLC. | Z168696 | Medium tip, curved forceps, stainless steel, 4" |
| Scalpel handle | Sigma-Aldrich Co. LLC. | S2896 | Scalpel handles, No. 3, stainless steel |
| Scalpel blade | Sigma-Aldrich Co. LLC. | S2771 | Scalpel blades, No. 11, steel |
| Guillotine | Harvard Apparatus | 73-1918 | Kleine guillotine type 7575 |
| Spatula | Sigma | Z648299 | Micro spoon and spatula weighing set. Use small spatula: 5.9” long x 0.07” diameter handle with square end: 0.17” x 1.3” long, other end round: 0.17” x 1.27” long |
| Hook | Autozone | 98069 | SureBilt hook and pick set. Use grinder to dull sharp points of hook to prevent injury to animals mouth. |
| 95/5% O2/CO2 | Airgas, Inc. | X02OX95C2003102 | 5% Carbon dioxide balance oxygen certified standard gas mixture, size 200 Cylinder, CGA-296 |
| Regulator | Airgas, Inc. | Y11244D296-AG | Single stage brass 0-100 psi analytical cylinder regulator CGA-296 with needle outlet. Use brass adjustable airline pipe valve to go from 3/8", inner diameter, vinyl airline tubing connected to regulator to a 3/16", inner diameter, airline connection going to airstone or glass pasteur pipette. |
| Adjustable airline pipe valve | Doctors Foster and Smith | CD-12061 | Brass valve |
| Rigid table | Unknown | Unknown | Auto-clave door laid on top of a sturdy table. Nine 5" diameter tennis balls isolate vibrations from the top surface of the table. |
| 5" tennis ball | Petco Animal Supplies, Inc. | 712868 | Petco Jumbo Pet Tennis Ball: balls are unsliced and held within an integrated frame on the underside part of the autoclave door. |
| Alternative vibration isolation table | Newport Corporation | INT1-36-6-N | Rigid vibration control system, integrity 1: Surface dimensions, 3' x 6' |
| Gimbal | ISI, International Scientific Instruments, Inc. | Stage from SUPER III-A Scanning EM | 5-axis eucentric stage: X, Y, and Z linear movements, ±20 mm, 0.1 mm precision; Rotations, vertical, ±10°, and horizontal, ±12.5°, with 1.25° precision. Note: from decommission instrument. |
| Chuck for gimbal | Unknown | Unknown | Chuck from an old microtome of unknown manufacture was machined to fit the shaft of the specimen holder of the Scanning EM stage |
| Alternative gimbal | ThorLabs, Inc. | GN2/M with MBT602/M | Dual-axis goniometer (GN2/M) mounted on 3-axis microblock stage with thumbscrew adjusters (MBT602/M): design a chuck to hold turtle head with eye at 12.7 mm above top surface of goniometer (distance to point of rotation) |
| Video-based eye tracking system | Arrington Research, Inc. | ViewPoint EyeTracker, PC-60 | Tracking method: Infrared video by dark pupil; Black and white camera (Item BC02): 30 Hz, 640 x 480; System requirements: Windows 2000, XP, 7, 8, 8.1, 10; Visual range: Horizontal +/- 44°; vertical +/- 20°; Accuracy ~0.5°; Spatial resolution ~0.15°; Pupil size resolution ~0.03 mm; Eye data: X, Y position of gaze, pupil height and width, torsion, delta time, total time, and regions of interest (ROI); Real-time communication (Item 0022): 4-Channel AnalogOut with eight TTL input channels to mark codes into the data file |
| Multi-position magnetic base | Harbor Freight Tools | Pittsburg, item #5645 | Magnetic holder reaches up to 12" and produces 45 lbs. of magnetic pull. Use to position camera. Machine thread holes onto the end of the rod to mount cameras. |
| Micromanipulator | Kopf | 900 | 5 axis manipulation for mount of suction electrode: X, Y, Z linear travel, 2 axis of rotation |
| Dissection scope on boom | Lieca | GZ6 | Magnification range, 6.7x – 40x |
| Nerve/muscle stimulator | Astro-Med Grass Telefactor | Grass S88 | Dual pulse voltage stimulator: two output channels that can be operated independently or synchronized to generate non-isolated constant voltage pulses (10 mv to 150 V). Pulses can be single (10 μsec to 10 sec), repetitive (0.01 Hz to 1 KHz), and trains (1 ms to 10 s) and synchronized with TTL inputs and output. Send TTL outputs via the output channels of a DB25 connector to the TTL input channels of the ViewPoint EyeTracker. Note: Astro-Med Grass Telefactor is no longer in business. |
| Current isolation device | Astro-Med Grass Telefactor | PSIU6 | Current stimulus isolation unit: enables safe delivery of constant currents by the S88 to the preparation. The PSIU6 connects by a BNC cable to one of the output channels of the S88. Multiplier switches on the PSIU6 allow the S88 to generate a wide array of current amplitudes ranging from 0.1 µA to 15 mA. |
| Alternative nerve/muscle stimulator with isolation | A-M Systems | 2100 | Isolated Pulse Stimulator: Unit has built-in isolator to produce constant currents. |
Ссылки
- Kikillus, K. H., Hare, K. M., Hartley, S. Minimizing false-negatives when predicting the potential distribution of an invasive species: A bioclimatic envelope for the red-eared slider at global and regional scales. Anim Conserv. 13, 5-15 (2010).
- Lutz, P. L., Rosenthal, M., Sick, T. J. Living without oxygen: turtle brain as a model of anaerobic metabolism. Mol Physiol. 8, 411-425 (1985).
- Lutz, P. L., Milton, S. L. Negotiating brain anoxia survival in the turtle. J Exp Biol. 207, 3141-3147 (2004).
- Storey, K. B. Anoxia tolerance in turtles: Metabolic regulation and gene expression. Comp Biochem Physiol A-Mol Integr Physiol. 147 (2), 263-276 (2007).
- Granda, A. M., Dearworth, J. R., Subramaniam, B. Balanced interactions in ganglion-cell receptive fields. Vis Neurosci. 16, 319-332 (1999).
- Dearworth, J. R., Granda, A. M. Multiplied functions unify shapes of ganglion-cell receptive fields in retina of turtle. J Vis. 2 (3), 204-217 (2002).
- Nesbit, S. C., Van Hoof, A. G., Le, C. C., Dearworth Jr, J. R. Extracellular recording of light responses from optic nerve fibers and the caudal photoreceptor in the crayfish. J Undergrad Neurosci Educ. 14 (1), A29-A38 (2015).
- McMahon, B. R. Respiratory and circulatory compensation to hypoxia in crustaceans. Resp Phsiol. 128 (3), 349-364 (2001).
- Leigh, R. J., Zee, D. S. . The neurology of eye movements. , (1999).
- Robinson, D. A. A method of measuring eye movement using a scleral search coil in a magnetic field. IEEE Trans Biomed Eng. 10, 137-145 (1963).
- Judge, S. J., Richmond, B. J., Chu, F. C. Implantation of magnetic search coils for measurement of eye position: an improved method. Vis Res. 20, 535-538 (1980).
- Ong, J. K. Y., Halswanter, T. Measuring torsional eye movements by tracking stable iris features. J Neurosci Meth. 192, 261-267 (2010).
- Kimmel, D. L., Mammo, D., Newsome, W. T. Tracking the eye non-invasively: simultaneous comparison of the scleral search coil and optical tracking techniques in the macaque monkey. Front Behav Neurosci. 6 (49), 1-17 (2012).
- Otero-Millan, J., Roberts, D. C., Lasker, A., Zee, D. S., Kheradmand, A. Knowing what the brain is seeing in three dimensions: A novel, noninvasive, sensitive, accurate, and low-noise technique for measuring ocular torsion. J Vis. 15 (14), 1-15 (2015).
- Demski, L. S., Bauer, D. H. Eye movements evoked by electrical stimulation of the brain in anesthetized fishes. Brain Behav Evol. 11, 109-129 (1975).
- Gioanni, H., Bennis, M., Sansonetti, A. Visual and vestibular reflexes that stabilize gaze in the chameleon. Vis Neurosci. 10, 947-956 (1993).
- Straka, H., Dieringer, N. Basic organization principles of the VOR: lessons from frogs. Prog Neurobio. 73 (4), 259-309 (2004).
- Voss, J., Bischof, H. -. J. Eye movements of laterally eyed birds are not independent. J Exp Biol. 212 (10), 1568-1575 (2009).
- Ariel, M. Independent eye movements in the turtle. Vis Neurosci. 5, 29-41 (1990).
- Ariel, M., Rosenberg, A. F. Effects of synaptic drugs on turtle optokinetic nystagmus and the spike responses of the basal optic nucleus. Vis Neurosci. 7, 431-440 (1991).
- Balaban, C. D., Ariel, M. A "beat-to-beat" interval generator for optokinetic nystagmus. Biol Cybern. 66, 203-216 (1992).
- Keifer, J. In vitro eye-blink reflex model: Role of excitatory amino acid receptors and labeling of network activity with sulforhodamine. Exp Brain Res. 97, 239-253 (1993).
- Keifer, J., Armstrong, K. E., Houk, J. C. In vitro classical conditioning of abducens nerve discharge in turtles. J Neurosci. 15, 5036-5048 (1995).
- Rosenberg, A. F., Ariel, M. A model for optokinetic eye movements in turtles that incorporates properties of retinal slip neurons. Vis Neurosci. 13, 375-383 (1996).
- Ariel, M. Open-loop optokinetic responses of the turtle. Vis Res. 37, 925-933 (1997).
- Anderson, C. W., Keifer, J. Properties of conditioned abducens nerve responses in a highly reduced in vitro brainstem preparation from the turtle. J Neurophysiol. 81, 1242-1250 (1999).
- Keifer, J. In vitro classical conditioning of the turtle eyeblink reflex: Approaching cellular mechanisms of acquisition. Cerebell. 2, 55-61 (2003).
- Zhu, D., Keifer, J. Pathways controlling trigeminal and auditory nerve-evoked abducens eyeblink reflexes in pond turtles. Brain Behav Evol. 64, 207-222 (2004).
- Jones, M. S., Ariel, M. The effects of unilateral eighth nerve block on fictive VOR in the turtle. Br Res. 1094, 149-162 (2006).
- Jones, M. S., Ariel, M. Morphology, intrinsic membrane properties, and rotation-evoked responses of trochlear motoneurons in the turtle. J Neurophysiol. 99 (3), 1187-1200 (2008).
- Krenz, J. G., Naylor, G. J. P., Shaffer, H. B., Janzen, F. J. Molecular phylogenetics and evolution of turtles. Mol Phylogenet Evol. 37 (1), 178-191 (2005).
- Dearworth, J. R., et al. Role of the trochlear nerve in eye abduction and frontal vision of the red-eared slider turtle (Trachemys scripta elegans). J Comp Neur. 52, 3464-3477 (2013).
- Dearworth, J. R., et al. Pupil constriction evoked in vitro by stimulation of the oculomotor nerve in the turtle (Trachemys scripta elegans). Vis Neurosci. 26, 309-318 (2009).
- Mead, K., et al. IFEL TOUR: a description of the introduction to FUN electrophysiology labs workshop at Bowdoin College, July 27-30, and the resultant faculty learning community. J Undergrad Neurosci Educ. 5, A42-A48 (2007).
- Jackson, D. C., Ultsch, G. R. Physiology of hibernation under the ice by turtles and frogs. J Exp Zool A Ecol Genet Physiol. 313 (6), 311-327 (2010).
- Romano, J. M., Dearworth, J. R. Pupil constriction evoked by stimulation of the ciliary nerve in the red-eared slider turtle (Trachemys scripta elegans). J Penns Acad Sci. 85, 4-8 (2011).
- Miller, J. M., Robins, D. Extraocular-muscle forces in alert monkey. Vis Res. 32, 1099-1113 (1992).
- Gamlin, P. D., Miller, J. M. Extraocular muscle motor units characterized by spike-triggered averaging in alert monkey. J Neurosci Meth. 204, 159-167 (2011).
- Quaia, C., Ying, H. S., Optican, L. M. The Viscoelastic properties of passive eye muscle in primates. III: Force elicited by natural elongations. PLOS ONE. 5, A236-A254 (2010).
- Anderson, S. R., et al. Dynamics of primate oculomotor plant revealed by effects of abducens microstimulation. J Neurophys. 101, 2907-2923 (2009).
- Maxwell, J. H., Harless, M., Morlock, H. Anesthesia and surgery. Turtles: Perspective and Research. , 127-152 (1979).
- AVMA Panel on Euthanasia. American Veterinary Medical Association. J Am Vet Med Assoc. 218 (5), 669-696 (2001).
- Clarke, R. J. Shaping the pupil's response to light in the hooded rat. Exp Br Res. 176, 641-651 (2007).
- Bennett, R. A. A review of anesthesia and chemical restraint in reptiles. J Zoo Wild Med. 22 (3), 282-303 (1991).
- Bickler, P. E., Buck, L. T. Hypoxia Tolerance in Reptiles, Amphibians, and Fishes: Life with Variable Oxygen Availability. Ann Rev Physiol. 69, 145-170 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены