Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Oküler kinematik Vitro uyarılması kaplumbağa kranial sinirler tarafından ölçülen
Bu Makalede
Özet
Bu iletişim kuralı bir vitro izole kaplumbağa kafa hazırlık onların göz hareketleri kinematik ölçmek için nasıl kullanılacağını açıklar. Kafatası beyin kaldırıldıktan sonra kranial sinirler rotasyonlar göz ve öğrenci boyutlarda değişiklikleri ölçmek için akımları ile uyarılmış.
Özet
Hayvan are euthanized sonra onların dokular ölmeye başlar. Kaplumbağaları özellikle sıcak kanlı omurgalılar için karşılaştırıldığında onların dokular, bir daha uzun yaşam süresi nedeniyle bir avantaj sunuyor. Bu nedenle, uzun bir süre sinir sinyalleri araştırmaya ve hakim olmak-in onların hedef eylemler için kaplumbağaları vitro deneyler yapılabilir. İzole bir baş hazırlık kullanarak, kaplumbağalar göz hareketleri kinematik şiddetindeydi ve onların modülasyon tarafından elektrikle ilgili sinyal kranial sinirler tarafından taşınan. Kranial sinirler dokunmadan beyin kafatasından kaldırdıktan sonra disseke kafa göz hareketleri ayarlamak için bir yalpa yerleştirildi. Cam elektrotlar kranial sinirler için bağlı (oculomotor, trochlear ve abducens) ve göz hareketleri yaratamayacak akımların ile uyarılmış. Kızılötesi bir video izleme sistemi ve gözlerin quantified rotasyonlar ile göz hareketleri izlenir. Geçerli genlikleri, frekansları, bir dizi ile bakliyat ve tren süreleri yanıt üzerindeki etkileri gözlemlemek için kullanıldı. Hazırlık beyinden ayrılır çünkü sinir merkezi olarak işlenmiş duyusal bilginin yokluğunda sinyal araştırmak için izole kas hedefe gidiş efferent yol incelenebilir.
Giriş
Gerekçe kaymak kırmızı kulaklı kaplumbağaların elektrofizyolojik deneylerde kullanmak için:
Kırmızı kulaklı kaymak kaplumbağaları (Trachemys scripta elegans), dünyanın en kötü istilacı türlerin1 biri olarak kabul edilir ve bir ekosistem dertte belirtebilirsiniz. Neden kaymak kırmızı kulaklı kaplumbağaların çok başarılı olduğunu neden kötü anlaşılmaktadır ama kısmen hoşgörülü fizyolojisi ve bulundurma hipoksik koşulları2,3altında,4 yaşayabilir gergin dokuların nedeniyle olabilir . Onları istimal o için deneme sayıları tehdit etmediğini ve en az çaba ile elektrofizyolojik hazırlıkları üzerinde genişletilmiş süreleri, 18 saat5,6sürece canlı kalabilir. Ayrıca oksijen8seviyesinin düşük dayanacak şekilde şifreleyebilirler kerevit7gibi omurgasız hayvanlar kullanmanın yararı için benzer bir şeydir.
Göz hareketleri Ölçme teknikleri:
Yaklaşımlar göz hareketleri içinde ön gözlü hayvan insan dışı primatlar kullanarak ölçmek için iyi gelişmiş9olmuştur. Göz yörüngede yaklaşık üç eksen döndürür: yatay, dikey ve burulma. Manyetik arama bobini yöntemi genellikle ölçüm rotasyonu için en güvenilir olarak kabul edilir, ancak invaziv, hayvanlar10,11scleras eklenecek küçük bobinleri gerektiren. Video tabanlı sistemler de rotasyonlar ölçebilir ve non-invaziv olma avantajına sahip. Yenilikçi görüntü işleme ile birlikte daha iyi fotoğraf makinesi gelişimi video tabanlı sistemler12,13,14düşünün için cazip bir alternatif yapmak işlevselliğini arttırmak.
Nonmammals göz hareketleri ölçmek için geliştirilmiş teknikleri daha az önemli olmuştur. Önlemler de düşük çözünürlükte ya da rotasyonlar15,16,17,18yalnızca bazıları açıklanmaktadır. Görsel hedefleri takip etmek eğitim nonmammals zorluk üzerinde geliştirme eksikliği kısmen sorumlu. Her ne kadar göz hareketleri de kırmızı kulaklı kaymak kaplumbağalar19,20,21,22,23,24,25 incelenmiştir ,26,27,28,29,30, hedefleri, izlemek için nedeniyle eğitim hayvanlarda göz hareketleri kesin kinematik mücadeledir kötü anladım.
Kaydırıcıyı kırmızı kulaklı kaplumbağaların genellikle lateral gözlü omurgalılar kabul, ama onlar tamamen kafalarının onların kabuk31geri çekmek, kabuğu tarafından yanal visual alanlarının önemli tıkanıklığı32oluşur. Onların görsel bakış açısı onları daha çok ön gözlü memeliler gibi çalışır hale önüne doğru zorlanır sonucudur. Bu nedenle, bunların kullanımı bir model olarak göz hareketleri ölçmek için yaklaşımlar geliştirmek için benzersiz bir evrimsel bakış açısı sunuyor.
Bu çalışmada açıklanan protokol bir izole vitro baş hazırlık kaymak kırmızı kulaklı kaplumbağaların göz hareketlerinde kinematik tanımlamak için kullanır. Beyin kranial sinirler dokunmadan kafatasları kesmiştim. Kafa göz hareketleri kalibre ve yanıt-e doğru anımsatmak için yalpa kranial sinirler göz kasları innerve elektriksel stimülasyon tarafından yerleştirilir. Önlemler dönmenin gözler tarafından karanlık bir öğrencisi ve iris işaretleri takip Yazılım algoritmaları kullanarak bir video tabanlı sistem tarafından yapılır. Hazırlık Gözdışı ikisinin kinematik (yani, yatay, dikey ve burulma rotasyonlar) ölçmek için fırsat sağlar32 ve göz içi (yani, öğrenci değişiklikleri)33 hareketleri.
Efferent sinirsel yollar analiz için sistem modeli:
Daha genel olarak, yaklaşım nasıl efferent sinir sinyalleri çalışma fırsatı oluşturmak göz hareketleri kaslar rahat durumlarına ve beyin32tarafındanişlenen entegre duyusal bilgi yokluğunda başlattığınızda müfettişler sağlar, 33. Bu nedenle, onlar sadece efferent sinir yolu bırakarak beyin ve kaslar synapsing tarafından işlenme bir modeli sistemi göz kinematik incelenebilir.
Protokol
Not: Kırmızı kulaklı kaymak kaplumbağalar, erkek ve kadın, bir satıcıdan satın alındı. Kaplumbağalar, sıcak bir hayvan paketi 250 W kızılötesi ışıkları altında sunning için tuğla Adaları ile donatılmış iki 60 litrelik küvetleri içeren yer. Çevre su sıcaklığı 22 ° C'de ile 14/10-h açık/koyu döngüsü devam edildi Işıklar 6: 00'de açık ve 8:00 de devre dışı. Filtreleme sistemleri ile donatılmış tankları haftalık temizlenmiştir ve kaplumbağalar ad libitum her geçen gün beslenen edildi. Kırmızı kulaklı kaymak bakım kaplumbağaları ve tüm aşağıdaki deneysel prosedürler açıklanan burada32,33 kurumsal hayvan bakım ve kullanım Komitesi (IACUC) Lafayette Koleji tarafından kabul edildi.
1. ekipman kurulumu
- Kaplumbağa zil'ın çözüm hazırlamak. Bu sırada distile su için aşağıdakileri ekleyin: sodyum klorür 96.5 mM (58.44 g/mol), potasyum klorür 2.6 mM (74.56 g/mol), magnezyum klorür 2.0 mM (203.31 g/mol), sodyum bikarbonat 31.5 mM (84.01 g/mol), dekstroz 20,0 mM (180.16 g/mol), konsantre hidroklorik asit pH 7,51 ve kalsiyum klorür 4.0 mM (110.98 g/mol) ayarlamak için (bkz. Tablo malzeme). Çözüm süre her tuz ekleyerek karıştırın.
Dikkat: Konsantre HCl tehlikeli (Cilt, gözleri, solunum ve sindirim tehlikeler) olduğunu. - İpuçları üzerinden 5 cm uzunluğunda kılcal emme elektrotlar için make kranial sinirler değişen kalınlıkta ağırlama cam iç çapları farklı boyutlarda yangın parlatma tarafından (bkz. Tablo malzeme).
- Küçük bir dosya kapiller cam parçası arasında bir çizgi etch için kullanın. Doku sayfa yerleştirin ve ikiye böl.
- Yavaş yavaş kapiller cam ucuna birini Bunsen burner alevin içine at. Düzenli olarak incelemek boyutu, pürüzsüzlük ve simetri bir diseksiyon kullanma için belgili tanımlık uç kapsam ve fiber optik ışık kaynağı ( Malzeme tablobakınız).
Not: kafa genişliği 20 ve 30 mm arasında olan kaplumbağaları için en uygun uygun iç çapı genellikle oculomotor sinir (nIII), için 0.8 mm ile 0,4 arasındadır trochlear sinir (NIV) için 0.3-0.6 mm ve abducens sinir (in) için 0,2-0,4 mm boyutlandırır.
- Temiz ve Rongeurs, bir künt diseksiyon sonda, microscissors, iyi forseps, Kıvrımlı pensler ve neşter kulpu ( Tablo malzemelerigörmek) kanatları diseksiyon ile organize edin.
Not: Sterilizasyon aletleri seçime bağlıdır.
2. anestezi ve ötenazi
- Yer bir buz kaplumbağa kova cryoanesthetize için 60 dk için o.
- Kaplumbağayı kullanarak küçük bir hayvan Giyotin işten çıkarma tarafından ötenazi ( Tablo malzemelerigörmek).
- Böylece bir kanca takılı ve üst çene ucu altında uygun ortaya yavaşça küçük bir tartı spatula ile Hayvansal açık çene Gözetlemek.
- Hayvanın kafasını giyotin ile genişletmek için sabit basınç ile çek. Hızla hayvan başını kesmek.
- Kaplumbağa kafasını bir diseksiyon tabak yerleştirin. Yandan doku sulamak için yeterli kaplumbağa zil'ın çözüm var. 95/5 O2Co2 çözümle oxygenize (bkz. Tablo malzeme).
- 4 ° C'de doku çanak dış buz yerleştirerek korumak.
3. diseksiyon
- Diseksiyon kapsamlı bir fiber optik ışık kaynağı ile diseksiyon taşımak için kullanın.
- Alt çene kaldırın. Başın daha kolay kullanım sağlamak için ağız yoluyla bir künt diseksiyon sondası yerleştirin. Bir neşter ile kafatası dentary kemik bağlanma ortak kesti. Rongeurs kafatası uzak alt çene çekmek için kullanın. Rongeurs deri ve kaslar onların eklerinden kafatası dorsal ve yanal bölgeler koparmak için kullanın.
- Vertebral sütun kaldırmak.
- Kafatası kaudal sonundaki vertebral sütun tanımlayın. Spinal kord ventrally maruz vertebral sütunun viraj. Spinal kord makasla kesme için microscissors kullanın. Rongeurs vertebral sütunun ve diğer doku caudally çekerek kafatası kaldırmak için kullanın.
- Beyin kranial sinirler kesme sonra kafatası kaldırın.
- Deliği magnum başlayarak, rongeurs iki insizyon dorsal kafatası üzerinde kesmek için kullanın. Kesikler yüzeysel altında beyin zarar görmesini önlemek için yapmak.
- Rongeurs dikkatli bir şekilde dorsal kafatası çekmek için kullanın. Microscissors beyin kalan ortaya çıkarmak için meninx kaldırmak için kullanın. Olfaktör ampuller anterior kranial boşluğunda belirlenebilir kadar yeterli meninx kaldırmak ( Şekil 1A' ya bakınız). Gerektiği gibi kaplumbağa zil'ın çözüm ile beyin sulamak devam edin.
- Kıvrımlı pensler yavaşça cerebrum caudally çekin ve kranial sinir hafif gerginlik üretmek için kullanın. Dikkatle kes gitsin ve olfaktör ampuller ve cerebrum eğri forseps ile kaldırın.
- Microscissors orta kranial sinirler ortaya çıkarmak için orta hat doğru yavaşça itin için kullanın; nIII, yaklaşık 0,6 mm, NIV önünde görülebilir ve NIV çapını biraz nIII daha az olacaktır. Kesilmiş nIII ve NIV nerede onlar için orta eklemek (bkz. Şekil 1B). Bunu diğer tarafta tekrarlayın.
- Sol ve sağ optik siniri (nII) microscissors ile kesti. O zaman beyin sapı bir tarafa eğin. İn pons ve medulla yakınındaki ventral yüzeyinden yükselen gözlemlemek (bkz. Şekil 1 c); İn çapı küçük ve yaklaşık 0.3 mm. hem sol ve sağ in kes.
- Beyin kalan bölümlerini kaplumbağa iyi forseps ve microscissors ile kaldırın. Kafatası boş olduğunda, kafatası boşluğu kat inceleyin. NIII, NIV ve in tanımlayın.
- Alt ve üst göz-göz kapakları ile iyi forseps ve microscissors kaldırmak.
4. göz hareketleri kalibrasyonu
- Katı bir tabloyu kullanın (gimbal ve diğer enstrümanlar yerleşimini desteklemek için Malzemeler tablobkz:). Kaplumbağa kafa baş sırt yüzeyine paralel olarak küçük bir kabarcık düzeyi arasında kafatası dinlenme kullanarak ufuk gimbal chuck yerleştirin. Kabaca gözleri gimbal'ın yatay ve dikey döndürme merkezinde getirin.
- Bir kızılötesi ışık yayan diyot (LED), video tabanlı göz izleme sistemi parçası olan ile donatılmış kızılötesi kamera yerleştirin (bkz. Tablo malzemeler), yaklaşık 12 cm kaplumbağanın göz görüş uzaklığı olarak.
- Kameranın göz yukarıda bakış açısı 45 derece açı. LED kamera objektifi bakıldığında 11: 00 konumda olmalıdır. Merkezi LED gözün optik eksen boyunca. Kamerayı biraz ekseni (göz yukarıdan bakıldığında) olacaktır.
- Kamera görünümü sonuna kadar gözü tarafından doldurulur göz fotoğraf makinesinin mesafeyi ayarlayın. Gözler (canthi) köşe yatay görünüm kenarlarında olduğundan emin olun.
- Kamera izleme sistemi verileri işlemek için video tabanlı göz bağlayın. Ham video yakalamak için bir DVD kaydedici için sinyal bölün. Gözün net bir görüntü elde etmek için kamera odaklama. Güzel pozisyonlu linear ayar (x, y, z) üç derece kullanarak kamera görünümü ortasındaki göz gimbal ile sağlanan için dikkat ediniz.
- Karanlık gözbebeği uygun takip sistemi video tabanlı göz ile sağlanan program kullanarak kontrast ve eşik ayarlayarak algılamak.
- Fareyi kullanarak, "Video" menüsünde'i tıklatın ve "Mode" altında "Yüksek hassasiyetli 30 Hz (kararlılık-in 640 piksel x 480 satırları) örnekleme hızında çekim" seçin. Ayrıca "Görüntü'nün altında", "Karanlık gözbebeği" "Öğrenci türü" ve "Elips (döndürülmüş elips)" için "öğrenci segmentasyon yöntemi için" seçin.
- "EyeCamera" penceresinde, "Öğrenci arama alanı ayarlama" simgesini (merkezi bir nokta ile küçük dikey dikdörtgen) tıklayın. Öğrenci bir çevresi sınırlar bir dikdörtgen dışarı sürüklemek için fareyi kullanın. Karışık karanlık bölgeler ile öğrenci kaçının.
- "Denetim" penceresinde, "Otomatik görüntü" ve "pozitif-kilidi eşik izleme" kutularını işaretli olduğundan emin olun. "Auto-tarama, yoğunluk en iyi duruma getirmek için üzerinde karanlık bir öğrencisi yeşil noktalar poliçelerinizin eşik" tıklayın.
- Yatay ekseni çevresinde ve (+/-) 10 ° dikey ekseni etrafında gimbal 12.5 ° (+/-) rotasyonları için programı izleme video tabanlı göz video görüntüsünü ayarlama.
- "Denetim" penceresinde, "Ekranda"'ı tıklatın. Kutuları "Gaze" ve "Stim" altında "Gaze Point", "Calib bölge" ve "Geometri kılavuz" için işaretleyin. "Geometri kılavuz" altındaki kutuları kontrol ettikten sonra bir penceresi açılır ve demek, "geometri kılavuz görüntülenebilir önce uyarıcı ekran geometri ölçülmesi gerekir. Sana bunu şimdi yapmak istiyor musunuz?" "Y" için Evet'i seçin.
- Fareyi kullanarak, "Windows" menüsünü tıklatın ve "Uyarıcı" seçin. Ekranın ortasındaki bir dikey ve yatay çizgi geçiş gösterilen "Uyarıcı" penceresi açılacaktır. En yakın mm. "Esc" tuşuna basın satırlarına uzunlukları "Uyarıcı" penceresinden çıkmak için klavyedeki ölçmek.
- Fareyi kullanarak, "Uyarıcı" menüsünde'i tıklatın ve "geometri" seçin. Sadece ölçüldü çizgi uzunlukları girdi. Derece/satır eşit yatay çizgi ve dikey çizgi için 20 ° 25 ° görüş uzaklığı ayarlayın. "Store" butonuna tıklayın ve pencereyi kapatın.
- "EyeSpace" penceresinde, kalibrasyon "Veri noktasını" "9" olarak sayısını seçin. Merkezde konumlandırılmış kaplumbağanın göz ile üstünde belgili tanımlık merkez veri üzerine gelin ve "burada yeniden" düğmesini tıklatın.
Not: "Uyarıcı" pencere-ecek açık ve ekranın merkezinde "Hazır olsun" görünecektir. Bir kutu merkezi konumda görünür ve sonra kaybolur. Onun kayboluşu "Uyarıcı" penceresi kapatılacak. Merkezi konumu şimdi ayarlanması. - Sağa/sola yalpa +12.5 ° / °-12.5, dönen tarafından ve yukarı/aşağı + 10 ° /-10 kalan veri noktaları ayarlamak için ° yordamı yineleyin.
- Burulma döndürmeyi ayarlamak için algoritma programı izleme video tabanlı göz ile sağlanan uygun şablonu kullanın. Algoritma üzerindeki iris işaretleri dayalı bir sıfır noktasını ayarlar ve işaretler öğrenci centroid ofset haline ne zaman bir dönüş açısını hesaplar.
- Fare işaretçisi, "Windows" menüsünü tıklatın ve "Burulma" seçin. "Burulma" penceresinde "Başlat" düğmesini tıklatın. "EyeCamera" penceresinde, bir yay göz görüntüleri üzerinde gösterilir.
- Yarıçapı, açı ve düzensiz işaretler iris mevcut nerede bir yerde kaydırıcıları kullanarak ark uzunluğu ayarlayın. "Gerçek zamanlı" grafik"ve"Auto-Set sonra ayarlama"için kutuları işaretleyin. Gerekirse, parlaklığı ayarlayın ve denetimleri pencere ve re-eşik karanlık gözbebeği kontrast (bkz. Adım 4). "Şablon ayarla" düğmesini tıklatın.
- Aynı odak düzlemi öğrenci olarak bir cetvel yerleştirin ve tam Kamera görünümünün kaydedin. Değer daha sonra öğrenci gerçek genişliğini belirlemek için kullanılır.
5. kranial sinir göz hareketleri uyandırmak için üzerinde emme elektrot konumlandırma
- Dikkatli bir PIN referans elektrot kafasına kalan bağ veya kas dokusu içine koyun.
- Emme elektrot yerleştirin (bkz. Tablo reçetesi) kranial sinir micromanipulator ve diseksiyon kapsamı kullanan bir patlama monte edilmiş. Görüntülemek ve Yerleştirme Kılavuzu için bir fiber optik ışık kaynağı kullanın.
- Bir sinir kapiller cam bahşiş için uygun. Deneme yanılma bir sinir çapı çevresinde en iyi bir uyum elde etmek gereklidir (bkz. Adım 1.2 boyut önerileri için). Cam ucu emme elektrot üzerine yerleştirin. Emme elektrot zil'ın çözüm ile doldurun ve şırınga yaklaşık içinde ses seviyesini kapasitesini yarısı.
- Dikkatle micromanipulator kullanarak seçili sinir kesme uç yukarıda bir pozisyon elektrot cam ucu taşıyın. Zil'ın çözüm kafatası doldurur ve belgili tanımlık uç yüzeyi altında olduğundan emin olun. Gerekirse, modelleme kil nerede zil'ın çözüm kafatası dışarı sızdırıyor mekanlar baraj için kullanın.
- Şırınga pistonu üzerinde geri çek.
Not: Vakum sinir kapiler uç uç çekecek. İyi bir uyum içinde ipucu uygulanan az veya hiç ek vakum ile kalan sinir simgesiyle gösterilir.
6. kranial sinir ve göz hareketleri Analizi uyarılması
- Genel amaçlı sinir/kas Stimülatörü geçerli bir yalıtım aygıtıyla kullanmak (kranial sinir emme elektrot ile uyarmak için Malzemeler tablobkz:).
- Emme elektrot bir kablo kullanarak geçerli yalıtım cihaza bağlayın. Müşteri adayının yalıtım aygıt toprağa bağlama PIN referans elektrot bağlayın.
- Parametreleri dials kullanarak akıntılarının seçin ve uyarıcı ve yalıtım aygıtta geçer. 10 Hz. Kullanım 1 veya 2 ms 100, 500 ya da 1000 ms süren tren bakliyat 400 sıklığı ile a sıra-in 100 µA 1 akımları kullanın.
- Elektrodlar zamanlamasını kaydedin.
Not: Transistör transistör mantığı (TTL) bakliyat akımları teslimatlar üzerinden uyarıcı ile eşitlenir ve iletişim kablo giriş kanalları izleme sistemi video tabanlı göz ile gerçek zamanlı. Bir yazılım modülü program denetimleri iletişim izleme video tabanlı göz ile sağlanan.- Mevcut uygulamalar ve göz hareketleri onların etkisi zamanlaması görselleştirmek için "PenPlots" menüsünde tıklatın. "Seç X Gaze konum", "Y Gaze konumu", "Burulma" ve "Öğrenci genişliği" göz pozisyonları, burulma ve öğrenci Genişlik X ve Y için gerçek zamanlı ham veri araziler göstermek için. Ayrıca "Saniye & işaretleyicileri" bir zamanlama komplo 1 s aralıklarla görünür onay işaretleri ile göstermek için "PenPlots" menüsünden seçin.
Not: Aynı anda geçerli uygulama ile meydana gelen TTL darbe başlangıcı işaretleme bir büyük harf "T" görünür. - Göz hareketleri akımlar tarafından uyarılmış verileri depolamak için "Dosya" menüsünü tıklatın ve "Veri" altında "yeni veri dosyası" seçin. Bir dosya adı girin ve "Enter" tuşuna basın. Kaydetme veri duraklatılmış ve tuş komutları, "Ctrl" + "p" kullanarak yeniden başlatılır. Deneysel bir oturum tamamlandığında, "Yakın veri dosyası" "Dosya" menüsünden "Veri" altında kapalı seçeneğini belirleyin.
- Uygulanan akımları türünü izlemenize yardımcı olmak için "Windows" menüsünü tıklatın ve "Veri Pad" seçin. "Tuş takımı/DataMarker" pencere-ecek gözükmek. Tıkırtı üstünde bir mektup ya da sinir için teslim edilen geçerli elektrodlar parametrelerini tanımlamak için bir sayı.
Not: Örneğin, "X" duramazdı 10 µA. için "X" üzerine tıklamak onun giriş içine veri dosyasının post hoc analizi için gerçek zamanlı depolar. Ayrıca "PenPlot" "Saniye & işaretleri" sürekli gözlem altında görünür.
- Mevcut uygulamalar ve göz hareketleri onların etkisi zamanlaması görselleştirmek için "PenPlots" menüsünde tıklatın. "Seç X Gaze konum", "Y Gaze konumu", "Burulma" ve "Öğrenci genişliği" göz pozisyonları, burulma ve öğrenci Genişlik X ve Y için gerçek zamanlı ham veri araziler göstermek için. Ayrıca "Saniye & işaretleyicileri" bir zamanlama komplo 1 s aralıklarla görünür onay işaretleri ile göstermek için "PenPlots" menüsünden seçin.
- Göz izci sistemi veri analiz.
- Verileri düzenlemek ve istatistiksel analizlerini seçtikleri bir forma levha programına ayrılmış metin biçimindedir, kaydedilen veri dosyasını açın.
- Gerçek boyutları mm dosyasında depolanan öğrenci genişlik değerleri dönüştürmek.
- X değerleri dönüştürmek ve Y konumları ve torsion birimlerine derecesi göz ve göz hareketleri tanımlamak için kuralları kullanın; Bu nedenle, rotasyonlar olumlu yönleri: intorsion, bakış açısını ve dıştan; ve negatif döndürme yönleri: extorsion, depresyon ve kaçırma.
- Başlık bilgilerini yeni bir çalışma sayfası üzerine kopyalayın. Bu ekran boyutu (genişlik ve yükseklik) ve görüntüleme mesafe değerleri yer alacak. Sekiz 30 Hz oranında toplanan veri sütunlarının başlık bilgilerini takip eder.
- Ham verileri içeren çalışma sayfasına dön. A "bulmak" "" işareti nerede stimülasyon 10 µA. ile uygulanan "T" geçerli stimülasyon başlangıcı işaretleme, bul insidansı bulmak için"başlıklı X için" son sütun var. 15 satır kopyalamak (0,5 s) "T" ve 90 kare daha önce "T" sonra meydana gelen veri (3.0 s); yani, 3.5 s toplam. Verileri yeni çalışma sayfasının başlık bilgilerini aşağıda yapıştırın.
- "PupilWidth" sonra boş bir sütun ekleyin. Boş sütun, mm kalibre edilmiş boyut dönüştürmek:
Yatay öğrenci çapı = "PupilWidth" × kamera görünümü Genişlik boyutunu - 2 boş sütun "X_Gaze" ve "Y_Gaze" sonra ekleyin. Görüntüleme ekran boyutları konumlara normalize: koordinatları (0, 0) üst sol ekran için uzanan (1, 1) sağ alt. İlk boş sütunda bir koordinat sistemi olan pozisyonlar çevirmek (0, 0) ekranın merkezinde. Ekran boyutları dönüştürmeye mm şunlardır:
X = (0,5 × Genişlik) – ("X_Gaze" × Genişlik); Y = (0.5 x yükseklik) – ("Y_Gaze" x yükseklik)
Not: Sol göz için işlem dizisidir. Sıra için sağ gözü kaçırma için negatif ve pozitif dıştan için Kongre izleyebilmek için tersine çevrilmesi gerekir. - İkinci sütun, trigonometri işlevleri döndürme açıları (°) dönüştürmek için kullanın:
Yatay döndürme arctan (X/viewing mesafe); = dikey döndürme arctan (Y/viewing mesafe) = - Burulma zaten derece birimlerinde gösterilmiştir, ancak ölçüm sol göz kulak yapılır Eğer Kongre için intorsion, olumluluk uyması için -1 tarafından çarpın. Sağ gözü yok çarpma gereklidir. Program saat yönünde döndür olumlu olarak kodlar.
- Öğrenci çapı ve rotasyonlar bir fonksiyonu olarak arsa.
- Verileri düzenlemek ve istatistiksel analizlerini seçtikleri bir forma levha programına ayrılmış metin biçimindedir, kaydedilen veri dosyasını açın.
Sonuçlar
Şekil 1 fotoğraf diseksiyon açıklayan bir videodan alınan görüntülerin gösterir. Görüntüler sinir kesme beyin üzerinden önce tipik mekanlar sunar.
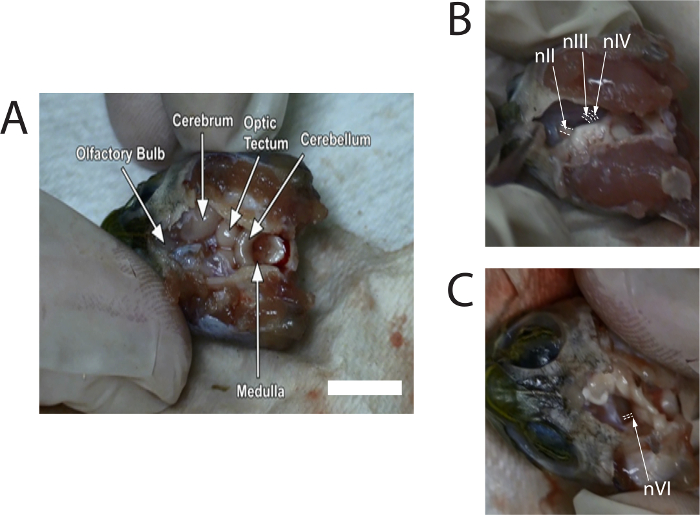
Şekil 1: optik sinir (nII), oculomotor sinir (nIII), trochlear sinir (NIV) ve abducens sinir (in) konumları göstermek için fotoğraf diseksiyon v...
Tartışmalar
Kritik adımlar:
Bu iletişim kuralı içinde önemli adımlar şunlardır: 1) diseksiyon ve transected sinirler; canlılığı korumak için alınan bakım 2) boyutları kranial sinirler tutarlı yanıtlar sağlamak için emme elektrotlar tarafından eşleşen; ve 3) dönmenin gözün yeterli kalibrasyon sağlamak için yalpa kafasından yerleşimini.
Sorun giderme:
Diseksiyon zor olabilir, ama bir kaç kez tamamladıktan sonra adımları nisp...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Yazarlar Bayan Paulette McKenna ve sekreterlik desteği için bu çalışmada Lisa Pezzino ve Bay Phil Auerbach teknik destek için teşekkür ederiz. Yazarlar ayrıca Drs. Michael Ariel ve Michael S. Jones (Saint Louis Üniversitesi Tıp Fakültesi) izole vitro baş hazırlık için bize tanıtmak için teşekkür ederiz. Bu işbirliği destek için fon Biyoloji bölümü (Robert S. Chase Fonu), akademik araştırma komitesi ve Lafayette Koleji'nde sinirbilim programı tarafından sağlandı. Son olarak, bu eser 28 Eylül 2016 yılında vefat eden Bay Phil Auerbach adanmıştır; taramalı elektron mikroskobu hizmet dışı ve 5 eksenli sahne bu iletişim kuralını kullanmak için kullanışlılığı tanıdı. Onun dostluk ve güçlülük çok özleyeceğiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Red-eared slider turtles | Kons Scientific | Trachemys scripta elegans | Large size (carapace length 15-20 cm) |
| Sodium chloride | Sigma-Aldrich Co. LLC. | S5886 | |
| Potassium chloride | Sigma-Aldrich Co. LLC. | P5405 | |
| Magnesium choride | Sigma-Aldrich Co. LLC. | M7304 | |
| Sodium bicarbonate | Sigma-Aldrich Co. LLC. | S5761 | |
| Dextrose | Sigma-Aldrich Co. LLC. | C5767 | |
| Concentrated hydrochloric acid | Sigma-Aldrich Co. LLC. | H7020 | |
| Calcium chloride | Sigma-Aldrich Co. LLC. | C7902 | |
| pH meter | Oakton | pH 6+ | |
| Suction stimulation electrode | A-M Systems | 573000 | Bipolar suction electrode. Note that 573000 has been replaced with 573050. |
| Capillary glass | A-M systems | 626000 | Single-barrel borosilicate capillary glass without microfilament, length 10 cm, outside diameter 1.0 mm, inner diameter 0.50 mm |
| Alternative suction stimulation electrode | A-M Systems | 573050 | Bipolar suction electrode. Requires larger diameter capillary glass: 627000, outside diameter 1.2 mm, inner diameter 0.68 mm |
| Stereoscope | Lieca | GZ7 | Magnification range, 10x – 70x |
| Fiber optic light source | Amscope | HL250-A | 150W Fiber optical microscope illuminator light box |
| Rongeurs | Carolina Biological Supply Company | 625654 | stainless steel, straight spring, 5.25" |
| Blunt dissection probe | Carolina Biological Supply Company | 627405 | Huber mall probe, double-ended probe and seeker, 6" |
| Microscissors | Carolina Biological Supply Company | 623555 | Iris microdissecting scissors, stainless steel, 0.5" blades, 4.75" long |
| Fine forceps | Sigma-Aldrich Co. LLC. | F6521 | Jewelers forceps, dumont No. 5, inox alloy, 4.25" |
| Curved forceps | Sigma-Aldrich Co. LLC. | Z168696 | Medium tip, curved forceps, stainless steel, 4" |
| Scalpel handle | Sigma-Aldrich Co. LLC. | S2896 | Scalpel handles, No. 3, stainless steel |
| Scalpel blade | Sigma-Aldrich Co. LLC. | S2771 | Scalpel blades, No. 11, steel |
| Guillotine | Harvard Apparatus | 73-1918 | Kleine guillotine type 7575 |
| Spatula | Sigma | Z648299 | Micro spoon and spatula weighing set. Use small spatula: 5.9” long x 0.07” diameter handle with square end: 0.17” x 1.3” long, other end round: 0.17” x 1.27” long |
| Hook | Autozone | 98069 | SureBilt hook and pick set. Use grinder to dull sharp points of hook to prevent injury to animals mouth. |
| 95/5% O2/CO2 | Airgas, Inc. | X02OX95C2003102 | 5% Carbon dioxide balance oxygen certified standard gas mixture, size 200 Cylinder, CGA-296 |
| Regulator | Airgas, Inc. | Y11244D296-AG | Single stage brass 0-100 psi analytical cylinder regulator CGA-296 with needle outlet. Use brass adjustable airline pipe valve to go from 3/8", inner diameter, vinyl airline tubing connected to regulator to a 3/16", inner diameter, airline connection going to airstone or glass pasteur pipette. |
| Adjustable airline pipe valve | Doctors Foster and Smith | CD-12061 | Brass valve |
| Rigid table | Unknown | Unknown | Auto-clave door laid on top of a sturdy table. Nine 5" diameter tennis balls isolate vibrations from the top surface of the table. |
| 5" tennis ball | Petco Animal Supplies, Inc. | 712868 | Petco Jumbo Pet Tennis Ball: balls are unsliced and held within an integrated frame on the underside part of the autoclave door. |
| Alternative vibration isolation table | Newport Corporation | INT1-36-6-N | Rigid vibration control system, integrity 1: Surface dimensions, 3' x 6' |
| Gimbal | ISI, International Scientific Instruments, Inc. | Stage from SUPER III-A Scanning EM | 5-axis eucentric stage: X, Y, and Z linear movements, ±20 mm, 0.1 mm precision; Rotations, vertical, ±10°, and horizontal, ±12.5°, with 1.25° precision. Note: from decommission instrument. |
| Chuck for gimbal | Unknown | Unknown | Chuck from an old microtome of unknown manufacture was machined to fit the shaft of the specimen holder of the Scanning EM stage |
| Alternative gimbal | ThorLabs, Inc. | GN2/M with MBT602/M | Dual-axis goniometer (GN2/M) mounted on 3-axis microblock stage with thumbscrew adjusters (MBT602/M): design a chuck to hold turtle head with eye at 12.7 mm above top surface of goniometer (distance to point of rotation) |
| Video-based eye tracking system | Arrington Research, Inc. | ViewPoint EyeTracker, PC-60 | Tracking method: Infrared video by dark pupil; Black and white camera (Item BC02): 30 Hz, 640 x 480; System requirements: Windows 2000, XP, 7, 8, 8.1, 10; Visual range: Horizontal +/- 44°; vertical +/- 20°; Accuracy ~0.5°; Spatial resolution ~0.15°; Pupil size resolution ~0.03 mm; Eye data: X, Y position of gaze, pupil height and width, torsion, delta time, total time, and regions of interest (ROI); Real-time communication (Item 0022): 4-Channel AnalogOut with eight TTL input channels to mark codes into the data file |
| Multi-position magnetic base | Harbor Freight Tools | Pittsburg, item #5645 | Magnetic holder reaches up to 12" and produces 45 lbs. of magnetic pull. Use to position camera. Machine thread holes onto the end of the rod to mount cameras. |
| Micromanipulator | Kopf | 900 | 5 axis manipulation for mount of suction electrode: X, Y, Z linear travel, 2 axis of rotation |
| Dissection scope on boom | Lieca | GZ6 | Magnification range, 6.7x – 40x |
| Nerve/muscle stimulator | Astro-Med Grass Telefactor | Grass S88 | Dual pulse voltage stimulator: two output channels that can be operated independently or synchronized to generate non-isolated constant voltage pulses (10 mv to 150 V). Pulses can be single (10 μsec to 10 sec), repetitive (0.01 Hz to 1 KHz), and trains (1 ms to 10 s) and synchronized with TTL inputs and output. Send TTL outputs via the output channels of a DB25 connector to the TTL input channels of the ViewPoint EyeTracker. Note: Astro-Med Grass Telefactor is no longer in business. |
| Current isolation device | Astro-Med Grass Telefactor | PSIU6 | Current stimulus isolation unit: enables safe delivery of constant currents by the S88 to the preparation. The PSIU6 connects by a BNC cable to one of the output channels of the S88. Multiplier switches on the PSIU6 allow the S88 to generate a wide array of current amplitudes ranging from 0.1 µA to 15 mA. |
| Alternative nerve/muscle stimulator with isolation | A-M Systems | 2100 | Isolated Pulse Stimulator: Unit has built-in isolator to produce constant currents. |
Referanslar
- Kikillus, K. H., Hare, K. M., Hartley, S. Minimizing false-negatives when predicting the potential distribution of an invasive species: A bioclimatic envelope for the red-eared slider at global and regional scales. Anim Conserv. 13, 5-15 (2010).
- Lutz, P. L., Rosenthal, M., Sick, T. J. Living without oxygen: turtle brain as a model of anaerobic metabolism. Mol Physiol. 8, 411-425 (1985).
- Lutz, P. L., Milton, S. L. Negotiating brain anoxia survival in the turtle. J Exp Biol. 207, 3141-3147 (2004).
- Storey, K. B. Anoxia tolerance in turtles: Metabolic regulation and gene expression. Comp Biochem Physiol A-Mol Integr Physiol. 147 (2), 263-276 (2007).
- Granda, A. M., Dearworth, J. R., Subramaniam, B. Balanced interactions in ganglion-cell receptive fields. Vis Neurosci. 16, 319-332 (1999).
- Dearworth, J. R., Granda, A. M. Multiplied functions unify shapes of ganglion-cell receptive fields in retina of turtle. J Vis. 2 (3), 204-217 (2002).
- Nesbit, S. C., Van Hoof, A. G., Le, C. C., Dearworth Jr, J. R. Extracellular recording of light responses from optic nerve fibers and the caudal photoreceptor in the crayfish. J Undergrad Neurosci Educ. 14 (1), A29-A38 (2015).
- McMahon, B. R. Respiratory and circulatory compensation to hypoxia in crustaceans. Resp Phsiol. 128 (3), 349-364 (2001).
- Leigh, R. J., Zee, D. S. . The neurology of eye movements. , (1999).
- Robinson, D. A. A method of measuring eye movement using a scleral search coil in a magnetic field. IEEE Trans Biomed Eng. 10, 137-145 (1963).
- Judge, S. J., Richmond, B. J., Chu, F. C. Implantation of magnetic search coils for measurement of eye position: an improved method. Vis Res. 20, 535-538 (1980).
- Ong, J. K. Y., Halswanter, T. Measuring torsional eye movements by tracking stable iris features. J Neurosci Meth. 192, 261-267 (2010).
- Kimmel, D. L., Mammo, D., Newsome, W. T. Tracking the eye non-invasively: simultaneous comparison of the scleral search coil and optical tracking techniques in the macaque monkey. Front Behav Neurosci. 6 (49), 1-17 (2012).
- Otero-Millan, J., Roberts, D. C., Lasker, A., Zee, D. S., Kheradmand, A. Knowing what the brain is seeing in three dimensions: A novel, noninvasive, sensitive, accurate, and low-noise technique for measuring ocular torsion. J Vis. 15 (14), 1-15 (2015).
- Demski, L. S., Bauer, D. H. Eye movements evoked by electrical stimulation of the brain in anesthetized fishes. Brain Behav Evol. 11, 109-129 (1975).
- Gioanni, H., Bennis, M., Sansonetti, A. Visual and vestibular reflexes that stabilize gaze in the chameleon. Vis Neurosci. 10, 947-956 (1993).
- Straka, H., Dieringer, N. Basic organization principles of the VOR: lessons from frogs. Prog Neurobio. 73 (4), 259-309 (2004).
- Voss, J., Bischof, H. -. J. Eye movements of laterally eyed birds are not independent. J Exp Biol. 212 (10), 1568-1575 (2009).
- Ariel, M. Independent eye movements in the turtle. Vis Neurosci. 5, 29-41 (1990).
- Ariel, M., Rosenberg, A. F. Effects of synaptic drugs on turtle optokinetic nystagmus and the spike responses of the basal optic nucleus. Vis Neurosci. 7, 431-440 (1991).
- Balaban, C. D., Ariel, M. A "beat-to-beat" interval generator for optokinetic nystagmus. Biol Cybern. 66, 203-216 (1992).
- Keifer, J. In vitro eye-blink reflex model: Role of excitatory amino acid receptors and labeling of network activity with sulforhodamine. Exp Brain Res. 97, 239-253 (1993).
- Keifer, J., Armstrong, K. E., Houk, J. C. In vitro classical conditioning of abducens nerve discharge in turtles. J Neurosci. 15, 5036-5048 (1995).
- Rosenberg, A. F., Ariel, M. A model for optokinetic eye movements in turtles that incorporates properties of retinal slip neurons. Vis Neurosci. 13, 375-383 (1996).
- Ariel, M. Open-loop optokinetic responses of the turtle. Vis Res. 37, 925-933 (1997).
- Anderson, C. W., Keifer, J. Properties of conditioned abducens nerve responses in a highly reduced in vitro brainstem preparation from the turtle. J Neurophysiol. 81, 1242-1250 (1999).
- Keifer, J. In vitro classical conditioning of the turtle eyeblink reflex: Approaching cellular mechanisms of acquisition. Cerebell. 2, 55-61 (2003).
- Zhu, D., Keifer, J. Pathways controlling trigeminal and auditory nerve-evoked abducens eyeblink reflexes in pond turtles. Brain Behav Evol. 64, 207-222 (2004).
- Jones, M. S., Ariel, M. The effects of unilateral eighth nerve block on fictive VOR in the turtle. Br Res. 1094, 149-162 (2006).
- Jones, M. S., Ariel, M. Morphology, intrinsic membrane properties, and rotation-evoked responses of trochlear motoneurons in the turtle. J Neurophysiol. 99 (3), 1187-1200 (2008).
- Krenz, J. G., Naylor, G. J. P., Shaffer, H. B., Janzen, F. J. Molecular phylogenetics and evolution of turtles. Mol Phylogenet Evol. 37 (1), 178-191 (2005).
- Dearworth, J. R., et al. Role of the trochlear nerve in eye abduction and frontal vision of the red-eared slider turtle (Trachemys scripta elegans). J Comp Neur. 52, 3464-3477 (2013).
- Dearworth, J. R., et al. Pupil constriction evoked in vitro by stimulation of the oculomotor nerve in the turtle (Trachemys scripta elegans). Vis Neurosci. 26, 309-318 (2009).
- Mead, K., et al. IFEL TOUR: a description of the introduction to FUN electrophysiology labs workshop at Bowdoin College, July 27-30, and the resultant faculty learning community. J Undergrad Neurosci Educ. 5, A42-A48 (2007).
- Jackson, D. C., Ultsch, G. R. Physiology of hibernation under the ice by turtles and frogs. J Exp Zool A Ecol Genet Physiol. 313 (6), 311-327 (2010).
- Romano, J. M., Dearworth, J. R. Pupil constriction evoked by stimulation of the ciliary nerve in the red-eared slider turtle (Trachemys scripta elegans). J Penns Acad Sci. 85, 4-8 (2011).
- Miller, J. M., Robins, D. Extraocular-muscle forces in alert monkey. Vis Res. 32, 1099-1113 (1992).
- Gamlin, P. D., Miller, J. M. Extraocular muscle motor units characterized by spike-triggered averaging in alert monkey. J Neurosci Meth. 204, 159-167 (2011).
- Quaia, C., Ying, H. S., Optican, L. M. The Viscoelastic properties of passive eye muscle in primates. III: Force elicited by natural elongations. PLOS ONE. 5, A236-A254 (2010).
- Anderson, S. R., et al. Dynamics of primate oculomotor plant revealed by effects of abducens microstimulation. J Neurophys. 101, 2907-2923 (2009).
- Maxwell, J. H., Harless, M., Morlock, H. Anesthesia and surgery. Turtles: Perspective and Research. , 127-152 (1979).
- AVMA Panel on Euthanasia. American Veterinary Medical Association. J Am Vet Med Assoc. 218 (5), 669-696 (2001).
- Clarke, R. J. Shaping the pupil's response to light in the hooded rat. Exp Br Res. 176, 641-651 (2007).
- Bennett, R. A. A review of anesthesia and chemical restraint in reptiles. J Zoo Wild Med. 22 (3), 282-303 (1991).
- Bickler, P. E., Buck, L. T. Hypoxia Tolerance in Reptiles, Amphibians, and Fishes: Life with Variable Oxygen Availability. Ann Rev Physiol. 69, 145-170 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır