Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Okuläre Kinematik gemessen durch In-vitro- Stimulation der Hirnnerven in die Schildkröte
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt, wie eine in-vitro- isoliert Schildkröte Kopf Vorbereitung zu verwenden, um die Kinematik des ihre Augenbewegungen zu messen. Nach der Entnahme des Gehirns aus dem Schädel können Hirnnerven mit Strömungen, Drehungen des Auges und Veränderungen der Pupille Größen quantifizieren angeregt werden.
Zusammenfassung
Nachdem Tiere eingeschläfert werden, beginnen ihre Gewebe zu sterben. Schildkröten bieten einen Vorteil wegen eine längere Überlebenszeit von ihrem Gewebe, vor allem im Vergleich zu warmblütige Wirbeltiere. Aus diesem Grund können in-vitro- Experimente in der Schildkröten für längere Zeit zu untersuchen, die neuronale Signale und Kontrolle ihrer Ziel-Aktionen durchgeführt werden. Mit einem isolierten Leiter Vorbereitung, wir Maßen die Kinematik der Augenbewegungen in Schildkröten und deren Modulation durch elektrische Signale, die von Hirnnerven durchgeführt. Nachdem das Gehirn aus dem Schädel entfernt wurde, war intakt die Hirnnerven, seziert Kopf in eine kardanische Augenbewegungen zu kalibrieren platziert. Glaselektroden wurden angebracht, um Hirnnerven (okulomotorischen, trochlear, und rectus) und stimulierte mit Strömungen, Augenbewegungen zu erwähnen. Wir überwachen Augenbewegungen mit einem Infrarot-Video-tracking-System und quantifizierte Rotationen der Augen. Strom-Impulse mit einer Reihe von Amplituden, Frequenzen, und Zug Dauer wurden verwendet, um die Auswirkungen auf die Reaktionen zu beobachten. Da die Vorbereitung vom Gehirn getrennt ist, kann der ableitenden Weg zu Muskel-Ziele isoliert untersuchen neuronale Signalisierung bei fehlender zentral verarbeitet sensorische Informationen untersucht werden.
Einleitung
Begründung für die Verwendung von rot-eared Slider Schildkröten in elektrophysiologischen Experimenten:
Rot-eared Slider Schildkröten (ist Scripta Elegans), gelten als eine der weltweit schlimmsten invasiven Arten1 und können angeben, dass ein Ökosystem in Schwierigkeiten ist. Rot-eared Slider Schildkröten sind deshalb so erfolgreich ist wenig bekannt, aber es kann teilweise durch ihre tolerante Physiologie und des Besitzes von Nervengewebe, die unter hypoxischen Bedingungen2,3,4 überleben können . Verwenden sie für Experimente nicht ihre Zahl gefährdet und mit minimalem Aufwand, elektrophysiologische Vorbereitungen lebensfähig über längere Dauer, so lange wie 18 Stunden5,6 bleiben können. Der Vorteil ist ähnlich wie der Vorteil der Verwendung von wirbellosen Tiere wie Krebse7, die auch geringe Mengen an Sauerstoff8standhalten können.
Techniken zur Messung der Augenbewegungen:
Ansätze zur Messung der Augenbewegungen in Frontal-eyed Tiere mit nicht-menschlichen Primaten sind gut entwickelte9gewesen. Das Auge dreht sich im Orbit um drei Achsen: horizontale, vertikale und Torsionssteifigkeit. Die magnetische Spule Suchmethode gilt allgemein als die zuverlässigste Messung Umdrehungen, aber ist invasiv und erfordert kleine Spulen in den Scleras der Tiere10,11eingefügt werden soll. Video-basierte Systeme können auch Rotationen Messen und haben den Vorteil, nicht-invasiv. Die Entwicklung von besseren Kameras zusammen mit innovativen Bildverarbeitung verbessert ihre Funktionalität, Video-basierte Systeme eine attraktive Alternative zu erwägen,12,13,14.
Techniken entwickelt, die zur Messung der Augenbewegungen in Nonmammals wurden viel weniger bedeutend. Maßnahmen sind entweder niedrige Auflösung oder beschreiben nur einige Umdrehungen15,16,17,18. Der Mangel an Entwicklung kann teilweise auf die Schwierigkeiten bei der Ausbildung Nonmammals, visuellen Ziele Folgen verantwortlich gemacht werden. Obwohl Augenbewegungen auch in rot-eared Slider Schildkröten19,20,21,22,23,24,25 untersucht wurden ,26,27,28,29,30, wegen der Herausforderung in Ausbildung Tiere verfolgen Ziele, die präzise Kinematik des ihre Augenbewegungen ist schlecht verstanden.
Rot-eared Slider Schildkröten gelten in der Regel Lateral-eyed Wirbeltiere, sondern weil sie ihre Köpfe in ihre Schale31vollständig zurückziehen können, erhebliche Okklusion der seitlichen Gesichtsfeld durch die Panzer tritt32. Das Ergebnis ist, dass ihre visuelle Sichtverbindung nach vorne, so dass sie eher wie Frontal-eyed Säugetiere Verhalten gezwungen ist. Ihre Verwendung als Modell für die Entwicklung von Ansätzen zur Messung der Augenbewegungen bietet daher auch eine einzigartige evolutionäre Perspektive.
In dieser Arbeit beschriebene Protokoll verwendet eine in-vitro- isoliert Kopf Vorbereitung um die Kinematik der Augenbewegungen in rot-eared Slider Schildkröten zu identifizieren. Gehirne sind aus den Schädeln der Hirnnerven intakt seziert. Köpfe sind in eine kardanische kalibrieren Augenbewegungen und evozieren Reaktionen durch elektrische Stimulation der Hirnnerven innervieren die Augenmuskeln gelegt. Maßnahmen der Rotationen von den Augen erfolgt durch ein Video-basiertes System mit Software-Algorithmen, die die dunkle Pupille und die Markierungen der Iris zu verfolgen. Die Vorbereitung bietet die Möglichkeit, die Kinematik der beiden extraokulären (d.h., horizontale, vertikale und Torsionssteifigkeit Rotationen) messen32 und intraokularen (d.h. Schüler Änderungen)33 Bewegungen.
Modellsystem zur Analyse der ableitenden Nervenbahnen:
Im Allgemeinen bietet der Ansatz Ermittler die Möglichkeit zu studieren wie ableitenden neuralen Signale generieren Augenbewegungen, wenn Muskeln aus ihren entspannten Zuständen und in Ermangelung von integrierten Sinnesinformationen verarbeitet das Gehirn32beginnen, 33. Daher kann die Auge Kinematik im Modellsystem untersucht werden, in denen sie ausschließlich durch den ableitenden neuronale Weg verlassen das Gehirn und an den muskelsegmenten synapsing verarbeitet werden.
Protokoll
Hinweis: Rot-eared Slider Schildkröten, männlich und weiblich, wurden von einem Händler gekauft. Schildkröten lebten in einer warmen Tier Suite mit zwei 60-Gallone-Wannen mit Backstein-Inseln zum Sonnen unter 250-W Infrarot-Leuchten ausgestattet. Die Umwelt blieb auf einem 14/10-h-Hell/Dunkel-Zyklus mit der Wassertemperatur auf 22 ° C. Lichter waren eingeschaltet um 06:00 und um 20:00 ausgeschaltet. Die Tanks mit Filtersystemen ausgestattet wurden wöchentlich gereinigt, und Schildkröten wurden Ad Libitum jeden zweiten Tag gefüttert. Die Pflege der rot-eared Slider Schildkröten und alle der folgenden experimentellen Verfahren beschrieben hier32,33 durch die institutionelle Tier Pflege und Nutzung Committee (IACUC) am Lafayette College angenommen wurden.
1. Geräte-Setup
- Bereiten Sie die Schildkröte Ringer-Lösung. Fügen Sie Folgendes hinzu destilliertes Wasser in dieser Reihenfolge: Natriumchlorid 96,5 mM (58.44 g/Mol), Kaliumchlorid 2,6 mM (74,56 g/Mol), Magnesiumchlorid 2,0 mM (203.31 g/Mol), Natriumbicarbonat 31,5 mM (84.01 g/Mol), Traubenzucker 20,0 mM (180.16 g/Mol), konzentriert Salzsäure zur Einstellung des pH-Wertes auf 7,51 und Calciumchlorid 4,0 mM (110.98 g/Mol) (siehe Tabelle der Materialien). Mischen Sie die Lösung, während jedes Salz hinzugefügt.
Achtung: Konzentrierte HCl ist gefährlich (Haut, Augen, Inhalation und Verschlucken Gefahren). - Tipps für die saugelektroden von 5 cm langen Kapillare machen Glas (siehe Tabelle der Materialien), durch Feuer-Polieren, verschiedene Größen von Innendurchmesser um Hirnnerven unterschiedlicher Dicke Rechnung zu tragen.
- Verwenden Sie eine kleine Datei, um eine Linie über ein Stück der Kapillare Glas zu ätzen. In Seidenpapier und brechen Sie entzwei.
- Langsam Rollen eines der Enden der Kapillare Glas in der Flamme einen Bunsenbrenner. In regelmäßigen Abständen prüfen die Tipp für Größe, Glätte und Symmetrie eine Dissektion mit Umfang und eine Fiber optic Licht Quelle (siehe Tabelle der Materialien).
Hinweis: Für Schildkröten mit Kopf Breite zwischen 20 und 30 mm Größen optimale Passform Innendurchmesser in der Regel reichen von 0,4 bis 0,8 mm für den Oculomotor Nerv (nIII), 0,3 bis 0,6 mm für trochlearis (nIV) und 0,2 bis 0,4 mm für den rectus Nerv (nVI).
- Reinigen und Rongeurs, eine stumpfe Dissektion Sonde, Microscissors, feine Pinzette, gebogenen Pinzette und Skalpell Griff mit klingen (siehe Tabelle der Materialien) für die Dissektion zu organisieren.
Hinweis: Sterilisation von Instrumenten ist optional.
(2) Anästhesie und Euthanasie
- Ort die Schildkröte in einem Eis Eimer für 60 min. zu Cryoanesthetize es.
- Die Schildkröte durch Enthauptung mit einem kleinen Tier Guillotine einschläfern (siehe Tabelle der Materialien).
- Hebeln Sie sanft die Backen des tierischen eröffnet mit einem kleinen Spatel mit einem Gewicht von, so dass ein Haken kann eingefügt und wandte sich unter der Spitze des Oberkiefers passen.
- Ziehen Sie mit gleichmäßigen Druck auf den Kopf des Tieres durch die Guillotine zu verlängern. Enthaupten Sie rasch das Tier.
- Legen Sie Schildkröte Kopf in einer Dissektion Schale. Haben Sie genug Schildkröte Ringer-Lösung zur Verfügung, um das Gewebe zu bewässern. Die Lösung mit 95/5 O2Co2 oxygenize (siehe Tabelle der Materialien).
- Pflegen Sie das Gewebe bei 4 ° C, indem man Eis um die Außenseite der Schale.
(3) Dissektion
- Verwenden Sie die Dissektion Bereich mit einer Faser Optik Lichtquelle, die Dissektion durchzuführen.
- Entfernen Sie den Unterkiefer. Legen Sie eine stumpfe Dissektion Sonde durch den Mund, um einfacher Handhabung des Kopfes zu gewährleisten. Schneiden Sie das Gelenk verbindet die dentale Knochen auf den Schädel mit einem Skalpell. Verwenden Sie Rongeurs, um den Unterkiefer Weg von den Schädel zu ziehen. Verwenden Sie Rongeurs zum Abziehen der Haut und Muskulatur aus ihren Anlagen an der dorsalen und lateralen Regionen des Schädels.
- Entfernen Sie die vertebrale Spalte.
- Identifizieren Sie die Wirbelsäule am kaudalen Ende des Schädels. Biegen der Wirbelsäule ventral um das Rückenmark zu entlarven. Verwenden Sie Microscissors, um das Rückenmark zu schnippeln. Verwenden Sie Rongeurs, um die vertebrale Spalte und andere Gewebe aus dem Schädel zu entfernen, indem kaudal ziehen.
- Entfernen Sie das Gehirn aus dem Schädel nach dem Schneiden der Hirnnerven.
- Verwenden Sie das Foramen Magnum ab, Rongeurs um zwei Einschnitte auf der dorsalen Schädel geschnitten. Kürzen Sie um eine Beschädigung des Gehirns unter oberflächlichen.
- Verwenden Sie Rongeurs die dorsalen Schädel vorsichtig abziehen. Verwenden Sie Microscissors, um die 1880er, den Rest des Gehirns aussetzen zu entfernen. Genügend 1880er zu entfernen, bis die olfaktorischen Birnen in die vorderen Schädelhöhle identifiziert werden können (siehe Abbildung 1A). Weiterhin das Gehirn mit Schildkröte Ringer-Lösung, bei Bedarf zu bewässern.
- Verwenden Sie gebogene Pinzette sanft das Großhirn kaudal ziehen und leichten Spannung auf die Hirnnerven zu produzieren. Sorgfältig weggeschnitten und die olfaktorischen Birnen und Großhirn mit gebogenen Pinzette entfernen.
- Verwenden Sie Microscissors, schieben Sie das Mittelhirn in Richtung der Mittellinie, die Hirnnerven verfügbar zu machen; nIII, ca. 0,6 mm, sehen vor nIV, und der Durchmesser der nIV werden etwas weniger als nIII. NIII und nIV schneiden, wo legen sie auf dem Mittelhirn (siehe Abbildung 1 b). Wiederholen Sie diesen Vorgang auf der anderen Seite.
- Schneiden Sie den linken und rechten Sehnerv (nII) mit Microscissors. Dann kippen Sie den Hirnstamm auf der einen Seite. NVI aus der ventralen Oberfläche in der Nähe der Kreuzung von der Pons und der Medulla zu beobachten (siehe Abbildung 1); der Durchmesser des nVI ist klein und ca. 0,3 mm. Schneiden sowohl die linken und rechten nVI.
- Entfernen Sie die restlichen Teile der Hirnstamm aus der Schildkröte mit feinen Zangen und Microscissors. Sobald die Schädel leer ist, prüfen Sie die Schädelhöhle Boden. Identifizieren Sie nIII, nIV und nVI.
- Entfernen Sie die oberen und unteren Augenlider mit feinen Zangen und Microscissors.
4. Kalibrierung der Augenbewegungen
- Verwenden Sie eine starre Tabelle (siehe Tabelle der Materialien), die Platzierung der Gimbal und andere Instrumente zu unterstützen. Legen Sie die Schildkröte Kopf in das Gimbal-Futter, so dass die dorsale Oberfläche des Kopfes parallel zum Horizont mit eine kleine Wasserwaage ruht auf dem Schädel ist. Grob ein Auge in der Mitte der horizontalen und vertikalen Rotationen der Gimbal zu positionieren.
- Legen Sie die Infrarot-Kamera, ausgestattet mit einem Infrarot-Licht emittierende Diode (LED), die Bestandteil der videobasierten Eye-tracking System ist (siehe Tabelle der Materialien), in einem Betrachtungsabstand von etwa 12 cm von der Schildkröte Auge.
- Winkel der Kameras 45 Grad über der Sichtlinie des Auges. Die LED sollte die 11:00-Position bei der Betrachtung der Kameralinse. Die LED Zentrum entlang der optischen Achse des Auges. Die Kamera werden leicht aus Achse (von oben das Auge betrachtet).
- Einstellen Sie die Entfernung von der Kamera aus dem Auge so, dass die Kamera-Ansicht maximal durch den Augapfel gefüllt wird. Stellen Sie sicher, dass die Ecken der Augen (Augenwinkel) an den Rändern der horizontalen Ansicht sind.
- Schließen Sie die Kamera, die Video-basierte Eye-tracking System zur Verarbeitung der Daten. Teilen Sie das Signal an einen DVD-Rekorder, die raw-Video zu erfassen. Fokussieren Sie die Kamera um ein klares Bild des Auges zu erhalten. Achten Sie darauf, fein-Position das Auge in der Mitte der Kameraansicht, indem die drei Grade der lineare Anpassung (X, y, Z) mit der Gimbal versehen.
- Erkennen Sie die dunkle Pupille durch Einstellen der Schwelle und Kontrast entsprechend mit dem Programm mit der videobasierten Eye-tracking-System zur Verfügung gestellt.
- Mit der Maus, klicken Sie im Menü "Video" und wählen Sie unter "Modus" "Hohe Präzision", Bilder bei einer Abtastrate von 30 Hz (Auflösung von 640 Pixel 480 Zeilen) zu erfassen. Auch unter "Video", wählen Sie "Dunkle Pupille" für "Schüler" und "Ellipse (gedrehte Ellipse)" für "Schüler-Segmentierung-Methode".
- Klicken Sie im Fenster "EyeCamera" auf das Symbol "Schüler Suche Bereich Adjustment" (kleine vertikale Rechteck mit einem Punkt in der Mitte). Verwenden Sie die Maus, um ein Rechteck ziehen, die eine Fläche um die Pupille begrenzt. Vermeiden Sie dunkle Bereiche, die verwechselt werden könnte mit der Pupille.
- Bestätigen Sie im Fenster "Controls", dass die Kontrollkästchen für "Auto Bild" und "Positive-Lock Schwelle-Tracking" aktiviert sind. Klicken Sie auf "Auto-Schwelle" zur Optimierung der Dichte des Scannens, die über die dunkle Pupille als grüne Punkte angezeigt werden.
- Kalibrieren Sie die Video-Anzeige von der Video-basierte Eye-tracking-Programm auf die Drehbewegungen des Gimbals 12,5 ° (+/-) um seine horizontale Achse und 10° (+/-) um seine vertikale Achse.
- Klicken Sie im Fenster "Controls" auf "Anzeigen". Aktivieren Sie die Kontrollkästchen unter "Blick" und "Stim" für "Blick-Punkt", "Calib Region" und "Geometrie Grid". Nach dem Markieren der Kästchen unter"Geometrie", wird ein Fenster pop-up und sagen: "die Reiz-Display-Geometrie gemessen werden muss bevor das Geometrie-Raster angezeigt werden kann. Wünschen Sie dies jetzt tun?" Wählen Sie "Y" für ja.
- Mit der Maus, klicken Sie auf das Menü "Fenster" und wählen Sie "Stimulus". Der "Stimulus" Fenster wird geöffnet, eine vertikale und horizontale Linie Kreuzung in der Mitte des Displays. Messen Sie die Länge der Zeilen auf die nächste mm. Drücken Sie "Esc" auf der Tastatur, um den "Stimulus" Fenster zu schließen.
- Mit der Maus, klicken Sie im Menü "Stimulus" und wählen Sie "Geometrie Setup". Geben Sie die Länge der Linien, die nur gemessen wurden. Einstellen Sie den Betrachtungsabstand so, dass die Grad/Zeile gleich 25 ° für die horizontale Linie und 20° für die vertikale Linie. Klicken Sie auf "Speichern" und schließen Sie das Fenster.
- Wählen Sie im Fenster "EyeSpace" die Anzahl der Kalibrierung "Datenpunkt" bis "9" sein. Klicken Sie mit der Schildkröte Auge in der Mitte positioniert das Center Daten zeigen Sie und klicken Sie auf "Neu präsentieren".
Hinweis: Das "Stimulus" Fenster wird geöffnet, und "Get Ready" erscheint in der Mitte des Bildschirms. Eine Kiste erscheint an der Center-Position und dann verschwinden. Auf seinem verschwinden wird das "Stimulus" Fenster zu schließen. Die mittlere Position sollte jetzt kalibriert werden. - Wiederholen Sie den Vorgang, durch den Gimbal rechts/links, +12,5 ° /-12,50 °, drehen und nach oben/unten + 10°/-10 °, die übrigen Datenpunkte zu kalibrieren.
- Zum Kalibrieren Torsionssteifigkeit Drehung mit Hilfe der Schablone passend Algorithmus mit der videobasierten Eye-tracking-Programm zur Verfügung gestellt. Der Algorithmus setzt eine Nullstellung anhand der Markierungen der Iris und einen Drehwinkel berechnet, wenn die Markierungen von den Schwerpunkt des Schülers versetzt werden.
- Mit dem Mauszeiger, klicken Sie auf das Menü "Fenster" und wählen Sie "Torsion". Klicken Sie auf die Schaltfläche "START" im Fenster "Torsion". Im Fenster "EyeCamera" erscheint ein Bogen über das Bild des Auges.
- Stellen Sie den Radius, den Winkel und die Länge des Bogens mit den Schiebereglern an einem Ort wo unregelmäßige Markierungen in der Iris vorhanden sind. Aktivieren Sie die Kontrollkästchen für "Echtzeit-Grafiken" und "Auto-Set nach anpassen". Falls erforderlich, stellen Sie die Helligkeit und Kontrast im Fenster mit den Steuerelementen und Re-Schwelle die dunkle Pupille (siehe Schritt 4). Klicken Sie auf die Schaltfläche "Vorlage festlegen".
- Legen Sie ein Lineal in der gleichen Brennebene als die Pupille und zeichnen Sie die Breite der vollen Kameraansicht auf. Der Wert wird später verwendet werden, um die tatsächliche Breite des Schülers zu bestimmen.
(5) Positionierung der Saug-Elektrode auf Hirnnerven, Augenbewegungen zu erwähnen
- Legen Sie vorsichtig eine Referenzelektrode Pin in das Bindegewebe oder Muskel Gewebe noch auf den Kopf.
- Legen Sie die Saug-Elektrode (siehe Tabelle der Materialien) an den Hirnnerven mit einem Mikromanipulator und Dissektion Bereich auf einem Ausleger montiert. Verwenden Sie eine Faser Optik Lichtquelle zum Anzeigen und leiten die Platzierung.
- Passen Sie die Größe eines Nervs zu einer Kapillare Glas-Spitze. Trial And Error ist notwendig, eine ausgleichsgerade rund um den Durchmesser eines Nervs zu erhalten (siehe Schritt 1.2 für Größenempfehlungen). Setzen Sie die Glas-Spitze auf die Absaugung Elektrode. Füllen Sie die Saug-Elektrode mit Ringer Lösung und stellen Sie die Lautstärke in die Spritze auf etwa die Hälfte seiner Kapazität.
- Vorsichtig bewegen die Glas-Spitze der Elektrode mit dem Mikromanipulator in eine Position über dem Schnitt-Ende des ausgewählten Nerven. Stellen Sie sicher, dass Ringer Lösung die Schädel füllt und die Spitze unter der Oberfläche ist. Verwenden Sie ggf. die Modelliermasse zu Aufnahmeorten dam wo die Ringer-Lösung aus dem Schädel undicht ist.
- Ziehen Sie den Kolben der Spritze zurück.
Hinweis: Das Vakuum wird den Nerv in Ende der Kapillare Spitze ziehen. Eine gute Passform wird durch den Nerv noch in der Spitze mit wenig oder gar keine zusätzliche Vakuum angewendet.
6. Förderung der Hirnnerven und Analyse von Augenbewegungen
- Eine Allzweck-Nerv/Muskel-Stimulator mit einem aktuellen Isolation Gerät verwenden (siehe Tabelle der Materialien) zu den Hirnnerven über die Absaugung Elektrode stimulieren.
- Schließen Sie die Saug-Elektrode an das Stromgerät Isolierung über ein Kabel an. Verbinden Sie das Kabel von der Pin-Referenz-Elektrode, die Erdung des Gerätes isoliert.
- Wählen Sie die Parameter der Ströme mit den Zifferblättern und schaltet auf dem Stimulator und Isolation Gerät. Verwenden Sie eine Reihe von Ströme von 1 bis 100 µA mit Frequenz von 10 bis 400, die Hz mit 1 oder 2 ms in den Zügen von 100, 500 oder 1.000 ms pulsiert.
- Notieren Sie das Timing der Stimulationen.
Hinweis: Transistor-Transistor-Logik (TTL) Hülsenfrüchte werden synchronisiert mit den Lieferungen der Ströme aus den Stimulator und kommunizieren Sie in Echtzeit über ein Kabel mit Eingangskanäle der videobasierten Eye-tracking System. Ein Software-Modul zur Verfügung gestellt mit der videobasierten Eye tracking Programm steuert die Kommunikation.- Um das Timing der aktuellen Anwendungen und deren Einfluss auf Augenbewegungen sichtbar zu machen, klicken Sie im Menü "PenPlots". "Wählen Sie X blicken Position", "Y-Blick-Position", "Torsion" und "Pupillenweite" Real-Time Rohdaten Grundstücke zeigen für X und Y Positionen, Torsion und Pupillenweite Auge. Wählen Sie auch die "Sekunden & Marken" aus dem Menü "PenPlots" ein Timing-Grundstück mit Teilstrichen, zeigen die in 1 s Abständen erscheinen.
Hinweis: Ein Großbuchstabe "T" erscheint markiert den Beginn des TTL-Impulses, gleichzeitig mit der aktuellen Anwendung auftreten. - Um die Daten der Augenbewegungen, hervorgerufen durch Strömungen zu speichern, klicken Sie auf das Menü "Datei" und wählen Sie "Neue Datei" unter "Daten". Geben Sie einen Dateinamen ein und drücken Sie "Enter". Speichern Daten können pausiert werden und dann neu gestartet, mit der Kombination der wichtigsten Befehle, "Strg" + "p". Wenn eine experimentelle Sitzung abgeschlossen ist, wählen Sie "Datei schließen Daten" off "Datei"-Menü unter "Daten".
- Um die Art der Ströme angewendet den Überblick behalten, klicken Sie auf das Menü "Fenster" und wählen Sie "Daten-Pad". "Tastatur/Datenpunktmarkierungen" Fenster wird angezeigt. Klicken Sie auf einen Buchstaben oder eine Zahl, um die Parameter der aktuellen Stimulationen an den Nerv zu identifizieren.
Hinweis: zum Beispiel "X" stehen könnte für 10 µA. speichert durch Klicken auf "X" Einzug in die Datendatei in Echtzeit für die post-Hoc Analyse. Es erscheint auch auf der "PenPlot" für "Sekunden & Marker" für die laufende Beobachtung.
- Um das Timing der aktuellen Anwendungen und deren Einfluss auf Augenbewegungen sichtbar zu machen, klicken Sie im Menü "PenPlots". "Wählen Sie X blicken Position", "Y-Blick-Position", "Torsion" und "Pupillenweite" Real-Time Rohdaten Grundstücke zeigen für X und Y Positionen, Torsion und Pupillenweite Auge. Wählen Sie auch die "Sekunden & Marken" aus dem Menü "PenPlots" ein Timing-Grundstück mit Teilstrichen, zeigen die in 1 s Abständen erscheinen.
- Analysieren von Daten aus der Eye-Tracker-System.
- Öffnen Sie die gespeicherte Datendatei, die in einem Textformat abgegrenzt ist, in eine Ausbreitung Blatt Programm Ihrer Wahl zu organisieren der Daten und statistische Analysen durchzuführen.
- Konvertieren Sie die Pupille Breitenwerte in der Datei zu realen Größen in mm gespeichert.
- Konvertieren Sie die Werte von X und Y Augen-Positionen und Torsionen in Einheiten von Grad und Konventionen für die Beschreibung von Augenbewegungen zu verwenden; daher positive Richtungen der Drehungen: Intorsion, Höhe und Adduktion; und negative Richtungen der Drehungen: Machtmissbrauchs, Depression und Entführung.
- Kopieren Sie die Header-Informationen in einem neuen Arbeitsblatt. Dazu gehören Werte für die Display-Größe (Breite und Höhe) und der Betrachtungsabstand. Acht Säulen der Daten mit einer Rate von 30 Hz werden unterhalb der Headerinformationen folgen.
- Gehen Sie zurück in das Arbeitsblatt enthält die Rohdaten. Führen Sie eine "Entdeckung" für "X" in der letzten Spalte mit dem Titel "Marker" um zu suchen, wo die Stimulation mit 10 µA. angewandt wurde finden Inzidenz von "T", markiert den Beginn der aktuellen Stimulation. 15 Zeilen kopieren (0,5 s) von Daten, die vor dem "T" und 90 Frames nach "T" (3.0 s); d. h.3,5 s gesamt. Fügen Sie die Daten in das neue Arbeitsblatt unterhalb der Headerinformationen.
- Fügen Sie eine leere Spalte nach "PupilWidth". In die leere Spalte Konvertieren der kalibrierten Dimension in mm:
Horizontale Schüler Durchmesser = "PupilWidth" × die Dimension der Kamera Ansicht Breite - Fügen Sie 2 leere Spalten nach "X_Gaze" und "Y_Gaze". Positionen auf die Abmessungen des Bildschirms anzeigen zu normalisieren: Koordinaten (0, 0) an der Spitze der Bildschirm erweitern Links (1, 1) unten rechts. In der ersten leeren Spalte übersetzen Positionen auf ein Koordinatensystem mit (0, 0) in der Mitte des Bildschirms. Nehmen Sie die Umstellung auf die Abmessungen des Bildschirms in mm:
X = (0,5 × Breite) – ("X_Gaze" × Breite); Y = (0,5 × Höhe) – ("Y_Gaze" × Höhe)
Hinweis: Die Reihenfolge der Betrieb ist für das linke Auge. Die Reihenfolge muss für das rechte Auge rückgängig gemacht werden, um die Konvention von Negativität für Entführung und Positivität für Adduktion zu folgen. - Verwenden Sie in der zweiten Spalte Trigonometrie Funktionen zum Konvertieren in Winkel (°) der Drehung:
horizontale Drehung = Arctan (X/viewing Abstand); vertikale Rotation = Arctan (Y-/viewing-Abstand) - Torsion ist in Einheiten von Grad bereits gezeigt, aber angepasst zur Konvention der Positivität für Intorsion, wenn Messung auf dem linken Auge erfolgt, mit-1 multipliziert. Für das rechte Auge ist keine Vervielfachung notwendig. Das Programm-codes Drehung im Uhrzeigersinn positiv.
- Darstellen Sie der Durchmesser der Pupille und Rotationen als Funktion der Zeit.
- Öffnen Sie die gespeicherte Datendatei, die in einem Textformat abgegrenzt ist, in eine Ausbreitung Blatt Programm Ihrer Wahl zu organisieren der Daten und statistische Analysen durchzuführen.
Ergebnisse
Abbildung 1 zeigt Standbilder von Bilder aus einem Video beschreibt die Dissektion. Bilder bieten typische Standorte der Nerven vor dem Schneiden aus dem Gehirn.
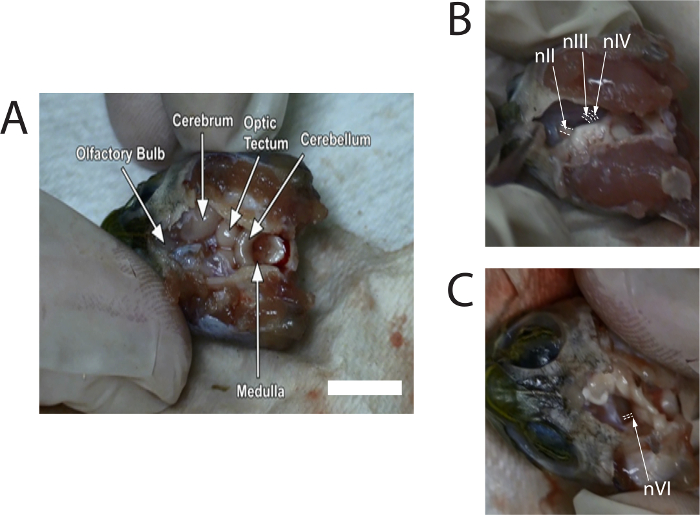
Abbildung 1: Standbilder von Bildern aus dem Video von der Dissektion anzuzeigenden Standorte der Sehnerv (nII), Oculomotor Nerv (nIII), trochlearis...
Diskussion
Wichtige Schritte:
Die entscheidenden Schritte innerhalb dieses Protokolls sind die folgenden: 1) die Zerlegung und die Sorgfalt, die zur Aufrechterhaltung der Lebensfähigkeit der durchtrennten Nerven; (2) die passenden Größen von saugelektroden, Hirnnerven, konsistente Antworten bereitzustellen; und 3) die Platzierung des Kopfes in den Gimbal, adäquate Kalibrierung der Umdrehungen des Auges zu bieten.
Fehlerbehebung:
Die Dissektion kann ei...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren danken Frau Paulette McKenna und Lisa Pezzino in dieser Studie für Sekretariat und Herr Phil Auerbach für den technischen Support. Die Autoren danken auch DRS. Michael Ariel und Michael S. Jones (Saint Louis University School of Medicine) für die Einführung von uns, die in-vitro- isoliert Kopf Vorbereitung. Unterstützung dieser Zusammenarbeit wurde von der Fakultät für Biologie (Robert S. Chase Fund), Academic Research Committee und die Neurowissenschaften Programm am Lafayette College finanziert. Schließlich ist diese Arbeit Herr Phil Auerbach, gewidmet der 28. September 2016 verstorben; er ein Rasterelektronenmikroskop stillgelegt und erkannte den Nutzen seiner 5-Achs-Bühne für den Einsatz in diesem Protokoll. Seine Freundschaft und Einfallsreichtum werden sehr vermisst werden.
Materialien
| Name | Company | Catalog Number | Comments |
| Red-eared slider turtles | Kons Scientific | Trachemys scripta elegans | Large size (carapace length 15-20 cm) |
| Sodium chloride | Sigma-Aldrich Co. LLC. | S5886 | |
| Potassium chloride | Sigma-Aldrich Co. LLC. | P5405 | |
| Magnesium choride | Sigma-Aldrich Co. LLC. | M7304 | |
| Sodium bicarbonate | Sigma-Aldrich Co. LLC. | S5761 | |
| Dextrose | Sigma-Aldrich Co. LLC. | C5767 | |
| Concentrated hydrochloric acid | Sigma-Aldrich Co. LLC. | H7020 | |
| Calcium chloride | Sigma-Aldrich Co. LLC. | C7902 | |
| pH meter | Oakton | pH 6+ | |
| Suction stimulation electrode | A-M Systems | 573000 | Bipolar suction electrode. Note that 573000 has been replaced with 573050. |
| Capillary glass | A-M systems | 626000 | Single-barrel borosilicate capillary glass without microfilament, length 10 cm, outside diameter 1.0 mm, inner diameter 0.50 mm |
| Alternative suction stimulation electrode | A-M Systems | 573050 | Bipolar suction electrode. Requires larger diameter capillary glass: 627000, outside diameter 1.2 mm, inner diameter 0.68 mm |
| Stereoscope | Lieca | GZ7 | Magnification range, 10x – 70x |
| Fiber optic light source | Amscope | HL250-A | 150W Fiber optical microscope illuminator light box |
| Rongeurs | Carolina Biological Supply Company | 625654 | stainless steel, straight spring, 5.25" |
| Blunt dissection probe | Carolina Biological Supply Company | 627405 | Huber mall probe, double-ended probe and seeker, 6" |
| Microscissors | Carolina Biological Supply Company | 623555 | Iris microdissecting scissors, stainless steel, 0.5" blades, 4.75" long |
| Fine forceps | Sigma-Aldrich Co. LLC. | F6521 | Jewelers forceps, dumont No. 5, inox alloy, 4.25" |
| Curved forceps | Sigma-Aldrich Co. LLC. | Z168696 | Medium tip, curved forceps, stainless steel, 4" |
| Scalpel handle | Sigma-Aldrich Co. LLC. | S2896 | Scalpel handles, No. 3, stainless steel |
| Scalpel blade | Sigma-Aldrich Co. LLC. | S2771 | Scalpel blades, No. 11, steel |
| Guillotine | Harvard Apparatus | 73-1918 | Kleine guillotine type 7575 |
| Spatula | Sigma | Z648299 | Micro spoon and spatula weighing set. Use small spatula: 5.9” long x 0.07” diameter handle with square end: 0.17” x 1.3” long, other end round: 0.17” x 1.27” long |
| Hook | Autozone | 98069 | SureBilt hook and pick set. Use grinder to dull sharp points of hook to prevent injury to animals mouth. |
| 95/5% O2/CO2 | Airgas, Inc. | X02OX95C2003102 | 5% Carbon dioxide balance oxygen certified standard gas mixture, size 200 Cylinder, CGA-296 |
| Regulator | Airgas, Inc. | Y11244D296-AG | Single stage brass 0-100 psi analytical cylinder regulator CGA-296 with needle outlet. Use brass adjustable airline pipe valve to go from 3/8", inner diameter, vinyl airline tubing connected to regulator to a 3/16", inner diameter, airline connection going to airstone or glass pasteur pipette. |
| Adjustable airline pipe valve | Doctors Foster and Smith | CD-12061 | Brass valve |
| Rigid table | Unknown | Unknown | Auto-clave door laid on top of a sturdy table. Nine 5" diameter tennis balls isolate vibrations from the top surface of the table. |
| 5" tennis ball | Petco Animal Supplies, Inc. | 712868 | Petco Jumbo Pet Tennis Ball: balls are unsliced and held within an integrated frame on the underside part of the autoclave door. |
| Alternative vibration isolation table | Newport Corporation | INT1-36-6-N | Rigid vibration control system, integrity 1: Surface dimensions, 3' x 6' |
| Gimbal | ISI, International Scientific Instruments, Inc. | Stage from SUPER III-A Scanning EM | 5-axis eucentric stage: X, Y, and Z linear movements, ±20 mm, 0.1 mm precision; Rotations, vertical, ±10°, and horizontal, ±12.5°, with 1.25° precision. Note: from decommission instrument. |
| Chuck for gimbal | Unknown | Unknown | Chuck from an old microtome of unknown manufacture was machined to fit the shaft of the specimen holder of the Scanning EM stage |
| Alternative gimbal | ThorLabs, Inc. | GN2/M with MBT602/M | Dual-axis goniometer (GN2/M) mounted on 3-axis microblock stage with thumbscrew adjusters (MBT602/M): design a chuck to hold turtle head with eye at 12.7 mm above top surface of goniometer (distance to point of rotation) |
| Video-based eye tracking system | Arrington Research, Inc. | ViewPoint EyeTracker, PC-60 | Tracking method: Infrared video by dark pupil; Black and white camera (Item BC02): 30 Hz, 640 x 480; System requirements: Windows 2000, XP, 7, 8, 8.1, 10; Visual range: Horizontal +/- 44°; vertical +/- 20°; Accuracy ~0.5°; Spatial resolution ~0.15°; Pupil size resolution ~0.03 mm; Eye data: X, Y position of gaze, pupil height and width, torsion, delta time, total time, and regions of interest (ROI); Real-time communication (Item 0022): 4-Channel AnalogOut with eight TTL input channels to mark codes into the data file |
| Multi-position magnetic base | Harbor Freight Tools | Pittsburg, item #5645 | Magnetic holder reaches up to 12" and produces 45 lbs. of magnetic pull. Use to position camera. Machine thread holes onto the end of the rod to mount cameras. |
| Micromanipulator | Kopf | 900 | 5 axis manipulation for mount of suction electrode: X, Y, Z linear travel, 2 axis of rotation |
| Dissection scope on boom | Lieca | GZ6 | Magnification range, 6.7x – 40x |
| Nerve/muscle stimulator | Astro-Med Grass Telefactor | Grass S88 | Dual pulse voltage stimulator: two output channels that can be operated independently or synchronized to generate non-isolated constant voltage pulses (10 mv to 150 V). Pulses can be single (10 μsec to 10 sec), repetitive (0.01 Hz to 1 KHz), and trains (1 ms to 10 s) and synchronized with TTL inputs and output. Send TTL outputs via the output channels of a DB25 connector to the TTL input channels of the ViewPoint EyeTracker. Note: Astro-Med Grass Telefactor is no longer in business. |
| Current isolation device | Astro-Med Grass Telefactor | PSIU6 | Current stimulus isolation unit: enables safe delivery of constant currents by the S88 to the preparation. The PSIU6 connects by a BNC cable to one of the output channels of the S88. Multiplier switches on the PSIU6 allow the S88 to generate a wide array of current amplitudes ranging from 0.1 µA to 15 mA. |
| Alternative nerve/muscle stimulator with isolation | A-M Systems | 2100 | Isolated Pulse Stimulator: Unit has built-in isolator to produce constant currents. |
Referenzen
- Kikillus, K. H., Hare, K. M., Hartley, S. Minimizing false-negatives when predicting the potential distribution of an invasive species: A bioclimatic envelope for the red-eared slider at global and regional scales. Anim Conserv. 13, 5-15 (2010).
- Lutz, P. L., Rosenthal, M., Sick, T. J. Living without oxygen: turtle brain as a model of anaerobic metabolism. Mol Physiol. 8, 411-425 (1985).
- Lutz, P. L., Milton, S. L. Negotiating brain anoxia survival in the turtle. J Exp Biol. 207, 3141-3147 (2004).
- Storey, K. B. Anoxia tolerance in turtles: Metabolic regulation and gene expression. Comp Biochem Physiol A-Mol Integr Physiol. 147 (2), 263-276 (2007).
- Granda, A. M., Dearworth, J. R., Subramaniam, B. Balanced interactions in ganglion-cell receptive fields. Vis Neurosci. 16, 319-332 (1999).
- Dearworth, J. R., Granda, A. M. Multiplied functions unify shapes of ganglion-cell receptive fields in retina of turtle. J Vis. 2 (3), 204-217 (2002).
- Nesbit, S. C., Van Hoof, A. G., Le, C. C., Dearworth Jr, J. R. Extracellular recording of light responses from optic nerve fibers and the caudal photoreceptor in the crayfish. J Undergrad Neurosci Educ. 14 (1), A29-A38 (2015).
- McMahon, B. R. Respiratory and circulatory compensation to hypoxia in crustaceans. Resp Phsiol. 128 (3), 349-364 (2001).
- Leigh, R. J., Zee, D. S. . The neurology of eye movements. , (1999).
- Robinson, D. A. A method of measuring eye movement using a scleral search coil in a magnetic field. IEEE Trans Biomed Eng. 10, 137-145 (1963).
- Judge, S. J., Richmond, B. J., Chu, F. C. Implantation of magnetic search coils for measurement of eye position: an improved method. Vis Res. 20, 535-538 (1980).
- Ong, J. K. Y., Halswanter, T. Measuring torsional eye movements by tracking stable iris features. J Neurosci Meth. 192, 261-267 (2010).
- Kimmel, D. L., Mammo, D., Newsome, W. T. Tracking the eye non-invasively: simultaneous comparison of the scleral search coil and optical tracking techniques in the macaque monkey. Front Behav Neurosci. 6 (49), 1-17 (2012).
- Otero-Millan, J., Roberts, D. C., Lasker, A., Zee, D. S., Kheradmand, A. Knowing what the brain is seeing in three dimensions: A novel, noninvasive, sensitive, accurate, and low-noise technique for measuring ocular torsion. J Vis. 15 (14), 1-15 (2015).
- Demski, L. S., Bauer, D. H. Eye movements evoked by electrical stimulation of the brain in anesthetized fishes. Brain Behav Evol. 11, 109-129 (1975).
- Gioanni, H., Bennis, M., Sansonetti, A. Visual and vestibular reflexes that stabilize gaze in the chameleon. Vis Neurosci. 10, 947-956 (1993).
- Straka, H., Dieringer, N. Basic organization principles of the VOR: lessons from frogs. Prog Neurobio. 73 (4), 259-309 (2004).
- Voss, J., Bischof, H. -. J. Eye movements of laterally eyed birds are not independent. J Exp Biol. 212 (10), 1568-1575 (2009).
- Ariel, M. Independent eye movements in the turtle. Vis Neurosci. 5, 29-41 (1990).
- Ariel, M., Rosenberg, A. F. Effects of synaptic drugs on turtle optokinetic nystagmus and the spike responses of the basal optic nucleus. Vis Neurosci. 7, 431-440 (1991).
- Balaban, C. D., Ariel, M. A "beat-to-beat" interval generator for optokinetic nystagmus. Biol Cybern. 66, 203-216 (1992).
- Keifer, J. In vitro eye-blink reflex model: Role of excitatory amino acid receptors and labeling of network activity with sulforhodamine. Exp Brain Res. 97, 239-253 (1993).
- Keifer, J., Armstrong, K. E., Houk, J. C. In vitro classical conditioning of abducens nerve discharge in turtles. J Neurosci. 15, 5036-5048 (1995).
- Rosenberg, A. F., Ariel, M. A model for optokinetic eye movements in turtles that incorporates properties of retinal slip neurons. Vis Neurosci. 13, 375-383 (1996).
- Ariel, M. Open-loop optokinetic responses of the turtle. Vis Res. 37, 925-933 (1997).
- Anderson, C. W., Keifer, J. Properties of conditioned abducens nerve responses in a highly reduced in vitro brainstem preparation from the turtle. J Neurophysiol. 81, 1242-1250 (1999).
- Keifer, J. In vitro classical conditioning of the turtle eyeblink reflex: Approaching cellular mechanisms of acquisition. Cerebell. 2, 55-61 (2003).
- Zhu, D., Keifer, J. Pathways controlling trigeminal and auditory nerve-evoked abducens eyeblink reflexes in pond turtles. Brain Behav Evol. 64, 207-222 (2004).
- Jones, M. S., Ariel, M. The effects of unilateral eighth nerve block on fictive VOR in the turtle. Br Res. 1094, 149-162 (2006).
- Jones, M. S., Ariel, M. Morphology, intrinsic membrane properties, and rotation-evoked responses of trochlear motoneurons in the turtle. J Neurophysiol. 99 (3), 1187-1200 (2008).
- Krenz, J. G., Naylor, G. J. P., Shaffer, H. B., Janzen, F. J. Molecular phylogenetics and evolution of turtles. Mol Phylogenet Evol. 37 (1), 178-191 (2005).
- Dearworth, J. R., et al. Role of the trochlear nerve in eye abduction and frontal vision of the red-eared slider turtle (Trachemys scripta elegans). J Comp Neur. 52, 3464-3477 (2013).
- Dearworth, J. R., et al. Pupil constriction evoked in vitro by stimulation of the oculomotor nerve in the turtle (Trachemys scripta elegans). Vis Neurosci. 26, 309-318 (2009).
- Mead, K., et al. IFEL TOUR: a description of the introduction to FUN electrophysiology labs workshop at Bowdoin College, July 27-30, and the resultant faculty learning community. J Undergrad Neurosci Educ. 5, A42-A48 (2007).
- Jackson, D. C., Ultsch, G. R. Physiology of hibernation under the ice by turtles and frogs. J Exp Zool A Ecol Genet Physiol. 313 (6), 311-327 (2010).
- Romano, J. M., Dearworth, J. R. Pupil constriction evoked by stimulation of the ciliary nerve in the red-eared slider turtle (Trachemys scripta elegans). J Penns Acad Sci. 85, 4-8 (2011).
- Miller, J. M., Robins, D. Extraocular-muscle forces in alert monkey. Vis Res. 32, 1099-1113 (1992).
- Gamlin, P. D., Miller, J. M. Extraocular muscle motor units characterized by spike-triggered averaging in alert monkey. J Neurosci Meth. 204, 159-167 (2011).
- Quaia, C., Ying, H. S., Optican, L. M. The Viscoelastic properties of passive eye muscle in primates. III: Force elicited by natural elongations. PLOS ONE. 5, A236-A254 (2010).
- Anderson, S. R., et al. Dynamics of primate oculomotor plant revealed by effects of abducens microstimulation. J Neurophys. 101, 2907-2923 (2009).
- Maxwell, J. H., Harless, M., Morlock, H. Anesthesia and surgery. Turtles: Perspective and Research. , 127-152 (1979).
- AVMA Panel on Euthanasia. American Veterinary Medical Association. J Am Vet Med Assoc. 218 (5), 669-696 (2001).
- Clarke, R. J. Shaping the pupil's response to light in the hooded rat. Exp Br Res. 176, 641-651 (2007).
- Bennett, R. A. A review of anesthesia and chemical restraint in reptiles. J Zoo Wild Med. 22 (3), 282-303 (1991).
- Bickler, P. E., Buck, L. T. Hypoxia Tolerance in Reptiles, Amphibians, and Fishes: Life with Variable Oxygen Availability. Ann Rev Physiol. 69, 145-170 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten