Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Síntesis de ésteres mediante una esterificación Steglich más verde en acetonitrilo
En este artículo
Resumen
Una reacción de esterificación Steglich modificada fue utilizada para sintetizar una pequeña biblioteca de derivados de éster con los alcoholes primarios y secundarios. La metodología utiliza un acetonitrilo solvente, no halogenados y más verde y permite el aislamiento producto de altos rendimientos sin necesidad de purificación cromatográfica.
Resumen
La Steglich esterificación es una reacción utilizada para la síntesis de ésteres de ácidos carboxílicos y alcoholes. Eficiente y suave, la reacción es comúnmente realizado usando cloro o sistemas solventes amida, que son peligrosos para la salud humana y el medio ambiente. Nuestra metodología utiliza acetonitrilo como un más verde y menos sistema de solventes peligroso. Este protocolo exhibe tasas y rendimientos comparables a los sistemas solventes tradicionales y emplea una extracción y la secuencia de lavado que elimina la necesidad de la purificación del producto éster mediante cromatografía en columna. Este método general puede utilizarse para acoplar una variedad de ácidos carboxílicos con 1° y alcoholes alifáticos 2°, bencílica y alílicos alcoholes y fenoles para obtener ésteres puros en altos rendimientos. El objetivo del protocolo detallado aquí es brindar una alternativa más ecológica a una reacción de esterificación común, que podría servir útil para la síntesis del éster en aplicaciones industriales y académicos.
Introducción
Compuestos de éster son ampliamente utilizados para los usos tales como compuestos de sabor, productos farmacéuticos, cosméticos y materiales. Comúnmente, el uso de carbodiimida reactivos de acoplamiento se utiliza para facilitar la formación de un éster de un ácido carboxílico y un alcohol1. Por ejemplo, en la esterificación Steglich, diciclohexilcarbodiimida (DCC) es reaccionado con un ácido carboxílico en presencia de 4-dimethylaminopyridine (DMAP) para formar un derivado ácido activado, generalmente en un sistema de solventes clorado o dimetilformamida (DMF)2,3,4. El derivado ácido activado entonces sufre una sustitución nucleofílica de acilo con un alcohol para formar el producto de ester, que generalmente se purifica mediante cromatografía. La esterificación Steglich permite acoplamiento suave de grandes y complejos ácidos carboxílicos y alcoholes, incluyendo sterically obstaculizan alcoholes secundarios y terciarios2,5,6. El objetivo de este trabajo es modificar el protocolo de esterificación Steglich estándar para proporcionar una opción más verde sintético para esta reacción de esterificación común.
Un aspecto importante en el diseño de nuevas metodologías sintéticas es tratar de minimizar el uso y la formación de sustancias peligrosas. Los doce principios de la química verde7 puede utilizarse para proporcionar una guía para la creación de síntesis más seguro. Algunos de estos incluyen la prevención de la generación de residuos (principio 1) y el uso de disolventes más seguros (principio 5). En particular, disolventes representan el 80-90% de la masa no acuoso de los materiales en la fabricación de productos farmacéuticos8. Por lo tanto, modificar un protocolo para usar un solvente menos peligroso puede hacer un gran impacto en el verdor de una reacción orgánica.
Las reacciones de esterificación Steglich utilizan sistemas solventes tratados con cloro anhidros o DMF; sin embargo, estos solventes son motivo de preocupación para el medio ambiente y la salud. Diclorometano (CH2Cl2) y cloroformo (CHCl3) son probables carcinógenos humanos y DMF tiene preocupaciones de toxicidad para la reproducción9. Además, CH2Cl2 es10que agotan la capa de ozono. Así, un solvente menos peligroso para la esterificación de Steglich sería de gran utilidad. Si bien no hay todavía verde sustitución de disolventes apróticos polares, acetonitrilo se recomienda como sustituto más verde para el CH2Cl2, CHCl3y DMF9. Acetonitrilo en la actualidad se produce como un subproducto en la fabricación de acrilonitrilo; sin embargo, una síntesis verde de acetonitrilo de la biomasa a nivel académico ha sido reportado11y posibles opciones para la reutilización y la recuperación de los flujos de residuos están siendo investigados12. Acetonitrilo se ha utilizado previamente como una alternativa solvente más verde para el acoplamiento de reacciones de síntesis de péptidos de fase de sólido de carbodiimida para formar amida vínculos13. El uso de acetonitrilo como disolvente para esterificación Steglich ha sido demostrada14,15,16,17,18,19, 20,21; sin embargo, estos métodos no se han centrado en el aspecto verde del solvente y también emplean más purificación mediante cromatografía en columna.
Reducir la necesidad de cromatografía en columna como un paso de purificación también minimiza residuos solventes peligrosos8. Además de utilizar un disolvente de reacción menos peligroso, la metodología permite el aislamiento del producto muy puro sin necesidad de cromatografía. El reactivo de acoplamiento utilizados tradicionalmente diciclohexilcarbodiimida (DCC) es sustituido con 1-etil - 3-(3-dimetilaminopropil) carbodiimida clorhidrato (EDC). El grupo funcional amina básica este reactivo permite cualquier reactivos residuales para ser retirado a través de pasos de lavado ácido y básico y los subproductos de la reacción.
El protocolo aquí presentado puede utilizarse con una variedad de ácido y alcohol asociados (figura 1). Se utilizó para sintetizar una pequeña biblioteca de cinamil derivados de éster con primaria, secundaria, bencilo y alilo alcoholes y fenoles22. Además, la velocidad de la reacción de esterificación en acetonitrilo es comparable a la de los clorados y sistemas disolvente DMF, sin necesidad de secar o destilar el acetonitrilo antes la reacción22. Los ésteres sintetizados a partir de los alcoholes terciarios no se han aislado, que actualmente es una limitación de la metodología en comparación con la esterificación Steglich tradicional en clorados solventes23. Además, otros grupos ácido-labile podrían verse afectadas por los pasos de lavado ácido, potencialmente haciendo necesario la cromatografía en columna para la purificación después de la extracción de acetonitrilo. A pesar de estas limitaciones, la reacción es un método fácil y general para la síntesis de ésteres de alto rendimiento utilizando una variedad de componentes de alcohol y ácido carboxílico. El uso de un sistema de solventes más verde y sin necesidad de pasos de cromatografía de alta pureza hacen de este una alternativa atractiva a una esterificación Steglich tradicional del protocolo.
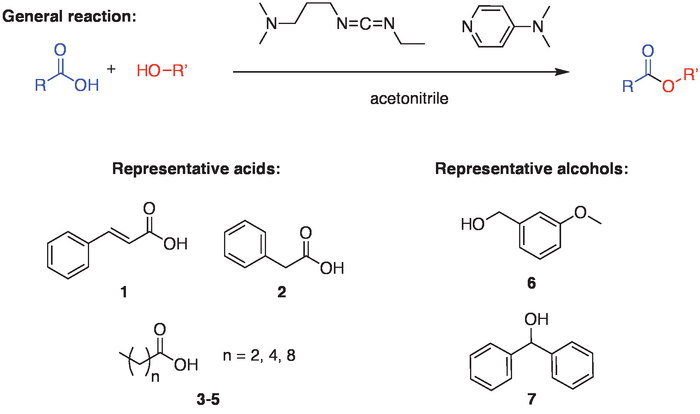
Figura 1. Esquema de reacción general. El esquema general para la reacción involucra la Unión de un ácido carboxílico y un alcohol, que se facilita con un agente de acoplamiento reactivo carbodiimida (1-etil - 3-(3-dimetilaminopropil) carbodiimida clorhidrato o EDC) y (4-dimethylaminopyridine DMAP) en acetonitrilo. Para demostrar la amplitud de la reacción, los ésteres se formaron mediante diversos ácidos (1-5) con un alcohol secundario (7) o primaria (6). Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
PRECAUCIÓN: Consultar hojas de seguridad (SDSs) antes del uso de los productos químicos en este procedimiento. Uso equipo de protección personal (EPP) como splash gafas, bata de laboratorio y nitrilo o guantes de butilo como muchos de los reactivos y disolventes son inflamables o corrosivos. Llevar a cabo todas las reacciones en una campana de humos. No es necesario para cristalería seco o con atmósfera de nitrógeno para este protocolo.
1. reacción de acoplamiento carbodiimida para alcoholes primarios
- De 50 mL redondo matraz de fondo, combinar (E)-ácido cinámico (1,02 mmol, mg 151, 1.2 equiv), DMAP (312 mg, 2.55 mmol, 3 equiv) y EDC (244 mg, 1,28 mmol, equivalente 1,5). Añadir acetonitrilo (15 mL) y alcohol 3-methoxybenzyl (μL 98, 0,85 mmol, 1 equiv) a la mezcla junto con una barra de agitación.
PRECAUCIÓN: Acetonitrilo es un disolvente inflamable. - Sujete el frasco en un baño de agua de 40 ° C y agitar la reacción.
Nota: Si refiere a la reacción de un alcohol aromático, vigile la reacción por la pérdida del alcohol mediante cromatografía en capa fina (TLC) con acetato de etilo/hexano 1:3. La reacción es completa cuando el lugar de alcohol ya no es visible en la placa de TLC por la irradiación con una lámpara UV.
2. extracción Workup
- Una vez que la reacción está completa según lo indicado por el TLC o después de 45 minutos, retire el acetonitrilo a presión reducida utilizando un rotavapor para obtener un sólido crudo.
Nota: Por favor vea recursos adicionales para la información sobre el uso de un evaporador rotativo24,25. - A los residuos, añadir éter dietílico (20 mL) y 1 M HCl (20 mL). Agitar el matraz para disolver el residuo en las capas de solvente.
PRECAUCIÓN: el éter dietílico es un disolvente muy inflamable.
Nota: Para disminuir el riesgo de solvente, acetato de etilo puede usarse en lugar del éter dietílico; sin embargo, existe un mayor potencial para la formación de una emulsión durante las etapas de extracción y lavado. - Verter la solución en un matraz de filtración. Enjuague el matraz de evaporación con éter dietílico adicional (5 mL) y añadir el enjuague el matraz.
- Agite suavemente el matraz de filtración para extraer el producto en la capa de éter, ventilación periódicamente. Permiten las capas separar y luego retirar la capa acuosa drenando hacia fuera desde la parte inferior del embudo a un matraz Erlenmeyer o vaso de precipitados.
Nota: Por favor vea recursos adicionales para la información sobre las extracciones y el uso de un embudo de separatory24,25.
3. procedimiento de lavado
- La capa orgánica que queda en el matraz, añadir 1 M HCl (20 mL) y agitar suavemente el matraz separatory, ventilación periódicamente. Permiten las capas separar y luego retirar la capa acuosa drenando hacia fuera desde la parte inferior del embudo a un matraz Erlenmeyer o vaso de precipitados.
- Repita el procedimiento de lavado con solución de bicarbonato de sodio saturado (2 x 20 mL) y luego con solución saturada de cloruro sódico (20 mL).
- Derramar la capa orgánica desde la parte superior del matraz a un matraz Erlenmeyer limpio, seque la capa con sulfato de magnesio, y gravedad filtrar la solución a través de papel filtro en un matraz de evaporación masivo.
Nota: Por favor vea recursos adicionales para obtener información sobre las extracciones y el uso de sulfato de magnesio como un agente secado24,25. - Elimine el éter dietílico disolvente a presión reducida utilizando un evaporador rotatorio.
- Análisis de una muestra del producto por 1H y 13C NMR espectroscopia en CDCl3 y por espectrometría de masas.
Nota: Por favor vea recursos adicionales para la información sobre la preparación de muestras para el análisis de NMR24,25.
4. reacción de acoplamiento carbodiimida para alcoholes secundarios y deficientes en electrones
- De 50 mL redondo matraz de fondo, combinar (E)-ácido cinámico (1,02 mmol, mg 151, 1.2 equiv), DMAP (312 mg, 2.55 mmol, 3 equiv) y EDC (244 mg, 1,28 mmol, equivalente 1,5). Añadir acetonitrilo (15 mL) y diphenylmethanol (157 mg, 0,85 mmol, 1 equiv) a la mezcla junto con una barra de agitación.
PRECAUCIÓN: Acetonitrilo es un disolvente inflamable. - Sujete el frasco y agitar la reacción a temperatura ambiente durante 24 h. Inserte un condensador de aire en el cuello del matraz para minimizar la evaporación de disolventes.
- Siga el workup de extracción y lavado procedimiento descrito en los pasos 2-3 arriba.
5. reacción de carbodiimida acoplamiento de cadena larga o hidrofóbicas ácidos carboxílicos
- De 50 mL redondo matraz de fondo, combinar Ácido decanoico (146 mg, 0,85 mmol, 1 equiv), DMAP (312 mg, 2.55 mmol, 3 equiv) y EDC (244 mg, 1,28 mmol, equivalente 1,5). Añadir acetonitrilo (15 mL) y diphenylmethanol (157 mg, 0,85 mmol, 1 equiv) a la mezcla junto con una barra de agitación.
PRECAUCIÓN: Acetonitrilo es un disolvente inflamable. - Sujete el frasco y agitar la reacción a temperatura ambiente durante 24 h. Inserte un condensador de aire en el cuello del matraz para minimizar la evaporación de disolventes. Si se usa un alcohol primario, revuelva la reacción en un baño de agua a 40 ° C por 1 h.
- Siga el workup de extracción y lavado procedimiento descrito en los pasos 2-3 arriba.
Resultados
Mediante la esterificación de Steglich modificada en acetonitrilo seguido de un workup de extracción ácido-base, cinamato de 3-methoxybenzyl (8) se obtuvo como un aceite amarillo claro (205 mg, 90% de rendimiento) sin necesidad de cromatografía en columna. 1 Espectros de RMN de C de H y 13se presentan en la figura 2 que confirma la estructura y pureza.
Comp...
Discusión
La metodología presentada aquí fue desarrollada para reducir al mínimo los riesgos del solvente asociado con una esterificación Steglich tradicional mediante un sistema de solventes más verde y reduciendo la necesidad de columna cromatografía8,9. Rendimientos de reacción comparables y los tipos se logra con el uso de acetonitrilo en lugar seco disolventes clorados o DMF22.
Varios pasos claves permiten la ...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación fue apoyada por el Siena College y el centro de licenciatura investigación y actividad creativa. Agradecemos al Dr. Thomas Hughes y Dr. Kristopher Kolonko para conversaciones útiles, Sra. Allycia Barbera para la etapa temprana del trabajo sobre esta metodología, el Siena College Stewart instrumentación avanzada y tecnología (Santo) centro de recursos de instrumentación.
Materiales
| Name | Company | Catalog Number | Comments |
| trans -cinnamic acid | Acros Organics | 158571000 | |
| butyric acid | Sigma-Aldrich | B103500 | Caution: corrosive |
| hexanoic acid | Sigma-Aldrich | 153745-100G | Caution: corrosive |
| decanoic acid | Sigma-Aldrich | 21409-5G | Caution: corrosive |
| phenylacetic acid | Sigma-Aldrich | P16621-5G | |
| 3-methoxybenzyl alcohol | Sigma-Aldrich | M11006-25G | |
| diphenylmethanol | Acros Organics | 105391000 | Benzhydrol |
| chloroform-d | Acros Organics | 166260250 | 99.8% with 1% v/v tetramethylsilane, Caution: toxic |
| hexane | BDH Chemicals | BDH1129-4LP | Caution: flammable |
| ethyl acetate | Sigma-Aldrich | 650528 | Caution: flammable |
| diethyl ether | Fisher Scientific | E138-500 | Caution: flammable |
| acetonitrile | Fisher Scientific | A21-1 | ACS Certified, >99.5%, Caution: flammable |
| 4-dimethylaminopyridine | Acros Organics | 148270250 | Caution: toxic |
| magnesium sulfate | Fisher Scientific | M65-3 | |
| hydrochloric acid, 1 M | Fisher Scientific | S848-4 | Caution: corrosive |
| sodium chloride | BDH Chemicals | BDH8014 | |
| sodium bicarbonate | Fisher Scientific | S25533B | |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride | Chem-Impex | 00050 | Caution: skin and eye irritant |
| thin layer chromatography plates | EMD Millipore | 1055540001 | aluminum backed sheets |
| Note: All commercially available reagents and solvents were used as received without further purification. |
Referencias
- Williams, A., Ibrahim, I. T. Carbodiimide chemistry: recent advances. Chemical Reviews. 81 (6), 589-636 (1981).
- Höfle, G., Steglich, W., Vorbrüggen, H. 4-Dialkylaminopyridines as Highly Active Acylation Catalysts. [New synthetic method (25)]. Angewandte Chemie International Edition in English. 17 (8), 569-583 (1978).
- Neises, B., Steglich, W. Simple Method for the Esterification of Carboxylic Acids. Angewandte Chemie International Edition in English. 17 (7), 522-524 (1978).
- Tsvetkova, B., Tencheva, J., Peikov, P. Esterification of 7-theophyllineacetic acid with diethylene glycol monomethyl ether. Acta pharmaceutica. 56 (2), 251-257 (2006).
- Tsakos, M., Schaffert, E. S., Clement, L. L., Villadsen, N. L., Poulsen, T. B. Ester coupling reactions - an enduring challenge in the chemical synthesis of bioactive natural products. Natural Product Reports. 32 (4), (2015).
- Morales-Serna, J., et al. Using Benzotriazole Esters as a Strategy in the Esterification of Tertiary Alcohols. Synthesis. 2010 (24), 4261-4267 (2010).
- Anastas, P., Eghbali, N. Green Chemistry: Principles and Practice. Chemical Society Reviews. 39 (1), 301-312 (2010).
- Constable, D. J. C., Jimenez-Gonzalez, C., Henderson, R. K. Perspective on solvent use in the pharmaceutical industry. Organic Process Research and Development. 11 (1), 133-137 (2007).
- Byrne, F. P., et al. Tools and techniques for solvent selection: green solvent selection guides. Sustainable Chemical Processes. 4 (1), 7 (2016).
- Hossaini, R., Chipperfield, M. P., Montzka, S. A., Rap, A., Dhomse, S., Feng, W. Efficiency of short-lived halogens at influencing climate through depletion of stratospheric ozone. Nature Geoscience. 8 (3), (2015).
- Corker, E. C., Mentzel, U. V., Mielby, J., Riisager, A., Fehrmann, R. An alternative pathway for production of acetonitrile: ruthenium catalysed aerobic dehydrogenation of ethylamine. Green Chemistry. 15 (4), 928-933 (2013).
- McConvey, I. F., Woods, D., Lewis, M., Gan, Q., Nancarrow, P. The Importance of Acetonitrile in the Pharmaceutical Industry and Opportunities for its Recovery from Waste. Organic Process Research & Development. 16 (4), 612-624 (2012).
- Jad, Y. E., et al. Peptide synthesis beyond DMF: THF and ACN as excellent and friendlier alternatives. Organic & Biomolecular Chemistry. 13 (8), 2393-2398 (2015).
- Williams, J., et al. Quantitative method for the profiling of the endocannabinoid metabolome by LC-atmospheric pressure chemical ionization-MS. Analytical Chemistry. 79 (15), 5582-5593 (2007).
- Benmansour, F., et al. Discovery of novel dengue virus NS5 methyltransferase non-nucleoside inhibitors by fragment-based drug design. European Journal of Medicinal Chemistry. 125, 865-880 (2017).
- Maier, W., Corrie, J. E. T., Papageorgiou, G., Laube, B., Grewer, C. Comparative analysis of inhibitory effects of caged ligands for the NMDA receptor. Journal of Neuroscience Methods. 142 (1), 1-9 (2005).
- Schwartz, E., et al. Water soluble azido polyisocyanopeptides as functional β-sheet mimics. Journal of Polymer Science Part A: Polymer Chemistry. 47 (16), 4150-4164 (2009).
- Hangauer, M. J., Bertozzi, C. R. A FRET-Based Fluorogenic Phosphine for Live-Cell Imaging with the Staudinger Ligation. Angewandte Chemie International Edition. 47 (13), 2394-2397 (2008).
- Hsieh, P. -. W., Chen, W. -. Y., Aljuffali, I., Chen, C. -. C., Fang, J. -. Y. Co-Drug Strategy for Promoting Skin Targeting and Minimizing the Transdermal Diffusion of Hydroquinone and Tranexamic Acid. Current Medicinal Chemistry. 20 (32), 4080-4092 (2013).
- Moretto, A., et al. A Rigid Helical Peptide Axle for a [2]Rotaxane Molecular Machine. Angewandte Chemie International Edition. 48 (47), 8986-8989 (2009).
- Hanessian, S., McNaughton-Smith, G. A versatile synthesis of a β-turn peptidomimetic scaffold: An approach towards a designed model antagonist of the tachykinin NK-2 receptor. Bioorganic & Medicinal Chemistry Letters. 6 (13), 1567-1572 (1996).
- Lutjen, A. B., Quirk, M. A., Barbera, A. M., Kolonko, E. M. Synthesis of (E)-cinnamyl ester derivatives via a greener Steglich esterification (In Press). Bioorganic & Medicinal Chemistry. , (2018).
- Wang, Z. Steglich Esterification. Comprehensive Organic Name Reactions and Reagents. , (2010).
- Padias, A. B. . Making the Connections: A How-To Guide for Organic Chemistry Lab Techniques. , (2011).
- Zubrick, J. W. . The Organic Chem Lab Survival Manual: A Student's Guide to Techniques. , (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados