É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Síntese de ésteres através de uma esterificação Steglich mais verde em acetonitrila
Neste Artigo
Resumo
Uma reação de esterificação Steglich modificada foi usada para sintetizar uma pequena biblioteca de derivados de éster com álcoois primários e secundários. A metodologia usa um acetonitrilo solvente, não halogenados e mais verde e permite o isolamento de produto em rendimentos elevados sem a necessidade de purificação cromatográfica.
Resumo
A esterificação Steglich é uma utilizado reação para a síntese de ésteres de ácidos carboxílicos e álcoois. Embora eficiente e suave, a reação é comumente realizado usando clorados ou sistemas solvente amida, que são perigosos para a saúde humana e o ambiente. Nossa metodologia utiliza acetonitrilo como um mais verde e menos perigoso sistema solvente. Este protocolo apresenta taxas e rendimentos que são comparáveis aos sistemas tradicionais de solventes e emprega uma extração e a sequência de lavagem que elimina a necessidade para a purificação do produto éster através de cromatografia em coluna. Esse método geral pode ser usado para acoplar uma variedade de ácidos carboxílicos com álcoois alifáticos 2° 1°, álcoois alílicos e benzílicos e fenóis para obter ésteres puros em rendimentos elevados. O objetivo do Protocolo detalhado aqui é fornecer uma alternativa mais verde para uma reação de esterificação comum, que poderia servir de útil para a síntese de éster em aplicações acadêmicas e industriais.
Introdução
Compostos de éster são amplamente utilizados para aplicações tais como compostos de sabor, produtos farmacêuticos, cosméticos e materiais. Comumente, o uso de carbodiimida reagentes de acoplamento é usado para facilitar uma formação de éster de um ácido carboxílico e um álcool1. Por exemplo, na esterificação Steglich, dicyclohexylcarbodiimide (DCC) é reagida com um ácido carboxílico na presença de 4-dimetilaminopiridina (DMAP) para formar um derivado de ácido ativado, geralmente em um sistema de solvente clorado ou Dimetilformamida (DMF)2,3,4. O derivado ácido ativado então sofre uma substituição nucleofílica acílica com um álcool para formar o produto de éster, que geralmente é purificado através de cromatografia. A esterificação Steglich permite acoplamento suave de grandes e complexos de ácidos carboxílicos e álcoois, incluindo estericamente impedida álcoois secundários e terciários2,5,6. O objetivo deste trabalho é modificar o protocolo padrão de esterificação Steglich para fornecer uma opção mais verde sintética desta reação de esterificação comum.
Um aspecto importante na concepção da nova metodologia sintética é procurar minimizar o uso e a formação de substâncias perigosas. Os doze princípios da química verde7 pode ser usado para fornecer uma orientação para a criação de sínteses mais seguros. Algumas delas incluem a prevenção da geração de resíduos (princípio 1) e o uso de solventes mais seguras (princípio 5). Em particular, solventes representam 80-90% da massa dos materiais na fabricação farmacêutica8aquosos. Assim, modificar um protocolo para usar um solvente menos perigoso pode fazer um grande impacto sobre o verde de uma reação orgânica.
Reações de esterificação Steglich frequentemente usam sistemas solventes clorados anidro ou DMF; no entanto, estes solventes são motivo de preocupação para o ambiente e a saúde humana. Diclorometano (CH2Cl2) e clorofórmio (CHCl3) são prováveis cancerígenos humanos e DMF tem toxicidade reprodutiva preocupações9. Além disso, CH2Cl2 é10que empobrecem a camada de ozônio. Assim, um solvente menos perigoso para a esterificação Steglich seria de grande utilidade. Enquanto não houver ainda verde substituições para solventes apróticos polares, acetonitrilo é recomendado como um substituto mais verde para CH2Cl2, CHCl3e DMF9. Acetonitrilo, atualmente, é produzido como subproduto na fabricação de acrilonitrila; no entanto, uma síntese verde de acetonitrilo de biomassa em uma escala acadêmica tem sido relatado11e opções possíveis para a reutilização e a valorização de fluxos de resíduos estão sendo investigadas12. Acetonitrilo anteriormente foi usado como uma alternativa mais verde solvente para carbodiimida acoplamento de reações de síntese do peptide de fase sólida para formar de ligações Amida13. O uso de acetonitrilo como um sistema de solvente para Steglich esterifications tem sido demonstrada14,15,16,17,18,19, 20,21; no entanto, esses métodos não têm incidido sobre o aspecto verde do solvente e também empregam purificação adicional através de cromatografia em coluna.
Reduzindo a necessidade de cromatografia de coluna como uma etapa de purificação também minimiza resíduos solventes perigosos8. Além de usar um solvente de reação a menos perigoso, a metodologia permite o isolamento do produto altamente puro, sem a necessidade de cromatografia. O reagente de acoplamento utilizado tradicionalmente dicyclohexylcarbodiimide (DCC) é substituído por 1-etil - 3-(3-dimetilaminopropil) carbodiimida cloridrato (EDC). O grupo funcional amina básica sobre este reagente permite que os subprodutos da reação e qualquer reagentes residuais deve ser removido através de etapas de lavagem ácida e básica.
O protocolo apresentado neste documento pode ser usado com uma variedade de parceiros de ácido e álcool (Figura 1). Foi usada para sintetizar uma pequena biblioteca de derivados de éster Cinamil usando primária, secundária, benzílico e alil álcoois e fenóis22. Além disso, a taxa da reação de esterificação em acetonitrila é comparável nos clorados e sistemas solventes DMF, sem a necessidade de secar ou destilar o acetonitrilo antes da reação de22. Ésteres, sintetizados a partir de álcoois terciários não foram isolados, que atualmente é uma limitação da metodologia em comparação com a tradicional Steglich esterificação em clorados solvente23. Além disso, outros ácido-lábeis grupos poderiam ser afetados pelas etapas de lavagem ácida, potencialmente necessitando de cromatografia de coluna de purificação após a remoção de acetonitrilo. Apesar dessas limitações, a reação é um método fácil e geral para a síntese de ésteres em rendimentos elevados, usando uma variedade de componentes tanto álcool e ácido carboxílico. O uso de um sistema de solvente mais verde e sem a necessidade de etapas de cromatografia de alta pureza dificulte uma alternativa atraente para uma tradicional Steglich esterificação do protocolo.
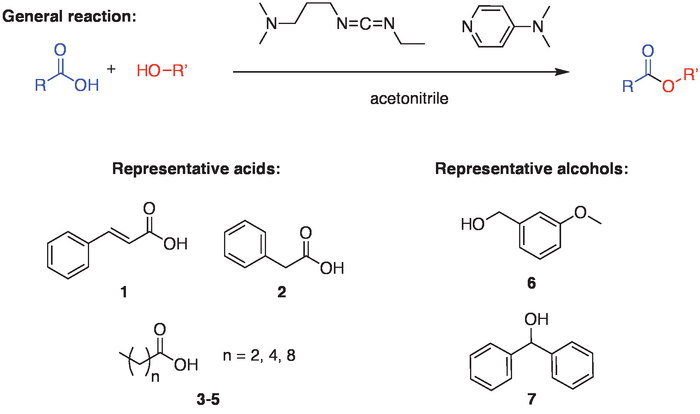
Figura 1. Esquema de reação geral. O regime geral para a reação envolve o acoplamento de um ácido carboxílico e um álcool, o que é facilitado a utilização de um reagente de acoplamento carbodiimida (1-etil - 3-(3-dimetilaminopropil) carbodiimida cloridrato ou EDC) e 4-dimetilaminopiridina ( DMAP) em acetonitrila. Para demonstrar a amplitude de reação, ésteres foram formados usando vários ácidos (1-5) com um álcool secundário (7) ou primário (6). Clique aqui para ver uma versão maior desta figura.
Protocolo
Atenção: Consultar fichas de dados de segurança (SDSs) antes da utilização dos produtos químicos neste procedimento. Usar equipamento de protecção adequado (EPI) incluindo respingo óculos de proteção, jaleco e nitrilo ou luvas de butilo, como muitos dos reagentes e solventes são inflamáveis ou corrosivos. Realize todas as reações em uma coifa. É desnecessário para vidro seco ou usar uma atmosfera de nitrogênio para este protocolo.
1. reação de acoplamento carbodiimida para álcoois primários
- Em um 50 mL redonda balão de fundo, combinar (E)-ácido cinâmico (151 mg, 1,02 mmol, 1.2 equiv), DMAP (312 mg, 2,55 mmol, 3 equiv) e EDC (244 mg, 1,28 mmol, 1.5 equiv). Adicione acetonitrilo (15 mL) e álcool 3-metoxibenzílico (98 μL, 0,85 mmol, 1 equiv) à mistura junto com uma barra de agitação.
Cuidado: Acetonitrilo é um solvente inflamável. - Fixe o frasco num banho de água de 40 ° C e agitar a reação.
Nota: Se a reação envolve um álcool aromático, monitore a reação para a perda do álcool através de cromatografia de camada fina (TLC) usando 1:3. o acetato de etila/hexano. A reação é completa quando o lugar de álcool não é mais visível na placa de TLC por irradiação com uma lâmpada UV.
2. extração exame
- Uma vez que a reação é completa, como indicado por TLC ou após 45 min, retire o acetonitrilo sob pressão reduzida usando um evaporador rotativo para obter um sólido bruto.
Nota: Por favor, consulte recursos adicionais para as informações sobre a utilização de um evaporador rotativo24,25. - Para o resíduo, adicione éter dietílico (20 mL) e 1 M HCl (20 mL). Agite o frasco para dissolver o resíduo para as camadas de solventes.
Cuidado: éter etílico é um solvente altamente inflamável.
Nota: Para diminuir o risco de solvente, acetato de etila pode ser usado no lugar do éter dietílico; no entanto, há um potencial maior para a formação de emulsão durante as etapas de extração e lavagem. - Despeje a solução em um funil de separação. Lavar o balão de evaporação adicional pelo éter dietílico (5 mL) e adicionar o enxágue para funil de separação.
- Agite o funil de separação para extrair o produto na camada de éter, ventilação periodicamente. Permitir que as camadas separar e em seguida, retire a camada aquosa por drená-las para fora da parte inferior do funil em um frasco Erlenmeyer ou béquer.
Nota: Por favor, consulte recursos adicionais para as informações sobre a extração e o uso de um funil de separação24,25.
3. procedimento de lavagem
- Para a camada orgânica restante no funil de separação, adicionar 1 M HCl (20 mL) e agitar suavemente o frasco ampola, ventilação periodicamente. Permitir que as camadas separar e em seguida, retire a camada aquosa por drená-las para fora da parte inferior do funil em um frasco Erlenmeyer ou béquer.
- Repita o procedimento de lavagem com solução saturada de bicarbonato de sódio (2 x 20 mL) e, em seguida, com solução saturada de cloreto de sódio (20 mL).
- Despeje a camada orgânica para fora da parte superior do funil de separação em um frasco de Erlenmeyer limpo, seque a camada com sulfato de magnésio, e gravidade filtrar a solução através de papel de filtro para um balão de evaporação em massa.
Nota: Veja recursos adicionais para obter informações sobre a extração e o uso do sulfato de magnésio como agente secagem24,25. - Remova o solvente éter dietílico sob pressão reduzida usando um evaporador rotativo.
- Analise uma amostra do produto por 1H e de 13a espectroscopia NMR C em CDCl3 e por espectrometria de massa.
Nota: Por favor, consulte recursos adicionais para as informações relativas à preparação das amostras para análise de NMR24,25.
4. reação de acoplamento carbodiimida para álcoois secundários e elétron-deficientes
- Em um 50 mL redonda balão de fundo, combinar (E)-ácido cinâmico (151 mg, 1,02 mmol, 1.2 equiv), DMAP (312 mg, 2,55 mmol, 3 equiv) e EDC (244 mg, 1,28 mmol, 1.5 equiv). Adicione acetonitrilo (15 mL) e diphenylmethanol (157 mg, 0,85 mmol, 1 equiv) à mistura junto com uma barra de agitação.
Cuidado: Acetonitrilo é um solvente inflamável. - Fixe o frasco e agitar a reação na temperatura ambiente por 24 h. inserir um condensador de ar para o pescoço do balão para minimizar a evaporação do solvente.
- Siga o exame de extração e lavagem o procedimento descrito nos passos 2-3 acima.
5. reação de acoplamento carbodiimida de cadeia longa ou hidrofóbicos ácidos carboxílicos
- Em um 50 mL redonda balão de fundo, combine ácido decanoico (146 mg, 0,85 mmol, 1 equiv), DMAP (312 mg, 2,55 mmol, 3 equiv) e EDC (244 mg, 1,28 mmol, 1.5 equiv). Adicione acetonitrilo (15 mL) e diphenylmethanol (157 mg, 0,85 mmol, 1 equiv) à mistura junto com uma barra de agitação.
Cuidado: Acetonitrilo é um solvente inflamável. - Fixe o frasco e agitar a reação na temperatura ambiente por 24 h. inserir um condensador de ar para o pescoço do balão para minimizar a evaporação do solvente. Se for usado um álcool primário, agite a reação em banho-maria a 40 ° C, durante 1 h.
- Siga o exame de extração e lavagem o procedimento descrito nos passos 2-3 acima.
Resultados
Usando a esterificação Steglich modificada em acetonitrila, seguida de um exame de extração ácido-base, 3-metoxibenzílico cinamato (8) obteve-se como um óleo amarelo-luz (205 mg, 90% de rendimento), sem a necessidade de cromatografia de coluna. 1 Espectro de RMN de C H e 13é apresentados na Figura 2 para confirmar a estrutura e indicar a pureza.
Compost...
Discussão
A metodologia aqui apresentada foi desenvolvida para minimizar os riscos de solvente associado com uma esterificação Steglich tradicional, usando um sistema de solvente mais verde e reduzindo a necessidade para cromatografia de coluna8,9. Rendimentos de reação comparáveis e taxas podem ser conseguidas com o uso de acetonitrilo no lugar secos solventes clorados ou DMF22.
Diversas etapas-chave permitem a puri...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Esta pesquisa foi apoiada pelo Siena College e do centro de iniciação científica e atividade criativa. Agradecemos o Dr. Thomas Hughes e Dr. Kristopher Kolonko para conversas úteis, MS. Allycia Barbera para fase inicial de trabalho sobre esta metodologia e o Siena College Stewart instrumentação avançada e tecnologia (SAInT) centro de recursos de instrumentação.
Materiais
| Name | Company | Catalog Number | Comments |
| trans -cinnamic acid | Acros Organics | 158571000 | |
| butyric acid | Sigma-Aldrich | B103500 | Caution: corrosive |
| hexanoic acid | Sigma-Aldrich | 153745-100G | Caution: corrosive |
| decanoic acid | Sigma-Aldrich | 21409-5G | Caution: corrosive |
| phenylacetic acid | Sigma-Aldrich | P16621-5G | |
| 3-methoxybenzyl alcohol | Sigma-Aldrich | M11006-25G | |
| diphenylmethanol | Acros Organics | 105391000 | Benzhydrol |
| chloroform-d | Acros Organics | 166260250 | 99.8% with 1% v/v tetramethylsilane, Caution: toxic |
| hexane | BDH Chemicals | BDH1129-4LP | Caution: flammable |
| ethyl acetate | Sigma-Aldrich | 650528 | Caution: flammable |
| diethyl ether | Fisher Scientific | E138-500 | Caution: flammable |
| acetonitrile | Fisher Scientific | A21-1 | ACS Certified, >99.5%, Caution: flammable |
| 4-dimethylaminopyridine | Acros Organics | 148270250 | Caution: toxic |
| magnesium sulfate | Fisher Scientific | M65-3 | |
| hydrochloric acid, 1 M | Fisher Scientific | S848-4 | Caution: corrosive |
| sodium chloride | BDH Chemicals | BDH8014 | |
| sodium bicarbonate | Fisher Scientific | S25533B | |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride | Chem-Impex | 00050 | Caution: skin and eye irritant |
| thin layer chromatography plates | EMD Millipore | 1055540001 | aluminum backed sheets |
| Note: All commercially available reagents and solvents were used as received without further purification. |
Referências
- Williams, A., Ibrahim, I. T. Carbodiimide chemistry: recent advances. Chemical Reviews. 81 (6), 589-636 (1981).
- Höfle, G., Steglich, W., Vorbrüggen, H. 4-Dialkylaminopyridines as Highly Active Acylation Catalysts. [New synthetic method (25)]. Angewandte Chemie International Edition in English. 17 (8), 569-583 (1978).
- Neises, B., Steglich, W. Simple Method for the Esterification of Carboxylic Acids. Angewandte Chemie International Edition in English. 17 (7), 522-524 (1978).
- Tsvetkova, B., Tencheva, J., Peikov, P. Esterification of 7-theophyllineacetic acid with diethylene glycol monomethyl ether. Acta pharmaceutica. 56 (2), 251-257 (2006).
- Tsakos, M., Schaffert, E. S., Clement, L. L., Villadsen, N. L., Poulsen, T. B. Ester coupling reactions - an enduring challenge in the chemical synthesis of bioactive natural products. Natural Product Reports. 32 (4), (2015).
- Morales-Serna, J., et al. Using Benzotriazole Esters as a Strategy in the Esterification of Tertiary Alcohols. Synthesis. 2010 (24), 4261-4267 (2010).
- Anastas, P., Eghbali, N. Green Chemistry: Principles and Practice. Chemical Society Reviews. 39 (1), 301-312 (2010).
- Constable, D. J. C., Jimenez-Gonzalez, C., Henderson, R. K. Perspective on solvent use in the pharmaceutical industry. Organic Process Research and Development. 11 (1), 133-137 (2007).
- Byrne, F. P., et al. Tools and techniques for solvent selection: green solvent selection guides. Sustainable Chemical Processes. 4 (1), 7 (2016).
- Hossaini, R., Chipperfield, M. P., Montzka, S. A., Rap, A., Dhomse, S., Feng, W. Efficiency of short-lived halogens at influencing climate through depletion of stratospheric ozone. Nature Geoscience. 8 (3), (2015).
- Corker, E. C., Mentzel, U. V., Mielby, J., Riisager, A., Fehrmann, R. An alternative pathway for production of acetonitrile: ruthenium catalysed aerobic dehydrogenation of ethylamine. Green Chemistry. 15 (4), 928-933 (2013).
- McConvey, I. F., Woods, D., Lewis, M., Gan, Q., Nancarrow, P. The Importance of Acetonitrile in the Pharmaceutical Industry and Opportunities for its Recovery from Waste. Organic Process Research & Development. 16 (4), 612-624 (2012).
- Jad, Y. E., et al. Peptide synthesis beyond DMF: THF and ACN as excellent and friendlier alternatives. Organic & Biomolecular Chemistry. 13 (8), 2393-2398 (2015).
- Williams, J., et al. Quantitative method for the profiling of the endocannabinoid metabolome by LC-atmospheric pressure chemical ionization-MS. Analytical Chemistry. 79 (15), 5582-5593 (2007).
- Benmansour, F., et al. Discovery of novel dengue virus NS5 methyltransferase non-nucleoside inhibitors by fragment-based drug design. European Journal of Medicinal Chemistry. 125, 865-880 (2017).
- Maier, W., Corrie, J. E. T., Papageorgiou, G., Laube, B., Grewer, C. Comparative analysis of inhibitory effects of caged ligands for the NMDA receptor. Journal of Neuroscience Methods. 142 (1), 1-9 (2005).
- Schwartz, E., et al. Water soluble azido polyisocyanopeptides as functional β-sheet mimics. Journal of Polymer Science Part A: Polymer Chemistry. 47 (16), 4150-4164 (2009).
- Hangauer, M. J., Bertozzi, C. R. A FRET-Based Fluorogenic Phosphine for Live-Cell Imaging with the Staudinger Ligation. Angewandte Chemie International Edition. 47 (13), 2394-2397 (2008).
- Hsieh, P. -. W., Chen, W. -. Y., Aljuffali, I., Chen, C. -. C., Fang, J. -. Y. Co-Drug Strategy for Promoting Skin Targeting and Minimizing the Transdermal Diffusion of Hydroquinone and Tranexamic Acid. Current Medicinal Chemistry. 20 (32), 4080-4092 (2013).
- Moretto, A., et al. A Rigid Helical Peptide Axle for a [2]Rotaxane Molecular Machine. Angewandte Chemie International Edition. 48 (47), 8986-8989 (2009).
- Hanessian, S., McNaughton-Smith, G. A versatile synthesis of a β-turn peptidomimetic scaffold: An approach towards a designed model antagonist of the tachykinin NK-2 receptor. Bioorganic & Medicinal Chemistry Letters. 6 (13), 1567-1572 (1996).
- Lutjen, A. B., Quirk, M. A., Barbera, A. M., Kolonko, E. M. Synthesis of (E)-cinnamyl ester derivatives via a greener Steglich esterification (In Press). Bioorganic & Medicinal Chemistry. , (2018).
- Wang, Z. Steglich Esterification. Comprehensive Organic Name Reactions and Reagents. , (2010).
- Padias, A. B. . Making the Connections: A How-To Guide for Organic Chemistry Lab Techniques. , (2011).
- Zubrick, J. W. . The Organic Chem Lab Survival Manual: A Student's Guide to Techniques. , (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados