Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Co de tinción de los vasos sanguíneos y fibras nerviosas en el tejido adiposo
En este artículo
Resumen
Formación de vasos sanguíneos y la inervación simpática juegan papeles fundamentales en la remodelación del tejido adiposo. Sin embargo, quedan cuestiones técnicas en visualizar y medir cuantitativamente el tejido adiposo. Aquí presentamos un protocolo para etiquetar correctamente y comparar cuantitativamente la densidad de los vasos sanguíneos y fibras nerviosas en diferentes tejidos adiposos.
Resumen
Estudios recientes han puesto de relieve el papel fundamental de la angiogénesis y la inervación simpática en el tejido adiposo remodelación durante el desarrollo de la obesidad. Por lo tanto, es necesario desarrollar un método fácil y eficiente para documentar los cambios dinámicos en el tejido adiposo. Aquí, describimos un método inmunofluorescente modificado que eficientemente Co las manchas de los vasos sanguíneos y fibras nerviosas en los tejidos adiposos. En comparación con los métodos tradicionales y recientemente desarrollados, nuestro enfoque es relativamente fácil de seguir y más eficiente en el etiquetado de los vasos sanguíneos y fibras nerviosas con densidades más altas y menos fondo. Por otra parte, la mayor resolución de las imágenes más nos permite medir con precisión el área de los vasos, la cantidad de ramificaciones y la longitud de las fibras por el software de código abierto. Como una demostración con nuestro método, mostramos que el tejido adiposo marrón (BAT) contiene cantidades más altas de los vasos sanguíneos y fibras nerviosas en comparación con el tejido adiposo blanco (WAT). Somos además encontrar que entre los WATs, WAT subcutáneo (sWAT) tiene más los vasos sanguíneos y fibras nerviosas en comparación con el epidídimo WAT (eWAT). Nuestro método proporciona así una herramienta útil para la investigación de remodelación del tejido adiposo.
Introducción
El tejido adiposo tiene clave metabólica y endocrina funciones1. Dinámicamente se expande o se contrae en respuesta a diferentes nutrientes destaca2. El tejido activo proceso de remodelación consta de múltiples caminos, escalones fisiológicas incluyendo angiogénesis, fibrosis y formación de microambientes inflamatorios locales2,3,4. Algunos estímulos físicos, como la exposición fría y ejercicio, pueden desencadenar la activación simpática, que en última instancia conduce a la formación de vasos sanguíneos y la inervación simpática en el tejido adiposo5,6. Estos procesos de remodelación están vinculados estrechamente a los resultados metabólicos sistémicos incluyendo sensibilidad a la insulina, el sello del tipo 2 diabetes2. Así, la visualización de estos cambios patológicos es muy importante para entender el estado saludable de todo los tejidos adiposos.
La angiogénesis es el proceso de formación de vasos sanguíneos nuevos. Ya que los vasos sanguíneos proveen oxígeno, nutrientes, hormonas y factores de crecimiento al tejido, la angiogénesis se ha considerado un paso clave en la remodelación del tejido adiposo, que se ha documentado con diferentes técnicas6,7, 8 , 9 , 10 , 11 , 12 , 13. sin embargo, quedan preguntas sobre la resolución de las imágenes, la eficiencia de inmunotinción y métodos para la cuantificación de la densidad de vasos. En comparación con la formación de vasos sanguíneos, inervación en el tejido adiposo ha subestimado durante mucho tiempo. Recientemente, Zeng et al. 14 utilizada avanzada microscopía de dos fotones intravital y demostró que los adipocitos están rodeados por capas de fibras nerviosas14. Desde entonces, los investigadores han comenzado a apreciar el papel fundamental de la inervación simpática en la regulación de la fisiología del tejido adiposo. Por lo tanto, es importante desarrollar un enfoque fácil y práctico a la inervación del nervio adiposo documento.
Aquí, Divulgamos un método optimizado para co tinción de los vasos sanguíneos y fibras nerviosas basadas en los protocolos anteriores. Con este método, podemos lograr imágenes claras de los vasos sanguíneos y fibras nerviosas sin fondo ruidoso. Por otra parte, obtenemos una resolución lo suficientemente alta para realizar la medición cuantitativa de las densidades con software de código abierto. Mediante el uso de este nuevo enfoque, con éxito podemos comparar las estructuras y densidades de los vasos sanguíneos y fibras nerviosas en diferentes depósitos adiposos.
Protocolo
Todos los procedimientos que contiene temas de animales han sido aprobados por el Animal bienestar Comité de University of Texas Health Science Center Houston (número de protocolo animal: AWC-18-0057).
1. preparación del reactivo
- 1 x solución salina tamponada con fosfato (PBS, pH 7,4): para hacer 1 L de PBS 1 x, disolver 8 g de NaCl, 0,2 g de KCl, 1,44 g de Na2HPO4y 0.24 g de KH2PO4 en 800 mL de agua destilada. Ajustar el pH a 7,4 y llenar con agua destilada hasta alcanzar un volumen final de 1 L.
- paraformaldehído al 1% en PBS 1 x (1% PFA, wt/vol): para alcanzar un volumen final de 50 mL, añadir mL 3,125% 16 PFA (véase Tabla de materiales) a 46,875 mL de PBS 1 x. Mezclar bien y guardar a 4 ° C para su uso posterior.
PRECAUCIÓN: Paraformaldehido es tóxico. Todos los procedimientos deben realizarse bajo una campana de humos para evitar la inhalación y contacto con la piel. - 0.1% polisorbato 20 (véase tabla de materiales) en PBS 1 x (1 x SAFT, pH 7,4, vol/vol): para alcanzar un volumen final de 50 mL, Añadir 0,05 mL de polisorbato 20 a 49.95 mL de PBS 1 x. Mezclar y conservar a 4 ° C durante 1 mes.
- 1% octoxinol-9 (véase Tabla de materiales) en PBS 1 x (1 x TX de PBS, pH 7,4, vol/vol): para alcanzar un volumen final de 10 mL, Añadir 0,1 mL de octoxinol-9 9,9 mL de PBS 1 x. Mezclar y conservar a 4 ° C durante 1 mes.
- azida de sodio 2% (peso/vol): para obtener 10 mL de azida sódica al 2%, agregar 0.2 g de azida de sodio en 10 mL de PBS 1 x. Mezclar bien y guardar a 4 ° C para su uso posterior.
- 90% de glicerol en PBS 1 x (vol/vol): para alcanzar un volumen final de 10 mL, añadir 1 mL de PBS 1 x a 9 mL de glicerol. Mezclar y almacenar a temperatura ambiente (RT) para su uso posterior.
2. animal Ddissection y colección de tejido adiposo
- Uso de ratones machos de 6 semanas de edad C57BL/6J. Anestesiar los ratones con isoflurano (4% – 5% para la inducción y 1%-2% para mantenimiento). Una vez anestesiados, realizar un reflejo del pellizco del dedo del pie para determinar la profundidad anestésica, a juzgar por la falta de reflejos pedal. Una vez que los ratones son profundamente anestesiados, diseccionar los ratones siguiendo el protocolo publicado previamente15.
- Esterilizar las tijeras embotadas y área quirúrgica del pecho (sin necesidad de afeitarse el cabello). Abre el cofre por cortar el diafragma y las costillas a lo largo de la superficie lateral con un tamaño de ~ 2 cm con unas tijeras embotadas. La bandera del pecho con pinza hemostática de la abrazadera y reflejan al poner la pinza en la cabeza.
- Hacer una pequeña incisión en el ventrículo izquierdo (~0.5 cm) con tijeras de iris. Inserte una aguja con punta de oliva de la perfusión a través del sitio de incisión y sujete la punta de la aguja en el lugar con la pinza hemostática. Conecte la aguja a una jeringa de 50 mL con solución de fijación paraformaldehido (1% PFA, pH 7,4).
- Abrir la aurícula derecha por el corte de la sección con tijeras de iris como la salida de la perfusión. Iniciar la perfusión por suavemente y continuamente empujando la jeringa a una velocidad de perfusión a 10 mL/min deja de empujar cuando el líquido que sale de la salida de sangre. Todo el proceso debe requerir ~ 5 min.
PRECAUCIÓN: Realice estos pasos bajo una campana de humos para evitar la toxicidad de la PFA. - Disecar tejidos adiposos blancos y marrón de los ratones. Utilice tijeras para romper las muestras de tejido en trozos pequeños de aproximadamente 5 x 5 x 3 mm en trozos3. Transferir los trozos pequeños con las pinzas esterilizadas en el tejido incrustar cintas con el etiquetado correcto de las muestras de tejido en los cassettes.
- Sumerja los cassettes de inclusión que contiene las muestras de tejido en la solución de fijación (1% PFA en 1 x PBS, pH 7,4) a 4 ° C durante 24 – 48 h.
Nota: La solución de fijación y el tiempo de fijación varían según los tamaños de los tejidos16,17,18. - Lavar las muestras con fresco 1 x buffer PBS tres veces (0.5 mL/lavado).
PRECAUCIÓN: Realizar este paso bajo una campana de humos. Los residuos de paraformaldehido deben manipularse correctamente según los procedimientos de disposición de residuos peligrosos.
Nota: Los tejidos pueden almacenarse en PBS 1 x a 4 ° C para su posterior procesamiento.
3. anticuerpo incubación
- Cortar las muestras de tejido fijo en aproximadamente 2 mm3 cubos con tijeras esterilizadas. Para la permeabilización, transferir las muestras en un tubo de 1,5 mL que contiene 1 mL de 1 x PBS-TX (octoxinol-9 de 1% en PBS 1 x, véase tabla de materiales, pH 7,4) y gire suavemente los tubos a temperatura ambiente durante 1 hora a 18 rpm.
- Retire con cuidado el 1 x PBS-TX por aspiración. Lavar las muestras 3 x mediante la adición de 1 x PBS directamente en los tubos del mismo (sin necesidad de cambiar los tubos). Durante cada ciclo de lavado, invertir los tubos varias veces.
- De bloqueo, agregar 0,5 mL de solución amortiguadora de bloqueo (Tabla de materiales) a las muestras e incube a temperatura ambiente durante 2 h con rotación suave.
- Para preparar 0,4 mL de solución de anticuerpo primario, diluir 2 μL de anti - endomucin (el marcador de los vasos sanguíneos) 5 (1: 200) y 2 μL de anti-anticuerpos de tirosina hidroxilasa (TH, el marcador de las fibras nerviosas) 5 (1: 200, 1 μg/mL) (tabla de materiales para información de anticuerpo) en 396 μL de solución amortiguadora de bloqueo. Vórtice y vuelta hasta recuperar el volumen.
- Para la primera incubación de anticuerpo, con cuidado retire el amortiguador de bloqueo de los trozos de tejido. Añada 100 μL de solución de anticuerpo primario preparado en el paso 3.4 en tubos e incubar a 4 ° C durante la noche.
Nota: El tiempo de disolución y de incubación del anticuerpo puede variar entre los diferentes anticuerpos. Se recomienda añadir azida sódica al 0.02% a la solución de anticuerpo para prevenir crecimiento microbiano. Para preparar 0,4 mL de solución de anticuerpo primario con azida de sodio, añadir 4 μL de anticuerpos (1 μL de cada uno) y 4 μL de 2% de azida sódica en 392 μL de solución amortiguadora de bloqueo. - Recoger cuidadosamente la solución de anticuerpo primario para su reutilización si lo desea. Lavar las muestras con 1 x PBST (pH 7,4, 100 μl/lavado) tres veces (30 min) con rotación suave a 18 rpm.
- Para la preparación de la solución de anticuerpo secundario, diluir 2 μL del fluoróforo (onda longitud 495 nanómetro) conjugado de IgG de anti-cabra (1: 200) y 2 μL de fluoróforo (onda longitud 650 nm) conjugado anti-conejo IgG (1: 200) (véase Tabla de materiales) en 396 μL de solución amortiguadora de bloqueo. Vórtice y vuelta brevemente a recoger todo el líquido.
Nota: Proteger las muestras de la luz durante los siguientes procedimientos. - Para la segunda incubación del anticuerpo, quite el último tampón de lavado de las muestras. Pipetear 100 μL de solución de anticuerpo secundario en los tubos e incubar a RT por 2 h con rotación suave a 18 rpm.
- Retire con cuidado la solución de anticuerpo secundario. Lavar las muestras 3 x 1 x PBST (pH 7,4, 30 min cada uno) con rotación suave a 18 rpm.
Nota: No utilice esta solución de anticuerpo secundario, como pueden estar contaminado con pequeñas cantidades de anticuerpos primarios por los tejidos. - Para la separación óptica, sumergir las muestras en 1 mL de glicerol 90% y mantener las muestras a 4 ° C en la oscuridad hasta que se transparente.
Nota: La duración de la inmersión depende en el tamaño y tipo de tejido. Típicamente, un cubo de3 mm 2 de tejido adiposo blanco necesita incubación durante la noche, mientras el mismo tamaño marrón tejido adiposo muestra necesita más tiempo. - Adherir un aislante de silicona a la diapositiva para crear un pozo para la proyección de imagen de volumen. Alternativamente, coloque varias capas de cinta adhesiva transparente en las diapositivas y cortar un cuadrado de la mitad para crear un pozo (Figura 2).
Nota: Ajuste la profundidad para ajustarla al tamaño de la muestra. En este protocolo, se utiliza una profundidad de 1 mm bien. - Transferir las muestras en el pozo y llenarlo con el medio de montaje (véase Tabla de materiales). Coloque un cubreobjetos sobre la superficie y sellar las esquinas del cubreobjetos con un medio de alta viscosidad (véase Tabla de materiales). Deje que la curación de medio de montaje por 24 h a temperatura ambiente en oscuridad.
Nota: Asegúrese de que ningún espacio queda entre la muestra y el cubreobjetos. Evitar las burbujas bajo el cubreobjetos. Evite colocar una presión excesiva sobre las muestras.
4. adquisición de la imagen
- Adquisición de imágenes Z-stack (consulte los pasos 4.2-4.7) con el objetivo 20 x de un microscopio confocal y software.
- Inicie el sistema. Haga clic en la fichaconfiguraciónde < > y activar el láser de argón y láser de HeNe 633. Haga clic en la ficha <adquisición>. En el panel de líneas láser <Visible>, subir los correspondientes reguladores de intensidad para elegir las líneas de láser de 488 nm y 633 nm. Inicialmente, las intensidades se pueden ajustar a 20 – 30%. Seleccione el espejo de dichoric triple 488/561/633. Activar la PMT haciendo clic en las casillas de verificación <activo>, elegir PMT1 para la emisión excitada por el 488 nm láser y PMT3 para eso de los 633 nm láser. Establecer el intervalo de longitud de onda a 500-550 nm PMT1 y 750nm de 650 para PMT3. Seleccione la psudocolor a utilizarse para la imagen haciendo clic en el rectángulo coloreado al lado de cada PMT doble y elegir un color del menú emergente.
- Haga clic en <Live> verificar la imagen de las muestras. Use la perilla de posición z para seleccionar un plano de enfoque dentro de la región XY de interés. Ajuste la intensidad de láser, smart gain y offset para ajustar el brillo de las imágenes. Para cada canal de fluorescencia, realizar este ajuste en el modo de pantalla <QLUT> (rápida mirada por tabla). Haga clic en el botón <QLUT> para entrar en el modo QLUT, en la que píxeles saturados se muestran en azul para facilitar al ajuste de nivel de brillo adecuado. Haga clic dos veces en el botón <QLUT> para volver al modo de visualización de pseudocolor.
Nota: Los valores de la configuración puede variar entre cada experimento. - Durante el escaneo, gire la perilla de posición Z hacia la izquierda para pasar el plan de atención a uno de los extremos del volumen de interés y haga clic en la flecha <final> para establecer la posición de final de análisis. Luego gire la perilla de posición Z para mover el plano de foco a través de la muestra al otro extremo del volumen de interés y haga clic en la flecha <Begin> para establecer la posición de comenzar escaneo.
Nota: Para la comparación entre muestras diferentes, definen el mismo volumen de Z para diferentes muestras. - Ajustar el tamaño de paso de z a 3 μm. cambio la calidad de imagen, seleccione un formato de 1024 x 1024, velocidad de 100Hz y línea media de 2.
- Seleccione <Inicio > para iniciar la adquisición de la imagen de z-stack.
- Proyección máxima de la pila de la imagen adquirida, haga clic en la ficha <proceso> y <herramienta>, selecciona <proyección 3D> e introducir <máxima> en la lista de método sin cambios a X, Y y Z. conjunto Umbralde < > 0. Haga clic en <aplicación>. La intensidad máxima del Z-volumen se apilan en una imagen 2D que aparecerá (Figura 4A).
5. Análisis de redes de fibras nerviosas y vasos sanguíneos
-
Análisis 2D de imágenes a través de software de código abierto (véase tabla de materiales)19
- Abra las imágenes apiladas en el software. Ajustar intensidad y el diámetro del vaso hasta que todas las estructuras del buque pueden ser correctamente seleccionan (Figura 4B).
- Seleccione ejecutar análisis y exportar los datos siguiendo la orientación del software.
-
Análisis de 3D imágenes mediante el software con licencia (véase tabla de materiales)
- Abra los datos en bruto de las imágenes con el software. Ajuste el umbral y otros parámetros hasta que las estructuras del buque en cada capa del z-volumen se seleccionan correctamente (consulte la guía del usuario para obtener más información en el software) (figura 4).
- Analizar los personajes de segmentos seleccionados y exportar los datos siguiendo la guía del software.
Resultados
La región distal del tejido adiposo blanco Epididimal (eWAT), región medial de dorsolumbar blanco tejido adiposo subcutáneo (sWAT) y región medial del Interescapular tejido adiposo marrón (BAT) fueron recogidos. Los lugares para recoger estos tejidos se indican en la figura 1.
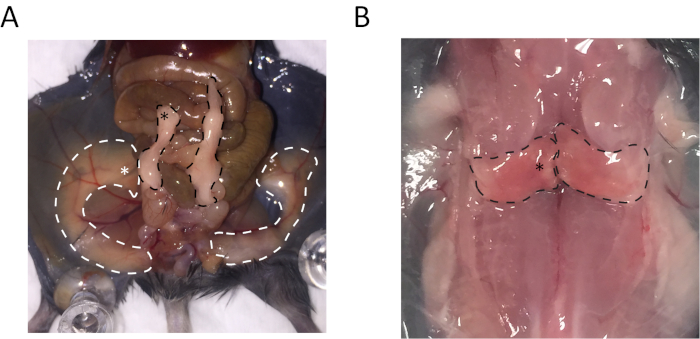
Figura 1: Anatomía del tej...
Discusión
Remodelación del tejido adiposo está directamente ligado al dysregulation metabólico durante el desarrollo de obesidad1,2. Angiogénesis e inervación simpática son esenciales para el proceso remodelación dinámica2,12. Por lo tanto, un enfoque aplicable para visualizar los vasos sanguíneos así como fibras nerviosas son de gran importancia. Los métodos anteriores se han divulgado para documentar l...
Divulgaciones
Los autores declaran que no tienen intereses financieros que compiten.
Agradecimientos
Este estudio fue apoyado por el Instituto Nacional de salud (NIH) subsidio R01DK109001 (K.S.).
Materiales
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 AffiniPure Bovine Anti-Goat IgG (H+L) | Jackson ImmunoResearch | 805-545-180 | Lot: 116969 |
| Alexa Fluor 647 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-605-152 | Lot: 121944 |
| Amira 6.0 | Thermo Fisher Scientific | Licensed software | |
| Angio tool | National Institutes of Health | Open source software https://ccrod.cancer.gov/confluence/display/ROB2/Home | |
| Anti-mouse endomucin antibody | R&D research system | AF4666 | Lot: CAAS0115101 |
| Anti-tyrosine hydroxylase antibody | Pel Freez Biologicals | P40101-150 | Lot: aj01215y |
| Cover glasses high performance, D = 0.17 mm | Zeiss | 474030-9020-000 | |
| Cytoseal 280 | Thermo Fisher Scientific | 8311-4 | High-viscosity medium |
| Glycerol | Fisher | G33-500 | |
| Paraformaldehyde,16% | TED PELLA | 170215 | |
| Press-to-Seal Silicone Isolator with Adhesive, eight wells, 9 mm diameter, 1.0 mm deep | INVITROGEN | P24744 | Silicone isolator |
| ProLong Diamond Antifade Mountant | Thermo Fisher Scientific | P36965 | Mounting medium |
| SEA BLOCK Blocking Buffer | Thermo Fisher Scientific | 37527X3 | |
| Sodium azide | Sigma-Aldrich | S2002-100G | |
| Tissue Path IV Tissue Cassettes | Thermo Fisher Scientific | 22-272416 | |
| Triton Χ-100 | Sigma-Aldrich | X100 | Generic term: octoxynol-9 |
| Tube rotator and rotisseries | VWR | 10136-084 | |
| Tween-20 | Sigma-Aldrich | P1379 | Generic term: Polysorbate 20 |
Referencias
- Rosen, E. D., Spiegelman, B. M. What we talk about when we talk about fat. Cell. 156 (1-2), 20-44 (2014).
- Sun, K., Kusminski, C. M., Scherer, P. E. Adipose tissue remodeling and obesity. Journal of Clinical Investigations. 121 (6), 2094-2101 (2011).
- Sun, K., et al. Endotrophin triggers adipose tissue fibrosis and metabolic dysfunction. Nature Communication. 5, 3485 (2014).
- Zhao, Y., et al. Divergent functions of endotrophin on different cell populations in adipose tissue. American Journal of Physiology-Endocrinology and Metabolism. 311 (6), E952-E963 (2016).
- Zhao, Y., et al. Transient Overexpression of VEGF-A in Adipose Tissue Promotes Energy Expenditure via Activation of the Sympathetic Nervous System. Molecular and Cellular Biology. , (2018).
- Xue, Y., et al. Hypoxia-independent angiogenesis in adipose tissues during cold acclimation. Cell Metabolism. 9 (1), 99-109 (2009).
- Chen, S., et al. LncRNA TDRG1 enhances tumorigenicity in endometrial carcinoma by binding and targeting VEGF-A protein. BBA Molecular Basis of Disease. 1864 (9 Pt B), 3013-3021 (2018).
- Sun, K., et al. Dichotomous effects of VEGF-A on adipose tissue dysfunction. Proceedings of the National Academy of Sciences of the United States of America. 109 (15), 5874-5879 (2012).
- During, M. J., et al. Adipose VEGF Links the White-to-Brown Fat Switch With Environmental, Genetic, and Pharmacological Stimuli in Male Mice. Endocrinology. 156 (6), 2059-2073 (2015).
- Elias, I., et al. Adipose tissue overexpression of vascular endothelial growth factor protects against diet-induced obesity and insulin resistance. Diabetes. 61 (7), 1801-1813 (2012).
- Sung, H. K., et al. Adipose vascular endothelial growth factor regulates metabolic homeostasis through angiogenesis. Cell Metabolism. 17 (1), 61-72 (2013).
- Cao, Y. Angiogenesis and vascular functions in modulation of obesity, adipose metabolism, and insulin sensitivity. Cell Metabolism. 18 (4), 478-489 (2013).
- Sun, K., et al. Brown adipose tissue derived VEGF-A modulates cold tolerance and energy expenditure. Molecular Metabolism. 3 (4), 474-483 (2014).
- Zeng, W., et al. Sympathetic neuro-adipose connections mediate leptin-driven lipolysis. Cell. 163 (1), 84-94 (2015).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), (2012).
- Berry, R., et al. Imaging of adipose tissue. Methods in Enzymology. 537, 47-73 (2014).
- Jiang, H., Ding, X., Cao, Y., Wang, H., Zeng, W. Dense Intra-adipose Sympathetic Arborizations Are Essential for Cold-Induced Beiging of Mouse White Adipose Tissue. Cell Metabolism. 26 (4), 686-692 (2017).
- Chi, J., et al. Three-Dimensional Adipose Tissue Imaging Reveals Regional Variation in Beige Fat Biogenesis and PRDM16-Dependent Sympathetic Neurite Density. Cell Metabolism. 27 (1), 226-236 (2018).
- Zudaire, E., Gambardella, L., Kurcz, C., Vermeren, S. A computational tool for quantitative analysis of vascular networks. PLoS One. 6 (11), e27385 (2011).
- An, Y. A., et al. Angiopoietin-2 in white adipose tissue improves metabolic homeostasis through enhanced angiogenesis. eLife. 6, (2017).
- Chi, J., Crane, A., Wu, Z., Cohen, P. Adipo-Clear: A Tissue Clearing Method for Three-Dimensional Imaging of Adipose Tissue. Journal of Visualized Experiments. (137), (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados