É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Co a coloração dos vasos sanguíneos e fibras nervosas no tecido adiposo
Neste Artigo
Resumo
Formação da embarcação de sangue novo e inervação simpática desempenham um papel crucial na remodelação do tecido adiposo. No entanto, subsistem questões técnicas em Visualizar e medir quantitativamente o tecido adiposo. Aqui nós apresentamos um protocolo para rotular com êxito e comparar quantitativamente as densidades de vasos sanguíneos e fibras nervosas em diferentes tecidos adiposos.
Resumo
Estudos recentes têm destacado o papel crítico da angiogênese e inervação simpática no tecido adiposo remodelação durante o desenvolvimento da obesidade. Portanto, desenvolver um método fácil e eficiente para documentar as mudanças dinâmicas no tecido adiposo é necessário. Aqui, descrevemos uma abordagem de imunofluorescência modificada que eficientemente co manchas, vasos sanguíneos e fibras nervosas no tecido adiposo. Em comparação com métodos tradicionais e recentemente desenvolvidos, nossa abordagem é relativamente fácil de seguir e mais eficiente na rotulagem dos vasos sanguíneos e fibras nervosas com densidades maiores e menos fundo. Além disso, quanto maior a resolução das imagens ainda mais nos permite medir com precisão a área dos navios, quantidade de ramificação e comprimento das fibras por software de código aberto. Como uma demonstração usando o nosso método, mostramos que o tecido adiposo marrom (BAT) contém quantidades mais elevadas de vasos sanguíneos e fibras nervosas em relação ao tecido adiposo branco (WAT). Podemos ainda encontrar que entre os WATs, WAT subcutâneo (sWAT) tem mais vasos sanguíneos e fibras nervosas em relação ao epidídimo WAT (eWAT). Nosso método, portanto, fornece uma ferramenta útil para investigar a remodelação do tecido adiposo.
Introdução
Tecido adiposo tem chave metabólica e endócrina funções1. Isso dinamicamente aumenta ou diminui em resposta a diferentes nutrientes sublinha2. O tecido ativo processo de remodelação é composto por vários caminhos fisiológicas/etapas incluindo angiogênese, fibrose e formação de um microambiente inflamatório local2,3,4. Alguns estímulos físicos, tais como exposição fria e exercício, podem desencadear a ativação simpática, que em última análise, leva à formação de embarcação de sangue novo e inervação simpática em tecidos adiposos5,6. Estes processos de remodelação estão ligados firmemente a resultados metabólicos sistêmicos, incluindo a sensibilidade à insulina, a marca do tipo 2 diabetes2. Assim, a visualização dessas alterações patológicas é muito importante para compreender o estado saudável dos tecidos adiposos.
Angiogênese é o processo de formação da embarcação de sangue novo. Uma vez que os vasos sanguíneos fornecer oxigênio, nutrientes, hormônios e fatores de crescimento para o tecido, angiogênese foi considerado um passo fundamental no tecido adiposo remodelação, que tem sido documentado com diferentes técnicas6,7, 8 , 9 , 10 , 11 , 12 , 13. no entanto, subsistem dúvidas sobre a resolução das imagens, eficiência de imunocoloração e métodos para a quantificação da densidade do navio. Em relação à formação da embarcação de sangue novo, inervação no tecido adiposo foi subestimada por muito tempo. Recentemente, Zeng et al. 14 usado avançados de microscopia intravital dois fotões e demonstrou que os adipócitos estão cercados por camadas de fibras nervosas14. Desde então, os pesquisadores começaram a apreciar o papel fulcral da inervação simpática no Regulamento da fisiologia do tecido adiposo. Assim, desenvolver uma abordagem fácil e prática de inervação do nervo adiposa de documento é importante.
Aqui, nós relatamos um método otimizado para a coloração co de vasos sanguíneos e fibras nervosas, com base em nossos protocolos anteriores. Com este método, podemos conseguir imagens claras de vasos sanguíneos e fibras nervosas sem fundo ruidoso. Além disso, nós obtemos uma resolução que é alta o suficiente para executar a medição quantitativa de densidades com software de código aberto. Usando esta nova abordagem, podemos comparar com sucesso as estruturas e as densidades de vasos sanguíneos e fibras nervosas em diferentes depósitos adiposos.
Protocolo
Todos os procedimentos que contenham assuntos animais foram aprovados pelo centro de Ciências de Saúde Animal Welfare Comitê da Universidade do Texas em Houston (número de protocolo animal: AWC-18-0057).
1. preparação do reagente
- 1 x tampão fosfato salino (PBS, pH 7,4): para fazer 1 L de PBS 1x, dissolver 8 g de NaCl, 0,2 g de KCl, 1,44 g de Na2HPO4e 0,24 g de KH2PO4 em 800 mL de água destilada. Ajustar o pH para 7,4 e encha com água destilada para alcançar um volume final de 1 L.
- 1% paraformaldeído em PBS 1x (1% PFA, wt/vol): para obter um volume final de 50 mL, adicionar 3,125 mL de 16% PFA (ver Tabela de materiais) para 46,875 mL de 1X PBS. Misture bem e guarde a 4 ° C para uso posterior.
Atenção: Paraformaldeído é tóxico. Todos os procedimentos devem ser realizados sob uma coifa para evitar a inalação e contacto com a pele. - 0,1% polissorbato 20 (consulte a tabela de materiais) em PBS 1x (1 x PBST, pH 7,4, vol/vol): para obter um volume final de 50 mL, adicionar 0,05 mL de polissorbato 20 de 49,95 mL de 1X PBS. Vórtice e loja a 4 ° C por até 1 mês.
- 1% Octoxinol-9 (ver Tabela de materiais) em PBS 1x (1X PBS-TX, pH 7,4, vol/vol): para obter um volume final de 10 mL, adicionar 0,1 mL de Octoxinol-9 a 9,9 mL de 1X PBS. Vórtice e loja a 4 ° C por até 1 mês.
- 2% de azida sódica (wt/vol): para produzir 10 mL de 2% de azida de sódio, adicionar 0,2 g de azida de sódio a 10 mL de 1X PBS. Misture bem e guarde a 4 ° C para uso posterior.
- 90% de glicerol em 1X PBS (vol/vol): para obter um volume final de 10 mL, adicionar 1 mL de 1X PBS a 9 mL de glicerol. Vórtice e armazenar à temperatura ambiente (RT) para uso posterior.
2. animal Ddissection e coleção de tecido adiposo
- Use camundongos machos do C57BL/6J 6 semanas de idade. Anestesia os ratos com isoflurano (4-5% para indução então 1%-2% para manutenção). Uma vez anestesiado, realize um reflexo de dedo-pinch para determinar a profundidade anestésica, a julgar pela falta de pedais reflexos. Uma vez que os ratos são anestesiados profundamente, disse os ratos seguindo o protocolo como publicado anteriormente15.
- Esterilize a tesoura sem corte e área cirúrgica do tórax (sem necessidade de rapar o cabelo). Abra o baú cortando o diafragma e as costelas ao longo da superfície lateral com um tamanho de ~ 2 cm com uma tesoura sem corte. Fixar a bandeira no peito com pinça hemostática e refleti-la, colocando a pinça hemostática sobre a cabeça.
- Faça uma pequena incisão no ventrículo esquerdo (~0.5 cm) com uma tesoura de íris. Inserir uma agulha com ponta oliva perfusão através do local da incisão e prenda a ponta da agulha no lugar com a pinça hemostática. Conecte a agulha de uma seringa de 50 mL contendo solução de fixação paraformaldeído (1% PFA, pH 7,4).
- Abra o átrio direito pela corte de seção com uma tesoura de íris como a saída de perfusão. Iniciar a perfusão por suavemente e continuamente empurrando a seringa em uma taxa de perfusão perto de 10 mL/min. parar de empurrar quando o fluido sair da tomada está livre de qualquer sangue. Todo o processo deve exigir ~ 5 min.
Atenção: Execute estas etapas sob uma coifa para evitar toxicidade da PFA. - Disse os tecidos adiposo brancos e marrons de ratos. Use a tesoura para quebrar as amostras de tecido em pequenos pedaços de pedaços de cerca de 5 x 5 x 3 mm3. Transfira os pedaços pequenos com uma pinça esterilizada no tecido incorporação cassettes com rotulagem adequada das amostras de tecido sobre as fitas.
- Mergulhe as incorporação cassettes contendo amostras de tecido para a solução de fixação (1% PFA em 1X PBS, pH 7,4) a 4 ° C por 24 – 48 h.
Nota: A solução de fixação e o tempo de fixação variam de acordo com tamanhos dos tecidos16,17,18. - Lave as amostras com frescos 1x tampão PBS três vezes (0,5 mL/lavagem).
Atenção: Execute esta etapa sob uma coifa. Os resíduos de paraformaldeído devem ser manuseados corretamente de acordo com os procedimentos de eliminação de resíduos perigosos.
Nota: Os tecidos podem ser armazenados em 1X PBS a 4 ° C para posterior processamento.
3. incubação do anticorpo
- Corte as amostras de tecido fixo em cubos de3 aproximadamente 2 mm com a tesoura esterilizada. Para permeabilização, transferir as amostras em um tubo de 1,5 mL contendo 1 mL de 1 x PBS-TX (1% Octoxinol-9 em PBS 1x, consulte tabela de materiais, pH 7,4) e rodar suavemente os tubos no RT por 1h a 18 rpm.
- Remova cuidadosamente a 1 x PBS-TX por aspiração. Lavar as amostras 3 x adicionando a PBS 1x diretamente para os tubos de mesmos (sem necessidade de alterar os tubos). Durante cada lavagem, inverta os tubos várias vezes.
- Para bloquear, adicionar 0,5 mL de tampão de bloqueio (Tabela de materiais) para as amostras e incubar a RT por 2h com rotação suave.
- Para preparar a 0,4 mL da solução de anticorpo primário, diluir 2 μL de anti - endomucin (o marcador dos vasos sanguíneos) 5 (1: 200) e 2 μL de anti — anticorpos de 5 (1: 200, 1 µ g/mL) Tirosina Hidroxilase (TH, o marcador de fibras nervosas) (tabela de materiais para obter informações de anticorpo) em 396 μL de tampão de bloqueio. Vórtice e spin para baixo para recuperar o volume.
- Para a primeira incubação do anticorpo, cuidadosamente remova o tampão de bloqueio os pedaços de tecido. Adicionar 100 μL de solução de anticorpo primário, preparada no passo 3.4 para tubos e incube a 4 ° C durante a noite.
Nota: O tempo de diluição e incubação do anticorpo pode variar entre diferentes anticorpos. É recomendável adicionar 0,02% de azida de sódio para a solução de anticorpo para evitar o crescimento microbiano. Para preparar a 0,4 mL da solução de anticorpo primário com azida de sódio, adicione 4 μL de anticorpos (1 μL de cada um) e 4 μL de 2% de azida de sódio em 392 μL de tampão de bloqueio. - Recolha cuidadosamente a solução de anticorpo primário para reutilizá-las se desejado. Lavar as amostras com 1 x PBST (pH 7,4, 100 µ l/lavagem) três vezes (30 min cada) com suave rotação em rpm 18.
- Para a preparação da solução de anticorpo secundário, diluir 2 μL de fluoróforo (onda comprimento 495 nm) Conjugado IgG anticabra (1: 200) e 2 μL de fluoróforo (onda comprimento 650 nm) Conjugado IgG anticoelho (1: 200) (ver Tabela de materiais) em 396 μL de tampão de bloqueio. Vórtice e spin brevemente para recolher todo o líquido.
Nota: Protege as amostras da luz durante os procedimentos a seguir. - Para a segunda incubação do anticorpo, remova o último tampão de lavagem de amostras. Adicionar 100 μL de solução de anticorpo secundário em tubos e incubar a RT por 2h com suave rotação em rpm 18.
- Remova cuidadosamente a solução de anticorpo secundário. Lavar as amostras 3 x com 1 x PBST (pH 7,4, 30 min cada) com suave rotação em rpm 18.
Nota: Não reutilize esta solução de anticorpo secundário, como que possam estar contaminado com os vestígios de anticorpos primários trazidos por tecidos. - Para a compensação óptica, mergulhe as amostras em 1 mL de glicerol de 90% e manter as amostras em 4 ° C na escuridão, até ficarem transparentes.
Nota: A duração da imersão depende do tipo de tecido e tamanho. Normalmente, um cubo de3 de 2 mm de tecido adiposo branco precisa de incubação durante a noite, enquanto as mesmo tamanho marrom tecido adiposo amostra necessidades mais tempo. - Aderir a um isolador de silicone para o slide para criar um bem para a imagem latente de volume. Alternativamente, anexar várias camadas de fita adesiva transparente para os slides e cortar um quadrado do meio para criar um poço (Figura 2).
Nota: Ajuste a profundidade bem para caber o tamanho da amostra. Neste protocolo, uma profundidade de 1 mm bem é usada. - Cuidadosamente, transferir as amostras para o bem e encha-o com o meio de montagem (ver Tabela de materiais). Colocar uma lamínula sobre a superfície e os cantos da lamínula com média viscosidade elevada do selo (ver Tabela de materiais). Deixe a cura médio de montagem para 24 h no RT na escuridão.
Nota: Certifique-se de que nenhum espaço é deixado entre a amostra e a lamínula. Evite bolhas sob a lamínula. Evite colocar pressão excessiva sobre as amostras.
4. aquisição de imagem
- Adquira imagens de Z-pilha (consulte os passos 4.2 – 4.7) com o objetivo de 20x de um microscópio confocal/software.
- Inicie o sistema. Clique na guia <configuração> e ativar o laser de argônio e laser de 633 aqui vai. Clique na guia <Acquire>. No painel de linhas do laser <Visible>, subir as barras de intensidade correspondente para escolher as linhas de laser de 488 nm e 633 nm. Inicialmente, as intensidades podem ser definidas para 20%-30%. Selecione o espelho triplo dichoric 488/561/633. Ative os PMTs clicando sobre as caixas de seleção <ativo>, escolhendo PMT1 para emissão animada por 488 nm laser e PMT3 para da 633 nm laser. Defina o intervalo de comprimento de onda para 500 – 550 nm para PMT1 e 650-750nm para PMT3. Selecione o psudocolor a ser usado para exibição de imagem dupla clicando no retângulo colorido ao lado de cada PMT e escolhendo uma cor no menu pop-up.
- Clique no <Live> para verificar a imagem de amostras. Use o botão z-posição para selecionar um plano de foco dentro da região XY de interesse. Ajuste o brilho das imagens por meio do ajuste da intensidade do laser, ganho inteligente e deslocamento. Para cada canal de fluorescência, realizar este ajuste sob o modo de exibição de <QLUT> (veja acima tabela rápida). Clique no botão <QLUT> para entrar no modo QLUT, na qual os pixels saturados são exibidos em azul para auxiliar a configuração do nível de brilho adequado. Clique duas vezes no botão <QLUT> para voltar ao modo de exibição pseudocolorida.
Nota: Os valores numéricos da configuração podem variar entre cada experimento. - Ao fazer a varredura, gire o botão de Z-posição para a esquerda para mover o plano de foco para uma extremidade do volume de interesse e, em seguida, clique na seta para definir a posição final digitalização <final>. Em seguida, gire o botão de Z-posição para a direita para mover o plano de foco através da amostra para a outra extremidade do volume de interesse e, em seguida, clique na seta <Begin> para definir a posição de começar a varredura.
Nota: Para a comparação entre diferentes amostras, defina o mesmo Z-volume de amostras diferentes. - Ajuste o tamanho de z-passo de 3 µm. alterar a qualidade de imagem, selecionando um formato de 1024 x 1024, velocidade de 100 Hz e linha média de 2.
- Selecione <Iniciar > para iniciar a aquisição de imagem de z-pilha.
- Para a projeção máxima da pilha imagem adquirida, clique na guia <processo> e <ferramenta>, selecione <projeção 3D> e digite <máxima> na lista de método sem alterações para X, Y e z Set <Limiar> 0. Clique no <aplicar>. A intensidade máxima do Z-volume vai ser empilhada em uma imagem 2D que será mostrada (Figura 4A).
5. análise de redes de fibras nervosas e vasos sanguíneos
-
Análise de 2D imagens através do software de fonte aberta (ver tabela de materiais)19
- Abra as imagens empilhadas no software. Ajuste a intensidade e o diâmetro do vaso até que todas as estruturas do navio podem ser adequadamente selecionado (Figura 4B).
- Selecione executar análise e exportar os dados seguindo orientação do software.
-
Análise de 3D imagens através do software licenciado (consulte a tabela de materiais)
- Abra os dados brutos de imagens com o software. Ajustar o limiar e outros parâmetros, até as estruturas de navio em cada camada do z-volume são corretamente selecionadas (consulte o guia do usuário para detalhes no software) (Figura 4).
- Analisar os caracteres selecionados segmentos e exportar os dados a seguir a orientação do software.
Resultados
A região distal do epidídimo tecido adiposo branco (eWAT), região medial do dorsolombar branco tecido adiposo subcutâneo (sWAT) e região medial da interscapulaire tecido adiposo marrom (BAT) foram coletados. Os locais de recolha desses tecidos são indicados na Figura 1.
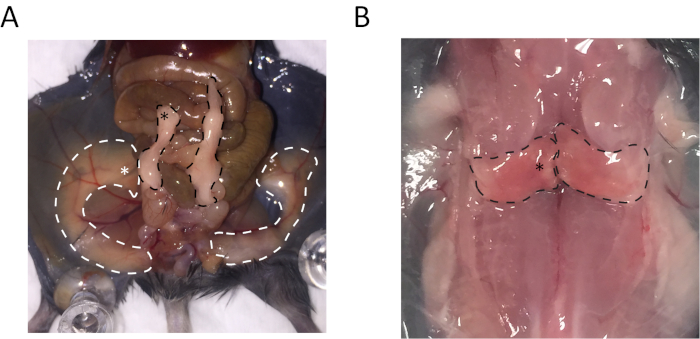
Figura 1: Anatomia do tecido adip...
Discussão
Remodela o tecido adiposo está diretamente ligada à desregulação metabólica durante o desenvolvimento de obesidade1,2. Angiogênese e inervação simpática são essenciais para a dinâmica remodela processo2,12. Portanto, desenvolver uma abordagem aplicável para visualizar os novos vasos sanguíneos, bem como as fibras nervosas são de grande importância. Métodos anteriores têm sido relatados pa...
Divulgações
Os autores declaram que eles têm não tem interesses financeiro concorrente.
Agradecimentos
Este estudo foi suportado pelo Instituto Nacional de saúde (NIH) grant R01DK109001 (K.S.).
Materiais
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 AffiniPure Bovine Anti-Goat IgG (H+L) | Jackson ImmunoResearch | 805-545-180 | Lot: 116969 |
| Alexa Fluor 647 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-605-152 | Lot: 121944 |
| Amira 6.0 | Thermo Fisher Scientific | Licensed software | |
| Angio tool | National Institutes of Health | Open source software https://ccrod.cancer.gov/confluence/display/ROB2/Home | |
| Anti-mouse endomucin antibody | R&D research system | AF4666 | Lot: CAAS0115101 |
| Anti-tyrosine hydroxylase antibody | Pel Freez Biologicals | P40101-150 | Lot: aj01215y |
| Cover glasses high performance, D = 0.17 mm | Zeiss | 474030-9020-000 | |
| Cytoseal 280 | Thermo Fisher Scientific | 8311-4 | High-viscosity medium |
| Glycerol | Fisher | G33-500 | |
| Paraformaldehyde,16% | TED PELLA | 170215 | |
| Press-to-Seal Silicone Isolator with Adhesive, eight wells, 9 mm diameter, 1.0 mm deep | INVITROGEN | P24744 | Silicone isolator |
| ProLong Diamond Antifade Mountant | Thermo Fisher Scientific | P36965 | Mounting medium |
| SEA BLOCK Blocking Buffer | Thermo Fisher Scientific | 37527X3 | |
| Sodium azide | Sigma-Aldrich | S2002-100G | |
| Tissue Path IV Tissue Cassettes | Thermo Fisher Scientific | 22-272416 | |
| Triton Χ-100 | Sigma-Aldrich | X100 | Generic term: octoxynol-9 |
| Tube rotator and rotisseries | VWR | 10136-084 | |
| Tween-20 | Sigma-Aldrich | P1379 | Generic term: Polysorbate 20 |
Referências
- Rosen, E. D., Spiegelman, B. M. What we talk about when we talk about fat. Cell. 156 (1-2), 20-44 (2014).
- Sun, K., Kusminski, C. M., Scherer, P. E. Adipose tissue remodeling and obesity. Journal of Clinical Investigations. 121 (6), 2094-2101 (2011).
- Sun, K., et al. Endotrophin triggers adipose tissue fibrosis and metabolic dysfunction. Nature Communication. 5, 3485 (2014).
- Zhao, Y., et al. Divergent functions of endotrophin on different cell populations in adipose tissue. American Journal of Physiology-Endocrinology and Metabolism. 311 (6), E952-E963 (2016).
- Zhao, Y., et al. Transient Overexpression of VEGF-A in Adipose Tissue Promotes Energy Expenditure via Activation of the Sympathetic Nervous System. Molecular and Cellular Biology. , (2018).
- Xue, Y., et al. Hypoxia-independent angiogenesis in adipose tissues during cold acclimation. Cell Metabolism. 9 (1), 99-109 (2009).
- Chen, S., et al. LncRNA TDRG1 enhances tumorigenicity in endometrial carcinoma by binding and targeting VEGF-A protein. BBA Molecular Basis of Disease. 1864 (9 Pt B), 3013-3021 (2018).
- Sun, K., et al. Dichotomous effects of VEGF-A on adipose tissue dysfunction. Proceedings of the National Academy of Sciences of the United States of America. 109 (15), 5874-5879 (2012).
- During, M. J., et al. Adipose VEGF Links the White-to-Brown Fat Switch With Environmental, Genetic, and Pharmacological Stimuli in Male Mice. Endocrinology. 156 (6), 2059-2073 (2015).
- Elias, I., et al. Adipose tissue overexpression of vascular endothelial growth factor protects against diet-induced obesity and insulin resistance. Diabetes. 61 (7), 1801-1813 (2012).
- Sung, H. K., et al. Adipose vascular endothelial growth factor regulates metabolic homeostasis through angiogenesis. Cell Metabolism. 17 (1), 61-72 (2013).
- Cao, Y. Angiogenesis and vascular functions in modulation of obesity, adipose metabolism, and insulin sensitivity. Cell Metabolism. 18 (4), 478-489 (2013).
- Sun, K., et al. Brown adipose tissue derived VEGF-A modulates cold tolerance and energy expenditure. Molecular Metabolism. 3 (4), 474-483 (2014).
- Zeng, W., et al. Sympathetic neuro-adipose connections mediate leptin-driven lipolysis. Cell. 163 (1), 84-94 (2015).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), (2012).
- Berry, R., et al. Imaging of adipose tissue. Methods in Enzymology. 537, 47-73 (2014).
- Jiang, H., Ding, X., Cao, Y., Wang, H., Zeng, W. Dense Intra-adipose Sympathetic Arborizations Are Essential for Cold-Induced Beiging of Mouse White Adipose Tissue. Cell Metabolism. 26 (4), 686-692 (2017).
- Chi, J., et al. Three-Dimensional Adipose Tissue Imaging Reveals Regional Variation in Beige Fat Biogenesis and PRDM16-Dependent Sympathetic Neurite Density. Cell Metabolism. 27 (1), 226-236 (2018).
- Zudaire, E., Gambardella, L., Kurcz, C., Vermeren, S. A computational tool for quantitative analysis of vascular networks. PLoS One. 6 (11), e27385 (2011).
- An, Y. A., et al. Angiopoietin-2 in white adipose tissue improves metabolic homeostasis through enhanced angiogenesis. eLife. 6, (2017).
- Chi, J., Crane, A., Wu, Z., Cohen, P. Adipo-Clear: A Tissue Clearing Method for Three-Dimensional Imaging of Adipose Tissue. Journal of Visualized Experiments. (137), (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados