JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
혈관과 신경 섬유 지방 조직에서 공동 얼룩
요약
새로운 혈관 형성 및 동 정적인 신경 분포 개장 하는 지방 조직에서 중추적인 역할을 재생합니다. 그러나, 시각화 및 양적 측정 지방 조직에 기술적인 문제가 남아 있다. 여기 우리는 성공적으로 레이블 및 양적 혈관과 다른 adipose 조직에 신경 섬유의 밀도 비교 하는 프로토콜을 제시.
초록
최근 연구는 신생 및 비만의 발달 동안에 개장 하는 지방 조직에 동 정적인 신경 분포의 중요 한 역할을 강조 했습니다. 따라서, 지방 조직에서 동적인 변화를 문서화 하는 간단 하 고 효율적인 방법을 개발은 필요입니다. 여기, 혈관과 신경 섬유 지방 조직에서 효율적으로 공동 얼룩 수정된 immunofluorescent 방식을 설명 합니다. 전통 및 최근 개발 된 방법에 비해, 우리의 접근 방법 이며 비교적 따라 하기 쉬운 혈관 및 높은 밀도와 신경 섬유 및 더 적은 배경 라벨에 더 효율적. 또한, 추가 이미지의 높은 해상도를 수 있습니다 오픈 소스 소프트웨어에 의해 혈관, 분기, 및 섬유의 길이 영역을 정확 하 게 측정. 우리의 방법을 사용 하 여 데모, 우리는 그 갈색 지방이 많은 직물 (박쥐)의 혈관과 신경 섬유 흰색 adipose 조직 (WAT)에 비해 높은 금액을 포함 보여줍니다. 우리 찾기 시 켰 지, 중 피하 왓 (sWAT)는 혈관 및 신경 섬유 epididymal 와트 (eWAT)에 비해 더 더. 따라서 우리의 메서드는 지방 조직 리 모델링 조사에 대 한 유용한 도구를 제공 합니다.
서문
지방 조직 변화 키 고 내 분 비 기능1. 그것은 동적으로 확장 하거나 축소 하는 다른에 대 한 응답 영양소 강조2. 과정을 개장 하는 활성 조직 구성 여러 생리 적 경로/단계 신생 혈관, 섬유 증, 지역 염증 성 microenvironments2,,34의 형성 등. 추위 노출, 운동, 등 일부 물리적 자극, 궁극적으로 새로운 혈관 형성 및 지방 조직5,6에 동 정적인 신경 분포에 이르게 공감 활성화, 실행할 수 있는. 이러한 리 모델링 프로세스 조직의 대사 결과 인슐린 감도, 유형 2 당뇨병2의 특징을 포함 하 여 밀접 하 게 연결 됩니다. 따라서, 이러한 병 적인 변화의 시각화 전체 adipose 조직의 건강 상태를 이해 하는 데 매우 중요 하다.
신생은 새로운 혈관 형성 과정입니다. 때문에 혈관 산소, 영양분, 호르몬, 및 조직에 성장 요소를 제공, 신생 다른 기법6,7, 로 문서화 되었습니다., 개장 하는 지방 조직에서 중요 한 단계 고려 되었습니다. 8 , 9 , 10 , 11 , 12 , 그러나 13., 거기 남아 있는 이미지의 해상도, immunostaining, 및 배 밀도의 정량화 방법의 효율성에 대 한 질문. 새로운 혈관 형성에 비해, 지방 조직에 신경 분포는 오랜 시간에 대 한 과소평가 되었습니다. 최근, 쩡 외입니다. 14 사용 고급 intravital 두 광자 현미경 그리고 시연 adipocytes14신경 섬유 층에 의해 포위 된다. 그 이후, 연구원은 지방 조직 생리학의 규칙에 동 정적인 신경 분포의 중추적인 역할을 감사 하기 시작 했습니다. 따라서, 문서 많은 신경 신경 분포 하는 간단 하 고 실용적인 접근 방식을 개발이 중요 합니다.
여기, 우리 보고 공동 혈관과 우리의 이전 프로토콜에 기반으로 하는 신경 섬유의 얼룩에 대 한 최적화 된 방법 합니다. 이 방법으로 우리 혈관과 신경 섬유 시끄러운 배경 없이 선명한 영상을 얻을 수 있습니다. 또한, 우리는 오픈 소스 소프트웨어와 밀도의 정량적 측정을 수행 하기 위해 충분히 높은 해상도 얻을. 이 새로운 접근법을 사용 하 여 우리가 성공적으로 구조와 혈관과 다른 많은 플랫폼에 신경 섬유의 밀도 비교할 수 있습니다.
프로토콜
동물 주제를 포함 하는 모든 절차 휴스턴에서 동물 복지 위원회의의 텍사스 대학 보건 과학 센터에 의해 승인 되었습니다 (동물 프로토콜 번호: AWC-18-0057).
1. 시 약 준비
- 1 인산 염 버퍼 식 염 수 (PBS, pH 7.4) x: 1 L 1 x PBS의 수 있도록, NaCl의 8 g, KCl의 0.2 g, 나2HPO4, 1.44 g 그리고 증류수 800 mL에 KH2포4 의 0.24 g을 분해. 7.4 및 채우기 증류수 1 l.의 최종 볼륨을 달성 하기 위하여 pH를 조정
- 1 x PBS (1 %PFA, wt/집)에서 1 %paraformaldehyde: 50 mL의 최종 볼륨을 달성 하기 위해 추가 16%의 3.125 mL PFA ( 재료의 표참조) 1 x PBS의 46.875 ml. 잘 혼합 하 고 나중에 사용할 4 ° C에서 저장.
주의: Paraformaldehyde 독성이 있다. 모든 절차는 증기 두건 흡입을 방지 하 고 피부 접촉을 아래에서 밖으로 실행 되어야 한다. - 1 x PBS (PBST, pH 7.4, vol/vol 1)에서 0.1% 폴 ( 재료의 표참조) 20: 50 mL의 최종 볼륨을 달성 하기 위해 추가 음식 1 x PBS의 49.95에 20 mL의 0.05 mL. 와 동 그리고 1 개월까지 4 ° C에서 저장소.
- 1 %octoxynol-9 ( 재료의 표참조)에 1 x PBS (PBS-텍사스, pH 7.4, vol/vol 1): 10 mL의 최종 볼륨을 달성 하기 위해 1 x PBS의 9.9 ml 0.1 mL octoxynol-9의 추가. 와 동 그리고 1 개월까지 4 ° C에서 저장소.
- 2% 나트륨 아 지 드 (wt/vol): 2% 나트륨 아 지 드의 10 mL를 생산, 1 x PBS의 10 mL를의 나트륨 아 지 드 0.2 g을 추가. 잘 혼합 하 고 나중에 사용할 4 ° C에서 저장.
- 1 x PBS (vol/vol)에 90% 글리세롤: 글리세롤의 9 mL에 1 x PBS의 1 mL 10 mL의 최종 볼륨을 달성 하기 위해 추가. 소용돌이 하 고 실내 온도 (RT) 나중에 사용에 대 한 저장소.
2. 동물 Ddissection 및 지방이 많은 직물 컬렉션
- 6 주 된 C57BL/6J 남성 마우스를 사용 합니다. Isoflurane (4%-5% 유도 후 유지 보수에 대 한 1%-2%)와 마우스 anesthetize 일단 마 취, 마 취 깊이, 페달 반사의 부족으로 판단 결정 하 발가락 핀치 반사를 수행 합니다. 일단 쥐 취 깊이 이전에 게시15프로토콜에 따라 쥐를 해 부.
- 무딘가 위 및 가슴 (머리를 면도 필요 없음)의 외과 영역 소독. 횡 경 막과 늑 무딘가 위를 사용 하 여 ~ 2 cm의 크기와 측면 서피스를 따라 절단 하 여 가슴을 엽니다. Hemostat로 가슴 플래그 클램프 머리는 hemostat 넣어 그것을 반영 하 고.
- 아이리스가 위 좌 심 실 (~0.5 cm)에 작은 절 개를 확인 합니다. 절 개 사이트를 통해 올리브 밀고 관류 바늘을 삽입 하 고는 hemostat 장소에 바늘 끝을 클램프. Paraformaldehyde 고정 솔루션 (1 %PFA, pH 7.4)를 포함 하는 50 mL 주사기를 바늘을 연결 합니다.
- 관류 콘센트로 아이리스가 위 섹션을 절단 하 여 오른쪽 아 트리 움을 엽니다. 부드럽게 하 여 재 관류를 시작 하 고 지속적으로 추진 주사기 관류 속도에 가까운 10 mL/분 콘센트를 종료 하는 액체는 분명 어떤 혈액의 때를 밀고 중지 합니다. 전체 프로세스는 ~ 5 분을 필요로 한다.
주의: PFA에서 독성을 방지 하기 위해 증기 두건에서 다음이 단계를 수행 합니다. - 흰색과 갈색 지방 조직에서 쥐를 해 부. 가 위를 사용 하 여 조직 샘플을 덩어리 약 5 x 5 x 3 m m3의 작은 조각에 침입. 카세트는 카세트에 조직 샘플의 적절 한 라벨을 포함 하는 조직으로 멸 균된 핀셋으로 작은 덩어리를 전송.
- 조직 샘플 고정 솔루션에 포함 된 포함 카세트를 담가 (1 %1 x PBS, pH 7.4에에서 PFA) 24-48 h 4 ° C에서.
참고: 고정 솔루션 및 고정 시간 조직16,,1718의 크기에 따라 다릅니다. - (0.5 mL/워시) 시간 PBS 버퍼 3 x 신선한 1 샘플을 씻으십시오.
주의: 증기 두건 아래이 단계를 수행 합니다. 유해 폐기물 처리 절차에 따라 paraformaldehyde 폐기물을 제대로 처리 되어야 합니다.
참고: 조직 추가 처리를 위해 4 ° C에서 1 x PBS에 저장할 수 있습니다.
3. 항 체 외피
- 멸 균가 위로 고정된 조직 샘플 약 2 mm3 조각으로 잘라. Permeabilization에 대 한 전송 샘플 1의 1 mL를 포함 하는 1.5 mL 튜브에 PBS-TX x (1 x PBS에서 1 %octoxynol-9 참조 자료에 대 한 테이블, pH 7.4) 18 rpm에서 1 h에 대 한 실시간에 튜브를 부드럽게 회전 하는 고.
- 1를 조심 스럽게 제거 PBS-TX 포부에 의해 x. 워시 샘플 3 x 1 x PBS 같은 튜브 (튜브를 변경할 필요가 없습니다)에 직접 추가 하 여. 각 세척 하는 동안 튜브를 여러 번 반전.
- 차단, 샘플에 블로킹 버퍼 (자료 테이블)의 0.5 mL을 추가 하 고 부드러운 회전 2 h에 대 한 RT에서 품 어.
- 1 차적인 항 체 솔루션의 0.4 mL를 준비 하려면 희석 안티-endomucin (혈관의 마커) 5 (1: 200)의 2 μ와 안티의 2 μ-티로신 hydroxylase (TH, 신경 섬유의 마커) 5 (1: 200, 1 µ g/mL) 항 체 (테이블의 재료 항 체 정보) 블로킹 버퍼의 396 μ로. 와 동 그리고 복구 볼륨 아래로 회전입니다.
- 첫 번째 항 체 외피에 대 한 신중 하 게 조직 덩어리에서 블로킹 버퍼를 제거 합니다. 튜브로 3.4 단계에서 준비 하는 1 차적인 항 체 솔루션의 100 μ를 추가 하 고 하룻밤 4 ° C에서 품 어.
참고: 항 체 희석과 부 화에 다른 항 체 사이에서 달라질 수 있습니다. 미생물 성장을 방지 하기 위해 항 체 솔루션을 0.02% 나트륨 아 지 드를 추가 하는 것이 좋습니다. 나트륨 아 지 드와 함께 1 차 항 체 솔루션의 0.4 mL를 준비 하려면 차단 버퍼의 392 μ에 항 체 (각각 1 μ)의 4 μ와 4 μ 2% 나트륨 아 지 드의을 추가 합니다. - 원하는 경우에 신중 하 게 재사용에 대 한 1 차적인 항 체 솔루션을 수집 합니다. 1 샘플 워시 x PBST (pH 7.4, 100 µ L/워시) 3 18 rpm에서 부드러운 회전 (각 30 분) 시간.
- 이차 항 체 솔루션, fluorophore (웨이브 길이 495 nm)의 희석 2 μ의 준비 항 염소 IgG (1: 200)을 활용 하 고 2 μ fluorophore (웨이브 길이 650 nm)의 활용-토끼 IgG (1: 200) ( 재료의 표참조)의 396 μ로 블로킹 버퍼입니다. 와 동 그리고 짧게 모든 액체를 수집 하는 스핀.
참고: 다음 절차 동안 빛에서 샘플을 보호 합니다. - 두 번째 항 체 외피에 대 한 샘플에서 마지막 워시 버퍼를 제거 합니다. 튜브로 이차 항 체 솔루션의 100 μ를 추가 하 고 부드러운 회전 18 rpm에서 2 h에 대 한 RT에서 품 어.
- 조심 스럽게 이차 항 체 솔루션 제거. 워시 샘플 3 1 x 18 rpm에서 부드러운 회전 x PBST (pH 7.4, 각 30 분).
참고: 추적 양의 1 차 항 체는 조직에 의해 오염 될 수 있습니다이 이차 항 체 솔루션을 재사용 하지 마십시오. - 광 통관에 대 한 90% 글리세롤의 1 mL에 샘플을 몰두 하 고 투명 하 게 될 때까지 어둠 속에서 샘플 4 ° C에서 유지 합니다.
참고: 침수 기간 조직 유형 및 크기에 따라 달라 집니다. 일반적으로, 백색 지방이 많은 직물의 2 mm3 큐브 같은 크기 갈색 지방 조직 샘플 요구 더 이상 동안 야간 보육이 필요합니다. - 볼륨 이미지에 대 한 잘 만들 슬라이드에 실리콘 절연체를 준수 합니다. 또는 슬라이드에 투명 테이프의 여러 레이어를 연결 하 고 잘 만들려고 중간에서 잘라 사각형 (그림 2).
참고: 샘플 크기에 맞게 잘 깊이 조정 합니다. 이 프로토콜에서 1 m m 잘 깊이 사용 됩니다. - 신중 하 게 우물에 샘플을 전송 하 고 설치 매체와 함께 작성 ( 재료의 표참조). 표면에 커버 슬립을 봉쇄하 고 점도 매체와 커버 슬립의 모서리 ( 재료의 표참조). 어둠 속에서 RT에서 24 h에 대 한 장착 중간 치료를 하자.
참고: 샘플 및 커버 슬립 사이 공간이 남아는 확인 하십시오. 커버 슬립에서 거품을 하지 마십시오. 샘플에 과도 한 압력을 배치 하지 마십시오.
4. 이미지 수집
- Confocal 현미경/소프트웨어의 20 배 목표 (단계 4.2-4.7 참조) Z-스택 이미지를 취득 합니다.
- 시스템을 시작 합니다. <구성> 탭에서 클릭 하 고 아르곤 레이저와 HeNe 633 레이저 활성화. <취득> 탭을 클릭 하십시오. <표시> 레이저 라인 패널에서 해당 강도 슬라이더까지 이동 488의 레이저 라인 선택 및 633 nm. 처음에, 고 농도 20%-30%로 설정할 수 있습니다. 488/561/633 트리플 dichoric 미러를 선택 합니다. Pmt는 633 nm 레이저의 대 한 488 nm 레이저와 PMT3에 의해 흥분된 방출에 대 한 PMT1를 선택, <활성> 확인란을 클릭 하 여 활성화 합니다. PMT3에 대 한 PMT1 및 650-750nm 500-550 nm 파장 범위를 설정 합니다. 두 번 각 PMT 옆에 있는 색된 사각형을 클릭 하 고 팝업 메뉴에서 색상을 선택 하 여 이미지 표시에 사용할 psudocolor를 선택 합니다.
- <라이브> 샘플 이미지를 확인을 클릭 합니다. Z 위치 노브를 사용 하 여 지역 내에서 XY 관심의 초점의 비행기를 선택 합니다. 레이저 강도, 스마트 이득 및 오프셋 조정 하 여 이미지의 밝기를 조정 합니다. 각 형광 채널에 대 한 <QLUT> (빠른 볼을 테이블) 디스플레이 모드로이 조정을 수행 합니다. <QLUT> 버튼 포화 픽셀 적절 한 밝기 레벨 설정 지원에 파란색으로 표시 됩니다 QLUT 모드 입력을 클릭 합니다. 모조 색상 표시 모드로 돌아갈 <QLUT> 버튼 두 번 클릭 합니다.
참고: 설정의 숫자 값은 각 실험 사이에서 달라질 수 있습니다. - 스캔 하는 동안 Z 위치 조절기를 시계 반대 방향으로 초점의 계획의 볼륨의 한쪽 끝을 이동 하 고 검색 끝 위치를 설정 하려면 <끝> 화살촉에 클릭 돌립니다. 다음 Z 위치 손잡이의 볼륨의 다른 쪽 끝을 표본을 통해 초점의 비행기를 이동 하는 시계 방향으로 바뀌고 클릭 검색 시작 위치를 설정 하려면 <시작> 화살촉.
참고: 다른 샘플 사이 비교를 위해 다른 샘플에 대 한 동일한 Z 볼륨을 정의 합니다. - 3 µ m. 변경 1024 x 1024의 포맷을 선택 하 여 이미지 품질, 100 Hz의 속도 2 선 평균을 z 스텝 크기를 조정 합니다.
- 선택 <시작 > z-스택 이미지 수집을 시작 하.
- 획득된 한 이미지 스택 최대 투영, <과정> 탭을 클릭 하 고 <도구>, <3D 투영>을 선택 하 고 x, 변경 없이 방법 목록에서 <최대> 입력 하는 다음 Y 및 Z. 세트 <임계값> 0. <적용> 클릭 하십시오. Z-볼륨의 최대 강도 2D 이미지 표시 됩니다 (그림 4A)으로 쌓아 것입니다.
5. 혈관과 신경 섬유 네트워크의 분석
-
오픈 소스 소프트웨어를 통해 이미지를 2D의 분석 (참조 테이블의 자료)19
- 소프트웨어에서 스택된 이미지를 엽니다. 모든 선박 구조는 제대로 될 수 있습니다 (그림 4B)를 선택 될 때까지 선박 직경 및 강도 조정 합니다.
- 분석을 실행 을 선택 하 고 소프트웨어의 지침에 따라 데이터를 내보냅니다.
-
허가 된 소프트웨어를 통해 이미지 3D의 분석 (재료의 표 참조)
- 소프트웨어와 함께 이미지의 원시 데이터를 엽니다. 선박 구조 z-볼륨의 각 층에는 제대로 선택 될 때까지 임계값 및 다른 매개 변수를 조정 (자세한 내용은 소프트웨어에서 사용자 안내서를 참조 하십시오) (그림 4C).
- 선택한 세그먼트 문자를 분석 하 고 소프트웨어의 지침에 따라 데이터를 내보냅니다.
결과
Epididymal 백색 지방 조직 (eWAT)의 원심 영역, dorsolumbar 피하 흰색 adipose 조직 (sWAT)의 중간 지역과 interscapular 갈색 지방이 많은 직물 (박쥐)의 중간 영역 수집 했다. 수집 하는이 조직에 대 한 위치는 그림 1에 표시 됩니다.
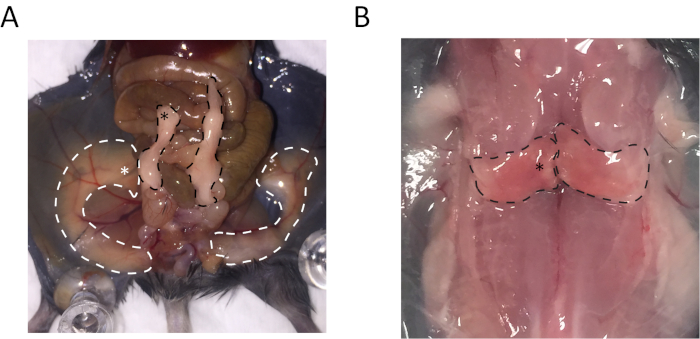
그림 1: 피하 흰색 ...
토론
지방 조직 리 모델링은 직접 연결할 대사 dysregulation 비만 개발1,2중. 신생 및 동 정적인 신경 분포는 모두 동적 개장 과정2,12필수 있습니다. 따라서 신경 섬유 뿐만 아니라 새로운 혈관을 시각화 하는 적용 가능한 접근을 개발은 매우 중요입니다. 이전 방법은 문서화 신생 지방 조직에 보고 되었습니다. 그러나,...
공개
저자 들은 아무 경쟁 금융 관심사 선언 합니다.
감사의 말
이 연구는 건강 (NIH) 부여 R01DK109001 (캔사스)의 국가 학회에 의해 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 AffiniPure Bovine Anti-Goat IgG (H+L) | Jackson ImmunoResearch | 805-545-180 | Lot: 116969 |
| Alexa Fluor 647 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-605-152 | Lot: 121944 |
| Amira 6.0 | Thermo Fisher Scientific | Licensed software | |
| Angio tool | National Institutes of Health | Open source software https://ccrod.cancer.gov/confluence/display/ROB2/Home | |
| Anti-mouse endomucin antibody | R&D research system | AF4666 | Lot: CAAS0115101 |
| Anti-tyrosine hydroxylase antibody | Pel Freez Biologicals | P40101-150 | Lot: aj01215y |
| Cover glasses high performance, D = 0.17 mm | Zeiss | 474030-9020-000 | |
| Cytoseal 280 | Thermo Fisher Scientific | 8311-4 | High-viscosity medium |
| Glycerol | Fisher | G33-500 | |
| Paraformaldehyde,16% | TED PELLA | 170215 | |
| Press-to-Seal Silicone Isolator with Adhesive, eight wells, 9 mm diameter, 1.0 mm deep | INVITROGEN | P24744 | Silicone isolator |
| ProLong Diamond Antifade Mountant | Thermo Fisher Scientific | P36965 | Mounting medium |
| SEA BLOCK Blocking Buffer | Thermo Fisher Scientific | 37527X3 | |
| Sodium azide | Sigma-Aldrich | S2002-100G | |
| Tissue Path IV Tissue Cassettes | Thermo Fisher Scientific | 22-272416 | |
| Triton Χ-100 | Sigma-Aldrich | X100 | Generic term: octoxynol-9 |
| Tube rotator and rotisseries | VWR | 10136-084 | |
| Tween-20 | Sigma-Aldrich | P1379 | Generic term: Polysorbate 20 |
참고문헌
- Rosen, E. D., Spiegelman, B. M. What we talk about when we talk about fat. Cell. 156 (1-2), 20-44 (2014).
- Sun, K., Kusminski, C. M., Scherer, P. E. Adipose tissue remodeling and obesity. Journal of Clinical Investigations. 121 (6), 2094-2101 (2011).
- Sun, K., et al. Endotrophin triggers adipose tissue fibrosis and metabolic dysfunction. Nature Communication. 5, 3485 (2014).
- Zhao, Y., et al. Divergent functions of endotrophin on different cell populations in adipose tissue. American Journal of Physiology-Endocrinology and Metabolism. 311 (6), E952-E963 (2016).
- Zhao, Y., et al. Transient Overexpression of VEGF-A in Adipose Tissue Promotes Energy Expenditure via Activation of the Sympathetic Nervous System. Molecular and Cellular Biology. , (2018).
- Xue, Y., et al. Hypoxia-independent angiogenesis in adipose tissues during cold acclimation. Cell Metabolism. 9 (1), 99-109 (2009).
- Chen, S., et al. LncRNA TDRG1 enhances tumorigenicity in endometrial carcinoma by binding and targeting VEGF-A protein. BBA Molecular Basis of Disease. 1864 (9 Pt B), 3013-3021 (2018).
- Sun, K., et al. Dichotomous effects of VEGF-A on adipose tissue dysfunction. Proceedings of the National Academy of Sciences of the United States of America. 109 (15), 5874-5879 (2012).
- During, M. J., et al. Adipose VEGF Links the White-to-Brown Fat Switch With Environmental, Genetic, and Pharmacological Stimuli in Male Mice. Endocrinology. 156 (6), 2059-2073 (2015).
- Elias, I., et al. Adipose tissue overexpression of vascular endothelial growth factor protects against diet-induced obesity and insulin resistance. Diabetes. 61 (7), 1801-1813 (2012).
- Sung, H. K., et al. Adipose vascular endothelial growth factor regulates metabolic homeostasis through angiogenesis. Cell Metabolism. 17 (1), 61-72 (2013).
- Cao, Y. Angiogenesis and vascular functions in modulation of obesity, adipose metabolism, and insulin sensitivity. Cell Metabolism. 18 (4), 478-489 (2013).
- Sun, K., et al. Brown adipose tissue derived VEGF-A modulates cold tolerance and energy expenditure. Molecular Metabolism. 3 (4), 474-483 (2014).
- Zeng, W., et al. Sympathetic neuro-adipose connections mediate leptin-driven lipolysis. Cell. 163 (1), 84-94 (2015).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), (2012).
- Berry, R., et al. Imaging of adipose tissue. Methods in Enzymology. 537, 47-73 (2014).
- Jiang, H., Ding, X., Cao, Y., Wang, H., Zeng, W. Dense Intra-adipose Sympathetic Arborizations Are Essential for Cold-Induced Beiging of Mouse White Adipose Tissue. Cell Metabolism. 26 (4), 686-692 (2017).
- Chi, J., et al. Three-Dimensional Adipose Tissue Imaging Reveals Regional Variation in Beige Fat Biogenesis and PRDM16-Dependent Sympathetic Neurite Density. Cell Metabolism. 27 (1), 226-236 (2018).
- Zudaire, E., Gambardella, L., Kurcz, C., Vermeren, S. A computational tool for quantitative analysis of vascular networks. PLoS One. 6 (11), e27385 (2011).
- An, Y. A., et al. Angiopoietin-2 in white adipose tissue improves metabolic homeostasis through enhanced angiogenesis. eLife. 6, (2017).
- Chi, J., Crane, A., Wu, Z., Cohen, P. Adipo-Clear: A Tissue Clearing Method for Three-Dimensional Imaging of Adipose Tissue. Journal of Visualized Experiments. (137), (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유