È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Co-macchiatura dei vasi sanguigni e fibre nervose nel tessuto adiposo
In questo articolo
Riepilogo
Formazione del vaso sanguigno di nuovo e lo stimolo simpatico svolgono un ruolo fondamentale nel rimodellamento del tessuto adiposo. Tuttavia, permangono problemi tecnici nella visualizzazione e quantitativamente misurando il tessuto adiposo. Qui presentiamo un protocollo per etichettare correttamente e confrontare quantitativamente le densità dei vasi sanguigni e fibre nervose in diversi tessuti adiposi.
Abstract
Recenti studi hanno evidenziato il ruolo critico dell'angiogenesi e stimolo simpatico nel rimodellamento del tessuto adiposo durante lo sviluppo dell'obesità. Pertanto, lo sviluppo di un metodo semplice ed efficace per documentare i cambiamenti dinamici nel tessuto adiposo è necessario. Qui, descriviamo un metodo immunofluorescente modificato che efficacemente co-macchie vasi sanguigni e fibre nervose in tessuti adiposi. Rispetto ai metodi tradizionali e sviluppati di recente, il nostro approccio è relativamente facile da seguire e più efficiente in etichettatura i vasi sanguigni e fibre nervose con densità più elevate e meno lo sfondo. Inoltre, la maggiore risoluzione delle immagini ulteriormente permette di misurare con precisione la zona dei vasi, la quantità di ramificazione e dalla lunghezza delle fibre di software open source. Come una dimostrazione con il nostro metodo, vi indichiamo che il tessuto adiposo marrone (pipistrello) contiene una maggiore quantità di vasi sanguigni e fibre nervose rispetto al tessuto adiposo bianco (WAT). Inoltre trovare che tra i Wat, WAT sottocutaneo (sWAT) ha più vasi sanguigni e fibre nervose rispetto al WAT epididimaria (eWAT). Il nostro metodo fornisce pertanto uno strumento utile per indagare il rimodellamento del tessuto adiposo.
Introduzione
Tessuto adiposo ha chiave metabolica ed endocrina funzioni1. Si espande o si contrae in risposta a differenti dinamicamente nutriente sottolinea2. Il tessuto attivo processo di rimodellamento è costituito da più percorsi/passaggi fisiologici tra cui l'angiogenesi, la fibrosi e la modellatura di microambienti infiammatoria locale2,3,4. Alcuni stimoli fisici, quali esposizione al freddo e l'esercizio, possono innescare l'attivazione simpatica, che infine conduce alla formazione del vaso sanguigno di nuovo e lo stimolo simpatico in tessuti adiposi5,6. Questi processi di rimodellamento sono collegati strettamente ai risultati metabolici sistemici compreso la sensibilità dell'insulina, il segno distintivo di tipo 2 il diabete2. Così, la visualizzazione di queste mutazioni patologiche è molto importante per comprendere lo stato integro di interi tessuti adiposi.
L'angiogenesi è il processo di formazione del vaso sanguigno di nuovo. Poiché i vasi sanguigni fornire ossigeno, nutrienti, ormoni e fattori di crescita del tessuto, l'angiogenesi è stata considerata un passo fondamentale nel rimodellamento del tessuto adiposo, che è stato documentato con tecniche differenti6,7, 8 , 9 , 10 , 11 , 12 , 13. Tuttavia, persistono dubbi la risoluzione delle immagini, efficienza di immunostaining e metodi per la quantificazione della densità della nave. Rispetto alla formazione del vaso sanguigno di nuovo, lo stimolo nel tessuto adiposo è stato sottovalutato per lungo tempo. Recentemente, Zeng et al.. 14 usato avanzata videomicroscopia microscopia del due-fotone e dimostrato che adipocytes sono circondati da strati di fibre nervose14. Da allora, i ricercatori hanno iniziato ad apprezzare il ruolo fondamentale di stimolo simpatico nel regolamento della fisiologia del tessuto adiposo. È quindi importante sviluppare un approccio facile e pratico per lo stimolo del nervo adiposa documento.
Qui, segnaliamo un metodo ottimizzato per la co-colorazione dei vasi sanguigni e fibre nervose basate sui nostri protocolli precedenti. Con questo metodo, possiamo ottenere immagini chiare dei vasi sanguigni e fibre nervose senza sfondo rumoroso. Inoltre, otteniamo una risoluzione che è sufficientemente elevata per eseguire la misurazione quantitativa della densità con software open source. Utilizzando questo nuovo approccio, possiamo confrontare correttamente le strutture e la densità dei vasi sanguigni e fibre nervose in diversi depositi adiposi.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le procedure contenenti animali soggetti sono state approvate da Animal Welfare Comitato della University of Texas Health Science Center a Houston (numero di protocollo animale: AWC-18-0057).
1. preparazione dei reagenti
- 1x tampone fosfato salino (PBS, pH 7.4): per rendere 1 L di PBS 1X, sciogliere 8 g di NaCl, 0,2 g di KCl, 1,44 g di Na2HPO4e 0,24 g di KH2PO4 in 800 mL di acqua distillata. Regolare il pH a 7,4 e riempire con acqua distillata per ottenere un volume finale di 1 L.
- paraformaldeide 1% in PBS 1X (1% PFA, wt/vol): per ottenere un volume finale di 50 mL, aggiungere mL 3,125 del 16% PFA (Vedi Tabella materiali) a 46,875 mL di PBS 1X. Mescolare bene e conservare a 4 ° C per un uso successivo.
Attenzione: Paraformaldeide è tossico. Tutte le procedure devono essere eseguite sotto cappa aspirante per evitare l'inalazione e contatto con la pelle. - 0,1% polisorbato 20 (Vedi tabella materiali) in PBS 1X (1 x PBST, pH 7.4, vol/vol): per ottenere un volume finale di 50 mL, aggiungere 0,05 mL di polisorbato 20 a 49.95 mL di PBS 1X. Vortice e conservare a 4 ° C per 1 mese.
- 1% octoxynol-9 (Vedi Tabella materiali) in PBS 1X (1x PBS-TX, pH 7.4, vol/vol): per ottenere un volume finale di 10 mL, aggiungere 0,1 mL di octoxynol-9 a 9,9 mL di PBS 1X. Vortice e conservare a 4 ° C per 1 mese.
- 2% di sodio azide (wt/vol): per produrre 10 mL di 2% di sodio azide, aggiungere 10 mL di PBS 1x 0,2 g di sodio azide. Mescolare bene e conservare a 4 ° C per un uso successivo.
- glicerolo 90% in PBS 1X (vol/vol): per ottenere un volume finale di 10 mL, aggiungere 1 mL di PBS 1X a 9 mL di glicerolo. Vortice e conservare a temperatura ambiente (RT) per un uso successivo.
2. animale Ddissection e tessuto adiposo collezione
- Utilizzare topi maschii di C57BL/6J week-old 6. Anestetizzare i topi con isoflurano (4 – 5% per induzione poi 1-2% per la manutenzione). Una volta anestetizzato, eseguire un riflesso di punta-pizzico per determinare la profondità anestetica, a giudicare dalla mancanza di riflessi pedale. Una volta che i topi sono anestetizzati, sezionare i topi seguendo il protocollo come precedentemente pubblicato il15.
- Sterilizzare le forbici smussate e area chirurgica del torace (non c'è bisogno di radersi i capelli). Aprite la cassa tagliando il diaframma e costole lungo la superficie laterale con una dimensione di ~ 2 cm utilizzando forbici smussate. Bloccare la bandiera di petto con pinza emostatica e rifletterlo mettendo il laccio emostatico sopra la testa.
- Praticare una piccola incisione nel ventricolo sinistro (~0.5 cm) con forbici iris. Inserire un ago con punta oliva perfusione attraverso il sito di incisione e bloccare la punta dell'ago sul posto con la pinza emostatica. Inserire l'ago di una siringa da 50 mL contenente soluzione di fissazione del paraformaldeide (1% PFA, pH 7.4).
- Aprire l'atrio di destra taglio sezione con forbici iris come la presa di aspersione. Iniziare la perfusione di dolcemente e continuamente spingendo la siringa ad un tasso di aspersione vicino a 10 mL/min non spingere quando il fluido in uscita alla presa è chiaro di sangue. L'intero processo dovrebbe richiedere ~ 5 min.
Attenzione: Eseguire la procedura sotto cappa aspirante per impedire la tossicità da PFA. - Sezionare il tessuto adiposo bianco e marrone dai topi. Usare le forbici per rompere i campioni di tessuto in piccoli pezzi di pezzi circa 5 x 5 x 3 mm3. Trasferire i piccoli pezzi con la pinzetta sterilizzata nel tessuto incorporamento cassette con etichettatura corretta dei campioni di tessuto sulle cassette.
- Immergere l'incorporamento cassette contenenti i campioni di tessuto nella soluzione di fissazione (1% PFA in 1X PBS, pH 7.4) a 4 ° C per 24 – 48 h.
Nota: La soluzione di fissazione e l'ora di fissazione variano in base alle dimensioni dei tessuti16,17,18. - Lavare i campioni con fresco 1x tampone PBS tre volte (0,5 mL/lavaggio).
Attenzione: Eseguire questo passaggio sotto cappa aspirante. I rifiuti di paraformaldeide devono essere correttamente smaltiti secondo le procedure di smaltimento di rifiuti pericolosi.
Nota: I tessuti possono essere memorizzati in 1X PBS a 4 ° C per un'ulteriore elaborazione.
3. anticorpo incubazione
- Tagliate i campioni di tessuto fisso3 cubetti di circa 2 mm con le forbici sterilizzate. Per la permeabilizzazione, trasferire i campioni in una provetta da 1,5 mL contenente 1 mL di 1 x PBS-TX (1% octoxynol-9 in PBS 1X, Vedi tabella per i materiali, pH 7.4) e ruotare delicatamente le provette a RT per 1 h a 18 giri/min.
- Rimuovere con cautela la 1 x PBS-TX dall'aspirazione. Lavare i campioni 3 x aggiungendo il PBS 1X direttamente nelle provette stesse (nessuna necessità di cambiare i tubi). Durante ogni lavaggio, invertire i tubi più volte.
- Per bloccare, aggiungere 0,5 mL di tampone bloccante (Tabella materiali) ai campioni e incubare a RT per 2 h con leggera rotazione.
- Per preparare 0,4 mL di soluzione di anticorpo primario, diluire 2 μL di anti - endomucin (l'indicatore dei vasi sanguigni) 5 (1: 200) e 2 μL di anti — anticorpi di tirosina idrossilasi (TH, l'indicatore delle fibre nervose) 5 (1: 200, 1 µ g/mL) (tabella materiali per informazioni sugli anticorpi) in 396 μL di tampone bloccante. Vortice e spin giù per recuperare il volume.
- Per la prima incubazione dell'anticorpo, rimuovere con cautela il tampone bloccante dai blocchi del tessuto. Aggiungere 100 μL di soluzione di anticorpo primario preparata al punto 3.4 nelle provette e incubare a 4 ° C durante la notte.
Nota: Il tempo di diluizione e incubazione anticorpo può variare tra diversi anticorpi. Si consiglia di aggiungere alla soluzione di anticorpo a impediscono la crescita microbica 0,02% di sodio azide. Per preparare 0,4 mL di soluzione di anticorpo primario con sodio azide, aggiungere 4 μL di anticorpi (1 μL di ciascuno) e 4 μL di 2% sodio azide in 392 μL di tampone bloccante. - Raccogliere con cura la soluzione di anticorpo primario per il riutilizzo, se lo si desidera. Lavare i campioni con 1 x PBST (pH 7.4, 100 µ l/lavaggio) tre volte (ogni 30 min.) con leggera rotazione a 18 giri/min.
- Per la preparazione della soluzione di anticorpo secondario, diluire 2 μL di fluoroforo (onda lunghezza 495 nm) coniugato IgG di anti-capra (1: 200) e 2 μL di fluoroforo (onda lunghezza 650 nm) coniugato di anti-coniglio IgG (1: 200) (Vedi Tabella materiali) in 396 μL di tampone di bloccaggio. Vortex e centrifugare brevemente per raccogliere tutto il liquido.
Nota: Proteggere i campioni dalla luce durante le procedure seguenti. - Per la seconda incubazione dell'anticorpo, è necessario rimuovere il tampone di lavaggio ultimo da campioni. Aggiungere 100 μL di soluzione di anticorpo secondario nelle provette e incubare a RT per 2 h con delicata rotazione a 18 giri/min.
- Rimuovere con attenzione la soluzione di anticorpo secondario. Lavare i campioni 3 x con 1 x PBST (pH 7.4, 30 min. ciascuno) con leggera rotazione a 18 giri/min.
Nota: Non riutilizzare questa soluzione di anticorpo secondario, come possono essere contaminato con le tracce di anticorpi primari portati dai tessuti. - Per lo sdoganamento ottico, immergere i campioni in 1 mL di glicerolo al 90% e mantenere i campioni a 4 ° C al buio fino a quando non diventano trasparenti.
Nota: La durata di immersione dipende dal tipo di tessuto e le dimensioni. In genere, un cubo di3 2 mm di tessuto adiposo bianco ha bisogno di incubazione durante la notte, mentre gli stessi bisogni di campione del tessuto adiposo di marrone dimensione più lunghi. - Rispettare un isolatore di silicone alla diapositiva per creare un pozzo per l'imaging con volumi. In alternativa, allegare diversi strati di nastro trasparente per le diapositive e tagliato un quadrato di mezzo per creare un pozzo (Figura 2).
Nota: Regolare la profondità di ben per adattarsi alla dimensione del campione. In questo protocollo, una profondità di ben 1 mm viene utilizzata. - Attentamente i campioni di trasferimento nel pozzo e riempirlo con il mezzo di montaggio (Vedi Tabella materiali). Porre un coprivetrino sulla superficie e sigillare gli angoli di vetrini coprioggetto con media viscosità alta (Vedi Tabella materiali). Lasciate che la cura di medie di montaggio per 24 h a RT nel buio.
Nota: Assicurarsi che non vi è spazio tra il campione ed il vetrino coprioggetto. Evitare le bolle sotto il vetrino coprioggetto. Evitare di applicare pressione eccessiva sui campioni.
4. acquisizione immagini
- Acquisire immagini dello stack Z (fare riferimento ai punti 4.2-4.7) con l'obiettivo di 20 x di un microscopio confocale/software.
- Avviare il sistema. Fare clic sulla scheda <Configuration> e attivare il laser ad argon e il laser HeNe 633. Fare clic sulla scheda <Acquire>. Nel pannello di linee laser <Visible>, spostare i cursori di intensità corrispondente a scegliere le linee laser di 488 nm e 633 nm. Inizialmente, l'intensità può essere impostata a 20 – 30%. Selezionare il mirror dichoric triple 488/561/633. Attivare il PMTs cliccando sulle caselle <attivo>, scegliendo PMT1 per l'emissione eccitato di 488 nm laser e PMT3 per quello del laser 633 nm. Impostare l'intervallo di lunghezza d'onda a 500 – 550 nm per PMT1 e 650-750nm per PMT3. Selezionare il psudocolor da utilizzare per la visualizzazione dell'immagine facendo doppio clic il rettangolo colorato accanto a ogni rata e scegliere un colore dal menu a comparsa.
- Fare clic su <Live> per verificare l'immagine dei campioni. Usare la manopola di posizione z per selezionare un piano di messa a fuoco all'interno della regione XY di interesse. Regolare la luminosità delle immagini regolando l'intensità del laser, smart guadagno e offset. Per ogni canale di fluorescenza, eseguire questa regolazione sotto la modalità di visualizzazione di <QLUT> (Quick Look Up Table). Fare clic sul pulsante <QLUT> per accedere alla modalità QLUT, in cui saturi pixel vengono visualizzati in blu per facilitare l'impostazione del livello di luminosità appropriata. Fare clic due volte sul pulsante <QLUT> per tornare alla modalità di visualizzazione pseudocolor.
Nota: I valori numerici dell'impostazione può variare tra ogni esperimento. - Durante la scansione, ruotare la manopola di Z-posizione in senso antiorario per spostare il piano di messa a fuoco ad una estremità del volume di interesse e quindi fare clic sulla punta della freccia <fine> per impostare la posizione di fine scansione. Quindi ruotare la manopola di Z-posizione in senso orario per spostare il piano di messa a fuoco attraverso il campione per l'altra estremità del volume di interesse e quindi fare clic sulla punta della freccia <Begin> per impostare la posizione di inizio scansione.
Nota: Per il confronto tra diversi campioni, definire lo stesso Z-volume per diversi campioni. - Regolare la dimensione z-passo a 3 µm. cambia la qualità di immagine selezionando un formato di 1024 x 1024, velocità di 100 Hz e la linea media di 2.
- Selezionare <Start > per avviare l'acquisizione di immagini di z-stack.
- Per proiezione massima dello stack immagine acquisita, fare clic sulla scheda <processo> e <strumento>, selezionare <proiezione 3D> quindi immettere <massima> nell'elenco metodo senza modifiche a X, Y e Z. Set <Soglia> 0. Fare clic su <applicare>. L'intensità massima del Z-volume sarà sistemata in un'immagine 2D che verrà mostrata (Figura 4A).
5. analisi dei vasi sanguigni e fibre nervose reti
-
Analisi 2D immagini tramite software open source (Vedi tabella materiali)19
- Aprire le immagini impilate nel software. Regolare l'intensità e il diametro del vaso fino a tutte le strutture della nave possono essere correttamente selezionata (Figura 4B).
- Selezionare Esegui analisi ed esportare i dati seguendo la guida del software.
-
Analisi di 3D immagini tramite il software concesso in licenza (Vedi tabella materiali)
- Aprire i dati grezzi delle immagini con il software. Regolare la soglia e altri parametri, fino a quando le strutture della nave in ogni strato del z-volume siano selezionate correttamente (consultare la Guida utente per ulteriori informazioni sul software) (Figura 4).
- Analizzare i caratteri di segmenti selezionati ed esportare i dati seguendo la guida del software.
Access restricted. Please log in or start a trial to view this content.
Risultati
La regione distale del tessuto adiposo bianco dell'epididimo (eWAT), regione mediale di dorsolumbar bianco tessuto adiposo sottocutaneo (sWAT) e mediale regione interscapolare tessuto adiposo marrone (pipistrello) sono stati raccolti. Le posizioni per la raccolta di questi tessuti sono indicate nella Figura 1.
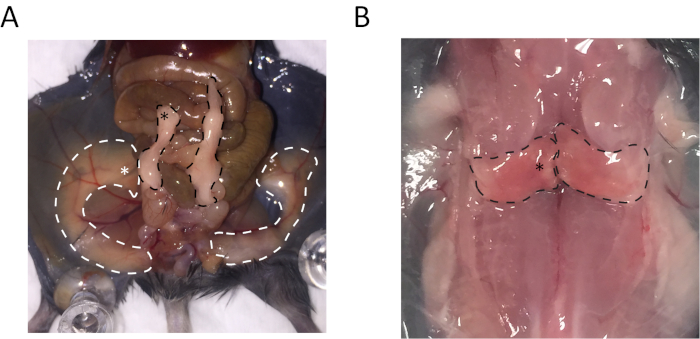
Access restricted. Please log in or start a trial to view this content.
Discussione
Rimodellamento del tessuto adiposo è direttamente collegato al dysregulation metabolico durante lo sviluppo dell'obesità1,2. Angiogenesi e stimolo simpatico sono entrambi essenziali per il rimodellamento dinamico processo2,12. Di conseguenza, lo sviluppo di un approccio applicabile per visualizzare i nuovi vasi sanguigni così come le fibre nervose sono di grande importanza. Metodi precedenti sono stati...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere nessun concorrenti interessi finanziari.
Riconoscimenti
Questo studio è stato sostenuto dall'Istituto nazionale di sovvenzione di salute (NIH) R01DK109001 (a K.S.).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 AffiniPure Bovine Anti-Goat IgG (H+L) | Jackson ImmunoResearch | 805-545-180 | Lot: 116969 |
| Alexa Fluor 647 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-605-152 | Lot: 121944 |
| Amira 6.0 | Thermo Fisher Scientific | Licensed software | |
| Angio tool | National Institutes of Health | Open source software https://ccrod.cancer.gov/confluence/display/ROB2/Home | |
| Anti-mouse endomucin antibody | R&D research system | AF4666 | Lot: CAAS0115101 |
| Anti-tyrosine hydroxylase antibody | Pel Freez Biologicals | P40101-150 | Lot: aj01215y |
| Cover glasses high performance, D = 0.17 mm | Zeiss | 474030-9020-000 | |
| Cytoseal 280 | Thermo Fisher Scientific | 8311-4 | High-viscosity medium |
| Glycerol | Fisher | G33-500 | |
| Paraformaldehyde,16% | TED PELLA | 170215 | |
| Press-to-Seal Silicone Isolator with Adhesive, eight wells, 9 mm diameter, 1.0 mm deep | INVITROGEN | P24744 | Silicone isolator |
| ProLong Diamond Antifade Mountant | Thermo Fisher Scientific | P36965 | Mounting medium |
| SEA BLOCK Blocking Buffer | Thermo Fisher Scientific | 37527X3 | |
| Sodium azide | Sigma-Aldrich | S2002-100G | |
| Tissue Path IV Tissue Cassettes | Thermo Fisher Scientific | 22-272416 | |
| Triton Χ-100 | Sigma-Aldrich | X100 | Generic term: octoxynol-9 |
| Tube rotator and rotisseries | VWR | 10136-084 | |
| Tween-20 | Sigma-Aldrich | P1379 | Generic term: Polysorbate 20 |
Riferimenti
- Rosen, E. D., Spiegelman, B. M. What we talk about when we talk about fat. Cell. 156 (1-2), 20-44 (2014).
- Sun, K., Kusminski, C. M., Scherer, P. E. Adipose tissue remodeling and obesity. Journal of Clinical Investigations. 121 (6), 2094-2101 (2011).
- Sun, K., et al. Endotrophin triggers adipose tissue fibrosis and metabolic dysfunction. Nature Communication. 5, 3485(2014).
- Zhao, Y., et al. Divergent functions of endotrophin on different cell populations in adipose tissue. American Journal of Physiology-Endocrinology and Metabolism. 311 (6), E952-E963 (2016).
- Zhao, Y., et al. Transient Overexpression of VEGF-A in Adipose Tissue Promotes Energy Expenditure via Activation of the Sympathetic Nervous System. Molecular and Cellular Biology. , (2018).
- Xue, Y., et al. Hypoxia-independent angiogenesis in adipose tissues during cold acclimation. Cell Metabolism. 9 (1), 99-109 (2009).
- Chen, S., et al. LncRNA TDRG1 enhances tumorigenicity in endometrial carcinoma by binding and targeting VEGF-A protein. BBA Molecular Basis of Disease. 1864 (9 Pt B), 3013-3021 (2018).
- Sun, K., et al. Dichotomous effects of VEGF-A on adipose tissue dysfunction. Proceedings of the National Academy of Sciences of the United States of America. 109 (15), 5874-5879 (2012).
- During, M. J., et al. Adipose VEGF Links the White-to-Brown Fat Switch With Environmental, Genetic, and Pharmacological Stimuli in Male Mice. Endocrinology. 156 (6), 2059-2073 (2015).
- Elias, I., et al. Adipose tissue overexpression of vascular endothelial growth factor protects against diet-induced obesity and insulin resistance. Diabetes. 61 (7), 1801-1813 (2012).
- Sung, H. K., et al. Adipose vascular endothelial growth factor regulates metabolic homeostasis through angiogenesis. Cell Metabolism. 17 (1), 61-72 (2013).
- Cao, Y. Angiogenesis and vascular functions in modulation of obesity, adipose metabolism, and insulin sensitivity. Cell Metabolism. 18 (4), 478-489 (2013).
- Sun, K., et al. Brown adipose tissue derived VEGF-A modulates cold tolerance and energy expenditure. Molecular Metabolism. 3 (4), 474-483 (2014).
- Zeng, W., et al. Sympathetic neuro-adipose connections mediate leptin-driven lipolysis. Cell. 163 (1), 84-94 (2015).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), (2012).
- Berry, R., et al. Imaging of adipose tissue. Methods in Enzymology. 537, 47-73 (2014).
- Jiang, H., Ding, X., Cao, Y., Wang, H., Zeng, W. Dense Intra-adipose Sympathetic Arborizations Are Essential for Cold-Induced Beiging of Mouse White Adipose Tissue. Cell Metabolism. 26 (4), 686-692 (2017).
- Chi, J., et al. Three-Dimensional Adipose Tissue Imaging Reveals Regional Variation in Beige Fat Biogenesis and PRDM16-Dependent Sympathetic Neurite Density. Cell Metabolism. 27 (1), 226-236 (2018).
- Zudaire, E., Gambardella, L., Kurcz, C., Vermeren, S. A computational tool for quantitative analysis of vascular networks. PLoS One. 6 (11), e27385(2011).
- An, Y. A., et al. Angiopoietin-2 in white adipose tissue improves metabolic homeostasis through enhanced angiogenesis. eLife. 6, (2017).
- Chi, J., Crane, A., Wu, Z., Cohen, P. Adipo-Clear: A Tissue Clearing Method for Three-Dimensional Imaging of Adipose Tissue. Journal of Visualized Experiments. (137), (2018).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon