Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Obtención de vesículas híbridas unilamelares gigantes por electroformación y medición de sus propiedades mecánicas por aspiración de micropipeta
En este artículo
Resumen
El objetivo del protocolo es medir de forma fiable las propiedades mecánicas de membrana de las vesículas gigantes por aspiración de micropipetas.
Resumen
Las vesículas gigantes obtenidas a partir de fosfolípidos y copolímeros pueden explotarse en diferentes aplicaciones: administración controlada y dirigida de fármacos, reconocimiento biomolecular dentro de biosensores para el diagnóstico, membranas funcionales para células artificiales y desarrollo de micro/nanorreactores bioinspirados. En todas estas aplicaciones, la caracterización de sus propiedades de membrana es de importancia fundamental. Entre las técnicas de caracterización existentes, la aspiración de micropipetas, pionera por E. Evans, permite la medición de las propiedades mecánicas de la membrana, como el módulo de compresibilidad de área, el módulo de flexión y la tensión y la tensión de lisis y la tensión y la tensión. Aquí, presentamos todas las metodologías y procedimientos detallados para obtener vesículas gigantes a partir de la película delgada de un lípido o copolímero (o ambos), la fabricación y tratamiento superficial de micropipetas, y el procedimiento de aspiración que conduce a la medición de todos los parámetros mencionados anteriormente.
Introducción
Las vesículas gigantes obtenidas a partir de fosfolípidos (liposomas) han sido ampliamente utilizadas desde la década de 1970 como la membrana celular básica modelo1. A finales de la década de 1990, las morfologías vesiculares obtenidas del autoensamblaje de copolímeros, denominados polímeros en referencia a sus análogos de lípidos2,3,aparecieron rápidamente como una alternativa interesante a los liposomas que poseen una débil estabilidad mecánica y una pobre funcionalidad química modular. Sin embargo, su carácter biomimético celular es bastante limitado en comparación con los liposomas ya que estos últimos están compuestos de fosfolípidos, el componente principal de la membrana celular. Además, su baja permeabilidad a la membrana puede ser un problema en algunas aplicaciones como la administración de fármacos donde se requiere la difusión controlada de especies a través de la membrana. Recientemente, la asociación de fosfolípidos con copolímeros de bloque para diseñar vesículas y membranas híbridas de polímero-lípido sha sido objeto de un número creciente de estudios4,5. La idea principal es diseñar entidades que combinen sinérgicamente los beneficios de cada componente (biofuncionalidad y permeabilidad de las bicapas lipídicas con la estabilidad mecánica y versatilidad química de las membranas poliméricas), que pueden ser explotadas en diferentes aplicaciones: entrega controlada y dirigida de fármacos, reconocimiento biomolecular dentro de biosensores para el diagnóstico, membranas funcionales para células artificiales, desarrollo de micro-nano-reactores bioinspirados.
Hoy en día, diferentes comunidades científicas (bioquímicos, químicos, biofísicos, físico-químicos, biólogos) tienen un creciente interés en el desarrollo de un modelo de membrana celular más avanzado. Aquí, nuestro objetivo es presentar, lo más detalladamente posible, metodologías existentes (electroformación, aspiración de micropipetas) para obtener y caracterizar las propiedades mecánicas de las vesículas gigantes y los recientes modelos de membrana celular "avanzados" que son vesículas gigantes de lípidos de polímero híbrido4,5.
El propósito de estos métodos es obtener una medición fiable de la compresibilidad de la zona y los módulos de flexión de la membrana, así como su tensión de lisis y tensión. Una de las técnicas más comunes existentes para medir la rigidez de flexión de una vesícula gigante es el análisis de fluctuación6,7, basado en la observación directa del microscopio de vídeo; pero esto requiere una gran fluctuación visible de la membrana, y no se obtiene sistemáticamente en membranas gruesas (por ejemplo, polímeros). El módulo de compresibilidad de área se puede determinar experimentalmente utilizando la técnica Langmuir Blodgett, pero más a menudo en una monocapa8. La técnica de aspiración de micropipetas permite la medición de ambos módulos en una bicapa formando vesícula unilamellar gigante (GUV) en un experimento.
El siguiente método es adecuado para todas las moléculas anfifílicas o macromoléculas capaces de formar bicapas y, en consecuencia, vesículas por electroformación. Esto requiere un carácter fluido de la bicapa a la temperatura de la electroformación.
Protocolo
1. Fabricación de micropipetas
NOTA: Aquí son necesarias micropipetas con un diámetro interior de 6 a 12 m y una longitud córnea de alrededor de 3-4 mm. A continuación se describe un método detallado de fabricación de micropipetas.
- Coloque el capilar de vidrio borosilicato en la barra de tracción del tirador y fije uno de los extremos apretando la perilla.
- Deslice cuidadosamente el vidrio a través de los orificios en el lado de la cámara del calentador.
- Apriete la perilla de sujeción en el otro extremo.
- Controle el tamaño de la punta y la longitud del cónico para lograr las especificaciones deseadas. Para ello, optimice parámetros técnicos como la temperatura de calentamiento, la tracción, la velocidad, el retardo y la presión. A continuación se muestra un ejemplo de un programa utilizado:
Calor: 550 oC
Extracción: 10 (Rango de la máquina: 0-255 en unidades arbitrarias)
Velocidad: 30 (Rango: 0-255 en unidades arbitrarias)
Retardo: 1 (Rango: 0-255 en unidades arbitrarias)
Presión: 500 (Rango: 0-999 en unidades arbitrarias) - Haga clic en PULL para ejecutar los eventos definidos por el programa. El capilar se separa en dos micropipetas, cuyas dimensiones deben ajustarse mediante una microforja.
- Inserte el micropipeta en el soporte de pipeta metálica de la microforja (consulte la figura 1). Mediante el uso de 10x objetivo, ajuste la etapa del microscopio y el manipulador de pipetas (movimiento vertical y horizontal) hasta que la punta de la pipeta esté cerca de la superficie del cordón de vidrio.
- Presione el interruptor del pie para derretir el cordón de vidrio. Baje la punta y pónlala en contacto con el cordón de vidrio fundido. El vidrio fundido fluirá en la pipeta por acción capilar. Espere unos segundos hasta que el nivel del vidrio fundido alcance una cierta altura como se muestra en la inserción de la Figura 1.
- Detenga el calentamiento quitando la presión en el interruptor del pie y tire rápidamente de la punta hacia fuera usando el manipulador de pipetas vertical para causar una rotura brusca.
- Repita los pasos 1.7 y 1.8 hasta obtener el diámetro deseado (6 a 12 m).
NOTA: Para mejorar la precisión de la medición del diámetro, durante el último paso, utilice un objetivo de 32x equipado con una retícula.
2. Puntas de pipeta de recubrimiento con BSA (albúmina sérica bovina)
- Preparar una solución de 0,1 M de glucosa que contenga 1% wt. BSA en agua pura.
- Pesar 180 mg de glucosa en polvo, colocar en un tubo cónico de polipropileno de 15 ml y completo con 10 ml de agua pura.
- Añadir 0,1 g de polvo de BSA y agitar suavemente con un mezclador rotatorio de tubo de ensayo hasta la disolución completa (aproximadamente 4 h).
- Tome la solución con una jeringa Luer desechable de 10 ml equipada con una aguja. Una vez llenada, retire la aguja e instale un filtro de celulosa de acetato de 0,22 m. Llene varios tubos de microcentrífuga de polipropileno (1,5 ml) que se utilizarán para sumergir la punta.
- Coloque los capilares verticalmente en soportes. Baje el soporte y sumerja la punta en la solución de glucosa/BSA durante la noche. La solución debe elevarse aproximadamente 1 cm de altura por acción capilar.
- Retire la punta de la pipeta de la solución de glucosa/BSA. Preparar 5 ml de solución de glucosa de 0,1 M (diluir 90 mg de glucosa en polvo en 5 ml de agua pura) y filtrar a través de un filtro de celulosa de acetato de 0,22 m.
- Llene la pipeta con la solución de glucosa utilizando una jeringa de vidrio de 500 ml equipada con un capilar de sílice fusionado flexible. A continuación, retire toda la solución de glucosa succionándola de nuevo y deséchela(Figura 2). Repita este paso varias veces para quitar la BSA sin enlazar.
3. Formación de GUVs y GHuVs por electroformación
NOTA: La electroformación es una técnica de uso común desarrollada por Angelova9. Los procedimientos para obtener una cámara de electroformación, depositar una película de lípidos o polímeros (o ambos para GVAND (Vesículas Unilamellar híbridas gigantes)) e hidratar la película bajo un campo eléctrico alternativo se describen a continuación. También se describe el procedimiento para recoger el GUV obtenido.
- Preparación de soluciones de anfífilo, sacarosa y glucosa
- Preparar una solución de anfifílico a una concentración de 1 mg/ml. Pesar 10 mg de anfífilo y disolver en 10 ml de cloroformo. Conservar la solución en viales sellados para evitar la evaporación del disolvente.
- Preparar una solución en stock de 1,2-dioleoyl-sn-glicero-3-fosfoethanolamine-N-(lissamine rhodamine B sulfonil) (DOPE-Rhod) a 1 mg/ml en cloroformo.
- Añadir 10 l de solución de lípidos fluorescentes a la solución de anfifílico. Conservar las soluciones en viales sellados para evitar la evaporación del disolvente.
- Preparar soluciones de sacarosa y glucosa a una concentración de 0,1 M. Pesar 342 mg y 180 mg de sacarosa y glucosa, respectivamente, y disolverlas en 10 ml de agua pura.
- Preparación de la cámara de electroformación
NOTA: Se pueden utilizar diferentes materiales conductores para fabricar un dispositivo de electroformación (por ejemplo, cables de platino10, agujas inoxidables11). La cámara de electroformación se compone de dos correderas ITO separadas por un espaciador de goma de junta tórica que se ha cortado en un lado para crear una abertura. Las diapositivas están conectadas a un generador de voltaje a través de dos cables eléctricos(Figura 3 y Figura 4A).- Limpie las guías ITO con disolvente orgánico (p. ej., cloroformo). Identifique la superficie conductora utilizando un ohmmeter.
- Coloque los cables eléctricos en el lado conductor con cinta adhesiva.
- Deposición de la solución de anfilia
- Sumerja un capilar en la solución hasta que el nivel aumente por acción capilar y recoja aproximadamente 5 ml de la solución.
- Ponga el capilar en contacto con el centro de la placa de vidrio ITO y extienda suavemente la solución. Espere 10 segundos para asegurar la evaporación completa del disolvente(Figura 4A).
- Repita este procedimiento 3 veces para cada lado.
- Agregue una capa de grasa libre de silicio a ambos lados del espaciador de junta tórica abierto. Ponlo alrededor del área de deposición. Coloque la cara conductora de la segunda placa de vidrio ITO en la parte superior del espaciador.
- Coloque la cámara de electroformación al vacío durante 3 horas para eliminar cualquier rastro de disolvente orgánico.
- Procedimiento de electroformación
- Enchufe los cables eléctricos al generador.
- Utilice los siguientes ajustes para el generador:
Tensión sinusoidal alternativa
Frecuencia: 10 Hz
Amplitud: 2 Vpico a pico
NOTA: Se debe encontrar una frecuencia y una duración de tensión óptimas para cada sistema. - Asegúrese de que la tensión se aplica antes de la inyección de la solución en la cámara.
- Inyectar 1 ml de solución con una jeringa con aguja de diámetro interior de 0,8 mm para llenar la cámara. Elimine las burbujas eventuales.
- Deje que la cámara bajo la tensión/frecuencia aplicada durante 75 min(Figura 4B).
- Cosecha de GUVs
- Apague el generador.
- Usando una jeringa de 1 ml con aguja de diámetro interno de 0,8 mm, succionar una pequeña parte de la solución para producir una burbuja de aire dentro de la cámara. Incline ligeramente la cámara para hacer que esta burbuja se mueva dentro de la cámara. Esto puede ayudar a los GUVs a separarse de la superficie iTO(Figura 4C).
- Succionar toda la solución y transferirla a un tubo de plástico de 1 ml.
- Retire los cables y limpie las correderas ITO con disolventes orgánicos (tolueno y cloroformo).
4. Configuración de micromanipulación
NOTA: El principio de la aspiración de micropipetas es chupar una sola vesícula a través de una micropipette de vidrio aplicando una depresión. La longitud de la lengua dentro de la pipeta se mide en función de la presión de aspiración. El recubrimiento de pipeta con BSA, descrito anteriormente, es esencial para prevenir o minimizar cualquier adhesión entre las membranas vesículas y la pipeta.
El protocolo se ilustra a continuación.
- Conexión de pipeta y depósito lleno de agua
NOTA: El depósito lleno de agua y el micrómetro se fijan a una placa deslizante. Un contador digital con un cabezal de micrómetro permite un desplazamiento vertical del dispositivo en un rango de 0 a 2,5 cm y una precisión de 1 m. El desplazamiento a lo largo de un carril óptico de aluminio es posible hasta 1 metro de longitud. Un tubo de silicio conecta el depósito y el soporte capilar(Figura 5A).- Llene el tanque con agua pura. Conecte una jeringa desechable de 5 ml al soporte de metal capilar a través de tubos de silicona y aspirar para crear un flujo de agua desde el tanque hasta el soporte.
- Toque el tubo ligeramente para eliminar las burbujas de aire. Simultáneamente, levante el tanque de agua para crear una presión positiva. La jeringa de 5 ml sigue conectada al soporte.
- Después de los pasos de recubrimiento y limpieza descritos anteriormente (ver paso 2), llene un capilar con solución de glucosa hasta que se forme una gota al final. Retire el tubo de la jeringa del soporte metálico para crear un ligero flujo de agua en su extremo.
- Gire el capilar al revés y conecte la gota de glucosa con el flujo de agua del soporte. Fije el capilar y el soporte atornillandolos juntos.
- Colocar una pipeta
NOTA: Durante esta operación, el depósito de agua todavía se coloca en el riel de aluminio para mantener una presión positiva.- Tome la etapa de aluminio casera equipada con dos portaobjetos de vidrio (previamente limpiados con etanol) y péguelos con grasa al vacío en cada lado. Instálelo en la etapa del microscopio y forme un menisco entre las dos diapositivas utilizando una jeringa de 1 ml que contenga 0,1 M de glucosa como se muestra en la Figura 5B,C.
- Coloque la pipeta y su soporte en la unidad motora del micromanipulador y apriete la perilla de sujeción.
- Utilice el joystick del panel de control en modo grueso para bajar el micropipeta cerca del menisco de glucosa. Ajuste la posición de la punta al centro del menisco utilizando el modo fino.
- Sostenga la punta sumergida en glucosa durante unos minutos para limpiar su superficie exterior e interna (a medida que se mantenga una presión positiva, el flujo de agua enjuagará la superficie interna de la pipeta para eliminar la BSA no recubierta).
- Guarde la posición de la punta en el teclado del micromanipulador y retírela del menisco.
- Retire el menisco de glucosa y reemplácelo por uno nuevo. Chupa 2 ml de GUVs en sacarosa de 0,1 M usando un micropipeta de 20 ml y colócalo en el menisco de glucosa fresco. Observe en modo DIC (contraste de interferencia diferencial) los GUVs situados en la parte inferior debido a la diferencia de densidad entre la sacarosa (principalmente dentro de los GUVs) y la glucosa (principalmente fuera de los GUVs).
- Cuando las vesículas estén ligeramente desinfladas, vuelva a insertar la pipeta de aspiración y concéntrese en la punta. Ajuste la altura H0 del tanque de agua para el que la presión es casi 0. Para ello, aproveche las pequeñas vesículas o partículas que están presentes naturalmente en la solución y ajuste la altura del tanque de agua hasta que se detenga el movimiento de estas partículas.
- En este punto, rodea el menisco con aceite mineral para evitar la evaporación del agua, ver Figura 5D.
NOTA: La temperatura ambiente debe controlarse entre 20-22 oC mediante el uso de aire acondicionado.
- Experimento de aspiración de micropipetas
- Baje la punta de la pipeta (6-12 m de diámetro) y cree una pequeña aspiración (-1 cm) para aspirar una vesícula (15-30 m de diámetro). La membrana de la vesícula seleccionada debe fluctuar ligeramente y no debe presentar defectos visibles (sin brote ni filamento)(Figura 6).
- Elevar la pipeta a un nivel superior para aislar la vesícula aspirada de las otras vesículas, utilizando el micromanipulador y mantener esta posición durante todo el experimento.
- Pre-estrese la vesícula bajando el tanque lleno de agua a aproximadamente -10 cm, luego disminuya la presión para volver a su valor inicial (-1 cm). Repita este paso varias veces para eliminar el exceso de membrana y pequeños defectos de la membrana.
- A partir de una altura de -0,5 cm definida por la posición del tanque de agua, disminuir lentamente la presión de aspiración con el micrómetro para alcanzar un régimen en el que la membrana fluctúa. A continuación, aumente la presión para visualizar claramente una lengua en la punta con una longitud de proyección significativa (unos pocos micras).
NOTA: La presión aplicada más baja (P0) que permite aspirar la longitud de proyección de membrana más pequeña (L0) definirá el punto de referencia0 (Figura 7A). Todos los puntos de la curva se medirán de acuerdo con esta referencia (L - L-L0 y P -P0). - Aumente la presión de aspiración con el micrómetro de manera escalonada hasta alcanzar 0,5 -0,8 mN/m. En cada paso, espere 5 s y tome una instantánea de la lengua. Este procedimiento a baja tensión permite determinar el módulo de flexión.
- Siga aumentando la presión de aspiración de 0,5 mN/m a la tensión de ruptura ajustando la altura del deslizamiento lleno de agua en el riel (que oscila entre -2 y -50 cm)(Figura 7B-D). A partir de este experimento en régimen de alta tensión, se medirá el módulo de compresibilidad de la zona, la tensión de lisis y la tensión de lisis.
- Estirar alrededor de 15-20 vesículas para adquirir estadísticas significativas. Cada experimento de aspiración de micropipetas tarda entre 7 y 10 minutos. Realizar análisis de imagen utilizando el software LASAF para medir la longitud de proyección de la lengua, el diámetro de las vesículas y el radio del capilar.
- Medición del módulo de flexión, módulo de compresibilidad de área, tensión de lisis y tensión de lisis
- Para acceder a estos parámetros, utilice el formalismo establecido por E. Evans12. Calcular la presión de aspiración aplicada sobre la membrana a partir de la ecuación 1:
• P awg (h-h0) (1)
donde g es la aceleración gravitacional (9,8 ms 2),w es la densidad del agua (a 1 g cmx 3), h es la posición del tanque de agua y h0 es la posición inicial donde la presión es igual a cero. - Calcular la tensión de membrana a partir de la ecuación de Laplace:
 (2)
(2)
donde es la presión de succión en la micropipette, Rp y Rv son el micropipeta y los radios vesículos (fuera de la micropipeta) respectivamente. La tensión de la superficie de la membrana se define como: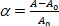 (3)
(3)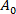 siendo el área de membrana de la vesícula a la presión de aspiración más baja.
siendo el área de membrana de la vesícula a la presión de aspiración más baja. - Calcular a partir del aumento de la longitud de proyección - L de vesícula dentro de la punta capilar de acuerdo con la ecuación 412:
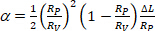 (4)
(4) - Bajo un régimen de muy baja tensión, el suavizado de las ondulaciones de flexión térmica domina la expansión aparente. Trazar ln(o) vs. A valores bajos (típicamente 0,001–0,5 mN.m.113), esto da una línea recta cuya pendiente está vinculada al módulo de flexión, Kb (primer término de la ecuación 5)14:
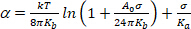 (5)
(5)
NOTA: Bajo altas tensiones (> 0,5mN.m.1),las ondulaciones de membrana se suprimen por completo y el área de la membrana aumenta como resultado de un mayor espaciado entre moléculas. En este régimen, el segundo término de la ecuación 5 domina y da acceso al módulo de compresibilidad de área Ka (Figura 8 y Figura 9).
- Para acceder a estos parámetros, utilice el formalismo establecido por E. Evans12. Calcular la presión de aspiración aplicada sobre la membrana a partir de la ecuación 1:
Resultados
Con el protocolo antes mencionado, hemos estudiado diferentes vesículas unilamellares gigantes sintéticas (GUV), obtenidas a partir de un fosfolípido: 2-oleoyl-1-palmitoyl-sn-glicero-3-fosfocolina (POPC), un copolímero tribloque: Poli(etilenoóxido)-b-Poli(dimethylsiloxane)-b-Poly(etilóxido) (PEO12-b-PDMS43-b-PEO12) sintetizado en un estudio anterior13, y un copolímero dibloque Poly...
Discusión
El recubrimiento del micropipeta es uno de los puntos clave para obtener mediciones fiables. Se debe evitar la adhesión de la vesícula a la micropipeta, y se utiliza comúnmente un recubrimiento en la literatura17,18,19,20,21, con BSA, é-caseína o surfasil. Los detalles del procedimiento de recubrimiento rara vez se mencionan.
L...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a la ANR su apoyo financiero (ANR Sysa).
Materiales
| Name | Company | Catalog Number | Comments |
| Required equipment and materials for micropipette design | |||
| Borosilicate Glass Capillaries | World Precision Instruments | 1B100-4 | external and internal diameter of 1mm and 0.58 mm respectively. |
| Filament installed | Sutter Instrument Co. | FB255B | 2.5mm*2.5mm Box Filament |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | Model P-97 | |
| Microforge | NARISHGE Co. | MF-900 | fitted with two objectives (10x and 32x) |
| Materials for coating pipette tips with BSA | |||
| Bovine Serum Albumin Fraction V (BSA) | Sigma-Aldrich | 10735078001 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| Disposable 10 ml syringe Luer Tip | Codan | 626616 | |
| Disposable 5 ml syringe Luer Tip | Codan | 62.5607 | |
| Disposable acetate cellulose filter | Cluzeau Info Labo | L5003SPA | Pore size: 0.22µm, diameter: 25mm |
| Flexible Fused Silica Capillary Tubing | Polymicro Technologies. | TSP530660 | Inner Diameter 536µm, Outer Diameter 660µm, |
| Glucose | Sigma-Aldrich | G5767 | |
| Syringe 500 µL luer Lock GASTIGHT | Hamilton Syringe Company | 1750 | |
| Test tube rotatory mixer | Labinco | 28210109 | |
| Micromanipulation Set up | |||
| Aluminum Optical Rail, 1000 mm Length, M4 threads, X48 Series | Newport | ||
| Damped Optical Table | Newport | used as support of microscope to prevent external vibrations. | |
| Micromanipulator | Eppendorf | Patchman NP 2 | The module unit (motor unit for X, Y and Z movement) is mounted on the inverted microscope by the way of an adapter. |
| Micrometer | Mitutoyo Corporation | 350-354-10 | Digimatic LCD Micrometer Head 25,4 mm Range 0,001 mm |
| Plexiglass water reservoir (100 ml) | Home made | ||
| TCS SP5 inverted confocal microscope (DMI6000) equipped with a resonant scanner and a water immersion objective (HCX APO L 40x/0.80 WU-V-I). | Leica | ||
| X48 Rail Carrier 80 mm Length,with 1/4-20, 8-32 and 4-40 thread | Newport | ||
| Materials for sucrose and amphiphile solution preparation | |||
| 2-Oleoyl-1-palmitoyl-sn-glycero-3-phosphocholine | Sigma-Aldrich | ||
| Chloroform | VWR | 22711.244 | |
| L-α-Phosphatidylethanolamine-N-(lissamine rhodamine B sulfonyl) | Sigma-Aldrich | 810146C | Rhodamine tagged lipid |
| Sucrose | Sigma-Aldrich | S7903 | |
| Electroformation set up | |||
| 10 µL glass capillary ringcaps | Hirschmann | 9600110 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| H Grease | Apiezon | Apiezon H Grease | Silicon-free grease |
| Indium tin oxide coated glass slides | Sigma-Aldrich | 703184 | |
| Needle | Terumo | AN2138R1 | 0.8 x 38 mm |
| Ohmmeter (Multimeter) | Voltcraft | VC140 | |
| Toluene | VWR | 28676.297 | |
| Voltage generator | Keysight | 33210A |
Referencias
- Bangham, A. D., Standish, M. M., Watkins, J. C. Diffusion of univalent ions across the lamellae of swollen phospholipids. Journal of Molecular Biology. 13 (1), (1965).
- Discher, D. E., Eisenberg, A. Polymer vesicles. Science. 297 (5583), 967-973 (2002).
- Hammer, D., et al. Polymersomes: vesicles from block copolymers. Annals of Biomedical Engineering. 28 (SUPPL. 1), (2000).
- Le Meins, J. F., Schatz, C., Lecommandoux, S., Sandre, O. Hybrid polymer/lipid vesicles: state of the art and future perspectives. Materials Today. 16 (10), 397-402 (2013).
- Schulz, M., Binder, W. H. Mixed Hybrid Lipid/Polymer Vesicles as a Novel Membrane Platform. Macromolecular Rapid Communications. 36, 2031-2041 (2015).
- Schneider, M. B., Jenkins, J. T., Webb, W. W. Thermal fluctuations of large quasi-spherical bimolecular phospholipid vesicles. Journal De Physique. 45 (9), 1457-1472 (1984).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Advances in Colloid and Interface Science. 208, 225-234 (2014).
- Rodríguez-García, R., et al. Polymersomes: smart vesicles of tunable rigidity and permeability. Soft Matter. 7 (4), 1532-1542 (2011).
- Angelova, M. I., Dimitrov, D. S. Liposome electroformation. Faraday Discussions of the Chemical Society. 81, 303-311 (1986).
- Dao, T. P. T., et al. Membrane properties of giant polymer and lipid vesicles obtained by electroformation and pva gel-assisted hydration methods. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 533, 347-353 (2017).
- Pereno, V., et al. Electroformation of Giant Unilamellar Vesicles on Stainless Steel Electrodes. ACS omega. 2 (3), 994-1002 (2017).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Physical Review Letters. 64 (17), 2094-2097 (1990).
- Dao, T. P. T., et al. Modulation of phase separation at the micron scale and nanoscale in giant polymer/lipid hybrid unilamellar vesicles (GHUVs). Soft Matter. 13 (3), 627-637 (2017).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 11 (11), 693-703 (1973).
- Dao, T. P. T., et al. The combination of block copolymers and phospholipids to form giant hybrid unilamellar vesicles (GHUVs) does not systematically lead to "intermediate'' membrane properties. Soft Matter. 14 (31), 6476-6484 (2018).
- Shoemaker, S. D., Kyle Vanderlick, T. Material Studies of Lipid Vesicles in the Lα and Lα-Gel Coexistence Regimes. Biophysical Journal. 84 (2), 998-1009 (2003).
- Longo, M. L., Ly, H. V., Dopico, A. M. . Methods in Membrane Lipids. , 421-437 (2007).
- Chen, D., Santore, M. M. Hybrid copolymer-phospholipid vesicles: phase separation resembling mixed phospholipid lamellae, but with mechanical stability and control. Soft Matter. 11 (13), 2617-2626 (2015).
- Mabrouk, E., et al. Formation and material properties of giant liquid crystal polymersomes. Soft Matter. 5, 1870-1878 (2009).
- Henriksen, J., et al. Universal behavior of membranes with sterols. Biophysical Journal. 90 (5), 1639-1649 (2006).
- Ly, H. V., Block, D. E., Longo, M. L. Interfacial Tension Effect of Ethanol on Lipid Bilayer Rigidity, Stability, and Area/Molecule: A Micropipet Aspiration Approach. Langmuir. 18 (23), 8988-8995 (2002).
- Bermudez, H., Hammer, D. A., Discher, D. E. Effect of Bilayer Thickness on Membrane Bending Rigidity. Langmuir. 20, 540-543 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados