È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Obsistenza di Giant Unilamellar Hybrid Vesicles by Electroformation and Measurement of their Mechanical Properties by Micropipette Aspiration
In questo articolo
Riepilogo
L'obiettivo del protocollo è quello di misurare in modo affidabile le proprietà meccaniche della membrana delle vesciche giganti mediante aspirazione alla micropipetta.
Abstract
Le vesciche giganti ottenute da fosfolipidi e copolimeri possono essere sfruttate in diverse applicazioni: somministrazione controllata e mirata di farmaci, riconoscimento biomolecolare all'interno di biosensori per la diagnosi, membrane funzionali per cellule artificiali e sviluppo di micro/nanoreattori bioispirati. In tutte queste applicazioni, la caratterizzazione delle loro proprietà della membrana è di fondamentale importanza. Tra le tecniche di caratterizzazione esistenti, l'aspirazione di micropipette, introdotta da E. Evans, consente la misurazione delle proprietà meccaniche della membrana come il modulo di comprimibilità dell'area, la piegatura del modulo e lo stress e la deformazione della lisi. Qui, presentiamo tutte le metodologie e le procedure dettagliate per ottenere vesciche giganti dalla pellicola sottile di un lipidico o un polimero (o entrambi), la produzione e il trattamento superficiale delle micropipette, e la procedura di aspirazione che porta alla misurazione di tutti i parametri sopra menzionati.
Introduzione
Le vesciche giganti ottenute dai fosfolipidi (liposomi) sono state ampiamente utilizzate fin dagli anni '70 come modello di membrana cellulare di base1. Alla fine degli anni '90, le morfologie vescicolari ottenute dall'auto-assemblaggio dei polimeri, chiamati polimeriini in riferimento ai loro analoghi lipidi2,3, sono apparse rapidamente come un'interessante alternativa ai liposomi che possiedono una debole stabilità meccanica e scarsa funzionalità chimica modulare. Tuttavia, il loro carattere biomimetico cellulare è piuttosto limitato rispetto ai liposomi poiché questi ultimi sono composti da fosfolipidi, il componente principale della membrana cellulare. Inoltre, la loro bassa permeabilità della membrana può essere un problema in alcune applicazioni come la somministrazione di farmaci in cui è necessaria la diffusione controllata delle specie attraverso la membrana. Recentemente, l'associazione dei fosfolipidi con i copomeri a blocchi per progettare vescicoli polimerici e membrane ibride è stata oggetto di un numero crescente di studi4,5. L'idea principale è quella di progettare entità che combininino in modo sinergico i benefici di ogni componente (bio-funzionalità e permeabilità dei bistrati lipidi con la stabilità meccanica e la versatilità chimica delle membrane polimeriche), che possono essere sfruttate in diverse applicazioni: somministrazione controllata e mirata di farmaci, riconoscimento biomolecolare all'interno di biosensori per la diagnosi, membrane funzionali per le cellule artificiali, sviluppo di microreattori bio-ispirati.
Al giorno d'oggi, diverse comunità scientifiche (biochimici, chimici, biofisici, fisici chimici, biologi) hanno crescente interesse per lo sviluppo di un modello di membrana cellulare più avanzato. Qui, il nostro obiettivo è quello di presentare, nel modo più dettagliato possibile, metodologie esistenti (elettroformazione, aspirazione micropipette) per ottenere e caratterizzare le proprietà meccaniche delle vescicoli giganti e i recenti modelli a membrana cellulare "avanzati" che sono vescicoli giganti lipidi polimeriici ibridi4,5.
Lo scopo di questi metodi è quello di ottenere una misurazione affidabile della comprimibilità dell'area e della moduli di flessione della membrana, nonché il loro stress e tensione di lisi. Una delle tecniche più comuni esistenti per misurare la rigidità di piegatura di una vescica gigante è l'analisi della fluttuazione6,7, basata sull'osservazione diretta del microscopio video; ma questo richiede una grande fluttuazione visibile della membrana, e non è sistematicamente ottenuto su membrane spesse (ad esempio polimero). Il modulo di comprimibilità dell'area può essere determinato sperimentalmente utilizzando la tecnica Langmuir Blodgett, ma il più delle volte su un monostrato8. La tecnica di aspirazione delle micropipette consente la misurazione di entrambi i moduli su un bistrato che formano la vescicle unilamellar gigante (GUV) in un esperimento.
Il seguente metodo è appropriato per tutte le molecole di anfifianco o macromolecole in grado di formare bistrati e, di conseguenza, vescicoli per elettroformazione. Ciò richiede un carattere fluido del biostrato alla temperatura dell'elettroformazione.
Protocollo
1. Fabbricazione di micropipette
NOTA: Qui sono necessarie micropipette con un diametro interno compreso tra 6 e 12 m e una lunghezza di conia intorno ai 3-4 mm. Un metodo dettagliato di produzione micropipetta è descritto di seguito.
- Posizionare il vetro borosilicate capillare nella barra di traino dell'estraente e fissare una delle estremità stringendo la manopola.
- Far scorrere con attenzione il vetro attraverso i fori sul lato della camera riscaldatrice.
- Stringere la manopola di bloccaggio all'altra estremità.
- Controllare le dimensioni della punta e la lunghezza del cono per ottenere le specifiche desiderate. Per questo, ottimizzare i parametri tecnici come la temperatura di riscaldamento, tirare, velocità, ritardo e pressione. Di seguito è riportato un esempio di un programma utilizzato:Here is an example of a program used:
Calore: 550 gradi centigradi
Tirare: 10 (Gamma della macchina: 0-255 in unità arbitrarie)
Velocità: 30 (Intervallo: 0-255 in unità arbitrarie)
Ritardo: 1 (Intervallo: 0-255 in unità arbitrarie)
Pressione: 500 (Intervallo: 0-999 in unità arbitrarie) - Fare clic su PULL per eseguire gli eventi definiti dal programma. Il capillare viene quindi separato in due micropipette, le cui dimensioni devono essere regolate utilizzando una microforforgia.
- Inserire la micropipetta nel porta tubi metallici della microforforgia (vedere la figura 1). Utilizzando l'obiettivo 10x, regolare lo stadio del microscopio e il manipolatore pipette (movimento verticale e orizzontale) fino a quando la punta della pipetta non è vicina alla superficie del tallone di vetro.
- Premere l'interruttore del piede per sciogliere il tallone di vetro. Abbassare la punta e metterla a contatto con il tallone di vetro fuso. Il vetro fuso fluirà nella pipetta per azione capillare. Attendere alcuni secondi fino a quando il livello del vetro fuso raggiunge una certa altezza, come mostrato nell'inserto della Figura 1.
- Interrompere il riscaldamento rimuovendo la pressione sull'interruttore del piede e tirare rapidamente la punta via utilizzando il manipolatore pipetta verticale per causare una rottura brusca.
- Ripetere i passaggi 1.7 e 1.8 fino a ottenere il diametro desiderato (da 6 a 12 m).
NOTA: Per migliorare la precisione della misurazione del diametro, durante l'ultima fase, utilizzare un obiettivo 32x dotato di un reticle.
2. Suggerimenti pipette coating con BSA (albumina del siero bovino)
- Per preparare una soluzione di 0,1 M di glucosio contenente 1% wt. BSA in acqua pura.
- Pesare 180 mg di polvere di glucosio, mettere in un tubo conico di polipropilene 15 mL e completare con 10 mL di acqua pura.
- Aggiungere 0,1 g di polvere di BSA e agitare delicatamente con un miscelatore rotativo della provetta fino alla completa dissoluzione (circa 4 h).
- Prendere la soluzione con una siringa Luer usa e getta da 10 mL dotata di ago. Una volta riempito, rimuovere l'ago e installare un filtro di cellulosa in acetato da 0,22 m. Riempire diversi tubi di microcentrismo di polipropilene (1,5 mL) che verranno utilizzati per immergere la punta.
- Posizionare i capillari verticalmente in supporti. Abbassare il supporto e immergere la punta nella soluzione glucosio/BSA durante la notte. La soluzione dovrebbe salire di circa 1 cm di altezza per azione capillare.
- Rimuovere la punta della pipetta dalla soluzione glucosio/BSA. Preparare 5 mL di 0,1 M di soluzione di glucosio (diluire 90 mg di polvere di glucosio in 5 mL di acqua pura) e filtrare attraverso un filtro di cellulosa in acetato da 0,22 m.
- Riempire la pipetta con la soluzione di glucosio utilizzando una siringa di vetro da 500 o L dotata di un capillare di silice fusa flessibile. Quindi, rimuovere tutta la soluzione di glucosio succhiandoindietrolo e scartarlo (Figura 2). Ripetere questo passaggio più volte per rimuovere il BSA senza limiti.
3. Formazione di GUV e GHUV mediante elettroformazione
NOTA: L'elettroformazione è una tecnica di uso comune sviluppata da Angelova9. Le procedure per ottenere una camera di elettroformazione, depositare una pellicola lipidica o polimerica (o entrambe per GHUV (Giant Hybrid Unilamellar Vesicles)) e idratare la pellicola sotto un campo elettrico alternativo sono descritte di seguito. Viene descritta anche la procedura per raccogliere il GUV ottenuto.
- Preparazione di soluzioni anfifile, saccarosio e glucosio
- Preparare una soluzione anfifila ad una concentrazione di 1 mg/mL. Pesare 10 mg di anfifilo e sciogliere in 10 mL di cloroformio. Mantenere la soluzione in fiale sigillate per evitare l'evaporazione del solvente.
- Preparare una soluzione di riserva di 1,2 dioleoyl-sn-glicero-3-phoseothanolamine-N-(lissamina rhodamine B sulfonyl) (DOPE-Rhod) a 1 mg/mL in cloroformio.
- Aggiungere 10 ll di lipidico fluorescente alla soluzione anfifilo. Conservare le soluzioni in fiale sigillate per evitare l'evaporazione del solvente.
- Preparare soluzioni di saccarosio e glucosio ad una concentrazione di 0,1 M. Pesare 342 mg e 180 mg di saccarosio e glucosio, rispettivamente, e scioglierli in 10 mL di acqua pura.
- Preparazione della camera di elettroformazione
NOTA: Diversi materiali conduttivi possono essere utilizzati per creare un dispositivo di elettroformazione (ad esempio, fili di platino10, aghi inossidabili11). La camera di elettroformazione è composta da due diapositive ITO separate da un distanziale in gomma O-ring che è stato tagliato su un lato per creare un'apertura. I vetrini sono collegati a un generatore di tensione tramite due fili elettrici (Figura 3 e Figura 4A).- Pulire i vetrini ITO con solvente organico (ad esempio, cloroformio). Identificare la superficie conduttiva utilizzando un ohmmeter.
- Fissare i fili elettrici sul lato conduttivo utilizzando nastro adesivo.
- Deposizione di soluzioni anfifili
- Immergere un capillare nella soluzione fino a quando il livello aumenta per azione capillare e raccogliere circa 5 ll della soluzione.
- Mettere il capillare a contatto con il centro della lastra di vetro ITO e stendere delicatamente la soluzione. Attendere 10 secondi per garantire l'evaporazione completa del solvente (Figura 4A).
- Ripetere questa procedura 3 volte per ogni lato.
- Aggiungere uno strato di grasso privo di silicio su entrambi i lati del distanziale O-anello aperto. Mettilo intorno all'area di deposizione. Posizionare la faccia conduttiva della seconda lastra di vetro ITO sulla parte superiore del distanziale.
- Posizionare la camera di elettroformazione sotto vuoto per 3 ore per rimuovere eventuali tracce di solvente organico.
- Procedura di elettroformazione
- Collegare i fili elettrici al generatore.
- Utilizzare le seguenti impostazioni per il generatore:
Tensione sinusoidale alternativa
Frequenza: 10 Hz
Ampiezza: 2 Vpicco-picco
NOTA: per ogni sistema è necessario trovare la frequenza e la durata di tensione ottimali. - Assicurarsi che la tensione venga applicata prima dell'iniezione della soluzione nella camera.
- Iniettare 1 mL di soluzione utilizzando una siringa con ago di diametro interno da 0,8 mm per riempire la camera. Rimuovere eventuali bolle.
- Lasciare che la camera sotto la tensione/frequenza applicata per 75 min (Figura 4B).
- Raccolto DI ILVI
- Spegnere il generatore.
- Utilizzando 1 mL di siringa con ago di diametro interno di 0,8 mm, aspirare una piccola parte della soluzione per produrre una bolla d'aria all'interno della camera. Inclinare leggermente la camera per far muovere questa bolla all'interno della camera. Questo può aiutare i GUV a staccarsi dalla superficie ITO (Figura 4C).
- Succhiare tutta la soluzione e trasferirla in un tubo di plastica da 1 mL.
- Rimuovere i fili e pulire i vetrini ITO con solventi organici (toluene poi cloroformio).
4. Micromanipolazione allestita
NOTA: Il principio dell'aspirazione delle micropipette è quello di succhiare una singola vescica attraverso una micropipetta di vetro applicando una depressione. La lunghezza della lingua all'interno della pipetta viene misurata in funzione della pressione di aspirazione. Il rivestimento pipetta con BSA, descritto in precedenza, è essenziale per prevenire o ridurre al minimo qualsiasi adesione tra le membrane vescicli e la pipetta.
Il protocollo è illustrato di seguito.
- Collegamento del serbatoio con pipetta e pieno d'acqua
NOTA: Il serbatoio pieno d'acqua e il micrometro sono fissati a una piastra scorrevole. Un contatore digitale con testa di micrometro consente uno spostamento verticale del dispositivo in un intervallo compreso tra 0 e 2,5 cm e una precisione di 1 m. Spostamento lungo un rallo ottico in alluminio è possibile fino a 1 metro di lunghezza. Un tubo di silicio collega il serbatoio e il supporto capillare (Figura 5A).- Riempire il serbatoio con acqua pura. Collegare una siringa usa e getta da 5 mL al supporto metallico capillare tramite tubi in silicone e aspirare per creare un flusso d'acqua dal serbatoio al supporto.
- Toccare leggermente il tubo per eliminare le bolle d'aria. Contemporaneamente, sollevare il serbatoio dell'acqua per creare una pressione positiva. La siringa da 5 mL è ancora attaccata al supporto.
- Dopo il rivestimento e le fasi di pulizia descritte in precedenza (vedi passo 2), riempire un capillare con soluzione di glucosio fino a quando una goccia si forma alla fine. Rimuovere il tubo della siringa dal supporto metallico per creare un leggero flusso d'acqua alla sua estremità.
- Ruotare il capillare a testa in giù e collegare la goccia di glucosio con il flusso d'acqua dal supporto. Fissare il capillare e il supporto avvitandoli insieme.
- Posizionare una pipetta
NOTA: Durante questa operazione, il serbatoio dell'acqua è ancora posizionato sulla rotaia di alluminio per mantenere una pressione positiva.- Prendere il palco in alluminio fatto in casa dotato di due vetrini di vetro (precedentemente puliti con etanolo) e incollarli con grasso sottovuoto su ogni lato. Installarlo sullo stadio del microscopio e formare un menisco tra i due vetrini utilizzando una siringa da 1 mL contenente 0,1 M di glucosio, come mostrato nella Figura 5B,C.
- Posizionare la pipetta e il suo supporto sull'unità motore del micromanipolatore e stringere la manopola di bloccaggio.
- Utilizzare il joystick del pannello di controllo in modalità grossolana per abbassare la micropipetta vicino al menisco di glucosio. Regolare la posizione della punta al centro del menisco utilizzando la modalità fine.
- Tenere la punta immersa nel glucosio per alcuni minuti per pulire la sua superficie esterna ed interna (come una pressione positiva viene mantenuta, il flusso d'acqua risciacquare la superficie interna della pipetta per rimuovere LA BSA non rivestita).
- Conservare la posizione della punta sulla tastiera del micromanipolatore e ritirarla dal menisco.
- Rimuovere il menisco di glucosio e sostituirlo con uno nuovo. Succhiare 2 L di GUV in 0,1 M di saccarosio utilizzando una micropipetta da 20 l e metterla nel menisco di glucosio fresco. Osservare in modalità DIC (contrasto di interferenza differenziale) i GUV situati nella parte inferiore a causa della differenza di densità tra saccarosio (principalmente all'interno dei GUV) e glucosio (principalmente al di fuori dei GUV).
- Quando le vesciche sono leggermente sgonfie, reinserire la pipetta di aspirazione e concentrarsi sulla punta. Impostare l'altezza H0 del serbatoio dell'acqua per il quale la pressione è quasi 0. Per questo, approfittare di piccole vesciche o particelle che sono naturalmente presenti in soluzione e regolare l'altezza del serbatoio dell'acqua fino a quando il movimento di queste particelle è fermato.
- A questo punto, circondare il menisco con olio minerale per evitare l'evaporazione dell'acqua, vedere Figura 5D.
NOTA: La temperatura ambiente deve essere controllata tra i 20 e i 22 gradi centigradi utilizzando l'aria condizionata.
- Esperimento di aspirazione micropipette
- Abbassare la punta della pipetta (6-12 m di diametro) e creare una piccola aspirazione (-1 cm) per aspirare una vescica (15-30 m di diametro). La membrana della vescica selezionata dovrebbe leggermente fluttuare e non deve presentare difetti visibili (nessun bocciolo o filamento) (Figura 6).
- Sollevare la pipetta ad un livello superiore per isolare la vescica aspirata dalle altre vesciche, utilizzando il micromanipolatore e mantenere questa posizione durante l'intero esperimento.
- Pre-stressare la vescica abbassando il serbatoio pieno d'acqua a circa -10 cm, quindi diminuire la pressione per tornare al suo valore iniziale (-1 cm). Ripetere questo passaggio più volte per rimuovere l'eccesso di membrana e piccoli difetti dalla membrana.
- Da un'altezza di -0,5 cm definita dalla posizione del serbatoio dell'acqua, diminuire lentamente la pressione di aspirazione con il micrometro per raggiungere un regime in cui la membrana fluttua. Quindi aumentare la pressione per visualizzare chiaramente una lingua nella punta con una lunghezza di proiezione significativa (pochi micron).
NOTA: la pressione applicata più bassa (P0) che consente di aspirare la lunghezza di proiezione della membrana più piccola (L0) definirà il punto di riferimento :0 (Figura 7A). Tutti i punti della curva saranno misurati in base a questo riferimento (zl - L-L0 e P - P-P0). - Aumentare la pressione di aspirazione con il micrometro in modo graduale fino a raggiungere 0,5 -0,8 mN/m. Ad ogni passo, attendere 5 s e scattare un'istantanea della lingua. Questa procedura a bassa tensione consente la determinazione del modulo di piegatura.
- Continuare ad aumentare la pressione di aspirazione da 0,5 mN/m alla tensione di rottura regolando l'altezza dell'acqua riempita scivolando sulla rotaia (che va da -2 a -50 cm) (Figura 7B-D). Da questo esperimento a regime ad alta tensione, saranno misurati il modulo di comprimibilità dell'area, la tensione di lisi e il ceppo di lisi.
- Allungare circa 15-20 vesciche per acquisire statistiche significative. Ogni esperimento di aspirazione delle micropipette dura da 7 a 10 minuti. Eseguire l'analisi delle immagini utilizzando il software LASAF per misurare la lunghezza di proiezione della lingua, il diametro delle vesciche e il raggio del capillare.
- Misurazione del modulo di flessione, modulo di comprimibilità dell'area, tensione del lisi e deformazione di lisi
- Per accedere a questi parametri, utilizzare il formalismo stabilito da E. Evans12. Calcolare la pressione di aspirazione applicata sulla membrana dall'equazione 1:
P (h-h0) (1)
dove g è l'accelerazione gravitazionale (9,8 m ss s 2),w è la densità dell'acqua (1 g dicm) h è la posizione del serbatoio dell'acqua e h0 è la posizione iniziale in cui la pressione è uguale a zero. - Calcolare la tensione della membrana dall'equazione di Laplace:
 (2)
(2)
dove la pressione di aspirazione sulla micropipetta, Rp e Rv sono rispettivamente i raggi micropipette e vescicolari (al di fuori della micropipetta). La deformazione della superficie (z) della membrana è definita come: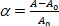 (3)
(3)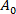 essere l'area della membrana della vescica alla pressione di aspirazione più bassa.
essere l'area della membrana della vescica alla pressione di aspirazione più bassa. - Calcolare il valore di z dall'aumento della lunghezza di proiezione, l of vescicolo all'interno della punta capillare secondo l'equazione 412:
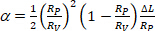 (4)
(4) - Sotto un regime di tensione molto bassa, l'arrotondamento delle ondulazioni termiche di piegatura domina l'apparente espansione. Traccia ln(' ) vs. A valori bassi (in genere 0,001-0,5 mN.m113), si ottiene una linea retta la cui pendenza è collegata al modulo di piegatura, Kb (primo termine dell'equazione 5)14:
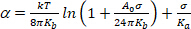 (5)
(5)
NOTA: In alta tensione (> 0,5 mN.m), le ondulazioni a membrana sono completamente soppresse e l'area della membrana aumenta a causa di una maggiore spaziatura tra le molecole. In questo regime, il secondo termine dell'equazione 5 domina e dà accesso al modulo di comprimibilità dell'area Ka (Figura 8 e Figura 9).
- Per accedere a questi parametri, utilizzare il formalismo stabilito da E. Evans12. Calcolare la pressione di aspirazione applicata sulla membrana dall'equazione 1:
Risultati
Con il protocollo di cui sopra, abbiamo studiato diversi vescicoli di unilamellar sintetico sintetico (GUV), ottenuti da un fosfolipidide: 2-oleoyl-1-palmitoyl-sn-glycero-3-phosphocholine (POPC), un copolimero di triblocco: Poly(ethyleneoxide)-b-Poly(dimetilsiloxane) -b-Poly(etileneossido) (PEO12-b-PDMS43-b-PEO12)sintetizzato in uno studio precedente13, e un copolimero disblocco Poly(dime...
Discussione
Il rivestimento della micropipetta è uno dei punti chiave per ottenere misurazioni affidabili. L'adesione della vescica alla micropipetta deve essere prevenuta, e un rivestimento è comunemente usato nella letteratura17,18,19,20,21, con BSA, zo-casein o surfasil. I dettagli della procedura di rivestimento sono raramente menzionati.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori riconoscono con gratitudine l'ANR per il sostegno finanziario (ANR Sysa).
Materiali
| Name | Company | Catalog Number | Comments |
| Required equipment and materials for micropipette design | |||
| Borosilicate Glass Capillaries | World Precision Instruments | 1B100-4 | external and internal diameter of 1mm and 0.58 mm respectively. |
| Filament installed | Sutter Instrument Co. | FB255B | 2.5mm*2.5mm Box Filament |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | Model P-97 | |
| Microforge | NARISHGE Co. | MF-900 | fitted with two objectives (10x and 32x) |
| Materials for coating pipette tips with BSA | |||
| Bovine Serum Albumin Fraction V (BSA) | Sigma-Aldrich | 10735078001 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| Disposable 10 ml syringe Luer Tip | Codan | 626616 | |
| Disposable 5 ml syringe Luer Tip | Codan | 62.5607 | |
| Disposable acetate cellulose filter | Cluzeau Info Labo | L5003SPA | Pore size: 0.22µm, diameter: 25mm |
| Flexible Fused Silica Capillary Tubing | Polymicro Technologies. | TSP530660 | Inner Diameter 536µm, Outer Diameter 660µm, |
| Glucose | Sigma-Aldrich | G5767 | |
| Syringe 500 µL luer Lock GASTIGHT | Hamilton Syringe Company | 1750 | |
| Test tube rotatory mixer | Labinco | 28210109 | |
| Micromanipulation Set up | |||
| Aluminum Optical Rail, 1000 mm Length, M4 threads, X48 Series | Newport | ||
| Damped Optical Table | Newport | used as support of microscope to prevent external vibrations. | |
| Micromanipulator | Eppendorf | Patchman NP 2 | The module unit (motor unit for X, Y and Z movement) is mounted on the inverted microscope by the way of an adapter. |
| Micrometer | Mitutoyo Corporation | 350-354-10 | Digimatic LCD Micrometer Head 25,4 mm Range 0,001 mm |
| Plexiglass water reservoir (100 ml) | Home made | ||
| TCS SP5 inverted confocal microscope (DMI6000) equipped with a resonant scanner and a water immersion objective (HCX APO L 40x/0.80 WU-V-I). | Leica | ||
| X48 Rail Carrier 80 mm Length,with 1/4-20, 8-32 and 4-40 thread | Newport | ||
| Materials for sucrose and amphiphile solution preparation | |||
| 2-Oleoyl-1-palmitoyl-sn-glycero-3-phosphocholine | Sigma-Aldrich | ||
| Chloroform | VWR | 22711.244 | |
| L-α-Phosphatidylethanolamine-N-(lissamine rhodamine B sulfonyl) | Sigma-Aldrich | 810146C | Rhodamine tagged lipid |
| Sucrose | Sigma-Aldrich | S7903 | |
| Electroformation set up | |||
| 10 µL glass capillary ringcaps | Hirschmann | 9600110 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| H Grease | Apiezon | Apiezon H Grease | Silicon-free grease |
| Indium tin oxide coated glass slides | Sigma-Aldrich | 703184 | |
| Needle | Terumo | AN2138R1 | 0.8 x 38 mm |
| Ohmmeter (Multimeter) | Voltcraft | VC140 | |
| Toluene | VWR | 28676.297 | |
| Voltage generator | Keysight | 33210A |
Riferimenti
- Bangham, A. D., Standish, M. M., Watkins, J. C. Diffusion of univalent ions across the lamellae of swollen phospholipids. Journal of Molecular Biology. 13 (1), (1965).
- Discher, D. E., Eisenberg, A. Polymer vesicles. Science. 297 (5583), 967-973 (2002).
- Hammer, D., et al. Polymersomes: vesicles from block copolymers. Annals of Biomedical Engineering. 28 (SUPPL. 1), (2000).
- Le Meins, J. F., Schatz, C., Lecommandoux, S., Sandre, O. Hybrid polymer/lipid vesicles: state of the art and future perspectives. Materials Today. 16 (10), 397-402 (2013).
- Schulz, M., Binder, W. H. Mixed Hybrid Lipid/Polymer Vesicles as a Novel Membrane Platform. Macromolecular Rapid Communications. 36, 2031-2041 (2015).
- Schneider, M. B., Jenkins, J. T., Webb, W. W. Thermal fluctuations of large quasi-spherical bimolecular phospholipid vesicles. Journal De Physique. 45 (9), 1457-1472 (1984).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Advances in Colloid and Interface Science. 208, 225-234 (2014).
- Rodríguez-García, R., et al. Polymersomes: smart vesicles of tunable rigidity and permeability. Soft Matter. 7 (4), 1532-1542 (2011).
- Angelova, M. I., Dimitrov, D. S. Liposome electroformation. Faraday Discussions of the Chemical Society. 81, 303-311 (1986).
- Dao, T. P. T., et al. Membrane properties of giant polymer and lipid vesicles obtained by electroformation and pva gel-assisted hydration methods. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 533, 347-353 (2017).
- Pereno, V., et al. Electroformation of Giant Unilamellar Vesicles on Stainless Steel Electrodes. ACS omega. 2 (3), 994-1002 (2017).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Physical Review Letters. 64 (17), 2094-2097 (1990).
- Dao, T. P. T., et al. Modulation of phase separation at the micron scale and nanoscale in giant polymer/lipid hybrid unilamellar vesicles (GHUVs). Soft Matter. 13 (3), 627-637 (2017).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 11 (11), 693-703 (1973).
- Dao, T. P. T., et al. The combination of block copolymers and phospholipids to form giant hybrid unilamellar vesicles (GHUVs) does not systematically lead to "intermediate'' membrane properties. Soft Matter. 14 (31), 6476-6484 (2018).
- Shoemaker, S. D., Kyle Vanderlick, T. Material Studies of Lipid Vesicles in the Lα and Lα-Gel Coexistence Regimes. Biophysical Journal. 84 (2), 998-1009 (2003).
- Longo, M. L., Ly, H. V., Dopico, A. M. . Methods in Membrane Lipids. , 421-437 (2007).
- Chen, D., Santore, M. M. Hybrid copolymer-phospholipid vesicles: phase separation resembling mixed phospholipid lamellae, but with mechanical stability and control. Soft Matter. 11 (13), 2617-2626 (2015).
- Mabrouk, E., et al. Formation and material properties of giant liquid crystal polymersomes. Soft Matter. 5, 1870-1878 (2009).
- Henriksen, J., et al. Universal behavior of membranes with sterols. Biophysical Journal. 90 (5), 1639-1649 (2006).
- Ly, H. V., Block, D. E., Longo, M. L. Interfacial Tension Effect of Ethanol on Lipid Bilayer Rigidity, Stability, and Area/Molecule: A Micropipet Aspiration Approach. Langmuir. 18 (23), 8988-8995 (2002).
- Bermudez, H., Hammer, D. A., Discher, D. E. Effect of Bilayer Thickness on Membrane Bending Rigidity. Langmuir. 20, 540-543 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon