Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Dev Unilamellar Hibrid Veziküllerin Elektroformasyon ile Obtention ve Mikropipet Aspirasyon ile Mekanik Özelliklerinin Ölçümü
Bu Makalede
Özet
Protokolün amacı, dev veziküllerin membran mekanik özelliklerini mikropipet aspirasyonu ile güvenilir bir şekilde ölçmektir.
Özet
Fosfolipidlerden ve kopolimerlerden elde edilen dev veziküller farklı uygulamalarda kullanılabilir: kontrollü ve hedefli ilaç dağıtımı, tanı için biyosensörler içinde biyomoleküler tanıma, yapay hücreler için fonksiyonel membranlar ve biyoilham mikro/nano-reaktörlerin geliştirilmesi. Tüm bu uygulamalarda membran özelliklerinin karakterizasyonu temel önemtaşımaktadır. Mevcut karakterizasyon teknikleri arasında, E. Evans'ın öncülük ettiği mikropipet aspirasyonu, membranın alan sıkıştırılabilirlik modülü, bükme modülü ve lysis gerilimi ve gerilme gibi mekanik özelliklerinin ölçülmesine olanak sağlar. Burada, bir lipid veya kopolimerin ince filmden (veya her ikisinden) dev veziküller elde etmek için tüm metodolojileri ve ayrıntılı prosedürleri, mikropipetlerin üretim ve yüzey işlemesini ve daha önce bahsedilen tüm parametrelerin ölçülmelerine yol açan aspirasyon prosedürünü saklı atıyoruz.
Giriş
Fosfolipidlerden elde edilen dev veziküller (lipozomlar) 1970'lerden beri temel hücre zarı modeli1olarak yaygın olarak kullanılmaktadır. 1990'ların sonlarında, kopolimerlerin kendi kendine biraraya gelen vesiküler morfolojileri, lipid analoglarına referans olarak polimeromlar olarak adlandırılan2,3, hızla zayıf mekanik stabilite ve zayıf modüler kimyasal işlevselliğe sahip lipozomlara ilginç bir alternatif olarak ortaya çıkmıştır. Ancak, ikinci fosfolipidler oluşur beri onların hücre biyomimetik karakteri oldukça lipozomlar ile karşılaştırıldığında sınırlıdır, hücre zarının ana bileşeni. Ayrıca, düşük membran geçirgenliği, zar dan türlerin kontrollü difüzyonunun gerekli olduğu ilaç dağıtımı gibi bazı uygulamalarda sorun olabilir. Son zamanlarda, blok kopolimerler ile fosfolipidlerin ilişki melez polimer-lipid veziküller ve membranlar tasarımı çalışmaların artan sayıda konu olmuştur4,5. Ana fikir sinerjik her bileşenin yararları birleştirmek varlıklar tasarlamaktır (biyo-işlevsellik ve polimer membranların mekanik istikrar ve kimyasal çok yönlülük ile lipid bilayers geçirgenlik), hangi farklı uygulamalarda istismar edilebilir: kontrollü ve hedefli ilaç teslimatı, tanı için biyosensörler içinde biyomoleküler tanıma, yapay hücreler için fonksiyonel membranlar, biyo-ilham mikro-nano-reaktörlerin geliştirilmesi.
Günümüzde, farklı bilimsel topluluklar (biyokimyacılar, kimyagerler, biyofizikçiler, fiziko-kimyagerler, biyologlar) daha gelişmiş bir hücre zarı modelinin geliştirilmesine olan ilgiartmaktadır. Burada, amacımız, mümkün olduğunca ayrıntılı olarak, mevcut metodolojileri (elektroformasyon, mikropipette aspirasyon) elde etmek ve dev veziküllerin mekanik özellikleri ve hibrid polimer lipid dev veziküller olan son "gelişmiş" hücre zarı modelleri karakterizesunmaktır 4,5.
Bu yöntemlerin amacı, membranın alan sıkıştırılabilirliğinin ve bükülme modulisinin güvenilir bir şekilde ölçülmesinin yanı sıra, membranın lysis gerilimi ve gerilmelerinin güvenilir bir şekilde ölçülmesini sağlamaktır. Dev bir vezikül bükme sertliğini ölçmek için mevcut en yaygın tekniklerden biri dalgalanma analizi6,7, doğrudan video mikroskop gözlemdayalı; ancak bu büyük görünür membran dalgalanması gerektirir ve kalın membranlar (örn. polimeromlar) üzerinde sistematik olarak elde edilmez. Alan sıkıştırılabilirlik modülü deneysel Langmuir Blodgett tekniği kullanılarak belirlenebilir ama en sık bir monolayer8. Mikropipet aspirasyon tekniği, bir deneyde dev unilamellar vezikül (GUV) oluşturan iki katmanlı bir modüler in ölçülmesine olanak sağlar.
Aşağıdaki yöntem, iki katmanlı ve dolayısıyla elektroformasyon ile veziküller oluşturabilen tüm amfilik moleküller veya makromoleküller için uygundur. Bu elektroformasyon sıcaklığında iki katmanlı bir sıvı karakteri gerektirir.
Protokol
1. Mikropipetlerin imalatı
NOT: Burada iç çapı 6 ila 12 mm arasında değişen ve 3-4 mm civarında konik uzunluğu olan mikropipetler gereklidir. Mikropipet in iã§in ayrıntılı bir yöntem aşağıda veå tirilere tanımlanmıŠtır.
- Borosilikat cam kılcal yerleştirin çekmece çekmecesine ve bir ucunu knob sıkarak düzeltmek.
- Bardağı ısıtıcı haznesinin kenarındaki deliklerden dikkatlice kaydırın.
- Diğer uçtaki kelepçeucunu sıkın.
- İstenilen özelliklere ulaşmak için ucun boyutunu ve konik uzunluğunu kontrol edin. Bunun için, ısıtma sıcaklığı, çekme, hız, gecikme ve basınç gibi teknik parametreleri optimize edin. Burada kullanılan bir program örneği:
Isı: 550 °C
Çekme: 10 (Makinenin menzili: 0-255 rasgele birimler)
Hız: 30 (Aralık: 0-255 rasgele birimler)
Gecikme: 1 (Aralık: 0-255 rasgele birimler)
Basınç: 500 (Menzil: 0-999 rasgele birimler) - Program tarafından tanımlanan olayları yürütmek için PULL'yi tıklatın. Kılcal damar daha sonra boyutları bir mikroforge kullanılarak ayarlanması gereken iki mikropipete ayrılır.
- Mikropipeti mikroforgenin metal pipet tutucuya yerleştirin (bkz. Şekil 1). 10x hedefi kullanarak, pipet ucu cam boncuk yüzeyine yakın olana kadar mikroskop aşamasını ve pipet manipülatörü (dikey ve yatay hareket) ayarlayın.
- Cam boncuk eritmek için ayak anahtarı basın. Ucu düşürün ve erimiş cam boncuk ile temas koydu. Erimiş cam kılcal eylem ile pipet içine akar. Erimiş camın seviyesi Şekil 1'inekinde gösterildiği gibi belirli bir yüksekliğe ulaşana kadar birkaç saniye bekleyin.
- Ayak anahtarındaki basıncı kaldırarak ısıtmayı durdurun ve keskin bir kırılmaya neden olmak için dikey pipet manipülatörü kullanarak ucu hızla çekin.
- İstenilen çap elde edilene kadar (6-12 μm) 1,7 ve 1,8 adımlarını tekrarlayın.
NOT: Çap ölçümünün doğruluğunu artırmak için, son adımda, bir dürbünle donatılmış 32x nesnel kullanın.
2. BSA (sığır serum albumin) ile kaplama pipet uçları
- Saf suda %1 wt. BSA içeren 0,1 M glikoz çözeltisi hazırlamak.
- Tartmak 180 glukoz tozu mg, bir yer 15 mL polipropilen konik tüp ve saf su 10 mL ile tamamlandı.
- 0,1 g BSA tozu ekleyin ve test tüpü döner mikseri kullanarak iyice çırpın, tamamen çözünene kadar (yaklaşık 4 saat).
- İğne ile donatılmış 10 mL tek kullanımlık Luer şırınga ile çözeltiyi alın. Doldurulduğunda iğneyi çıkarın ve 0,22 m asetat selüloz filtresi tökezleyin. Ucu batırmak için kullanılacak birkaç polipropilen mikro santrifüj tüpü (1,5 mL) doldurun.
- Kılcal damarları dikey olarak tutuculara yerleştirin. Tutucuyu indirin ve ucu bir gecede glikoz/BSA çözeltisine batırın. Çözelti kılcal etki ile yaklaşık 1 cm yüksekliğinde yükselmelidir.
- Pipet ucunu glikoz/BSA çözeltisinden çıkarın. 5 mL 0,1 M glukoz çözeltisi (5 mL saf suda 90 mg glikoz tozunu seyreltin) hazırlayın ve 0,22 m asetat selüloz filtreden filtre uygulayın.
- Esnek erimiş silika kılcal damar ile donatılmış 500 μL cam şırınga kullanarak pipeti glikoz çözeltisi ile doldurun. Daha sonra, geri emerek tüm glikoz çözeltisi çıkarın ve atın (Şekil 2). Sınırsız BSA'yı kaldırmak için bu adımı birkaç kez tekrarlayın.
3. Elektroformasyon ile GUVs ve GHUV oluşumu
NOT: Elektroformasyon Angelova9tarafından geliştirilen yaygın olarak kullanılan bir tekniktir. Bir elektroformasyon odası elde etmek, bir lipid veya polimer film yatırmak (veya Her ikisi de GHUVs (Dev Hibrid Unilamellar Veziküller) ve alternatif bir elektrik alanı altında film nemlendirmek için prosedürler aşağıdaki açıklanmıştır. Elde edilen GUV toplamak için prosedür de açıklanmıştır.
- Amphiphile, sakaroz ve glikoz çözeltisi hazırlama
- 1 mg/mL konsantrasyonda bir amphipile çözeltisi hazırlayın. Tartmak 10 mg amphiphile ve kloroform 10 mL çözünür. Çözücü buharlaşmasını önlemek için çözeltiyi mühürlü şişelerde saklayın.
- Kloroformda 1 mg/mL'de1,2-dioleoyl-sn -glycero-3-fosfoetanolamine-N-(lissamine rodamin B sülfonil) (DOPE-Rhod) bir stok çözeltisi hazırlayın.
- Amphipile çözeltisine 10 μL floresan lipid çözeltisi ekleyin. Çözücü buharlaşmasını önlemek için çözeltileri mühürlü şişelerde saklayın.
- Sakaroz ve glikoz çözeltilerini sırasıyla 0,1 M. Weigh 342 mg ve 180 mg sakaroz ve glikoz konsantrasyonunda hazırlayın ve 10 mL saf suda çözün.
- Elektroformasyon odasının hazırlanması
NOT: Elektroformasyon cihazı yapmak için farklı iletken malzemeler kullanılabilir (örn. platin teller10, paslanmaz iğneler11). Elektroformasyon odası, diyafram oluşturmak için bir tarafta kesilmiş bir O-halka kauçuk spacer ile ayrılmış iki ITO slayttan oluşur. Slaytlar iki elektrik teli(Şekil 3 ve Şekil 4A)ile bir gerilim jeneratörüne bağlanır.- ITO slaytlarını organik çözücü (örn. kloroform) ile temizleyin. Bir ohmmetre kullanarak iletken yüzeyi tanımlayın.
- Elektrik kablolarını iletken tarafa yapışkan bant kullanarak takın.
- Amphipile çözeltisi birikimi
- Bir kılcal damarı, kılcal etki ile seviyesi artana kadar çözeltiye batırın ve çözeltinin yaklaşık 5 μL'sini toplayın.
- Kapilleri İTO cam plakanın merkeziyle temas altına alayın ve çözeltiyi yavaşça yayın. Tam çözücü buharlaşmasını sağlamak için 10 saniye bekleyin(Şekil 4A).
- Her iki taraf için bu yordamı 3 kez tekrarlayın.
- Açılan O-ring spacer her iki tarafında silikonsuz gres bir tabaka ekleyin. İfade alanının etrafına koy. İkinci ITO cam plakanın iletken yüzünü boşluk tabakasının üstüne yerleştirin.
- Organik çözücü izlerini gidermek için elektroformasyon odasını 3 saat vakum altına yerleştirin.
- Elektroformasyon prosedürü
- Elektrik kablolarını jeneratöre bağla.
- Jeneratör için aşağıdaki ayarları kullanın:
Alternatif sinüzoidal gerginlik
Frekans: 10 Hz
Genlik: 2 Vtepeden tırnak
NOT: Her sistem için optimum gerilim frekansı ve süresi bulunmalıdır. - Çözeltinin hazneye enjeksiyonundan önce gerilimin uygulandığından emin olun.
- Hazneyi doldurmak için 0,8 mm iç çaplı iğneile şırınga kullanarak 1 mL çözelti enjekte edin. Nihai kabarcıklar kaldırın.
- 75 dk(Şekil 4B)için uygulanan gerilim/frekans altındaki hazneyi bırakın.
- GUVs hasat
- Jeneratörü kapatın.
- 0,8 mm iç çaplı iğne ile 1 mL şırınga kullanarak, oda içinde bir hava kabarcığı üretmek için çözeltinin küçük bir kısmını emmek. Bu kabarcık oda içinde hareket yapmak için biraz oda yatırın. Bu, GUV'ların ITO yüzeyinden ayrılmasına yardımcı olabilir (Şekil 4C).
- Tüm çözeltiyi emerek 1 mL plastik bir tüpe aktarın.
- Telleri çıkarın ve ITO slaytlarını organik çözücülerle (toluen sonra kloroform) temizleyin.
4. Mikromanipülasyon kurmak
NOT: Mikropipet aspirasyonunun prensibi, bir depresyon uygulayarak cam mikropipet ile tek bir vezikül emmektir. Pipet içindeki dilin uzunluğu emme basıncının bir fonksiyonu olarak ölçülür. BSA ile pipet kaplama, daha önce açıklanan, önlemek veya vezikül membranlar ve pipet arasındaki herhangi bir yapışmayı en aza indirmek için gereklidir.
Protokol aşağıda gösterilmiştir.
- Pipet ve su dolu rezervuar bağlantısı
NOT: Su dolu tank ve mikrometre sürgülü bir plakaya sabitlenir. Mikrometre kafalı dijital sayaç, cihazın 0 ila 2,5 cm aralığında dikey olarak yer değiştirmesine ve 1 μm. doğrulukla alüminyum optik ray boyunca 1 metreye kadar uzunluğa kadar yer değiştirmesine olanak tanır. Silikon boru, rezervuarı ve kılcal tutucuyu bağlar (Şekil 5A).- Tankı saf suyla doldurun. Tek kullanımlık 5 mL şırıngasilikon boru ve aspire ile kapiller metal tutucuya bağlayarak tanktan tutucuya bir su akışı oluşturun.
- Hava kabarcıklarını ortadan kaldırmak için tüpü hafifçe dokunun. Aynı anda, pozitif bir basınç oluşturmak için su tankı yükseltmek. 5 mL şırınga hala tutucuya bağlıdır.
- Daha önce açıklanan kaplama ve temizleme adımlarını (bkz. adım 2), sonunda bir damla oluşana kadar bir kılcal damarı glikoz çözeltisi ile doldurun. Sonunda hafif bir su akışı oluşturmak için metal tutucudan şırınga boruçıkarın.
- Kılcal damarı ters çevirin ve glikoz damlasını tutucudan gelen su akışına bağlayın. Kılcal damarı ve tutucuyu birbirine vidalayarak düzeltin.
- Bir pipet konumlandırın
NOT: Bu işlem sırasında, su tankı hala pozitif bir basınç korumak için alüminyum demiryolu üzerinde konumlandırılmış.- İki cam slayt (daha önce etanol ile temizlenmiş) ile donatılmış ev yapımı alüminyum sahne alın ve her iki tarafta vakum gres ile yapıştırın. Mikroskop aşamasına töforve şekil 5B,C'degösterildiği gibi 0,1 M glukoz içeren 1 mL şırınga kullanarak iki slayt arasında menisküs oluşturun.
- Pipeti ve tutucuyu mikromanipülatörün motor ünitesine yerleştirin ve sıkma bileni sıkın.
- Glikoz menisküs yakınındaki mikropipeti düşürmek için kaba modda kontrol paneli joystick kullanın. İnce modu kullanarak ucun konumunu menisküs ortasına ayarlayın.
- Dış ve iç yüzeyini temizlemek için birkaç dakika glukoza daldırılmış ucu tutun (pozitif basınç korununca, su akışı kaplanmamış BSA'yı çıkarmak için pipetin iç yüzeyini durular).
- Ucun konumunu mikromanipülatör klavyede saklayın ve menisküsten çekin.
- Glikoz menisküs çıkarın ve taze bir ile değiştirin. 20 μL mikropipet kullanarak 0,1 M sakarozda 2 μL GUVs suck ve taze glikoz menisküs koyun. Dic modunda (diferansiyel girişim kontrastı) sakaroz (özellikle GUVs içinde) ve glikoz (özellikle GUVs dışında) arasındaki yoğunluk farkı nedeniyle alt kısmında bulunan GUVs gözlemleyin.
- Veziküller hafifçe söndüğünde, emme pipetini yeniden takın ve uca odaklanın. Basınç neredeyse 0 olan su tankının H0 yüksekliğini ayarlayın. Bunun için, çözeltide doğal olarak bulunan küçük veziküllerden veya parçacıklardan yararlanın ve bu parçacıkların hareketi durdurulana kadar su tankı yüksekliğini ayarlayın.
- Bu noktada, su buharlaşmasını önlemek için mineral yağ ile menisküs çevreleyen, Şekil 5Dbakın.
NOT: Oda sıcaklığı klima kullanılarak 20-22 °C arasında kontrol edilmelidir.
- Mikropipet aspirasyon deneyi
- Pipet ucunu (6-12 μm çapında) düşürüp vezikül (15-30 μm çapında) aspire etmek için küçük bir emme (-1 cm) oluşturun. Seçilen vezikül membranı hafifçe dalgalanmalı olmalı ve görünür bir kusur (tomurcuk veya filament yok) olmamalıdır(Şekil 6).
- Mikromanipülörü kullanarak aspire vezikülleri diğer veziküllerden izole etmek için pipeti daha yüksek bir seviyeye yükseltin ve tüm deney boyunca bu konumu koruyun.
- Su dolu tankı yaklaşık -10 cm'ye indirerek vezikülü önceden geri çekin, ardından ilk değerine (-1 cm) dönmek için basıncı düşürün. Membran fazlalığı ve membrandan küçük kusurları gidermek için bu adımı birkaç kez tekrarlayın.
- Su tankının konumuile tanımlanan -0,5 cm yükseklikten, membranın dalgalandığı bir rejime ulaşmak için mikrometre ile emme basıncını yavaşça düşürün. Daha sonra önemli bir projeksiyon uzunluğu (birkaç mikron) ile ucu bir dil açıkça görselleştirmek için basıncı artırmak.
NOT: En küçük membran projeksiyon uzunluğunu (L 0) emmeyi sağlayan en düşük uygulanan basınç(P0)α0 (Şekil 7A)referans noktasını tanımlar. Eğrinin tüm noktaları bu referansa göre ölçülecektir (ΔL = L-L0 ve ΔP = P-P0). - 0,5 -0,8 mN/m'ye ulaşana kadar mikrometre ile emme basıncını adım adım artırın. Her adımda, 5 s bekleyin ve dilin bir anlık çekin. Düşük gerilimde bu işlem bükme modülünün belirlenmesini sağlar.
- Emiş basıncını 0,5 mN/m'den kopma gerilimine, rayüzerinde kayan suyun yüksekliğini (-2 ila -50 cm) ayarlayarak artırmaya devam edin(Şekil 7B-D). Yüksek gerilim rejimindeki bu deneyden alan sıkıştırılabilirlik modülü, lysis gerilimi ve lysis gerilimi ölçülecektir.
- Önemli istatistikler elde etmek için yaklaşık 15-20 vezikülleri esnetin. Her mikropipet aspirasyon deneyi 7 ila 10 dakika sürer. Dilin projeksiyon uzunluğunu, veziküllerin çapını ve kılcal damar yarıçapını ölçmek için LASAF yazılımını kullanarak görüntü analizi yapın.
- Bükme modülü, alan sıkıştırılabilirlik modülü, lysis gerilimi ve lysis gerilme ölçümü
- Bu parametrelere erişmek için, E. Evans12tarafından kurulan formalizmi kullanın. Denklem 1'den membran üzerine uygulanan emme basıncını hesaplayın:
Δ P = ρwg (h−h0) (1)
g'nin yerçekimi ivmesi (9.8 m−s−2),ρw suyun yoğunluğudur (ρ = 1 g¡cm−3),h su tankının konumudur ve h0 basıncın sıfıra eşit olduğu ilk konumdur. - Laplace denkleminden membran gerilimini hesaplayın:
 (2)
(2)
ΔP mikropipet üzerindeki emme basıncı, Rp ve Rv sırasıyla mikropipet ve vezikül yarıçapı (mikropipet dışında) vardır. Membranın yüzey alanı (α) aşağıdaki gibi tanımlanır: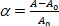 (3)
(3)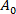 alt emme basıncında vezikül membran alanı olmak.
alt emme basıncında vezikül membran alanı olmak. - Denklem 412'yegöre kapiller uç içindeki vezikülün projeksiyon uzunluğu ΔL'deki artıştan α'yı hesaplayın :
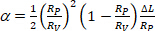 (4)
(4) - Çok düşük bir gerilim rejimi altında, termal bükme undulations yumuşatma belirgin genişleme hakimdir. Çizim ln(σ) vs α. Düşük σ değerlerinde (genellikle 0.001-0.5 mN.m−113),eğimi bükme modülüne bağlı düz bir çizgi verir, Kb (denklemin ilk terimi 5)14:
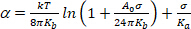 (5)
(5)
NOT: Yüksek gerilimlerde (> 0.5 mN.m−1),membran undülasyonları tamamen bastırılır ve moleküller arasındaki boşluk artışı sonucunda membran alanı artar. Bu rejimde, denklem 5'in ikinci terimi hakimdir ve alan sıkıştırılabilirlik modülü Ka 'ya erişim sağlar (Şekil 8 ve Şekil 9).
- Bu parametrelere erişmek için, E. Evans12tarafından kurulan formalizmi kullanın. Denklem 1'den membran üzerine uygulanan emme basıncını hesaplayın:
Sonuçlar
Yukarıda belirtilen protokolle, biz farklı sentetik dev unilamellar vezikül inceledik (GUV), bir fosfolipid elde: 2-oleoyl-1-palmitoyl-sn-glycero-3-fosfokolin (POPC), bir triblok kopolimer: Poli (etilenoksit)-b-Poli(dimethylsiloxane)-b-Poly(etilenoksit) (PEO12-b-PDMS43-b-PEO12) bir önceki çalışmada sentezlenen13, ve bir diblock kopolimer Poli(dimethylsiloxane)-b-Poly( etil...
Tartışmalar
Mikropipetin kaplaması güvenilir ölçümler elde etmek için önemli noktalardan biridir. Mikropipet vezikül yapışması önlenmelidir, ve bir kaplama yaygın literatürde kullanılır17,18,19,20,21, BSA ile, β-kazein veya surfasil. Kaplama prosedürünün ayrıntıları nadiren belirtilir.
BSA'nın çözülmesi iyi bir isolif...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar minnetle mali destek (ANR Sysa) için ANR kabul.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Required equipment and materials for micropipette design | |||
| Borosilicate Glass Capillaries | World Precision Instruments | 1B100-4 | external and internal diameter of 1mm and 0.58 mm respectively. |
| Filament installed | Sutter Instrument Co. | FB255B | 2.5mm*2.5mm Box Filament |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | Model P-97 | |
| Microforge | NARISHGE Co. | MF-900 | fitted with two objectives (10x and 32x) |
| Materials for coating pipette tips with BSA | |||
| Bovine Serum Albumin Fraction V (BSA) | Sigma-Aldrich | 10735078001 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| Disposable 10 ml syringe Luer Tip | Codan | 626616 | |
| Disposable 5 ml syringe Luer Tip | Codan | 62.5607 | |
| Disposable acetate cellulose filter | Cluzeau Info Labo | L5003SPA | Pore size: 0.22µm, diameter: 25mm |
| Flexible Fused Silica Capillary Tubing | Polymicro Technologies. | TSP530660 | Inner Diameter 536µm, Outer Diameter 660µm, |
| Glucose | Sigma-Aldrich | G5767 | |
| Syringe 500 µL luer Lock GASTIGHT | Hamilton Syringe Company | 1750 | |
| Test tube rotatory mixer | Labinco | 28210109 | |
| Micromanipulation Set up | |||
| Aluminum Optical Rail, 1000 mm Length, M4 threads, X48 Series | Newport | ||
| Damped Optical Table | Newport | used as support of microscope to prevent external vibrations. | |
| Micromanipulator | Eppendorf | Patchman NP 2 | The module unit (motor unit for X, Y and Z movement) is mounted on the inverted microscope by the way of an adapter. |
| Micrometer | Mitutoyo Corporation | 350-354-10 | Digimatic LCD Micrometer Head 25,4 mm Range 0,001 mm |
| Plexiglass water reservoir (100 ml) | Home made | ||
| TCS SP5 inverted confocal microscope (DMI6000) equipped with a resonant scanner and a water immersion objective (HCX APO L 40x/0.80 WU-V-I). | Leica | ||
| X48 Rail Carrier 80 mm Length,with 1/4-20, 8-32 and 4-40 thread | Newport | ||
| Materials for sucrose and amphiphile solution preparation | |||
| 2-Oleoyl-1-palmitoyl-sn-glycero-3-phosphocholine | Sigma-Aldrich | ||
| Chloroform | VWR | 22711.244 | |
| L-α-Phosphatidylethanolamine-N-(lissamine rhodamine B sulfonyl) | Sigma-Aldrich | 810146C | Rhodamine tagged lipid |
| Sucrose | Sigma-Aldrich | S7903 | |
| Electroformation set up | |||
| 10 µL glass capillary ringcaps | Hirschmann | 9600110 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| H Grease | Apiezon | Apiezon H Grease | Silicon-free grease |
| Indium tin oxide coated glass slides | Sigma-Aldrich | 703184 | |
| Needle | Terumo | AN2138R1 | 0.8 x 38 mm |
| Ohmmeter (Multimeter) | Voltcraft | VC140 | |
| Toluene | VWR | 28676.297 | |
| Voltage generator | Keysight | 33210A |
Referanslar
- Bangham, A. D., Standish, M. M., Watkins, J. C. Diffusion of univalent ions across the lamellae of swollen phospholipids. Journal of Molecular Biology. 13 (1), (1965).
- Discher, D. E., Eisenberg, A. Polymer vesicles. Science. 297 (5583), 967-973 (2002).
- Hammer, D., et al. Polymersomes: vesicles from block copolymers. Annals of Biomedical Engineering. 28 (SUPPL. 1), (2000).
- Le Meins, J. F., Schatz, C., Lecommandoux, S., Sandre, O. Hybrid polymer/lipid vesicles: state of the art and future perspectives. Materials Today. 16 (10), 397-402 (2013).
- Schulz, M., Binder, W. H. Mixed Hybrid Lipid/Polymer Vesicles as a Novel Membrane Platform. Macromolecular Rapid Communications. 36, 2031-2041 (2015).
- Schneider, M. B., Jenkins, J. T., Webb, W. W. Thermal fluctuations of large quasi-spherical bimolecular phospholipid vesicles. Journal De Physique. 45 (9), 1457-1472 (1984).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Advances in Colloid and Interface Science. 208, 225-234 (2014).
- Rodríguez-García, R., et al. Polymersomes: smart vesicles of tunable rigidity and permeability. Soft Matter. 7 (4), 1532-1542 (2011).
- Angelova, M. I., Dimitrov, D. S. Liposome electroformation. Faraday Discussions of the Chemical Society. 81, 303-311 (1986).
- Dao, T. P. T., et al. Membrane properties of giant polymer and lipid vesicles obtained by electroformation and pva gel-assisted hydration methods. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 533, 347-353 (2017).
- Pereno, V., et al. Electroformation of Giant Unilamellar Vesicles on Stainless Steel Electrodes. ACS omega. 2 (3), 994-1002 (2017).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Physical Review Letters. 64 (17), 2094-2097 (1990).
- Dao, T. P. T., et al. Modulation of phase separation at the micron scale and nanoscale in giant polymer/lipid hybrid unilamellar vesicles (GHUVs). Soft Matter. 13 (3), 627-637 (2017).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 11 (11), 693-703 (1973).
- Dao, T. P. T., et al. The combination of block copolymers and phospholipids to form giant hybrid unilamellar vesicles (GHUVs) does not systematically lead to "intermediate'' membrane properties. Soft Matter. 14 (31), 6476-6484 (2018).
- Shoemaker, S. D., Kyle Vanderlick, T. Material Studies of Lipid Vesicles in the Lα and Lα-Gel Coexistence Regimes. Biophysical Journal. 84 (2), 998-1009 (2003).
- Longo, M. L., Ly, H. V., Dopico, A. M. . Methods in Membrane Lipids. , 421-437 (2007).
- Chen, D., Santore, M. M. Hybrid copolymer-phospholipid vesicles: phase separation resembling mixed phospholipid lamellae, but with mechanical stability and control. Soft Matter. 11 (13), 2617-2626 (2015).
- Mabrouk, E., et al. Formation and material properties of giant liquid crystal polymersomes. Soft Matter. 5, 1870-1878 (2009).
- Henriksen, J., et al. Universal behavior of membranes with sterols. Biophysical Journal. 90 (5), 1639-1649 (2006).
- Ly, H. V., Block, D. E., Longo, M. L. Interfacial Tension Effect of Ethanol on Lipid Bilayer Rigidity, Stability, and Area/Molecule: A Micropipet Aspiration Approach. Langmuir. 18 (23), 8988-8995 (2002).
- Bermudez, H., Hammer, D. A., Discher, D. E. Effect of Bilayer Thickness on Membrane Bending Rigidity. Langmuir. 20, 540-543 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır