Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Verdunkelung von Riesen-Unilamellar-Hybridvesikeln durch Elektroformation und Messung ihrer mechanischen Eigenschaften durch Micropipette Aspiration
In diesem Artikel
Zusammenfassung
Ziel des Protokolls ist es, die mechanischen Eigenschaften von Riesenvesikeln durch Mikropipette-Aspiration zuverlässig zu messen.
Zusammenfassung
Riesige Vesikel aus Phospholipiden und Copolymeren können in verschiedenen Anwendungen genutzt werden: kontrollierte und gezielte Wirkstoffabgabe, biomolekulare Erkennung innerhalb von Biosensoren zur Diagnose, funktionelle Membranen für künstliche Zellen und Entwicklung bioinspirierter Mikro-/Nanoreaktoren. In all diesen Anwendungen ist die Charakterisierung ihrer Membraneigenschaften von grundlegender Bedeutung. Unter den bestehenden Charakterisierungstechniken ermöglicht die von E. Evans entwickelte Mikropipette-Aspiration die Messung der mechanischen Eigenschaften der Membran wie Flächenkompressiermodul, Biegemodul und Lysespannung und Dehnung. Hier stellen wir alle Methoden und detaillierten Verfahren zur Gewinnung von Riesenbläschen aus dem Dünnschicht eines Lipids oder Copolymers (oder beidem), die Herstellung und Oberflächenbehandlung von Mikropipetten und das Aspirationsverfahren vor, das zur Messung aller zuvor genannten Parameter führt.
Einleitung
Riesenbläschen aus Phospholipiden (Liposomen) sind seit den 1970er Jahren als Basis-Zellmembranmodell1weit verbreitet. In den späten 1990er Jahren erschienen vesikuläre Morphologien, die aus der Selbstmontage von Copolymeren gewonnen wurden, polymersomen in Bezug auf ihre Lipidanaloga2,3, schnell als interessante Alternative zu Liposomen, die eine schwache mechanische Stabilität und eine schlechte modulare chemische Funktionalität besitzen. Ihr zellbiomimetischer Charakter ist jedoch im Vergleich zu Liposomen eher begrenzt, da letztere aus Phospholipiden bestehen, dem Hauptbestandteil der Zellmembran. Darüber hinaus kann ihre geringe Membrandurchlässigkeit in einigen Anwendungen wie der Medikamentenabgabe ein Problem sein, bei der eine kontrollierte Diffusion von Arten durch die Membran erforderlich ist. Kürzlich wurde die Verbindung von Phospholipiden mit Blockcopolymeren zur Entwicklung von Hybridpolymer-Lipid-Vesikeln und Membranen Gegenstand einer zunehmenden Anzahl von Studien4,5. Die Hauptidee besteht darin, Einheiten zu entwerfen, die die Vorteile jeder Komponente synergistisch kombinieren (Biofunktionalität und Permeabilität von Lipid-Doppelschichten mit der mechanischen Stabilität und chemischen Vielseitigkeit von Polymermembranen), die in verschiedenen Anwendungen genutzt werden können: kontrollierte und zielgerichtete Wirkstoffabgabe, biomolekulare Erkennung innerhalb von Biosensoren für die Diagnose, funktionelle Membranen für künstliche Zellen, Entwicklung bioinspirierter Mikro-/Nanoreaktoren.
Heutzutage haben verschiedene wissenschaftliche Gemeinschaften (Biochemiker, Chemiker, Biophysiker, Physiker, Biologen) ein wachsendes Interesse an der Entwicklung eines fortschrittlicheren Zellmembranmodells. Hier ist es unser Ziel, so detailliert wie möglich, bestehende Methoden (Elektroformation, Mikropipette-Aspiration) zu präsentieren, um die mechanischen Eigenschaften von Riesenvesikeln und die jüngsten "fortgeschrittenen" Zellmembranmodelle zu erhalten und zu charakterisieren, die Hybridpolymer-Lipid-Riesenbläschen4,5sind.
Der Zweck dieser Methoden ist es, eine zuverlässige Messung der Flächenkompressibilität und Biegemodul i der Membran sowie deren Lysespannung und Dehnung zu erhalten. Eine der gebräuchlichsten Techniken zur Messung der Biegesteifigkeit eines riesigen Vesikels ist die Fluktuationsanalyse6,7, basierend auf direkter Videomikroskopbeobachtung; dies erfordert jedoch eine große sichtbare Membranfluktuation und wird nicht systematisch auf dicken Membranen (z.B. Polymersomen) gewonnen. Der Flächenkompressibilitätsmodul kann experimentell mit der Langmuir Blodgett-Technik bestimmt werden, aber meistens auf einer Monoschicht8. Die Micropipette-Aspirationstechnik ermöglicht die Messung beider Module an einem bilayerbildenden Riesen-Unilamellen-Vesikel (GUV) in einem Experiment.
Die folgende Methode eignet sich für alle amphiphilen Moleküle oder Makromoleküle, die in der Lage sind, Bilayer und damit Vesikel durch Elektroformation zu bilden. Dies erfordert einen flüssigen Charakter der Bilayer bei der Temperatur der Elektroformation.
Protokoll
1. Herstellung von Mikropipetten
HINWEIS: Hier sind Mikropipetten mit einem Innendurchmesser von 6 bis 12 m und einer Verjüngungslänge von ca. 3-4 mm erforderlich. Eine detaillierte Methode zur Herstellung von Mikropipette wird im Folgenden beschrieben.
- Legen Sie die Borosilikatglaskapillare in die Zugstange des Abziehers und fixieren Sie eine der Enden, indem Sie den Knopf anziehen.
- Schieben Sie das Glas vorsichtig durch die Löcher an der Seite der Heizkammer.
- Ziehen Sie den Klemmknopf am anderen Ende fest.
- Steuern Sie die Größe der Spitze und die Verjüngungslänge, um die gewünschten Spezifikationen zu erreichen. Optimieren Sie dabei technische Parameter wie Heiztemperatur, Zug, Geschwindigkeit, Verzögerung und Druck. Hier ist ein Beispiel für ein Programm verwendet:
Wärme: 550 °C
Ziehen: 10 (Maschinenbereich: 0-255 in beliebigen Einheiten)
Geschwindigkeit: 30 (Bereich: 0-255 in beliebigen Einheiten)
Verzögerung: 1 (Bereich: 0-255 in beliebigen Einheiten)
Druck: 500 (Bereich: 0-999 in beliebigen Einheiten) - Klicken Sie auf PULL, um die vom Programm definierten Ereignisse auszuführen. Die Kapillare wird dann in zwei Mikropipetten aufgeteilt, deren Abmessungen mit einer Mikroschmiede eingestellt werden müssen.
- Setzen Sie die Mikropipette in den Metallpipettenhalter der Mikroschmiede ein (siehe Abbildung 1). Mit 10x Objektiv, stellen Sie die Mikroskopstufe und die Pipettenmanipulator (vertikale und horizontale Bewegung), bis die Pipettenspitze in der Nähe der Glasperlenoberfläche ist.
- Drücken Sie den Fußschalter, um die Glasperle zu schmelzen. Senken Sie die Spitze und setzen Sie sie in Kontakt mit der geschmolzenen Glasperle. Geschmolzenes Glas wird durch Kapillarwirkung in die Pipette fließen. Warten Sie einige Sekunden, bis der Füllstand des geschmolzenen Glases eine bestimmte Höhe erreicht, wie im Einsatz der Abbildung 1gezeigt.
- Stoppen Sie die Heizung, indem Sie den Druck auf den Fußschalter entfernen, und ziehen Sie die Spitze schnell mit dem vertikalen Pipettenmanipulator weg, um einen scharfen Bruch zu verursachen.
- Wiederholen Sie die Schritte 1.7 und 1.8, bis der gewünschte Durchmesser erreicht ist (6 bis 12 m).
HINWEIS: Um die Genauigkeit der Durchmessermessung zu verbessern, verwenden Sie im letzten Schritt ein 32-faches Objektiv, das mit einem Absehen ausgestattet ist.
2. Pipette-Spitzen mit BSA (Rinderserumalbumin) beschichten
- Zur Herstellung einer 0,1 M-Glukoselösung mit 1% Gew. BSA in reinem Wasser.
- 180 mg Glukosepulver wiegen, in ein 15 ml Polypropylen-Konusrohr geben und mit 10 ml reinem Wasser füllen.
- 0,1 g BSA-Pulver zugeben und mit einem Reagenzglas-Drehmischer bis zur vollständigen Auflösung (ca. 4 h) vorsichtig schütteln.
- Nehmen Sie die Lösung mit einer 10 ml Einweg-Luer-Spritze mit einer Nadel. Nach dem Befüllen die Nadel entfernen und einen 0,22 m Acetat-Zellulosefilter installieren. Füllen Sie mehrere Polypropylen-Mikrozentrifugenrohre (1,5 ml), die zum Eintauchen der Spitze verwendet werden.
- Legen Sie die Kapillaren vertikal in die Halter. Senken Sie den Halter und tauchen Sie die Spitze über Nacht in die Glucose/BSA-Lösung ein. Die Lösung sollte durch Kapillarwirkung etwa 1 cm hoch werden.
- Entfernen Sie die Pipettenspitze aus der Glucose/BSA-Lösung. 5 ml 0,1 m Glukoselösung (verdünnt 90 mg Glukosepulver in 5 ml reinem Wasser) vorbereiten und durch einen 0,22 m Acetat-Zellulosefilter filtern.
- Füllen Sie die Pipette mit der Glukoselösung, indem Sie eine 500 L Glasspritze mit einer flexiblen geschmolzenen Kieselsäurekapillare verwenden. Entfernen Sie dann die gesamte Glukoselösung, indem Sie sie zurücksaugen und entsorgen Sie sie (Abbildung 2). Wiederholen Sie diesen Schritt mehrmals, um die ungebundene BSA zu entfernen.
3. Bildung von GUVs und GHUVs durch Elektroformation
HINWEIS: Elektroformation ist eine häufig verwendete Technik, die von Angelova9entwickelt wurde. Die Verfahren zur Gewinnung einer Elektroformationskammer, Ablagerung einer Lipid- oder Polymerfolie (oder beider für GHUVs (Giant Hybrid Unilamellar Vesicles)) und Hydratder der Folie unter einem alternativen elektrischen Feld sind im Folgenden beschrieben. Das Verfahren zur Erhebung der erhaltenen GUV wird ebenfalls beschrieben.
- Herstellung von Amphiphilen-, Saccharose- und Glukoselösungen
- Bereiten Sie eine Amphiphillösung in einer Konzentration von 1 mg/ml vor. 10 mg Amphiphil wiegen und in 10 ml Chloroform auflösen. Bewahren Sie die Lösung in versiegelten Durchstechflaschen auf, um eine Lösungsmittelverdunstung zu vermeiden.
- Bereiten Sie eine Stammlösung von 1,2-Dioleoyl-sn-Glycero-3-Phosphoethanolamin-N-(Lissamine Rhodamin B Sulfonyl) (DOPE-Rhod) bei 1 mg/ml in Chloroform vor.
- Fügen Sie der Amphiphillösung eine fluoreszierende Lipidlösung mit 10 l zu. Bewahren Sie die Lösungen in versiegelten Durchstechflaschen auf, um eine Lösungsmittelverdunstung zu vermeiden.
- Herstellung von Saccharose- und Glukoselösungen in einer Konzentration von 0,1 M. Wiegen Sie 342 mg bzw. 180 mg Saccharose und Glukose und lösen Sie sie in 10 ml reinem Wasser auf.
- Vorbereitung der Elektroformationskammer
HINWEIS: Zur Herstellung einer Elektroformationsvorrichtung können verschiedene leitfähige Materialien verwendet werden (z. B. Platindrähte10, Edelstahlnadeln11). Die Elektroformationskammer besteht aus zwei ITO-Dias, die durch einen O-Ring-Gummiabstandraum, der auf einer Seite geschnitten wurde, um eine Blende zu erzeugen, getrennt sind. Die Dias werden über zwei elektrische Drähte an einen Spannungsgenerator angeschlossen (Abbildung 3 und Abbildung 4A).- Reinigen Sie die ITO-Dias mit organischem Lösungsmittel (z. B. Chloroform). Identifizieren Sie die leitfähige Oberfläche mit einem Ohmmeter.
- Befestigen Sie die elektrischen Drähte auf der leitfähigen Seite mit Klebeband.
- Amphiphile Lösungsabscheidung
- Tauchen Sie eine Kapillare in die Lösung, bis der Pegel durch Kapillarwirkung steigt und etwa 5 l der Lösung sammeln.
- Setzen Sie die Kapillare in Kontakt mit der Mitte der ITO-Glasplatte und verteilen Sie die Lösung vorsichtig. Warten Sie 10 Sekunden, um eine vollständige Lösungsmittelverdampfung sicherzustellen (Abbildung 4A).
- Wiederholen Sie diesen Vorgang 3 Mal für jede Seite.
- Fügen Sie eine Schicht aus silikonfreiem Fett auf beiden Seiten des geöffneten O-Ring-Abstandsabstands hinzu. Setzen Sie es um den Bereich der Ablagerung. Legen Sie die leitfähige Fläche der zweiten ITO-Glasplatte auf die Oberseite des Abstands.
- Stellen Sie die Elektroformationskammer 3 Stunden lang unter Vakuum, um Spuren von organischem Lösungsmittel zu entfernen.
- Elektroformationsverfahren
- Schließen Sie die elektrischen Drähte an den Generator an.
- Verwenden Sie die folgenden Einstellungen für den Generator:
Alternative sinusförmige Spannung
Frequenz: 10 Hz
Amplitude: 2 VPeak-to-Peak
HINWEIS: Für jedes System müssen eine optimale Spannungsfrequenz und -dauer gefunden werden. - Stellen Sie sicher, dass die Spannung vor dem Einspritzen der Lösung in die Kammer aufgebracht wird.
- Injizieren Sie 1 ml Lösung mit einer Spritze mit 0,8 mm Innendurchmesser Nadel, um die Kammer zu füllen. Entfernen Sie eventuelle Blasen.
- Lassen Sie die Kammer unter der angelegten Spannung / Frequenz für 75 min (Abbildung 4B).
- GUVs-Ernte
- Schalten Sie den Generator aus.
- Mit 1 ml Spritze mit 0,8 mm Innendurchmesser Nadel, saugen Sie einen kleinen Teil der Lösung, um eine Luftblase in der Kammer zu produzieren. Kippen Sie die Kammer leicht, damit sich diese Blase innerhalb der Kammer bewegt. Dies kann den GUVs helfen, sich von der ITO-Oberfläche zu lösen (Abbildung 4C).
- Saugen Sie die gesamte Lösung und übertragen Sie sie in ein 1 ml Kunststoffrohr.
- Entfernen Sie die Drähte und reinigen Sie die ITO-Dias mit organischen Lösungsmitteln (Toluol dann Chloroform).
4. Mikromanipulation eingerichtet
HINWEIS: Das Prinzip der Mikropipette-Aspiration ist es, eine einzelne Vesikel durch eine Glas-Mikropipette durch die Anwendung einer Depression zu saugen. Die Länge der Zunge in der Pipette wird in Abhängigkeit vom Saugdruck gemessen. Die zuvor beschriebene Pipettenbeschichtung mit BSA ist unerlässlich, um eine Haftung zwischen den Vesikelmembranen und der Pipette zu verhindern oder zu minimieren.
Das Protokoll ist unten dargestellt.
- Leitungs- und Wasserbehälteranschluss
HINWEIS: Der mit Wasser gefüllte Tank und das Mikrometer sind an einer Schiebeplatte befestigt. Ein digitaler Zähler mit Mikrometerkopf ermöglicht eine vertikale Verschiebung des Gerätes in einem Bereich von 0 bis 2,5 cm und eine Genauigkeit von 1 m. Verdrängung entlang einer Aluminium-Optikschiene ist bis zu 1 Meter lang möglich. Ein Siliziumschlauch verbindet das Reservoir mit dem Kapillarhalter (Abbildung 5A).- Füllen Sie den Tank mit reinem Wasser. Schließen Sie eine Einwegspritze von 5 ml über Silikonschläuche und Aspirate an den Kapillarmetallhalter an, um einen Wasserfluss vom Tank zum Halter zu erzeugen.
- Berühren Sie das Rohr leicht, um Luftblasen zu beseitigen. Erhöhen Sie gleichzeitig den Wassertank, um einen positiven Druck zu erzeugen. Die 5 ml Spritze ist noch am Halter befestigt.
- Nach den zuvor beschriebenen Beschichtungs- und Reinigungsschritten (siehe Schritt 2) füllen Sie eine Kapillare mit Glukoselösung, bis sich am Ende ein Tropfen bildet. Entfernen Sie die Spritzenschläuche aus dem Metallhalter, um einen leichten Wasserfluss an seinem Ende zu erzeugen.
- Drehen Sie die Kapillare auf den Kopf und verbinden Sie den Glukosetropfen mit dem Wasserfluss aus dem Halter. Befestigen Sie die Kapillare und den Halter, indem Sie sie zusammenschrauben.
- Positionieren einer Pipette
HINWEIS: Während dieses Vorgangs wird der Wassertank immer noch auf der Aluminiumschiene positioniert, um einen positiven Druck aufrechtzuerhalten.- Nehmen Sie die hausgemachte Aluminium-Bühne mit zwei Glasrutschen (zuvor mit Ethanol gereinigt) ausgestattet und kleben Sie sie mit Vakuumfett auf jeder Seite. Installieren Sie es auf der Mikroskopstufe und bilden Sie einen Meniskus zwischen den beiden Dias mit einer 1 ml Spritze mit 0,1 M Glukose, wie in Abbildung 5B,Cdargestellt.
- Legen Sie die Pipette und ihren Halter auf die Motoreinheit des Mikromanipulators und ziehen Sie den Klemmknopf fest.
- Verwenden Sie den Bedienfeld-Joystick im groben Modus, um die Mikropipette in der Nähe des Glukose-Meniskus zu senken. Passen Sie die Position der Spitze mit dem feinformatigen Modus in der Mitte des Meniskus an.
- Halten Sie die Spitze ein wenig Minuten in Glukose eingetaucht, um ihre äußere und innere Oberfläche zu reinigen (da ein positiver Druck beibehalten wird, spült der Wasserdurchfluss die innere Oberfläche der Pipette, um unbeschichtete BSA zu entfernen).
- Bewahren Sie die Position der Spitze auf der Mikromanipulator-Tastatur auf und ziehen Sie sie aus dem Meniskus.
- Entfernen Sie den Glukose-Meniskus und ersetzen Sie ihn durch einen frischen. Saugen Sie 2 l GUVs in 0,1 M Saccharose mit einer 20-L-Mikropipette und legen Sie sie in den frischen Glukose-Meniskus. Beobachten Sie im DIC-Modus (Differentialinterferenzkontrast) die GUVs, die sich am unteren Rand befinden, aufgrund des Dichteunterschieds zwischen Saccharose (hauptsächlich innerhalb der GUVs) und Glukose (hauptsächlich außerhalb der GUVs).
- Wenn die Vesikel leicht entleert sind, setzen Sie die Saugpipette wieder ein und konzentrieren Sie sich auf die Spitze. Stellen Sie die Höhe H0 des Wassertanks ein, für den der Druck fast 0 beträgt. Nutzen Sie dazu kleine Vesikel oder Partikel, die natürlicherweise in Lösung vorhanden sind, und passen Sie die Wassertankhöhe an, bis die Bewegung dieser Partikel gestoppt wird.
- An dieser Stelle den Meniskus mit Mineralöl umgeben, um Eine Wasserverdunstung zu verhindern, siehe Abbildung 5D.
HINWEIS: Die Raumtemperatur sollte zwischen 20-22 °C durch Klimaanlage gesteuert werden.
- Micropipette-Aspirationsexperiment
- Senken Sie die Pipettenspitze (6-12 m Durchmesser) und erzeugen Sie eine kleine Absaugung (-1 cm), um ein Vesikel (15-30 m Durchmesser) zu aspirieren. Die Membran des ausgewählten Vesikels sollte leicht schwanken und darf keine sichtbaren Defekte aufweisen (keine Knospe oder Filament) (Abbildung 6).
- Heben Sie die Pipette auf ein höheres Niveau, um das angesaugte Vesikel von den anderen Vesikeln zu isolieren, indem Sie den Mikromanipulator verwenden und diese Position während des gesamten Experiments beibehalten.
- Vorbeanspruchung des Vesikels durch Senken des mit Wasser gefüllten Tanks auf ca. -10 cm, dann verringern Sie den Druck, auf ihren Ursprünglichen Wert (-1 cm) zurückzukehren. Wiederholen Sie diesen Schritt mehrmals, um Membranüberschuss und kleine Defekte aus der Membran zu entfernen.
- Ab einer Höhe von -0,5 cm, definiert durch die Position des Wassertanks, verringern Sie langsam den Saugdruck mit dem Mikrometer, um ein Regime zu erreichen, in dem die Membran schwankt. Dann erhöhen Sie den Druck, eine Zunge in der Spitze mit einer signifikanten Projektionslänge (ein paar Mikrometer) klar zu visualisieren.
ANMERKUNG: Der niedrigste aufgebrachte Druck (P0), der das Aufsaugen der kleinsten Membranprojektionslänge (L0) ermöglicht, definiert den Bezugspunkt0 (Abbildung 7A). Alle Punkte der Kurve werden gemäß dieser Referenz gemessen (L = L-L0 und P = P-P0). - Erhöhen Sie den Saugdruck mit dem Mikrometer schrittweise bis zu 0,5 -0,8 mN/m. Warten Sie bei jedem Schritt 5 s und machen Sie einen Schnappschuss der Zunge. Dieses Verfahren bei niedriger Spannung ermöglicht die Bestimmung des Biegemoduls.
- Erhöhen Sie den Saugdruck von 0,5 mN/m auf die Bruchspannung, indem Sie die Höhe des wassergefüllten Gleitens auf der Schiene (von -2 bis -50 cm) einstellen(Bild 7B-D). Aus diesem Experiment bei Hochspannungsregime werden der Flächenkompressibilitätsmodul, die Lysespannung und die Lysedehnung gemessen.
- Dehnen Sie etwa 15-20 Vesikel, um signifikante Statistiken zu erwerben. Jedes Micropipette-Aspirationsexperiment dauert zwischen 7 und 10 Minuten. Führen Sie eine Bildanalyse mit der LASAF-Software durch, um die Projektionslänge der Zunge, den Durchmesser der Vesikel und den Radius der Kapillare zu messen.
- Messmodul, Flächenkompressibilitätsmodul, Lysespannung und Lysedehnung
- Um auf diese Parameter zuzugreifen, verwenden Sie den formalismus, der von E. Evans12festgelegt wurde. Berechnen Sie den Saugdruck, der über die Membran ausgeübt wird, aus Gleichung 1:
- P =- wg (h-h0) (1)
wobei g die Gravitationsbeschleunigung ist (9,8 m s2),w die Dichte des Wassers ist (n = 1 g cm,3 ), h ist die Position des Wassertanks und h0 ist die Anfangsposition, in der der Druck gleich Null ist. - Berechnen Sie die Membranspannung aus der Laplace-Gleichung:
 (2)
(2)
wobei der Saugdruck auf die Mikropipette, Rp und Rv die Mikropipette und die Vesikelradien (außerhalb der Mikropipette) sind. Der Oberflächendehnungsstamm der Membran ist definiert wie folgt: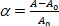 (3)
(3)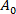 Membranbereich des Vesikels bei dem niedrigeren Saugdruck.
Membranbereich des Vesikels bei dem niedrigeren Saugdruck. - Berechnen Sie die S-Werte aus der Erhöhung der Projektionslänge L des Vesikels innerhalb der Kapillarspitze gemäß Gleichung 412:
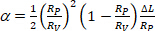 (4)
(4) - Bei einem sehr niedrigen Spannungsregime dominiert die Glättung von thermischen Biegewellen die scheinbare Ausdehnung. Plot ln(') vs. Bei niedrigen Werten (typischerweise 0,001–0,5 mN.mbei 113) ergibt sich eine gerade Linie, deren Steigung mit dem Biegemodul verbunden ist, Kb (erster Term der Gleichung 5)14:
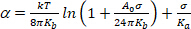 (5)
(5)
HINWEIS: Bei hohen Spannungen (> 0,5 mN.m.1) werden Membranwellen vollständig unterdrückt und die Membranfläche nimmt infolge des erhöhten Abstands zwischen molekülen zu. In diesem Regime dominiert der zweite Begriff der Gleichung 5 und gibt Zugang zum Flächenkompressibilitätsmodul Ka (Abbildung 8 und Abbildung 9).
- Um auf diese Parameter zuzugreifen, verwenden Sie den formalismus, der von E. Evans12festgelegt wurde. Berechnen Sie den Saugdruck, der über die Membran ausgeübt wird, aus Gleichung 1:
Ergebnisse
Mit dem oben genannten Protokoll wir haben verschiedene synthetische Riesen-Unilamellar-Vesikel (GUV) untersucht, die aus einem Phospholipid gewonnen wurden: 2-Oleoyl-1-Palmitoyl-sn-glycero-3-phosphocholin (POPC), ein Triblock-Copolymer: Poly(Ethylenoxid)-b-Poly(Dimethylsiloxan)-b-Poly(Ethylenoxid) (PEO12-b-PDMS43-b-PEO12) in einer früheren Studie13und ein Diblock-Copolymer Poly(Dimethylsiloxan)-...
Diskussion
Die Beschichtung der Mikropipette ist einer der wichtigsten Punkte, um zuverlässige Messungen zu erhalten. Die Haftung des Vesikels an der Mikropipette muss verhindert werden, und eine Beschichtung wird häufig in der Literatur17,18,19,20,21, mit BSA, '-Casein oder Surfasil verwendet. Details des Beschichtungsverfahrens werden selten erwähnt.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren danken dem ANR für die finanzielle Unterstützung (ANR Sysa).
Materialien
| Name | Company | Catalog Number | Comments |
| Required equipment and materials for micropipette design | |||
| Borosilicate Glass Capillaries | World Precision Instruments | 1B100-4 | external and internal diameter of 1mm and 0.58 mm respectively. |
| Filament installed | Sutter Instrument Co. | FB255B | 2.5mm*2.5mm Box Filament |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | Model P-97 | |
| Microforge | NARISHGE Co. | MF-900 | fitted with two objectives (10x and 32x) |
| Materials for coating pipette tips with BSA | |||
| Bovine Serum Albumin Fraction V (BSA) | Sigma-Aldrich | 10735078001 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| Disposable 10 ml syringe Luer Tip | Codan | 626616 | |
| Disposable 5 ml syringe Luer Tip | Codan | 62.5607 | |
| Disposable acetate cellulose filter | Cluzeau Info Labo | L5003SPA | Pore size: 0.22µm, diameter: 25mm |
| Flexible Fused Silica Capillary Tubing | Polymicro Technologies. | TSP530660 | Inner Diameter 536µm, Outer Diameter 660µm, |
| Glucose | Sigma-Aldrich | G5767 | |
| Syringe 500 µL luer Lock GASTIGHT | Hamilton Syringe Company | 1750 | |
| Test tube rotatory mixer | Labinco | 28210109 | |
| Micromanipulation Set up | |||
| Aluminum Optical Rail, 1000 mm Length, M4 threads, X48 Series | Newport | ||
| Damped Optical Table | Newport | used as support of microscope to prevent external vibrations. | |
| Micromanipulator | Eppendorf | Patchman NP 2 | The module unit (motor unit for X, Y and Z movement) is mounted on the inverted microscope by the way of an adapter. |
| Micrometer | Mitutoyo Corporation | 350-354-10 | Digimatic LCD Micrometer Head 25,4 mm Range 0,001 mm |
| Plexiglass water reservoir (100 ml) | Home made | ||
| TCS SP5 inverted confocal microscope (DMI6000) equipped with a resonant scanner and a water immersion objective (HCX APO L 40x/0.80 WU-V-I). | Leica | ||
| X48 Rail Carrier 80 mm Length,with 1/4-20, 8-32 and 4-40 thread | Newport | ||
| Materials for sucrose and amphiphile solution preparation | |||
| 2-Oleoyl-1-palmitoyl-sn-glycero-3-phosphocholine | Sigma-Aldrich | ||
| Chloroform | VWR | 22711.244 | |
| L-α-Phosphatidylethanolamine-N-(lissamine rhodamine B sulfonyl) | Sigma-Aldrich | 810146C | Rhodamine tagged lipid |
| Sucrose | Sigma-Aldrich | S7903 | |
| Electroformation set up | |||
| 10 µL glass capillary ringcaps | Hirschmann | 9600110 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| H Grease | Apiezon | Apiezon H Grease | Silicon-free grease |
| Indium tin oxide coated glass slides | Sigma-Aldrich | 703184 | |
| Needle | Terumo | AN2138R1 | 0.8 x 38 mm |
| Ohmmeter (Multimeter) | Voltcraft | VC140 | |
| Toluene | VWR | 28676.297 | |
| Voltage generator | Keysight | 33210A |
Referenzen
- Bangham, A. D., Standish, M. M., Watkins, J. C. Diffusion of univalent ions across the lamellae of swollen phospholipids. Journal of Molecular Biology. 13 (1), (1965).
- Discher, D. E., Eisenberg, A. Polymer vesicles. Science. 297 (5583), 967-973 (2002).
- Hammer, D., et al. Polymersomes: vesicles from block copolymers. Annals of Biomedical Engineering. 28 (SUPPL. 1), (2000).
- Le Meins, J. F., Schatz, C., Lecommandoux, S., Sandre, O. Hybrid polymer/lipid vesicles: state of the art and future perspectives. Materials Today. 16 (10), 397-402 (2013).
- Schulz, M., Binder, W. H. Mixed Hybrid Lipid/Polymer Vesicles as a Novel Membrane Platform. Macromolecular Rapid Communications. 36, 2031-2041 (2015).
- Schneider, M. B., Jenkins, J. T., Webb, W. W. Thermal fluctuations of large quasi-spherical bimolecular phospholipid vesicles. Journal De Physique. 45 (9), 1457-1472 (1984).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Advances in Colloid and Interface Science. 208, 225-234 (2014).
- Rodríguez-García, R., et al. Polymersomes: smart vesicles of tunable rigidity and permeability. Soft Matter. 7 (4), 1532-1542 (2011).
- Angelova, M. I., Dimitrov, D. S. Liposome electroformation. Faraday Discussions of the Chemical Society. 81, 303-311 (1986).
- Dao, T. P. T., et al. Membrane properties of giant polymer and lipid vesicles obtained by electroformation and pva gel-assisted hydration methods. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 533, 347-353 (2017).
- Pereno, V., et al. Electroformation of Giant Unilamellar Vesicles on Stainless Steel Electrodes. ACS omega. 2 (3), 994-1002 (2017).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Physical Review Letters. 64 (17), 2094-2097 (1990).
- Dao, T. P. T., et al. Modulation of phase separation at the micron scale and nanoscale in giant polymer/lipid hybrid unilamellar vesicles (GHUVs). Soft Matter. 13 (3), 627-637 (2017).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 11 (11), 693-703 (1973).
- Dao, T. P. T., et al. The combination of block copolymers and phospholipids to form giant hybrid unilamellar vesicles (GHUVs) does not systematically lead to "intermediate'' membrane properties. Soft Matter. 14 (31), 6476-6484 (2018).
- Shoemaker, S. D., Kyle Vanderlick, T. Material Studies of Lipid Vesicles in the Lα and Lα-Gel Coexistence Regimes. Biophysical Journal. 84 (2), 998-1009 (2003).
- Longo, M. L., Ly, H. V., Dopico, A. M. . Methods in Membrane Lipids. , 421-437 (2007).
- Chen, D., Santore, M. M. Hybrid copolymer-phospholipid vesicles: phase separation resembling mixed phospholipid lamellae, but with mechanical stability and control. Soft Matter. 11 (13), 2617-2626 (2015).
- Mabrouk, E., et al. Formation and material properties of giant liquid crystal polymersomes. Soft Matter. 5, 1870-1878 (2009).
- Henriksen, J., et al. Universal behavior of membranes with sterols. Biophysical Journal. 90 (5), 1639-1649 (2006).
- Ly, H. V., Block, D. E., Longo, M. L. Interfacial Tension Effect of Ethanol on Lipid Bilayer Rigidity, Stability, and Area/Molecule: A Micropipet Aspiration Approach. Langmuir. 18 (23), 8988-8995 (2002).
- Bermudez, H., Hammer, D. A., Discher, D. E. Effect of Bilayer Thickness on Membrane Bending Rigidity. Langmuir. 20, 540-543 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten