É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Obtenção de vesículas híbridas unilamellares gigantes por eletroformação e medição de suas propriedades mecânicas pela aspiração micropipette
Neste Artigo
Resumo
O objetivo do protocolo é medir de forma confiável as propriedades mecânicas da membrana de vesículas gigantes por aspiração micropipette.
Resumo
Vesículas gigantes obtidas a partir de fosfolípidos e polímeros podem ser exploradas em diferentes aplicações: entrega de medicamentos controlados e direcionados, reconhecimento biomolecular dentro de biossensores para diagnóstico, membranas funcionais para células artificiais e desenvolvimento de micro/nanores bioinspirados. Em todas essas aplicações, a caracterização de suas propriedades de membrana é de fundamental importância. Entre as técnicas de caracterização existentes, a aspiração micropipette, pioneira por E. Evans, permite a medição de propriedades mecânicas da membrana, como modulus de compresibilidade de área, modulus de flexão e estresse e tensão de lise. Aqui, apresentamos todas as metodologias e procedimentos detalhados para obter vesículas gigantes a partir da película fina de um lipídico ou copolímero (ou ambos), a fabricação e o tratamento superficial de micropipettes e o procedimento de aspiração que leva à medição de todos os parâmetros mencionados anteriormente.
Introdução
Vesículas gigantes obtidas a partir de fosfolípidos (lipossomos) têm sido amplamente utilizados desde a década de 1970 como o modelo de membrana celular básica1. No final da década de 1990, as morfologias vesiculares obtidas a partir da automontagem de copolímeros, denominadas polimerasias em referência aos seus análogos lipídicos2,3, rapidamente apareceram como uma alternativa interessante aos lipossomas que possuem estabilidade mecânica fraca e má funcionalidade química modular. No entanto, seu caráter biomimético celular é bastante limitado em comparação com os lipossomos, uma vez que estes últimos são compostos de fosfolípidos, o principal componente da membrana celular. Além disso, sua baixa permeabilidade da membrana pode ser um problema em algumas aplicações, como a entrega de drogas, onde a difusão controlada de espécies através da membrana é necessária. Recentemente, a associação de fosfolípidos com polímeros de bloco para projetar vesículas e membranas polímeras-lipídios híbridas tem sido objeto de um número crescente de estudos4,5. A idéia principal é projetar entidades que combinam sinergicamente os benefícios de cada componente (biofuncionalidade e permeabilidade de bicamadas lipídicas com a estabilidade mecânica e versatilidade química das membranas polímeras), que podem ser exploradas em diferentes aplicações: entrega de medicamentos controlados e direcionados, reconhecimento biomolecular dentro de biossensores para diagnóstico, membranas funcionais para células artificiais, desenvolvimento de micro/nano-reatores de inspiração biológica.
Hoje em dia, diferentes comunidades científicas (bioquímicos, químicos, biofísicos, químicos-físicos, biólogos) têm um interesse crescente no desenvolvimento de um modelo de membrana celular mais avançado. Aqui, nosso objetivo é apresentar, o mais detalhado possível, metodologias existentes (eletroformação, aspiração micropipette) para obter e caracterizar as propriedades mecânicas das vesículas gigantes e os recentes modelos de membrana celular "avançada" que são vesículas gigantes lipídicas de polímero híbrido4,5.
O objetivo desses métodos é obter medição confiável da compresibilidade da área e moduli de flexão da membrana, bem como seu estresse e tensão de lyse. Uma das técnicas mais comuns existentes para medir a rigidez de flexão de uma vesícula gigante é a análise de flutuação6,7,com base na observação direta do microscópio de vídeo; mas isso requer grande flutuação visível da membrana, e não é sistematicamente obtido em membranas espessas (por exemplo, polimémersos). Modulus de compresibilidade de área pode ser determinada experimentalmente usando a técnica Langmuir Blodgett, mas na maioria das vezes em um monocamada8. A técnica de aspiração micropipette permite a medição de ambos moduli em um bicamada formando vesícula unilamellar gigante (GUV) em um experimento.
O seguinte método é apropriado para todas as moléculas ou macromoléculas anfofílicas capazes de formar bicamadas e, consequentemente, vesículas por eletroformação. Isso requer um caráter fluido do bicamada à temperatura da eletroformação.
Protocolo
1. Fabricação de micropipettes
NOTA: Aqui, micropipettes com um diâmetro interno que variam de 6 a 12 μm e um comprimento de cone em torno de 3-4 mm são necessários. Um método detalhado de fabricação de micropipette é descrito no seguinte.
- Coloque o capilar de vidro borosilicato na barra de desenho do puxador e corrigir uma das extremidades, apertando o botão.
- Cuidadosamente deslize o vidro através dos buracos ao lado da câmara do aquecedor.
- Aperte o botão de aperto do outro lado.
- Controle o tamanho da ponta e o comprimento do taper para conseguir as especificações desejadas. Para isso, otimizar parâmetros técnicos como temperatura de aquecimento, tração, velocidade, atraso e pressão. Aqui está um exemplo de um programa usado:
Calor: 550 °C
Puxar: 10 (Alcance da máquina: 0-255 em unidades arbitrárias)
Velocidade: 30 (Alcance: 0-255 em unidades arbitrárias)
Atraso: 1 (Intervalo: 0-255 em unidades arbitrárias)
Pressão: 500 (Alcance: 0-999 em unidades arbitrárias) - Clique no PULL para executar os eventos definidos pelo programa. O capilar é então separado em duas micropipettes, cujas dimensões têm de ser ajustadas através de uma microforja.
- Insira a micropipette no suporte de pipeta de metal da microforja (ver Figura 1). Usando o objetivo 10x, ajuste o estágio do microscópio e o manipulador da pipeta (movimento vertical e horizontal) até que a ponta da pipeta esteja perto da superfície do grânulo de vidro.
- Pressione o interruptor do pé para derreter a conta de vidro. Abaixe a ponta e coloque-a em contato com a conta de vidro derretido. O vidro derretido fluirá na pipeta pela ação capilar. Espere alguns segundos até que o nível do vidro derretido atinja uma certa altura, como mostrado na inserção da Figura 1.
- Pare o aquecimento removendo a pressão no interruptor do pé, e puxe rapidamente a ponta afastado usando o manipulador vertical da pipeta para causar uma ruptura afiada.
- Repita os passos 1,7 e 1,8 até que o diâmetro desejado seja obtido (6 a 12 μm).
NOTA: Para melhorar a precisão da medição do diâmetro, durante a última etapa, use um objetivo 32x equipado com um reticle.
2. Revestimento dicas pipette com BSA (albumina séte bovina)
- Para preparar uma solução de 0,1 M de glicose contendo 1% wt. BSA em água pura.
- Pese 180 mg de pó de glicose, coloque em um tubo cônico de polipropileno de 15 mL e complete com 10 mL de água pura.
- Adicione 0,1 g de pó BSA e agite suavemente usando um misturador rotatório tubo de ensaio até a dissolução completa (aproximadamente 4 h).
- Tome a solução com uma seringa ler descartável de 10 mL equipada com uma agulha. Uma vez preenchido, retire a agulha e instale um filtro de celulose de acetato de 0,22 μm. Preencha vários tubos de microcentrífuga de polipropileno (1,5 mL) que serão usados para mergulhar a ponta.
- Coloque os capilares verticalmente em suportes. Abaixe o suporte e mergulhe a ponta na solução da glicose/BSA durante a noite. A solução deve aumentar cerca de 1 cm de altura por ação capilar.
- Retire a ponta da pipeta da solução de glicose/BSA. Prepare 5 mL de solução de glicose de 0,1 M (diluir 90 mg de pó de glicose em 5 mL de água pura) e filtrar através de um filtro de celulose de acetato de 0,22 μm.
- Encha a pipeta com a solução de glicose usando uma seringa de vidro 500 μL equipada com um capilar de sílica fundido flexível. Em seguida, retire toda a solução de glicose, sugando-o de volta e descartá-lo (Figura 2). Repita esta etapa várias vezes para remover o BSA ilimitado.
3. Formação de GUVs e GHUVs por eletroformação
NOTA: A eletroformação é um técnico comumente usado desenvolvido por Angelova9. Os procedimentos para obter uma câmara de eletroformação, depositar um filme lipídico ou polímero (ou ambos para GHUVs (Vesículas Unilamellares Híbridos Gigantes)) e hidratar o filme um campo elétrico alternativo são descritos no seguinte. O procedimento de coleta do GUV obtido também é descrito.
- Preparação de soluções de anfifilos, sacarose e glicose
- Prepare uma solução de anfifilos a uma concentração de 1 mg/mL. Pese 10 mg de anfifilo e dissolva-se em 10 mL de clorofórmio. Mantenha a solução em frascos selados para evitar a evaporação solvente.
- Prepare uma solução de estoque de 1,2-dioleoyl-sn-glycero-3-fosfoetanolamina-N-(lissamina rhodamina B sulfonyl) (DOPE-Rhod) em 1 mg/mL em clorofórmio.
- Adicione 10 μL de solução lipídica fluorescente à solução de anfifilos. Mantenha as soluções em frascos selados para evitar a evaporação solvente.
- Prepare soluções de sacarose e glicose a uma concentração de 0,1 M. Pesa 342 mg e 180 mg de sacarose e glicose, respectivamente, e dissolva-as em 10 mL de água pura.
- Preparação da câmara de eletroformação
NOTA: Diferentes materiais condutores podem ser usados para fazer um dispositivo de eletroformação (por exemplo, fios de platina10, agulhas inoxidáveis11). A câmara de eletroformação é composta por dois slides ITO separados por um espaçador de borracha O-ring que foi cortado de um lado para criar uma abertura. Os slides estão conectados a um gerador de tensão através de dois fios elétricos (Figura 3 e Figura 4A).- Limpe os slides de ITO com solvente orgânico (por exemplo, clorofórmio). Identifique a superfície condutora usando um ohmmeter.
- Anexe os fios elétricos no lado condutor usando fita adesiva.
- Depoimento de solução anfífilo
- Mergulhe um capilar na solução até que o nível aumente pela ação capilar e colete cerca de 5 μL da solução.
- Coloque o capilar em contato com o centro da placa de vidro ITO e espalhe suavemente a solução. Espere 10 segundos para garantir a evaporação completa solvente(Figura 4A).
- Repita este procedimento 3 vezes para cada lado.
- Adicione uma camada de graxa livre de silício em ambos os lados do espaçador de anel O aberto. Coloque-o ao redor da área de depoimento. Coloque o rosto condutor da segunda placa de vidro ITO na parte superior do espaçador.
- Coloque a câmara de eletroformação vácuo por 3 horas para remover quaisquer vestígios de solvente orgânico.
- Procedimento de eletroformação
- Ligue os fios elétricos ao gerador.
- Use as seguintes configurações para o gerador:
Tensão sinusoidal alternativa
Frequência: 10 Hz
Amplitude: 2 Vde pico a pico
NOTA: A frequência e a duração da tensão ideal devem ser encontradas para cada sistema. - Certifique-se de que a tensão é aplicada antes da injeção da solução na câmara.
- Injete 1 mL de solução usando uma seringa com agulha de diâmetro interno de 0,8 mm para encher a câmara. Remova bolhas eventuais.
- Deixe a câmara a tensão aplicada/frequência por 75 min(Figura 4B).
- GUVs colheita
- Desligue o gerador.
- Usando seringa de 1 mL com agulha de diâmetro interno de 0,8 mm, sugar uma pequena parte da solução, a fim de produzir uma bolha de ar dentro da câmara. Incline ligeiramente a câmara, a fim de fazer esta bolha se mover dentro da câmara. Isso pode ajudar os GUVs a se separarem da superfície ito(Figura 4C).
- Sugar toda a solução e transferi-lo para um tubo de plástico 1 mL.
- Retire os fios e limpe os slides de ITO com solventes orgânicos (tolueno, em seguida, clorofórmio).
4. Micromanipulação criada
NOTA: O princípio da aspiração micropipette é sugar uma única vesícula através de uma micropipette de vidro, aplicando uma depressão. O comprimento da língua dentro da pipeta é medido em função da pressão de sucção. O revestimento de pipeta com BSA, descrito anteriormente, é essencial para prevenir ou minimizar qualquer adesão entre as membranas vesículas e a pipeta.
O protocolo é ilustrado abaixo.
- Conexão cheia de tubulação e água do reservatório
NOTA: O tanque cheio de água e o micrômetro são fixados a uma placa deslizante. Um contador digital com uma cabeça de micrômetro permite um deslocamento vertical do dispositivo em uma faixa de 0 a 2,5 cm e uma precisão de 1 μm. Uma tubulação de silício conecta o reservatório e o suporte capilar(Figura 5A).- Encha o tanque com água pura. Conecte uma seringa descartável de 5 mL ao suporte capilar do metal através da tubulação do silicone e aspira para criar um fluxo de água do tanque ao suporte.
- Toque o tubo ligeiramente para eliminar bolhas de ar. Simultaneamente, levante o tanque de água para criar uma pressão positiva. A seringa de 5 mL ainda está ligada ao suporte.
- Após o revestimento e a limpeza de etapas descritas previamente (veja a etapa 2), encha um capillary com a solução da glicose até que uma gota dê forma na extremidade. Retire a tubulação de seringa do suporte de metal para criar um ligeiro fluxo de água em sua extremidade.
- Vire o capilar de cabeça para baixo e conecte a queda de glicose com o fluxo de água do suporte. Corrigir o capilar e o titular, ferrando-os juntos.
- Posicione uma pipeta
NOTA: Durante esta operação, o tanque de água ainda está posicionado no trilho de alumínio para manter uma pressão positiva.- Pegue o palco de alumínio caseiro equipado com duas lâminas de vidro (anteriormente limpo com etanol) e cole-os com graxa de vácuo de cada lado. Instalá-lo no estágio do microscópio e formar um menisco entre os dois slides usando uma seringa de 1 mL contendo 0,1 M de glicose, como mostrado na Figura 5B, C.
- Coloque a pipeta e seu suporte na unidade motora do micromanipulador e aperte o botão de aperto.
- Use o joystick do painel de controle na modalidade grosseira para abaixar o micropipette perto do menisco da glicose. Ajuste a posição da ponta para o centro do menisco usando o modo fino.
- Segure a ponta imersa em glicose por alguns minutos para limpar sua superfície externa e interna (como uma pressão positiva é mantida, o fluxo de água vai enxaguar a superfície interna da pipeta para remover BSA não revestido).
- Guarde a posição da ponta no teclado micromanipulador e retire-a do menisco.
- Retire o menisco de glicose e substituí-lo por um fresco. Chupar 2 μL de GUVs em 0,1 M sacarose usando uma micropipette de 20 μL e coloque-a no menisco de glicose fresca. Observe no modo DIC (contraste de interferência diferencial) os GUVs localizados na parte inferior devido à diferença de densidade entre a sacarose (principalmente dentro do GUVs) e a glicose (principalmente fora dos GUVs).
- Quando as vesículas são ligeiramente esvaziadas, reinserir a pipeta de sucção e se concentrar na ponta. Definir a altura H0 do tanque de água para o qual a pressão é quase 0. Para isso, aproveite as pequenas vesículas ou partículas que estão naturalmente presentes na solução e ajustar a altura do tanque de água até que o movimento dessas partículas seja interrompido.
- Neste ponto, cercar o menisco com óleo mineral para evitar a evaporação da água, ver Figura 5D.
NOTA: A temperatura ambiente deve ser controlada entre 20-22 °C usando ar condicionado.
- Experimento de aspiração micropipette
- Abaixe a ponta da pipeta (6-12 μm no diâmetro) e crie uma sucção pequena (-1 cm) para aspirar uma vesícula (15-30 μm no diâmetro). A membrana do vesícula selecionado deve flutuar ligeiramente, e não deve apresentar quaisquer defeitos visíveis (sem bud ou filamento) (Figura 6).
- Elevá-lo a pipeta a um nível mais elevado para isolar a vesícula aspirada das outras vesículas, usando o micromanipulador e manter esta posição durante todo o experimento.
- Pré-estresse da vesícula, reduzindo o tanque cheio de água para aproximadamente -10 cm, em seguida, diminuir a pressão para retornar ao seu valor inicial (-1 cm). Repita esta etapa várias vezes para remover o excesso de membrana e pequenos defeitos da membrana.
- A partir de uma altura de -0,5 cm definida pela posição do tanque de água, diminuir lentamente a pressão de sucção com o micrômetro para chegar a um regime em que a membrana flutua. Em seguida, aumentar a pressão para visualizar claramente uma língua na ponta com um comprimento de projeção significativa (alguns mícrons).
NOTA: A menor pressão aplicada (P0)que permite sugar o menor comprimento de projeção de membrana (L0)definirá o ponto de referência α0 (Figura 7A). Todos os pontos da curva serão medidos de acordo com esta referência (ΔL = L-L0 e ΔP = P-P0). - Aumentar a pressão de sucção com o micrômetro de forma passo a passo até atingir 0,5 -0,8 mN/m. A cada passo, espere 5 s e tire uma foto da língua. Este procedimento em baixa tensão permite a determinação do modulus da dobra.
- Continue aumentando a pressão de sucção de 0,5 mN/m para a tensão de ruptura, ajustando a altura da água cheia deslizando no trilho (variando de -2 a -50 cm) (Figura 7B-D). A partir deste experimento em regime de alta tensão, a área de compresibilidade modulus, tensão de lyse e tensão de lyse será medida.
- Estique cerca de 15-20 vesículas para adquirir estatísticas significativas. Cada experimento de aspiração micropipette leva entre 7 e 10 minutos. Realize a análise de imagem usando o software LASAF para medir o comprimento de projeção da língua, o diâmetro das vesículas e o raio do capilar.
- Medição de modulus de flexão, modulus de compresibilidade da área, tensão de lyse e tensão de lyse
- Para acessar esses parâmetros, use o formalismo estabelecido por E. Evans12. Calcule a pressão de sucção aplicada sobre a membrana da equação 1:
Δ P = ρwg (h-h0) (1)
onde g é a aceleração gravitacional (9,8 m ' s−2), ρw é a densidade da água (ρ = 1 gº cm−3),h é a posição do tanque de água e h0 é a posição inicial onde a pressão é igual a zero. - Calcule a tensão da membrana da equação de Laplace:
 (2)
(2)
onde δp é a pressão de sucção sobre a micropipette, Rp e Rv são a micropipette e vesicle radii (fora da micropipette), respectivamente. A tensão da área de superfície (α) da membrana é definida como: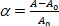 (3)
(3)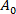 sendo a área de membrana da vesícula na menor pressão de sucção.
sendo a área de membrana da vesícula na menor pressão de sucção. - Calcule α a partir do aumento do comprimento de projeção δl de vesícula dentro da ponta capilar de acordo com a Equação 412:
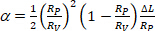 (4)
(4) - um regime de tensão muito baixa, a suavização das ondulações térmicas dobrando domina a aparente expansão. Enredo ln (σ) vs α. Em valores de baixo-σ (tipicamente 0,001-0,5 mN.m−113),isso dá uma linha reta cuja inclinação está ligada ao modulus flexão, Kb (primeiro mandato da equação 5)14:
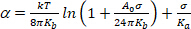 (5)
(5)
NOTA: altas tensões (> 0.5 mN.m−1),ondulações de membrana são completamente suprimidas e a área da membrana aumenta como resultado do aumento do espaçamento entre moléculas. Neste regime, o segundo mandato da equação 5 domina e dá acesso à compresibilidade da área modulus Ka (Figura 8 e Figura 9).
- Para acessar esses parâmetros, use o formalismo estabelecido por E. Evans12. Calcule a pressão de sucção aplicada sobre a membrana da equação 1:
Resultados
Com o protocolo acima mencionado, estudamos diferentes vesículas unilamellares sintéticas (GUV), obtidas a partir de um fosfolípido: 2-oleoyl-1-palmitoyl-sn-glycero-3-fosfocolina (POPC), um polímero tribloco: Poli (etileóxido)-b-Poly (dimetilsiloxane) -b-Poly (etilenoóxido) (PEO12-b-PDMS43-b-PEO12) sintetizado em um estudo anterior13, e um diblock copolímero Poly (dimetilsiloxane) ...
Discussão
O revestimento da micropipette é um dos pontos-chave para obter medições confiáveis. A adesão da vesícula à micropipette deve ser evitada, e um revestimento é comumente usado na literatura17,18,19,20,21,com BSA, β-casein ou surfasil. Detalhes do procedimento de revestimento raramente são mencionados.
A dissolução da BSA ...
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores reconhecem com gratidão a ANR pelo apoio financeiro (ANR Sysa).
Materiais
| Name | Company | Catalog Number | Comments |
| Required equipment and materials for micropipette design | |||
| Borosilicate Glass Capillaries | World Precision Instruments | 1B100-4 | external and internal diameter of 1mm and 0.58 mm respectively. |
| Filament installed | Sutter Instrument Co. | FB255B | 2.5mm*2.5mm Box Filament |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | Model P-97 | |
| Microforge | NARISHGE Co. | MF-900 | fitted with two objectives (10x and 32x) |
| Materials for coating pipette tips with BSA | |||
| Bovine Serum Albumin Fraction V (BSA) | Sigma-Aldrich | 10735078001 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| Disposable 10 ml syringe Luer Tip | Codan | 626616 | |
| Disposable 5 ml syringe Luer Tip | Codan | 62.5607 | |
| Disposable acetate cellulose filter | Cluzeau Info Labo | L5003SPA | Pore size: 0.22µm, diameter: 25mm |
| Flexible Fused Silica Capillary Tubing | Polymicro Technologies. | TSP530660 | Inner Diameter 536µm, Outer Diameter 660µm, |
| Glucose | Sigma-Aldrich | G5767 | |
| Syringe 500 µL luer Lock GASTIGHT | Hamilton Syringe Company | 1750 | |
| Test tube rotatory mixer | Labinco | 28210109 | |
| Micromanipulation Set up | |||
| Aluminum Optical Rail, 1000 mm Length, M4 threads, X48 Series | Newport | ||
| Damped Optical Table | Newport | used as support of microscope to prevent external vibrations. | |
| Micromanipulator | Eppendorf | Patchman NP 2 | The module unit (motor unit for X, Y and Z movement) is mounted on the inverted microscope by the way of an adapter. |
| Micrometer | Mitutoyo Corporation | 350-354-10 | Digimatic LCD Micrometer Head 25,4 mm Range 0,001 mm |
| Plexiglass water reservoir (100 ml) | Home made | ||
| TCS SP5 inverted confocal microscope (DMI6000) equipped with a resonant scanner and a water immersion objective (HCX APO L 40x/0.80 WU-V-I). | Leica | ||
| X48 Rail Carrier 80 mm Length,with 1/4-20, 8-32 and 4-40 thread | Newport | ||
| Materials for sucrose and amphiphile solution preparation | |||
| 2-Oleoyl-1-palmitoyl-sn-glycero-3-phosphocholine | Sigma-Aldrich | ||
| Chloroform | VWR | 22711.244 | |
| L-α-Phosphatidylethanolamine-N-(lissamine rhodamine B sulfonyl) | Sigma-Aldrich | 810146C | Rhodamine tagged lipid |
| Sucrose | Sigma-Aldrich | S7903 | |
| Electroformation set up | |||
| 10 µL glass capillary ringcaps | Hirschmann | 9600110 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| H Grease | Apiezon | Apiezon H Grease | Silicon-free grease |
| Indium tin oxide coated glass slides | Sigma-Aldrich | 703184 | |
| Needle | Terumo | AN2138R1 | 0.8 x 38 mm |
| Ohmmeter (Multimeter) | Voltcraft | VC140 | |
| Toluene | VWR | 28676.297 | |
| Voltage generator | Keysight | 33210A |
Referências
- Bangham, A. D., Standish, M. M., Watkins, J. C. Diffusion of univalent ions across the lamellae of swollen phospholipids. Journal of Molecular Biology. 13 (1), (1965).
- Discher, D. E., Eisenberg, A. Polymer vesicles. Science. 297 (5583), 967-973 (2002).
- Hammer, D., et al. Polymersomes: vesicles from block copolymers. Annals of Biomedical Engineering. 28 (SUPPL. 1), (2000).
- Le Meins, J. F., Schatz, C., Lecommandoux, S., Sandre, O. Hybrid polymer/lipid vesicles: state of the art and future perspectives. Materials Today. 16 (10), 397-402 (2013).
- Schulz, M., Binder, W. H. Mixed Hybrid Lipid/Polymer Vesicles as a Novel Membrane Platform. Macromolecular Rapid Communications. 36, 2031-2041 (2015).
- Schneider, M. B., Jenkins, J. T., Webb, W. W. Thermal fluctuations of large quasi-spherical bimolecular phospholipid vesicles. Journal De Physique. 45 (9), 1457-1472 (1984).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Advances in Colloid and Interface Science. 208, 225-234 (2014).
- Rodríguez-García, R., et al. Polymersomes: smart vesicles of tunable rigidity and permeability. Soft Matter. 7 (4), 1532-1542 (2011).
- Angelova, M. I., Dimitrov, D. S. Liposome electroformation. Faraday Discussions of the Chemical Society. 81, 303-311 (1986).
- Dao, T. P. T., et al. Membrane properties of giant polymer and lipid vesicles obtained by electroformation and pva gel-assisted hydration methods. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 533, 347-353 (2017).
- Pereno, V., et al. Electroformation of Giant Unilamellar Vesicles on Stainless Steel Electrodes. ACS omega. 2 (3), 994-1002 (2017).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Physical Review Letters. 64 (17), 2094-2097 (1990).
- Dao, T. P. T., et al. Modulation of phase separation at the micron scale and nanoscale in giant polymer/lipid hybrid unilamellar vesicles (GHUVs). Soft Matter. 13 (3), 627-637 (2017).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 11 (11), 693-703 (1973).
- Dao, T. P. T., et al. The combination of block copolymers and phospholipids to form giant hybrid unilamellar vesicles (GHUVs) does not systematically lead to "intermediate'' membrane properties. Soft Matter. 14 (31), 6476-6484 (2018).
- Shoemaker, S. D., Kyle Vanderlick, T. Material Studies of Lipid Vesicles in the Lα and Lα-Gel Coexistence Regimes. Biophysical Journal. 84 (2), 998-1009 (2003).
- Longo, M. L., Ly, H. V., Dopico, A. M. . Methods in Membrane Lipids. , 421-437 (2007).
- Chen, D., Santore, M. M. Hybrid copolymer-phospholipid vesicles: phase separation resembling mixed phospholipid lamellae, but with mechanical stability and control. Soft Matter. 11 (13), 2617-2626 (2015).
- Mabrouk, E., et al. Formation and material properties of giant liquid crystal polymersomes. Soft Matter. 5, 1870-1878 (2009).
- Henriksen, J., et al. Universal behavior of membranes with sterols. Biophysical Journal. 90 (5), 1639-1649 (2006).
- Ly, H. V., Block, D. E., Longo, M. L. Interfacial Tension Effect of Ethanol on Lipid Bilayer Rigidity, Stability, and Area/Molecule: A Micropipet Aspiration Approach. Langmuir. 18 (23), 8988-8995 (2002).
- Bermudez, H., Hammer, D. A., Discher, D. E. Effect of Bilayer Thickness on Membrane Bending Rigidity. Langmuir. 20, 540-543 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados