Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Обслушание гигантских unilamellar гибридных пузырьков электроформации и измерения их механических свойств Micropipette аспирации
В этой статье
Резюме
Цельпротокола состоит в том, чтобы надежно измерить мембранные механические свойства гигантских пузырьков с помощью микропипетики аспирации.
Аннотация
Гигантские пузырьки, полученные из фосфолипидов и кополимеров, могут быть использованы в различных областях применения: контролируемая и целенаправленная доставка лекарств, биомолекулярное распознавание в биосенсорах для диагностики, функциональные мембраны для искусственных клеток и разработка биовдохновленных микро/нанореакторов. Во всех этих приложениях характеристика их мембранных свойств имеет основополагающее значение. Среди существующих методов характеристик, микропайпет аспирации, впервые E. Эванс, позволяет измерения механических свойств мембраны, такие как модуля сжатия области, изгиб модуля и лизис напряжения и деформации. Здесь мы представляем все методологии и подробные процедуры получения гигантских пузырьков из тонкой пленки липидов или copolymer (или обоих), производство и поверхностная обработка микропипететов, а также процедуру аспирации, приводящую к измерению всех ранее упомянутых параметров.
Введение
Гигантские пузырьки, полученные из фосфолипидов (липосомы) широко используются с 1970-х годов в качестве основной модели клеточной мембраны1. В конце 1990-х годов везикулярные морфологии, полученные из самосборки кополимеров, названных полимеромпомы по отношению к их липидным аналогам2,3, быстро появились как интересная альтернатива липосом, обладающим слабой механической устойчивостью и плохой модульной химической функциональностью. Однако, их биомиметический характер клетки довольно лимитирован сравненный к липосомам в виду того что последние составлены фосфолипидов, главным образом компонентом мембраны клетки. Кроме того, их низкая проницаемость мембраны может быть проблемой в некоторых приложениях, таких как доставка лекарств, где требуется контролируемое распространение видов через мембрану. В последнее время, связь фосфолипидов с блоком кополимеров для разработки гибридных полимерно-липидных пузырьков и мембран был предметом все большего числа исследований4,5. Основная идея заключается в разработке объектов, которые синергетически сочетают преимущества каждого компонента (биофункциональность и проницаемость липидных бислой с механической стабильностью и химической универсальностью полимеров), которые могут быть использованы в различных приложениях: контролируемая и целевая доставка лекарств, биомолекулярное распознавание в рамках биосенсоров для диагностики, функциональные мембраны для искусственных клеток, развитие био-вдохновленных микро-/нанореакторов.
В настоящее время различные научные сообщества (биохимики, химики, биофизики, физики-химики, биологи) проявляют все больший интерес к разработке более продвинутой модели клеточных мембран. Здесь наша цель состоит в том, чтобы представить, как подробно, как это возможно, существующие методологии (электроформация, микропипетус аспирации), чтобы получить и охарактеризовать механические свойства гигантских пузырьков и последние "продвинутые" модели клеточных мембран, которые являются гибридными полимерными липидными гигантскими пузырьками4,5.
Целью этих методов является получение надежного измерения области сжатия и изгиба модули мембраны, а также их лиза т.д. напряжения и напряжения. Одним из наиболее распространенных методов, существующих для измерения жесткости изгиба гигантского везикулы является анализ колебаний6,7, на основе прямого наблюдения видеомикроскопа; но это требует больших видимых колебаний мембран и не получается систематически на толстых мембранах (например, полимеросомы). Модули сжатия области можно экспериментально определить с помощью техники Langmuir Blodgett, но чаще всего на монослой8. Метод аспирации микропипет позволяет измерять оба модули на двухслойном, образуя гигантский unilamellar vesicle (GUV) в одном эксперименте.
Следующий метод подходит для всех молекул амфифилов или макромолекул, способных образовывать двуслойные и, следовательно, пузырьки электроформации. Это требует жидкого характера двухслойного при температуре электроформации.
протокол
1. Изготовление микропайпетов
ПРИМЕЧАНИЕ: Здесь, micropipettes с внутренним диаметром от 6 до 12 мкм и конус длиной около 3-4 мм необходимы. Подробный метод производства микропипетты описан в следующем.
- Поместите боросиликатный стеклянный капилляр в ящик шкива и зафиксировать один из концов, затягивая ручку.
- Тщательно сдвиньте стекло через отверстия сбоку от нагревательной камеры.
- Затяните ручку зажима на другом конце.
- Управление размером наконечника и конусной длины для достижения желаемых спецификаций. Для этого оптимизируйте технические параметры, такие как температура нагрева, тяга, скорость, задержка и давление. Вот пример используемой программы:
Тепло: 550 градусов по Цельсию
Потяните: 10 (Диапазон машины: 0-255 в произвольных единицах)
Скорость: 30 (Диапазон: 0-255 в произвольных единицах)
Задержка: 1 (Диапазон: 0-255 в произвольных единицах)
Давление: 500 (Диапазон: 0-999 в произвольных единицах) - Нажмите на PULL, чтобы выполнить события, определенные программой. Затем капилляры разделены на две микропипетты, размеры которых должны быть скорректированы с помощью микрокузнии.
- Вставьте микропипетт в держатель металлической пипетки микрокузе (см. рисунок 1). С помощью 10x цели, настроить микроскоп этапе и пипетки манипулятор (вертикальное и горизонтальное движение) до pipette наконечник близко к стеклянной поверхности бисера.
- Нажмите на выключатель ноги, чтобы расплавить стеклянную бисер. Опустите кончик и соприкасайтесь с расплавленным стеклянным бисером. Расплавленное стекло будет поступать в пипетку капиллярным действием. Подождите несколько секунд, пока уровень расплавленного стекла не достигнет определенной высоты, как показано на вставке на рисунке 1.
- Остановите нагревание, сняв давление на выключатель стопы, и быстро вытащите кончик с помощью вертикального манипулятора пипетки, чтобы вызвать резкий разрыв.
- Повторите шаги 1.7 и 1.8 до получения желаемого диаметра (от 6 до 12 мкм).
ПРИМЕЧАНИЕ: Для повышения точности измерения диаметра, во время последнего шага, используйте 32x цель оснащена ретиком.
2. Покрытие пипетка советы с BSA (буйный сывороточный альбомин)
- Для приготовления 0,1 М раствор глюкозы, содержащий 1% ВТ. BSA в чистой воде.
- Взвесить 180 мг порошка глюкозы, поместите в 15 мл полипропиленовой конической трубки и в комплекте с 10 мл чистой воды.
- Добавьте 0,1 г порошка BSA и осторожно встряхните с помощью вращающей сяротной смеситель пробирки до полного растворения (примерно 4 ч).
- Возьмите раствор с 10 мл одноразовый шприц Luer оснащен иглой. После заполнения, удалить иглу и установить 0,22 мкм ацетат целлюлозы фильтр. Заполните несколько полипропиленовых микроцентрифуговых трубок (1,5 мл), которые будут использоваться для погружения кончика.
- Поместите капилляры вертикально в держатели. Опустите держатель и погрузите кончик в раствор глюкозы/BSA на ночь. Раствор должен подниматься высотой около 1 см при капиллярном действии.
- Удалите наконечник пипетки из раствора глюкозы/BSA. Приготовьте 5 мл раствора глюкозы 0,1 М (разбавить 90 мг порошка глюкозы в 5 мл чистой воды) и процедите через фильтр целлюлозы 0,22 мкм.
- Заполните пипетку раствором глюкозы с помощью стеклянного шприца 500 л, оснащенного гибким сросшимся капиллярами кремнезема. Затем, удалить все раствор глюкозы, сосать его обратно и отказаться от него (Рисунок 2). Повторите этот шаг несколько раз, чтобы удалить неограниченный BSA.
3. Формирование ГУВИ и ГХУВ путем электроформации
ПРИМЕЧАНИЕ: Электроформация является широко используемой техникой, разработанной Ангеловой9. Процедуры получения электроформации камеры, отложения липидной или полимерной пленки (или как для GHUV (Giant Hybrid Unilamellar Vesicles)) и гидратируют пленку под альтернативным электрическим полем описаны в следующем. Описана также процедура сбора полученного ГУВ.
- Амфифил, препарат из сахарозы и глюкозы
- Приготовьте раствор амфифилов в концентрации 1 мг/мл. Взвесить 10 мг амфифила и растворить в 10 мл хлороформа. Храните раствор в герметичных флаконах, чтобы избежать испарения растворителя.
- Подготовьте стоковый раствор 1,2-диолеой-сна -глицеро-3-фосфоэтаноламин-N-(лиссамин родамин B сульфонил) (DOPE-Rhod) при 1 мг/мл в хлороформе.
- Добавьте 10 л флуоресцентного липидного раствора в раствор амфифила. Храните растворы в запечатанных флаконах, чтобы избежать испарения растворителя.
- Приготовьте сахарозы и растворы глюкозы в концентрации 0,1 М. Взвесьте 342 мг и 180 мг сахарозы и глюкозы соответственно, и растворите их в 10 мл чистой воды.
- Подготовка камеры электроформации
ПРИМЕЧАНИЕ: Различные проводящие материалы могут быть использованы для создания электроформации устройства (например, платиновые провода10,нержавеющей иглы11). Камера электроформации состоит из двух слайдов ITO, разделенных резиновым прокладкой O-ring, которая была вырезана с одной стороны для создания диафрагмы. Слайды соединены с генератором напряжения двумя электрическими проводами(рисунок 3 и рисунок 4А).- Очистите слайды ITO органическим растворителем (например, хлороформом). Определите проводящую поверхность с помощью омметра.
- Прикрепите электрические провода на проводящей стороне с помощью клейкой ленты.
- Осаждение раствора амфифилов
- Опустите капилляр в раствор до тех пор, пока уровень не повысится капиллярным действием, и соберите около 5 злицу раствора.
- Положите капилляр в контакт с центром стеклянной пластины ITO и аккуратно распределите раствор. Подождите 10 секунд, чтобы обеспечить полное испарение растворителя(рисунок 4A).
- Повторите эту процедуру 3 раза для каждой стороны.
- Добавьте слой кремниевого смазки с обеих сторон открытого прокладки O-кольца. Положите его вокруг области осаждения. Поместите проводящую грань второй стеклянной пластины ITO на верхнюю часть прокладки.
- Поместите камеру электроформации под вакуум на 3 часа, чтобы удалить любые следы органического растворителя.
- Процедура электрообразования
- Подключите электрические провода к генератору.
- Используйте следующие настройки для генератора:
Альтернативное синусоидное напряжение
Частота: 10 Гц
Амплитуда: 2 Vпик-к-пик
ПРИМЕЧАНИЕ: Оптимальная частота напряжения и продолжительность должны быть найдены для каждой системы. - Убедитесь, что напряжение применяется перед инъекцией раствора в камере.
- Введите 1 мл раствора с помощью шприца с иглой внутреннего диаметра 0,8 мм для заполнения камеры. Удалите возможные пузыри.
- Пусть камера под прикладным напряжением/частотой в течение 75 мин(рисунок 4B).
- Урожай ГУВ
- Выключите генератор.
- Используя 1 мл шприца с иглой внутреннего диаметра 0,8 мм, сосать небольшую часть раствора для того, чтобы произвести пузырь воздуха внутри камеры. Слегка наклоните камеру, чтобы заставить этот пузырь двигаться внутри камеры. Это может помочь GUVs отделить от поверхности ITO(Рисунок 4C).
- Сосать все растворить и передать его в 1 мл пластиковой трубки.
- Удалите провода и очистите слайды ITO органическими растворителями (толуол, затем хлороформ).
4. Установка микроманипуляций
ПРИМЕЧАНИЕ: Принцип микропайпета стремление сосать один везикул через стеклянный микропипет, применяя депрессии. Длина языка внутри пипетки измеряется как функция всасывающего давления. Покрытие пипетки с BSA, описанное ранее, имеет важное значение для предотвращения или минимизации каких-либо сливок между весиковыми мембранами и пипеткой.
Протокол проиллюстрирован ниже.
- Пипетка и заполненная водой соединение резервуара
ПРИМЕЧАНИЕ: Заполненный водой резервуар и микрометр крепятся к раздвижной пластине. Цифровой счетчик с микрометровой головкой позволяет вертикальное смещение устройства в диапазоне от 0 до 2,5 см и точностью от 1 мкм. Перемещение вдоль алюминиевой оптической железной дороги возможно до 1 метра в длину. Силиконовая трубка соединяет резервуар и держатель капилляра(рисунок 5А).- Заполните бак чистой водой. Соедините одноразовый 5 мл шприца к держателю капиллярного металла с помощью силиконовых труб и аспирируйте для создания потока воды из резервуара в держатель.
- Прикоснитесь к трубке немного, чтобы устранить пузырьки воздуха. Одновременно поднимите резервуар для воды, чтобы создать положительное давление. Шприц 5 мл по-прежнему крепится к держателю.
- После покрытия и очистки шаги, описанные ранее (см. шаг 2), заполнить капилляр с раствором глюкозы до капли формы в конце. Удалите шприц трубки из металлического держателя, чтобы создать небольшой поток воды в его конце.
- Переверните капилляр вверх дном и соедините падение глюкозы с потоком воды из держателя. Исправить капилляр и держатель, завинчивая их вместе.
- Позиция пипетки
ПРИМЕЧАНИЕ: Во время этой операции, резервуар для воды по-прежнему расположен на алюминиевой железной дороге для поддержания положительного давления.- Возьмите самодельный алюминиевой этап оснащен двумя стеклянными слайдами (ранее очищенные этанолом) и приклейте их вакуумной смазкой с каждой стороны. Установите его на стадии микроскопа и сформировать мениск между двумя слайдами с помощью шприца 1 мл, содержащего 0,1 М глюкозы, как показано на рисунке 5B,C.
- Поместите пипетку и ее держатель на моторную установку микроманипулятора и затяните зажимручку ручки.
- Используйте джойстик панели управления в грубом режиме, чтобы снизить микропипетик вблизи мениска глюкозы. Отрегулируйте положение наконечника к центру мениска с помощью тонкого режима.
- Держите кончик, погруженный в глюкозу, в течение нескольких минут, чтобы очистить его внешнюю и внутреннюю поверхность (как положительное давление поддерживается, поток воды будет промыть внутреннюю поверхность пипетки, чтобы удалить непокрытую BSA).
- Храните положение наконечника на клавиатуре микроманипулятора и снимите его с мениска.
- Удалить глюкозный мениск и заменить его свежим. Сосать 2 Л ГУВ в 0,1 М сахарозы с помощью 20 мл микропипетты и положить его в свежий мениск глюкозы. Наблюдайте в режиме DIC (контраст дифференциальной интерференции) ГУВ, расположенные внизу из-за разницы плотности между сахарозой (в основном внутри ГУВ) и глюкозой (в основном за пределами ГУВ).
- Когда пузырьки слегка спущены, восстановить всасывающий пипетку и сосредоточьтесь на кончике. Установите высоту H0 резервуара для воды, для которого давление почти 0. Для этого воспользуйтесь небольшими пузырьками или частицами, которые естественным образом присутствуют в растворе, и отрегулируйте высоту резервуара для воды до тех пор, пока движение этих частиц не будет остановлено.
- На данный момент, окружить мениска с минеральным маслом, чтобы предотвратить испарение воды, см. Рисунок 5D.
ПРИМЕЧАНИЕ: Комнатная температура должна контролироваться между 20-22 градусами Цельсия с помощью кондиционирования воздуха.
- Эксперимент аспирации микропипетов
- Опустите наконечник пипетки (6-12 мкм в диаметре) и создайте небольшой всасывание (-1 см), чтобы аспирировать везикул (15-30 мкм в диаметре). Мембрана выбранной везикулы должна слегка колебаться, и не должна представлять никаких видимых дефектов (без бутона или нити)(рисунок 6).
- Поднимите пипетку на более высокий уровень, чтобы изолировать аспирированные везикулы от других пузырьков, используя микроманипулятор и сохранить эту позицию в течение всего эксперимента.
- Предварительно напрягивите везикул, опустив заполненный водой бак примерно до -10 см, затем уменьшите давление, чтобы вернуться к его первоначальному значению (-1 см). Повторите этот шаг несколько раз, чтобы удалить избытки мембраны и небольшие дефекты из мембраны.
- С высоты -0,5 см, определяемой положением резервуара для воды, медленно уменьшайте давление всасывания с микрометром, чтобы достичь режима, в котором мембрана колеблется. Затем увеличьте давление, чтобы четко визуализировать язык в кончике со значительной длиной проекции (несколько микрон).
ПРИМЕЧАНИЕ: Наименьшее применяемое давление (P0),что позволяет всасывать самую маленькую длину проекции мембраны (L0)будет определять точку отсчетаNo 0 (рисунок 7A). Все точки кривой будут измеряться в соответствии с этой ссылкой (Зли- L-L0 и P - P-P0). - Увеличьте давление всасывания с микрометром поэтапно до достижения 0,5 -0,8 мН/м. На каждом шагу, ждать 5 с и сделать снимок языка. Эта процедура при низком напряжении позволяет определить изгиб модуля.
- Продолжайте увеличивать давление всасывания с 0,5 мН/м до разрыва напряжения, регулируя высоту воды, заполняющейся скользящей по рельсу (от -2 до -50 см)(рис. 7Б-Д). Из этого эксперимента при высоком режиме напряжения будут измеряться модуля сжатия области, напряжение лисиса и штамм лиза.
- Растянуть около 15-20 пузырьков для получения значительной статистики. Каждый эксперимент по аспирации микропипетов занимает от 7 до 10 минут. Выполните анализ изображений с помощью программного обеспечения LASAF для измерения длины проекции языка, диаметра пузырьков и радиуса капилляра.
- Измерение изгиба модуля, модуля сжатия области, напряжения лисиса и штамма лиза
- Чтобы получить доступ к этим параметрам, используйте формализм, установленный Э.Эвансом 12. Рассчитайте давление всасывания, применяемое над мембраной из уравнения 1:
ихх0(1)
где g является гравитационное ускорение (9,8 мс 2),w является плотность воды (я 1 г см3),ч является положение резервуара для воды и h0 является исходным положением, где давление равно нулю. - Рассчитайте мембранное напряжение из уравнения Лапласта:
 (2)
(2)
где QP является всасывающее давление на микропипетте, Rp и Rv являются микропайпетии и везикулы радиусы (за пределами микропипетты) соответственно. Напряжение площади поверхности (к) мембраны определяется как: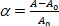 (3)
(3)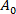 мембранной области везикулы при более низком всасывающем давлении.
мембранной области везикулы при более низком всасывающем давлении. - Рассчитайте: от увеличения длины проекции зЛ везикула внутри капиллярного наконечника в соответствии с уравнением 412:
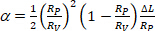 (4)
(4) - При очень низком режиме напряжения, сглаживание теплового изгиба волнообразных доминирует очевидное расширение. Участок Ln (я) против К. При низких значениях (обычно 0,001-0,5 мн.м11)это дает прямую линию, наклон которой связан с изгибом модуля, Kb (первый термин уравнения 5)14:
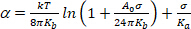 (5)
(5)
ПРИМЕЧАНИЕ: При высокой напряженности (0,5 мн.м.No 1),мембранные волнистые волнообразности полностью подавлены и мембранная область увеличивается в результате увеличения интервала между молекулами. В этом режиме доминирует второй термин уравнения 5 и дает доступ к модулю сжатия областиK a(рисунок 8 и рисунок 9).
- Чтобы получить доступ к этим параметрам, используйте формализм, установленный Э.Эвансом 12. Рассчитайте давление всасывания, применяемое над мембраной из уравнения 1:
Результаты
С вышеупомянутым протоколом, мы изучили различные синтетические гигантские unilamellar везикул (GUV), полученные из фосфолипида: 2-олеоил-1-пальмитоил-сн-глицеро-3-фосфохолин (POPC), триблок кополимер: Поли (этиленоксид)-b --Поли(диметилсилоксан)-b-Поли (этиленоксид) (PEO12...
Обсуждение
Покрытие микропипетта является одним из ключевых моментов для получения надежных измерений. Прилипание везикулы к микропипетету должно быть предотвращено, и покрытие обычно используется в литературе17,18,19,20,
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы с благодарностью признают ANR за финансовую поддержку (ANR Sysa).
Материалы
| Name | Company | Catalog Number | Comments |
| Required equipment and materials for micropipette design | |||
| Borosilicate Glass Capillaries | World Precision Instruments | 1B100-4 | external and internal diameter of 1mm and 0.58 mm respectively. |
| Filament installed | Sutter Instrument Co. | FB255B | 2.5mm*2.5mm Box Filament |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | Model P-97 | |
| Microforge | NARISHGE Co. | MF-900 | fitted with two objectives (10x and 32x) |
| Materials for coating pipette tips with BSA | |||
| Bovine Serum Albumin Fraction V (BSA) | Sigma-Aldrich | 10735078001 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| Disposable 10 ml syringe Luer Tip | Codan | 626616 | |
| Disposable 5 ml syringe Luer Tip | Codan | 62.5607 | |
| Disposable acetate cellulose filter | Cluzeau Info Labo | L5003SPA | Pore size: 0.22µm, diameter: 25mm |
| Flexible Fused Silica Capillary Tubing | Polymicro Technologies. | TSP530660 | Inner Diameter 536µm, Outer Diameter 660µm, |
| Glucose | Sigma-Aldrich | G5767 | |
| Syringe 500 µL luer Lock GASTIGHT | Hamilton Syringe Company | 1750 | |
| Test tube rotatory mixer | Labinco | 28210109 | |
| Micromanipulation Set up | |||
| Aluminum Optical Rail, 1000 mm Length, M4 threads, X48 Series | Newport | ||
| Damped Optical Table | Newport | used as support of microscope to prevent external vibrations. | |
| Micromanipulator | Eppendorf | Patchman NP 2 | The module unit (motor unit for X, Y and Z movement) is mounted on the inverted microscope by the way of an adapter. |
| Micrometer | Mitutoyo Corporation | 350-354-10 | Digimatic LCD Micrometer Head 25,4 mm Range 0,001 mm |
| Plexiglass water reservoir (100 ml) | Home made | ||
| TCS SP5 inverted confocal microscope (DMI6000) equipped with a resonant scanner and a water immersion objective (HCX APO L 40x/0.80 WU-V-I). | Leica | ||
| X48 Rail Carrier 80 mm Length,with 1/4-20, 8-32 and 4-40 thread | Newport | ||
| Materials for sucrose and amphiphile solution preparation | |||
| 2-Oleoyl-1-palmitoyl-sn-glycero-3-phosphocholine | Sigma-Aldrich | ||
| Chloroform | VWR | 22711.244 | |
| L-α-Phosphatidylethanolamine-N-(lissamine rhodamine B sulfonyl) | Sigma-Aldrich | 810146C | Rhodamine tagged lipid |
| Sucrose | Sigma-Aldrich | S7903 | |
| Electroformation set up | |||
| 10 µL glass capillary ringcaps | Hirschmann | 9600110 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| H Grease | Apiezon | Apiezon H Grease | Silicon-free grease |
| Indium tin oxide coated glass slides | Sigma-Aldrich | 703184 | |
| Needle | Terumo | AN2138R1 | 0.8 x 38 mm |
| Ohmmeter (Multimeter) | Voltcraft | VC140 | |
| Toluene | VWR | 28676.297 | |
| Voltage generator | Keysight | 33210A |
Ссылки
- Bangham, A. D., Standish, M. M., Watkins, J. C. Diffusion of univalent ions across the lamellae of swollen phospholipids. Journal of Molecular Biology. 13 (1), (1965).
- Discher, D. E., Eisenberg, A. Polymer vesicles. Science. 297 (5583), 967-973 (2002).
- Hammer, D., et al. Polymersomes: vesicles from block copolymers. Annals of Biomedical Engineering. 28 (SUPPL. 1), (2000).
- Le Meins, J. F., Schatz, C., Lecommandoux, S., Sandre, O. Hybrid polymer/lipid vesicles: state of the art and future perspectives. Materials Today. 16 (10), 397-402 (2013).
- Schulz, M., Binder, W. H. Mixed Hybrid Lipid/Polymer Vesicles as a Novel Membrane Platform. Macromolecular Rapid Communications. 36, 2031-2041 (2015).
- Schneider, M. B., Jenkins, J. T., Webb, W. W. Thermal fluctuations of large quasi-spherical bimolecular phospholipid vesicles. Journal De Physique. 45 (9), 1457-1472 (1984).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Advances in Colloid and Interface Science. 208, 225-234 (2014).
- Rodríguez-García, R., et al. Polymersomes: smart vesicles of tunable rigidity and permeability. Soft Matter. 7 (4), 1532-1542 (2011).
- Angelova, M. I., Dimitrov, D. S. Liposome electroformation. Faraday Discussions of the Chemical Society. 81, 303-311 (1986).
- Dao, T. P. T., et al. Membrane properties of giant polymer and lipid vesicles obtained by electroformation and pva gel-assisted hydration methods. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 533, 347-353 (2017).
- Pereno, V., et al. Electroformation of Giant Unilamellar Vesicles on Stainless Steel Electrodes. ACS omega. 2 (3), 994-1002 (2017).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Physical Review Letters. 64 (17), 2094-2097 (1990).
- Dao, T. P. T., et al. Modulation of phase separation at the micron scale and nanoscale in giant polymer/lipid hybrid unilamellar vesicles (GHUVs). Soft Matter. 13 (3), 627-637 (2017).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 11 (11), 693-703 (1973).
- Dao, T. P. T., et al. The combination of block copolymers and phospholipids to form giant hybrid unilamellar vesicles (GHUVs) does not systematically lead to "intermediate'' membrane properties. Soft Matter. 14 (31), 6476-6484 (2018).
- Shoemaker, S. D., Kyle Vanderlick, T. Material Studies of Lipid Vesicles in the Lα and Lα-Gel Coexistence Regimes. Biophysical Journal. 84 (2), 998-1009 (2003).
- Longo, M. L., Ly, H. V., Dopico, A. M. . Methods in Membrane Lipids. , 421-437 (2007).
- Chen, D., Santore, M. M. Hybrid copolymer-phospholipid vesicles: phase separation resembling mixed phospholipid lamellae, but with mechanical stability and control. Soft Matter. 11 (13), 2617-2626 (2015).
- Mabrouk, E., et al. Formation and material properties of giant liquid crystal polymersomes. Soft Matter. 5, 1870-1878 (2009).
- Henriksen, J., et al. Universal behavior of membranes with sterols. Biophysical Journal. 90 (5), 1639-1649 (2006).
- Ly, H. V., Block, D. E., Longo, M. L. Interfacial Tension Effect of Ethanol on Lipid Bilayer Rigidity, Stability, and Area/Molecule: A Micropipet Aspiration Approach. Langmuir. 18 (23), 8988-8995 (2002).
- Bermudez, H., Hammer, D. A., Discher, D. E. Effect of Bilayer Thickness on Membrane Bending Rigidity. Langmuir. 20, 540-543 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены