Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Obtention de vésicules hybrides Unilamellar géantes par électroformation et mesure de leurs propriétés mécaniques par Micropipette Aspiration
Dans cet article
Résumé
L'objectif du protocole est de mesurer de façon fiable les propriétés mécaniques membranaires des vésicules géantes par aspiration micropipette.
Résumé
Les vésicules géantes obtenues à partir de phospholipides et de copolymères peuvent être exploitées dans différentes applications : livraison contrôlée et ciblée de médicaments, reconnaissance biomoléculaire au sein des biocapteurs pour le diagnostic, membranes fonctionnelles pour les cellules artificielles et développement de micro/nanoréacteurs bioinspirés. Dans toutes ces applications, la caractérisation de leurs propriétés membranaires est d'une importance fondamentale. Parmi les techniques de caractérisation existantes, l'aspiration micropipette, lancée par E. Evans, permet de mesurer les propriétés mécaniques de la membrane telles que le modulus de compressibilité de zone, le modulus de flexion et le stress et la contrainte de lyse. Ici, nous présentons toutes les méthodologies et procédures détaillées pour obtenir des vésicules géantes à partir de la fine pellicule d'un lipide ou d'un copolymère (ou les deux), la fabrication et le traitement de surface des micropipettes, et la procédure d'aspiration menant à la mesure de tous les paramètres mentionnés précédemment.
Introduction
Les vésicules géantes obtenues à partir de phospholipides (liposomes) ont été largement utilisés depuis les années 1970 comme modèle de membrane cellulaire de base1. À la fin des années 1990, les morphologies vésiculaires obtenues à partir de l'auto-assemblage de copolymères, nommés polymères en référence à leurs analogues lipidiques2,3, sont rapidement apparus comme une alternative intéressante aux liposomes qui possèdent une faible stabilité mécanique et une faible fonctionnalité chimique modulaire. Cependant, leur caractère biomimétique cellulaire est plutôt limité par rapport aux liposomes puisque ces derniers sont composés de phospholipides, la principale composante de la membrane cellulaire. En outre, leur perméabilité à faible membrane peut être un problème dans certaines applications comme la livraison de médicaments où la diffusion contrôlée des espèces à travers la membrane est nécessaire. Récemment, l'association des phospholipides avec des copolymères de bloc pour concevoir les vésicules et membranes hybrides polymères-lipidiques a fait l'objet d'un nombre croissant d'études4,5. L'idée principale est de concevoir des entités qui combinent en synergie les avantages de chaque composant (biofonctionnalité et perméabilité des bicouches lipidiques avec la stabilité mécanique et la polyvalence chimique des membranes polymères), qui peuvent être exploitées dans différentes applications : livraison contrôlée et ciblée de médicaments, reconnaissance biomoléculaire au sein des biocapteurs pour le diagnostic, membranes fonctionnelles pour les cellules artificielles, développement de micro-réacteurs bio-inspirés.
Aujourd'hui, différentes communautés scientifiques (biochimistes, chimistes, biophysiciens, physico-chimistes, biologistes) s'intéressent de plus en plus au développement d'un modèle de membrane cellulaire plus avancé. Ici, notre objectif est de présenter, aussi détaillées que possible, des méthodologies existantes (électroformation, aspiration micropipette) pour obtenir et caractériser les propriétés mécaniques des vésicules géantes et les récents modèles de membrane cellulaire " avancé " qui sont des vésicules géantes hybrides de lipides polymères4,5.
Le but de ces méthodes est d'obtenir une mesure fiable de la compressibilité de la zone et la flexion moduli de la membrane ainsi que leur stress de lyse et de la souche. Une des techniques les plus courantes existantes pour mesurer la rigidité de flexion d'une vésicule géante est l'analyse de fluctuation6,7, basée sur l'observation vidéo directe de microscope ; mais cela nécessite une grande fluctuation visible de la membrane, et n'est pas systématiquement obtenu sur des membranes épaisses (par exemple polymères). Le modulus de compressibilité de zone peut être expérimentalement déterminé utilisant la technique de Langmuir Blodgett mais le plus souvent sur un monolayer8. La technique d'aspiration de micropipette permet la mesure des deux moduli sur une bicouche formant la vésicule unilamellar géante (GUV) dans une expérience.
La méthode suivante est appropriée pour toutes les molécules amphiphiles ou macromolécules capables de former des bicouches et, par conséquent, des vésicules par électroformation. Cela nécessite un caractère fluide de la bicouche à la température de l'électroformation.
Protocole
1. Fabrication de micropipettes
REMARQUE : Ici, des micropipettes d'un diamètre intérieur allant de 6 à 12 m et d'une longueur de cône d'environ 3 à 4 mm sont nécessaires. Une méthode détaillée de fabrication de micropipette est décrite dans ce qui suit.
- Placez le capillaire en verre borosilicate dans la barre de tirage du tire-lamans et fixez l'une des extrémités en resserrant le bouton.
- Faites glisser soigneusement le verre à travers les trous sur le côté de la chambre chauffante.
- Resserrez le bouton de serrage à l'autre extrémité.
- Contrôlez la taille de la pointe et la longueur du cône pour atteindre les spécifications souhaitées. Pour cela, optimiser les paramètres techniques tels que la température de chauffage, la traction, la vitesse, le retard et la pression. Voici un exemple d'un programme utilisé :
Chaleur : 550 oC
Tirer: 10 (Gamme de la machine: 0-255 dans les unités arbitraires)
Vitesse: 30 (Range: 0-255 dans les unités arbitraires)
Retard: 1 (Range: 0-255 dans les unités arbitraires)
Pression: 500 (Range: 0-999 dans les unités arbitraires) - Cliquez sur PULL pour exécuter les événements définis par le programme. Le capillaire est ensuite séparé en deux micropipettes, dont les dimensions doivent être ajustées à l'aide d'une microforge.
- Insérer la micropipette dans le porte-pipette métallique de la microforge (voir Figure 1). En utilisant l'objectif 10x, ajuster l'étape du microscope et le manipulateur de pipette (mouvement vertical et horizontal) jusqu'à ce que la pointe de pipette soit proche de la surface de perle de verre.
- Appuyez sur l'interrupteur pour faire fondre la perle de verre. Abaissez la pointe et mettez-la en contact avec la perle de verre fondu. Le verre fondu s'écoulera dans la pipette par action capillaire. Attendez quelques secondes jusqu'à ce que le niveau du verre fondu atteigne une certaine hauteur comme le montre l'insert de la figure 1.
- Arrêtez le chauffage en supprimant la pression sur l'interrupteur du pied, et tirez rapidement la pointe loin en utilisant le manipulateur de pipette verticale pour causer une rupture nette.
- Répétez les étapes 1,7 et 1,8 jusqu'à ce que le diamètre désiré soit obtenu (6 à 12 m).
REMARQUE: Pour améliorer la précision de la mesure du diamètre, au cours de la dernière étape, utilisez un objectif 32x équipé d'un réticule.
2. Conseils de pipette de revêtement avec BSA (albumin de sérum bovin)
- Préparer une solution de 0,1 M de glucose contenant 1% de BSA dans de l'eau pure.
- Peser 180 mg de poudre de glucose, placer dans un tube conique en polypropylène de 15 ml et avec 10 ml d'eau pure.
- Ajouter 0,1 g de poudre de BSA et secouer doucement à l'aide d'un mélangeur rotatif de tube à essai jusqu'à dissolution complète (environ 4 h).
- Prenez la solution avec une seringue Luer jetable de 10 ml ml minée d'une aiguille. Une fois remplie, retirez l'aiguille et installez un filtre à cellulose d'acétate de 0,22 m. Remplir plusieurs tubes de microcentrifugeuse en polypropylène (1,5 ml) qui seront utilisés pour immerger la pointe.
- Placez les capillaires verticalement dans les supports. Abaissez le support et plongez la pointe dans la solution glucose/BSA pendant la nuit. La solution devrait monter d'environ 1 cm de haut par action capillaire.
- Retirez la pointe de pipette de la solution glucose/BSA. Préparer 5 ml de solution de glucose de 0,1 M (diluer 90 mg de poudre de glucose dans 5 ml d'eau pure) et filtrer à travers un filtre à cellulose d'acétate de 0,22 m.
- Remplissez la pipette avec la solution de glucose à l'aide d'une seringue en verre de 500 l équipée d'un capillaire de silice fusionné flexible. Ensuite, retirez toute la solution de glucose en la suçant en arrière etjetez-la (figure 2). Répétez cette étape plusieurs fois pour supprimer le BSA illimité.
3. Formation de VGU et de VJO par électroformation
REMARQUE: Electroformation est un technique couramment utilisé développé par Angelova9. Les procédures pour obtenir une chambre d'électroformation, déposer un film lipidique ou polymère (ou les deux pour les VJO (Giant Hybrid Unilamellar Vesicles)) et hydrater le film sous un champ électrique alternatif sont décrites dans ce qui suit. La procédure de collecte du GUV obtenue est également décrite.
- Préparation des solutions d'amphiphile, de saccharose et de glucose
- Préparer une solution amphiphile à une concentration de 1 mg/ml. Peser 10 mg d'amphiphile et dissoudre dans 10 ml de chloroforme. Gardez la solution dans des flacons scellés pour éviter l'évaporation des solvants.
- Préparer une solution de stock de 1,2-dioleoyl-sn -glycero-3-phosphoethanolamine-N-(lissamine rhodamine B sulfonyl) (DOPE-Rhod) à 1 mg/mL en chloroforme.
- Ajoutez 10 L de solution lipidique fluorescente à la solution amphiphile. Gardez les solutions dans des flacons scellés pour éviter l'évaporation des solvants.
- Préparer des solutions de saccharose et de glucose à une concentration de 0,1 M. Peser 342 mg et 180 mg de saccharose et de glucose, respectivement, et les dissoudre dans 10 ml d'eau pure.
- Préparation de la chambre d'électroformation
REMARQUE : Différents matériaux conducteurs peuvent être utilisés pour fabriquer un dispositif d'électroformation (p. ex., fils de platine10, aiguilles en acier inoxydable11). La chambre d'électroformation est composée de deux diapositives ITO séparées par un espaceur en caoutchouc O-anneau qui a été coupé sur un côté pour créer une ouverture. Les glissières sont reliées à un générateur de tension par deux fils électriques(figure 3 et figure 4A).- Nettoyez les glissières ITO avec du solvant organique (p. ex. chloroforme). Identifiez la surface conductrice à l'aide d'un ohmmeter.
- Fixez les fils électriques du côté conducteur à l'aide de ruban adhésif.
- Dépôt de solution amphiphile
- Trempez un capillaire dans la solution jusqu'à ce que le niveau augmente par action capillaire et de recueillir environ 5 L de la solution.
- Mettez le capillaire en contact avec le centre de la plaque de verre ITO et étalez doucement la solution. Attendez 10 secondes pour assurer l'évaporation complète du solvant (Figure 4A).
- Répétez cette procédure 3 fois pour chaque côté.
- Ajouter une couche de graisse sans silicium des deux côtés de l'espaceur O-anneau ouvert. Mettez-le autour de la zone de dépôt. Placez la face conductrice de la deuxième plaque de verre ITO sur le dessus de l'espaceur.
- Placer la chambre d'électroformation sous vide pendant 3 heures pour enlever toute trace de solvant organique.
- Procédure d'électroformation
- Branchez les fils électriques sur le générateur.
- Utilisez les paramètres suivants pour le générateur :
Tension sinusoïdale alternative
Fréquence: 10 Hz
Amplitude: 2 Vde pointe en pointe
REMARQUE : La fréquence et la durée optimales de tension doivent être trouvées pour chaque système. - Assurez-vous que la tension est appliquée avant l'injection de la solution dans la chambre.
- Injecter 1 ml de solution à l'aide d'une seringue avec une aiguille de diamètre intérieur de 0,8 mm pour remplir la chambre. Enlevez les bulles éventuelles.
- Laissez la chambre sous la tension/fréquence appliquée pendant 75 min (figure 4B).
- GuVs récolte
- Éteignez le généra teur.
- À l'aide d'une seringue de 1 ml avec une aiguille de diamètre intérieur de 0,8 mm, aspirer une petite partie de la solution afin de produire une bulle d'air à l'intérieur de la chambre. Inclinez légèrement la chambre afin de faire bouger cette bulle à l'intérieur de la chambre. Cela peut aider les VGU à se détacher de la surface de l'OIT (figure 4C).
- Sucer toute la solution et la transférer dans un tube en plastique de 1 ml.
- Retirez les fils et nettoyez les glissières ITO avec des solvants organiques (toluène puis chloroforme).
4. Micromanipulation mise en place
REMARQUE: Le principe de l'aspiration micropipette est de sucer une seule vésicule à travers une micropipette en verre en appliquant une dépression. La longueur de la langue à l'intérieur de la pipette est mesurée en fonction de la pression d'aspiration. Le revêtement de pipette avec BSA, décrit précédemment, est essentiel pour empêcher ou réduire au minimum toute adhérence entre les membranes vésicules et la pipette.
Le protocole est illustré ci-dessous.
- Pipette et connexion de réservoir remplie d'eau
REMARQUE : Le réservoir rempli d'eau et le micromètre sont fixés à une plaque coulissante. Un compteur numérique avec une tête de micromètre permet un déplacement vertical de l'appareil dans une plage de 0 à 2,5 cm et une précision de 1 m. Le déplacement le long d'un rail optique en aluminium est possible jusqu'à 1 mètre de longueur. Un tube de silicium relie le réservoir et le support capillaire (Figure 5A).- Remplissez le réservoir d'eau pure. Connectez une seringue jetable de 5 ml au support métallique capillaire par l'intermédiaire d'un tube en silicone et aspirez pour créer un flux d'eau du réservoir au support.
- Touchez légèrement le tube pour éliminer les bulles d'air. Simultanément, soulevez le réservoir d'eau pour créer une pression positive. La seringue de 5 ml est toujours fixée au support.
- Après le revêtement et les étapes de nettoyage décrites précédemment (voir l'étape 2), remplissez un capillaire avec une solution de glucose jusqu'à ce qu'une goutte se forme à la fin. Retirez le tube de seringue du support métallique pour créer un léger débit d'eau à son extrémité.
- Tournez le capillaire à l'envers et connectez la goutte de glucose avec le flux d'eau du support. Fixer le capillaire et le support en les vissant ensemble.
- Positionner une pipette
REMARQUE : Pendant cette opération, le réservoir d'eau est toujours positionné sur le rail en aluminium pour maintenir une pression positive.- Prenez l'étape en aluminium maison équipée de deux lames en verre (préalablement nettoyées avec de l'éthanol) et collez-les avec de la graisse sous vide de chaque côté. Installez-le au microscope et formez un ménisque entre les deux diapositives à l'aide d'une seringue de 1 ml contenant 0,1 M de glucose, comme le montre la figure 5B,C.
- Placez la pipette et son support sur l'unité motrice du micromanipulateur et serrez le bouton de serrage.
- Utilisez le joystick du panneau de commande en mode grossier pour abaisser la micropipette près du ménisque de glucose. Ajuster la position de la pointe au centre du ménisque en utilisant le mode fin.
- Maintenez la pointe immergée dans le glucose pendant quelques minutes pour nettoyer sa surface extérieure et intérieure (comme une pression positive est maintenue, le flux d'eau rincera la surface intérieure de la pipette pour enlever BSA non couché).
- Conservez la position de la pointe sur le clavier du micromanipulateur et retirez-la du ménisque.
- Retirez le ménisque du glucose et remplacez-le par un ménisque frais. Suck 2 L de VGU dans un saccharose de 0,1 M à l'aide d'une micropipette de 20 L et la mettre dans le ménisque de glucose frais. Observez en mode DIC (contraste d'interférence différentielle) les GUV situés en bas en raison de la différence de densité entre le saccharose (principalement à l'intérieur des GUV) et le glucose (principalement en dehors des GUV).
- Lorsque les vésicules sont légèrement dégonflées, réinsérer la pipette d'aspiration et se concentrer sur la pointe. Définir la hauteur H0 du réservoir d'eau pour lequel la pression est presque 0. Pour cela, profitez de petites vésicules ou particules qui sont naturellement présentes en solution et ajustez la hauteur du réservoir d'eau jusqu'à ce que le mouvement de ces particules soit arrêté.
- À ce stade, entourez le ménisque d'huile minérale pour empêcher l'évaporation de l'eau, voir Figure 5D.
REMARQUE : La température ambiante doit être contrôlée entre 20 et 22 oC en utilisant la climatisation.
- Expérience d'aspiration de Micropipette
- Abaissez l'extrémité de la pipette (6-12 m de diamètre) et créez une petite aspiration (-1 cm) pour aspirer une vésicule (15-30 m de diamètre). La membrane de la vésicule sélectionnée doit légèrement fluctuer et ne doit présenter aucun défaut visible (pas de bourgeon ou de filament) (figure 6).
- Élever la pipette à un niveau plus élevé pour isoler la vésicule aspirée des autres vésicules, en utilisant le micromanipulateur et garder cette position pendant toute l'expérience.
- Pré-stresser la vésicule en abaissant le réservoir rempli d'eau à environ -10 cm, puis diminuer la pression pour revenir à sa valeur initiale (-1 cm). Répétez cette étape plusieurs fois pour enlever l'excès de membrane et les petits défauts de la membrane.
- D'une hauteur de -0,5 cm définie par la position du réservoir d'eau, diminuer lentement la pression d'aspiration avec le micromètre pour atteindre un régime dans lequel la membrane fluctue. Ensuite, augmentez la pression pour visualiser clairement une langue dans la pointe avec une longueur de projection significative (quelques microns).
REMARQUE : La pression appliquée la plus basse (P0) qui permet d'aspirer la plus petite longueur de projection de membrane (L0) définira le point de référence0 (Figure 7A). Tous les points de la courbe seront mesurés en fonction de cette référence (L 'L'L 0 et 'P ' P0). - Augmenter la pression d'aspiration avec le micromètre dans le sens des étapes jusqu'à ce qu'elle atteigne 0,5 à 0,8 mN/m. À chaque étape, attendez 5 s et prenez un instantané de la langue. Cette procédure à basse tension permet la détermination du modulus de flexion.
- Continuez d'augmenter la pression d'aspiration de 0,5 mN/m à la tension de rupture en ajustant la hauteur de l'eau remplie de glissement sur le rail (allant de -2 à -50 cm) (Figure 7B-D). À partir de cette expérience à haut régime de tension, le modulus de compressibilité de zone, la tension de lyse et la souche de lyse seront mesurés.
- Étirez environ 15-20 vésicules pour acquérir des statistiques significatives. Chaque expérience d'aspiration de micropipette prend entre 7 et 10 minutes. Effectuez l'analyse d'image à l'aide du logiciel LASAF pour mesurer la longueur de projection de la langue, le diamètre des vésicules et le rayon du capillaire.
- Mesure du modulus de flexion, modulus de compressibilité de secteur, tension de lyse et souche de lyse
- Pour accéder à ces paramètres, utilisez le formalisme établi par E. Evans12. Calculer la pression d'aspiration appliquée sur la membrane à partir de l'équation 1 :
P'wg (h'h0) (1)
où g est l'accélération gravitationnelle (9,8 m's 2),w est la densité de l'eau (1 g 'cm3), h est la position du réservoir d'eau et h0 est la position initiale où la pression est égale à zéro. - Calculez la tension membranaire de l'équation De Laplace :
 (2)
(2)
où la pression d'aspiration sur la micropipette, Rp et Rv sont respectivement la micropipette et le vésicule radii (en dehors de la micropipette). La souche de surface de la membrane est définie comme :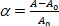 (3)
(3)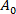 étant la zone membranaire de la vésicule à la pression d'aspiration inférieure.
étant la zone membranaire de la vésicule à la pression d'aspiration inférieure. - Calculer l'augmentation de la longueur de projection de la vésicule à l'intérieur de la pointe capillaire selon l'équation 412:
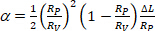 (4)
(4) - Sous un régime de tension très faible, le lissage des ondulations thermiques domine l'expansion apparente. Terrain ln () vs. À des valeurs basses (généralement 0,001 à 0,0,5 mN.m113),cela donne une ligne droite dont la pente est liée au modulus de flexion, Kb (premier terme de l'équation 5)14:
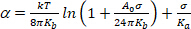 (5)
(5)
REMARQUE : Sous haute tension (0,5 mN.m-1), les ondulations membranaires sont complètement supprimées et la surface de la membrane augmente en raison de l'espacement accru entre les molécules. Dans ce régime, le deuxième terme de l'équation 5 domine et donne accès au modulus de compressibilité de zone Ka (Figure 8 et Figure 9).
- Pour accéder à ces paramètres, utilisez le formalisme établi par E. Evans12. Calculer la pression d'aspiration appliquée sur la membrane à partir de l'équation 1 :
Résultats
With the protocol aforementioned, we have studied different synthetic giant unilamellar vesicle (GUV), obtained from a phospholipid: 2-oleoyl-1-palmitoyl-sn-glycero-3-phosphocholine (POPC), a triblock copolymer: Poly(ethyleneoxide)-b-Poly(dimethylsiloxane)-b-Poly(ethyleneoxide) (PEO12-b-PDMS43-b-PEO12) synthesized in a previous study13, and a diblock copolymer Poly(dimethylsiloxane)-b...
Discussion
Le revêtement de la micropipette est l'un des points clés pour obtenir des mesures fiables. L'adhérence de la vésicule à la micropipette doit être évitée, et un revêtement est couramment utilisé dans la littérature17,18,19,20,21, avec BSA, '-caséine ou surfasil. Les détails de la procédure de revêtement sont rarement mentionnés.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs remercient l'ANR pour son soutien financier (ANR Sysa).
matériels
| Name | Company | Catalog Number | Comments |
| Required equipment and materials for micropipette design | |||
| Borosilicate Glass Capillaries | World Precision Instruments | 1B100-4 | external and internal diameter of 1mm and 0.58 mm respectively. |
| Filament installed | Sutter Instrument Co. | FB255B | 2.5mm*2.5mm Box Filament |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | Model P-97 | |
| Microforge | NARISHGE Co. | MF-900 | fitted with two objectives (10x and 32x) |
| Materials for coating pipette tips with BSA | |||
| Bovine Serum Albumin Fraction V (BSA) | Sigma-Aldrich | 10735078001 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| Disposable 10 ml syringe Luer Tip | Codan | 626616 | |
| Disposable 5 ml syringe Luer Tip | Codan | 62.5607 | |
| Disposable acetate cellulose filter | Cluzeau Info Labo | L5003SPA | Pore size: 0.22µm, diameter: 25mm |
| Flexible Fused Silica Capillary Tubing | Polymicro Technologies. | TSP530660 | Inner Diameter 536µm, Outer Diameter 660µm, |
| Glucose | Sigma-Aldrich | G5767 | |
| Syringe 500 µL luer Lock GASTIGHT | Hamilton Syringe Company | 1750 | |
| Test tube rotatory mixer | Labinco | 28210109 | |
| Micromanipulation Set up | |||
| Aluminum Optical Rail, 1000 mm Length, M4 threads, X48 Series | Newport | ||
| Damped Optical Table | Newport | used as support of microscope to prevent external vibrations. | |
| Micromanipulator | Eppendorf | Patchman NP 2 | The module unit (motor unit for X, Y and Z movement) is mounted on the inverted microscope by the way of an adapter. |
| Micrometer | Mitutoyo Corporation | 350-354-10 | Digimatic LCD Micrometer Head 25,4 mm Range 0,001 mm |
| Plexiglass water reservoir (100 ml) | Home made | ||
| TCS SP5 inverted confocal microscope (DMI6000) equipped with a resonant scanner and a water immersion objective (HCX APO L 40x/0.80 WU-V-I). | Leica | ||
| X48 Rail Carrier 80 mm Length,with 1/4-20, 8-32 and 4-40 thread | Newport | ||
| Materials for sucrose and amphiphile solution preparation | |||
| 2-Oleoyl-1-palmitoyl-sn-glycero-3-phosphocholine | Sigma-Aldrich | ||
| Chloroform | VWR | 22711.244 | |
| L-α-Phosphatidylethanolamine-N-(lissamine rhodamine B sulfonyl) | Sigma-Aldrich | 810146C | Rhodamine tagged lipid |
| Sucrose | Sigma-Aldrich | S7903 | |
| Electroformation set up | |||
| 10 µL glass capillary ringcaps | Hirschmann | 9600110 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| H Grease | Apiezon | Apiezon H Grease | Silicon-free grease |
| Indium tin oxide coated glass slides | Sigma-Aldrich | 703184 | |
| Needle | Terumo | AN2138R1 | 0.8 x 38 mm |
| Ohmmeter (Multimeter) | Voltcraft | VC140 | |
| Toluene | VWR | 28676.297 | |
| Voltage generator | Keysight | 33210A |
Références
- Bangham, A. D., Standish, M. M., Watkins, J. C. Diffusion of univalent ions across the lamellae of swollen phospholipids. Journal of Molecular Biology. 13 (1), (1965).
- Discher, D. E., Eisenberg, A. Polymer vesicles. Science. 297 (5583), 967-973 (2002).
- Hammer, D., et al. Polymersomes: vesicles from block copolymers. Annals of Biomedical Engineering. 28 (SUPPL. 1), (2000).
- Le Meins, J. F., Schatz, C., Lecommandoux, S., Sandre, O. Hybrid polymer/lipid vesicles: state of the art and future perspectives. Materials Today. 16 (10), 397-402 (2013).
- Schulz, M., Binder, W. H. Mixed Hybrid Lipid/Polymer Vesicles as a Novel Membrane Platform. Macromolecular Rapid Communications. 36, 2031-2041 (2015).
- Schneider, M. B., Jenkins, J. T., Webb, W. W. Thermal fluctuations of large quasi-spherical bimolecular phospholipid vesicles. Journal De Physique. 45 (9), 1457-1472 (1984).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Advances in Colloid and Interface Science. 208, 225-234 (2014).
- Rodríguez-García, R., et al. Polymersomes: smart vesicles of tunable rigidity and permeability. Soft Matter. 7 (4), 1532-1542 (2011).
- Angelova, M. I., Dimitrov, D. S. Liposome electroformation. Faraday Discussions of the Chemical Society. 81, 303-311 (1986).
- Dao, T. P. T., et al. Membrane properties of giant polymer and lipid vesicles obtained by electroformation and pva gel-assisted hydration methods. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 533, 347-353 (2017).
- Pereno, V., et al. Electroformation of Giant Unilamellar Vesicles on Stainless Steel Electrodes. ACS omega. 2 (3), 994-1002 (2017).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Physical Review Letters. 64 (17), 2094-2097 (1990).
- Dao, T. P. T., et al. Modulation of phase separation at the micron scale and nanoscale in giant polymer/lipid hybrid unilamellar vesicles (GHUVs). Soft Matter. 13 (3), 627-637 (2017).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 11 (11), 693-703 (1973).
- Dao, T. P. T., et al. The combination of block copolymers and phospholipids to form giant hybrid unilamellar vesicles (GHUVs) does not systematically lead to "intermediate'' membrane properties. Soft Matter. 14 (31), 6476-6484 (2018).
- Shoemaker, S. D., Kyle Vanderlick, T. Material Studies of Lipid Vesicles in the Lα and Lα-Gel Coexistence Regimes. Biophysical Journal. 84 (2), 998-1009 (2003).
- Longo, M. L., Ly, H. V., Dopico, A. M. . Methods in Membrane Lipids. , 421-437 (2007).
- Chen, D., Santore, M. M. Hybrid copolymer-phospholipid vesicles: phase separation resembling mixed phospholipid lamellae, but with mechanical stability and control. Soft Matter. 11 (13), 2617-2626 (2015).
- Mabrouk, E., et al. Formation and material properties of giant liquid crystal polymersomes. Soft Matter. 5, 1870-1878 (2009).
- Henriksen, J., et al. Universal behavior of membranes with sterols. Biophysical Journal. 90 (5), 1639-1649 (2006).
- Ly, H. V., Block, D. E., Longo, M. L. Interfacial Tension Effect of Ethanol on Lipid Bilayer Rigidity, Stability, and Area/Molecule: A Micropipet Aspiration Approach. Langmuir. 18 (23), 8988-8995 (2002).
- Bermudez, H., Hammer, D. A., Discher, D. E. Effect of Bilayer Thickness on Membrane Bending Rigidity. Langmuir. 20, 540-543 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon