Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Radiotracer Administración para La Tomografía por Emisión de Positrones de Alta Resolución Temporal del Cerebro Humano: Aplicación a FDG-fPET
En este artículo
Resumen
Este manuscrito describe dos protocolos de administración de radiosonda para FDG-PET (infusión constante y bolo más perfusión) y los compara con la administración de bolos. Las resoluciones temporales de 16 s se pueden lograr utilizando estos protocolos.
Resumen
La tomografía funcional por emisión de positrones (fPET) proporciona un método para rastrear dianas moleculares en el cerebro humano. Con un análogo de glucosa marcado radioactivamente, 18F-fluordeoxyglucose (FDG-fPET), ahora es posible medir la dinámica del metabolismo de la glucosa con resoluciones temporales que se acercan a las de la resonancia magnética funcional (fMRI). Esta medida directa de la captación de glucosa tiene un enorme potencial para entender la función cerebral normal y anormal y sondear los efectos de las enfermedades metabólicas y neurodegenerativas. Además, los nuevos avances en el hardware híbrido MR-PET permiten capturar fluctuaciones en la glucosa y la oxigenación de la sangre simultáneamente utilizando fMRI y FDG-fPET.
La resolución temporal y la señal a ruido de las imágenes FDG-fPET dependen críticamente de la administración de la radiosonda. Este trabajo presenta dos protocolos alternativos de perfusión continua y los compara con un enfoque tradicional del bolo. Presenta un método para adquirir muestras de sangre, PET de bloqueo de tiempo, RMN, estímulo experimental y administrar la administración de trazador no tradicional. Utilizando un estímulo visual, los resultados del protocolo muestran mapas corticales de la glucosa-respuesta a estímulos externos a nivel individual con una resolución temporal de 16 s.
Introducción
La tomografía por emisión de positrones (PET) es una potente técnica de imagen molecular que se utiliza ampliamente tanto en entornos clínicos como de investigación (ver Heurling et al.1 para una revisión exhaustiva reciente). Las dianas moleculares que se pueden tomar imágenes utilizando PET sólo están limitadas por la disponibilidad de radiosondas, y numerosos trazadores se han desarrollado para tomar imágenes de receptores del metabolismo neural, proteínas y enzimas2,3. En neurociencia, uno de los radiosondas más utilizados es 18F-fluorodeoxiglucosa (FDG-PET), que mide la ingesta de glucosa, generalmente interpretado como un índice de metabolismo de la glucosa cerebral. El cerebro humano requiere un suministro constante y confiable de glucosa para satisfacer sus requisitos de energía4,5, y 70-80% del metabolismo de la glucosa cerebral es utilizado por las neuronas durante la transmisión sináptica6. Se cree que los cambios en el metabolismo de la glucosa cerebral inician y contribuyen a numerosas afecciones, incluyendo afecciones psiquiátricas, neurodegenerativas e isquémicas7,8,9. Además, como la ingesta de FDG es proporcional a la actividad sináptica10,11,12, se considera un índice más directo y menos confundido de la actividad neuronal en comparación con la sangre más utilizada respuesta de resonancia magnética funcional dependiente del nivel de oxigenación (BOLD-fMRI). BOLD-fMRI es un índice indirecto de actividad neuronal y mide los cambios en la hemoglobina desoxigenada que se producen después de una cascada de cambios neurovasculares después de la actividad neuronal.
La mayoría de los estudios FDG-PET del cerebro humano adquieren imágenes estáticas de la absorción de glucosa cerebral. El participante descansa tranquilamente durante 10 minutos con los ojos abiertos en una habitación oscurecida. La dosis completa de radiosonda se administra como bolo durante un período de segundos, y el participante reposa durante otros 30 minutos. Después del período de captación, los participantes se colocan en el centro del escáner PET, y se adquiere una imagen PET que refleja la distribución acumulativa de FDG en el transcurso de los períodos de captación y escaneo. Por lo tanto, la actividad neuronal indexada por la imagen PET representa el promedio acumulado de toda la actividad cognitiva sobre los períodos de aceptación y exploración y no es específica de la actividad cognitiva durante la exploración. Este método ha proporcionado una gran visión del metabolismo cerebral del cerebro y la función neuronal. Sin embargo, la resolución temporal es igual a la duración de la exploración (a menudo 45 min, produciendo efectivamente una medición estática de la absorción de glucosa; esto se compara desfavorablemente con la respuesta neuronal durante los procesos cognitivos y experimentos comunes en neuroimagen. Debido a la resolución temporal limitada, el método proporciona un índice no específico de la acumulación de glucosa (es decir, no bloqueado a una tarea o proceso cognitivo) y no puede proporcionar medidas de variabilidad dentro del sujeto, lo que puede conducir a conclusiones científicas erróneas debidas a la Paradoja13de Simpson. La Paradoja de Simpson es un escenario, donde las relaciones cerebro-comportamiento calculadas entre sujetos no son necesariamente indicativas de las mismas relaciones probadas dentro de los sujetos. Además, los intentos recientes de aplicar medidas de conectividad funcional a FDG-PET solo pueden medir la conectividad entre sujetos. Por lo tanto, las diferencias en la conectividad sólo se pueden comparar entre grupos y no se pueden calcular para sujetos individuales. Si bien es discutible qué medidas de conectividad exactamente entre sujetos14, está claro que las medidas calculadas a través de los sujetos, pero no dentro de los sujetos, no pueden utilizarse como biomarcador para los estados de la enfermedad ni utilizarse para examinar la fuente de variación individual.
En los últimos cinco años, el desarrollo y la accesibilidad más amplia de los escáneres simultáneos de resonancia magnética-PET de grado clínico ha despertado un renovado interés de investigación en la imagen FDG-PET2 en neurociencia cognitiva. Con estos desarrollos, los investigadores se han centrado en mejorar la resolución temporal de FDG-PET para abordar los estándares de BOLD-fMRI (0,5 x 2,5 s). Tenga en cuenta que la resolución espacial de BOLD-fMRI puede aproximarse a resoluciones submilimétricas, pero la resolución espacial de FDG-PET se limita fundamentalmente a alrededor de 0,54 mm de ancho completo a la mitad máxima (FWHM) debido al rango de positrones15. Las adquisiciones dinámicas de FDG-PET, que a menudo se utilizan clínicamente, utilizan el método de administración del bolo y reconstruyen los datos en modo lista en contenedores. El método fDG-PET dinámico de bolo ofrece una resolución temporal de alrededor de 100 s (por ejemplo, Tomasi et al.16). Esto es claramente mucho mejor en comparación con la imagen estática FDG-PET, pero no es comparable a BOLD-fMRI. Además, la ventana en la que se puede examinar la función cerebral es limitada, porque la concentración plasmática sanguínea de FDG disminuye poco después de administrar el bolo.
Para ampliar esta ventana experimental, un puñado de estudios17,18,19,20,21 han adaptado el método de infusión de radiosonda previamente propuesto por Carson22, 23. En este método, a veces descrito como 'FDG-PET funcional' (FDG-fPET, análogo a BOLD-fMRI), la radiosonda se administra como una perfusión constante en el transcurso de toda la tomografía por emisión de positrones (90 min). El objetivo del protocolo de perfusión es mantener un suministro plasmático constante de FDG para realizar un seguimiento de los cambios dinámicos en la utilización de glucosa a lo largo del tiempo. En un estudio de prueba de concepto, Villien et al.21 utilizaron un protocolo de perfusión constante y UNA resonancia magnética/FDG-fPET simultánea para mostrar cambios dinámicos en la ingesta de glucosa en respuesta a la estimulación de tablero de ajedrez con una resolución temporal de 60 s. Los estudios posteriores han utilizado este método para mostrar el FDG-fPET bloqueado por tareas (es decir, bloqueado en el tiempo a un estímulo externo19)y el FDG-fPET relacionado con las tareas (es decir, no bloqueado en el tiempo a un estímulo externo17, 18) acumulación de glucosa. Utilizando estos métodos, se han obtenido resoluciones temporales FDG-fPET de 60 s, lo que es una mejora sustancial sobre los métodos de bolo. Los datos preliminares muestran que el método de perfusión puede proporcionar resoluciones temporales de 20 a 60 s19.
A pesar de los resultados prometedores del método de perfusión constante, las curvas de radiactividad plasmática de estos estudios muestran que el método de perfusión no es suficiente para alcanzar un estado estable dentro del período de tiempo de una exploración de 90 minutos19,21. Además del procedimiento de perfusión constante, Carson22 también propuso un procedimiento híbrido de bolo/infusión, donde el objetivo es alcanzar rápidamente el equilibrio al comienzo de la exploración, y luego mantener los niveles de radiactividad plasmática en equilibrio para el duración de la exploración. 20 aplicó recientemente esta técnica utilizando un 20% de bolo más 80% de perfusión. Como era de esperar, la función de entrada arterial subió rápidamente por encima de los niveles basales y se mantuvo a una tasa más alta durante más tiempo, en comparación con los resultados utilizando un procedimiento de solo perfusión19,21.
Este documento describe los protocolos de adquisición para la adquisición de exploraciones de PET FDG-fde alta resolución temporal utilizando solo perfusión y administración de radiosonda de bolo/infusión. Estos protocolos se han desarrollado para su uso en un entorno MRI-PET simultáneo con un tiempo de adquisición de 90 a 95 minutos19. En el protocolo, se toman muestras de sangre para cuantificar la radiactividad sérica plasmática para la cuantificación posterior de imágenes PET. Si bien el enfoque del protocolo es la aplicación de métodos de infusión para la neuroimagen funcional utilizando BOLD-fMRI/FDG-fPET, estos métodos se pueden aplicar a cualquier estudio de FDG-fPET independientemente de si la RMN simultánea, BOLD-f Se adquieren resonancias magnéticas, tomografía computarizada (TC) u otras neuroimágenes. El cuadro 1 muestra el diagrama de flujo de los procedimientos en este protocolo.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Este protocolo ha sido revisado y aprobado por el Comité de ética de investigación humana de la Universidad de Monash (número de aprobación CF16/1108 - 2016000590) de acuerdo con la Declaración Nacional Australiana sobre Conducta Etica en Investigación Humana24. Los procedimientos se desarrollaron bajo la dirección de un físico médico acreditado, un tecnólogo de medicina nuclear y un radiógrafo clínico. Los investigadores deben referirse a sus expertos locales y directrices para la administración de radiación ionizante en humanos.
1. Equipo y personal requeridos
- Consulte la Tabla de Materiales para la sala de escáneres, el laboratorio de radioquímica y los materiales generales. Se utilizó un proveedor comercial para la radiosonda.
- En el entorno simultáneo de RMN-PET, utilice cuatro personas: un radiógrafo (RG) para realizar la exploración, un tecnólogo de medicina nuclear (NMT) para supervisar la administración de la radiosonda y la adquisición de muestras de sangre, un asistente de laboratorio (LA) para espinar sangre, y un asistente de investigación (RA) responsable de supervisar el diseño experimental y la presentación de estímulo.
2. Preparación
- Preparación de la dosis del trazador por el NMT
- Calcule el volumen de perfusión que se administrará en el transcurso de la exploración. En este protocolo, la velocidad de perfusión es de 0,01 ml/s durante 95 min. Por lo tanto, en una exploración de 95 minutos, los participantes reciben 0,01 ml/s x 60 s x 95 min a 57 ml.
- Calcule la dosis del trazador que se diluirá en la solución salina administrada. En este protocolo, se administra una dosis total de 260 MBq al participante durante 95 min. Esta dosis fue elegida para limitar la exposición a la radiación a 4,9 mSv, para mantenerse dentro de la categorización de "bajo nivel" de acuerdo con las directrices de la Agencia Australiana de Protección contra la Radiación y Seguridad Nuclear (ARPANSA) para la exposición de los seres humanos a la radiación ionizante25. Decaimiento correcto 260 MBq desde el punto de infusión medio (47,5 min) de nuevo a T0. Usando la Ecuación 1, resuelva para A0
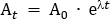
Donde At es la radiactividad (MBq) en el punto medio de la perfusión, A0 es la radiactividad inicial, y es la constante de descomposición radiactiva específica del trazador. Para FDG, el valor es de 0,693/T1/2. T1/2 es la vida media de 18F (110 min).
NOTA: En este ejemplo, At a 260 MBq, a 0,693/110 y a t a -47,5, por lo que A0 a 350.942 MBq. - Calcule la dosis de radiosonda requerida para la bolsa salina de 100 ml que se utilizará para administrar la dosis al participante. La radiosonda necesaria para la bolsa de salina se diluye hasta un volumen total de 5 ml y se extrae en una jeringa de 5 ml. Por lo tanto, para la bolsa salina de 100 ml, el factor de dilución es el volumen de salina (100 ml) además del volumen de 5 ml de la jeringa con radiosonda. Este volumen total de 105 ml se divide por el volumen de perfusión de 57 ml (es decir, 105 ml/57 ml a 1,842). Por lo tanto, la radiactividad total en un volumen de 5 ml requerido para la adición a la bolsa de 100 ml es A0 x el factor de dilución (es decir, 350.942 MBq x 1.842 a 646.44 MBq). Añadir asépticamente la radiosonda a la bolsa de salina.
NOTA: Es importante tener en cuenta que la actividad calculada de 646,44 MBq que se añade a la bolsa de salina es la actividad necesaria al comienzo de la perfusión. Generalmente, las dosis para este protocolo se preparan entre 15 min a 1 h antes de la administración. Por lo tanto, es importante tener en cuenta la descomposición del radioisótopo. Ecuación 1 en 2.1.2. se puede utilizar para explicar esto, donde el tiempo (t) es el número total de minutos desde la preparación de la dosis hasta cuando se administrará la actividad, At a 646.44 MBq, resolviendo para A0. - Prepare la dosis de cebado. Retire 20 ml de la bolsa en una jeringa y recórtela. Calibre esta jeringa y etiqueta de 20 ml. La jeringa se calibra como una comprobación de referencia para garantizar que la radiactividad se haya dispersado uniformemente dentro de la bolsa salina.
- Prepare la dosis. Con una jeringa de 50 ml, retire 60 ml de la bolsa y la tapa con un tapón rojo de Combi. Esta jeringa no está calibrada, ya que la concentración de la radiactividad se conoce desde el momento en que se añadió a la bolsa de salina (paso 2.1.3). Almacene ambas jeringas en el laboratorio de radioquímica hasta que estén listas para escanear.
NOTA: Es posible dibujar un volumen de 60 ml en una jeringa de 50 ml, ya que las jeringas Terumo están marcadas a un 20% por encima del volumen etiquetado (es decir, una jeringa de 50 ml está marcada a 60 ml). - Prepare la dosis de referencia. Llenar un matraz volumétrico de 500 ml con aproximadamente 480 ml de agua destilada. Dibuje 10 MBq de 18F-FDG en una jeringa, corregido por decaimiento a la hora de inicio de la exploración (usando la Ecuación 1) y agréguelo al matraz. Cubra el volumen hasta la marca de 500 ml con más agua destilada y mezcle bien. Fije las etiquetas antes y después de la calibración de la jeringa.
- Preparación de la sala de escáneres por el NMT
- Una vez que el participante está colocado en el escáner, hay muy poco espacio para manipular o salvar la línea para perfusión o muestras de sangre si se produce bloqueo. Prepare la sala del escáner para minimizar la posibilidad de bloqueo de la línea.
- Asegúrese de que todos los equipos de recolección de sangre estén al alcance del sitio de recolección. Coloque las almohadillas inferiores al final de la cánula y en cualquier superficie que sostenga los recipientes de sangre. Coloque contenedores para residuos regulares y residuos biopeligrosos al alcance del sitio de recolección de sangre.
- Preparación de la bomba de perfusión por el NMT
- Configure la bomba de perfusión en la sala del escáner en el lado que se conectará con el participante. Construir ladrillos de plomo alrededor de la base de la bomba y colocar el escudo de plomo delante de la bomba. Conecte el tubo de la bomba de perfusión que suministra la perfusión al participante y asegúrese de que se ha introducido la velocidad de perfusión correcta. Para este protocolo, la velocidad es 0.01 mL/s.
- Prepara el tubo antes de que se conecte a la cánula del participante. Conecte la dosis de cebado de 20 ml a la bomba de perfusión. Al final del tubo que se conectará al participante, coloque un grifo de tres vías y una jeringa vacía de 20 ml. Asegúrese de que el grifo esté posicionado para permitir que la solución 18F-FDG fluya desde la dosis de cebado a través del tubo y se acuse sólo en la jeringa vacía.
- Preajuste la bomba de perfusión para preparar un volumen de 15 ml. Seleccione el botón Prime en la bomba y siga las indicaciones para preparar la línea.
- Coloque la jeringa de dosis de 50 ml en la bomba de perfusión en lugar de la dosis de cebado. La dosis cebada de 15 ml en el grifo de tres vías puede permanecer allí hasta que el participante esté listo para ser conectado a la bomba.
- Preparación de los participantes por el NMT, la RA y el RG
- Aconseje a los participantes que ayunan durante 6 h, y que consuman sólo agua (aproximadamente dos vasos), antes de la exploración.
- Hacer que la RA lleve a cabo los procedimientos de consentimiento y adquiera medidas adicionales (por ejemplo, encuestas demográficas, baterías cognitivas, etc.). Haga que el NMT y el RG lleven a cabo las pantallas de seguridad, la seguridad de revisión de NMT para la exploración por PET (por ejemplo, exclusión para el embarazo, la diabetes, la quimioterapia o la radioterapia en las 8 semanas anteriores, y las alergias conocidas), y la seguridad de los participantes de la revisión de RG para la exploración por RMN (por ejemplo, exclusión para el embarazo, implantes metálicos médicos o no médicos, implantes dentales no extraíbles, claustrofobia).
- Cannutar al participante.
- Utilice dos cánulas: una para la administración de dosis y otra para el muestreo de sangre. La cánula más adecuada varía según los participantes, pero la vena más adecuada debe reservarse para la recolección de sangre. Una cánula de 22 G es el tamaño mínimo preferido. Recoger una muestra de sangre basal de 10 ml durante la cannulación. Desconecte todos los lavados salinos bajo presión para mantener la latencia de la línea.
- Pruebe el nivel de azúcar en sangre del participante y otras medidas de sangre basales (por ejemplo, hemoglobina) de la muestra basal.
- Posicionamiento del participante en el escáner por el RG y NMT
- Pida a la RG que coloque al participante en el orificio del escáner. Para escaneos largos, es imperativo asegurar la comodidad con el fin de reducir el riesgo de que el participante abandone y el artefacto de movimiento debido a molestias. El participante debe estar cubierto con una manta desechable para mantener una temperatura corporal cómoda.
- Tenga el NMT al ras de la cánula para asegurarse de que es patente con una resistencia mínima antes de conectar la línea de perfusión. Una vez conectado, el tubo se puede pegar ligeramente cerca de la muñeca. Indique al participante que mantenga el brazo enderezado. Utilice soportes como espuma o cojines para mayor comodidad. Pida al NMT que también revise la cánula que se utilizará para las muestras de plasma para asegurarse de que es capaz de extraer sangre con una resistencia mínima. Puede ser necesario conectar un tubo de extensión cebado con solución salina normal para hacer la cánula más accesible mientras el participante está en el escáner. Si es necesario, se debe comprobar si hay fugas.
- Una vez que el sujeto está en el orificio del escáner, haga que el NMT compruebe que tienen acceso adecuado a ambas cánulas.
- Pida al NMT que notifique al RG y a la RA si hay algún problema con la cánula de recolección de sangre, la cánula de perfusión o la bomba de perfusión (por ejemplo, oclusión, batería, extravasación) en cualquier momento durante la exploración.
3. Escanee al participante
- Inicio de la exploración con nMT, RG y RA
- Al inicio de la exploración, sitúe el NMT en la sala del escáner para supervisar el equipo de infusión. Asegúrese de que el NMT lleva protección auditiva y que utilice el protector de barrera para minimizar la exposición a la radiación de la dosis siempre que sea posible.
- A medida que el RG realiza el análisis del localizador para asegurarse de que el participante está en la posición correcta, compruebe los detalles para la adquisición de PET (por ejemplo, duración del escaneo, recopilación de datos en modo lista, isótopo correcto).
- Diseñar el protocolo para que la adquisición de PET comience con la primera secuencia de RMN. El RG prepara e inicia la secuencia de RMN. La hora de inicio de la adquisición de PET de 95 minutos está bloqueada en el tiempo para el inicio de la secuencia de RMN. Si es necesario, el NMT debe entregar el bolo en el momento de la adquisición de PET(Figura 1).
- Encienda la bomba de perfusión. El RG debe indicar el NMT (por ejemplo, a través de un signo pulgar hacia arriba) para iniciar la bomba 30 s después del inicio de la adquisición de PET. Este protocolo inicia la bomba de perfusión 30 s después de la hora de inicio del escaneo para proporcionar un búfer de seguridad en caso de fallo de la exploración. Esto también asegura que la primera imagen tomada durante la exploración por PET indexa el cerebro antes de la administración de la radiosonda para la recopilación completa de datos de la curva de actividad de tiempo. Pida al NMT que observe la bomba para asegurarse de que ha comenzado a infundir el 18F-FDG y que no hay oclusión inmediata de la línea.
- Pida a la AR que inicie cualquier estímulo externo a la hora acordada (es decir, al inicio de un bloque funcional de ejecución/experimental) y calcule los tiempos para las muestras de sangre. Un formulario de registro de ejemplo se muestra en Suplemento 1. Pida a la AR que calcule el tiempo previsto de cada muestra de sangre y proporcione copias al NMT y al asistente de laboratorio (LA). Haga que la AR se asegure de que el NMT tome las muestras de sangre en aproximadamente el momento correcto, y monitoree el equipo (por ejemplo, bomba de perfusión, estímulo) para detectar cualquier signo de error.
- Tomar muestras de sangre a intervalos de tiempo regulares
- Pida al NMT y a la RA que tomen una muestra cada 10 minutos. Por lo general, hay 10 muestras en total, sin incluir la muestra de línea base.
- Si adquiere resonancias magnéticas simultáneamente con tomografías por emisión de ecos, tenga la protección auditiva de desgaste NMT al entrar en la sala del escáner.
- Pida a la NMT que use guantes y frote la punta de la cánula limpia. Mientras que el sitio de la cánula se seca, abra una jeringa de 5 ml y una jeringa de 10 ml, vacutainer, y un lavado de salina de 10 ml.
- Con la jeringa de 5 ml, retire 4-5 ml de sangre fresca y deseche la jeringa en los residuos de riesgo biológico.
- Con la jeringa de 10 ml, retire hasta 10 ml de sangre. El volumen puede estar limitado por la facilidad con la que se puede retirar la sangre. Es importante minimizar cualquier resistencia que posteriormente cause daño a los glóbulos rojos que pueden hemolyze. En el punto de midcollection, tenga la señal NMT a la RA, que marcará esta vez en el formulario de registro(Suplemento 1) como el tiempo "real" de la muestra.
- Conecte la jeringa de 10 ml al vacutainer y luego deposite la sangre en el tubo sanguíneo correspondiente.
- Lavar rápidamente la cánula con 10 ml de salina, desconectada bajo presión, para minimizar cualquier posibilidad de coagulación de la línea.
- Lleve inmediatamente la muestra de sangre al laboratorio de radioquímica para su análisis.
- Girando la sangre por el LA
- Pida al LA que prepare todo el equipo(Tabla 1)y use guantes. Tener tres estantes preparados para las muestras: uno para los tubos sanguíneos, otro para pipetar la muestra y otro para muestras rellenas pipeteadas (pre y post-conteo).
- Haga que el LA cambie regularmente los guantes durante todo el procedimiento, especialmente cuando manipule el tubo de conteo. Si el LA tiene contaminación por plasma radiactivo en sus guantes, se puede transferir al tubo de conteo y aumentar espúreamente el número de recuentos registrados de la muestra.
- La muestra de sangre se puede colocar en la centrífuga como lo permite la disponibilidad de recursos de personal, porque se observó el tiempo que se tomó la muestra de sangre, y el momento en que se contó. Gire todas las muestras a una fuerza centrífuga relativa de 724 x g. Los ajustes de centrífuga utilizados para este protocolo son de 2.000 rpm durante 5 min con las curvas de aceleración y desaceleración establecidas en ocho.
- Una vez que la muestra haya sido hilando, coloque el tubo en el estante de pipeteo. Retire la tapa del tubo para no perturbar la separación de la muestra. Coloque un tubo de conteo etiquetado en el bastidor. La etiqueta debe corresponder al tubo sanguíneo.
- Asegúrese de que la punta esté firmemente sujeta a la pipeta. Tenga un pañuelo listo para cualquier goteo. Pipeta firme de 1.000 ml de plasma del tubo sanguíneo, transfiera al tubo de conteo y reemplace las tapas del tubo de conteo y del tubo sanguíneo.
- Coloque el tubo de conteo en el contador de pozos y cuente durante 4 min. Registre la hora de inicio del conteo en la hoja de registro ('tiempo de medición') para cada muestra. Esto es necesario para las correcciones posteriores a la hora de inicio de la adquisición de PET. En los momentos posteriores durante la exploración, haga que la LA realice cada paso en rápida sucesión para evitar una acumulación de muestras pendientes.
- Deseche los residuos de productos sanguíneos en bolsas de riesgo biológico.
- Pida al LA que prepare todo el equipo(Tabla 1)y use guantes. Tener tres estantes preparados para las muestras: uno para los tubos sanguíneos, otro para pipetar la muestra y otro para muestras rellenas pipeteadas (pre y post-conteo).
Access restricted. Please log in or start a trial to view this content.
Resultados
Métodos específicos del estudio
Aquí, se informan detalles específicos del estudio para los resultados representativos. Estos detalles no son críticos para el procedimiento y variarán según los estudios.
Participantes y diseño de tareas
Los participantes (n.o 3, Cuadro 2)se sometieron a un estudio simultáneo de BOLD-fMRI/FDG-fPET. Como este manus...
Access restricted. Please log in or start a trial to view this content.
Discusión
FDG-PET es una potente tecnología de imagen que mide la ingesta de glucosa, un índice de metabolismo de la glucosa cerebral. Hasta la fecha, la mayoría de los estudios de neurociencia utilizan FDG-PET utilizan un enfoque tradicional de administración del bolo, con una resolución de imagen estática que representa la integral de toda la actividad metabólica en el transcurso de la exploración2. Este manuscrito describe dos protocolos alternativos de administración de radiosonda: los protocol...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no declaran conflicto de intereses. La fuente de financiación no participó en el diseño, recopilación, análisis e interpretación de datos del estudio.
Agradecimientos
Jamadar cuenta con el apoyo de un premio Discovery Career Researcher Award del Consejo Australiano de Investigación (ARC) (DECRA DE150100406). Jamadar, Ward y Egan cuentan con el apoyo del Centro de Excelencia ARC para la Función Cerebral Integrativa (CE114100007). Chen y Li cuentan con el apoyo de la Fundación Cultural Reignwood.
Jamadar, Ward, Carey y McIntyre diseñaron el protocolo. Carey, McIntyre, Sasan y Fallon recopilaron los datos. Jamadar, Ward, Parkes y Sasan analizaron los datos. Jamadar, Ward, Carey y McIntyre escribieron el primer borrador del manuscrito. Todos los autores han revisado y aprobado la versión final.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Blood Collection Equipment | |||
| --12-15 vacutainers | Becton Dickinson, NJ USA | 364880 | Remain in sterile packaging until required to put blood in tube |
| --12-15 10mL LH blood collecting tubes | Becton Dickinson | 367526 | Marked with the sample number (e.g., S1, S2…) and subsequently marked with the sample time (e.g., time 0 + x min [T0+x]) |
| --2-15 10mL Terumo syringe | Terumo Tokyo, Japan | SS+10L | These are drawn up on the day of the study and capped with the ampoule that contained the saline |
| -- pre-drawn 0.9% saline flushes | Pfizer, NY, USA | 61039117 | |
| --12-15 5mL Terumo syringes | Terumo Tokyo, Japan | SS+05S | Remain in sterile packaging until ready to withdraw a blood sample |
| Safety & Waste Equipment | All objects arranged on a plastic chair inside the scanner room on the same side as the arm from which the blood samples will be taken. Biohazard and non-biohazard waste bags to be used. Gloves and waste bags to be easily accessible when preparing the radioactivity in the dispensing area and when pipetting the plasma samples. Biohazard and non-biohazard waste bags to be used. All waste generated is checked with the Geiger counter to ensure that radioactive contaminated waste is stored until it is safe to be disposed of according to Australian Radiation Protection and Nuclear Safety Agency (APRANSA) guidelines for Radiation protection series No.6 (2017). | ||
| -- Gloves | Westlab, VIC, Australia | 663-219 | |
| -- waste bags | Austar Packaging, VIC, Australia | YIW6090 | |
| --cello underpads ‘blueys’ Underpads 5 Ply | Halyard Health, NSW, Australia | 2765A | |
| --Blue Sharpie pen | Sharpie, TN, USA | S30063 | |
| Dose Syringes | Remain in sterile packaging until ready for use. All syringes used in this facility have an additional 20% volume capacity above the stated volume on the packaging. This is important for the 50mL syringe where the total capacity of 60mL is used | ||
| --5mL | Terumo Tokyo, Japan | SS+05S | |
| -- 20mL | Terumo Tokyo, Japan | SS+20L | |
| --50mL | Terumo Tokyo, Japan | SS*50LE | |
| --1 Terumo 18-gauge needle | Terumo Tokyo, Japan | NN+1838R | Remain in sterile packaging until ready to inject [18F]FDG into the saline bag |
| --100mL 0.9% saline bag | Baxter Pharmaceutical, IL, USA | AHB1307 | Remain in sterile packaging until ready to inject [18F]FDG |
| Radiochemistry Lab Supplies | |||
| --Heraeus Megafuge 16 centrifuge; Rotor Bioshield 720 | ThermoScientific MA, USA | 75004230 | Relative Centrifugal Force = 724 Our settings are 2000RPM for 5mins. Acceleration and deceleration curves set to 8 |
| --Single well counter | Laboratory Technologies, Inc. IL, USA | 630-365-1000 | Complete daily quality control (includes background count) and protocol set to 18F and 4mins. Cross calibration is performed between the well counter, dose calibrator and scanner on a bi-monthly basis. |
| --Pipette | ISG Xacto, Vienna, Austria | LI10434 | We use a 100-1000 μL set to 1000μL. It is calibrated annually. |
| --12-15 plasma counting tubes | Techno PLAS; SA Australia | P10316SU | Marked in the same manner as the LH blood tubes |
| --12-15 pipette tips | Expell Capp, Denmark | 5130140-1 | |
| --3 test tube racks | Generic | Checked with a Geiger counter to ensure there is no radiation contamination on them | |
| --500mL volumetric flask and distilled water | Generic | Need approximately 500mL of distilled water to prepare the reference for gamma counting | |
| --Synchronised clocks in scanner room, console and radiochemistry lab | Generic | Synchronisation checks are routinely completed in the facility on a weekly basis | |
| --Haemoglobin Monitor | EKF Diagnostic Cardiff, UK Haemo Control. | 3000-0810-6801 | Manufacturer recommended quality control performed before testing on participant’s blood sample. |
| --Glucometre | Roche Accu-Chek | 6870252001 | Accu-Chek Performa is used to measure participant blood sugar levels in mmol/L. Quality control is performed daily using high and low concentration solution control test. |
| Cannulating Equipment | Check expiry dates and train NMT to prepare aseptically for cannulation. | ||
| --Regulation tourniquet | CBC Classic Kimetec GmBH | K5020 | |
| --20, 22 and 24 gauge cannulas | Braun, Melsungen Germany | 4251644-03; 4251628-03; 4251601-03 | |
| --tegaderm dressings | 3M, MN USA | 1624W | |
| --alcohol and chlorhexidine swabs | Reynard Health Supplies, NSW Australia | RHS408 | |
| --0.9% saline 10mL ampoules; for flushes | Pfizer, NY, USA | 61039117 | |
| --10mL syringes | Terumo Tokyo, Japan | SS+10L | |
| --3-way tap | Becton Dickinson Connecta | 394600 | |
| --IV bung | Safsite Braun PA USA | 415068 | |
| --Optional extension tube, microbore extension set | M Devices, Denmark | IV054000 | |
| Scanner Room Equipment | |||
| --Siemens Biograph 3T mMR | Siemens, Erlangen, Germany | ||
| --Portable lead barrier shield | Gammasonics | Custom-built | MR-conditional lead barrier shield. Positioned at the 2000 Gauss line with the castors locked to provide additional shielding of the radioactivity connected to the infusion pump. |
| --Infusion pump BodyGuard 323 MR-conditional infusion pump | Caesarea Medical Electronics | 300-040XP | MR-compatible. This model is cleared for use on 1.5 and 3T scanners at 2000 Gauss with castors locked. |
| --Infusion pump tubing | Caesarea Medical Electronics | 100-163X2YNKS | Tubing is administration set with an anti-siphon valve and male luer lock (REF 100-163X2YNKS). |
| --Lead bricks | Custom built | Tested for ferromagnetic translational force | |
| Other Equipment | |||
| --Syringe shields | Biodex, NY USA | Custom-built | There is a 5mL tungsten syringe shield that is MR-safe, as well as a 50mL lead shield that has been tested for ferromagnetic attraction prior to use in the MR-PET scanner. It is used to transport the radioactive dose from the radiochemistry lab into the scanner to minimise radiation exposure to the NMT. |
| --Geiger counter Model 26-1 Integrated Frisker | Ludlum Measurements, Inc. TX USA | 48-4007 | This is calibrated annually and used to monitor potential contamination and waste. It is not taken into the MR-PET scanner. |
Referencias
- Heurling, K., et al. Quantitative positron emission tomography in brain research. Brain Research. 1670, 220-234 (2017).
- Chen, Z., et al. From simultaneous to synergistic MR-PET brain imaging: A review of hybrid MR-PET imaging methodologies. Human Brain Mapping. 39 (12), 5126-5144 (2018).
- Jones, T., Rabiner, E. A. The development, past achievements, and future directions of brain PET. Journal of Cerebral Blood Flow & Metabolism. 32 (7), 1426-1454 (2012).
- Kety, S. S. Metabolism of the nervous system. , Elsevier. 221-237 (1957).
- Sokoloff, L. The metabolism of the central nervous system in vivo. Handbook of Physiology, section I, neurophysiology. 3, 1843-1864 (1960).
- Harris, J. J., Jolivet, R., Attwell, D. Synaptic energy use and supply. Neuron. 75 (5), 762-777 (2012).
- Mosconi, L., et al. FDG-PET changes in brain glucose metabolism from normal cognition to pathologically verified Alzheimer's disease. European Journal of Nuclear Medicine and Molecular Imaging. 36 (5), 811-822 (2009).
- Pagano, G., Niccolini, F., Politis, M. Current status of PET imaging in Huntington's disease. European Journal of Nuclear Medicine and Molecular Imaging. 43 (6), 1171-1182 (2016).
- Petit-Taboue, M., Landeau, B., Desson, J., Desgranges, B., Baron, J. Effects of healthy aging on the regional cerebral metabolic rate of glucose assessed with statistical parametric mapping. Neuroimage. 7 (3), 176-184 (1998).
- Chugani, H. T., Phelps, M. E., Mazziotta, J. C. Positron emission tomography study of human brain functional development. Annals of Neurology. 22 (4), 487-497 (1987).
- Phelps, M. E., Mazziotta, J. C. Positron emission tomography: human brain function and biochemistry. Science. 228 (4701), 799-809 (1985).
- Zimmer, E. R., et al. [18 F] FDG PET signal is driven by astroglial glutamate transport. Nature Neuroscience. 20 (3), 393(2017).
- Roberts, R. P., Hach, S., Tippett, L. J., Addis, D. R. The Simpson's paradox and fMRI: Similarities and differences between functional connectivity measures derived from within-subject and across-subject correlations. Neuroimage. 135, 1-15 (2016).
- Horwitz, B. The elusive concept of brain connectivity. Neuroimage. 19 (2), 466-470 (2003).
- Moses, W. W. Fundamental limits of spatial resolution in PET. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 648, S236-S240 (2011).
- Tomasi, D. G., et al. Dynamic brain glucose metabolism identifies anti-correlated cortical-cerebellar networks at rest. Journal of Cerebral Blood Flow & Metabolism. 37 (12), 3659-3670 (2017).
- Hahn, A., et al. Quantification of task specific glucose metabolism with constant infusion of 18F-FDG. Journal of Nuclear Medicine. 57 (12), 1933-1940 (2016).
- Hahn, A., et al. Task-relevant brain networks identified with simultaneous PET/MR imaging of metabolism and connectivity. Brain Structure and Function. 223 (3), 1369-1378 (2018).
- Jamadar, S. D., et al. Simultaneous task-based BOLD-fMRI and [18-F] FDG functional PET for measurement of neuronal metabolism in the human visual cortex. Neuroimage. 189, 258-266 (2019).
- Rischka, L., et al. Reduced task durations in functional PET imaging with [18F] FDG approaching that of functional MRI. Neuroimage. 181, 323-330 (2018).
- Villien, M., et al. Dynamic functional imaging of brain glucose utilization using fPET-FDG. Neuroimage. 100, 192-199 (2014).
- Carson, R. E. PET physiological measurements using constant infusion. Nuclear Medicine and Biology. 27 (7), 657-660 (2000).
- Carson, R. E., et al. Comparison of bolus and infusion methods for receptor quantitation: application to [18F] cyclofoxy and positron emission tomography. Journal of Cerebral Blood Flow & Metabolism. 13 (1), 24-42 (1993).
- National Health and Medical Research Council. National statement on ethical conduct in human research. , (2007).
- Australian Radiation Protection and Nuclear Safety Agency. Code of practice for the exposure of humans to ionizing radiation for research purposes. , (2005).
- Jenkinson, M., Beckmann, C. F., Behrens, T. E., Woolrich, M. W., Smith, S. M. FSL. Neuroimage. 62 (2), 782-790 (2012).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310(2010).
- Avants, B., Klein, A., Tustison, N., Woo, J., Gee, J. C. 16th Annual Meeting for the Organization of Human Brain Mapping. , (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), e1005350(2017).
- Tustison, N. J., et al. Large-scale evaluation of ANTs and FreeSurfer cortical thickness measurements. Neuroimage. 99, 166-179 (2014).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. Neuroimage. 54 (3), 2033-2044 (2011).
- Burgos, N., et al. Attenuation correction synthesis for hybrid PET-MR scanners: application to brain studies. IEEE Transactions on Medical Imaging. 33 (12), 2332-2341 (2014).
- Panin, V. Y., Kehren, F., Michel, C., Casey, M. Fully 3-D PET reconstruction with system matrix derived from point source measurements. IEEE Transactions on Medical Imaging. 25 (7), 907-921 (2006).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. Neuroimage. 17 (2), 825-841 (2002).
- Bludau, S., et al. Cytoarchitecture, probability maps and functions of the human frontal pole. Neuroimage. 93, 260-275 (2014).
- Amunts, K., Malikovic, A., Mohlberg, H., Schormann, T., Zilles, K. Brodmann's areas 17 and 18 brought into stereotaxic space-where and how variable? Neuroimage. 11 (1), 66-84 (2000).
- Malikovic, A., et al. Cytoarchitectonic analysis of the human extrastriate cortex in the region of V5/MT+: a probabilistic, stereotaxic map of area hOc5. Cerebral Cortex. 17 (3), 562-574 (2006).
- Wilms, M., et al. Human V5/MT+: comparison of functional and cytoarchitectonic data. Anatomy and Embryology. 210 (5-6), 485-495 (2005).
- Eickhoff, S. B., Heim, S., Zilles, K., Amunts, K. Testing anatomically specified hypotheses in functional imaging using cytoarchitectonic maps. Neuroimage. 32 (2), 570-582 (2006).
- Eickhoff, S. B., et al. Assignment of functional activations to probabilistic cytoarchitectonic areas revisited. Neuroimage. 36 (3), 511-521 (2007).
- Eickhoff, S. B., et al. A new SPM toolbox for combining probabilistic cytoarchitectonic maps and functional imaging data. Neuroimage. 25 (4), 1325-1335 (2005).
- Everett, B. A., et al. Safety of radial arterial catheterization in PET research subjects. Journal of Nuclear Medicine. 50 (10), 1742-1742 (2009).
- Takagi, S., et al. Quantitative PET cerebral glucose metabolism estimates using a single non-arterialized venous-blood sample. Annals of Nuclear Medicine. 18 (4), 297-302 (2004).
- Zanotti-Fregonara, P., Chen, K., Liow, J. S., Fujita, M., Innis, R. B. Image-derived input function for brain PET studies: many challenges and few opportunities. Journal of Cerebral Blood Flow & Metabolism. 31 (10), 1986-1998 (2011).
- O'Loughlin, S., Currie, G. M., Trifonovic, M., Kiat, H. Ambient temperature and cardiac accumulation of 18F-FDG. Journal of Nuclear Medicine Technology. 42 (3), 188-193 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados