È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Radiotracer Administration for High Temporal Resolution Positron Emission Tomoography of the Human Brain: Application to FDG-fPET
In questo articolo
Riepilogo
Questo manoscritto descrive due protocolli di amministrazione del radiotracer per FDG-PET (infusione costante e bolus plus infusione) e li confronta con l'amministrazione del bolo. Le risoluzioni temporali di 16 s sono realizzabili utilizzando questi protocolli.
Abstract
La tomografia funzionale a emissione di positroni (fPET) fornisce un metodo per tracciare obiettivi molecolari nel cervello umano. Con un analogo al glucosio etichettato radioattivamente, 18F-fluordeoxyglucose (FDG-fPET), è ora possibile misurare la dinamica del metabolismo del glucosio con risoluzioni temporali che si avvicinano a quelle della risonanza magnetica funzionale (fMRI). Questa misura diretta dell'assorbimento del glucosio ha un enorme potenziale per comprendere la normale e anormale funzione cerebrale e sondare gli effetti delle malattie metaboliche e neurodegenerative. Inoltre, i nuovi progressi nell'hardware ibrido MR-PET consentono di cogliere le fluttuazioni del glucosio e dell'ossigenazione del sangue contemporaneamente utilizzando fMRI e FDG-fPET.
La risoluzione temporale e il segnale al rumore delle immagini FDG-fPET dipendono in modo critico dalla somministrazione del radiotracer. Questo lavoro presenta due protocolli alternativi di infusione continua e li confronta con un approccio tradizionale al bolo. Presenta un metodo per l'acquisizione di campioni di sangue, PET di blocco del tempo, risonanza magnetica, stimolo sperimentale e la somministrazione di traccianti non tradizionali. Utilizzando uno stimolo visivo, i risultati del protocollo mostrano le mappe corticali della risposta del glucosio a stimoli esterni a livello individuale con una risoluzione temporale di 16 s.
Introduzione
La tomografia a emissione di positroni (PET) è una potente tecnica di imaging molecolare ampiamente utilizzata sia in ambito clinico che di ricerca (vedere Heurling et al.1 per una recente revisione completa). Gli obiettivi molecolari che possono essere immagine utilizzando PET sono limitati solo dalla disponibilità di radiotracciatori, e numerosi traccianti sono stati sviluppati per l'immagine di recettori del metabolismo neurale, proteine ed enzimi2,3. Nelle neuroscienze, uno dei radiotracciatori più utilizzati è 18F-fluorodeoxyglucose (FDG-PET), che misura l'assorbimento del glucosio, di solito interpretato come un indice del metabolismo cerebrale del glucosio. Il cervello umano richiede un apporto costante e affidabile di glucosio per soddisfare il suo fabbisogno energetico4,5, e 70-80% del metabolismo del glucosio cerebrale viene utilizzato dai neuroni durante la trasmissione sinaptica6. Cambiamenti al metabolismo del glucosio cerebrale sono pensati per avviare e contribuire a numerose condizioni, tra cui psichiatriche, neurodegenerative, e condizioni ischemiche7,8,9. Inoltre, poiché l'assorbimento degli FDG è proporzionale all'attività sinaptica10,11,12, è considerato un indice più diretto e meno confuso di attività neuronale rispetto al sangue più utilizzato la risposta di risonanza magnetica funzionale dipendente dal livello di ossigenazione (BOLD-fMRI). BOLD-fMRI è un indice indiretto dell'attività neurale e misura i cambiamenti nell'emoglobina deossigenata che si verificano a seguito di una cascata di cambiamenti neurovascolari a seguito dell'attività neuronale.
La maggior parte degli studi FDG-PET del cervello umano acquisiscono immagini statiche dell'assorbimento del glucosio cerebrale. Il partecipante riposa tranquillamente per 10 min con gli occhi aperti in una stanza buia. La dose completa di radiotracer viene somministrata come bolus per un periodo di secondi, e il partecipante poi riposa per altri 30 min. Dopo il periodo di assorbimento, i partecipanti vengono posizionati al centro dello scanner PET e viene acquisita un'immagine PET che riflette la distribuzione FDG cumulativa nel corso dei periodi di assorbimento e scansione. Pertanto, l'attività neuronale indicizzata dall'immagine PET rappresenta la media cumulativa di tutta l'attività cognitiva nei periodi di assorbimento e scansione e non è specifica dell'attività cognitiva durante la scansione. Questo metodo ha fornito una grande comprensione del metabolismo cerebrale del cervello e della funzione neuronale. Tuttavia, la risoluzione temporale è uguale alla durata della scansione (spesso 45 min, producendo in modo efficace una misurazione statica dell'assorbimento del glucosio; questo si confronta sfavorevolmente alla risposta neuronale durante i processi cognitivi e gli esperimenti comuni in neuroimaging. A causa della limitata risoluzione temporale, il metodo fornisce un indice non specifico dell'assorbimento del glucosio (cioè non bloccato a un compito o a un processo cognitivo) e non può fornire misure di variabilità all'interno del soggetto, il che può portare a conclusioni scientifiche errate dovute al Paradosso di Simpson13. Il Paradosso di Simpson è uno scenario, in cui le relazioni cervello-comportamento calcolate tra i soggetti non sono necessariamente indicative delle stesse relazioni testate all'interno dei soggetti. Inoltre, i recenti tentativi di applicare misure di connettività funzionale a FDG-PET possono misurare solo la connettività tra i soggetti. Pertanto, le differenze di connettività possono essere confrontate solo tra i gruppi e non possono essere calcolate per i singoli soggetti. Mentre è discutibile ciò che esattamente tra i soggetti misure di connettività14, è chiaro che le misure calcolate tra i soggetti, ma non all'interno di argomenti, non possono essere utilizzate come biomarcatore per gli stati di malattia o utilizzate per esaminare la fonte di variazione individuale.
Negli ultimi cinque anni, lo sviluppo e la più ampia accessibilità degli scanner RM-PET simultanei di grado clinico hanno suscitato un rinnovato interesse di ricerca nell'imaging FDG-PET2 nelle neuroscienze cognitive. Con questi sviluppi, i ricercatori si sono concentrati sul miglioramento della risoluzione temporale di FDG-PET per avvicinarsi agli standard di BOLD-fMRI (0,5,5 s). Si noti che la risoluzione spaziale di BOLD-fMRI può affrontare risoluzioni submillimetriche, ma la risoluzione spaziale di FDG-PET è fondamentalmente limitata a circa 0,54 mm di larghezza completa a metà massima (FWHM) a causa della gamma dipositron15. Le acquisizioni dinamiche di FDG-PET, spesso utilizzate clinicamente, utilizzano il metodo di amministrazione del bolus e ricostruiscono i dati in modalità elenco nei contenitori. Il metodo bolus dinamico FDG-PET offre una risoluzione temporale di circa 100 s (ad esempio, Tomasi et al.16). Questo è chiaramente molto meglio rispetto all'imaging statico FDG-PET, ma non è paragonabile a BOLD-fMRI. Inoltre, la finestra in cui può essere esaminata la funzione cerebrale è limitata, perché la concentrazione di plasma sanguigno del FDG diminuisce subito dopo la somministrazione del bolo.
Per ampliare questa finestra sperimentale, una manciata di studi17,18,19,20,21 hanno adattato il metodo di infusione del radiotracer precedentemente proposto da Carson22, 23. In questo metodo, talvolta descritto come "FDG-PET funzionale" (FDG-fPET, analogo a BOLD-fMRI), il radiotracer viene somministrato come infusione costante nel corso dell'intera scansione PET (90 min). L'obiettivo del protocollo di infusione è mantenere una fornitura costante di plasma di FDG per monitorare i cambiamenti dinamici nell'assorbimento del glucosio nel tempo. In uno studio proof-of-concept, Villien et al.21 ha utilizzato un protocollo di infusione costante e UNA risonanza magnetica simultanea, la RM/FDG-fPET per mostrare cambiamenti dinamici nell'assorbimento del glucosio in risposta alla stimolazione a scacchiera con una risoluzione temporale di 60 s. Studi successivi hanno utilizzato questo metodo per mostrare FDG-fPET bloccati dal blocco di attività (cioè bloccati nel tempo a uno stimolo esterno19) e FDG-fPET relativi alle attività (cioè non bloccati nel tempo a uno stimolo esterno17, 18)assorbimento del glucosio. Utilizzando questi metodi, sono state ottenute risoluzioni temporali FDG-fPET di 60 s, il che è un sostanziale miglioramento rispetto ai metodi di bolus. I dati preliminari mostrano che il metodo di infusione può fornire risoluzioni temporali di 20-60 s19.
Nonostante i promettenti risultati del metodo di infusione costante, le curve di radioattività plasmatica di questi studi mostrano che il metodo di infusione non è sufficiente per raggiungere uno stato costante entro il lasso di tempo di una scansione di 90 min19,21. Oltre alla costante procedura di infusione, Carson22 ha anche proposto una procedura ibrida bolus/infusione, in cui l'obiettivo è quello di raggiungere rapidamente l'equilibrio all'inizio della scansione, e quindi sostenere i livelli di radioattività al plasma all'equilibrio per il durata della scansione. Rischka et al.20 ha recentemente applicato questa tecnica utilizzando un 20% bolus più 80% infusione. Come previsto, la funzione di input arterioso è rapidamente salita al di sopra dei livelli di base ed è stata sostenuta a un tasso più elevato per un tempo più lungo, rispetto ai risultati utilizzando una procedura di solo infusione19,21.
Questo documento descrive i protocolli di acquisizione per l'acquisizione di scansioni FDG-fPET ad alta risoluzione temporale utilizzando l'amministrazione di solo infusione e radiotracer bolus/infusione. Questi protocolli sono stati sviluppati per l'uso in un ambiente MRI-PET simultaneo con un tempo di acquisizione di 90-95 min19. Nel protocollo, vengono prelevati campioni di sangue per quantificare la radioattività del siero plasma per la successiva quantificazione delle immagini PET. Mentre l'obiettivo del protocollo è l'applicazione di metodi di infusione per il neuroimaging funzionale utilizzando BOLD-fMRI/FDG-fPET, questi metodi possono essere applicati a qualsiasi studio FDG-fPET indipendentemente dal fatto che la risonanza magnetica simultanea, BOLD-f La risonanza magnetica, la tomografia computerizzata (TC) o altre neuroimmagini vengono acquisite. Figura 1 Mostra il diagramma di flusso delle procedure in questo protocollo.
Protocollo
Questo protocollo è stato rivisto e approvato dal Comitato Etico della Ricerca Umana dell'Università di Monash (numero di approvazione CF16/1108 - 2016000590) in conformità con la dichiarazione nazionale australiana sulla condotta etica nella ricerca umana24. Le procedure sono state sviluppate sotto la guida di un fisico medico accreditato, tecnologo di medicina nucleare e radiografo clinico. I ricercatori dovrebbero fare riferimento ai loro esperti locali e linee guida per la somministrazione di radiazioni ionizzanti negli esseri umani.
1. Attrezzature e personale necessari
- Vedere la Tabella dei materiali per la sala scanner, laboratorio di radiochimica, e materiali generali. Per il radiotracer è stato utilizzato un fornitore commerciale.
- Nell'ambiente simultaneo MRI-PET, utilizzare quattro persone: un radiografo (RG) per eseguire la scansione, un tecnico medico nucleare (NMT) per supervisionare la somministrazione del radiotracer e l'acquisizione di campioni di sangue, un assistente di laboratorio (LA) per far girare il sangue, e un assistente di ricerca (RA) responsabile di supervisionare la presentazione sperimentale di progettazione e stimolo.
2. Preparazione
- Preparazione della dose di tracciamento da parte dell'NMT
- Calcolare il volume di infusione che verrà somministrato nel corso della scansione. In questo protocollo, il tasso di infusione è di 0,01 mL/s superiore a 95 min. Quindi, in una scansione di 95 min, i partecipanti ricevono 0,01 mL/s x 60 s x 95 min x 57 mL.
- Calcolare la dose di tracciante che verrà diluita nella soluzione salina somministrata. In questo protocollo, una dose totale di 260 MBq viene somministrata al partecipante oltre 95 min. Questa dose è stata scelta per limitare l'esposizione alle radiazioni a 4,9 mSv, per mantenere all'interno della categorizzazione "basso livello" secondo le linee guida dell'Agenzia australiana per la protezione dalle radiazioni e la sicurezza nucleare (ARPANSA) per l'esposizione degli esseri umani alle radiazioni ionizzanti25. Decadimento corretto 260 MBq dal punto di infusione centrale (47,5 min) torna a T0. Utilizzo dell'equazione 1, risolvere per A0
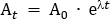
Quando At è la radioattività (MBq) a metà tempo dell'infusione, A0 è la radioattività iniziale, e il - è la costante di decadimento radioattivo specifica per il tracciante. Per la FDG, il valore di è s 0,693/T1/2. T1/2 è l'emivita di 18F (110 min).
NOTA: In questo esempio, At è 260 MBq, s, 0,693/110, e t -47,5, quindi A0 è 350.942 MBq. - Calcolare la dose di radiotracer necessaria per il sacchetto salino da 100 mL che verrà utilizzato per somministrare la dose al partecipante. Il radiotracer necessario per il sacchetto salitico viene diluito fino a un volume totale di 5 mL e redatto in una siringa da 5 mL. Pertanto, per il sacchetto salino da 100 mL, il fattore di diluizione è il volume della salina (100 mL) oltre al volume di 5 mL della siringa con radiotracciatore. Questo volume totale di 105 mL è diviso per il volume di infusione di 57 mL (cioè 105 mL/57 mL - 1.842). Quindi, la radioattività totale in un volume di 5 mL necessaria per l'aggiunta al sacchetto da 100 mL è A0 x il fattore di diluizione (cioè 350.942 MBq x 1.842 x 646,44 MBq). Aggiungere aquestolmente il radiotracer al sacchetto salino.
NOTA: È importante notare che l'attività calcolata di 646,44 MBq che viene aggiunta al sacchetto salina è l'attività richiesta all'inizio dell'infusione. Generalmente, le dosi per questo protocollo sono preparate tra 15 min a 1 h prima della somministrazione. Pertanto, è importante tenere conto del decadimento del radioisotopo. Equazione 1 in 2.1.2. può essere utilizzato per tenere conto di questo, dove il tempo (t) è il numero totale di minuti dalla preparazione della dose a quando l'attività sarà somministrata, At - 646,44 MBq, risolvendo per A0. - Preparare la dose di innesco. Ritirare 20 mL dalla borsa in una siringa e farla avvolgere. Calibrare questa siringa da 20 mL e l'etichetta. La siringa è calibrata come controllo di riferimento per garantire che la radioattività si sia dispersa uniformemente all'interno del sacchetto salino.
- Preparare la dose. Utilizzando una siringa da 50 mL, ritirare 60 mL dal sacchetto e il tappo con un tappo Rosso Combi. Questa siringa non è calibrata, in quanto la concentrazione della radioattività è nota dal momento in cui è stata aggiunta al sacchetto salino (passaggio 2.1.3). Conservare entrambe le siringhe nel laboratorio di radiochimica fino a quando non è pronto per la scansione.
NOTA: È possibile disegnare un volume di 60 mL in una siringa da 50 mL, perché le siringhe Terumo sono contrassegnate al 20% al di sopra del volume etichettato (ad esempio, una siringa da 50 mL è contrassegnata da 60 mL). - Preparare la dose di riferimento. Riempire un flacone volumetrico da 500 ml con circa 480 mL di acqua distillata. Disegnare 10 MBq di 18F-FDG in una siringa, corretta dal decadimento all'ora di inizio della scansione (utilizzando l'equazione 1) e aggiungerla al pallone. Completa il volume fino alla marca di 500 mL con più acqua distillata e mescola accuratamente. Apporre etichette pre e post-calibrazione per la siringa.
- Preparazione della sala scanner da parte dell'NMT
- Una volta che il partecipante è posizionato nello scanner, c'è molto poco spazio per manipolare o recuperare la linea per l'infusione o campioni di sangue se si verifica un blocco. Preparare la sala scanner per ridurre al minimo la possibilità di blocco della linea.
- Assicurarsi che tutte le attrezzature per la raccolta del sangue siano facilmente raggiungibili dal sito di raccolta. Posizionare i sottopad alla fine della cannula e su qualsiasi superficie che conterrà contenitori di sangue. Posizionare i bidoni per rifiuti regolari e rifiuti biopericolosi a portata di mano del sito di raccolta del sangue.
- Preparazione della pompa di infusione da parte del NMT
- Impostare la pompa di infusione nella sala scanner sul lato che verrà collegata al partecipante. Costruire mattoni di piombo intorno alla base della pompa e posizionare lo scudo di piombo di fronte alla pompa. Collegare il tubo per la pompa di infusione che fornisce l'infusione al partecipante e assicurarsi che sia stato inserito il tasso di infusione corretto. Per questo protocollo, la frequenza è 0,01 mL/s.
- Prime il tubo prima che sia collegato alla cannula del partecipante. Collegare la dose di innesco da 20 ml alla pompa di infusione. Alla fine del tubo che sarà collegato al partecipante, allegare un rubinetto a tre vie e una siringa vuota da 20 mL. Assicurarsi che il rubinetto sia posizionato per consentire alla soluzione 18F-FDG di fluire dalla dose di innesco attraverso il tubo e raccogliere solo nella siringa vuota.
- Preimpostare la pompa di infusione per innescare un volume di 15 mL. Selezionare il pulsante Prime sulla pompa e seguire le istruzioni per inizializzare la linea.
- Collegare la siringa di dose da 50 mL alla pompa di infusione al posto della dose di priming. La dose innescata da 15 mL sul rubinetto a tre può rimanere lì fino a quando il partecipante non è pronto per essere collegato alla pompa.
- Preparazione dei partecipanti da parte di NMT, RA e RG
- Consigliare ai partecipanti di digiunare per 6 h e di consumare solo acqua (circa due bicchieri), prima della scansione.
- Chiedi all'AR di eseguire le procedure di consenso e di acquisire misure aggiuntive (ad esempio, indagini demografiche, batterie cognitive, ecc.). Avere le nmT e RG condurre gli schermi di sicurezza, la sicurezza di revisione NMT per la scansione PET (ad esempio, l'esclusione per gravidanza, diabete, chemioterapia o radioterapia nelle precedenti 8 settimane e le allergie note), e la sicurezza dei partecipanti revisione RG per la scansione RM (ad esempio, l'esclusione per gravidanza, impianti metallici medici o non medici, impianti dentali non rimovibili, claustrofobia).
- Cannula il partecipante.
- Utilizzare due cannule: una per la somministrazione della dose e l'altra per il prelievo del sangue. La cannula più appropriata varia da partecipante a seconda dei partecipanti, ma la vena più adatta dovrebbe essere riservata alla raccolta del sangue. Una cannula da 22 G è la dimensione minima preferita. Raccogliere un campione di sangue di base da 10 ml durante la cannulating. Scollegare tutti i vampate di salina sotto pressione per mantenere la pacienza della linea.
- Verificare il livello di zucchero nel sangue del partecipante e altre misure del sangue di base (ad esempio, l'emoglobina) dal campione di base.
- Posizionamento del partecipante nello scanner da parte di RG e NMT
- Fare in modo che il file RG posizioni il partecipante nel foro dello scanner. Per scansioni lunghe, è imperativo garantire il comfort al fine di ridurre il rischio di abbandono del partecipante e movimento artefatto a causa di disagio. Il partecipante deve essere coperto con una coperta usa e getta per mantenere una temperatura corporea confortevole.
- Avere il NMT lavare la cannula per assicurarsi che sia brevettata con resistenza minima prima di collegare la linea di infusione. Una volta collegato, il tubo può essere leggermente registrato vicino al polso. Istruire il partecipante a tenere il braccio raddrizzato. Utilizzare supporti come schiuma o cuscini per il comfort. Chiedi al NMT anche di controllare la cannula che verrà utilizzata per i campioni di plasma per garantire che sia in grado di prelevare il sangue con una resistenza minima. Potrebbe essere necessario collegare un tubo di estensione innescato con normale salina per rendere la cannula più accessibile mentre il partecipante è nello scanner. Se necessario, deve essere controllato per eventuali perdite.
- Una volta che il soggetto è nel foro dello scanner, assicurarsi che il NMT controlli di avere un accesso adeguato a entrambe le cannule.
- Chiedi al NMT di informare l'RG e l'AR se ci sono problemi con la cannula di raccolta del sangue, la cannula di infusione o la pompa di infusione (ad esempio, occlusione, batteria, stravaganze) in qualsiasi momento durante la scansione.
3. Eseguire la scansione del partecipante
- Avvio della scansione con NMT, RG e RA
- All'inizio della scansione, collocare l'NMT nella sala scanner per monitorare l'apparecchiatura di infusione. Assicurarsi che l'NMT indossi la protezione dell'udito e utilizzi lo scudo barriera per ridurre al minimo l'esposizione alle radiazioni dalla dose, ove possibile.
- Mentre il RG esegue la scansione del localizzatore per assicurarsi che il partecipante si trova nella posizione corretta, controllare i dettagli per l'acquisizione PET (ad esempio, la durata della scansione, la raccolta dei dati in modalità elenco, l'isotopo corretto).
- Progettare il protocollo in modo che l'acquisizione del PET inizi con la prima sequenza di risonanza magnetica. Il RG prepara e inizia la sequenza di risonanza magnetica. L'ora di inizio dell'acquisizione PET di 95 min è bloccata nel tempo all'inizio della sequenza MRI. Se necessario, l'NMT deve fornire il bolus al momento dell'acquisizione pet (Figura 1).
- Avviare la pompa di infusione. Il RG deve segnalare il NMT (ad esempio, tramite un segno di pollice in su) per avviare la pompa 30 s dopo l'inizio dell'acquisizione PET. Questo protocollo avvia la pompa di infusione 30 s dopo l'ora di inizio della scansione per fornire un buffer di sicurezza in caso di guasto della scansione. Ciò garantisce inoltre che la prima immagine scattata durante la scansione PET indicizzi il cervello prima della somministrazione del radiotracer per la raccolta completa dei dati della curva di attività temporale. Avere il NMT osservare la pompa per assicurarsi che ha iniziato a infondere il 18F-FDG e che non vi è alcuna occlusione immediata della linea.
- Chiedere all'AR di avviare qualsiasi stimolo esterno al momento concordato (cioè, all'inizio di un blocco funzionale run/experimental) e di calcolare i tempi dei campioni di sangue. Un modulo di record di esempio è illustrato nel Supplemento 1. Chiedi all'AUTORITÀ di calcolare il tempo previsto di ogni campione di sangue e di fornire copie all'NMT e all'assistente di laboratorio (LA). Chiedere all'AR di assicurarsi che l'NMT prenda i campioni di sangue all'incirca al momento corretto e monitori le apparecchiature (ad esempio, pompa di infusione, stimolo) per eventuali segni di errori.
- Prelevare campioni di sangue a intervalli di tempo regolari
- Chiedi al NMT e all'AR di prendere un campione ogni 10 min. Di solito ci sono 10 campioni in totale, senza includere il campione di base.
- Se si acquisiscono scansioni RM contemporaneamente con scansioni PET, fare in modo che il NMT indossi la protezione dell'udito quando entra nella sala scanner.
- Fai pulire i guanti e i tamponi NMT. Mentre il sito di cannula si asciuga, aprire una siringa da 5 mL e una siringa da 10 mL, un vacutainer e un colore salina da 10 mL.
- Utilizzando la siringa da 5 mL, ritirare 4-5 mL di sangue fresco e scartare la siringa nei rifiuti di pericolo biologico.
- Utilizzando la siringa da 10 mL, ritirare fino a 10 mL di sangue. Il volume può essere limitato dalla facilità con cui il sangue può essere prelevato. È importante ridurre al minimo qualsiasi resistenza causando successivamente danni ai globuli rossi che possono emolizzare. Nel punto di raccolta media, chiedi al segnale NMT all'AR, che segnerà questa volta sul modulo di registrazione (Supplemento 1) come tempo 'effettivo' del campione.
- Collegare la siringa da 10 mL al vacutainer e quindi depositare il sangue nel relativo tubo sanguigno.
- Sciacquare rapidamente la cannula con 10 mL di salina, scollegata sotto pressione, per ridurre al minimo la possibilità di coagulazione della linea.
- Immediatamente portare il campione di sangue al laboratorio di radiochimica per l'analisi.
- Girare il sangue vicino al LA
- Chiedi al LA di preparare tutta l'attrezzatura (Tabella 1) e di indossare i guanti. Hanno tre rack per i campioni: uno per i tubi del sangue, uno per il pipettaggio del campione e uno per i campioni con tubi riempiti (pre e post-conteggio).
- Avere il LA cambiare regolarmente i guanti durante la procedura, soprattutto quando si maneggia il tubo di conteggio. Se l'ANA ha una contaminazione radioattiva al plasma sui guanti, può essere trasferita al tubo di conteggio e aumentare spuriamente il numero di conteggi registrati del campione.
- Il campione di sangue può essere collocato nella centrifuga come la disponibilità di risorse di personale permette, perché il tempo che il campione di sangue è stato prelevato, e il tempo è stato contato è stato notato. Girare tutti i campioni ad una forza centrifuga relativa di 724 x g. Le impostazioni di centrifuga utilizzati per questo protocollo sono 2.000 rpm per 5 min con le curve di accelerazione e decelerazione impostate su otto.
- Una volta che il campione è stato filato, posizionare il tubo nel rack di pipettaggio. Rimuovere il tappo del tubo per non disturbare la separazione del campione. Posizionare un tubo di conteggio etichettato nel rack. L'etichetta deve corrispondere al tubo sanguigno.
- Assicurarsi che la punta sia fissata saldamente alla pipetta. Avere un tessuto pronto per le gocce. Costantemente pipette 1.000 .
- Posizionare il tubo di conteggio nel contatore dei pozzi e contare per 4 min. Registrare l'ora di inizio del conteggio sul foglio di registrazione ('tempo di misurazione') per ogni campione. Ciò è necessario per le successive correzioni all'ora di inizio dell'acquisizione PET. In momenti successivi durante la scansione, fare in modo che l'AN esegua ogni fase in rapida successione per evitare un arretrato di campioni.
- Smaltire eventuali rifiuti di prodotti ematici in sacchetti per il rischio biologico.
- Chiedi al LA di preparare tutta l'attrezzatura (Tabella 1) e di indossare i guanti. Hanno tre rack per i campioni: uno per i tubi del sangue, uno per il pipettaggio del campione e uno per i campioni con tubi riempiti (pre e post-conteggio).
Risultati
Metodi specifici dello studio
Qui vengono riportati i dettagli specifici dello studio per i risultati rappresentativi. Questi dettagli non sono critici per la procedura e variano a seconda degli studi.
Partecipanti e progettazione delle attività
I partecipanti (n - 3, tabella 2) hanno subito uno studio simultaneo BOLD-fMRI/FDG-fPET. Poiché questo manosc...
Discussione
FDG-PET è una potente tecnologia di imaging che misura l'assorbimento del glucosio, un indice del metabolismo del glucosio cerebrale. Ad oggi, la maggior parte degli studi di neuroscienze che utilizzano FDG-PET utilizzano un approccio tradizionale di somministrazione di bolus, con una risoluzione statica dell'immagine che rappresenta l'integrale di tutta l'attività metabolica nel corso della scansione2. Questo manoscritto descrive due protocolli alternativi di amministrazione dei radiotracer: i ...
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi. La fonte di finanziamento non è stata coinvolta nella progettazione dello studio, nella raccolta, nell'analisi e nell'interpretazione dei dati.
Riconoscimenti
Jamadar è supportato da un Australian Council for Research (ARC) Discovery Early Career Researcher Award (DECRA DE150100406). Jamadar, Ward ed Egan sono supportati dal Centro di eccellenza ARC for Integrative Brain Function (CE114100007). Chen e Li sono sostenuti da finanziamenti della Reignwood Cultural Foundation.
Jamadar, Ward, Carey e McIntyre hanno progettato il protocollo. Carey, McIntyre, Sasan e Fallon hanno raccolto i dati. Jamadar, Ward, Parkes e Sasan hanno analizzato i dati. Jamadar, Ward, Carey e McIntyre scrissero la prima bozza del manoscritto. Tutti gli autori hanno esaminato e approvato la versione finale.
Materiali
| Name | Company | Catalog Number | Comments |
| Blood Collection Equipment | |||
| --12-15 vacutainers | Becton Dickinson, NJ USA | 364880 | Remain in sterile packaging until required to put blood in tube |
| --12-15 10mL LH blood collecting tubes | Becton Dickinson | 367526 | Marked with the sample number (e.g., S1, S2…) and subsequently marked with the sample time (e.g., time 0 + x min [T0+x]) |
| --2-15 10mL Terumo syringe | Terumo Tokyo, Japan | SS+10L | These are drawn up on the day of the study and capped with the ampoule that contained the saline |
| -- pre-drawn 0.9% saline flushes | Pfizer, NY, USA | 61039117 | |
| --12-15 5mL Terumo syringes | Terumo Tokyo, Japan | SS+05S | Remain in sterile packaging until ready to withdraw a blood sample |
| Safety & Waste Equipment | All objects arranged on a plastic chair inside the scanner room on the same side as the arm from which the blood samples will be taken. Biohazard and non-biohazard waste bags to be used. Gloves and waste bags to be easily accessible when preparing the radioactivity in the dispensing area and when pipetting the plasma samples. Biohazard and non-biohazard waste bags to be used. All waste generated is checked with the Geiger counter to ensure that radioactive contaminated waste is stored until it is safe to be disposed of according to Australian Radiation Protection and Nuclear Safety Agency (APRANSA) guidelines for Radiation protection series No.6 (2017). | ||
| -- Gloves | Westlab, VIC, Australia | 663-219 | |
| -- waste bags | Austar Packaging, VIC, Australia | YIW6090 | |
| --cello underpads ‘blueys’ Underpads 5 Ply | Halyard Health, NSW, Australia | 2765A | |
| --Blue Sharpie pen | Sharpie, TN, USA | S30063 | |
| Dose Syringes | Remain in sterile packaging until ready for use. All syringes used in this facility have an additional 20% volume capacity above the stated volume on the packaging. This is important for the 50mL syringe where the total capacity of 60mL is used | ||
| --5mL | Terumo Tokyo, Japan | SS+05S | |
| -- 20mL | Terumo Tokyo, Japan | SS+20L | |
| --50mL | Terumo Tokyo, Japan | SS*50LE | |
| --1 Terumo 18-gauge needle | Terumo Tokyo, Japan | NN+1838R | Remain in sterile packaging until ready to inject [18F]FDG into the saline bag |
| --100mL 0.9% saline bag | Baxter Pharmaceutical, IL, USA | AHB1307 | Remain in sterile packaging until ready to inject [18F]FDG |
| Radiochemistry Lab Supplies | |||
| --Heraeus Megafuge 16 centrifuge; Rotor Bioshield 720 | ThermoScientific MA, USA | 75004230 | Relative Centrifugal Force = 724 Our settings are 2000RPM for 5mins. Acceleration and deceleration curves set to 8 |
| --Single well counter | Laboratory Technologies, Inc. IL, USA | 630-365-1000 | Complete daily quality control (includes background count) and protocol set to 18F and 4mins. Cross calibration is performed between the well counter, dose calibrator and scanner on a bi-monthly basis. |
| --Pipette | ISG Xacto, Vienna, Austria | LI10434 | We use a 100-1000 μL set to 1000μL. It is calibrated annually. |
| --12-15 plasma counting tubes | Techno PLAS; SA Australia | P10316SU | Marked in the same manner as the LH blood tubes |
| --12-15 pipette tips | Expell Capp, Denmark | 5130140-1 | |
| --3 test tube racks | Generic | Checked with a Geiger counter to ensure there is no radiation contamination on them | |
| --500mL volumetric flask and distilled water | Generic | Need approximately 500mL of distilled water to prepare the reference for gamma counting | |
| --Synchronised clocks in scanner room, console and radiochemistry lab | Generic | Synchronisation checks are routinely completed in the facility on a weekly basis | |
| --Haemoglobin Monitor | EKF Diagnostic Cardiff, UK Haemo Control. | 3000-0810-6801 | Manufacturer recommended quality control performed before testing on participant’s blood sample. |
| --Glucometre | Roche Accu-Chek | 6870252001 | Accu-Chek Performa is used to measure participant blood sugar levels in mmol/L. Quality control is performed daily using high and low concentration solution control test. |
| Cannulating Equipment | Check expiry dates and train NMT to prepare aseptically for cannulation. | ||
| --Regulation tourniquet | CBC Classic Kimetec GmBH | K5020 | |
| --20, 22 and 24 gauge cannulas | Braun, Melsungen Germany | 4251644-03; 4251628-03; 4251601-03 | |
| --tegaderm dressings | 3M, MN USA | 1624W | |
| --alcohol and chlorhexidine swabs | Reynard Health Supplies, NSW Australia | RHS408 | |
| --0.9% saline 10mL ampoules; for flushes | Pfizer, NY, USA | 61039117 | |
| --10mL syringes | Terumo Tokyo, Japan | SS+10L | |
| --3-way tap | Becton Dickinson Connecta | 394600 | |
| --IV bung | Safsite Braun PA USA | 415068 | |
| --Optional extension tube, microbore extension set | M Devices, Denmark | IV054000 | |
| Scanner Room Equipment | |||
| --Siemens Biograph 3T mMR | Siemens, Erlangen, Germany | ||
| --Portable lead barrier shield | Gammasonics | Custom-built | MR-conditional lead barrier shield. Positioned at the 2000 Gauss line with the castors locked to provide additional shielding of the radioactivity connected to the infusion pump. |
| --Infusion pump BodyGuard 323 MR-conditional infusion pump | Caesarea Medical Electronics | 300-040XP | MR-compatible. This model is cleared for use on 1.5 and 3T scanners at 2000 Gauss with castors locked. |
| --Infusion pump tubing | Caesarea Medical Electronics | 100-163X2YNKS | Tubing is administration set with an anti-siphon valve and male luer lock (REF 100-163X2YNKS). |
| --Lead bricks | Custom built | Tested for ferromagnetic translational force | |
| Other Equipment | |||
| --Syringe shields | Biodex, NY USA | Custom-built | There is a 5mL tungsten syringe shield that is MR-safe, as well as a 50mL lead shield that has been tested for ferromagnetic attraction prior to use in the MR-PET scanner. It is used to transport the radioactive dose from the radiochemistry lab into the scanner to minimise radiation exposure to the NMT. |
| --Geiger counter Model 26-1 Integrated Frisker | Ludlum Measurements, Inc. TX USA | 48-4007 | This is calibrated annually and used to monitor potential contamination and waste. It is not taken into the MR-PET scanner. |
Riferimenti
- Heurling, K., et al. Quantitative positron emission tomography in brain research. Brain Research. 1670, 220-234 (2017).
- Chen, Z., et al. From simultaneous to synergistic MR-PET brain imaging: A review of hybrid MR-PET imaging methodologies. Human Brain Mapping. 39 (12), 5126-5144 (2018).
- Jones, T., Rabiner, E. A. The development, past achievements, and future directions of brain PET. Journal of Cerebral Blood Flow & Metabolism. 32 (7), 1426-1454 (2012).
- Kety, S. S. . Metabolism of the nervous system. , 221-237 (1957).
- Sokoloff, L. The metabolism of the central nervous system in vivo. Handbook of Physiology, section I, neurophysiology. 3, 1843-1864 (1960).
- Harris, J. J., Jolivet, R., Attwell, D. Synaptic energy use and supply. Neuron. 75 (5), 762-777 (2012).
- Mosconi, L., et al. FDG-PET changes in brain glucose metabolism from normal cognition to pathologically verified Alzheimer's disease. European Journal of Nuclear Medicine and Molecular Imaging. 36 (5), 811-822 (2009).
- Pagano, G., Niccolini, F., Politis, M. Current status of PET imaging in Huntington's disease. European Journal of Nuclear Medicine and Molecular Imaging. 43 (6), 1171-1182 (2016).
- Petit-Taboue, M., Landeau, B., Desson, J., Desgranges, B., Baron, J. Effects of healthy aging on the regional cerebral metabolic rate of glucose assessed with statistical parametric mapping. Neuroimage. 7 (3), 176-184 (1998).
- Chugani, H. T., Phelps, M. E., Mazziotta, J. C. Positron emission tomography study of human brain functional development. Annals of Neurology. 22 (4), 487-497 (1987).
- Phelps, M. E., Mazziotta, J. C. Positron emission tomography: human brain function and biochemistry. Science. 228 (4701), 799-809 (1985).
- Zimmer, E. R., et al. [18 F] FDG PET signal is driven by astroglial glutamate transport. Nature Neuroscience. 20 (3), 393 (2017).
- Roberts, R. P., Hach, S., Tippett, L. J., Addis, D. R. The Simpson's paradox and fMRI: Similarities and differences between functional connectivity measures derived from within-subject and across-subject correlations. Neuroimage. 135, 1-15 (2016).
- Horwitz, B. The elusive concept of brain connectivity. Neuroimage. 19 (2), 466-470 (2003).
- Moses, W. W. Fundamental limits of spatial resolution in PET. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 648, S236-S240 (2011).
- Tomasi, D. G., et al. Dynamic brain glucose metabolism identifies anti-correlated cortical-cerebellar networks at rest. Journal of Cerebral Blood Flow & Metabolism. 37 (12), 3659-3670 (2017).
- Hahn, A., et al. Quantification of task specific glucose metabolism with constant infusion of 18F-FDG. Journal of Nuclear Medicine. 57 (12), 1933-1940 (2016).
- Hahn, A., et al. Task-relevant brain networks identified with simultaneous PET/MR imaging of metabolism and connectivity. Brain Structure and Function. 223 (3), 1369-1378 (2018).
- Jamadar, S. D., et al. Simultaneous task-based BOLD-fMRI and [18-F] FDG functional PET for measurement of neuronal metabolism in the human visual cortex. Neuroimage. 189, 258-266 (2019).
- Rischka, L., et al. Reduced task durations in functional PET imaging with [18F] FDG approaching that of functional MRI. Neuroimage. 181, 323-330 (2018).
- Villien, M., et al. Dynamic functional imaging of brain glucose utilization using fPET-FDG. Neuroimage. 100, 192-199 (2014).
- Carson, R. E. PET physiological measurements using constant infusion. Nuclear Medicine and Biology. 27 (7), 657-660 (2000).
- Carson, R. E., et al. Comparison of bolus and infusion methods for receptor quantitation: application to [18F] cyclofoxy and positron emission tomography. Journal of Cerebral Blood Flow & Metabolism. 13 (1), 24-42 (1993).
- National Health and Medical Research Council. . National statement on ethical conduct in human research. , (2007).
- Australian Radiation Protection and Nuclear Safety Agency. . Code of practice for the exposure of humans to ionizing radiation for research purposes. , (2005).
- Jenkinson, M., Beckmann, C. F., Behrens, T. E., Woolrich, M. W., Smith, S. M. FSL. Neuroimage. 62 (2), 782-790 (2012).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310 (2010).
- Avants, B., Klein, A., Tustison, N., Woo, J., Gee, J. C. . 16th Annual Meeting for the Organization of Human Brain Mapping. , (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), e1005350 (2017).
- Tustison, N. J., et al. Large-scale evaluation of ANTs and FreeSurfer cortical thickness measurements. Neuroimage. 99, 166-179 (2014).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. Neuroimage. 54 (3), 2033-2044 (2011).
- Burgos, N., et al. Attenuation correction synthesis for hybrid PET-MR scanners: application to brain studies. IEEE Transactions on Medical Imaging. 33 (12), 2332-2341 (2014).
- Panin, V. Y., Kehren, F., Michel, C., Casey, M. Fully 3-D PET reconstruction with system matrix derived from point source measurements. IEEE Transactions on Medical Imaging. 25 (7), 907-921 (2006).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. Neuroimage. 17 (2), 825-841 (2002).
- Bludau, S., et al. Cytoarchitecture, probability maps and functions of the human frontal pole. Neuroimage. 93, 260-275 (2014).
- Amunts, K., Malikovic, A., Mohlberg, H., Schormann, T., Zilles, K. Brodmann's areas 17 and 18 brought into stereotaxic space-where and how variable?. Neuroimage. 11 (1), 66-84 (2000).
- Malikovic, A., et al. Cytoarchitectonic analysis of the human extrastriate cortex in the region of V5/MT+: a probabilistic, stereotaxic map of area hOc5. Cerebral Cortex. 17 (3), 562-574 (2006).
- Wilms, M., et al. Human V5/MT+: comparison of functional and cytoarchitectonic data. Anatomy and Embryology. 210 (5-6), 485-495 (2005).
- Eickhoff, S. B., Heim, S., Zilles, K., Amunts, K. Testing anatomically specified hypotheses in functional imaging using cytoarchitectonic maps. Neuroimage. 32 (2), 570-582 (2006).
- Eickhoff, S. B., et al. Assignment of functional activations to probabilistic cytoarchitectonic areas revisited. Neuroimage. 36 (3), 511-521 (2007).
- Eickhoff, S. B., et al. A new SPM toolbox for combining probabilistic cytoarchitectonic maps and functional imaging data. Neuroimage. 25 (4), 1325-1335 (2005).
- Everett, B. A., et al. Safety of radial arterial catheterization in PET research subjects. Journal of Nuclear Medicine. 50 (10), 1742-1742 (2009).
- Takagi, S., et al. Quantitative PET cerebral glucose metabolism estimates using a single non-arterialized venous-blood sample. Annals of Nuclear Medicine. 18 (4), 297-302 (2004).
- Zanotti-Fregonara, P., Chen, K., Liow, J. S., Fujita, M., Innis, R. B. Image-derived input function for brain PET studies: many challenges and few opportunities. Journal of Cerebral Blood Flow & Metabolism. 31 (10), 1986-1998 (2011).
- O'Loughlin, S., Currie, G. M., Trifonovic, M., Kiat, H. Ambient temperature and cardiac accumulation of 18F-FDG. Journal of Nuclear Medicine Technology. 42 (3), 188-193 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon