Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Radiotracer Administration for High Temporal Resolution Positron Emission Tomography of the Human Brain: Application to FDG-fPET Radiotracer Administration for High Temporal Resolution Positron Emission Tomography of the Human Brain: Application to FDG-fPET Radiotracer Administration for High Temporal Resolution Positron Emission Tomography of the Human Brain: Application to FDG-fPET Radiotracer
Dans cet article
Résumé
Ce manuscrit décrit deux protocoles d'administration de radiotracer pour FDG-PET (infusion constante et bolus plus perfusion) et les compare à l'administration de bolus. Les résolutions temporelles de 16 s sont réalisables en utilisant ces protocoles.
Résumé
La tomographie fonctionnelle par émission de positrons (fPET) fournit une méthode pour suivre les cibles moléculaires dans le cerveau humain. Avec un analogue de glucose radioactif-étiqueté, 18F-fluordeoxyglucose (FDG-fPET), il est maintenant possible de mesurer la dynamique du métabolisme de glucose avec des résolutions temporelles approchant ceux de l'imagerie par résonance magnétique fonctionnelle (FMRI). Cette mesure directe de l'absorption de glucose a un énorme potentiel pour comprendre la fonction normale et anormale du cerveau et sonder les effets des maladies métaboliques et neurodégénératives. De plus, les nouvelles avancées dans le matériel hybride MR-PET permettent de capter simultanément les fluctuations du glucose et de l'oxygénation sanguine à l'aide de l'IRMf et de l'AIG-fPET.
La résolution temporelle et le signal-au-bruit des images FDG-fPET dépendent de la critique de l'administration du radiotracer. Ce travail présente deux protocoles alternatifs d'infusion continue et les compare à une approche traditionnelle de bolus. Il présente une méthode pour l'acquisition d'échantillons de sang, le verrouillage du temps TEP, IRM, stimulus expérimental, et l'administration de la livraison traceur non-traditionnel. Utilisant un stimulus visuel, les résultats de protocole montrent des cartes corticales de la réponse de glucose aux stimulus externes à un niveau individuel avec une résolution temporelle de 16 s.
Introduction
La tomographie par émission de positrons (TEP) est une puissante technique d'imagerie moléculaire qui est largement utilisée dans les milieux cliniques et de recherche (voir Heurling et coll.1 pour un examen complet récent). Les cibles moléculaires qui peuvent être imaginées à l'aide de TEP ne sont limitées que par la disponibilité des radiotraceurs, et de nombreux traceurs ont été développés pour imager les récepteurs du métabolisme neuronal, les protéines et les enzymes2,3. En neurosciences, l'un des radiotraceurs les plus utilisés est 18F-fluorodeoxyglucose (FDG-PET), qui mesure l'absorption du glucose, généralement interprété comme un indice du métabolisme du glucose cérébral. Le cerveau humain a besoin d'un approvisionnement constant et fiable de glucose pour satisfaire ses besoins énergétiques4,5, et 70-80% du métabolisme du glucose cérébral est utilisé par les neurones pendant la transmission synaptique6. Les changements au métabolisme cérébral de glucose sont pensés pour initier et contribuer à de nombreuses conditions, y compris les conditions psychiatriques, neurodégénératives, etischémiques 7,8,9. En outre, comme l'utilisation de FDG est proportionnelle à l'activité synaptique10,11,12, il est considéré comme un indice plus direct et moins confondu de l'activité neuronale par rapport au sang plus largement utilisé réponse de résonance magnétique fonctionnelle dépendante du niveau d'oxygénation (BOLD-fMRI). BOLD-fMRI est un indice indirect de l'activité neuronale et mesure les changements dans l'hémoglobine désoxygénée qui se produisent à la suite d'une cascade de changements neurovasculaires suivant l'activité neuronale.
La plupart des études de FDG-PET du cerveau humain acquièrent des images statiques de l'absorption cérébrale de glucose. Le participant se repose tranquillement pendant 10 min, les yeux ouverts dans une pièce sombre. La dose complète de radiotraceur est administrée comme un bolus sur une période de secondes, et le participant se repose ensuite pendant 30 min. Après la période d'apprémoncellement, les participants sont placés au centre du scanner PET, et une image TEP qui reflète la distribution cumulative de FDG au cours des périodes d'apprélance et de numérisation est acquise. Ainsi, l'activité neuronale indexée par l'image PET représente la moyenne cumulative de toute l'activité cognitive sur les périodes d'utilisation et de balayage et n'est pas spécifique à l'activité cognitive pendant l'analyse. Cette méthode a fourni un grand aperçu du métabolisme cérébral du cerveau et de la fonction neuronale. Cependant, la résolution temporelle est égale à la durée d'analyse (souvent 45 min, produisant effectivement une mesure statique de l'absorption de glucose ; ceci compare défavorablement à la réponse neuronale pendant des processus cognitifs et des expériences communes dans la neuroimaging. En raison de la résolution temporelle limitée, la méthode fournit un indice non spécifique de l'absorption du glucose (c.-à-d. non verrouillé à une tâche ou à un processus cognitif) et ne peut pas fournir de mesures de la variabilité à l'intérieur du sujet, ce qui peut conduire à des conclusions scientifiques erronées à Simpson's Paradox13. Le paradoxe de Simpson est un scénario où les relations cerveau-comportement calculées entre les sujets ne sont pas nécessairement indicatives des mêmes relations testées au sein des sujets. En outre, les tentatives récentes d'appliquer des mesures de connectivité fonctionnelle à FDG-PET ne peuvent mesurer que la connectivité entre les sujets. Ainsi, les différences de connectivité ne peuvent être comparées qu'entre les groupes et ne peuvent pas être calculées pour des sujets individuels. Bien qu'il soit discutable ce que exactement les mesures de connectivité à travers le sujet14, il est clair que les mesures calculées entre les sujets, mais pas à l'intérieur des sujets ne peuvent pas être utilisés comme un biomarqueur pour les états de la maladie ou utilisés pour examiner la source de la variation individuelle.
Au cours des cinq dernières années, le développement et l'accessibilité plus large des scanners IRM-PET simultanés de qualité clinique ont suscité un regain d'intérêt pour la recherche sur l'imagerie FDG-PET2 en neurosciences cognitives. Avec ces développements, les chercheurs se sont concentrés sur l'amélioration de la résolution temporelle de FDG-PET pour approcher les normes de BOLD-fMRI (0,5 à 2,5 s). Notez que la résolution spatiale de BOLD-fMRI peut approcher les résolutions submillimétriques, mais la résolution spatiale de FDG-PET est fondamentalement limitée à environ 0,54 mm de pleine largeur à la moitié maximale (FWHM) en raison de la gamme de positron15. Les acquisitions dynamiques de FDG-PET, qui sont souvent utilisées cliniquement, utilisent la méthode d'administration de bolus et reconstruisent les données en mode liste en bacs. La méthode FDG-PET dynamique de bolus offre une résolution temporelle d'environ 100 s (p. ex., Tomasi et al.16). C'est clairement beaucoup mieux par rapport à l'imagerie statique FDG-PET, mais n'est pas comparable à BOLD-fMRI. En outre, la fenêtre dans laquelle la fonction cérébrale peut être examinée est limitée, parce que la concentration de plasma sanguin de FDG diminue peu de temps après le bolus est administré.
Pour élargir cette fenêtre expérimentale, une poignée d'études17,18,19,20,21 ont adapté la méthode d'infusion radiotracer précédemment proposé par Carson22, 23. Dans cette méthode, parfois décrite comme «fDG-PET fonctionnel» (FDG-fPET, analogue à BOLD-fMRI), le radiotracer est administré comme une perfusion constante au cours de l'ensemble du TEP (90 min). L'objectif du protocole d'infusion est de maintenir un approvisionnement constant en plasma de FDG pour suivre les changements dynamiques dans l'absorption de glucose à travers le temps. Dans une étude de preuve de concept, Villien et autres21 ont employé un protocole constant d'infusion et LE PET simultané de MRI/FDG-f pour montrer des changements dynamiques dans l'absorption de glucose en réponse à la stimulation de damier avec une résolution temporelle de 60 s. Des études ultérieures ont utilisé cette méthode pour montrer fDG-fPET (c.-à-d. verrouillé dans le temps à un stimulus externe19) et fDG-fPET lié aux tâches (c.-à-d., pas verrouillé dans le temps à un stimulus externe17, 18) absorption de glucose. En utilisant ces méthodes, FDG-fPET résolutions temporelles de 60 s ont été obtenues, ce qui est une amélioration substantielle par rapport aux méthodes de bolus. Les données préliminaires montrent que la méthode d'infusion peut fournir des résolutions temporelles de 20 à 60 s19.
Malgré les résultats prometteurs de la méthode d'infusion constante, les courbes de radioactivité plasmatique de ces études montrent que la méthode d'infusion n'est pas suffisante pour atteindre un état stable dans le délai d'un balayage de 90 min19,21. En plus de la procédure de perfusion constante, Carson22 a également proposé une procédure hybride bolus/perfusion, où l'objectif est d'atteindre rapidement l'équilibre au début de l'analyse, puis de maintenir les niveaux de radioactivité plasmatique à l'équilibre pour le durée de l'analyse. Rischka et coll.20 ont récemment appliqué cette technique à l'aide d'un bolus de 20 % plus une perfusion de 80 %. Comme prévu, la fonction d'entrée artérielle a rapidement augmenté au-dessus des niveaux de base et a été soutenue à un taux plus élevé pendant une plus longue période, par rapport aux résultats utilisant une procédure de perfusion seulement19,21.
Cet article décrit les protocoles d'acquisition pour l'acquisition des balayages de FDG-fPET à haute résolution temporelle utilisant l'administration de radiotracer d'infusion-seulement et de bolus/perfusion de radiotracer. Ces protocoles ont été développés pour une utilisation dans un environnement simultané IRM-PET avec un temps d'acquisition de 90 à 95 min19. Dans le protocole, des échantillons de sang sont prélevés pour quantifier la radioactivité du sérum plasmatique pour la quantification ultérieure des images de TEP. Bien que le protocole se concentre sur l'application de méthodes de perfusion pour la neuroimagerie fonctionnelle à l'aide de BOLD-fMRI/FDG-fPET, ces méthodes peuvent être appliquées à n'importe quelle étude FDG-fPET indépendamment du fait que l'IRM simultanée, BOLD-f MrI, la tomographie calculée (CT), ou d'autres neuroimages sont acquises. La figure 1 montre le diagramme de flux des procédures dans ce protocole.
Access restricted. Please log in or start a trial to view this content.
Protocole
Ce protocole a été examiné et approuvé par le Comité d'éthique de la recherche humaine de l'Université Monash (numéro d'approbation CF16/1108 - 2016000590) conformément à la Déclaration nationale australienne sur la conduite éthique dans la recherche humaine24. Des procédures ont été développées sous la direction d'un physicien médical accrédité, d'un technologue en médecine nucléaire et d'un radiographe clinique. Les chercheurs devraient se référer à leurs experts locaux et des lignes directrices pour l'administration du rayonnement ionisant chez l'homme.
1. Matériel et personnel requis
- Consultez la Table des matériaux pour la salle des scanners, le laboratoire de radiochimie et les documents généraux. Un fournisseur commercial a été utilisé pour le radiotraceur.
- Dans l'environnement simultané MRI-PET, utilisez quatre personnes : un radiographe (RG) pour faire fonctionner le scan, un technologue en médecine nucléaire (NMT) pour superviser l'administration du radiotraceur et l'acquisition d'échantillons de sang, un assistant de laboratoire (LA) pour faire tourner le sang, et un assistant de recherche (RA) chargé de superviser la conception expérimentale et la présentation de stimulus.
2. Préparation
- Préparation des doses traceurs par le NMT
- Calculez le volume d'infusion qui sera administré au cours de l'analyse. Dans ce protocole, le taux d'infusion est de 0,01 ml/s sur 95 min. Ainsi, dans un balayage de 95 min, les participants reçoivent 0.01 mL/s x 60 s x 95 min '57 mL.
- Calculez la dose de traceur qui sera diluée dans la solution saline administrée. Dans ce protocole, une dose totale de 260 MBq est administrée au participant de plus de 95 min. Cette dose a été choisie pour limiter l'exposition aux radiations à 4,9 mSv, afin de rester dans la catégorie du « risque de faible niveau » selon les lignes directrices de l'Australian Radiation Protection and Nuclear Safety Agency (ARPANSA) pour l'exposition des humains aux rayonnements ionisants25. Décroissance correcte 260 MBq du point d'infusion moyenne (47,5 min) à T0. Utilisation de l'équation 1, résoudre pour A0
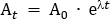
Là où At est la radioactivité (MBq) au milieu de l'infusion, A0 est la radioactivité initiale, et est la désintégration radioactive constante spécifique au traceur. Pour FDG, la valeur de 0,693/T1/2. T1/2 est la demi-vie de 18F (110 min).
REMARQUE : Dans cet exemple, At 260 MBq, 0,693/110, et t -47,5, donc A0 à 350,942 MBq. - Calculez la dose de radiotraceur requise pour le sac salin de 100 ml qui sera utilisé pour administrer la dose au participant. Le radiotraceur requis pour le sac salin est dilué jusqu'à un volume total de 5 ml et élaboré dans une seringue de 5 ml. Par conséquent, pour le sac salin de 100 ml, le facteur de dilution est le volume de salin (100 ml) en plus du volume de 5 ml de la seringue avec radiotracer. Ce volume total de 105 ml est divisé par le volume d'infusion de 57 ml (c.-à-d. 105 ml/57 ml à 1,842). Ainsi, la radioactivité totale dans un volume de 5 ml requis pour l'ajout du sac de 100 ml est A0 x le facteur de dilution (c.-à-d., 350.942 MBq x 1.842 -646.44 MBq). Ajouter aseptiquement le radiotracer au sac salin.
REMARQUE : Il est important de noter que l'activité calculée de 646,44 MBq qui est ajoutée au sac salin est l'activité requise au début de l'infusion. Généralement, les doses pour ce protocole sont préparées entre 15 min à 1 h avant l'administration. Par conséquent, il est important de tenir compte de la désintégration du radio-isotope. Équation 1 en 2.1.2. peut être utilisé pour expliquer cela, où le temps (t) est le nombre total de minutes de la préparation de la dose à quand l'activité sera administrée, At 646,44 MBq, en résolvant pour A0. - Préparer la dose d'amorçage. Retirez 20 mL du sac dans une seringue et plafonnez-le. Calibrer cette seringue de 20 ml et l'étiquette. La seringue est calibrée comme une vérification de référence pour s'assurer que la radioactivité s'est également dispersée dans le sac salin.
- Préparer la dose. À l'aide d'une seringue de 50 ml, retirer 60 ml du sac et du bouchon avec un bouchon Combi rouge. Cette seringue n'est pas calibrée, car la concentration de la radioactivité est connue depuis le moment où elle a été ajoutée au sac salin (étape 2.1.3). Conservez les deux seringues dans le laboratoire de radiochimie jusqu'à ce qu'elles soient prêtes à être numérisées.
REMARQUE : Il est possible de tirer un volume de 60 ml dans une seringue de 50 ml, car les seringues Terumo sont marquées à 20 % au-dessus du volume étiqueté (c.-à-d. qu'une seringue de 50 ml est marquée à 60 ml). - Préparer la dose de référence. Remplir un flacon volumétrique de 500 ml d'environ 480 ml d'eau distillée. Dessinez 10 MBq de 18F-FDG dans une seringue, corrigée de la carie à l'heure de début de l'analyse (à l'aide de l'équation 1) et ajoutez-la au flacon. Garnir le volume jusqu'à la marque de 500 ml avec plus d'eau distillée et bien mélanger. Affix étiquette sa seringue avant et après l'étalonnage.
- Préparation de la salle de scanner par le NMT
- Une fois que le participant est placé dans le scanner, il y a très peu de place pour manipuler ou récupérer la ligne pour l'infusion ou des échantillons de sang si le blocage se produit. Préparer la salle de scanner pour minimiser les risques de blocage de la ligne.
- Assurez-vous que tout l'équipement de collecte de sang est à portée de main du site de collecte. Placer les sous-coussins à l'extrémité de la canule et sur n'importe quelle surface qui tiendra des récipients de sang. Placez les bacs pour les déchets réguliers et les déchets biodangereux à portée de main du site de collecte de sang.
- Préparation de la pompe à perfusion par le NMT
- Installez la pompe à perfusion dans la salle de scanner sur le côté qui sera reliée au participant. Construisez des briques de plomb autour de la base de la pompe et placez le bouclier de plomb devant la pompe. Connectez le tube de la pompe à perfusion qui délivre l'infusion au participant et assurez-vous que le taux d'infusion correct a été entré. Pour ce protocole, le taux est de 0,01 mL/s.
- Amorcer le tube avant qu'il ne soit relié à la canule du participant. Connectez la dose d'amorçage de 20 ml à la pompe à perfusion. À l'extrémité du tube qui sera relié au participant, attachez un robinet à trois voies et une seringue vide de 20 ml. Assurez-vous que le robinet est positionné pour permettre à la solution 18F-FDG de s'écouler de la dose d'amorçage à travers le tube et de recueillir uniquement dans la seringue vide.
- Préinitialisez la pompe à perfusion pour amorcer un volume de 15 ml. Sélectionnez le bouton Prime sur la pompe et suivez les invites pour amorcer la ligne.
- Fixez la seringue de 50 ml à la pompe à perfusion à la place de la dose d'amorçage. La dose préférentielle de 15 ml sur le robinet à trois voies peut y rester jusqu'à ce que le participant soit prêt à être connecté à la pompe.
- Préparation des participants par le NMT, la RA et le RG
- Conseillez aux participants de jeûner pendant 6 h et de ne consommer que de l'eau (environ deux verres), avant l'analyse.
- Demandez à l'AR de mener les procédures de consentement et d'acquérir des mesures supplémentaires (p. ex., enquêtes démographiques, piles cognitives, etc.). Demandez au NMT et au RG de procéder aux écrans de sécurité, au NMT pour l'examen de l'innocuité de la TEP (p. ex., exclusion pour grossesse, diabète, chimiothérapie ou radiothérapie au cours des 8 semaines précédentes et allergies connues) et à l'innocuité des participants à l'examen des RG pour la numérisation par IRM (p. ex., l'exclusion pour la grossesse, les implants métalliques médicaux ou non médicaux, les implants dentaires non amovibles, la claustrophobie).
- Cannulelement du participant.
- Utilisez deux canules : l'une pour l'administration de la dose et l'autre pour l'échantillonnage du sang. La canule la plus appropriée varie d'un participant à l'autre, mais la veine la plus appropriée devrait être réservée à la collecte de sang. Une canule de 22 G est la taille minimale préférée. Recueillir un échantillon de sang de base de 10 ml pendant la cannulation. Débranchez toutes les bouffées de chaleur salines sous pression pour maintenir la patency de la ligne.
- Testez le taux de sucre dans le sang du participant et d'autres mesures sanguines de base (p. ex., l'hémoglobine) à partir de l'échantillon de référence.
- Positionnement des participants dans le scanner par le RG et le NMT
- Demandez à la RG de positionner le participant au scanner. Pour les longs scans, il est impératif d'assurer le confort afin de réduire le risque de décrochage du participant et le mouvement artefact en raison de l'inconfort. Le participant doit être recouvert d'une couverture jetable pour maintenir une température corporelle confortable.
- Demandez au NMT de rincer la canule pour s'assurer qu'elle est brevete avec une résistance minimale avant de connecter la ligne d'infusion. Une fois connecté, le tube peut être légèrement scotché près du poignet. Demandez au participant de garder son bras redressé. Utilisez des supports tels que de la mousse ou des coussins pour plus de confort. Demandez au NMT également de vérifier la canule qui sera utilisée pour les échantillons de plasma pour s'assurer qu'il est en mesure de retirer le sang avec une résistance minimale. Il peut être nécessaire de connecter un tube d'extension apprêté à la saline normale pour rendre la canule plus accessible pendant que le participant est dans le scanner. Si cela est nécessaire, il faut vérifier les fuites.
- Une fois que le sujet est dans le scanner alésage, avoir le NMT vérifier qu'ils ont un accès approprié aux deux canules.
- Demandez au NMT d'aviser le RG et la PR s'il y a des problèmes avec la canule de collecte de sang, la canule d'infusion ou la pompe à perfusion (p. ex. occlusion, batterie, extravasation) à tout moment pendant l'analyse.
3. Scanner le participant
- Démarrage de l'analyse avec le NMT, RG, et RA
- Au début de l'analyse, placez le NMT dans la salle du scanner pour surveiller l'équipement d'infusion. Assurez-vous que le NMT porte une protection auditive et utilise le bouclier de barrière pour minimiser l'exposition aux radiations de la dose dans la mesure du possible.
- Pendant que le RG effectue l'analyse de localisation pour s'assurer que le participant est dans la bonne position, vérifiez les détails de l'acquisition de TEP (p. ex., durée d'analyse, collecte de données en mode liste, isotope correct).
- Concevoir le protocole de sorte que l'acquisition de TEP commence avec la première séquence d'IRM. Le RG prépare et démarre la séquence IRM. L'heure de début de l'acquisition de TEP de 95 min est verrouillée au début de la séquence D'IRM. Au besoin, le NMT doit livrer le bolus au moment de l'acquisition de PET (figure 1).
- Démarrez la pompe à perfusion. Le RG doit signaler au NMT (p. ex., via une enseigne pouce-vers le haut) de démarrer la pompe 30 s après le début de l'acquisition de TEP. Ce protocole démarre la pompe à perfusion 30 s après l'heure de début de l'analyse pour fournir un tampon de sécurité en cas de défaillance de l'analyse. Cela garantit également que la première image prise lors de l'analyse DETE indexe le cerveau avant l'administration du radiotraceur pour la collecte complète de données sur la courbe d'activité temporelle. Demandez au NMT d'observer la pompe pour s'assurer qu'elle a commencé à infuser le 18F-FDG et qu'il n'y a pas d'occlusion immédiate de la ligne.
- Demandez à la PR d'initier un stimulus externe à l'heure convenue (c.-à-d. au début d'un bloc fonctionnel d'exécution/expérimental) et de calculer les temps pour les échantillons de sang. Un exemple de formulaire d'enregistrement est affiché dans le Supplément 1. Demandez à l'AR de calculer l'heure prévue de chaque échantillon de sang et de fournir des copies au NMT et à l'assistant de laboratoire (LA). Demandez à la PR de s'assurer que le NMT prélève les échantillons de sang à peu près au bon moment et surveille l'équipement (p. ex. pompe à perfusion, stimulus) pour déceler tout signe d'erreur.
- Prélever des échantillons de sang à intervalles réguliers
- Demandez au NMT et à la RA de prélever un échantillon toutes les 10 min. Il y a habituellement 10 échantillons au total, sans compter l'échantillon de référence.
- Si vous acquiez des IRM simultanément avec des TEP, ayez la protection auditive d'usure NMT lorsque vous entrez dans la salle du scanner.
- Demandez au NMT de porter des gants et de tamponner la pointe de la canule. Pendant que le site de la canule sèche, ouvrez une seringue de 5 ml et une seringue de 10 ml, un vacutainer et une chasse d'eau saline de 10 ml.
- À l'aide de la seringue de 5 ml, retirer 4-5 ml de sang frais et jeter la seringue dans les déchets de biorisque.
- À l'aide de la seringue de 10 ml, retirer jusqu'à 10 ml de sang. Le volume peut être limité par la facilité avec laquelle le sang peut être retiré. Il est important de minimiser toute résistance causant par la suite des dommages aux globules rouges qui peuvent hémolyser. Au point médian de la collecte, ayez le signal NMT à la RA, qui marquera ce temps sur le formulaire d'enregistrement (Supplément 1) comme le temps «réel» de l'échantillon.
- Connectez la seringue de 10 ml au vacutainer, puis déposez le sang dans le tube sanguin pertinent.
- Rincer rapidement la canule avec 10 ml de salin, déconnecté sous pression, afin de minimiser toute chance de coagulation de la ligne.
- Acquetre prendre l'échantillon de sang au laboratoire de radiochimie pour analyse.
- Faire tourner le sang par le LA
- Demandez à la LA d'obtenir tout l'équipement prêt (tableau 1) et être porter des gants. Disposer de trois supports pour les échantillons : un pour les tubes sanguins, un pour la pipetilisation de l'échantillon et un pour les échantillons remplis de pipettes (avant et après le comptage).
- Demandez à la LA de changer régulièrement de gants tout au long de la procédure, en particulier lors de la manipulation du tube de comptage. Si le LA a une contamination par le plasma radioactif sur ses gants, il peut être transféré au tube de comptage et augmenter faussement le nombre de comptages enregistrés de l'échantillon.
- L'échantillon de sang peut être placé dans la centrifugeuse comme la disponibilité des ressources de dotation le permet, parce que le temps que l'échantillon de sang a été prélevé, et le temps qu'il a été compté a été noté. Faire tourner tous les échantillons à une force centrifuge relative de 724 x g. Les réglages de centrifugeuse utilisés pour ce protocole sont de 2 000 tr/min pendant 5 min avec les courbes d'accélération et de décélération fixées à huit.
- Une fois que l'échantillon a été mis en œil, placez le tube dans le porte-tuyaux. Retirez le bouchon du tube pour ne pas perturber la séparation de l'échantillon. Placez un tube de comptage étiqueté dans le rack. L'étiquette doit correspondre au tube sanguin.
- Assurez-vous que la pointe est solidement attachée à la pipette. Ayez un mouchoir prêt pour les gouttes. Steadily pipette 1000 L de plasma du tube sanguin, le transfert au tube de comptage, et remplacer les couvercles sur le tube de comptage et tube de sang.
- Placez le tube de comptage dans le comptoir du puits et comptez pendant 4 min. Enregistrez l'heure de début de comptage sur la feuille d'enregistrement (« temps de mesure ») pour chaque échantillon. Ceci est nécessaire pour les corrections ultérieures à l'heure de début de l'acquisition PET. À des moments ultérieurs au cours de l'analyse, demandez à la LA d'effectuer chaque étape en succession rapide pour éviter un arriéré d'échantillons.
- Jetez tous les déchets de produits sanguins dans des sacs de biorisque.
- Demandez à la LA d'obtenir tout l'équipement prêt (tableau 1) et être porter des gants. Disposer de trois supports pour les échantillons : un pour les tubes sanguins, un pour la pipetilisation de l'échantillon et un pour les échantillons remplis de pipettes (avant et après le comptage).
Access restricted. Please log in or start a trial to view this content.
Résultats
Méthodes spécifiques à l'étude
Ici, des détails spécifiques à l'étude pour les résultats représentatifs sont rapportés. Ces détails ne sont pas essentiels à la procédure et varieront d'une étude à l'autre.
Participants et conception des tâches
Les participants (n ' 3, tableau 2) ont subi une étude simultanée BOLD-fMRI/FDG-fPET. Comme ce...
Access restricted. Please log in or start a trial to view this content.
Discussion
FDG-PET est une technologie d'imagerie puissante qui mesure l'absorption du glucose, un indice du métabolisme du glucose cérébral. À ce jour, la plupart des études en neurosciences utilisant FDG-PET utilisent une approche traditionnelle d'administration de bolus, avec une résolution d'image statique qui représente l'intégrale de toute activité métabolique au cours de l'analyse2. Ce manuscrit décrit deux protocoles alternatifs d'administration de radiotraceur : les protocoles d'infusion ...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d'intérêts. La source de financement n'a pas participé à la conception, à la collecte, à l'analyse et à l'interprétation des données de l'étude.
Remerciements
Jamadar est soutenu par un Australian Council for Research (ARC) Discovery Early Career Researcher Award (DECRA DE150100406). Jamadar, Ward et Egan sont soutenus par le Centre d'excellence de l'ARC pour la fonction cérébrale intégrative (CE114100007). Chen et Li sont soutenus par le financement de la Fondation culturelle Reignwood.
Jamadar, Ward, Carey et McIntyre ont conçu le protocole. Carey, McIntyre, Sasan et Fallon ont recueilli les données. Jamadar, Ward, Parkes et Sasan ont analysé les données. Jamadar, Ward, Carey et McIntyre ont écrit la première ébauche du manuscrit. Tous les auteurs ont examiné et approuvé la version finale.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Blood Collection Equipment | |||
| --12-15 vacutainers | Becton Dickinson, NJ USA | 364880 | Remain in sterile packaging until required to put blood in tube |
| --12-15 10mL LH blood collecting tubes | Becton Dickinson | 367526 | Marked with the sample number (e.g., S1, S2…) and subsequently marked with the sample time (e.g., time 0 + x min [T0+x]) |
| --2-15 10mL Terumo syringe | Terumo Tokyo, Japan | SS+10L | These are drawn up on the day of the study and capped with the ampoule that contained the saline |
| -- pre-drawn 0.9% saline flushes | Pfizer, NY, USA | 61039117 | |
| --12-15 5mL Terumo syringes | Terumo Tokyo, Japan | SS+05S | Remain in sterile packaging until ready to withdraw a blood sample |
| Safety & Waste Equipment | All objects arranged on a plastic chair inside the scanner room on the same side as the arm from which the blood samples will be taken. Biohazard and non-biohazard waste bags to be used. Gloves and waste bags to be easily accessible when preparing the radioactivity in the dispensing area and when pipetting the plasma samples. Biohazard and non-biohazard waste bags to be used. All waste generated is checked with the Geiger counter to ensure that radioactive contaminated waste is stored until it is safe to be disposed of according to Australian Radiation Protection and Nuclear Safety Agency (APRANSA) guidelines for Radiation protection series No.6 (2017). | ||
| -- Gloves | Westlab, VIC, Australia | 663-219 | |
| -- waste bags | Austar Packaging, VIC, Australia | YIW6090 | |
| --cello underpads ‘blueys’ Underpads 5 Ply | Halyard Health, NSW, Australia | 2765A | |
| --Blue Sharpie pen | Sharpie, TN, USA | S30063 | |
| Dose Syringes | Remain in sterile packaging until ready for use. All syringes used in this facility have an additional 20% volume capacity above the stated volume on the packaging. This is important for the 50mL syringe where the total capacity of 60mL is used | ||
| --5mL | Terumo Tokyo, Japan | SS+05S | |
| -- 20mL | Terumo Tokyo, Japan | SS+20L | |
| --50mL | Terumo Tokyo, Japan | SS*50LE | |
| --1 Terumo 18-gauge needle | Terumo Tokyo, Japan | NN+1838R | Remain in sterile packaging until ready to inject [18F]FDG into the saline bag |
| --100mL 0.9% saline bag | Baxter Pharmaceutical, IL, USA | AHB1307 | Remain in sterile packaging until ready to inject [18F]FDG |
| Radiochemistry Lab Supplies | |||
| --Heraeus Megafuge 16 centrifuge; Rotor Bioshield 720 | ThermoScientific MA, USA | 75004230 | Relative Centrifugal Force = 724 Our settings are 2000RPM for 5mins. Acceleration and deceleration curves set to 8 |
| --Single well counter | Laboratory Technologies, Inc. IL, USA | 630-365-1000 | Complete daily quality control (includes background count) and protocol set to 18F and 4mins. Cross calibration is performed between the well counter, dose calibrator and scanner on a bi-monthly basis. |
| --Pipette | ISG Xacto, Vienna, Austria | LI10434 | We use a 100-1000 μL set to 1000μL. It is calibrated annually. |
| --12-15 plasma counting tubes | Techno PLAS; SA Australia | P10316SU | Marked in the same manner as the LH blood tubes |
| --12-15 pipette tips | Expell Capp, Denmark | 5130140-1 | |
| --3 test tube racks | Generic | Checked with a Geiger counter to ensure there is no radiation contamination on them | |
| --500mL volumetric flask and distilled water | Generic | Need approximately 500mL of distilled water to prepare the reference for gamma counting | |
| --Synchronised clocks in scanner room, console and radiochemistry lab | Generic | Synchronisation checks are routinely completed in the facility on a weekly basis | |
| --Haemoglobin Monitor | EKF Diagnostic Cardiff, UK Haemo Control. | 3000-0810-6801 | Manufacturer recommended quality control performed before testing on participant’s blood sample. |
| --Glucometre | Roche Accu-Chek | 6870252001 | Accu-Chek Performa is used to measure participant blood sugar levels in mmol/L. Quality control is performed daily using high and low concentration solution control test. |
| Cannulating Equipment | Check expiry dates and train NMT to prepare aseptically for cannulation. | ||
| --Regulation tourniquet | CBC Classic Kimetec GmBH | K5020 | |
| --20, 22 and 24 gauge cannulas | Braun, Melsungen Germany | 4251644-03; 4251628-03; 4251601-03 | |
| --tegaderm dressings | 3M, MN USA | 1624W | |
| --alcohol and chlorhexidine swabs | Reynard Health Supplies, NSW Australia | RHS408 | |
| --0.9% saline 10mL ampoules; for flushes | Pfizer, NY, USA | 61039117 | |
| --10mL syringes | Terumo Tokyo, Japan | SS+10L | |
| --3-way tap | Becton Dickinson Connecta | 394600 | |
| --IV bung | Safsite Braun PA USA | 415068 | |
| --Optional extension tube, microbore extension set | M Devices, Denmark | IV054000 | |
| Scanner Room Equipment | |||
| --Siemens Biograph 3T mMR | Siemens, Erlangen, Germany | ||
| --Portable lead barrier shield | Gammasonics | Custom-built | MR-conditional lead barrier shield. Positioned at the 2000 Gauss line with the castors locked to provide additional shielding of the radioactivity connected to the infusion pump. |
| --Infusion pump BodyGuard 323 MR-conditional infusion pump | Caesarea Medical Electronics | 300-040XP | MR-compatible. This model is cleared for use on 1.5 and 3T scanners at 2000 Gauss with castors locked. |
| --Infusion pump tubing | Caesarea Medical Electronics | 100-163X2YNKS | Tubing is administration set with an anti-siphon valve and male luer lock (REF 100-163X2YNKS). |
| --Lead bricks | Custom built | Tested for ferromagnetic translational force | |
| Other Equipment | |||
| --Syringe shields | Biodex, NY USA | Custom-built | There is a 5mL tungsten syringe shield that is MR-safe, as well as a 50mL lead shield that has been tested for ferromagnetic attraction prior to use in the MR-PET scanner. It is used to transport the radioactive dose from the radiochemistry lab into the scanner to minimise radiation exposure to the NMT. |
| --Geiger counter Model 26-1 Integrated Frisker | Ludlum Measurements, Inc. TX USA | 48-4007 | This is calibrated annually and used to monitor potential contamination and waste. It is not taken into the MR-PET scanner. |
Références
- Heurling, K., et al. Quantitative positron emission tomography in brain research. Brain Research. 1670, 220-234 (2017).
- Chen, Z., et al. From simultaneous to synergistic MR-PET brain imaging: A review of hybrid MR-PET imaging methodologies. Human Brain Mapping. 39 (12), 5126-5144 (2018).
- Jones, T., Rabiner, E. A. The development, past achievements, and future directions of brain PET. Journal of Cerebral Blood Flow & Metabolism. 32 (7), 1426-1454 (2012).
- Kety, S. S. Metabolism of the nervous system. , Elsevier. 221-237 (1957).
- Sokoloff, L. The metabolism of the central nervous system in vivo. Handbook of Physiology, section I, neurophysiology. 3, 1843-1864 (1960).
- Harris, J. J., Jolivet, R., Attwell, D. Synaptic energy use and supply. Neuron. 75 (5), 762-777 (2012).
- Mosconi, L., et al. FDG-PET changes in brain glucose metabolism from normal cognition to pathologically verified Alzheimer's disease. European Journal of Nuclear Medicine and Molecular Imaging. 36 (5), 811-822 (2009).
- Pagano, G., Niccolini, F., Politis, M. Current status of PET imaging in Huntington's disease. European Journal of Nuclear Medicine and Molecular Imaging. 43 (6), 1171-1182 (2016).
- Petit-Taboue, M., Landeau, B., Desson, J., Desgranges, B., Baron, J. Effects of healthy aging on the regional cerebral metabolic rate of glucose assessed with statistical parametric mapping. Neuroimage. 7 (3), 176-184 (1998).
- Chugani, H. T., Phelps, M. E., Mazziotta, J. C. Positron emission tomography study of human brain functional development. Annals of Neurology. 22 (4), 487-497 (1987).
- Phelps, M. E., Mazziotta, J. C. Positron emission tomography: human brain function and biochemistry. Science. 228 (4701), 799-809 (1985).
- Zimmer, E. R., et al. [18 F] FDG PET signal is driven by astroglial glutamate transport. Nature Neuroscience. 20 (3), 393(2017).
- Roberts, R. P., Hach, S., Tippett, L. J., Addis, D. R. The Simpson's paradox and fMRI: Similarities and differences between functional connectivity measures derived from within-subject and across-subject correlations. Neuroimage. 135, 1-15 (2016).
- Horwitz, B. The elusive concept of brain connectivity. Neuroimage. 19 (2), 466-470 (2003).
- Moses, W. W. Fundamental limits of spatial resolution in PET. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 648, S236-S240 (2011).
- Tomasi, D. G., et al. Dynamic brain glucose metabolism identifies anti-correlated cortical-cerebellar networks at rest. Journal of Cerebral Blood Flow & Metabolism. 37 (12), 3659-3670 (2017).
- Hahn, A., et al. Quantification of task specific glucose metabolism with constant infusion of 18F-FDG. Journal of Nuclear Medicine. 57 (12), 1933-1940 (2016).
- Hahn, A., et al. Task-relevant brain networks identified with simultaneous PET/MR imaging of metabolism and connectivity. Brain Structure and Function. 223 (3), 1369-1378 (2018).
- Jamadar, S. D., et al. Simultaneous task-based BOLD-fMRI and [18-F] FDG functional PET for measurement of neuronal metabolism in the human visual cortex. Neuroimage. 189, 258-266 (2019).
- Rischka, L., et al. Reduced task durations in functional PET imaging with [18F] FDG approaching that of functional MRI. Neuroimage. 181, 323-330 (2018).
- Villien, M., et al. Dynamic functional imaging of brain glucose utilization using fPET-FDG. Neuroimage. 100, 192-199 (2014).
- Carson, R. E. PET physiological measurements using constant infusion. Nuclear Medicine and Biology. 27 (7), 657-660 (2000).
- Carson, R. E., et al. Comparison of bolus and infusion methods for receptor quantitation: application to [18F] cyclofoxy and positron emission tomography. Journal of Cerebral Blood Flow & Metabolism. 13 (1), 24-42 (1993).
- National Health and Medical Research Council. National statement on ethical conduct in human research. , (2007).
- Australian Radiation Protection and Nuclear Safety Agency. Code of practice for the exposure of humans to ionizing radiation for research purposes. , (2005).
- Jenkinson, M., Beckmann, C. F., Behrens, T. E., Woolrich, M. W., Smith, S. M. FSL. Neuroimage. 62 (2), 782-790 (2012).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310(2010).
- Avants, B., Klein, A., Tustison, N., Woo, J., Gee, J. C. 16th Annual Meeting for the Organization of Human Brain Mapping. , (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), e1005350(2017).
- Tustison, N. J., et al. Large-scale evaluation of ANTs and FreeSurfer cortical thickness measurements. Neuroimage. 99, 166-179 (2014).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. Neuroimage. 54 (3), 2033-2044 (2011).
- Burgos, N., et al. Attenuation correction synthesis for hybrid PET-MR scanners: application to brain studies. IEEE Transactions on Medical Imaging. 33 (12), 2332-2341 (2014).
- Panin, V. Y., Kehren, F., Michel, C., Casey, M. Fully 3-D PET reconstruction with system matrix derived from point source measurements. IEEE Transactions on Medical Imaging. 25 (7), 907-921 (2006).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. Neuroimage. 17 (2), 825-841 (2002).
- Bludau, S., et al. Cytoarchitecture, probability maps and functions of the human frontal pole. Neuroimage. 93, 260-275 (2014).
- Amunts, K., Malikovic, A., Mohlberg, H., Schormann, T., Zilles, K. Brodmann's areas 17 and 18 brought into stereotaxic space-where and how variable? Neuroimage. 11 (1), 66-84 (2000).
- Malikovic, A., et al. Cytoarchitectonic analysis of the human extrastriate cortex in the region of V5/MT+: a probabilistic, stereotaxic map of area hOc5. Cerebral Cortex. 17 (3), 562-574 (2006).
- Wilms, M., et al. Human V5/MT+: comparison of functional and cytoarchitectonic data. Anatomy and Embryology. 210 (5-6), 485-495 (2005).
- Eickhoff, S. B., Heim, S., Zilles, K., Amunts, K. Testing anatomically specified hypotheses in functional imaging using cytoarchitectonic maps. Neuroimage. 32 (2), 570-582 (2006).
- Eickhoff, S. B., et al. Assignment of functional activations to probabilistic cytoarchitectonic areas revisited. Neuroimage. 36 (3), 511-521 (2007).
- Eickhoff, S. B., et al. A new SPM toolbox for combining probabilistic cytoarchitectonic maps and functional imaging data. Neuroimage. 25 (4), 1325-1335 (2005).
- Everett, B. A., et al. Safety of radial arterial catheterization in PET research subjects. Journal of Nuclear Medicine. 50 (10), 1742-1742 (2009).
- Takagi, S., et al. Quantitative PET cerebral glucose metabolism estimates using a single non-arterialized venous-blood sample. Annals of Nuclear Medicine. 18 (4), 297-302 (2004).
- Zanotti-Fregonara, P., Chen, K., Liow, J. S., Fujita, M., Innis, R. B. Image-derived input function for brain PET studies: many challenges and few opportunities. Journal of Cerebral Blood Flow & Metabolism. 31 (10), 1986-1998 (2011).
- O'Loughlin, S., Currie, G. M., Trifonovic, M., Kiat, H. Ambient temperature and cardiac accumulation of 18F-FDG. Journal of Nuclear Medicine Technology. 42 (3), 188-193 (2014).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon