JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인간의 뇌의 고시간 해상도 양전자 방출 단층 촬영을위한 방사선 추적기 관리 : FDG-fPET에 응용 프로그램
요약
이 원고는 FDG-PET (일정한 주입 및 볼루스 플러스 주입)에 대한 두 개의 방사성 추적기 관리 프로토콜을 설명하고 볼러스 투여와 비교합니다. 16s의 시간적 해상도는 이러한 프로토콜을 사용하여 달성 할 수 있습니다.
초록
기능성 양전자 방출 단층 촬영(fPET)은 인간의 뇌에서 분자 표적을 추적하는 방법을 제공한다. 방사성 표지된 포도당 유사체, 18F-플루오데옥시글루코스(FDG-fPET)를 사용하면 기능적 자기 공명 영상(fMRI)에 접근하는 시간적 해상도로 포도당 대사의 역학을 측정할 수 있습니다. 포도당 관의 이 직접적인 측정은 정상과 이상한 두뇌 기능을 이해하고 신진 대사와 신경 퇴행성 질병의 효력을 탐구를 위한 거대한 잠재력을 가지고 있습니다. 또한, 하이브리드 MR-PET 하드웨어의 새로운 발전은 fMRI와 FDG-fPET를 사용하여 포도당과 혈액 산소화의 변동을 동시에 포착할 수 있게 합니다.
FDG-fPET 이미지의 시간적 해상도 및 신호-잡음은 방사성 추적기의 관리에 크게 좌우됩니다. 이 작품은 두 가지 대체 연속 주입 프로토콜을 제시하고 기존의 볼루스 접근법과 비교합니다. 혈액 샘플을 획득하고, PET, MRI, 실험 자극을 확보하고, 비전통적인 트레이서 전달을 투여하는 방법을 제시한다. 시각적 자극을 사용하여, 프로토콜 결과는 16 s의 시간적 해상도를 가진 개별 적인 수준에 외부 자극에 대한 포도당 반응의 피질 지도를 보여줍니다.
서문
양전자 방출 단층 촬영 (PET)은 임상 및 연구 설정 모두에서 널리 사용되는 강력한 분자 이미징 기술입니다 (최근 포괄적 인 검토를 위해 Heurling et al.1 참조). PET를 사용하여 영상을 볼 수 있는 분자 표적은 방사성 추적기의 가용성에 의해서만 제한되며, 수많은 트레이서는 신경 대사 수용체, 단백질 및 효소2,3을이미지화하기 위해 개발되었다. 신경 과학에서 가장 많이 사용되는 방사선 추적자 중 하나는 대뇌 포도당 대사 의 지수로 일반적으로 해석되는 포도당 섭취를 측정하는 18F-플루오로데옥시글루코스 (FDG-PET)입니다. 인간의 뇌는 시냅스 전송 시 뉴런에 의해 사용되는 뇌포도당 대사의4,5및 70-80%의 에너지 요구 사항을 충족시키기 위해 일정하고 신뢰할 수 있는 포도당 공급이필요하다. 대뇌 포도당 대사에 대한 변화는 정신과, 신경퇴행성 및 허혈성 질환을 포함한 수많은 조건에 개시하고 기여하는 것으로 생각된다7,8,9. 더욱이, FDG 섭취량은 시냅스 활성10,11,12에비례하기 때문에, 보다 널리 사용되는 혈액에 비해 신경 활동의 보다 직접적이고 덜 혼동된 지수로 여겨진다. 산소화 수준 의존적 자기 공명 화상 진찰 (BOLD-fMRI) 반응. BOLD-fMRI는 신경 활동의 간접 지수이며 신경 활동 다음 신경 혈관 변화의 폭포다음 발생하는 탈산소 헤모글로빈의 변화를 측정합니다.
인간의 두뇌의 대부분의 FDG-PET 연구는 대뇌 포도당 섭취의 정적 이미지를 취득. 참가자는 어두운 방에서 눈을 뜨고 10 분 동안 조용히 쉬고 있습니다. 전체 방사선 추적자 복용량 초의 기간에 볼루스로 관리, 그리고 참가자는 추가에 대 한 휴식 30 분. 섭취 기간 이후에는 참가자가 PET 스캐너의 중앙에 배치되고, 섭취 및 스캔 기간 동안 누적 FDG 분포를 반영하는 PET 이미지가 획득됩니다. 따라서, PET 이미지에 의해 인덱싱된 뉴런 활동은 모든 인지 활동의 누적 평균을 나타내며, 스캔 기간 동안의 인지 활동에는 특이적이지 않다. 이 방법은 뇌와 신경 기능의 대뇌 대사에 큰 통찰력을 제공하고있다. 그러나, 시간적 해상도는 스캔 기간과 동일합니다 (종종 ~ 45 분, 효과적으로 포도당 섭취량의 정적 측정을 산출; 이것은 신경 이미징의 인지 과정과 일반적인 실험 동안 신경 반응에 불리하게 비교. 제한된 시간적 해결로 인해 이 방법은 비특이적 포도당 섭취 지수(즉, 작업 또는 인지 과정에 고정되지 않음)를 제공하며, 대상 내 변동성에 대한 측정을 제공할 수 없으므로 잘못된 과학적 결론으로 이어질 수 있습니다. 심슨의 역설13. 심슨의 역설은 시나리오, 여기서 뇌 행동 관계 계산-주제에 걸쳐 계산 반드시 대상 내에서 테스트 동일한 관계를 나타내는. 또한 최근 FDG-PET에 기능적 연결 측정값을 적용하려는 시도는 피사체 간 연결만 측정할 수 있습니다. 따라서 연결의 차이는 그룹 간에만 비교할 수 있으며 개별 주제에 대해 계산할 수 없습니다. 정확히 피사체 간 연결이측정 14무엇인지 논쟁의 여지가 있지만, 전체 적인 측정이 질병 상태에 대한 바이오 마커로 사용되거나 개별 변이의 원인을 검사하는 데 사용될 수 없다는 것은 분명합니다.
지난 5년 동안, 임상 등급 동시 MRI-PET 스캐너의 개발과 접근성 향상은 인지 신경 과학에서 FDG-PET 이미징2에 대한 새로운 연구 관심을 촉발시켰습니다. 이러한 발전과 함께, 연구원은 BOLD-fMRI의 표준에 접근하기 위해 FDG-PET의 시간적 해상도를 개선하는 데 초점을 맞추고있다 (~ 0.5−2.5 s). BOLD-fMRI의 공간 해상도는 서브밀리미터 해상도에 접근할 수 있지만 FDG-PET의 공간 해상도는 양전자 범위15로인해 절반 최대(FWHM)에서 전체 폭 약 0.54mm로 근본적으로 제한됩니다. 종종 임상적으로 사용되는 동적 FDG-PET 수집은 bolus 관리 방법을 사용하고 목록 모드 데이터를 저장소로 재구성합니다. 볼러스 동적 FDG-PET 방법은 약 100s의 시간적 분해능을 제공한다(예를 들어, 토마시 외16). 이것은 확실히 정적 FDG-PET 화상 진찰에 비해 훨씬 낫습니다 그러나 BOLD-fMRI와 비교되지 않습니다. 추가적으로, FDG의 혈장 농도가 볼루스가 투여된 직후에 감소하기 때문에 뇌 기능을 검사할 수 있는 창은 제한됩니다.
이 실험 창을 확장하기 위해, 연구의 소수17,18,19,20,21 이전에 카슨(22)에의해 제안 된 방사성 추적기 주입 방법을적응한 , 23. 이 방법에서, 때때로 '기능적 FDG-PET'(FDG-f PET,BOLD-fMRI와 유사)로 묘사되며, 방사선 추적기는 전체 PET 스캔(~90분)의 과정에 걸쳐 일정한 주입으로서 투여된다. 주입 프로토콜의 목표는 시간에 걸쳐 포도당 섭취량의 동적 변화를 추적하기 위해 FDG의 일정한 플라즈마 공급을 유지하는 것입니다. 개념 증명 연구에서 Villien 등21은 일정한 주입 프로토콜과 동시 MRI/FDG-f PET를 사용하여 60s의 시간적 해상도로 바둑판 자극에 반응하여 포도당 섭취량의 동적 변화를 보여주었습니다. 후속 연구는 작업 잠긴 FDG-f PET(즉, 외부 자극에 시간 잠금19)및 작업 관련 FDG-f PET (즉, 외부 자극에 시간 잠겨 있지 않음)를 보여주기 위해이 방법을 사용했습니다17, 18)포도당 섭취. 이러한 방법을 사용하여, FDG-f PET 시간적 60s의 시간적 분해능이 얻어졌으며, 이는 볼루스 방법에 비해 상당한 개선이다. 예비 데이터는 주입 방법이 20-60 s19의시간적 해상도를 제공 할 수 있음을 보여줍니다.
일정한 주입 방법에서 유망한 결과에도 불구하고, 이러한 연구의 플라즈마 방사능 곡선은 주입 방법이 90 분 스캔19,21의기간 내에 정상 상태에 도달하기에 충분하지 않다는 것을 보여준다. 지속적인 주입 절차 이외에, Carson22는 또한 목표가 검사의 시작 부분에 평형에 빨리 도달하고, 그 때 평형에 플라즈마 방사능 수준을 유지하는 것입니다 하이브리드 bolus/주입 절차를 제안했습니다 검색 시간입니다. Rischka 등20 최근에 20 % 볼루스 플러스 80 % 주입을 사용하여이 기술을 적용했습니다. 예상대로, 동맥 입력 함수는 기준선 수준 이상으로 빠르게 상승하고 주입 전용 절차19,21을사용한 결과에 비해 더 긴 시간 동안 더 높은 속도로 유지되었다.
이 백서는 주입 전용 및 볼루스/주입 방사선추적기 관리를 사용하여 고시간 용해 FDG-f PET 스캔을 획득하기 위한 획득 프로토콜에 대해 설명합니다. 이러한 프로토콜은 90-95 분 획득 시간19와동시 MRI-PET 환경에서 사용하기 위해 개발되었습니다. 프로토콜에서, 혈액 샘플은 PET 이미지의 후속 정량화를 위한 혈장 혈청 방사능을 정량화하기 위하여 취합니다. 프로토콜의 초점은BOLD-fMRI/FDG-f PET를 사용하여 기능성 신경이미징을 위한 주입 방법의 응용이지만, 이러한 방법은 동시 MRI,BOLD-f 여부와 관계없이 모든 FDG-f PET 연구에 적용될 수 있습니다. MRI, 컴퓨터 단층 촬영 (CT) 또는 다른 신경 이미지가 획득됩니다. 그림 1은 이 프로토콜의 프로시저의 순서도를 보여 주며, 이 프로토콜의 순서도를 보여 주다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
이 프로토콜은 모나시 대학 인간 연구 윤리위원회 (승인 번호 CF16/1108 - 2016000590)에 의해 검토되고 승인되었습니다 인간 연구의 윤리적 행동에 대한 호주 국가 성명서 에 따라24. 절차는 공인 된 의학 물리학자, 핵 의학 기술자 및 임상 방사선 사진가의 지도하에 개발되었습니다. 연구원은 인간에 있는 이온화 방사선의 행정을 위한 그들의 현지 전문가 그리고 지침을 참조해야 합니다.
1. 필수 장비 및 인력
- 스캐너 룸, 방사성 화학 실험실 및 일반 재료에 대한 재료 표를 참조하십시오. 상용 공급 업체는 방사성 추적기사용되었다.
- 동시 MRI-PET 환경에서, 네 명의 인력을 사용: 방사선 사진사 (RG) 스캔을 실행하는, 핵 의학 기술자 (NMT) 방사선 추적기의 관리 및 혈액 샘플의 취득을 감독, 혈액을 회전하는 실험실 조수 (LA), 실험 설계 및 자극 프리젠 테이션을 감독할 책임이 있는 연구 조교(RA).
2. 준비
- NMT에 의한 트레이서 투여 준비
- 스캔 과정에서 투여될 주입 량을 계산합니다. 이 프로토콜에서 주입 속도는 95 분 이상 0.01 mL / s입니다. 따라서 95분 스캔으로 참가자는 0.01 mL/s x 60s x 95분 = 57mL를 받습니다.
- 투여된 식염수 용액으로 희석될 트레이서 용량을 계산합니다. 이 프로토콜에서, 총 260 MBq의 투여량은 95분 이상 참가자에게 투여된다. 이 투여량은 4.9 mSv로 방사선 노출을 제한하기 위해 선택되었으며, 호주 방사선 보호 및 원자력 안전 청 (ARPANSA) 지침에 따라 '낮은 수준의 위험' 분류 내에서 이온화 방사선25에대한 인간의 노출을 유지하도록 선택되었습니다. 부패 올바른 260 MBq 중반 주입 지점에서 (47.5 분) 다시 T0. 방정식 1을 사용하여 A0에 대해 해석
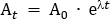
여기서 A는 주입의 중간 시점에서 방사능(MBq)이고, A0은 초기 방사능이고 λ는 트레이서에 특이적인 방사성 붕괴 상수이다. FDG의 경우, 값은 λ 0.693/T1/2입니다. T1/2는 18F (110 분)의 반감기입니다.
참고: 이 예제에서A t = 260MBq, λ = 0.693/110 및 t = -47.5, A0 = 350.942 MBq. - 참가자에게 용량을 투여하는 데 사용되는 100 mL 식염수 백에 필요한 방사선 추적기 용량을 계산합니다. 식염수 백에 필요한 방사성 추적기는 총 부피 5 mL까지 희석되어 5 mL 주사기로 작성됩니다. 따라서, 100 mL 식염수 백의 경우, 희석 계수는 방사성 추적기를 사용하여 주사기의 5 mL 부피 외에 식염수(100 mL)의 부피이다. 이 총 부피 105 mL은 57 mL의 주입 부피 (즉, 105 mL / 57 mL = 1.842)로 나뉩니다. 따라서, 100 mL 백에 첨가하기 위해 요구되는 5 mL의 부피에서의 총 방사능은 희석 인자 A0 배(즉, 350.942 MBq x 1.842 = 646.44 MBq)이다. 식염수 백에 방사성 추적기를 추가합니다.
참고 : 식염수 가방에 추가된 646.44 MBq의 계산 된 활동은 주입 시작시 필요한 활동이라는 점에 유의해야합니다. 일반적으로, 이 프로토콜에 대한 투여량은 투여 전에 15 분 내지 1 시간 사이에 제조된다. 따라서 방사성 동위원소의 붕괴를 고려하는 것이 중요합니다. 2.1.2의 방정식 1. 이를 설명하기 위해 사용될 수 있는데, 여기서 시간(t)은 투여량의 준비로부터 활동이 투여될 때까지의 총 분수, A=646.44 MBq, A0에대해 해결함으로써 사용될 수 있다. - 프라이밍 용량을 준비합니다. 가방에서 20 mL를 주사기에 넣고 캡을 씌울 수 있습니다. 이 20 mL 주사기 및 라벨을 보정하십시오. 주사기는 방사능이 식염수 백 내에 고르게 분산되었는지 확인하기 위해 참조 검사로 보정됩니다.
- 복용량을 준비하십시오. 50 mL 주사기를 사용하여 빨간색 콤비 스토퍼가있는 가방과 캡에서 60 mL을 인출하십시오. 이러한 주사기는 식염수 백에 첨가된 때부터 방사능의 농도가 공지됨에 따라 보정되지 않는다(단계 2.1.3). 스캔할 준비가 될 때까지 방사성 화학 실험실에 두 주사기를 보관하십시오.
참고: 테루모 주사기는 라벨이 붙은 부피보다 20% 높은 것으로 표시되어 있기 때문에 50mL 주사기에서 60mL 볼륨을 그릴 수 있습니다(즉, 50mL 주사기는 60mL로 표시되어 있음). - 기준 용량을 준비합니다. 약 480mL의 증류수로 500mL 의 체적 플라스크를 채웁니다. 18F-FDG의 10MBq를 주사기에 넣고 스캔 시작 시간(수학식 1 사용)에 부패 보정한 다음 플라스크에 추가합니다. 500 mL 마크까지 볼륨을 높이고 증류수를 더 많이 사용하여 완전히 섞어줍니다. 주사기에 대한 사전 및 사후 교정 라벨 부착.
- NMT에 의한 스캐너 룸 준비
- 참가자가 스캐너에 배치되면 막힘이 발생하면 주입 또는 혈액 샘플에 대한 라인을 조작하거나 회수 할 여지가 거의 없습니다. 스캐너 룸을 준비하여 라인 막힘의 가능성을 최소화합니다.
- 모든 혈액 수집 장비가 수집 현장에서 쉽게 접근 할 수 있는지 확인하십시오. 캐뉼라 끝과 혈액 용기를 담을 수 있는 표면에 언더패드를 놓습니다. 일반 폐기물 및 생체 유해 폐기물을 위해 쓰레기통을 혈액 채취 장소에서 쉽게 도착할 수 있습니다.
- NMT에 의한 주입 펌프 준비
- 참가자와 연결되는 측면의 스캐너 룸에 주입 펌프를 설정합니다. 펌프 의 기지 주위에 리드 벽돌을 구축하고 펌프 앞에 리드 쉴드를 배치합니다. 참가자에게 주입을 제공하는 주입 펌프튜브를 연결하고 올바른 주입 속도가 입력되었는지 확인하십시오. 이 프로토콜의 경우 속도는 0.01 mL/s입니다.
- 참가자의 캐뉼라에 연결되기 전에 튜브를 프라임합니다. 주입 펌프에 20 mL 프라이밍 복용량을 연결합니다. 참가자에게 연결될 튜빙의 끝에 3방향 탭과 빈 20mL 주사기를 부착합니다. 18F-FDG 용액이 튜브를 통해 프라이밍 용량에서 흐르고 빈 주사기로만 수집되도록 탭이 배치되었는지 확인합니다.
- 주입 펌프를 15 mL의 부피를 프라이밍하도록 미리 설정하십시오. 펌프의 프라임 버튼을 선택하고 프롬프트를 따라 라인을 프라이밍합니다.
- 프라이밍 용량 대신 주입 펌프에 50 mL 용량 주사기를 부착하십시오. 참가자가 펌프에 연결할 준비가 될 때까지 3방향 탭의 15mL 프라이밍 용량이 남아 있을 수 있습니다.
- NMT, RA 및 RG에 의한 참가자 준비
- 참가자들에게 6시간 동안 금식하고 스캔 하기 전에 물(약 2잔)만 섭취하도록 조언하십시오.
- RA가 동의 절차를 수행하고 추가 조치(예: 인구 통계학적 조사, 인지 배터리 등)를 획득하도록 합니다. NMT 및 RG가 안전 스크린, PET 스캐닝을 위한 NMT 검토 안전성(예를 들어, 이전 8주 동안의 임신, 당뇨병, 화학요법 또는 방사선 요법 제외, 및 알려진 알레르기) 및 MRI 스캐닝을 위한 RG 검토 참가자 안전(예를 들어, 임신, 의료 또는 비 의료 용 금속 임플란트, 비 이동식 치과 임플란트, 밀실 공포증에 대한 제외).
- 참가자를 칸에 다.
- 두 개의 캐뉼라를 사용하십시오 : 투여 투여용과 혈액 샘플링을위한 다른 캐뉼라. 가장 적합한 캐뉼라는 참가자마다 다르지만 가장 적합한 정맥은 혈액 수집을 위해 예약해야합니다. 22 G 캐뉼라는 바람직한 최소 크기입니다. 캐뉼링 하는 동안 10 mL 기준선 혈액 샘플을 수집합니다. 라인의 개통을 유지하기 위해 압력하에 모든 식염수 플러시를 분리하십시오.
- 참가자의 혈당 수치 및 기타 기준선 혈액 측정(예: 헤모글로빈)을 기준선 샘플에서 테스트합니다.
- RG 및 NMT에 의해 스캐너에서 참가자 위치 지정
- RG가 스캐너 보어의 참가자를 배치하게 합니다. 긴 스캔의 경우, 참가자가 중퇴하고 불편함으로 인해 운동 유물의 위험을 줄이기 위해 편안함을 보장하는 것이 필수적입니다. 참가자는 편안한 체온을 유지하기 위해 일회용 담요로 덮여 있어야합니다.
- 주입 라인을 연결하기 전에 NMT플러를 플러시하여 최소한의 저항으로 특허를 보장하십시오. 연결되면 튜브를 손목 근처에서 가볍게 테이프로 녹화할 수 있습니다. 참가자에게 팔을 곧게 펴지 않도록 지시한다. 편안함을 위해 폼이나 쿠션과 같은 지지대를 사용하십시오. NMT는 또한 최소한의 저항으로 혈액을 철회 할 수 있는지 확인하기 위해 플라즈마 샘플에 사용되는 캐뉼러를 확인해야합니다. 참가자가 스캐너에있는 동안 캐뉼라를 더 쉽게 접근 할 수 있도록 일반 식염수로 프라이밍 된 확장 튜브를 연결해야 할 수도 있습니다. 필요한 경우 누출 여부를 확인해야 합니다.
- 피사체가 스캐너 보어에 들어가면 NMT가 두 캐뉼라에 적합한 지 확인하십시오.
- NMT는 스캔 중 언제든지 혈액 수집 캐뉼러, 주입 캐뉼러 또는 주입 펌프(예: 폐색, 배터리, 외설)에 문제가 있는 경우 RG 및 RA에 통보합니다.
3. 참가자 스캔
- NMT, RG 및 RA로 스캔 시작
- 스캔이 시작될 때 스캐너 룸에 NMT를 배치하여 주입 장비를 모니터링합니다. NMT가 청력 보호구를 착용하고 장벽 실드를 사용하여 가능한 경우 선량에서 방사선 노출을 최소화하십시오.
- RG가 참가자가 올바른 위치에 있는지 확인하기 위해 지역화 기 스캔을 수행하면서 PET 수집에 대한 세부 정보(예: 스캔 기간, 목록 모드 데이터 수집, 올바른 동위원소)를 확인합니다.
- PET 획득이 첫 번째 MRI 서열로 시작되도록 프로토콜을 디자인합니다. RG는 MRI 서열을 준비하고 시작합니다. 95분 PET 획득의 시작 시간은 MRI 서열의 시작까지 시간 잠김된다. 필요한 경우 NMT는 PET 획득 시 볼루스를 제공해야합니다(그림 1).
- 주입 펌프를 시작합니다. RG는 PET 획득이 시작된 후 펌프 30s를 시동하기 위해 NMT(예: 엄지손가락 사인을 통해)에 신호를 보내야 합니다. 이 프로토콜은 스캔 실패 시 안전 완충액을 제공하기 위해 스캔 시작 시간 후 주입 펌프 30s를 시작합니다. 이것은 또한 PET 스캔 중에 찍은 첫 번째 이미지가 완전한 시간 활동 곡선 데이터 수집을 위해 방사성 추적기 투여 전에 뇌를 색인화하도록 보장한다. NMT가 펌프를관찰하여 18F-FDG에 주입하기 시작했으며 라인의 즉각적인 폐색이 없는지 확인합니다.
- RA가 합의된 시간(즉, 기능적 실행/실험 블록의 시작 시)에 임의의 외부 자극을 개시하고 혈액 샘플에 대한 시간을 계산하게 한다. 예제 레코드 양식은 보충 1에표시됩니다. RA가 각 혈액 샘플의 예측 시간을 계산하고 NMT 및 실험실 도우미(LA)에 사본을 제공하도록 합니다. RA가 NMT가 대략 정확한 시간에 혈액 샘플을 취하고, 장비(예: 주입 펌프, 자극)를 모니터링하여 오류 의 징후를 확인하도록 합니다.
- 일정한 시간 간격으로 혈액 샘플을 채취하십시오.
- NMT와 RA가 10분마다 1개의 샘플을 채취합니다. 일반적으로 기준선 샘플을 포함하지 않는 총 10개의 샘플이 있습니다.
- PET 스캔과 동시에 MRI 스캔을 획득하는 경우 스캐너 실에 들어갈 때 NMT 착용 청력 보호구를 착용하십시오.
- NMT가 장갑을 착용하고 캐뉼라 끝을 깨끗하게 면도하십시오. 캐뉼라 부위가 마르는 동안 5 mL및 10 mL 주사기, 혈관및 10 mL 식염수 플러시를 엽니다.
- 5 mL 주사기를 사용하여 신선한 혈액 4-5 mL을 철회하고 생물학적 위험 폐기물에 주사기를 버립니다.
- 10 mL 주사기를 사용하여 최대 10 mL의 혈액을 인출하십시오. 부피는 혈액이 얼마나 쉽게 철회될 수 있는지에 의해 제한될 수 있습니다. 그것은 어떤 저항을 최소화 하는 것이 중요 하다 이후 hemolyze 수 있는 적혈구에 손상을 일으키는. 중간 수집 지점에서 RA에 NMT 신호를 보내고, 이 시그널은 샘플의 '실제' 시간으로 레코드양식(보충 1)에이 시간을 표시합니다.
- 10 mL 주사기를 혈관증에 연결한 다음 관련 혈액 튜브에 혈액을 입금합니다.
- 10 mL의 식염수로 캐뉼라를 빠르게 씻어내며, 압력하에서 분리되어 라인 응고의 가능성을 최소화하십시오.
- 즉시 분석을 위해 방사선 화학 실험실에 혈액 샘플을 가져 가라.
- LA에 의해 혈액을 회전
- LA에 모든 장비를 준비하십시오(표 1)장갑을 착용하십시오. 시료에 대해 세 개의 랙을 설정합니다: 혈액 튜브용 랙, 샘플을 파이펫팅하기 위한 랙, 채워진 파이펫샘플용 랙(사전 및 사후 계산).
- LA는 특히 카운팅 튜브를 취급할 때 절차 전반에 걸쳐 정기적으로 장갑을 교체하십시오. LA가 장갑에 방사성 플라즈마 오염이있는 경우, 카운팅 튜브로 이송될 수 있으며 샘플의 기록 된 개수를 스퓨리어있게 증가시킬 수 있습니다.
- 혈액 샘플은 인력 자원의 가용성이 허용됨에 따라 원심 분리기에 배치 될 수 있습니다, 혈액 샘플을 촬영 한 시간 때문에, 그리고 계산 된 시간이 지적되었다. 724 x g의상대 원심력으로 모든 샘플을 회전합니다. 이 프로토콜에 사용되는 원심분리기 설정은 가속 및 감속 곡선이 8로 설정된 5분 동안 2,000rpm입니다.
- 시료가 번지면 튜브를 파이펫팅 랙에 놓습니다. 샘플 분리를 방해하지 않도록 튜브 캡을 제거합니다. 라벨이 부착된 계수 튜브를 랙에 놓습니다. 라벨은 혈액 관에 해당 해야 합니다.
- 팁이 파이펫에 단단히 고정되어 있는지 확인합니다. 드립에 대한 조직을 준비하십시오. 꾸준히 혈액 튜브에서 플라즈마의 1,000 μL을 피펫, 계수 튜브로 전송하고, 계수 튜브와 혈액 튜브에 뚜껑을 교체.
- 카운트 튜브를 웰 카운터에 넣고 4분 동안 계산합니다. 모든 샘플에 대해 기록 시트에 계수 시작 시간('측정 시간')을 기록합니다. 이는 PET 획득 시작 시간에 대한 후속 수정에 필요합니다. 스캔 중 이후 시점에서 LA가 샘플의 백로그를 피하기 위해 각 단계를 연속해서 수행하도록 합니다.
- 혈액 제품 폐기물을 생물학적 위험 봉투에 버리십시오.
- LA에 모든 장비를 준비하십시오(표 1)장갑을 착용하십시오. 시료에 대해 세 개의 랙을 설정합니다: 혈액 튜브용 랙, 샘플을 파이펫팅하기 위한 랙, 채워진 파이펫샘플용 랙(사전 및 사후 계산).
Access restricted. Please log in or start a trial to view this content.
결과
연구별 방법
여기서, 대표적인 결과에 대한 연구별 세부사항이 보고된다. 이러한 세부 사항은 절차에 중요하지 않으며 연구에 따라 다릅니다.
참가자 및 작업 설계
참가자(n=3, 표 2)는동시BOLD-fMRI/FDG-f PET 연구를 거쳤다. 이 원고는 PET 획득 프로토콜에 중점을 두므로 MRI 결?...
Access restricted. Please log in or start a trial to view this content.
토론
FDG-PET는 대뇌 포도당 대사 지수인 포도당 섭취를 측정하는 강력한 이미징 기술입니다. 현재까지 FDG-PET를 사용하는 대부분의 신경 과학 연구는 스캔2의과정에 걸쳐 모든 대사 활동의 통합을 나타내는 정적 이미지 해상도와 함께 전통적인 볼루스 투여 접근법을 사용합니다. 이 원고는 두 가지 대체 방사성 추적자 투여 프로토콜을 설명합니다: 주입 전용(예를 들어, 빌리엔 외, 자마...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 이해 상충을 선언하지 않습니다. 자금 출처는 데이터의 연구 설계, 수집, 분석 및 해석에 관여하지 않았습니다.
감사의 말
자마다르는 호주 연구위원회(ARC) 발견 초기 경력 연구자 상(DECRA DE150100406)의 지원을 받고 있습니다. 자마다르, 워드, 이건은 통합 뇌 기능에 대한 우수성의 ARC 센터에 의해 지원됩니다 (CE114100007). 첸과 리는 레인우드 문화 재단의 기금으로 지원된다.
자마다르, 워드, 캐리, 매킨타이어는 프로토콜을 설계했다. 캐리, 매킨타이어, 사산, 팰런은 데이터를 수집했다. 자마다르, 워드, 파크스, 사산은 데이터를 분석했다. 자마다르, 워드, 캐리, 매킨타이어는 원고의 첫 번째 초안을 썼다. 모든 작성자는 최종 버전을 검토하고 승인했습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Blood Collection Equipment | |||
| --12-15 vacutainers | Becton Dickinson, NJ USA | 364880 | Remain in sterile packaging until required to put blood in tube |
| --12-15 10mL LH blood collecting tubes | Becton Dickinson | 367526 | Marked with the sample number (e.g., S1, S2…) and subsequently marked with the sample time (e.g., time 0 + x min [T0+x]) |
| --2-15 10mL Terumo syringe | Terumo Tokyo, Japan | SS+10L | These are drawn up on the day of the study and capped with the ampoule that contained the saline |
| -- pre-drawn 0.9% saline flushes | Pfizer, NY, USA | 61039117 | |
| --12-15 5mL Terumo syringes | Terumo Tokyo, Japan | SS+05S | Remain in sterile packaging until ready to withdraw a blood sample |
| Safety & Waste Equipment | All objects arranged on a plastic chair inside the scanner room on the same side as the arm from which the blood samples will be taken. Biohazard and non-biohazard waste bags to be used. Gloves and waste bags to be easily accessible when preparing the radioactivity in the dispensing area and when pipetting the plasma samples. Biohazard and non-biohazard waste bags to be used. All waste generated is checked with the Geiger counter to ensure that radioactive contaminated waste is stored until it is safe to be disposed of according to Australian Radiation Protection and Nuclear Safety Agency (APRANSA) guidelines for Radiation protection series No.6 (2017). | ||
| -- Gloves | Westlab, VIC, Australia | 663-219 | |
| -- waste bags | Austar Packaging, VIC, Australia | YIW6090 | |
| --cello underpads ‘blueys’ Underpads 5 Ply | Halyard Health, NSW, Australia | 2765A | |
| --Blue Sharpie pen | Sharpie, TN, USA | S30063 | |
| Dose Syringes | Remain in sterile packaging until ready for use. All syringes used in this facility have an additional 20% volume capacity above the stated volume on the packaging. This is important for the 50mL syringe where the total capacity of 60mL is used | ||
| --5mL | Terumo Tokyo, Japan | SS+05S | |
| -- 20mL | Terumo Tokyo, Japan | SS+20L | |
| --50mL | Terumo Tokyo, Japan | SS*50LE | |
| --1 Terumo 18-gauge needle | Terumo Tokyo, Japan | NN+1838R | Remain in sterile packaging until ready to inject [18F]FDG into the saline bag |
| --100mL 0.9% saline bag | Baxter Pharmaceutical, IL, USA | AHB1307 | Remain in sterile packaging until ready to inject [18F]FDG |
| Radiochemistry Lab Supplies | |||
| --Heraeus Megafuge 16 centrifuge; Rotor Bioshield 720 | ThermoScientific MA, USA | 75004230 | Relative Centrifugal Force = 724 Our settings are 2000RPM for 5mins. Acceleration and deceleration curves set to 8 |
| --Single well counter | Laboratory Technologies, Inc. IL, USA | 630-365-1000 | Complete daily quality control (includes background count) and protocol set to 18F and 4mins. Cross calibration is performed between the well counter, dose calibrator and scanner on a bi-monthly basis. |
| --Pipette | ISG Xacto, Vienna, Austria | LI10434 | We use a 100-1000 μL set to 1000μL. It is calibrated annually. |
| --12-15 plasma counting tubes | Techno PLAS; SA Australia | P10316SU | Marked in the same manner as the LH blood tubes |
| --12-15 pipette tips | Expell Capp, Denmark | 5130140-1 | |
| --3 test tube racks | Generic | Checked with a Geiger counter to ensure there is no radiation contamination on them | |
| --500mL volumetric flask and distilled water | Generic | Need approximately 500mL of distilled water to prepare the reference for gamma counting | |
| --Synchronised clocks in scanner room, console and radiochemistry lab | Generic | Synchronisation checks are routinely completed in the facility on a weekly basis | |
| --Haemoglobin Monitor | EKF Diagnostic Cardiff, UK Haemo Control. | 3000-0810-6801 | Manufacturer recommended quality control performed before testing on participant’s blood sample. |
| --Glucometre | Roche Accu-Chek | 6870252001 | Accu-Chek Performa is used to measure participant blood sugar levels in mmol/L. Quality control is performed daily using high and low concentration solution control test. |
| Cannulating Equipment | Check expiry dates and train NMT to prepare aseptically for cannulation. | ||
| --Regulation tourniquet | CBC Classic Kimetec GmBH | K5020 | |
| --20, 22 and 24 gauge cannulas | Braun, Melsungen Germany | 4251644-03; 4251628-03; 4251601-03 | |
| --tegaderm dressings | 3M, MN USA | 1624W | |
| --alcohol and chlorhexidine swabs | Reynard Health Supplies, NSW Australia | RHS408 | |
| --0.9% saline 10mL ampoules; for flushes | Pfizer, NY, USA | 61039117 | |
| --10mL syringes | Terumo Tokyo, Japan | SS+10L | |
| --3-way tap | Becton Dickinson Connecta | 394600 | |
| --IV bung | Safsite Braun PA USA | 415068 | |
| --Optional extension tube, microbore extension set | M Devices, Denmark | IV054000 | |
| Scanner Room Equipment | |||
| --Siemens Biograph 3T mMR | Siemens, Erlangen, Germany | ||
| --Portable lead barrier shield | Gammasonics | Custom-built | MR-conditional lead barrier shield. Positioned at the 2000 Gauss line with the castors locked to provide additional shielding of the radioactivity connected to the infusion pump. |
| --Infusion pump BodyGuard 323 MR-conditional infusion pump | Caesarea Medical Electronics | 300-040XP | MR-compatible. This model is cleared for use on 1.5 and 3T scanners at 2000 Gauss with castors locked. |
| --Infusion pump tubing | Caesarea Medical Electronics | 100-163X2YNKS | Tubing is administration set with an anti-siphon valve and male luer lock (REF 100-163X2YNKS). |
| --Lead bricks | Custom built | Tested for ferromagnetic translational force | |
| Other Equipment | |||
| --Syringe shields | Biodex, NY USA | Custom-built | There is a 5mL tungsten syringe shield that is MR-safe, as well as a 50mL lead shield that has been tested for ferromagnetic attraction prior to use in the MR-PET scanner. It is used to transport the radioactive dose from the radiochemistry lab into the scanner to minimise radiation exposure to the NMT. |
| --Geiger counter Model 26-1 Integrated Frisker | Ludlum Measurements, Inc. TX USA | 48-4007 | This is calibrated annually and used to monitor potential contamination and waste. It is not taken into the MR-PET scanner. |
참고문헌
- Heurling, K., et al. Quantitative positron emission tomography in brain research. Brain Research. 1670, 220-234 (2017).
- Chen, Z., et al. From simultaneous to synergistic MR-PET brain imaging: A review of hybrid MR-PET imaging methodologies. Human Brain Mapping. 39 (12), 5126-5144 (2018).
- Jones, T., Rabiner, E. A. The development, past achievements, and future directions of brain PET. Journal of Cerebral Blood Flow & Metabolism. 32 (7), 1426-1454 (2012).
- Kety, S. S. Metabolism of the nervous system. , Elsevier. 221-237 (1957).
- Sokoloff, L. The metabolism of the central nervous system in vivo. Handbook of Physiology, section I, neurophysiology. 3, 1843-1864 (1960).
- Harris, J. J., Jolivet, R., Attwell, D. Synaptic energy use and supply. Neuron. 75 (5), 762-777 (2012).
- Mosconi, L., et al. FDG-PET changes in brain glucose metabolism from normal cognition to pathologically verified Alzheimer's disease. European Journal of Nuclear Medicine and Molecular Imaging. 36 (5), 811-822 (2009).
- Pagano, G., Niccolini, F., Politis, M. Current status of PET imaging in Huntington's disease. European Journal of Nuclear Medicine and Molecular Imaging. 43 (6), 1171-1182 (2016).
- Petit-Taboue, M., Landeau, B., Desson, J., Desgranges, B., Baron, J. Effects of healthy aging on the regional cerebral metabolic rate of glucose assessed with statistical parametric mapping. Neuroimage. 7 (3), 176-184 (1998).
- Chugani, H. T., Phelps, M. E., Mazziotta, J. C. Positron emission tomography study of human brain functional development. Annals of Neurology. 22 (4), 487-497 (1987).
- Phelps, M. E., Mazziotta, J. C. Positron emission tomography: human brain function and biochemistry. Science. 228 (4701), 799-809 (1985).
- Zimmer, E. R., et al. [18 F] FDG PET signal is driven by astroglial glutamate transport. Nature Neuroscience. 20 (3), 393(2017).
- Roberts, R. P., Hach, S., Tippett, L. J., Addis, D. R. The Simpson's paradox and fMRI: Similarities and differences between functional connectivity measures derived from within-subject and across-subject correlations. Neuroimage. 135, 1-15 (2016).
- Horwitz, B. The elusive concept of brain connectivity. Neuroimage. 19 (2), 466-470 (2003).
- Moses, W. W. Fundamental limits of spatial resolution in PET. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 648, S236-S240 (2011).
- Tomasi, D. G., et al. Dynamic brain glucose metabolism identifies anti-correlated cortical-cerebellar networks at rest. Journal of Cerebral Blood Flow & Metabolism. 37 (12), 3659-3670 (2017).
- Hahn, A., et al. Quantification of task specific glucose metabolism with constant infusion of 18F-FDG. Journal of Nuclear Medicine. 57 (12), 1933-1940 (2016).
- Hahn, A., et al. Task-relevant brain networks identified with simultaneous PET/MR imaging of metabolism and connectivity. Brain Structure and Function. 223 (3), 1369-1378 (2018).
- Jamadar, S. D., et al. Simultaneous task-based BOLD-fMRI and [18-F] FDG functional PET for measurement of neuronal metabolism in the human visual cortex. Neuroimage. 189, 258-266 (2019).
- Rischka, L., et al. Reduced task durations in functional PET imaging with [18F] FDG approaching that of functional MRI. Neuroimage. 181, 323-330 (2018).
- Villien, M., et al. Dynamic functional imaging of brain glucose utilization using fPET-FDG. Neuroimage. 100, 192-199 (2014).
- Carson, R. E. PET physiological measurements using constant infusion. Nuclear Medicine and Biology. 27 (7), 657-660 (2000).
- Carson, R. E., et al. Comparison of bolus and infusion methods for receptor quantitation: application to [18F] cyclofoxy and positron emission tomography. Journal of Cerebral Blood Flow & Metabolism. 13 (1), 24-42 (1993).
- National Health and Medical Research Council. National statement on ethical conduct in human research. , (2007).
- Australian Radiation Protection and Nuclear Safety Agency. Code of practice for the exposure of humans to ionizing radiation for research purposes. , (2005).
- Jenkinson, M., Beckmann, C. F., Behrens, T. E., Woolrich, M. W., Smith, S. M. FSL. Neuroimage. 62 (2), 782-790 (2012).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310(2010).
- Avants, B., Klein, A., Tustison, N., Woo, J., Gee, J. C. 16th Annual Meeting for the Organization of Human Brain Mapping. , (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), e1005350(2017).
- Tustison, N. J., et al. Large-scale evaluation of ANTs and FreeSurfer cortical thickness measurements. Neuroimage. 99, 166-179 (2014).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. Neuroimage. 54 (3), 2033-2044 (2011).
- Burgos, N., et al. Attenuation correction synthesis for hybrid PET-MR scanners: application to brain studies. IEEE Transactions on Medical Imaging. 33 (12), 2332-2341 (2014).
- Panin, V. Y., Kehren, F., Michel, C., Casey, M. Fully 3-D PET reconstruction with system matrix derived from point source measurements. IEEE Transactions on Medical Imaging. 25 (7), 907-921 (2006).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. Neuroimage. 17 (2), 825-841 (2002).
- Bludau, S., et al. Cytoarchitecture, probability maps and functions of the human frontal pole. Neuroimage. 93, 260-275 (2014).
- Amunts, K., Malikovic, A., Mohlberg, H., Schormann, T., Zilles, K. Brodmann's areas 17 and 18 brought into stereotaxic space-where and how variable? Neuroimage. 11 (1), 66-84 (2000).
- Malikovic, A., et al. Cytoarchitectonic analysis of the human extrastriate cortex in the region of V5/MT+: a probabilistic, stereotaxic map of area hOc5. Cerebral Cortex. 17 (3), 562-574 (2006).
- Wilms, M., et al. Human V5/MT+: comparison of functional and cytoarchitectonic data. Anatomy and Embryology. 210 (5-6), 485-495 (2005).
- Eickhoff, S. B., Heim, S., Zilles, K., Amunts, K. Testing anatomically specified hypotheses in functional imaging using cytoarchitectonic maps. Neuroimage. 32 (2), 570-582 (2006).
- Eickhoff, S. B., et al. Assignment of functional activations to probabilistic cytoarchitectonic areas revisited. Neuroimage. 36 (3), 511-521 (2007).
- Eickhoff, S. B., et al. A new SPM toolbox for combining probabilistic cytoarchitectonic maps and functional imaging data. Neuroimage. 25 (4), 1325-1335 (2005).
- Everett, B. A., et al. Safety of radial arterial catheterization in PET research subjects. Journal of Nuclear Medicine. 50 (10), 1742-1742 (2009).
- Takagi, S., et al. Quantitative PET cerebral glucose metabolism estimates using a single non-arterialized venous-blood sample. Annals of Nuclear Medicine. 18 (4), 297-302 (2004).
- Zanotti-Fregonara, P., Chen, K., Liow, J. S., Fujita, M., Innis, R. B. Image-derived input function for brain PET studies: many challenges and few opportunities. Journal of Cerebral Blood Flow & Metabolism. 31 (10), 1986-1998 (2011).
- O'Loughlin, S., Currie, G. M., Trifonovic, M., Kiat, H. Ambient temperature and cardiac accumulation of 18F-FDG. Journal of Nuclear Medicine Technology. 42 (3), 188-193 (2014).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유