需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
人脑高时态分辨率正态发射断层扫描的放射跟踪器管理:在FDG-fPET中的应用
摘要
本手稿描述了 FDG-PET 的两个放射性跟踪器管理协议(恒定输注和 bolus 加输注),并将其与 bolus 给用进行比较。使用这些协议可实现 16 s 的时态分辨率。
摘要
功能正电子发射断层扫描 (fPET) 提供了一种跟踪人脑中分子目标的方法。使用放射性标记的葡萄糖模拟物,18F-氟脱氧葡萄糖(FDG-fPET),现在可以通过接近功能磁共振成像(fMRI)的时间分辨率测量葡萄糖代谢的动态。这种直接的葡萄糖吸收量测量对于理解正常和异常的大脑功能以及探索代谢和神经退行性疾病的影响具有巨大的潜力。此外,混合MR-PET硬件的新进展使得使用fMRI和FDG-fPET同时捕获葡萄糖和血液氧合的波动成为可能。
FDG-fPET 图像的时间分辨率和信噪噪声在很大程度上取决于无线电跟踪器的管理。这项工作提出了两种替代的连续输注方案,并将其与传统博鲁斯方法进行比较。提出了一种采集血液样本、时间锁定PET、MRI、实验刺激以及管理非传统示踪剂输送的方法。使用视觉刺激,协议结果显示单个水平上对外部刺激的葡萄糖反应的皮质图,时间分辨率为16s。
引言
正电子发射断层扫描(PET)是一种强大的分子成像技术,广泛用于临床和研究环境(见Heurling等人1,最近进行了全面审查)。可以使用PET成像的分子靶点仅受放射性追踪器可用性的限制,并且已经开发出许多示踪剂来成像神经代谢受体、蛋白质和酶2、3。在神经科学中,最常用的放射性追踪器之一是18种F-氟氧葡萄糖(FDG-PET),它测量葡萄糖的吸量,通常被解释为脑葡萄糖代谢的指数。人脑需要恒定可靠的葡萄糖供应,以满足其能量需求4,5和70-80%的脑葡萄糖代谢被神经元在突触传播6使用。脑葡萄糖代谢的变化被认为是启动和促成许多情况,包括精神病,神经退行性,和缺血性条件7,8,9。此外,由于FDG的接受量与突触活性10、11、12成正比,与使用最广泛的血液相比,它被认为是神经元活性的更直接、更不混淆的指数氧合水平相关功能磁共振成像(BOLD-fMRI)响应。BOLD-fMRI是神经活动的间接指标,用于测量在神经元活动后发生一系列神经血管变化后发生的脱氧血红蛋白的变化。
大多数对人脑的FDG-PET研究获得脑葡萄糖摄取的静态图像。参与者在昏暗的房间里睁开眼睛,安静地休息了10分钟。完整的放射性追踪剂量在几秒钟内作为博鲁斯施用,然后参与者再休息30分钟。在摄取期之后,参与者被放置在 PET 扫描仪的中心,并获取反映摄取和扫描期间累积 FDG 分布的 PET 图像。因此,由 PET 图像索引的神经元活动表示所有认知活动在吸收和扫描期间以上的累积平均值,并不特定于扫描期间的认知活动。该方法对大脑大脑代谢和神经元功能提供了很好的见解。然而,时间分辨率等于扫描持续时间(通常为45分钟,有效地产生葡萄糖摄取的静态测量;这与认知过程中的神经元反应和神经成像中的常见实验相比是不利的。由于时间分辨率有限,该方法提供了葡萄糖摄入量的非特定指标(即,不锁定在任务或认知过程中),并且无法提供主体内变异性度量,这可能导致由于辛普森的悖论13。辛普森的悖论是一种情况,在这种情景中,跨主题计算的大脑行为关系并不一定表明受试者内部测试的相同关系。此外,最近尝试将功能连接措施应用于 FDG-PET 只能测量跨主体连接。因此,连接性的差异只能在组之间进行比较,不能针对各个主体计算。虽然究竟什么是跨主题连接性措施14尚存争议,但很显然,跨主题计算但非在受试者内的测量不能用作疾病状态的生物标志物,也不能用于检查个体变异的来源。
在过去五年中,临床级同步 MRI-PET 扫描仪的发展和更广泛的可访问性激发了对 FDG-PET 成像2认知神经科学的新研究兴趣。随着这些发展,研究人员专注于提高FDG-PET的时间分辨率,以接近BOLD-fMRI的标准(±0.5~2.5s)。请注意,BOLD-fMRI 的空间分辨率可以接近亚毫米分辨率,但由于正电子范围15,FDG-PET 的空间分辨率基本上限制在半最大 (FWHM) 时全宽约 0.54 mm。动态FDG-PET采集,在临床上经常使用,使用bolus管理方法,并将列表模式数据重建为bin。bolus动态FDG-PET方法提供大约100s的时间分辨率(例如,Tomasi等人16)。这显然比静态 FDG-PET 成像要好得多,但与 BOLD-fMRI 相比,效果不相上下。此外,检查大脑功能的窗口是有限的,因为FDG的血浆浓度在施用bolus后很快减少。
为了扩大这个实验窗口,少数研究17,18,19,20,21已经适应了无线电跟踪器输注方法之前提出的卡森22, 23.在此方法中,有时被描述为"功能 FDG-PET"(FDG-f PET,类似于 BOLD-f MRI),在整个 PET 扫描过程中,放射跟踪器作为持续输注进行管理(±90 分钟)。输注协议的目标是保持FDG的恒定血浆供应,以跟踪葡萄糖摄入量随时间的动态变化。在概念验证研究中,Villien等人21使用恒定输注协议和同时MRI/FDG-f PET显示葡萄糖摄入量的动态变化,以响应棋盘刺激,时间分辨率为60s。后续研究已使用此方法显示任务锁定的 FDG-fPET(即,时间锁定到外部刺激19)和与任务相关的 FDG-f PET(即,不锁定时间到外部刺激17,18)葡萄糖摄入量。利用这些方法,获得了60s的FDG-f PET时间分辨率,比bolus方法有了很大的改进。初步资料显示,输液方法可提供20~60s19的时间分辨率。
尽管恒定输注方法取得了可喜的结果,但这些研究的等离子体放射性曲线表明,输注方法不足以在90分钟的扫描19、21的时间内达到稳定状态。除了恒定的输注程序外,Carson22还提出了一种混合博鲁斯/输注程序,目标是在扫描开始时快速达到平衡,然后将等离子体放射性水平保持在平衡状态。扫描的持续时间。Rischka等人20最近使用20%的博鲁斯加80%的输注应用了这项技术。正如所料,动脉输入功能迅速上升到基线水平以上,并且以更高的速率维持更长时间,而使用输注程序19,21的结果。
本文介绍了使用输液和博鲁斯/输注放射跟踪器进行获取高时态分辨率FDG-f PET扫描的采集方案。这些协议已开发用于同时使用MRI-PET环境,采集时间为90-95分钟19。在协议中,采集血液样本以量化血浆血清放射性,以便随后对PET图像进行量化。虽然该协议的重点是使用BOLD-f MRI/FDG-f PET在功能神经成像中应用输注方法,但这些方法可以应用于任何FDG-f PET研究,而不管是否同时进行MRI,BOLD-fMRI,计算机断层扫描(CT),或其他神经图像被获取。图 1显示了此协议中过程的流程图。
Access restricted. Please log in or start a trial to view this content.
研究方案
该协议已根据《澳大利亚关于人类研究中道德行为的国家声明24》经莫纳什大学人类研究伦理委员会(批准号CF16/1108- 2016000590)审查和批准。程序是在经认可的医学物理学家、核医学技术专家和临床放射技师的指导下开发的。研究人员应参考当地专家和人类电离辐射管理指南。
1. 所需的设备和人员
- 请参阅扫描仪室、放射化学实验室和一般材料的材料表。一个商业供应商被用于无线电跟踪器。
- 在同时进行的MRI-PET环境中,使用四个人:一名放射技师(RG)进行扫描,一名核医学技师(NMT)监督放射追踪器的管理和采集血液样本,一名实验室助理(LA)负责旋转血液,和一个研究助理(RA)负责监督实验设计和刺激演示。
2. 准备
- NMT 的示踪剂剂量制备
- 计算在扫描过程中将施用的输液量。在此协议中,输注速率为0.01 mL/s,超过95分钟。因此,在 95 分钟的扫描中,参与者将获得 0.01 mL/s x 60 s x 95 分钟 = 57 mL。
- 计算将稀释到施用盐水溶液中的示踪剂剂量。在此协议中,总剂量为260 MBq,给参与者施用超过95分钟。根据澳大利亚辐射防护和核安全局(ARPANSA)关于人类暴露于电离辐射25的准则,选择这种剂量将辐射照射限制在4.9 mSv,以保持在"低水平风险"分类内。衰变正确的260 MBq从中间输注点(47.5分钟)回到T0。使用公式 1,求解 A0
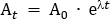
其中 At是输注的中点处的放射性 (MBq),A0是初始放射性,α 是示踪剂特有的放射性衰变常数。对于 FDG,值为 ± 0.693/T1/2。T1/2是18F (110 分钟) 的半寿命。
注:在此示例中,At = 260 MBq,= 0.693/110,t = -47.5,因此 A0 = 350.942 MBq。 - 计算100 mL盐水袋所需的放射性追踪剂剂量,该剂量将用于给参与者管理剂量。盐水袋所需的放射性追踪器被稀释至总体积为 5 mL,并在 5 mL 注射器中绘制。因此,对于100 mL盐水袋,除带放射性追踪器的注射器的 5 mL 体积外,稀释系数是盐水 (100 mL) 的体积。这总体积为 105 mL 除以 57 mL 的输注量(即 105 mL/57 mL = 1.842)。因此,除了 100 mL 袋外,增加 5 mL 体积所需的总放射性为 A0 x 稀释系数(即 350.942 MBq x 1.842 = 646.44 MBq)。无菌地将放射线添加到盐水袋中。
注:请务必注意,添加到盐水袋中的 646.44 MBq 的计算活性是输液开始时所需的活动。通常,此协议的剂量在施用前 15 分钟到 1 小时之间准备。因此,在放射性同位素衰变中考虑是很重要的。2.1.2 中的等式 1。可用于解释这一点,其中时间 (t) 是从准备剂量到活动将施用时的总分钟数,At = 646.44 MBq,通过求解 A0。 - 准备注油剂量。从袋子中取出20 mL到注射器中并盖上盖子。校准此 20 mL 注射器和标签。注射器经过校准,作为参考检查,以确保放射性均匀地分散在盐水袋内。
- 准备剂量。使用 50 mL 注射器,从袋子中取出 60 mL,并盖上红色 Combi 塞子。此注射器未经过校准,因为放射性浓度从添加到盐水袋时起就知道(步骤 2.1.3)。将两个注射器存放在放射化学实验室,直到准备扫描。
注: 在 50 mL 注射器中可以绘制 60 mL 的体积,因为 Terumo 注射器的标记比标记的体积高出 20%(即 50 mL 注射器标记为 60 mL)。 - 准备参考剂量。用约 480 mL 的蒸馏水填充 500 mL 体积烧瓶。将18F-FDG 的 10 MBq 绘制到注射器中,将衰变校正到扫描开始时间(使用公式 1),并将其添加到烧瓶中。用更多的蒸馏水将体积顶至 500 mL 标记,并彻底混合。注射器的预校准和校准后贴标签。
- NMT 的扫描仪室准备
- 一旦参与者被放置在扫描仪中,当发生堵塞时,几乎没有空间来操作或挽救输液或血液样本。准备扫描仪室,以尽量减少线路堵塞的可能性。
- 确保所有采血设备都很容易到达采集地点。将底垫放在管底和任何装有血液容器的表面。将常规废物和生物危险废物的垃圾箱放在血液收集场所的方便范围内。
- NMT 的输注泵制备
- 在将连接到参与者的侧的扫描仪室中设置输液泵。在泵底座周围构建铅砖,并将引线护罩放在泵前面。连接输注泵的油管,将输液输送到参与者,并确保输入正确的输注速率。对于此协议,速率为 0.01 mL/s。
- 在管道连接到学员的管管之前,先给油管加注。将 20 mL 注油剂量连接到输注泵。在将连接到参与者的管的末端,连接一个三向水龙头和一个空的 20 mL 注射器。确保水龙头定位,使18F-FDG 溶液从注油剂量流过管,并仅收集到空注射器中。
- 预设输液泵以充注 15 mL 的体积。选择泵上的"优质"按钮,然后按照提示为线路充油。
- 将 50 mL 剂量注射器连接到输注泵,以代替注油剂量。三向水龙头上的 15 mL 注油剂量可以保持在那里,直到参与者准备好连接到泵。
- NMT、RA 和 RG 的参与者准备
- 建议参与者在扫描前禁食6小时,只喝水(约两杯)。
- 让 RA 执行同意程序并获得其他措施(例如人口调查、认知电池等)。让 NMT 和 RG 进行安全检查,NMT 审查 PET 扫描的安全性(例如,过去 8 周内禁止怀孕、糖尿病、化疗或放射治疗,以及已知过敏),以及 RG 审查参与者 MRI 扫描的安全性(例如,不包括怀孕、医疗或非医疗金属植入物、不可拆卸牙科植入物、幽闭症)。
- 对参与者进行整理。
- 使用两个管状:一个用于剂量管理,另一个用于血液采样。最合适的静脉检查因参与者而异,但最合适的静脉应保留用于血液采集。22 G 形管是首选的最小尺寸。收集10 mL基线血样,同时进行排尿。在压力下断开所有盐水冲洗,以保持管线的轻量。
- 从基线样本测试参与者的血糖水平和其他基线血液测量值(例如血红蛋白)。
- RG 和 NMT 在扫描仪中的参与者定位
- 让 RG 定位学员进入扫描仪孔。对于长时间扫描,必须确保舒适,以减少参与者因不适而辍学和运动的风险。学员应用一次性毯子覆盖,以保持舒适的体温。
- 在连接输液管之前,让 NMT 冲洗导管,以确保其具有最小的电阻。连接后,管子可以轻轻贴在手腕附近。指示学员保持手臂伸直。使用泡沫或垫子等支架获得舒适。让 NMT 也检查将用于血浆样品的管状,以确保其能够以最小的阻力提取血液。可能需要将加线管与普通盐水连接,以使参与者在扫描仪中时更容易接触导管。如果需要,应检查泄漏情况。
- 一旦主体进入扫描仪孔中,请进行 NMT 检查,检查它们是否适合使用两个导管。
- 如果在扫描过程中随时出现采血管、输液管或输液泵(例如闭塞、电池、外溢)的任何问题,请 NMT 通知 RG 和 RA。
3. 扫描参与者
- 使用 NMT、RG 和 RA 开始扫描
- 在扫描开始时,将 NMT 置于扫描仪室以监控输液设备。确保 NMT 佩戴听力防护服,并使用屏障护罩,尽可能将剂量的辐射暴露降至最低。
- 当 RG 执行定位器扫描以确保参与者处于正确位置时,请检查 PET 采集的详细信息(例如,扫描持续时间、列表模式数据收集、正确同位素)。
- 设计协议,以便从第一个 MRI 序列开始 PET 采集。RG 准备并启动 MRI 序列。95 分钟 PET 采集的开始时间是时间锁定到 MRI 序列的开始时间。如果需要,NMT 应在购买 PET 时提供 bolus(图1)。
- 启动输注泵。RG 应发出 NMT 信号(例如,通过竖起大拇指标志)在 PET 采集开始后 30 s 启动泵。此协议在扫描开始时间后 30 s 启动输液泵,以在扫描失败时提供安全缓冲。这还确保在 PET 扫描期间拍摄的第一张图像在放射跟踪器管理之前对大脑进行索引,以便进行完整的时间活动曲线数据收集。让 NMT 观察泵,以确保它已开始注入18F-FDG,并且管路没有立即阻塞。
- 让 RA 在约定的时间启动任何外部刺激(即,在功能运行/实验块开始时),并计算血液样本的时间。示例记录窗体显示在补编 1中。让 RA 计算每个血液样本的预测时间,并将副本提供给 NMT 和实验室助理 (LA)。请 RA 确保 NMT 在大约正确的时间采集血液样本,并监控设备(例如输液泵、刺激器)是否存在任何错误迹象。
- 定期采集血液样本
- 让 NMT 和 RA 每 10 分钟采集一个样本。通常共有 10 个样本,不包括基线样本。
- 如果与 PET 扫描同时获得 MRI 扫描,则在进入扫描仪室时具有 NMT 磨损听力保护。
- 让 NMT 戴上手套,并擦拭导管的尖端。当管状部位干燥时,打开一个5 mL和10 mL注射器、迷幻器和10 mL盐水冲洗。
- 使用 5 mL 注射器,提取 4-5 mL 的新鲜血液,并将注射器丢弃在生物危害废物中。
- 使用 10 mL 注射器,提取最多 10 mL 的血液。血液的提取程度可能受限于血液的提取程度。重要的是要尽量减少任何抵抗,随后对红血球的损害,可以溶血。在中收集点,向 RA 发出 NMT 信号,RA 将在记录窗体(补充 1)上将此时间标记为样本的"实际"时间。
- 将 10 mL 注射器连接到静脉注射器,然后将血液存入相关血管。
- 用 10 mL 的盐水快速冲洗管断,在压力下断开,以尽量减少任何线路凝固的机会。
- 立即将血液样本带到放射化学实验室进行分析。
- 在洛杉矶旋转血液
- 让洛杉矶准备好所有的设备(表1),戴上手套。为样品设置三个机架:一个用于血管,一个用于移液样品,一个用于填充移液样品(计数前和计数后)。
- 让 LA 在整个过程中定期更换手套,尤其是在处理计数管时。如果洛杉矶手套上有任何放射性等离子体污染,它可以转移到计数管,并虚假地增加记录的样本数量。
- 在人力资源允许的情况下,血液样本可以放在离心机中,因为记录采集血液样本的时间和计数时间。以724 x g的相对离心力旋转所有样品。该协议使用的离心机设置为 2,000 rpm,5 分钟,加速和减速曲线设置为 8。
- 样品旋转后,将管放在移液架中。拆下管盖,以免干扰样品分离。在机架中放置一个贴有标签的计数管。标签应对应于血管。
- 确保吸头牢固地固定在移液器上。准备好一个组织,以便进行任何滴水。从血管稳定移液1,000 μL的血浆,转移到计数管,并更换计数管和血管上的盖子。
- 将计数管放入井面计数器,计数 4 分钟。将计数开始时间记录在记录单上("测量时间")上。这是对 PET 采集开始时间的后续更正所必需的。在扫描的后期点,让 LA 快速连续执行每个步骤,以避免样本积压。
- 处理生物危害袋中的任何血液制品废物。
- 让洛杉矶准备好所有的设备(表1),戴上手套。为样品设置三个机架:一个用于血管,一个用于移液样品,一个用于填充移液样品(计数前和计数后)。
Access restricted. Please log in or start a trial to view this content.
结果
研究特定方法
在这里,报告具有代表性结果的研究特定细节。这些细节对程序并不重要,并且会因研究而异。
参与者和任务设计
参与者(n = 3,表2)同时进行了BOLD-fMRI/FDG-f PET研究。由于本手稿侧重于 PET 采集协议,因此不会报告 MRI 结果。在95分钟的扫描过程中,参与?...
Access restricted. Please log in or start a trial to view this content.
讨论
FDG-PET是一种强大的成像技术,用于测量葡萄糖的摄取量,这是脑葡萄糖代谢的指标。迄今为止,大多数使用FDG-PET的神经科学研究都使用传统的bolus管理方法,静态图像分辨率表示扫描2过程中所有代谢活动的组成部分。本手稿描述了两种替代放射性追踪器管理协议:仅输液(例如,Villien等人、Jamadar等人19、21)和混合博鲁斯/输注(例如R...
Access restricted. Please log in or start a trial to view this content.
披露声明
提交人声明没有利益冲突。资金来源没有参与数据的研究设计、收集、分析和解释。
致谢
Jamadar 获得澳大利亚研究委员会 (ARC) 发现早期职业研究员奖 (DECRA DE150100406) 的支持。Jamadar、Ward 和 Egan 由 ARC 综合脑功能卓越中心 (CE114100007) 提供支持。陈和李由瑞格伍德文化基金会资助。
贾马达尔、沃德、凯里和麦金太尔设计了协议。凯里、麦金太尔、萨桑和法伦收集了这些数据。贾马达尔、沃德、帕克斯和萨桑分析了这些数据。贾玛达尔、沃德、凯里和麦金太尔撰写了手稿的初稿。所有作者都审阅并批准了最终版本。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Blood Collection Equipment | |||
| --12-15 vacutainers | Becton Dickinson, NJ USA | 364880 | Remain in sterile packaging until required to put blood in tube |
| --12-15 10mL LH blood collecting tubes | Becton Dickinson | 367526 | Marked with the sample number (e.g., S1, S2…) and subsequently marked with the sample time (e.g., time 0 + x min [T0+x]) |
| --2-15 10mL Terumo syringe | Terumo Tokyo, Japan | SS+10L | These are drawn up on the day of the study and capped with the ampoule that contained the saline |
| -- pre-drawn 0.9% saline flushes | Pfizer, NY, USA | 61039117 | |
| --12-15 5mL Terumo syringes | Terumo Tokyo, Japan | SS+05S | Remain in sterile packaging until ready to withdraw a blood sample |
| Safety & Waste Equipment | All objects arranged on a plastic chair inside the scanner room on the same side as the arm from which the blood samples will be taken. Biohazard and non-biohazard waste bags to be used. Gloves and waste bags to be easily accessible when preparing the radioactivity in the dispensing area and when pipetting the plasma samples. Biohazard and non-biohazard waste bags to be used. All waste generated is checked with the Geiger counter to ensure that radioactive contaminated waste is stored until it is safe to be disposed of according to Australian Radiation Protection and Nuclear Safety Agency (APRANSA) guidelines for Radiation protection series No.6 (2017). | ||
| -- Gloves | Westlab, VIC, Australia | 663-219 | |
| -- waste bags | Austar Packaging, VIC, Australia | YIW6090 | |
| --cello underpads ‘blueys’ Underpads 5 Ply | Halyard Health, NSW, Australia | 2765A | |
| --Blue Sharpie pen | Sharpie, TN, USA | S30063 | |
| Dose Syringes | Remain in sterile packaging until ready for use. All syringes used in this facility have an additional 20% volume capacity above the stated volume on the packaging. This is important for the 50mL syringe where the total capacity of 60mL is used | ||
| --5mL | Terumo Tokyo, Japan | SS+05S | |
| -- 20mL | Terumo Tokyo, Japan | SS+20L | |
| --50mL | Terumo Tokyo, Japan | SS*50LE | |
| --1 Terumo 18-gauge needle | Terumo Tokyo, Japan | NN+1838R | Remain in sterile packaging until ready to inject [18F]FDG into the saline bag |
| --100mL 0.9% saline bag | Baxter Pharmaceutical, IL, USA | AHB1307 | Remain in sterile packaging until ready to inject [18F]FDG |
| Radiochemistry Lab Supplies | |||
| --Heraeus Megafuge 16 centrifuge; Rotor Bioshield 720 | ThermoScientific MA, USA | 75004230 | Relative Centrifugal Force = 724 Our settings are 2000RPM for 5mins. Acceleration and deceleration curves set to 8 |
| --Single well counter | Laboratory Technologies, Inc. IL, USA | 630-365-1000 | Complete daily quality control (includes background count) and protocol set to 18F and 4mins. Cross calibration is performed between the well counter, dose calibrator and scanner on a bi-monthly basis. |
| --Pipette | ISG Xacto, Vienna, Austria | LI10434 | We use a 100-1000 μL set to 1000μL. It is calibrated annually. |
| --12-15 plasma counting tubes | Techno PLAS; SA Australia | P10316SU | Marked in the same manner as the LH blood tubes |
| --12-15 pipette tips | Expell Capp, Denmark | 5130140-1 | |
| --3 test tube racks | Generic | Checked with a Geiger counter to ensure there is no radiation contamination on them | |
| --500mL volumetric flask and distilled water | Generic | Need approximately 500mL of distilled water to prepare the reference for gamma counting | |
| --Synchronised clocks in scanner room, console and radiochemistry lab | Generic | Synchronisation checks are routinely completed in the facility on a weekly basis | |
| --Haemoglobin Monitor | EKF Diagnostic Cardiff, UK Haemo Control. | 3000-0810-6801 | Manufacturer recommended quality control performed before testing on participant’s blood sample. |
| --Glucometre | Roche Accu-Chek | 6870252001 | Accu-Chek Performa is used to measure participant blood sugar levels in mmol/L. Quality control is performed daily using high and low concentration solution control test. |
| Cannulating Equipment | Check expiry dates and train NMT to prepare aseptically for cannulation. | ||
| --Regulation tourniquet | CBC Classic Kimetec GmBH | K5020 | |
| --20, 22 and 24 gauge cannulas | Braun, Melsungen Germany | 4251644-03; 4251628-03; 4251601-03 | |
| --tegaderm dressings | 3M, MN USA | 1624W | |
| --alcohol and chlorhexidine swabs | Reynard Health Supplies, NSW Australia | RHS408 | |
| --0.9% saline 10mL ampoules; for flushes | Pfizer, NY, USA | 61039117 | |
| --10mL syringes | Terumo Tokyo, Japan | SS+10L | |
| --3-way tap | Becton Dickinson Connecta | 394600 | |
| --IV bung | Safsite Braun PA USA | 415068 | |
| --Optional extension tube, microbore extension set | M Devices, Denmark | IV054000 | |
| Scanner Room Equipment | |||
| --Siemens Biograph 3T mMR | Siemens, Erlangen, Germany | ||
| --Portable lead barrier shield | Gammasonics | Custom-built | MR-conditional lead barrier shield. Positioned at the 2000 Gauss line with the castors locked to provide additional shielding of the radioactivity connected to the infusion pump. |
| --Infusion pump BodyGuard 323 MR-conditional infusion pump | Caesarea Medical Electronics | 300-040XP | MR-compatible. This model is cleared for use on 1.5 and 3T scanners at 2000 Gauss with castors locked. |
| --Infusion pump tubing | Caesarea Medical Electronics | 100-163X2YNKS | Tubing is administration set with an anti-siphon valve and male luer lock (REF 100-163X2YNKS). |
| --Lead bricks | Custom built | Tested for ferromagnetic translational force | |
| Other Equipment | |||
| --Syringe shields | Biodex, NY USA | Custom-built | There is a 5mL tungsten syringe shield that is MR-safe, as well as a 50mL lead shield that has been tested for ferromagnetic attraction prior to use in the MR-PET scanner. It is used to transport the radioactive dose from the radiochemistry lab into the scanner to minimise radiation exposure to the NMT. |
| --Geiger counter Model 26-1 Integrated Frisker | Ludlum Measurements, Inc. TX USA | 48-4007 | This is calibrated annually and used to monitor potential contamination and waste. It is not taken into the MR-PET scanner. |
参考文献
- Heurling, K., et al. Quantitative positron emission tomography in brain research. Brain Research. 1670, 220-234 (2017).
- Chen, Z., et al. From simultaneous to synergistic MR-PET brain imaging: A review of hybrid MR-PET imaging methodologies. Human Brain Mapping. 39 (12), 5126-5144 (2018).
- Jones, T., Rabiner, E. A. The development, past achievements, and future directions of brain PET. Journal of Cerebral Blood Flow & Metabolism. 32 (7), 1426-1454 (2012).
- Kety, S. S. Metabolism of the nervous system. , Elsevier. 221-237 (1957).
- Sokoloff, L. The metabolism of the central nervous system in vivo. Handbook of Physiology, section I, neurophysiology. 3, 1843-1864 (1960).
- Harris, J. J., Jolivet, R., Attwell, D. Synaptic energy use and supply. Neuron. 75 (5), 762-777 (2012).
- Mosconi, L., et al. FDG-PET changes in brain glucose metabolism from normal cognition to pathologically verified Alzheimer's disease. European Journal of Nuclear Medicine and Molecular Imaging. 36 (5), 811-822 (2009).
- Pagano, G., Niccolini, F., Politis, M. Current status of PET imaging in Huntington's disease. European Journal of Nuclear Medicine and Molecular Imaging. 43 (6), 1171-1182 (2016).
- Petit-Taboue, M., Landeau, B., Desson, J., Desgranges, B., Baron, J. Effects of healthy aging on the regional cerebral metabolic rate of glucose assessed with statistical parametric mapping. Neuroimage. 7 (3), 176-184 (1998).
- Chugani, H. T., Phelps, M. E., Mazziotta, J. C. Positron emission tomography study of human brain functional development. Annals of Neurology. 22 (4), 487-497 (1987).
- Phelps, M. E., Mazziotta, J. C. Positron emission tomography: human brain function and biochemistry. Science. 228 (4701), 799-809 (1985).
- Zimmer, E. R., et al. [18 F] FDG PET signal is driven by astroglial glutamate transport. Nature Neuroscience. 20 (3), 393(2017).
- Roberts, R. P., Hach, S., Tippett, L. J., Addis, D. R. The Simpson's paradox and fMRI: Similarities and differences between functional connectivity measures derived from within-subject and across-subject correlations. Neuroimage. 135, 1-15 (2016).
- Horwitz, B. The elusive concept of brain connectivity. Neuroimage. 19 (2), 466-470 (2003).
- Moses, W. W. Fundamental limits of spatial resolution in PET. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 648, S236-S240 (2011).
- Tomasi, D. G., et al. Dynamic brain glucose metabolism identifies anti-correlated cortical-cerebellar networks at rest. Journal of Cerebral Blood Flow & Metabolism. 37 (12), 3659-3670 (2017).
- Hahn, A., et al. Quantification of task specific glucose metabolism with constant infusion of 18F-FDG. Journal of Nuclear Medicine. 57 (12), 1933-1940 (2016).
- Hahn, A., et al. Task-relevant brain networks identified with simultaneous PET/MR imaging of metabolism and connectivity. Brain Structure and Function. 223 (3), 1369-1378 (2018).
- Jamadar, S. D., et al. Simultaneous task-based BOLD-fMRI and [18-F] FDG functional PET for measurement of neuronal metabolism in the human visual cortex. Neuroimage. 189, 258-266 (2019).
- Rischka, L., et al. Reduced task durations in functional PET imaging with [18F] FDG approaching that of functional MRI. Neuroimage. 181, 323-330 (2018).
- Villien, M., et al. Dynamic functional imaging of brain glucose utilization using fPET-FDG. Neuroimage. 100, 192-199 (2014).
- Carson, R. E. PET physiological measurements using constant infusion. Nuclear Medicine and Biology. 27 (7), 657-660 (2000).
- Carson, R. E., et al. Comparison of bolus and infusion methods for receptor quantitation: application to [18F] cyclofoxy and positron emission tomography. Journal of Cerebral Blood Flow & Metabolism. 13 (1), 24-42 (1993).
- National Health and Medical Research Council. National statement on ethical conduct in human research. , (2007).
- Australian Radiation Protection and Nuclear Safety Agency. Code of practice for the exposure of humans to ionizing radiation for research purposes. , (2005).
- Jenkinson, M., Beckmann, C. F., Behrens, T. E., Woolrich, M. W., Smith, S. M. FSL. Neuroimage. 62 (2), 782-790 (2012).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310(2010).
- Avants, B., Klein, A., Tustison, N., Woo, J., Gee, J. C. 16th Annual Meeting for the Organization of Human Brain Mapping. , (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), e1005350(2017).
- Tustison, N. J., et al. Large-scale evaluation of ANTs and FreeSurfer cortical thickness measurements. Neuroimage. 99, 166-179 (2014).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. Neuroimage. 54 (3), 2033-2044 (2011).
- Burgos, N., et al. Attenuation correction synthesis for hybrid PET-MR scanners: application to brain studies. IEEE Transactions on Medical Imaging. 33 (12), 2332-2341 (2014).
- Panin, V. Y., Kehren, F., Michel, C., Casey, M. Fully 3-D PET reconstruction with system matrix derived from point source measurements. IEEE Transactions on Medical Imaging. 25 (7), 907-921 (2006).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. Neuroimage. 17 (2), 825-841 (2002).
- Bludau, S., et al. Cytoarchitecture, probability maps and functions of the human frontal pole. Neuroimage. 93, 260-275 (2014).
- Amunts, K., Malikovic, A., Mohlberg, H., Schormann, T., Zilles, K. Brodmann's areas 17 and 18 brought into stereotaxic space-where and how variable? Neuroimage. 11 (1), 66-84 (2000).
- Malikovic, A., et al. Cytoarchitectonic analysis of the human extrastriate cortex in the region of V5/MT+: a probabilistic, stereotaxic map of area hOc5. Cerebral Cortex. 17 (3), 562-574 (2006).
- Wilms, M., et al. Human V5/MT+: comparison of functional and cytoarchitectonic data. Anatomy and Embryology. 210 (5-6), 485-495 (2005).
- Eickhoff, S. B., Heim, S., Zilles, K., Amunts, K. Testing anatomically specified hypotheses in functional imaging using cytoarchitectonic maps. Neuroimage. 32 (2), 570-582 (2006).
- Eickhoff, S. B., et al. Assignment of functional activations to probabilistic cytoarchitectonic areas revisited. Neuroimage. 36 (3), 511-521 (2007).
- Eickhoff, S. B., et al. A new SPM toolbox for combining probabilistic cytoarchitectonic maps and functional imaging data. Neuroimage. 25 (4), 1325-1335 (2005).
- Everett, B. A., et al. Safety of radial arterial catheterization in PET research subjects. Journal of Nuclear Medicine. 50 (10), 1742-1742 (2009).
- Takagi, S., et al. Quantitative PET cerebral glucose metabolism estimates using a single non-arterialized venous-blood sample. Annals of Nuclear Medicine. 18 (4), 297-302 (2004).
- Zanotti-Fregonara, P., Chen, K., Liow, J. S., Fujita, M., Innis, R. B. Image-derived input function for brain PET studies: many challenges and few opportunities. Journal of Cerebral Blood Flow & Metabolism. 31 (10), 1986-1998 (2011).
- O'Loughlin, S., Currie, G. M., Trifonovic, M., Kiat, H. Ambient temperature and cardiac accumulation of 18F-FDG. Journal of Nuclear Medicine Technology. 42 (3), 188-193 (2014).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。