Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Radiotracer Administration for High Temporal Resolution Positron Emission Tomography of the Human Brain: Application to FDG-fPET
In diesem Artikel
Zusammenfassung
Dieses Manuskript beschreibt zwei Radiotracer-Verwaltungsprotokolle für FDG-PET (konstante Infusion und Bolus plus Infusion) und vergleicht sie mit der Bolus-Administration. Zeitliche Auflösungen von 16 s sind mit diesen Protokollen erreichbar.
Zusammenfassung
Die funktionelle Positronenemissionstomographie (fPET) bietet eine Methode, um molekulare Ziele im menschlichen Gehirn zu verfolgen. Mit einem radioaktiv markierten Glukoseanalog, 18F-Fluordeoxyglucose (FDG-fPET), ist es nun möglich, die Dynamik des Glukosestoffwechsels mit zeitlichen Auflösungen zu messen, die sich denen der funktionellen Magnetresonanztomographie (fMRI) annähern. Diese direkte Messung der Glukoseaufnahme hat ein enormes Potenzial für das Verständnis normaler und abnormaler Gehirnfunktion und die Untersuchung der Auswirkungen metabolischer und neurodegenerativer Erkrankungen. Darüber hinaus ermöglichen neue Fortschritte bei der hybriden MR-PET-Hardware die gleichzeitige Erfassung von Schwankungen der Glukose- und Blutsauerstoffversorgung mit fMRI und FDG-fPET.
Die zeitliche Auflösung und das Signal-zu-Rauschen der FDG-fPET-Bilder hängen entscheidend von der Verwaltung des Radiotracers ab. Diese Arbeit stellt zwei alternative kontinuierliche Infusionsprotokolle vor und vergleicht sie mit einem traditionellen Bolus-Ansatz. Es stellt eine Methode zum Erwerb von Blutproben, zeitverriegelnden PET, MRT, experimentellen Stimulus, und Die Verabreichung der nicht-traditionellen Tracer-Lieferung. Anhand eines visuellen Stimulus zeigen die Protokollergebnisse kortikale Karten der Glukose-Reaktion auf äußere Reize auf individueller Ebene mit einer zeitlichen Auflösung von 16 s.
Einleitung
Die Positronen-Emissionstomographie (PET) ist eine leistungsstarke molekulare Bildgebungstechnik, die sowohl in klinischen als auch in der Forschung weit verbreitet ist (siehe Heurling et al.1 für eine kürzliche umfassende Überprüfung). Die molekularen Ziele, die mit PET abgebildet werden können, sind nur durch die Verfügbarkeit von Radiotracern begrenzt, und zahlreiche Tracer wurden entwickelt, um neuronale Stoffwechselrezeptoren, Proteine und Enzyme2,3abzubilden. In der Neurowissenschaft ist einer der am häufigsten verwendeten Radiotracer 18F-Fluorodeoxyglucose (FDG-PET), die Glukoseaufnahme misst, die normalerweise als Index des zerebralen Glukosestoffwechsels interpretiert wird. Das menschliche Gehirn benötigt eine konstante und zuverlässige Versorgung mit Glukose, um seinen Energiebedarf zu decken4,5, und 70-80% des zerebralen Glukosestoffwechsels wird von Neuronen während der synaptischenÜbertragung6 verwendet. Veränderungen des zerebralen Glukosestoffwechsels werden gedacht, um zu initiieren und zu zahlreichen Bedingungen beitragen, einschließlich psychiatrische, neurodegenerative, und ischämische Bedingungen7,8,9. Da die FDG-Aufnahme proportional zur synaptischen Aktivität10,11,12ist, wird sie als direkterer und weniger verwirrter Index der neuronalen Aktivität im Vergleich zum weiter verbreiteten Blut Sauerstoffationsniveauabhängige funktionelle Magnetresonanztomographie (BOLD-fMRI). BOLD-fMRI ist ein indirekter Index der neuronalen Aktivität und misst Veränderungen des deoxygenierten Hämoglobins, die nach einer Kaskade neurovaskulärer Veränderungen nach neuronaler Aktivität auftreten.
Die meisten FDG-PET-Studien des menschlichen Gehirns erfassen statische Bilder der zerebralen Glukoseaufnahme. Der Teilnehmer ruht 10 min still mit offenen Augen in einem abgedunkelten Raum. Die volle Radiotracer-Dosis wird als Bolus über einen Zeitraum von Sekunden verabreicht, und der Teilnehmer ruht dann für weitere 30 min. Nach der Aufnahmezeit werden die Teilnehmer in der Mitte des PET-Scanners platziert, und es wird ein PET-Bild erfasst, das die kumulative FDG-Verteilung im Laufe der Aufnahme- und Scanperioden widerspiegelt. Daher stellt die neuronale Aktivität, die durch das PET-Bild indiziert wird, den kumulativen Durchschnitt aller kognitiven Aktivität über Aufnahme- und Scanperioden dar und ist nicht spezifisch für kognitive Aktivitäten während des Scans. Diese Methode hat einen großen Einblick in den zerebralen Stoffwechsel des Gehirns und die neuronale Funktion gegeben. Die zeitliche Auflösung entspricht jedoch der Scandauer (oft 45 min, was effektiv zu einer statischen Messung der Glukoseaufnahme führt; dies ist ungünstig mit der neuronalen Reaktion während kognitiver Prozesse und gemeinsamen Experimenten in Neuroimaging vergleichbar. Aufgrund der begrenzten zeitlichen Auflösung liefert die Methode einen unspezifischen Index der Glukoseaufnahme (d. h. nicht an eine Aufgabe oder einen kognitiven Prozess gebunden) und kann keine Messgrößen innerhalb des Subjekts liefern, die zu fehlerhaften wissenschaftlichen Schlussfolgerungen führen können, die zu Simpsons Paradox13. Simpsons Paradox ist ein Szenario, in dem zwischen den Probanden berechnete Beziehungen zwischen Gehirnverhalten nicht unbedingt auf dieselben Beziehungen hinweisen, die innerhalb der Probanden getestet wurden. Darüber hinaus können die jüngsten Versuche, funktionale Konnektivitätsmaßnahmen auf FDG-PET anzuwenden, nur die konnektivität zwischen den Themen messen. Daher können Unterschiede in der Konnektivität nur zwischen Gruppen verglichen werden und können nicht für einzelne Probanden berechnet werden. Obwohl es fraglich ist, was genau die themenübergreifende Konnektivität14misst, ist es klar, dass Maßnahmen, die über-, aber nicht innerhalb von Subjekten berechnet werden, nicht als Biomarker für Krankheitszustände verwendet werden können oder verwendet werden, um die Quelle individueller Variationen zu untersuchen.
In den letzten fünf Jahren hat die Entwicklung und breitere Zugänglichkeit von gleichzeitigen MRT-PET-Scannern in klinischer Qualität das Forschungsinteresse an FDG-PET-Bildgebung2 in der kognitiven Neurowissenschaft geweckt. Mit diesen Entwicklungen haben sich die Forscher darauf konzentriert, die zeitliche Auflösung von FDG-PET zu verbessern, um sich den Standards von BOLD-fMRI zu nähern (0,5 bis 2,5 s). Beachten Sie, dass die räumliche Auflösung von BOLD-fMRI Submillimeter-Auflösungen erreichen kann, aber die räumliche Auflösung von FDG-PET aufgrund des Positronenbereichs15grundsätzlich auf etwa 0,54 mm volle Breite bei halber Maximalbreite (FWHM) beschränkt ist. Dynamische FDG-PET-Erfassungen, die häufig klinisch verwendet werden, verwenden die Bolus-Verwaltungsmethode und rekonstruieren die Listenmodusdaten in Behältern. Die bolus dynamische FDG-PET-Methode bietet eine zeitliche Auflösung von ca. 100 s (z.B. Tomasi et al.16). Dies ist im Vergleich zur statischen FDG-PET-Bildgebung deutlich besser, aber nicht mit BOLD-fMRI vergleichbar. Zusätzlich ist das Fenster, in dem die Gehirnfunktion untersucht werden kann, begrenzt, da die Blutplasmakonzentration von FDG kurz nach der Verabreichung des Bolus abnimmt.
Um dieses experimentelle Fenster zu erweitern, haben eine Handvoll Studien17,18,19,20,21 die radiotracer Infusionsmethode angepasst, die zuvor von Carson22vorgeschlagenwurde, 23. Bei dieser Methode, die manchmal als "funktionelles FDG-PET" (FDG-fPET, analog zu BOLD-fMRT) beschrieben wird, wird der Radiotracer als konstante Infusion im Laufe des gesamten PET-Scans verabreicht (ca. 90 min). Das Ziel des Infusionsprotokolls ist es, eine konstante Plasmaversorgung mit FDG aufrechtzuerhalten, um dynamische Veränderungen der Glukoseaufnahme über die Zeit hinweg zu verfolgen. In einer Proof-of-Concept-Studie verwendeten Villien et al.21 ein konstantes Infusionsprotokoll und gleichzeitiges MRT/FDG-fPET, um dynamische Veränderungen der Glukoseaufnahme als Reaktion auf die Schachbrettstimulation mit einer zeitlichen Auflösung von 60 s zu zeigen. Nachfolgende Studien haben diese Methode verwendet, um aufgabengebundene FDG-fPET (d. h. zeitgebunden an einen externen Stimulus19) und aufgabenbezogene FDG-fPET (d. h. nicht zeitgebunden an einen externen Stimulus17, 18) Glukoseaufnahme. Mit diesen Methoden wurden FDG-fPET-Zeitauflösungen von 60 s erreicht, was eine wesentliche Verbesserung gegenüber Bolusmethoden darstellt. Vorläufige Daten zeigen, dass die Infusionsmethode zeitliche Auflösungen von 20 bis 60 s19liefern kann.
Trotz der vielversprechenden Ergebnisse der konstanten Infusionsmethode zeigen die Plasmaradioaktivitätskurven dieser Studien, dass die Infusionsmethode nicht ausreicht, um innerhalb des Zeitrahmens eines 90-min-Scans19,21einen stabilen Zustand zu erreichen. Zusätzlich zum konstanten Infusionsverfahren schlug Carson22 auch ein hybrides Bolus/Infusionsverfahren vor, bei dem das Ziel darin besteht, zu Beginn des Scans schnell das Gleichgewicht zu erreichen und dann die Plasmaradioaktivität im Gleichgewicht für die Dauer des Scans. Rischka et al.20 haben diese Technik vor kurzem mit einem 20% Bolus plus 80% Infusion angewendet. Wie erwartet stieg die arterielle Eingabefunktion schnell über die Ausgangswerte und wurde über einen längeren Zeitpunkt mit einer höheren Rate aufrechterhalten, verglichen mit Ergebnissen, die ein reines Infusionsverfahren19,21.
Dieses Papier beschreibt die Erfassungsprotokolle für die Erfassung von FDG-fPET-Scans mit hoher zeitlicher Auflösung unter Verwendung der reinen Infusions- und Bolus-/Infusionsradiotracer-Administration. Diese Protokolle wurden für den Einsatz in einer gleichzeitigen MRT-PET-Umgebung mit einer Erfassungszeit von 90 bis 95 min19entwickelt. Im Protokoll werden Blutproben entnommen, um die Radioaktivität des Plasmaserums für die nachfolgende Quantifizierung von PET-Bildern zu quantifizieren. Während der Schwerpunkt des Protokolls auf der Anwendung von Infusionsmethoden für die funktionelle Neuroimaging mit BOLD-fMRT/FDG-fPET liegt, können diese Methoden auf jede FDG-fPET-Studie angewendet werden, unabhängig davon, ob gleichzeitige MRT, BOLD-f MRT, Computertomographie (CT) oder andere Neuroimages werden erfasst. Abbildung 1 zeigt das Flussdiagramm der Prozeduren in diesem Protokoll.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Dieses Protokoll wurde von der Monash University Human Research Ethics Committee (Zulassungsnummer CF16/1108 - 2016000590) in Übereinstimmung mit der Australian National Statement on Ethical Conduct in Human Research24überprüft und genehmigt. Die Verfahren wurden unter Anleitung eines akkreditierten Medizinphysikers, Nuklearmediziners und klinischen Radiographen entwickelt. Die Forscher sollten sich auf ihre lokalen Experten und Richtlinien für die Verabreichung ionisierender Strahlung beim Menschen beziehen.
1. Erforderliche Ausrüstung und Personal
- Siehe Materialtabelle für den Scannerraum, das Radiochemielabor und allgemeine Materialien. Für den Radiotracer wurde ein kommerzieller Lieferant eingesetzt.
- Verwenden Sie in der gleichzeitigen MRT-PET-Umgebung vier Mitarbeiter: einen Radiologen (RG) für den Scan, einen Nuklearmedizin-Technologen (NMT), der die Verabreichung des Radiotracers und die Entnahme von Blutproben überwacht, einen Laborassistenten (LA) zum Blutspinnen, und ein wissenschaftlicher Mitarbeiter (RA), der für die Bewachung des experimentellen Designs und der Stimulus-Präsentation verantwortlich ist.
2. Vorbereitung
- Tracer-Dosis-Präparat durch das NMT
- Berechnen Sie das Infusionsvolumen, das im Laufe des Scans verabreicht wird. In diesem Protokoll beträgt die Infusionsrate 0,01 ml/s über 95 min. So erhalten die Teilnehmer in einem 95 min Scan 0,01 ml/s x 60 s x 95 min = 57 mL.
- Berechnen Sie die Tracer-Dosis, die in die verabreichte Saline-Lösung verdünnt wird. In diesem Protokoll wird dem Teilnehmer eine Gesamtdosis von 260 MBq über 95 min verabreicht. Diese Dosis wurde gewählt, um die Strahlenexposition auf 4,9 mSv zu begrenzen, um die Kategorisierung des "niedrigen Risikos" gemäß den Richtlinien der Australian Radiation Protection and Nuclear Safety Agency (ARPANSA) für die Exposition von Menschen gegenüber ionisierender Strahlung zu halten25. Zerfallen Sie 260 MBq vom mittleren Infusionspunkt (47,5 min) zurück zu T0. Verwenden von Gleichung 1, lösen sie für A0
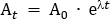
Wenn At die Radioaktivität (MBq) zur Mitte der Infusion ist, ist A0 die anfängliche Radioaktivität, und - ist die radioaktive Zerfallskonstante spezifisch für den Tracer. Für FDG beträgt der Wert von 0,693/T1/2. T1/2 ist die Halbwertszeit von 18F (110 min).
ANMERKUNG: In diesem Beispiel at = 260 MBq, n = 0,693/110 und t = -47,5, also A0 = 350,942 MBq. - Berechnen Sie die erforderliche Radiotracer-Dosis für den 100 ml-Salinebeutel, der zur Verabreichung der Dosis an den Teilnehmer verwendet wird. Der benötigte Radiotracer für den Salinebeutel wird bis zu einem Gesamtvolumen von 5 ml verdünnt und in einer 5 ml Spritze aufbereitet. Daher ist für den 100 ml Kochstoffbeutel der Verdünnungsfaktor das Volumen der Kochsaline (100 ml) zusätzlich zum 5 ml Volumen der Spritze mit Radiotracer. Dieses Gesamtvolumen von 105 ml wird durch das Infusionsvolumen von 57 ml (d. h. 105 ml/57 ml = 1,842) dividiert. Die Gesamtradioaktivität in einem Volumen von 5 ml, die für die Zugabe zum 100 ml-Beutel erforderlich ist, beträgt also A0 x den Verdünnungsfaktor (d. h. 350.942 MBq x 1.842 = 646.44 MBq). Aseptisch den Radiotracer in die Saline-Tasche geben.
HINWEIS: Es ist wichtig zu beachten, dass die berechnete Aktivität von 646.44 MBq, die dem Kochsalinebeutel hinzugefügt wird, die Aktivität ist, die zu Beginn der Infusion erforderlich ist. In der Regel werden die Dosen für dieses Protokoll zwischen 15 min und 1 h vor der Verabreichung vorbereitet. Daher ist es wichtig, den Zerfall des Radioisotops zu berücksichtigen. Gleichung 1 in 2.1.2. kann verwendet werden, um dies zu berücksichtigen, wobei Zeit (t) die Gesamtzahl der Minuten von der Vorbereitung der Dosis bis zu dem Zeitpunkt der Verabreichung der Aktivität ist, At = 646,44 MBq, durch Lösen für A0. - Bereiten Sie die Grundierungsdosis vor. 20 ml aus der Tasche in eine Spritze ziehen und verschließen. Kalibrieren Sie diese 20 ml Spritze und das Etikett. Die Spritze wird als Referenzkontrolle kalibriert, um sicherzustellen, dass sich die Radioaktivität gleichmäßig im Salinebeutel verteilt hat.
- Bereiten Sie die Dosis vor. Mit einer 50 ml Spritze 60 ml aus der Tasche ziehen und mit einem roten Combi-Stopfen kappen. Diese Spritze ist nicht kalibriert, da die Konzentration der Radioaktivität seit dem Zeitpunkt bekannt ist, an dem sie dem Salinebeutel zugesetzt wurde (Schritt 2.1.3). Bewahren Sie beide Spritzen im Radiochemielabor auf, bis sie zum Scannen bereit sind.
HINWEIS: Es ist möglich, ein Volumen von 60 ml in einer 50 ml Spritze zu zeichnen, da Terumo-Spritzen bis 20 % über dem markierten Volumen markiert sind (d. h. eine 50 ml Spritze ist auf 60 ml markiert). - Bereiten Sie die Referenzdosis vor. Füllen Sie einen 500 ml Volumetkolben mit ca. 480 ml destilliertem Wasser. Zeichnen Sie 10 MBq von 18F-FDG in eine Spritze, zerfallen korrigiert auf die Scan-Startzeit (mit Gleichung 1) und fügen Sie sie dem Kolben hinzu. Das Volumen bis zur 500 ml-Marke mit mehr destilliertem Wasser ansetzen und gründlich mischen. Befestigen Sie Etiketten vor und nach der Kalibrierung für die Spritze.
- Scannerraumvorbereitung durch das NMT
- Sobald der Teilnehmer im Scanner positioniert ist, gibt es sehr wenig Raum, um die Linie für Infusionen oder Blutproben zu manipulieren oder zu bergen, wenn eine Blockade auftritt. Bereiten Sie den Scannerraum vor, um die Wahrscheinlichkeit einer Leitungsblockade zu minimieren.
- Stellen Sie sicher, dass sich alle Blutentnahmegeräte in der Nähe der Sammelstelle befinden. Legen Sie Unterpads am Ende der Kanüle und auf jede Oberfläche, die Blutbehälter halten. Legen Sie Behälter für reguläre Abfälle und biogefährliche Abfälle in Reichweite der Blutentnahmestelle.
- Infusionspumpenvorbereitung durch das NMT
- Richten Sie die Infusionspumpe im Scannerraum auf der Seite ein, die mit dem Teilnehmer verbunden wird. Bauen Sie Bleisteine um die Basis der Pumpe und legen Sie die Bleischild vor der Pumpe. Schließen Sie die Schläuche für die Infusionspumpe an, die die Infusion an den Teilnehmer liefert, und stellen Sie sicher, dass die richtige Infusionsrate eingegeben wurde. Für dieses Protokoll beträgt die Rate 0,01 ml/s.
- Primieren Sie die Schläuche, bevor sie mit der Kanüle des Teilnehmers verbunden ist. Schließen Sie die 20 ml Grundierungsdosis an die Infusionspumpe an. Am Ende des Schlauches, der mit dem Teilnehmer verbunden wird, befestigen Sie einen Drei-Wege-Hahn und eine leere 20 ml Spritze. Stellen Sie sicher, dass der Wasserhahn so positioniert ist, dass die 18F-FDG-Lösung von der Grundierungsdosis durch den Schlauch fließen und nur in die leere Spritze gelangen kann.
- Stellen Sie die Infusionspumpe auf ein Volumen von 15 ml vor. Wählen Sie die Prime-Taste auf der Pumpe und folgen Sie den Anweisungen, um die Linie zu grundieren.
- Befestigen Sie die 50 ml Dosierspritze an der Infusionspumpe anstelle der Grundierungsdosis. Die 15 ml grundierte Dosis am Dreiwegehahn kann dort bleiben, bis der Teilnehmer bereit ist, an die Pumpe angeschlossen zu werden.
- Teilnehmervorbereitung durch NMT, RA und RG
- Raten Sie den Teilnehmern, vor dem Scan 6 h zu fasten und nur Wasser (ca. zwei Gläser) zu verbrauchen.
- Lassen Sie die RA die Zustimmungsverfahren durchführen und zusätzliche Maßnahmen (z. B. demografische Erhebungen, kognitive Batterien usw.) erwerben. Lassen Sie die NMT und RG die Sicherheitsbildschirme durchführen, die NMT überprüfen Sie die Sicherheit für PET-Scans (z. B. Ausschluss bei Schwangerschaft, Diabetes, Chemotherapie oder Strahlentherapie in den letzten 8 Wochen und bekannte Allergien) und die RG überprüfen Teilnehmersicherheit für MRT-Scanning (z. B. Ausschluss für Schwangerschaft, medizinische oder nichtmedizinische metallische Implantate, nicht abnehmbare Zahnimplantate, Klaustrophobie).
- Kanülieren Sie den Teilnehmer.
- Verwenden Sie zwei Kanülen: eine für die Dosisverabreichung und die andere für die Blutentnahme. Die am besten geeignete Kanüle variiert je nach Teilnehmer, aber die am besten geeignete Vene sollte für die Blutentnahme reserviert werden. Eine 22 G Kanüle ist die bevorzugte Mindestgröße. Sammeln Sie eine 10 ml Ausgangsblutprobe während der Konservenkonserven. Trennen Sie alle Kochisespülungen unter Druck, um die Durchgängigkeit der Leitung aufrechtzuerhalten.
- Testen Sie den Blutzuckerspiegel des Teilnehmers und andere Ausgangswerte im Blut (z. B. Hämoglobin) aus der Ausgangsprobe.
- Teilnehmerpositionierung im Scanner durch RG und NMT
- Lassen Sie die RG-Position den Teilnehmer in der Scannerbohrung positionieren. Bei langen Scans ist es unerlässlich, Komfort zu gewährleisten, um das Risiko des Abbruchs des Teilnehmers und des Bewegungsartefakts aufgrund von Beschwerden zu reduzieren. Der Teilnehmer sollte mit einer Einwegdecke bedeckt sein, um eine angenehme Körpertemperatur zu halten.
- Lassen Sie die NMT die Kanüle spülen, um sicherzustellen, dass sie patentiert ist und minimal widerstanden ist, bevor Sie die Infusionsleitung anschließen. Einmal verbunden, kann der Schlauch leicht in der Nähe des Handgelenks verklebt werden. Weisen Sie den Teilnehmer an, den Arm geglättet zu halten. Verwenden Sie Stützen wie Schaumstoff oder Kissen für Komfort. Lassen Sie die NMT auch die Kanüle überprüfen, die für Plasmaproben verwendet wird, um sicherzustellen, dass sie in der Lage ist, Blut mit minimalem Widerstand abzuziehen. Es kann notwendig sein, ein Verlängerungsrohr mit normaler Saline zu verbinden, um die Kanüle zugänglicher zu machen, während sich der Teilnehmer im Scanner befindet. Wenn dies erforderlich ist, sollte es auf Leckagen überprüft werden.
- Sobald sich das Motiv in der Scannerbohrung befindet, lassen Sie die NMT überprüfen, ob sie einen geeigneten Zugang zu beiden Kanülen haben.
- Lassen Sie die NMT die RG und RA benachrichtigen, wenn es Probleme mit der Blutentnahmekanüle, Infusionskanüle oder der Infusionspumpe (z. B. Okklusion, Batterie, Extravasation) gibt.
3. Scannen Sie den Teilnehmer
- Starten des Scans mit NMT, RG und RA
- Zu Beginn des Scans stellen Sie das NMT im Scannerraum ein, um die Infusionsgeräte zu überwachen. Stellen Sie sicher, dass das NMT Einen Gehörschutz trägt und den Abschirmung verwendet, um die Strahlenbelastung durch die Dosis nach Möglichkeit zu minimieren.
- Wenn die RG den Lokalisierer-Scan durchführt, um sicherzustellen, dass sich der Teilnehmer in der richtigen Position befindet, überprüfen Sie die Details für die PET-Erfassung (z. B. Scandauer, Listenmodus-Datenerfassung, richtiges Isotop).
- Entwerfen Sie das Protokoll so, dass die PET-Erfassung mit der ersten MRT-Sequenz beginnt. Die RG bereitet die MRT-Sequenz vor und startet sie. Die Startzeit der 95 min PET-Erfassung ist zeitgesperrt bis zum Beginn der MRT-Sequenz. Bei Bedarf sollte die NMT den Bolus zum Zeitpunkt der PET-Erfassung liefern (Abbildung 1).
- Starten Sie die Infusionspumpe. Die RG sollte dem NMT (z.B. über ein Daumen-up-Zeichen) signalisieren, dass die Pumpe 30 s nach dem Start der PET-Erfassung gestartet wird. Dieses Protokoll startet die Infusionspumpe 30 s nach der Scanstartzeit, um einen Sicherheitspuffer im Falle eines Scanfehlers bereitzustellen. Dadurch wird auch sichergestellt, dass das erste Während des PET-Scans aufgenommene Bild das Gehirn vor der Radiotracer-Administration für die vollständige Datenerfassung der Zeitaktivitätskurve indiziert. Lassen Sie die NMT die Pumpe beobachten, um sicherzustellen, dass sie begonnen hat, die 18F-FDG zu infundieren, und dass es keine sofortige Okklusion der Leitung gibt.
- Lassen Sie die RA zum vereinbarten Zeitpunkt (d.h. zu Beginn eines funktionellen Laufs/Experimentellen Blocks) externe Impulse initiieren und die Zeiten für Blutproben berechnen. Ein Beispieldatensatzformular wird in Beilage 1angezeigt. Lassen Sie die RA die vorhergesagte Zeit jeder Blutprobe berechnen und Kopien an den NMT und den Laborassistenten (LA) liefern. Lassen Sie die RA sicherstellen, dass die NMT die Blutproben ungefähr zur richtigen Zeit nimmt, und überwacht Geräte (z. B. Infusionspumpe, Stimulus) auf Fehlerspuren.
- Entnahme von Blutproben in regelmäßigen Zeitabständen
- Lassen Sie die NMT und RA alle 10 min eine Probe nehmen. In der Regel gibt es insgesamt 10 Stichproben, ohne die Basisstichprobe.
- Wenn Sie MRT-Scans gleichzeitig mit PET-Scans erfassen, lassen Sie den NMT beim Betreten des Scannerraums einen Gehörschutz tragen.
- Lassen Sie die NMT Handschuhe tragen und die Spitze der Kanüle sauber wischen. Während die Kanülenstelle trocknet, öffnen Sie eine 5 ml und eine 10 ml Spritze, vacutainer und eine 10 ml Salinespülung.
- Mit der 5 ml Spritze 4-5 ml frisches Blut abziehen und die Spritze im Bioabfall entsorgen.
- Mit der 10 ml Spritze bis zu 10 ml Blut abziehen. Das Volumen kann dadurch begrenzt werden, wie leicht das Blut entnommen werden kann. Es ist wichtig, jeden Widerstand zu minimieren, der später Schäden an den roten Blutkörperchen verursacht, die hämolysieren können. Am Midcollection-Punkt, haben Sie das NMT-Signal an die RA, die dieses Mal auf dem Datensatzformular (Ergänzung 1) als die "tatsächliche" Zeit der Probe markieren wird.
- Schließen Sie die 10 ml Spritze an den Vacutainer an und legen Sie das Blut dann in das entsprechende Blutröhrchen ab.
- Spülen Sie die Kanüle schnell mit 10 ml Kochnische, unter Druck getrennt, um jede Chance auf Leitungsgerinnung zu minimieren.
- Nehmen Sie die Blutprobe sofort zur Analyse ins Radiochemielabor.
- Spinnen des Blutes durch die LA
- Lassen Sie die LA alle Geräte bereit (Tabelle 1) und handschuhe tragen. Lassen Sie drei Regale für die Proben aufstellen: eine für Blutröhren, eine für das Pipettieren der Probe und eine für gefüllte Pipettenproben (Vor- und Nachzählung).
- Lassen Sie die LA während des gesamten Verfahrens regelmäßig die Handschuhe wechseln, insbesondere beim Umgang mit dem Zählrohr. Wenn die LA eine radioaktive Plasmakontamination an ihren Handschuhen hat, kann sie auf das Zählrohr übertragen werden und die Anzahl der aufgezeichneten Zählungen der Probe aufs präglyse erhöhen.
- Die Blutprobe kann in die Zentrifuge gelegt werden, da die Verfügbarkeit von Personalressourcen es zulässt, da die Zeit, zu der die Blutprobe entnommen wurde, und die Zeit, zu der sie gezählt wurde, zur Kenntnis genommen wurde. Drehen Sie alle Proben mit einer relativen Fliehkraft von 724 x g. Die für dieses Protokoll verwendeten Zentrifugeneinstellungen sind 2.000 U/min für 5 min, wobei die Beschleunigungs- und Verzögerungskurven auf acht eingestellt sind.
- Sobald die Probe gesponnen wurde, legen Sie das Rohr in das Pipettiergestell. Entfernen Sie die Rohrkappe, um die Probentrennung nicht zu stören. Legen Sie ein beschriftetes Zählrohr in das Rack. Das Etikett sollte dem Blutröhrchen entsprechen.
- Stellen Sie sicher, dass die Spitze sicher an der Pipette befestigt ist. Haben Sie ein Gewebe bereit für alle Tropfen. Stetige Pipette 1.000 l Plasma aus dem Blutröhre, Übertragung in das Zählrohr, und ersetzen Sie die Deckel auf der Zählröhre und Blutröhre.
- Legen Sie das Zählrohr in den Brunnenzähler und zählen Sie 4 min. Zeichnen Sie die Zählstartzeit auf dem Datensatzblatt ("Messzeit") für jede Probe auf. Dies ist für nachfolgende Korrekturen der PET-Erfassungsstartzeit erforderlich. Lassen Sie zu späteren Zeitpunkten während des Scans die LA jeden Schritt in schneller Folge ausführen, um einen Rückstand von Proben zu vermeiden.
- Entsorgen Sie alle Blutproduktabfälle in Biohazard-Beuteln.
- Lassen Sie die LA alle Geräte bereit (Tabelle 1) und handschuhe tragen. Lassen Sie drei Regale für die Proben aufstellen: eine für Blutröhren, eine für das Pipettieren der Probe und eine für gefüllte Pipettenproben (Vor- und Nachzählung).
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Studienspezifische Methoden
Hier werden studienspezifische Details zu den repräsentativen Ergebnissen berichtet. Diese Details sind für das Verfahren nicht entscheidend und variieren von Studien zu Studien.
Teilnehmer und Aufgabengestaltung
Die Teilnehmer (n = 3, Tabelle 2) wurden einer gleichzeitigen BOLD-fMRT/FDG-fPET-Studie unterzogen. Da sich dieses...
Access restricted. Please log in or start a trial to view this content.
Diskussion
FDG-PET ist eine leistungsstarke Bildgebungstechnologie, die die Glukoseaufnahme misst, ein Index des zerebralen Glukosestoffwechsels. Bis heute verwenden die meisten neurowissenschaftlichen Studien mit FDG-PET einen traditionellen Bolus-Verwaltungsansatz mit einer statischen Bildauflösung, die das Integral aller metabolischen Aktivität im Verlauf des Scans2darstellt. Dieses Manuskript beschreibt zwei alternative Radiotracer-Verwaltungsprotokolle: die nur infusionsbasierten Protokolle (z.B. Vill...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären keinen Interessenkonflikt. Die Finanzierungsquelle war nicht an der Studiengestaltung, Sammlung, Analyse und Interpretation von Daten beteiligt.
Danksagungen
Jamadar wird vom Australian Council for Research (ARC) Discovery Early Career Researcher Award (DECRA DE150100406) unterstützt. Jamadar, Ward und Egan werden vom ARC Centre of Excellence for Integrative Brain Function (CE114100007) unterstützt. Chen und Li werden von der Reignwood Cultural Foundation unterstützt.
Jamadar, Ward, Carey und McIntyre entwarfen das Protokoll. Carey, McIntyre, Sasan und Fallon sammelten die Daten. Jamadar, Ward, Parkes und Sasan analysierten die Daten. Jamadar, Ward, Carey und McIntyre schrieben den ersten Entwurf des Manuskripts. Alle Autoren haben die endgültige Fassung überprüft und genehmigt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Blood Collection Equipment | |||
| --12-15 vacutainers | Becton Dickinson, NJ USA | 364880 | Remain in sterile packaging until required to put blood in tube |
| --12-15 10mL LH blood collecting tubes | Becton Dickinson | 367526 | Marked with the sample number (e.g., S1, S2…) and subsequently marked with the sample time (e.g., time 0 + x min [T0+x]) |
| --2-15 10mL Terumo syringe | Terumo Tokyo, Japan | SS+10L | These are drawn up on the day of the study and capped with the ampoule that contained the saline |
| -- pre-drawn 0.9% saline flushes | Pfizer, NY, USA | 61039117 | |
| --12-15 5mL Terumo syringes | Terumo Tokyo, Japan | SS+05S | Remain in sterile packaging until ready to withdraw a blood sample |
| Safety & Waste Equipment | All objects arranged on a plastic chair inside the scanner room on the same side as the arm from which the blood samples will be taken. Biohazard and non-biohazard waste bags to be used. Gloves and waste bags to be easily accessible when preparing the radioactivity in the dispensing area and when pipetting the plasma samples. Biohazard and non-biohazard waste bags to be used. All waste generated is checked with the Geiger counter to ensure that radioactive contaminated waste is stored until it is safe to be disposed of according to Australian Radiation Protection and Nuclear Safety Agency (APRANSA) guidelines for Radiation protection series No.6 (2017). | ||
| -- Gloves | Westlab, VIC, Australia | 663-219 | |
| -- waste bags | Austar Packaging, VIC, Australia | YIW6090 | |
| --cello underpads ‘blueys’ Underpads 5 Ply | Halyard Health, NSW, Australia | 2765A | |
| --Blue Sharpie pen | Sharpie, TN, USA | S30063 | |
| Dose Syringes | Remain in sterile packaging until ready for use. All syringes used in this facility have an additional 20% volume capacity above the stated volume on the packaging. This is important for the 50mL syringe where the total capacity of 60mL is used | ||
| --5mL | Terumo Tokyo, Japan | SS+05S | |
| -- 20mL | Terumo Tokyo, Japan | SS+20L | |
| --50mL | Terumo Tokyo, Japan | SS*50LE | |
| --1 Terumo 18-gauge needle | Terumo Tokyo, Japan | NN+1838R | Remain in sterile packaging until ready to inject [18F]FDG into the saline bag |
| --100mL 0.9% saline bag | Baxter Pharmaceutical, IL, USA | AHB1307 | Remain in sterile packaging until ready to inject [18F]FDG |
| Radiochemistry Lab Supplies | |||
| --Heraeus Megafuge 16 centrifuge; Rotor Bioshield 720 | ThermoScientific MA, USA | 75004230 | Relative Centrifugal Force = 724 Our settings are 2000RPM for 5mins. Acceleration and deceleration curves set to 8 |
| --Single well counter | Laboratory Technologies, Inc. IL, USA | 630-365-1000 | Complete daily quality control (includes background count) and protocol set to 18F and 4mins. Cross calibration is performed between the well counter, dose calibrator and scanner on a bi-monthly basis. |
| --Pipette | ISG Xacto, Vienna, Austria | LI10434 | We use a 100-1000 μL set to 1000μL. It is calibrated annually. |
| --12-15 plasma counting tubes | Techno PLAS; SA Australia | P10316SU | Marked in the same manner as the LH blood tubes |
| --12-15 pipette tips | Expell Capp, Denmark | 5130140-1 | |
| --3 test tube racks | Generic | Checked with a Geiger counter to ensure there is no radiation contamination on them | |
| --500mL volumetric flask and distilled water | Generic | Need approximately 500mL of distilled water to prepare the reference for gamma counting | |
| --Synchronised clocks in scanner room, console and radiochemistry lab | Generic | Synchronisation checks are routinely completed in the facility on a weekly basis | |
| --Haemoglobin Monitor | EKF Diagnostic Cardiff, UK Haemo Control. | 3000-0810-6801 | Manufacturer recommended quality control performed before testing on participant’s blood sample. |
| --Glucometre | Roche Accu-Chek | 6870252001 | Accu-Chek Performa is used to measure participant blood sugar levels in mmol/L. Quality control is performed daily using high and low concentration solution control test. |
| Cannulating Equipment | Check expiry dates and train NMT to prepare aseptically for cannulation. | ||
| --Regulation tourniquet | CBC Classic Kimetec GmBH | K5020 | |
| --20, 22 and 24 gauge cannulas | Braun, Melsungen Germany | 4251644-03; 4251628-03; 4251601-03 | |
| --tegaderm dressings | 3M, MN USA | 1624W | |
| --alcohol and chlorhexidine swabs | Reynard Health Supplies, NSW Australia | RHS408 | |
| --0.9% saline 10mL ampoules; for flushes | Pfizer, NY, USA | 61039117 | |
| --10mL syringes | Terumo Tokyo, Japan | SS+10L | |
| --3-way tap | Becton Dickinson Connecta | 394600 | |
| --IV bung | Safsite Braun PA USA | 415068 | |
| --Optional extension tube, microbore extension set | M Devices, Denmark | IV054000 | |
| Scanner Room Equipment | |||
| --Siemens Biograph 3T mMR | Siemens, Erlangen, Germany | ||
| --Portable lead barrier shield | Gammasonics | Custom-built | MR-conditional lead barrier shield. Positioned at the 2000 Gauss line with the castors locked to provide additional shielding of the radioactivity connected to the infusion pump. |
| --Infusion pump BodyGuard 323 MR-conditional infusion pump | Caesarea Medical Electronics | 300-040XP | MR-compatible. This model is cleared for use on 1.5 and 3T scanners at 2000 Gauss with castors locked. |
| --Infusion pump tubing | Caesarea Medical Electronics | 100-163X2YNKS | Tubing is administration set with an anti-siphon valve and male luer lock (REF 100-163X2YNKS). |
| --Lead bricks | Custom built | Tested for ferromagnetic translational force | |
| Other Equipment | |||
| --Syringe shields | Biodex, NY USA | Custom-built | There is a 5mL tungsten syringe shield that is MR-safe, as well as a 50mL lead shield that has been tested for ferromagnetic attraction prior to use in the MR-PET scanner. It is used to transport the radioactive dose from the radiochemistry lab into the scanner to minimise radiation exposure to the NMT. |
| --Geiger counter Model 26-1 Integrated Frisker | Ludlum Measurements, Inc. TX USA | 48-4007 | This is calibrated annually and used to monitor potential contamination and waste. It is not taken into the MR-PET scanner. |
Referenzen
- Heurling, K., et al. Quantitative positron emission tomography in brain research. Brain Research. 1670, 220-234 (2017).
- Chen, Z., et al. From simultaneous to synergistic MR-PET brain imaging: A review of hybrid MR-PET imaging methodologies. Human Brain Mapping. 39 (12), 5126-5144 (2018).
- Jones, T., Rabiner, E. A. The development, past achievements, and future directions of brain PET. Journal of Cerebral Blood Flow & Metabolism. 32 (7), 1426-1454 (2012).
- Kety, S. S. Metabolism of the nervous system. , Elsevier. 221-237 (1957).
- Sokoloff, L. The metabolism of the central nervous system in vivo. Handbook of Physiology, section I, neurophysiology. 3, 1843-1864 (1960).
- Harris, J. J., Jolivet, R., Attwell, D. Synaptic energy use and supply. Neuron. 75 (5), 762-777 (2012).
- Mosconi, L., et al. FDG-PET changes in brain glucose metabolism from normal cognition to pathologically verified Alzheimer's disease. European Journal of Nuclear Medicine and Molecular Imaging. 36 (5), 811-822 (2009).
- Pagano, G., Niccolini, F., Politis, M. Current status of PET imaging in Huntington's disease. European Journal of Nuclear Medicine and Molecular Imaging. 43 (6), 1171-1182 (2016).
- Petit-Taboue, M., Landeau, B., Desson, J., Desgranges, B., Baron, J. Effects of healthy aging on the regional cerebral metabolic rate of glucose assessed with statistical parametric mapping. Neuroimage. 7 (3), 176-184 (1998).
- Chugani, H. T., Phelps, M. E., Mazziotta, J. C. Positron emission tomography study of human brain functional development. Annals of Neurology. 22 (4), 487-497 (1987).
- Phelps, M. E., Mazziotta, J. C. Positron emission tomography: human brain function and biochemistry. Science. 228 (4701), 799-809 (1985).
- Zimmer, E. R., et al. [18 F] FDG PET signal is driven by astroglial glutamate transport. Nature Neuroscience. 20 (3), 393(2017).
- Roberts, R. P., Hach, S., Tippett, L. J., Addis, D. R. The Simpson's paradox and fMRI: Similarities and differences between functional connectivity measures derived from within-subject and across-subject correlations. Neuroimage. 135, 1-15 (2016).
- Horwitz, B. The elusive concept of brain connectivity. Neuroimage. 19 (2), 466-470 (2003).
- Moses, W. W. Fundamental limits of spatial resolution in PET. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 648, S236-S240 (2011).
- Tomasi, D. G., et al. Dynamic brain glucose metabolism identifies anti-correlated cortical-cerebellar networks at rest. Journal of Cerebral Blood Flow & Metabolism. 37 (12), 3659-3670 (2017).
- Hahn, A., et al. Quantification of task specific glucose metabolism with constant infusion of 18F-FDG. Journal of Nuclear Medicine. 57 (12), 1933-1940 (2016).
- Hahn, A., et al. Task-relevant brain networks identified with simultaneous PET/MR imaging of metabolism and connectivity. Brain Structure and Function. 223 (3), 1369-1378 (2018).
- Jamadar, S. D., et al. Simultaneous task-based BOLD-fMRI and [18-F] FDG functional PET for measurement of neuronal metabolism in the human visual cortex. Neuroimage. 189, 258-266 (2019).
- Rischka, L., et al. Reduced task durations in functional PET imaging with [18F] FDG approaching that of functional MRI. Neuroimage. 181, 323-330 (2018).
- Villien, M., et al. Dynamic functional imaging of brain glucose utilization using fPET-FDG. Neuroimage. 100, 192-199 (2014).
- Carson, R. E. PET physiological measurements using constant infusion. Nuclear Medicine and Biology. 27 (7), 657-660 (2000).
- Carson, R. E., et al. Comparison of bolus and infusion methods for receptor quantitation: application to [18F] cyclofoxy and positron emission tomography. Journal of Cerebral Blood Flow & Metabolism. 13 (1), 24-42 (1993).
- National Health and Medical Research Council. National statement on ethical conduct in human research. , (2007).
- Australian Radiation Protection and Nuclear Safety Agency. Code of practice for the exposure of humans to ionizing radiation for research purposes. , (2005).
- Jenkinson, M., Beckmann, C. F., Behrens, T. E., Woolrich, M. W., Smith, S. M. FSL. Neuroimage. 62 (2), 782-790 (2012).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310(2010).
- Avants, B., Klein, A., Tustison, N., Woo, J., Gee, J. C. 16th Annual Meeting for the Organization of Human Brain Mapping. , (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), e1005350(2017).
- Tustison, N. J., et al. Large-scale evaluation of ANTs and FreeSurfer cortical thickness measurements. Neuroimage. 99, 166-179 (2014).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. Neuroimage. 54 (3), 2033-2044 (2011).
- Burgos, N., et al. Attenuation correction synthesis for hybrid PET-MR scanners: application to brain studies. IEEE Transactions on Medical Imaging. 33 (12), 2332-2341 (2014).
- Panin, V. Y., Kehren, F., Michel, C., Casey, M. Fully 3-D PET reconstruction with system matrix derived from point source measurements. IEEE Transactions on Medical Imaging. 25 (7), 907-921 (2006).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. Neuroimage. 17 (2), 825-841 (2002).
- Bludau, S., et al. Cytoarchitecture, probability maps and functions of the human frontal pole. Neuroimage. 93, 260-275 (2014).
- Amunts, K., Malikovic, A., Mohlberg, H., Schormann, T., Zilles, K. Brodmann's areas 17 and 18 brought into stereotaxic space-where and how variable? Neuroimage. 11 (1), 66-84 (2000).
- Malikovic, A., et al. Cytoarchitectonic analysis of the human extrastriate cortex in the region of V5/MT+: a probabilistic, stereotaxic map of area hOc5. Cerebral Cortex. 17 (3), 562-574 (2006).
- Wilms, M., et al. Human V5/MT+: comparison of functional and cytoarchitectonic data. Anatomy and Embryology. 210 (5-6), 485-495 (2005).
- Eickhoff, S. B., Heim, S., Zilles, K., Amunts, K. Testing anatomically specified hypotheses in functional imaging using cytoarchitectonic maps. Neuroimage. 32 (2), 570-582 (2006).
- Eickhoff, S. B., et al. Assignment of functional activations to probabilistic cytoarchitectonic areas revisited. Neuroimage. 36 (3), 511-521 (2007).
- Eickhoff, S. B., et al. A new SPM toolbox for combining probabilistic cytoarchitectonic maps and functional imaging data. Neuroimage. 25 (4), 1325-1335 (2005).
- Everett, B. A., et al. Safety of radial arterial catheterization in PET research subjects. Journal of Nuclear Medicine. 50 (10), 1742-1742 (2009).
- Takagi, S., et al. Quantitative PET cerebral glucose metabolism estimates using a single non-arterialized venous-blood sample. Annals of Nuclear Medicine. 18 (4), 297-302 (2004).
- Zanotti-Fregonara, P., Chen, K., Liow, J. S., Fujita, M., Innis, R. B. Image-derived input function for brain PET studies: many challenges and few opportunities. Journal of Cerebral Blood Flow & Metabolism. 31 (10), 1986-1998 (2011).
- O'Loughlin, S., Currie, G. M., Trifonovic, M., Kiat, H. Ambient temperature and cardiac accumulation of 18F-FDG. Journal of Nuclear Medicine Technology. 42 (3), 188-193 (2014).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten