É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Administração do radiotracer para a tomografia de emissão de positrão de alta resolução temporal do cérebro humano: aplicação para FDG-fPET
Neste Artigo
Resumo
Este manuscrito descreve dois protocolos de administração do radiotraçador para FDG-PET (infusão constante e bolus mais a infusão) e compara-os à administração do bolus. As resoluções temporais de 16 s são realizáveis usando estes protocolos.
Resumo
O tomography funcional da emissão de positrão (fpet) fornece um método para seguir alvos moleculars no cérebro humano. Com um análogo de glicose radioativamente rotulado, 18F-Fluordesoxiglicose (FDG-fpet), agora é possível medir a dinâmica do metabolismo da glicose com resoluções temporais abordando aqueles de ressonância magnética funcional (fMRI). Esta medida direta da captação da glicose tem o potencial enorme para compreender a função cerebral normal e anormal e a sondagem dos efeitos de doenças metabólicas e neurodegenerativas. Além disso, novos avanços no hardware híbrido MR-PET tornam possível capturar flutuações na glicose e oxigenação sanguínea simultaneamente usando fMRI e FDG-fPET.
A resolução temporal e o sinal-ruído das imagens FDG-fPET dependem criticamente da administração do radiotraçador. Este trabalho apresenta dois protocolos alternativos da infusão contínua e compara-os a uma aproximação tradicional do bolus. Apresenta um método para a aquisição de amostras de sangue, PET de bloqueio de tempo, ressonância magnética, estímulo experimental e administração da entrega de traçador não tradicional. Usando um estímulo visual, os resultados do protocolo mostram mapas corticais da glicose-resposta aos estímulos externos em um nível individual com uma definição temporal de 16 s.
Introdução
O tomography de emissão de Positron (animal de estimação) é uma técnica molecular poderosa da imagem latente que seja amplamente utilizada em ajustes clínicos e da pesquisa (veja Heurling et al.1 para uma revisão detalhada recente). Os alvos moleculares que podem ser imaged usando o animal de estimação são limitados somente pela disponibilidade dos radiotracers, e os traçadores numerosos foram desenvolvidos aosreceptores, àsproteínas, e às enzimas do metabolismo neural da imagem2,3. Na neurociência, um dos radiofármacos mais utilizados é 18F-fluorodeoxyglucose (FDG-PET), que mede a captação de glicose, geralmente interpretada como um índice de metabolismo da glicose cerebral. O cérebro humano exige uma fonte constante e de confiança da glicose para satisfazer suas exigências de energia4,5, e 70-80% do metabolismo cerebral da glicose é usado por neurônios durante a transmissão sináptica6. As alterações no metabolismo da glicose cerebral são pensados para iniciar e contribuir para inúmeras condições, incluindo doenças psiquiátricas, neurodegenerativas eisquêmicas7,8,9. Além disso, como a captação de FDG é proporcional à atividade sináptica10,11,12, éconsiderado um índice mais direto e menos confundido da atividade neuronal em comparação com o sangue mais amplamente utilizado resposta de ressonância magnética funcional dependente do nível de oxigenação (BOLD-fMRI). BOLD-fMRI é um índice indireto da atividade neural e mede mudanças na hemoglobina deoxigenada que ocorrem depois de uma cascata de mudanças neurovasculares que seguem a atividade neuronal.
A maioria de estudos de FDG-PET do cérebro humano adquirem imagens estáticas da tomada cerebral da glicose. O participante descansa calmamente por 10 min com os olhos abertos em um quarto escurecido. A dose completa do radiotraçador é administrada como um bolus durante um período de segundos, e o participante descansa então por uns 30 minutos mais adicionais. Após o período de captação, os participantes são colocados no centro do scanner PET e uma imagem PET que reflete a distribuição cumulativa da FDG ao longo dos períodos de captação e digitalização é adquirida. Assim, a atividade neuronal indexada pela imagem PET representa a média cumulativa de toda atividade cognitiva sobre os períodos de captação e varredura e não é específica para a atividade cognitiva durante o exame. Este método forneceu a grande introspecção no metabolismo cerebral do cérebro e da função neuronal. No entanto, a resolução temporal é igual à duração da digitalização (muitas vezes ~ 45 min, produzindo efetivamente uma medição estática da captação de glicose; isso compara de forma desfavorável à resposta neuronal durante os processos cognitivos e experimentos comuns em neuroimagem. Devido à limitada resolução temporal, o método fornece um índice não específico de captação de glicose (ou seja, não bloqueado para uma tarefa ou processo cognitivo) e não pode fornecer medidas de variabilidade dentro do assunto, o que pode levar a conclusões científicas erradas devido ao paradoxo13de Simpson. O paradoxo de Simpson é um cenário, onde as relações cérebro-comportamento calculadas entre os sujeitos não são necessariamente indicativas das mesmas relações testadas dentro dos assuntos. Além disso, as tentativas recentes de aplicar medidas de conectividade funcionais ao FDG-PET só podem medir a conectividade entre assuntos. Assim, as diferenças na conectividade só podem ser comparadas entre os grupos e não podem ser calculadas para indivíduos individuais. Embora seja discutível o que exatamente as medidas de conectividade em todo o assunto14, é claro que as medidas calculadas em toda-mas não dentro de sujeitos não podem ser usados como um biomarcador para Estados de doença ou utilizados para examinar a fonte de variação individual.
Nos últimos cinco anos, o desenvolvimento e a acessibilidade mais larga de varredores simultâneos da clínico-classe MRI-PET despertou o interesse renovado da pesquisa na imagem latente2 de FDG-PET na neurociência cognitiva. Com esses desenvolvimentos, os pesquisadores se concentraram em melhorar a resolução temporal de FDG-PET para abordar os padrões de BOLD-fMRI (~ 0.5 − 2.5 s). Note-se que a resolução espacial de Bold-fMRI pode abordar resoluções submilimétricas, mas a resolução espacial de FDG-PET é fundamentalmente limitada a cerca de 0,54 mm de largura total ao meio máximo (FWHM) devido à faixa de positrão15. As aquisições dinâmicas de FDG-PET, que são frequentemente usadas clinicamente, usam o método de administração do bolus e reconstroem os dados do modo de lista em compartimentos. O método dinâmico do bolus FDG-PET oferece uma resolução temporal de cerca de 100 s (por exemplo, Tomasi et al.16). Isto é claramente muito melhor comparado à imagem latente estática de FDG-PET mas não é comparável a BOLD-fMRI. Adicionalmente, a janela em que a função do cérebro pode ser examinada é limitada, porque a concentração do plasma do sangue de FDG diminui logo depois que o bolus é administrado.
Para ampliar esta janela experimental, um punhado de estudos17,18,19,20,21 adaptaram o método de infusão radiotraçador proposto anteriormente por Carson22, a 23. Neste método, às vezes descrito como ' funcional FDG-PET ' (FDG-fPET, análoga a Bold-fMRI), o radiotraçador é administrado como uma infusão constante ao longo de toda a varredura PET (~ 90 min). O objetivo do protocolo de infusão é manter um suprimento de plasma constante de FDG para rastrear mudanças dinâmicas na captação de glicose ao longo do tempo. Em um estudo de prova de conceito, Villien et al.21 utilizaram um protocolo de infusão constante e um PET simultâneo de RM/FDG-fpara mostrar mudanças dinâmicas na captação de glicose em resposta à estimulação do tabuleiro de xadrez com uma resolução temporal de 60 s. Os estudos subseqüentes usaram este método para mostrar o animal de estimação tarefa-Locked de FDG-f(isto é, tempo-travado a um estímulo externo19) e o animal de estimação tarefa-relacionado de FDG-f(isto é, não tempo-travado a um estímulo externo17, 18) captação da glicose. Usando estes métodos, as resoluções temporais do animal de estimação de FDG-fde 60 s foram obtidas, que é uma melhoria substancial sobre métodos do bolus. Os dados preliminares mostram que o método da infusão pode fornecer resoluções temporais de 20 − 60 s19.
Apesar dos resultados promissores do método de infusão constante, as curvas de radioatividade plasmática desses estudos mostram que o método de infusão não é suficiente para atingir um estado estacionário dentro do prazo de uma varredura de 90 min19,21. Além do procedimento de infusão constante, Carson22 também propôs um procedimento híbrido de bolus/infusão, onde o objetivo é alcançar rapidamente o equilíbrio no início da varredura e, em seguida, sustentar os níveis de radioatividade plasmática em equilíbrio para o duração da digitalização. Rischka et al.20 aplicaram recentemente esta técnica usando um bolus de 20% mais 80% de infusão. Como esperado, a função de entrada arterial subiu rapidamente acima dos níveis basais e foi sustentada a uma taxa maior por um tempo mais longo, comparado aos resultados usando um procedimento somente para infusão19,21.
Este artigo descreve os protocolos de aquisição para a obtenção de exames de PET de alta resolução temporal FDG-fusando a administração de radiotraçador de infusão e bolus/infusão. Estes protocolos foram desenvolvidos para o uso em um ambiente simultâneo de MRI-PET com um tempo de aquisição de 90 − 95 minutos19. No protocolo, amostras de sangue são tomadas para quantificar a radioatividade sérica plasmática para posterior quantificação de imagens PET. Quando o foco do protocolo for a aplicação de métodos da infusão para o neuroimagem funcional usando o animal de estimação de Bold-fMRI/FDG-f, estes métodos podem ser aplicados a todo o estudo do animal de estimação de FDG-fnão obstante se MRI simultâneo, Bold-f MRI, tomography computado (CT), ou outras neuroimages são adquiridas. A Figura 1 mostra o fluxograma dos procedimentos neste protocolo.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Este protocolo foi revisado e aprovado pelo Comitê de ética em pesquisa humana da Universidade Monash (número de aprovação CF16/1108-2016000590), de acordo com a declaração nacional australiana sobre conduta ética em pesquisa humana24. Os procedimentos foram desenvolvidos a orientação de um físico médico acreditado, Tecnologista da medicina nuclear, e radiographer clínico. Os investigadores devem referir-se a seus peritos locais e directrizes para a administração da radiação ionizante nos seres humanos.
1. equipamento e pessoal necessários
- Consulte a tabela de materiais para a sala do scanner, laboratório de radioquímica e materiais gerais. Um fornecedor comercial foi usado para o radiotracer.
- No ambiente simultâneo de MRI-PET, use quatro pessoais: um radiographer (RG) para executar a varredura, um tecnólogo da medicina nuclear (NMT) para supervisionar a administração do radiotraçador e a aquisição de amostras de sangue, um assistente de laboratório (la) para girar o sangue, e um assistente de pesquisa (RA) responsável por supervisionar o projeto experimental e a apresentação de estímulos.
2. preparação
- Preparação da dose traçador pelo NMT
- Calcule o volume de perfusão que será administrado ao longo da digitalização. Neste protocolo, a taxa de infusão é 0, 1 mL/s mais de 95 min. Assim, em uma varredura de 95 min, os participantes recebem 0, 1 mL/s x 60 s x 95 min = 57 mL.
- Calcule a dose traçador que será diluída na solução salina administrada. Neste protocolo, uma dose total de 260 MBq é administrada ao participante mais de 95 min. Esta dose foi escolhida para limitar a exposição à radiação para 4,9 mSv, para manter dentro da categorização de "baixo nível de risco" de acordo com as diretrizes da Australian Radiation Protection e da Agência de segurança nuclear (ARPANSA) para a exposição de seres humanos à radiação ionizante25. Deterioração correta 260 MBq do ponto Mid-Infusion (47,5 min) de volta a T0. Usando A equação 1, resolva para A0
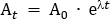
Quando at é a radioatividade (MBq) no ponto médio da infusão, a0 é a radioatividade inicial, e λ é a constante de deterioração radioativa específica para o traçador. Para FDG, o valor de é λ ≈ 0.693/T1/2. T1/2 é a meia-vida de 18F (110 min).
Observação: neste exemplo, At = 260 MBQ, λ = 0.693/110 e t =-47,5, portanto, a0 = 350,942 MBQ. - Calcule a dose necessária de radiotraçador para o saco fisiológico de 100 mL que será utilizado para administrar a dose ao participante. O radiotraçador requerido para o saco fisiológico é diluído até um volume total de 5 mL e elaborado numa seringa de 5 mL. Portanto, para o saco fisiológico de 100 mL, o fator de diluição é o volume de soro fisiológico (100 mL), além do volume de 5 mL da seringa com radiotraçador. Este volume total de 105 mL é dividido pelo volume de perfusão de 57 mL (i.e., 105 mL/57 mL = 1,842). Assim, a radioatividade total em um volume de 5 mL exigido para a adição ao saco de 100 mL é a0 x o fator da diluição (isto é, 350,942 MBQ x 1,842 = 646,44 MBq). Adicione assepticamente o radiotraçador ao saco salino.
Nota: é importante notar que a atividade calculada de 646,44 MBq que é adicionada ao saco salino é a atividade exigida no início da infusão. Geralmente, as doses para este protocolo são preparadas entre 15 min a 1 h antes da administração. Conseqüentemente, é importante fatorar na deterioração do radioisótopo. Equação 1 em 2.1.2. pode ser usado para dar conta disso, onde o tempo (t) é o número total de minutos a partir da preparação da dose para quando a atividade será administrada, at = 646,44 MBQ, resolvendo para a0. - Prepare a dose de escorva. Retire 20 mL do saco para dentro de uma seringa e tampe-o. Calibre esta seringa e etiqueta de 20 mL. A seringa é calibrada como uma verificação de referência para garantir que a radioatividade tenha se dispersado uniformemente dentro do saco salino.
- Prepare a dose. Utilizando uma seringa de 50 mL, retire 60 mL do saco e da tampa com uma rolha combi vermelha. Esta seringa não está calibrada, pois a concentração da radioatividade é conhecida a partir do momento em que foi adicionada à bolsa salina (passo 2.1.3). Guarde ambas as seringas no laboratório de radioquímica até estar pronto para digitalizar.
Nota: é possível extrair um volume de 60 mL numa seringa de 50 mL, uma vez que as seringas terumo estão marcadas para 20% acima do volume rotulado (ou seja, uma seringa de 50 mL está marcada para 60 mL). - Prepare a dose de referência. Encha um balão volumétrico de 500 mL com aproximadamente 480 mL de água destilada. Elaborar 10 MBq de 18F-FDG em uma seringa, deteriorado-corrigido para a hora de início da digitalização (usando a equação 1) e adicioná-lo ao balão. Top o volume até a marca de 500 mL com mais água destilada e misture completamente. Afixar rótulos pré e pós-calibração para a seringa.
- Preparação da sala do scanner pelo NMT
- Uma vez que o participante é posicionado no scanner, há muito pouco espaço para manipular ou salvar a linha para a infusão ou amostras de sangue se o bloqueio ocorre. Prepare a sala do scanner para minimizar a possibilidade de bloqueio de linha.
- Assegure-se de que todo o equipamento da colheita de sangue esteja dentro do alcance fácil do local da coleção. Coloque os descartáveis no final da cânula e em qualquer superfície que prenda recipientes de sangue. Coloque as caixas para resíduos regulares e resíduos bioperigosos a um alcance fácil do local de recolha de sangue.
- Preparação da bomba de infusão pelo NMT
- Configure a bomba de infusão na sala do scanner do lado que será conectada ao participante. Construa tijolos de chumbo em torno da base da bomba e coloque o escudo de chumbo na frente da bomba. Conecte o tubo para a bomba de infusão que entrega a infusão ao participante e assegure-se de que a taxa de infusão correta esteja introduzida. Para este protocolo, a taxa é 0, 1 mL/s.
- Prime o tubo antes de ser ligado à cânula do participante. Ligue a dose de escorva de 20 mL à bomba de perfusão. Na extremidade do tubo que será conectado ao participante, conecte um toque de três vias e uma seringa vazia de 20 mL. Assegure-se de que a torneira esteja posicionada para permitir que a solução de 18F-FDG flua da dose de escorva através do tubo e colete somente na seringa vazia.
- Predefinir a bomba de perfusão para aumentar um volume de 15 mL. Selecione o botão Prime na bomba e siga as instruções para Prime a linha.
- Fixe a seringa de dose de 50 mL à bomba de perfusão no lugar da dose de escorva. A dose pré-preparada de 15 mL na torneira de três vias pode permanecer lá até que o participante esteja pronto para ser conectado à bomba.
- Preparação dos participantes pelo NMT, RA e RG
- Aconselhe os participantes a jejuar por 6 h, e a consumir apenas água (aproximadamente dois copos), antes da digitalização.
- Faça com que a RA conduza os procedimentos de consentimento e adquira medidas adicionais (por exemplo, inquéritos demográficos, baterias cognitivas, etc.). Tenha o NMT e o RG conduzem as telas de segurança, a segurança da revisão de NMT para a exploração do animal de estimação (por exemplo, exclusão para a gravidez, o diabetes, a quimioterapia ou a radioterapia nas 8 semanas precedentes, e alergias conhecidas), e a segurança do participante da revisão RG para a exploração de MRI (por exemplo, exclusão para gravidez, implantes metálicos médicos ou não médicos, implantes dentários não removíveis, claustrofobia).
- Cannulate o participante.
- Use duas cânulas: uma para administração de dose e outra para amostragem de sangue. A cânula mais adequada varia entre os participantes, mas a veia mais adequada deve ser reservada para coleta de sangue. Uma cânula de 22 G é o tamanho mínimo preferido. Colete uma amostra de sangue basal de 10 mL enquanto cannulating. Desconecte todas as libera Salinas pressão para manter a permeabilidade da linha.
- Teste o nível de açúcar no sangue do participante e outras medidas sanguíneas de base (por exemplo, hemoglobina) da amostra basal.
- Posicionamento do participante no scanner pelo RG e NMT
- Tenha a posição RG o participante no furo do scanner. Para varreduras longas, é imperativo assegurar o conforto a fim reduzir o risco do participante que deixa cair para fora e artefacto do movimento devido ao incómodo. O participante deve ser coberto com um cobertor descartável para manter uma temperatura corporal confortável.
- Tenha o NMT nivelado a cânula para assegurar-se de que seja patente com resistência mínima antes de conectar a linha da infusão. Uma vez conectado, o tubo pode ser levemente gravado perto do pulso. Instrua o participante a manter o braço endireitado. Use apoios tais como a espuma ou os coxins para o conforto. Tenha o NMT igualmente verific a cânula que será usada para amostras do plasma para assegurar-se de que possa retirar o sangue com resistência mínima. Pode ser necessário conectar um tubo de extensão preparado com soro fisiológico normal para tornar a cânula mais acessível enquanto o participante está no scanner. Se isso for necessário, ele deve ser verificado para vazamentos.
- Uma vez que o assunto está no furo do varredor, tenha o NMT verific que têm o acesso apropriado a ambas as cânulas.
- Ter o NMT notificar o RG e RA se houver quaisquer problemas com a cânula de coleta de sangue, cânula de infusão, ou a bomba de infusão (por exemplo, oclusão, bateria, extravasamento) a qualquer momento durante a varredura.
3. digitalizar o participante
- Iniciando a digitalização com o NMT, RG e RA
- No início da digitalização, situar o NMT na sala do scanner para monitorar o equipamento de infusão. Assegure-se de que o NMT esteja vestindo proteção auditiva e usando o escudo de barreira para minimizar a exposição à radiação da dose sempre que possível.
- Como o RG executa a varredura do localizador para assegurar-se de que o participante esteja na posição correta, verific os detalhes para a aquisição do animal de estimação (por exemplo, duração da varredura, coleção de dados do modo de lista, isótopo correto).
- Projete o protocolo de modo que a aquisição do animal de estimação começe com a primeira seqüência de MRI. O RG prepara e inicia a sequência de ressonância magnética. A hora de início da aquisição de PET de 95 min é bloqueada pelo tempo para o início da sequência de ressonância magnética. Se necessário, o NMT deve entregar o bolus no momento da aquisição do PET (Figura 1).
- Inicie a bomba de perfusão. O RG deve sinalizar o NMT (por exemplo, através de um sinal do thumbs-up) para começar a bomba 30 s após o começo da aquisição do animal de estimação. Este protocolo inicia a bomba de infusão 30 s após a hora de início da digitalização para fornecer um buffer de segurança em caso de falha de digitalização. Isto igualmente assegura-se de que a primeira imagem tomada durante a varredura do animal de estimação indexe o cérebro antes da administração do radiotraçador para a coleção completa da curva da atividade do tempo. Ter o NMT observar a bomba para garantir que ele começou a inutilizar o 18F-FDG e que não há oclusão imediata da linha.
- Ter o RA iniciar qualquer estímulo externo no tempo acordado (ou seja, no início de um funcionamento funcional/bloco experimental) e calcular os tempos para amostras de sangue. Um formulário de registro de exemplo é mostrado no suplemento 1. Ter o RA calcular o tempo previsto de cada amostra de sangue e fornecer cópias para o NMT e assistente de laboratório (LA). Tenha o RA assegurar-se de que o NMT leve as amostras de sangue aproximadamente a hora correta, e monitore o equipamento (por exemplo, bomba da infusão, estímulo) para todos os sinais dos erros.
- Tome amostras de sangue em intervalos de tempo regulares
- Ter o NMT e RA tomar uma amostra a cada 10 min. Há geralmente 10 amostras no total, não incluindo a amostra de linha de base.
- Se adquirir varreduras de MRI simultaneamente com varreduras do animal de estimação, tenha a proteção da audição do desgaste de NMT ao entrar na sala do varredor.
- Tenha as luvas do desgaste de NMT e esfregue a ponta da cânula limpa. Enquanto o local da cânula seca, abra um 5 mL e uma seringa de 10 mL, vacutainer, e um 10 mL de descarga salina.
- Utilizando a seringa de 5 mL, retire 4-5 mL de sangue fresco e elimine a seringa no lixo biológico.
- Usando a seringa de 10 mL, retire até 10 mL de sangue. O volume pode ser limitado pela facilidade com que o sangue pode ser retirado. É importante minimizar qualquer resistência subsequentemente causando danos aos glóbulos vermelhos que podem hemolyze. No ponto do midcollection, tenha o sinal de NMT ao RA, que marcará esta vez no formulário Record (suplemento 1) como o tempo "real" da amostra.
- Ligue a seringa de 10 mL ao vacutainer e, em seguida, deposite o sangue no tubo sanguíneo relevante.
- Lave rapidamente a cânula com 10 mL de solução salina, desligada pressão, para minimizar qualquer chance de coagulação da linha.
- Leve imediatamente a amostra de sangue para o laboratório de radioquímica para análise.
- Girando o sangue pelo LA
- Tenha o LA começ todo o equipamento pronto (tabela 1) e seja luvas do desgaste. Ter três racks definidos para as amostras: um para tubos de sangue, um para pipetar a amostra, e um para amostras de pipetadas preenchidas (pré e pós-contagem).
- Tenha o LA mude regularmente luvas durante todo o procedimento, especial ao segurar o tubo de contagem. Se o LA tiver qualquer contaminação plasmática radioativa em suas luvas, ela pode ser transferida para o tubo de contagem e aumentar de forma espúria o número de contagens registradas da amostra.
- A amostra de sangue pode ser colocada no centrifugador como a disponibilidade de recursos de pessoal permite, porque o tempo que a amostra de sangue foi tomada, e o tempo que foi contado foi anotado. Gire todas as amostras em uma força centrífuga relativa de 724 x g. Os ajustes da centrífuga usados para este protocolo são 2.000 rpm por 5 minutos com as curvas da aceleração e da desaceleração ajustadas a oito.
- Uma vez que a amostra tenha sido girada, coloque o tubo no rack de pipetagem. Retire a tampa do tubo para não perturbar a separação da amostra. Coloque um tubo de contagem rotulado no rack. O rótulo deve corresponder ao tubo sanguíneo.
- Assegure-se de que a ponta está firmemente presa à pipeta. Prepare um lenço para os gotejantes. Pipete firmemente 1.000 μL de plasma do tubo sanguíneo, transfira para o tubo de contagem e substitua as tampas no tubo de contagem e no tubo sanguíneo.
- Coloque o tubo de contagem no contador do poço e conte por 4 min. Registre a hora de início da contagem na folha de registro (' tempo de medição ') para cada amostra. Isso é necessário para correções subseqüentes para a hora de início de aquisição de PET. Em pontos de tempo posteriores durante a digitalização, faça com que o LA execute cada etapa em rápida sucessão para evitar uma lista de pendências de amostras.
- Elimine qualquer resíduo de produto sanguíneo em sacos de risco biológico.
- Tenha o LA começ todo o equipamento pronto (tabela 1) e seja luvas do desgaste. Ter três racks definidos para as amostras: um para tubos de sangue, um para pipetar a amostra, e um para amostras de pipetadas preenchidas (pré e pós-contagem).
Access restricted. Please log in or start a trial to view this content.
Resultados
Métodos específicos do estudo
Aqui, os detalhes específicos do estudo para os resultados representativos são relatados. Esses detalhes não são críticos para o procedimento e variam entre estudos.
Participantes e projeto de tarefa
Os participantes (n = 3, tabela 2) foram submetidos a um estudo de PET em simultâneo com Bold-fMRI/FDG-f. Como este man...
Access restricted. Please log in or start a trial to view this content.
Discussão
FDG-PET é uma poderosa tecnologia de imagem que mede a captação de glicose, um índice de metabolismo da glicose cerebral. Até o momento, a maioria dos estudos de neurociência usando o FDG-PET usa uma abordagem de administração de bolus tradicional, com uma resolução de imagem estática que representa a integral de toda atividade metabólica ao longo do exame2. Este manuscrito descreve dois protocolos alternativos da administração do radiotraçador: o infusão-somente (por exemplo, vill...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não declaram conflito de interesses. A fonte de financiamento não estava envolvida no desenho, coleta, análise e interpretação dos dados do estudo.
Agradecimentos
Jamadar é apoiado por um Conselho australiano de pesquisa (ARC) Discovery Early carreira investigador Award (DECRA DE150100406). Jamadar, Ward e Egan são apoiados pelo centro ARC de excelência para a função cerebral Integrativa (CE114100007). Chen e li são apoiados pelo financiamento da Fundação Cultural Reignwood.
Jamadar, Ward, Carey e McIntyre projetaram o protocolo. Carey, McIntyre, Sasan e Fallon coletaram os dados. Jamadar, Ward, Parkes e Sasan analisaram os dados. Jamadar, Ward, Carey e McIntyre escreveram o primeiro rascunho do manuscrito. Todos os autores revisaram e aprovaram a versão final.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Blood Collection Equipment | |||
| --12-15 vacutainers | Becton Dickinson, NJ USA | 364880 | Remain in sterile packaging until required to put blood in tube |
| --12-15 10mL LH blood collecting tubes | Becton Dickinson | 367526 | Marked with the sample number (e.g., S1, S2…) and subsequently marked with the sample time (e.g., time 0 + x min [T0+x]) |
| --2-15 10mL Terumo syringe | Terumo Tokyo, Japan | SS+10L | These are drawn up on the day of the study and capped with the ampoule that contained the saline |
| -- pre-drawn 0.9% saline flushes | Pfizer, NY, USA | 61039117 | |
| --12-15 5mL Terumo syringes | Terumo Tokyo, Japan | SS+05S | Remain in sterile packaging until ready to withdraw a blood sample |
| Safety & Waste Equipment | All objects arranged on a plastic chair inside the scanner room on the same side as the arm from which the blood samples will be taken. Biohazard and non-biohazard waste bags to be used. Gloves and waste bags to be easily accessible when preparing the radioactivity in the dispensing area and when pipetting the plasma samples. Biohazard and non-biohazard waste bags to be used. All waste generated is checked with the Geiger counter to ensure that radioactive contaminated waste is stored until it is safe to be disposed of according to Australian Radiation Protection and Nuclear Safety Agency (APRANSA) guidelines for Radiation protection series No.6 (2017). | ||
| -- Gloves | Westlab, VIC, Australia | 663-219 | |
| -- waste bags | Austar Packaging, VIC, Australia | YIW6090 | |
| --cello underpads ‘blueys’ Underpads 5 Ply | Halyard Health, NSW, Australia | 2765A | |
| --Blue Sharpie pen | Sharpie, TN, USA | S30063 | |
| Dose Syringes | Remain in sterile packaging until ready for use. All syringes used in this facility have an additional 20% volume capacity above the stated volume on the packaging. This is important for the 50mL syringe where the total capacity of 60mL is used | ||
| --5mL | Terumo Tokyo, Japan | SS+05S | |
| -- 20mL | Terumo Tokyo, Japan | SS+20L | |
| --50mL | Terumo Tokyo, Japan | SS*50LE | |
| --1 Terumo 18-gauge needle | Terumo Tokyo, Japan | NN+1838R | Remain in sterile packaging until ready to inject [18F]FDG into the saline bag |
| --100mL 0.9% saline bag | Baxter Pharmaceutical, IL, USA | AHB1307 | Remain in sterile packaging until ready to inject [18F]FDG |
| Radiochemistry Lab Supplies | |||
| --Heraeus Megafuge 16 centrifuge; Rotor Bioshield 720 | ThermoScientific MA, USA | 75004230 | Relative Centrifugal Force = 724 Our settings are 2000RPM for 5mins. Acceleration and deceleration curves set to 8 |
| --Single well counter | Laboratory Technologies, Inc. IL, USA | 630-365-1000 | Complete daily quality control (includes background count) and protocol set to 18F and 4mins. Cross calibration is performed between the well counter, dose calibrator and scanner on a bi-monthly basis. |
| --Pipette | ISG Xacto, Vienna, Austria | LI10434 | We use a 100-1000 μL set to 1000μL. It is calibrated annually. |
| --12-15 plasma counting tubes | Techno PLAS; SA Australia | P10316SU | Marked in the same manner as the LH blood tubes |
| --12-15 pipette tips | Expell Capp, Denmark | 5130140-1 | |
| --3 test tube racks | Generic | Checked with a Geiger counter to ensure there is no radiation contamination on them | |
| --500mL volumetric flask and distilled water | Generic | Need approximately 500mL of distilled water to prepare the reference for gamma counting | |
| --Synchronised clocks in scanner room, console and radiochemistry lab | Generic | Synchronisation checks are routinely completed in the facility on a weekly basis | |
| --Haemoglobin Monitor | EKF Diagnostic Cardiff, UK Haemo Control. | 3000-0810-6801 | Manufacturer recommended quality control performed before testing on participant’s blood sample. |
| --Glucometre | Roche Accu-Chek | 6870252001 | Accu-Chek Performa is used to measure participant blood sugar levels in mmol/L. Quality control is performed daily using high and low concentration solution control test. |
| Cannulating Equipment | Check expiry dates and train NMT to prepare aseptically for cannulation. | ||
| --Regulation tourniquet | CBC Classic Kimetec GmBH | K5020 | |
| --20, 22 and 24 gauge cannulas | Braun, Melsungen Germany | 4251644-03; 4251628-03; 4251601-03 | |
| --tegaderm dressings | 3M, MN USA | 1624W | |
| --alcohol and chlorhexidine swabs | Reynard Health Supplies, NSW Australia | RHS408 | |
| --0.9% saline 10mL ampoules; for flushes | Pfizer, NY, USA | 61039117 | |
| --10mL syringes | Terumo Tokyo, Japan | SS+10L | |
| --3-way tap | Becton Dickinson Connecta | 394600 | |
| --IV bung | Safsite Braun PA USA | 415068 | |
| --Optional extension tube, microbore extension set | M Devices, Denmark | IV054000 | |
| Scanner Room Equipment | |||
| --Siemens Biograph 3T mMR | Siemens, Erlangen, Germany | ||
| --Portable lead barrier shield | Gammasonics | Custom-built | MR-conditional lead barrier shield. Positioned at the 2000 Gauss line with the castors locked to provide additional shielding of the radioactivity connected to the infusion pump. |
| --Infusion pump BodyGuard 323 MR-conditional infusion pump | Caesarea Medical Electronics | 300-040XP | MR-compatible. This model is cleared for use on 1.5 and 3T scanners at 2000 Gauss with castors locked. |
| --Infusion pump tubing | Caesarea Medical Electronics | 100-163X2YNKS | Tubing is administration set with an anti-siphon valve and male luer lock (REF 100-163X2YNKS). |
| --Lead bricks | Custom built | Tested for ferromagnetic translational force | |
| Other Equipment | |||
| --Syringe shields | Biodex, NY USA | Custom-built | There is a 5mL tungsten syringe shield that is MR-safe, as well as a 50mL lead shield that has been tested for ferromagnetic attraction prior to use in the MR-PET scanner. It is used to transport the radioactive dose from the radiochemistry lab into the scanner to minimise radiation exposure to the NMT. |
| --Geiger counter Model 26-1 Integrated Frisker | Ludlum Measurements, Inc. TX USA | 48-4007 | This is calibrated annually and used to monitor potential contamination and waste. It is not taken into the MR-PET scanner. |
Referências
- Heurling, K., et al. Quantitative positron emission tomography in brain research. Brain Research. 1670, 220-234 (2017).
- Chen, Z., et al. From simultaneous to synergistic MR-PET brain imaging: A review of hybrid MR-PET imaging methodologies. Human Brain Mapping. 39 (12), 5126-5144 (2018).
- Jones, T., Rabiner, E. A. The development, past achievements, and future directions of brain PET. Journal of Cerebral Blood Flow & Metabolism. 32 (7), 1426-1454 (2012).
- Kety, S. S. Metabolism of the nervous system. , Elsevier. 221-237 (1957).
- Sokoloff, L. The metabolism of the central nervous system in vivo. Handbook of Physiology, section I, neurophysiology. 3, 1843-1864 (1960).
- Harris, J. J., Jolivet, R., Attwell, D. Synaptic energy use and supply. Neuron. 75 (5), 762-777 (2012).
- Mosconi, L., et al. FDG-PET changes in brain glucose metabolism from normal cognition to pathologically verified Alzheimer's disease. European Journal of Nuclear Medicine and Molecular Imaging. 36 (5), 811-822 (2009).
- Pagano, G., Niccolini, F., Politis, M. Current status of PET imaging in Huntington's disease. European Journal of Nuclear Medicine and Molecular Imaging. 43 (6), 1171-1182 (2016).
- Petit-Taboue, M., Landeau, B., Desson, J., Desgranges, B., Baron, J. Effects of healthy aging on the regional cerebral metabolic rate of glucose assessed with statistical parametric mapping. Neuroimage. 7 (3), 176-184 (1998).
- Chugani, H. T., Phelps, M. E., Mazziotta, J. C. Positron emission tomography study of human brain functional development. Annals of Neurology. 22 (4), 487-497 (1987).
- Phelps, M. E., Mazziotta, J. C. Positron emission tomography: human brain function and biochemistry. Science. 228 (4701), 799-809 (1985).
- Zimmer, E. R., et al. [18 F] FDG PET signal is driven by astroglial glutamate transport. Nature Neuroscience. 20 (3), 393(2017).
- Roberts, R. P., Hach, S., Tippett, L. J., Addis, D. R. The Simpson's paradox and fMRI: Similarities and differences between functional connectivity measures derived from within-subject and across-subject correlations. Neuroimage. 135, 1-15 (2016).
- Horwitz, B. The elusive concept of brain connectivity. Neuroimage. 19 (2), 466-470 (2003).
- Moses, W. W. Fundamental limits of spatial resolution in PET. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 648, S236-S240 (2011).
- Tomasi, D. G., et al. Dynamic brain glucose metabolism identifies anti-correlated cortical-cerebellar networks at rest. Journal of Cerebral Blood Flow & Metabolism. 37 (12), 3659-3670 (2017).
- Hahn, A., et al. Quantification of task specific glucose metabolism with constant infusion of 18F-FDG. Journal of Nuclear Medicine. 57 (12), 1933-1940 (2016).
- Hahn, A., et al. Task-relevant brain networks identified with simultaneous PET/MR imaging of metabolism and connectivity. Brain Structure and Function. 223 (3), 1369-1378 (2018).
- Jamadar, S. D., et al. Simultaneous task-based BOLD-fMRI and [18-F] FDG functional PET for measurement of neuronal metabolism in the human visual cortex. Neuroimage. 189, 258-266 (2019).
- Rischka, L., et al. Reduced task durations in functional PET imaging with [18F] FDG approaching that of functional MRI. Neuroimage. 181, 323-330 (2018).
- Villien, M., et al. Dynamic functional imaging of brain glucose utilization using fPET-FDG. Neuroimage. 100, 192-199 (2014).
- Carson, R. E. PET physiological measurements using constant infusion. Nuclear Medicine and Biology. 27 (7), 657-660 (2000).
- Carson, R. E., et al. Comparison of bolus and infusion methods for receptor quantitation: application to [18F] cyclofoxy and positron emission tomography. Journal of Cerebral Blood Flow & Metabolism. 13 (1), 24-42 (1993).
- National Health and Medical Research Council. National statement on ethical conduct in human research. , (2007).
- Australian Radiation Protection and Nuclear Safety Agency. Code of practice for the exposure of humans to ionizing radiation for research purposes. , (2005).
- Jenkinson, M., Beckmann, C. F., Behrens, T. E., Woolrich, M. W., Smith, S. M. FSL. Neuroimage. 62 (2), 782-790 (2012).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310(2010).
- Avants, B., Klein, A., Tustison, N., Woo, J., Gee, J. C. 16th Annual Meeting for the Organization of Human Brain Mapping. , (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), e1005350(2017).
- Tustison, N. J., et al. Large-scale evaluation of ANTs and FreeSurfer cortical thickness measurements. Neuroimage. 99, 166-179 (2014).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. Neuroimage. 54 (3), 2033-2044 (2011).
- Burgos, N., et al. Attenuation correction synthesis for hybrid PET-MR scanners: application to brain studies. IEEE Transactions on Medical Imaging. 33 (12), 2332-2341 (2014).
- Panin, V. Y., Kehren, F., Michel, C., Casey, M. Fully 3-D PET reconstruction with system matrix derived from point source measurements. IEEE Transactions on Medical Imaging. 25 (7), 907-921 (2006).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. Neuroimage. 17 (2), 825-841 (2002).
- Bludau, S., et al. Cytoarchitecture, probability maps and functions of the human frontal pole. Neuroimage. 93, 260-275 (2014).
- Amunts, K., Malikovic, A., Mohlberg, H., Schormann, T., Zilles, K. Brodmann's areas 17 and 18 brought into stereotaxic space-where and how variable? Neuroimage. 11 (1), 66-84 (2000).
- Malikovic, A., et al. Cytoarchitectonic analysis of the human extrastriate cortex in the region of V5/MT+: a probabilistic, stereotaxic map of area hOc5. Cerebral Cortex. 17 (3), 562-574 (2006).
- Wilms, M., et al. Human V5/MT+: comparison of functional and cytoarchitectonic data. Anatomy and Embryology. 210 (5-6), 485-495 (2005).
- Eickhoff, S. B., Heim, S., Zilles, K., Amunts, K. Testing anatomically specified hypotheses in functional imaging using cytoarchitectonic maps. Neuroimage. 32 (2), 570-582 (2006).
- Eickhoff, S. B., et al. Assignment of functional activations to probabilistic cytoarchitectonic areas revisited. Neuroimage. 36 (3), 511-521 (2007).
- Eickhoff, S. B., et al. A new SPM toolbox for combining probabilistic cytoarchitectonic maps and functional imaging data. Neuroimage. 25 (4), 1325-1335 (2005).
- Everett, B. A., et al. Safety of radial arterial catheterization in PET research subjects. Journal of Nuclear Medicine. 50 (10), 1742-1742 (2009).
- Takagi, S., et al. Quantitative PET cerebral glucose metabolism estimates using a single non-arterialized venous-blood sample. Annals of Nuclear Medicine. 18 (4), 297-302 (2004).
- Zanotti-Fregonara, P., Chen, K., Liow, J. S., Fujita, M., Innis, R. B. Image-derived input function for brain PET studies: many challenges and few opportunities. Journal of Cerebral Blood Flow & Metabolism. 31 (10), 1986-1998 (2011).
- O'Loughlin, S., Currie, G. M., Trifonovic, M., Kiat, H. Ambient temperature and cardiac accumulation of 18F-FDG. Journal of Nuclear Medicine Technology. 42 (3), 188-193 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados