Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Detección de ADN libre de células en muestras de plasma sanguíneo de pacientes con cáncer
En este artículo
Resumen
En este artículo presentamos un protocolo detallado para la técnica de biopsia líquida no invasiva, incluyendo recolección de sangre, separación de plasma y capa buffy, extracción de ADN cfDNA y germinlina, cuantificación del ADN cfDNA o de la línea germinal, y análisis de enriquecimiento de fragmentos cfDNA.
Resumen
Identificar mutaciones en tumores de pacientes con cáncer es un paso muy importante en el manejo de enfermedades. Estas mutaciones sirven como biomarcadores para el diagnóstico tumoral, así como para la selección del tratamiento y su respuesta en pacientes con cáncer. El método estándar de oro actual para detectar mutaciones tumorales implica una prueba genética del ADN tumoral mediante biopsias tumorales. Sin embargo, este método invasivo es difícil de realizar repetidamente como una prueba de seguimiento del repertorio mutacional tumoral. La biopsia líquida es una técnica nueva y emergente para detectar mutaciones tumorales como un enfoque de biopsia fácil de usar y no invasivo.
Las células cancerosas se multiplican rápidamente. Paralelamente, numerosas células cancerosas se someten a apoptosis. Los desechos de estas células se liberan en el sistema circulatorio de un paciente, junto con piezas de ADN finamente fragmentadas, llamadas fragmentos de ADN libre de células (CFDNA), que llevan mutaciones del ADN tumoral. Por lo tanto, para identificar biomarcadores basados en CFDNA utilizando la técnica de biopsia líquida, se recogen muestras de sangre de los pacientes con cáncer, seguidas de la separación del plasma y la capa buffy. A continuación, el plasma se procesa para el aislamiento de cfDNA, y la capa de buffy respectiva se procesa para el aislamiento del ADN genómico de un paciente. A continuación, se comprueban ambas muestras de ácido nucleico en busca de su cantidad y calidad; y se analizaron para detectar mutaciones utilizando técnicas de secuenciación de próxima generación (NGS).
En este manuscrito, presentamos un protocolo detallado para la biopsia líquida, incluyendo la recolección de sangre, plasma y separación de capa buffy, extracción de ADN cfDNA y germlina, cuantificación del ADN cfDNA o germinina, y análisis de enriquecimiento de fragmentos cfDNA.
Introducción
Los avances tecnológicos han llevado a la secuenciación de cientos de genomas y transcriptomas de cáncer1. Esto ha contribuido a comprender los paisajes de cambios moleculares en diferentes tipos de cáncer2. Otros estudios sobre estos paisajes han ayudado a caracterizar las alteraciones somáticas secuenciales y las fusiones génicas-génicas3 que están implicadas en el cáncer o la progresión tumoral, al interrumpir en serie las vías de apoptosis4. Por lo tanto, las mutaciones somáticas y las fusiones génicas pueden proporcionar información sobre tumores sirviendo como biomarcadores en pacientes individuales para un tumor particular tipo5,identificando el pronóstico de tumores primarios existentes6,categorizando tumores secundarios basados en cambios moleculares7,e identificando dianas tumorales farmacológicas8. Dicha información puede facilitar la selección de tratamientos personalizados para pacientes con cáncer y en la determinación de respuestas positivas y negativas al tratamiento9. Sin embargo, la obtención de material tumoral para identificar el perfil genómico del tejido tumoral es un procedimiento invasivo10. Además, una biopsia tumoral comprende sólo una pequeña parte de un tumor heterogéneo; y, por lo tanto, no ser representativo para el perfil molecular de todo el tumor11. El monitorización en serie y el genotipado tumoral requieren una recopilación repetida de tejidos tumorales, que, por lo general, no es factible debido a la invasión del procedimiento de biopsia tumoral y a los problemas de seguridad que surgen de dichos procedimientos12.
La técnica de biopsia líquida, por otro lado, ha ganado una enorme atención en oncología de precisión en la última década13,14. Se debe principalmente a la no invasión de esta técnica, y a la posibilidad de que se repita en múltiples puntos de tiempo, lo que permite una técnica de monitorización fácil de usar y segura para los cursos de la enfermedad15,16. La biopsia líquida se basa en un fenómeno de que las células tumorales se multiplican rápidamente, y al mismo tiempo muchas de ellas se someten a apoptosis y necrosis. Esto conduce a la liberación de restos celulares apoptóticos en la sangre de los pacientes, junto con los fragmentos de ADN que se cortan en tamaños precisos durante la apoptosis17. La apoptosis de las células no cancerosas también conduce a la liberación de sus desechos celulares en la sangre, sin embargo, la tasa de apoptosis en estas células es relativamente mucho menor que las células tumorales18. La razón de la técnica de biopsia líquida es capturar moléculas asociadas al tumor como ADN, ARN, proteínas y células tumorales14,19 que circulan continuamente en la sangre. Varias técnicas20 se pueden utilizar para el análisis de estas moléculas, incluyendo secuenciación de próxima generación (NGS), reacción en cadena de la polimerasa de gota digital (ddPCR), PCR en tiempo real y ensayo inmunosorbente vinculado a enzimas (ELISA). La técnica de biopsia líquida permite identificar biomarcadores que son características de las células tumorales. Estas moléculas de biomarcador no sólo se liberan de partes específicas de un tumor, sino más bien de todas las partes del tumor21. Por lo tanto, los marcadores identificados en la biopsia líquida representan el perfil molecular de todo un tumor heterogéneo, además de otros tumores en el cuerpo, por lo tanto, tener ventajas sobre la técnica basada en biopsia de tejido22.
El cfDNA tiene un corto tiempo de vida media en la sangre circulante que va desde unos minutos hasta 1-2 horas23. Sin embargo, el corto tiempo de vida media de cfDNA facilita los análisis en tiempo real mediante la evaluación de la respuesta al tratamiento y evaluaciones dinámicas del tumor. Los niveles de CFDNA derivados del tumor indican el pronóstico de la etapa/tamaño del tumor evidenciado por varios estudios, que mostraron una relación entre los niveles de CFDNA y los resultados de supervivencia24. Además, los estudios han demostrado que el CFDNA tiene una mejor capacidad de predicción que los marcadores tumorales existentes25. El pronóstico del CFDNA es aún más pronunciado después del tratamiento oncológico, los niveles más altos de CFDNA después del tratamiento se correlacionan bien con una tasa reducida de supervivencia y resistencia al tratamiento. Mientras que, los niveles más bajos de CFDNA después del tratamiento generalmente corresponden con la respuesta positiva al tratamiento. Además, el CFDNA facilita la detección precoz de la respuesta al tratamiento que los métodos de detección tradicionales.
El CFDNA aumenta la posibilidad de detección precoz de mutaciones asociadas al cáncer: durante la enfermedad en etapa temprana15,la aparición de síntomas26 y antes del diagnóstico de cáncer de hasta 2 años27. Como cfDNA se libera de múltiples regiones tumorales o focos, su análisis proporciona una visión completa del genoma tumoral que representa28. Por lo tanto, el CFDNA permite detectar mutaciones somáticas que podrían haberse perdido en las muestras de tejido29. Como la heterogeneidad intra-tumoral y las mutaciones subclonales pueden ser detectadas por la secuenciación profunda de regiones genómicas que abarcan miles de bases, por lo tanto el análisis de la CFDNA permite descubrir subtipos moleculares específicos con firmas genómicas distintas13. Para obtener un nivel similar de información a través de la muestra de tejido se habrían necesitado muchas biopsias sólidas.
Además, los niveles de CFDNA en pacientes con una enfermedad localizada como el cáncer de colon, ovario y pulmón después de un tratamiento quirúrgico y/o quimioterapia, demostraron ser un potente marcador pronóstico para la recurrencia del cáncer y los resultados del tratamiento20. Además, en pacientes con cáncer de colon, mama y pulmón, los análisis de cfDNA de la sangre pudieron detectar con éxito los cambios específicos del tumor, lo que llevó a la predicción precisa de recurrencia con varios meses de antelación13. Además, los marcadores de resistencia al tratamiento, como mutaciones KRAS en pacientes con CRC que reciben tratamiento anti-EGFR30; VAF para genes como PIK3CA, MED1 o EGFR en pacientes con cáncer de mama después del tratamiento con diversas terapias31; y la mutación de resistencia al EGFR T790M en pacientes con cáncer de pulmón tratados con TKIs32 dirigidos por EGFR también se puede identificar mediante el análisis cfDNA.
En resumen, el análisis cfDNA se puede utilizar para identificar biomarcadores precisos en el campo de la oncología13,33. En este protocolo, se procesaron muestras de sangre de 3 pacientes con glioma y 3 controles sanos para obtener ADN genómico de los WBC y cfDNA del plasma. En el cáncer de glioma, las mutaciones en IDH, TERT, ATRX, EGFR y TP53 sirven como un diagnóstico, así como marcadores pronósticos que pueden ayudar en el diagnóstico precoz de tumores de glioma, clasificando diferentes tipos de tumores de glioma, guiando el tratamiento preciso para el paciente individual y entendiendo la respuesta al tratamiento34,35. El estado mutacional de estos genes se puede identificar utilizando CFDNA derivado de la sangre. En este manuscrito, presentamos un protocolo detallado de cfDNA derivado del plasma que se ha utilizado para estudiar los cambios mutacionales en el cáncer de glioma12. Este protocolo de biopsia líquida basado en cfDNA explicado en este artículo se puede utilizar para estudiar los cambios mutacionales en muchos otros tipos de cánceres. Además, un estudio reciente ha demostrado que la biopsia líquida basada en cfDNA puede detectar 50 tipos diferentes de cánceres36.
La recolección, almacenamiento y envío de muestras de sangre son pasos cruciales en este protocolo, ya que la temperatura incontrolada durante estos pasos causa lisis de los WBC, lo que conduce a la liberación de ADN genómico del CMB en el plasma y causa contaminación de la muestra cfDNA, que afecta al resto del procedimiento37. La hemólisis debido a la temperatura incontrolada puede afectar los procesos de preparación de muestras aguas abajo de cfDNA, como los pasosPCR 38. El suero contiene una alta proporción de cfDNA germinal en lugar de plasma, aunque presenta un gran ruido de fondo para cfDNA39asociado al tumor. Por lo tanto, para aislar el cfDNA asociado al tumor, el plasma es una muestra adecuada39. La sangre extraída en un anti-coagulante que contenga tubo de recolección de sangre debe reducirse inmediatamente o en un plazo de hasta dos horas, para separar el plasma y evitar la contaminación por CFDNA. En este protocolo, se utilizan tubos de recolección de sangre dedicados a la conservación comercial cfDNA (ver Tabla de Materiales),que son una alternativa al anticoagulante que contiene tubos de recolección de sangre. Estos tubos dedicados de recolección de sangre preservan cfDNA y cfRNA, y previenen la lisis de los WBC durante un tiempo de hasta 30 días a temperatura ambiente, y hasta 8 días a 37 °C. Esto facilita el mantenimiento de la temperatura adecuada durante un envío de muestras de sangre y hasta que el plasma y el CMB se separan40.
Actualmente hay tres tipos de metodologías de extracción cfDNA disponibles: aislamiento de fase, columna de espín a base de membrana de silicio y aislamiento magnético basado en cuentas41. El método de columna de espín basado en membrana de silicio produjo una gran cantidad de cfDNA con alta integridad en comparación con otros métodos de extracción cfDNA42.
La evaluación cuantitativa del ADN es un requisito fundamental en la biopsia líquida, hay una necesidad de desarrollar un procedimiento simple, asequible y estandarizado para su fácil implementación y uso amplio. Tres métodos comúnmente utilizados para la cuantificación cfDNA son espectrofotométricos, fluorimétricos y qPCR. El método fluorimétrico se demuestra mejor que los demás métodos relativos a la precisión, el costo y la facilidad de conducción43.
La integridad y pureza del cfDNA se puede estimar mediante electroforesis agarose o electroforesis capilar. La electroforesis de agarose no muestra sensibilidad a baja concentración de CFDNA ni tiene alta resolución para mostrar un tamaño preciso de fragmentos de CFDNA. Por otro lado, la electroforesis capilar tiene una ventaja sobre la electroforesis de agarose al superar los desafíos asociados y, por lo tanto, ampliamente utilizado por los investigadores para el análisis del tamaño de fragmentos cfDNA. En este protocolo, la distribución del tamaño del fragmento de cfDNA aislado se estimó utilizando un instrumento automatizado de electroforesis capilar (véase Tabla de materiales).
Protocolo
Antes de la recolección de sangre, se requiere el consentimiento informado de los sujetos que participan en la investigación y deben obtenerse. La investigación descrita en este manuscrito se realizó de acuerdo con el Centro Médico Rabin, el comité ético de Israel (código ético: 0039-17-RMC) y la Facultad de Medicina Der Christian-Albrechts-Universität zu Kiel, Comité ético de Alemania (código ético: D 405/14).
1. Recolección y almacenamiento de muestras de sangre en tubos conservantes cfDNA o cfRNA
- Etiquete correctamente los tubos de conservación
- Recoger ~ 8 ml de sangre en el tubo de preservación cf-DNA (ver Tabla de materiales),utilizando un conjunto de recolección de sangre y un soporte, según el protocolo institucional estándar para la venipuntura como se describe a continuación.
NOTA: El uso de un conjunto de recolección de sangre puede prevenir un posible flujo posterior de la sangre desde el tubo.- Alinee al paciente con el brazo en una posición hacia abajo.
- Sujete el tubo erguido, con la tapa hacia arriba, mientras se asegura de que el contenido del tubo no toque la tapa o la punta de la aguja.
- A medida que la sangre comienza a fluir hacia el tubo, suelte el torniquete lentamente.
- Inmediatamente después de que el tubo esté lleno de sangre (capacidad máxima: 8,4 ml de sangre entera), invierta suavemente el tubo (gire la muñeca del brazo que sostiene el tubo 180° hacia abajo y hacia atrás) 5 veces para estabilizar la muestra.
NOTA: La inversión garantiza que el conservante se mezcle uniformemente con la muestra. Sin embargo, no vuelva a agitar el contenido, incluso antes de la preparación del plasma. La mezcla insuficiente de conservantes con la muestra de sangre conduce a la desestabilización del contenido y la formación de micro coágulos o hemólisis. En esta etapa, el protocolo se puede continuar inmediatamente para la separación plasmática o tubos llenos de sangre pueden esperar hasta 30 días a temperatura ambiente (15-25 °C), y hasta 8 días a 37 °C.
2. Separación y almacenamiento de plasma y capa buffy
- Centrífuga el tubo de conservación lleno de sangre a 425 x g durante 20 minutos a temperatura ambiente para separar el plasma.
NOTA: Los pasos 2.2 y 2.3 deben realizarse en un armario de bioseguridad. - Pipetear cuidadosamente la capa superior de plasma a un tubo fresco en 1 mL aliquots, sin perturbar las capas inferiores.
- Transfiera cuidadosamente la siguiente capa de capa buffy a un tubo fresco (la capa aparece como un anillo por encima de los pellets RBC), evitando los RBC en la capa inferior.
- Proceda al paso 3 con plasma y paso 4 con la capa buffy. Si es necesario, almacene el contenido separado a -80 °C.
3. Purificación de cfDNA circulante a partir de 1 ml de plasma
NOTA: Este paso se realiza con un kit comercial (consulte Tabla de materiales). Todos los búferes se proporcionan con el kit.
- Preparación de tampones y reactivos
PRECAUCIÓN: No agregue soluciones ácidas o lejía directamente a los residuos de preparación de muestras. Las sales de guanidina presentes en lysis buffer, tampón de unión y tampone de lavado-1 cuando se combinan con lejía o ácidos pueden producir compuestos altamente reactivos.- Búfer de enlace: Mezcle 300 ml de concentrado de búfer de enlace con 200 ml de isopropanol 100% para hacer 500 ml de búfer de enlace de trabajo. Conservar a temperatura ambiente.
NOTA: El búfer de unión permite la unión óptima de los ácidos nucleicos circulantes a la membrana de sílice. 500 ml del búfer de encuadernación es suficiente para procesar 276, 138, 92, 69 o 55 muestras de 1, 2, 3, 4 o 5 ml de plasma respectivamente y es estable durante 1 año a temperatura ambiente. - Wash Buffer-1: Mezcle 19 ml de concentrado Wash Buffer-1 con 25 ml de etanol 96-100% para hacer 44 ml de wash buffer-1 en funcionamiento. Conservar a temperatura ambiente.
NOTA: Wash Buffer-1 elimina los contaminantes unidos a la membrana de sílice. 44 ml de lavado de trabajo Buffer-1 es suficiente para procesar 73 muestras de plasma de 1/2/3/4/5 ml y es estable durante 1 año a temperatura ambiente. - Wash Buffer-2: Mezcle bien 13 mL de concentrado de buffer-2 de lavado con 30 ml de etanol 96-100% para hacer 43 ml de tampone de lavado de trabajo-2. Conservar a temperatura ambiente.
NOTA: Wash Buffer-2 elimina los contaminantes unidos a la membrana de sílice. 43 ml de lavado de trabajo Buffer-2 es suficiente para procesar ~ 56 muestras de 1/2/3/4/5 mL de plasma y es estable durante 1 año a temperatura ambiente. - A un tubo que contenga ARN portador liofilizado de 310 μg, agregue 1.550 μL de tampón de elución, para preparar una solución portadora de ARN de 0,2 μg/μL. Después de disolver completamente el ARN portador, divida la solución a coácuotas adecuadas y guárdelo a –30 °C a –15 °C. No congele estos alícuotas más de 3 veces. Al buffer de lisis, tal y como se muestra en de la tabla S1, agregue el ARN portador reconstituido disuelto en el buffer de elution.
NOTA: Porque el ARN portador no se disuelve directamente en el buffer de lisis, primero debe disolverse en un búfer de elución y, a continuación, en el búfer de lisis. En primer lugar, la unión de ácidos nucleicos por membrana de sílice se mejora cuando hay muy pocas moléculas diana presentes en la muestra. En segundo lugar, el riesgo de degradación del ARN se reduce debido a la presencia de grandes cantidades de ARN portador.
- Búfer de enlace: Mezcle 300 ml de concentrado de búfer de enlace con 200 ml de isopropanol 100% para hacer 500 ml de búfer de enlace de trabajo. Conservar a temperatura ambiente.
- Antes de iniciar el aislamiento, lleve las columnas y muestras a temperatura ambiente y ajuste los volúmenes de la muestra a 1 ml con solución salina estéril amortiguada por fosfato (PBS), si es necesario. Precalentamiento 2 baños de agua o bloques de calefacción que contienen tubos centrífugas de 50 ml y tubos de recogida de 2 ml a 60 °C y 56 °C, respectivamente.
- A un tubo centrífuga de 50 ml, agregue 100 μL de Proteinase K, 1 mL de plasma y 0,8 ml de tampón Lysis que contenga 1,0 μg de ARN portador (preparado en el paso 3.1.4). Cierre el tubo centrífuga con una tapa y mezcle el contenido por vórtice de pulso durante 30 s, a la vez que garantiza un vórtice visible en el tubo. La mezcla exhaustiva de los contenidos es importante para una lisis eficiente.
NOTA: Inmediatamente después del vórtice, proceda al paso 3.4, sin demora. - Incubar la solución a 60 °C durante 30 min.
- Retire la tapa, agregue 1,8 ml del búfer de unión al tubo y mezcle a fondo con el vórtice de pulso durante 15-30 s después de colocar la tapa.
- Incubar la mezcla resultante durante 5 minutos sobre hielo e insertar la columna de membrana de sílice en el aparato de vacío que está conectado a la bomba de vacío. A continuación, inserte firmemente un extensor de tubo de 20 ml en la columna abierta para evitar fugas de muestra.
- Vierta cuidadosamente la mezcla incubada en el extensor de tubo de la columna y encienda la bomba de vacío. Después de que toda la mezcla de lysate se ejecute completamente a través de las columnas, apague la bomba de vacío, suelte la presión a 0 mbar y retire y deseche el extensor del tubo.
NOTA: Evitando la contaminación cruzada, el extensor del tubo debe desecharse cuidadosamente, para evitar su propagación sobre las columnas adyacentes. - Retire la columna del aparato de vacío, inserte en el tubo de recogida y centrífuga a 11.000 x g durante 30 s a temperatura ambiente, para eliminar cualquier lisato residual. Deseche el flujo a través.
- Añadir 600 μL de Wash Buffer-1 en la columna, centrífuga a 11.000 x g durante 1 min a temperatura ambiente, desechar el flujo a través.
- Añadir 750 μL de Wash Buffer-2 a la columna, centrífuga a 11.000 x g durante 1 min a temperatura ambiente, y desechar el flujo a través.
- Añadir 750 μL de etanol (96–100%) a la columna, centrífuga a 11.000 x g durante 1 min a temperatura ambiente y desechar el flujo a través.
- Centrífuga la columna a 20.000 x g durante 3 minutos, colocándola en un tubo de recogida limpio de 2 ml.
- Seque completamente el conjunto de columnas de membrana colocándolo en un nuevo tubo de recogida de 2 ml con la tapa abierta e incubando a 56 °C durante 10 minutos.
- Coloque la columna en un tubo de elución limpio de 1,5 ml. En el centro de la membrana de columna, aplicar 20-150 μL de tampón de elución e incubar a temperatura ambiente durante 3 minutos con la tapa cerrada.
NOTA: Asegúrese de que el búfer de elución esté equilibrado a temperatura ambiente. En caso de utilizar búfer de elución inferior a 50 μL, asegúrese de que se dispensa cuidadosamente en el centro de la membrana. Esto ayuda con la elución completa del ADN encuadernado. Sin embargo, el volumen de elución no es fijo y se puede cambiar según las aplicaciones de nivel inferior. El eluato recuperado puede ser de hasta 5 μL y ciertamente menor que el volumen de elución aplicado a la columna. - Centrífuga el eluato recuperado en una microcentrífuga a 20.000 x g durante 1 minuto para obtener los ácidos nucleicos, y almacenar a -20 °C.
4. Purificación del ADN genómico de buffy coat
NOTA: El kit comercial utilizado en este protocolo se menciona en la Tabla de materiales. Los búferes y reactivos mencionados en el protocolo siguiente, es decir, el búfer de lisis A, el búfer de lisis B, el búfer de lavado X, el búfer de lavado Y, el tampón de proteinasa, el búfer de elución y Proteinase K forman parte de este kit comercial.
- Preparación de los tampones y reactivos
PRECAUCIÓN: No agregue soluciones ácidas o lejía directamente a los residuos de preparación de muestras. Sales de guanidina presentes en Lysis buffer B y Wash buffer X cuando se combinan con lejía o ácidos, pueden producir compuestos altamente reactivos.- Tampone de lavado Y: Mezcle bien 12 ml de concentrado Wash Buffer Y con etanol de 48 ml (96-100%) para obtener 60 ml de lavado de trabajo Buffer Y. Almacenar a temperatura ambiente.
NOTA: 60 mL de lavado de trabajo Buffer Y es suficiente para procesar 100 muestras de capa de buffy y es estable durante 1 año. - Proteinasa K: Preparar la solución Proteinase K disolviendo 30 mg de Proteinasa K liofilizada en 1,35 ml de Proteinase Buffer.
NOTA: La solución de trabajo total de Proteinase K es suficiente para procesar 52 muestras de capa de buffy. La solución de trabajo Proteinase K se puede almacenar durante al menos 6 meses a -20 °C.
- Tampone de lavado Y: Mezcle bien 12 ml de concentrado Wash Buffer Y con etanol de 48 ml (96-100%) para obtener 60 ml de lavado de trabajo Buffer Y. Almacenar a temperatura ambiente.
- Pasos antes del inicio del procedimiento
- Equilibrar el abrigo buffy a temperatura ambiente.
- Ajuste el bloque de calor o el baño de agua a 56 °C.
- Suspenda la capa buffy en el búfer A de lisis para obtener un volumen final de 200 μL. A continuación, añadir 25 μL de solución Proteinase K, y 200 μL de Lysis buffer B. Mezclar por vórtice e incubar a 70 °C durante 10-15 min. Asegúrese de que las muestras estén completamente cubiertas con la solución de lisis.
NOTA: Para procesar series de muestras, Proteinase K y Lysis buffer A pueden ser premezclados 10-15 minutos antes del procedimiento, pero ya no antes de eso, ya que Proteinase K se auto-digiere en el búfer de lisis A sin sustrato. - Añadir 210 μL de etanol 96–100% a la mezcla y vórtice anteriores vigorosamente.
NOTA: La adición de etanol puede formar un precipitado encorvado; sin embargo, esto no afectará el aislamiento del ADN. Asegúrese de cargar el precipitado también en la columna, como se muestra en los pasos siguientes. - Cargue toda la muestra en la columna de sílice colocada en un tubo de recogida. Centrífuga durante 1 min a 11.000 x g. Coloque la columna en un nuevo tubo de recogida y deseche el tubo anterior junto con el flujo.
NOTA: Repita el paso de centrifugación si la muestra no se dibuja completamente a través de la matriz. - Agregue 500 μL de Wash buffer X, centrífuga durante 1 min a 11.000 x g, y deseche el flujo a través.
- Coloque la columna en el tubo de recolección, agregue 600 μL de Wash Buffer Y en la columna, centrífuga durante 1 min a 11.000 x g y deseche el flujo.
- Una vez más, coloque la columna en el tubo de recolección y centrífuga la columna durante 1 min a 20.000 x g para secar la membrana de sílice.
- Incubar la columna a temperatura ambiente durante 1 min, colocarla en un tubo de microcentrífuga de 1,5 ml, y luego añadir 100 μL de tampón de elución. Luego, eleje el ADN centrifugando durante 1 min a 11.000 x g y almacenar a -20 °C.
5. Cuantificación del CFDNA y el ADN genómico mediante fluorómetro
- Antes de iniciar el protocolo, realice los pasos siguientes.
- Diluir 2 μL de ADN genómico eluted (del paso 4.9) en proporciones 1:10 con agua libre de nucleasa ultrapura. Debido a las bajas concentraciones esperadas, no diluya las muestras de CFDNA del paso 3.15.
- Equilibrar el ensayo Standard #1 y ensayo Standard #2 a temperatura ambiente.
- Prepare un total de 6 tubos transparentes de paredes delgadas de tamaño de 0,5 ml.
NOTA: El protocolo presentado es para la cuantificación de 2 muestras de ADN genómico y 2 cfDNA, por lo tanto, 4 tubos para 4 muestras y este ensayo requiere 2 estándares. - Etiquete las tapas del tubo.
NOTA: El etiquetado en el lado del tubo podría interferir con la lectura. Además, los tubos estándar de ensayo están etiquetados cuidadosamente, ya que la calibración del fluorómetro requiere que las normas estén en el orden correcto. - Diluya el reactivo del ensayo en 1:200 con el búfer de ensayo para preparar la solución de trabajo. Para 4 muestras y 2 estándares, utilice 6 μL de reactivo de ensayo más 1.194 μL de tampón de ensayo para hacer 1.200 μL (200 μL en cada tubo) de solución de trabajo.
NOTA: No utilice un recipiente de vidrio, sino que utilice un tubo de plástico limpio. Cada tubo debe contener aproximadamente 200 μL del volumen final (un tubo estándar de ensayo debe contener 190 μL de la solución de trabajo, y el tubo de muestra debe contener 180-199 μL de la solución de trabajo). Se debe preparar una solución de trabajo suficiente para adaptarse a todos los estándares y muestras de ensayo. - En los tubos estándar de ensayo de trabajo, agregue 190 μL de solución de trabajo y 10 μL estándar de ensayo y mezcle la solución por vórtice durante 2-3 s. Evite la formación de burbujas dentro de la solución.
- En los tubos de muestra, añadir 198 μL solución de trabajo y 2 μL de CFDNA o ADN genómico. Mezcle la solución vórtice durante 2-3 s y manténgala incubada a temperatura ambiente durante 2 minutos.
- En la pantalla'Inicio'del instrumento del fluorómetro, pulse'ADN'y seleccione'Ensayo de alta sensibilidad dsDNA',para mostrar la pantalla'Estándares',luego pulse'Sí'en la pantalla del fluorómetro 'Estándares' para leer los estándares.
- En la cámara de muestra, inserte el ensayo Estándar #1 tubo, cierre la tapa y pulse 'Leer'. Retire el tubo una vez finalizada la lectura (aproximadamente 3 s) y repita el mismo paso para #2 estándar.
- Se muestra una pantalla de muestra después de la finalización del proceso de calibración, luego inserte un tubo de muestra y repita el paso '5.8'. A continuación, la "pantalla de muestra" mostrará un valor que corresponde a la concentración de la muestra después de la dilución en el tubo de muestra.
- Para cada paso de repetición de muestra '5.9', hasta que se lean todas las muestras.
- Utilice la siguiente ecuación para calcular la concentración real de la muestra.
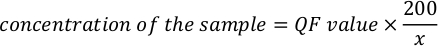
NOTA: Los valores de ensayo están en ng/mL y corresponden a la concentración después de la dilución en el tubo de ensayo. Ecuación mencionada en el paso anterior 5.11, valor QF es el valor dado por el instrumento fluorómetro, y x es el número de microlitros de muestra añadidos al tubo de ensayo. Las unidades para los valores QF generados por la ecuación son similares al valor proporcionado por el fluorómetro. Por ejemplo, si el valor del fluorómetro está en ng/mL, las unidades para la concentración calculadas por la ecuación son ng/mL.
6. Distribución del tamaño del fragmento de ADN de cfDNA por analizador de fragmentos
- El paso antes de iniciar el procedimiento: Equilibrar el concentrado de tinte de ADN y la matriz de gel de ADN a temperatura ambiente durante 30 minutos.
- Preparación de la mezcla de tinte de gel
PRECAUCIÓN: Manejar soluciones con precaución como DMSO se sabe para facilitar la entrada de moléculas orgánicas en los tejidos.- Descongelar completamente el DMSO vórtice el vial concentrado de tinte de ADN durante 10 s. Pipetear 15 μL de este concentrado en un vial de matriz de gel de ADN y almacenar a 4 °C en la oscuridad.
- Una vez más, vórtice el vial tapado durante 10 s hasta que se visualiza la mezcla del gel y el tinte.
- Vierta la mezcla en un filtro de giro en el receptáculo superior.
- Microcentrífuga el filtro de espín a 2.240 x g ± 20% durante 10 minutos a temperatura ambiente.
- Etiquete el tinte de gel preparado en el tubo y deseche el filtro, según buenas prácticas de laboratorio. Etiquete el tubo y registre la fecha de preparación.
NOTA: Deseche el filtrado según buenas prácticas de laboratorio. La mezcla de tinte de gel se puede utilizar para 5 chips de ADN de alta sensibilidad (SA). Si no se utiliza durante más de 1 h, guárdelo a 4 °C. El almacenamiento en la oscuridad es posible hasta 6 semanas.
- Para cargar la mezcla de tinte de gel, asegúrese de la posición de la placa base de la estación de cebado de viruta y ajuste el clip en la posición más baja.
- Eequilibra la mezcla de tinte de gel a temperatura ambiente durante 30 minutos, mientras monitorea la exposición a la luz.
- Tome un nuevo chip de ADN HS de una bolsa sellada y colóquelo en la estación de cebado de virutas, luego retire 9.0 μL de la mezcla de tinte de gel y prescinda en la parte inferior del pozo de chip, marcado como 'G'.
NOTA: Dibuje la mezcla de tinte de gel, evitando las partículas que pueden acumularse en la parte inferior del vial. Mientras dispensa bien la mezcla de tinte de gel en el chip de ADN HS, inserte la punta de la pipeta por completo, para evitar la formación de grandes burbujas de aire. Además, tocar la pipeta en los bordes del pozo producirá malos resultados. - Coloque el émbolo a 1 ml y cierre la estación de cebado de virutas. Asegúrese de que el bloqueo del pestillo haga clic y establezca el temporizador en 60 s, luego presione el émbolo hacia abajo hasta que esté sujetado por el clip, y exactamente después de 60 s, suelte el émbolo con el mecanismo de liberación del clip.
- Cuando el émbolo retroceda al menos a la marca de 0,3 ml, espere 5 s y, a continuación, tire lentamente hacia atrás hasta la posición de 1 ml, luego abra la estación de cebado de virutas y retire de nuevo 9,0 μL de la mezcla de tinte de gel y dispense en la parte inferior del chip de ADN del SA, marcado como 'G'.
- Para cargar el marcador de ADN, dispense 5 μL del marcador de ADN en el pozo, marcado con el símbolo de escalera. Repita el procedimiento para todos los 11 pozos de muestra.
- Para cargar la escalera y las muestras, dispense 1 μL de la escalera de ADN en el pozo, marcada con el símbolo de escalera y luego agregue 1 μL de muestra (pozos usados) o 1 μL de marcador (pozos no utilizados) en todos los 11 pozos de muestra.
- Vórtice el chip de ADN HS para 60 s a 2.400 rpm colocando el chip horizontalmente en el adaptador. Asegúrese de que la protuberancia que fija el chip de ADN del SA no esté dañada durante el vórtice.
- Para insertar el chip de ADN HS en el instrumento del analizador de fragmentos, abra la tapa y asegúrese de que el cartucho de electrodo esté correctamente insertado, y el selector de virutas se coloca en "DsHigh Sensitivity DNA" en el instrumento del analizador de fragmentos.
- Monte cuidadosamente el chip de ADN del SA en el receptáculo, que sólo cabe de una manera, luego pierda la tapa asegurándose de que el cartucho de electrodo se ajuste exactamente a los pozos del chip de ADN del SA.
- La pantalla en la pantalla de software del analizador de fragmentos indica el chip de ADN HS insertado y la tapa cerrada, a través del icono de chip en la parte superior izquierda de la pantalla.
- Para iniciar la ejecución del chip de ADN del SA, seleccione el ensayo de alta sensibilidad dsDNA en el menú'Ensayo'en la pantalla del instrumento, luego llene correctamente la tabla de nombres de muestra alimentando información como nombres de muestra y comentarios e inicie la ejecución del chip haciendo clic en el botón'Inicio' en la parte superior derecha de la pantalla.
- Limpieza de electrodos después de una carrera de chip de ADN del SA: Retire inmediatamente el chip de ADN del SA utilizado, tan pronto como se complete el ensayo y deseche de él de acuerdo con las buenas prácticas de laboratorio. Realice el siguiente procedimiento para garantizar que los electrodos estén limpios, sin restos de residuos del ensayo anterior.
- Llene lentamente 350 μL de agua de grado de análisis desionizado en uno de los pozos limpiadores de electrodos y coloque el limpiador de electrodos en el instrumento del analizador de fragmentos abriendo la tapa y luego cierre la tapa y espere unos 10 s.
- Retire el limpiador de electrodos abriendo la tapa y espere otros 10 s, para que el agua de los electrodos se evapore antes de cerrar la tapa.
Resultados
Separación por plasma
8.5-9 mL de sangre recolectada en tubos conservantes cfDNA o cfRNA produce alrededor de ~4 ml de plasma en volumen. El volumen de plasma separado de la sangre recolectada en tubos EDTA puede variar dependiendo de la temperatura. La exposición de tubos EDTA que contienen sangre a una temperatura superior a 37 °C conduce a una disminución del rendimiento del volumen plasmático44.
Resultados del ensayo del fluorómetro...
Discusión
La recolección de sangre de un paciente en un tubo, envío y almacenamiento son pasos iniciales cruciales en la biopsia líquida. El manejo inadecuado puede afectar la calidad del plasma y, por lo tanto, puede interferir con los resultados de la biopsia líquida47. Si se recoge una muestra de sangre en un tubo sanguíneo EDTA, el plasma debe separarse dentro de las dos horas posteriores a la recolección de sangre para evitar la lisis de los WBC y liberar su ADN genómico en el plasma
Divulgaciones
Los autores declaran que no tienen intereses financieros competidores.
Agradecimientos
Los autores desean agradecer a los miembros del Laboratorio de Genómica del Cáncer y Biocomputación de Enfermedades Complejas por sus agudas aportaciones observacionales y su participación en múltiples debates en diferentes etapas de este proyecto. El apoyo financiero incluye la Asociación contra el Cáncer de Israel (subvención ICA para M.F-M 2017-2019) y la concesión kamin de la Autoridad de Innovación de Israel (para M.F-M.).
Materiales
| Name | Company | Catalog Number | Comments |
| 2100 Bioanalyzer Instrument | Agilent Technologies, Inc. | G2939BA | The 2100 Bioanalyzer system is an established automated electrophoresis tool for the sample quality control of biomolecules. |
| Adjustable Clip for Priming Station | Agilent Technologies, Inc. | 5042-1398 | Used in combination with syringe to apply defined pressure for chip priming. |
| Agilent High Sensitivity DNA Kit | Agilent Technologies, Inc. | 5067-4626 | The High Sensitivity DNA assays are often used for sample quality control for next-generation sequencing libraries |
| cf-DNA/cf-RNA Preservative Tubes | Norgen Biotek Corp. | 63950 | Norgen's cf-DNA/cf-RNA Preservative Tubes are closed, evacuated plastic tubes for the collection and the preservation of cf-DNA, circulating tumor DNA, cf-RNA and circulating tumor cells in human whole blood samples during storage and shipping |
| Chip Priming Station | Agilent Technologies, Inc. | 5065-4401 | Used to load gel matrix into a chip with a syringe provided with each assay kit— used for RNA, DNA, and protein assays. Includes priming station, stop watch, and 1 syringe clip |
| Electrode Cleaner Kit | Agilent Technologies, Inc. | 5065-9951 | Prevents cross-contamination. Removes bacterial or protein contaminants from electrodes. |
| Filters for Gel Matrix | Agilent Technologies, Inc. | 185-5990 | Used for proper mixing of DNA dye concentrate and DNA gel matrix |
| IKA Basic Chip Vortex | IKA-Werke GmbH & Co. KG | MS-3-S36 | Used for proper mixing of DNA ladder and DNA sample on Bioanalyzer assay chips |
| NucleoSpin Tissue kit | MACHEREY-NAGEL | 740952.5 | With the NucleoSpin Tissue kit, genomic DNA can be prepared from tissue, cells (e.g., bacteria), and many other sources. |
| QIAamp circulating nucleic acid kit | Qiagen | 55114 | The QIAamp Circulating Nucleic Acid Kit enables efficient purification of these circulating nucleic acids from human plasma or serum and other cell-free body fluids. |
| QIAvac 24 Plus vacuum manifold | Qiagen | 19413 | The QIAvac 24 Plus vacuum manifold is designed for vacuum processing of QIAGEN columns in parallel. |
| QIAvac Connecting System | Qiagen | 19419 | In combination with the QIAvac Connecting System, the QIAvac 24 Plus vacuum manifold can be used as a flow-through system. The sample flow-through, containing possibly infectious material, is collected in a separate waste bottle. |
| Qubit 2.0 fluorometer | Invitrogen | Q32866 | The Qubit 2.0 Fluorometer is an easy-to-use, analytical instrument designed to work with the Qubit assays for DNA, RNA, and protein quantitation. |
| Qubit assay tubes | Thermo Fisher Scientific | Q32856 | Qubit assay tubes are 500 µL thin-walled polypropylene tubes for use with the Qubit Fluorometer. |
| Qubit dsDNA HS Assay Kit | Thermo Fisher Scientific | Q32851 | The Qubit dsDNA HS (High Sensitivity) Assay Kit is designed specifically for use with the Qubit Fluorometer. The assay is highly selective for double-stranded DNA (dsDNA) over RNA and is designed to be accurate for initial sample concentrations from 10 pg/µL to 100 ng/µL. |
| Vacuum Pump | Qiagen | 84010 | used for vacuum processing of QIAGEN columns |
| Miscellaneous | |||
| 50 ml centrifuge tubes | |||
| Crushed ice | |||
| Ethanol (96–100%) | |||
| Heating block or similar at 56 °C (capable of holding 2 ml collection tubes) | |||
| Isopropanol (100%) | |||
| Microcentrifuge | |||
| Phosphate-buffered saline (PBS) | |||
| Pipettes (adjustable) | |||
| Sterile pipette tips (pipette tips with aerosol barriers are recommended to help prevent cross-contamination) | |||
| Water bath or heating block capable of holding 50 mL centrifuge tubes at 60 °C |
Referencias
- Campbell, P. J., et al. Pan-cancer analysis of whole genomes. Nature. 578 (7793), 82-93 (2020).
- Liotta, L., Petricoin, E. Molecular profiling of human cancer. Nature Reviews Genetics. 1 (1), 48-56 (2000).
- Balamurali, D., et al. ChiTaRS 5.0: the comprehensive database of chimeric transcripts matched with druggable fusions and 3D chromatin maps. Nucleic Acids Research. 48 (1), 825-834 (2019).
- Trédan, O., et al. Molecular screening program to select molecular-based recommended therapies for metastatic cancer patients: Analysis from the ProfiLER trial. Annals of Oncology. 30 (5), 757-765 (2019).
- Oliveira, K. C. S., et al. Current perspectives on circulating tumor DNA, precision medicine, and personalized clinical management of cancer. Molecular Cancer Research. 18 (4), 517-528 (2020).
- Siegal, T. Clinical impact of molecular biomarkers in gliomas. Journal of Clinical Neuroscience. 22 (3), 437-444 (2015).
- Komori, T. The 2016 WHO Classification of Tumours of the Central Nervous System: The Major Points of Revision. Neurologia medico-chirurgica. 57 (7), 301-311 (2017).
- Duffy, M. J., O'Donovan, N., Crown, J. Use of molecular markers for predicting therapy response in cancer patients. Cancer Treatment Reviews. 37 (2), 151-159 (2011).
- Saenz-Antoñanzas, A., et al. Liquid Biopsy in Glioblastoma: Opportunities, Applications and Challenges. Cancers. 11 (7), 950 (2019).
- Marrugo-Ramírez, J., Mir, M., Samitier, J. Blood-Based Cancer Biomarkers in Liquid Biopsy: A Promising Non-Invasive Alternative to Tissue Biopsy. International Journal of Molecular Sciences. 19 (10), 2877 (2018).
- Pantel, K., Alix-Panabières, C. Liquid biopsy in 2016: Circulating tumour cells and cell-free DNA in gastrointestinal cancer. Nature Reviews Gastroenterology & Hepatology. 14 (2), 73-74 (2017).
- Bronkhorst, A. J., et al. The emerging role of cell-free DNA as a molecular marker for cancer management. Biomolecular Detection and Quantification. 17, 100087 (2019).
- Cescon, D. W., Bratman, S. V., Chan, S. M., Siu, L. L. Circulating tumor DNA and liquid biopsy in oncology. Nature Cancer. 1 (3), 276-290 (2020).
- Palmirotta, R., et al. Liquid biopsy of cancer: a multimodal diagnostic tool in clinical oncology. Therapeutic Advances in Medical Oncology. 10, 175883591879463 (2018).
- Cohen, J. D. J., et al. Detection and localization of surgically resectable cancers with a multi-analyte blood test. Science. 359 (6378), 926-930 (2018).
- Wan, J. C. M., et al. Liquid biopsies come of age: towards implementation of circulating tumour DNA. Nature Reviews Cancer. 17 (4), 223-238 (2017).
- Heitzer, E., Haque, I. S., Roberts, C. E. S., Speicher, M. R. Current and future perspectives of liquid biopsies in genomics-driven oncology. Nature Reviews Genetics. 20 (2), 71-88 (2018).
- Thierry, A. R., et al. Origins, structures, and functions of circulating DNA in oncology. Cancer and Metastasis Reviews. 35 (3), 347-376 (2016).
- Buscail, E., et al. High Clinical Value of Liquid Biopsy to Detect Circulating Tumor Cells and Tumor Exosomes in Pancreatic Ductal Adenocarcinoma Patients Eligible for Up-Front Surgery. Cancers. 11 (11), 1656 (2019).
- Heitzer, E., Ulz, P., Geigl, J. B. Circulating Tumor DNA as a Liquid Biopsy for Cancer. Clinical Chemistry. 61 (1), 112-123 (2015).
- Kustanovich, A., Schwartz, R., Peretz, T., Grinshpun, A. Life and death of circulating cell-free DNA. Cancer Biology and Therapy. 20 (8), 1057-1067 (2019).
- Crowley, E., Di Nicolantonio, F., Loupakis, F., Bardelli, A. Liquid biopsy: monitoring cancer-genetics in the blood. Nature Reviews Clinical Oncology. 10 (8), 472-484 (2013).
- Celec, P., et al. Cell-free DNA: the role in pathophysiology and as a biomarker in kidney diseases. Expert Reviews in Molecular Medicine. 20, (2018).
- Gautschi, O., et al. Origin and prognostic value of circulating KRAS mutations in lung cancer patients. Cancer Letters. 254 (2), 265-273 (2007).
- Bidard, F., et al. Detection rate and prognostic value of circulating tumor cells and circulating tumor DNA in metastatic uveal melanoma. International Journal of Cancer. 134 (5), 1207-1213 (2013).
- Chan, K. C. A., et al. Analysis of Plasma Epstein–Barr Virus DNA to Screen for Nasopharyngeal Cancer. New England Journal of Medicine. 377 (6), 513-522 (2017).
- Mao, L., et al. Detection of Oncogene Mutations in Sputum Precedes Diagnosis of Lung Cancer. Cancer Research. 54 (7), 1634-1637 (1994).
- De Mattos-Arruda, L., et al. Cerebrospinal fluid-derived circulating tumour DNA better represents the genomic alterations of brain tumours than plasma. Nature communications. 6 (1), 8839 (2015).
- Khier, S., Lohan, L. Kinetics of circulating cell-free DNA for biomedical applications: critical appraisal of the literature. Future science OA. 4 (4), 295 (2018).
- Misale, S., et al. Resistance to Anti-EGFR therapy in colorectal cancer: From heterogeneity to convergent evolution. Cancer Discovery. 4 (11), 1269-1280 (2014).
- Beddowes, E., Sammut, S. J., Gao, M., Caldas, C. Predicting treatment resistance and relapse through circulating DNA. Breast. 34, 31-35 (2017).
- Sacher, A. G., et al. Prospective Validation of Rapid Plasma Genotyping for the Detection of EGFR and KRAS Mutations in Advanced Lung Cancer. JAMA oncology. 2 (8), 1014-1022 (2016).
- Vaidyanathan, R., et al. Cancer diagnosis: from tumor to liquid biopsy and beyond. Lab on a Chip. 19 (1), 11-34 (2019).
- Kelly, P. Gliomas: Survival, origin and early detection. Surgical Neurology International. 1 (1), 96 (2010).
- Faria, G., Silva, E., Da Fonseca, C., Quirico-Santos, T. Circulating Cell-Free DNA as a Prognostic and Molecular Marker for Patients with Brain Tumors under Perillyl Alcohol-Based Therapy. International Journal of Molecular Sciences. 19 (6), 1610 (2018).
- Liu, M. C., et al. Sensitive and specific multi-cancer detection and localization using methylation signatures in cell-free DNA. Annals of Oncology. 31 (6), 745-759 (2020).
- Enko, D., Halwachs-Baumann, G., Kriegshäuser, G. Plasma free DNA: Evaluation of temperature-associated storage effects observed for roche cell-free DNA collection tubes. Biochemia Medica. 29 (1), 153-156 (2019).
- Streleckiene, G., et al. Effects of Quantification Methods Isolation Kits, Plasma Biobanking, and Hemolysis on Cell-Free DNA Analysis in Plasma. Biopreservation and Biobanking. 17 (6), 553-561 (2019).
- Thress, K. S., et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M. Nature Medicine. 21 (6), 560-562 (2015).
- Ward Gahlawat, A., et al. Evaluation of Storage Tubes for Combined Analysis of Circulating Nucleic Acids in Liquid Biopsies. International Journal of Molecular Sciences. 20 (3), 704 (2019).
- Lu, J. L., Liang, Z. Y. Circulating free DNA in the era of precision oncology: Pre- and post-analytical concerns. Chronic Diseases and Translational Medicine. 2 (4), 223-230 (2016).
- Iyapparaj, P., et al. Optimization of bacteriocin production by Lactobacillus sp. MSU3IR against shrimp bacterial pathogens. Aquatic Biosystems. 9 (1), 12 (2013).
- Ponti, G., et al. The value of fluorimetry (Qubit) and spectrophotometry (NanoDrop) in the quantification of cell-free DNA (cfDNA) in malignant melanoma and prostate cancer patients. Clinica Chimica Acta. 479, 14-19 (2018).
- Medina Diaz, I., et al. Performance of Streck cfDNA blood collection tubes for liquid biopsy testing. PLoS One. 11 (11), 0166354 (2016).
- Perkins, G., et al. Multi-Purpose Utility of Circulating Plasma DNA Testing in Patients with Advanced Cancers. PLoS One. 7 (11), 47020 (2012).
- Mouliere, F., et al. Multi-marker analysis of circulating cell-free DNA toward personalized medicine for colorectal cancer. Molecular Oncology. 8 (5), 927-941 (2014).
- Trigg, R. M., Martinson, L. J., Parpart-Li, S., Shaw, J. A. Factors that influence quality and yield of circulating-free DNA: A systematic review of the methodology literature. Heliyon. 4 (7), 00699 (2018).
- Risberg, B., et al. Effects of Collection and Processing Procedures on Plasma Circulating Cell-Free DNA from Cancer Patients. Journal of Molecular Diagnostics. 20 (6), 883-892 (2018).
- Markus, H., et al. Evaluation of pre-analytical factors affecting plasma DNA analysis. Scientific Reports. 8 (1), 7375 (2018).
- Chen, Z., et al. Comprehensive Evaluation of the Factors Affecting Plasma Circulating Cell-Free DNA Levels and Their Application in Diagnosing Nonsmall Cell Lung Cancer. Genetic Testing and Molecular Biomarkers. 23 (4), 270-276 (2019).
- Schwarzenbach, H., Hoon, D. S. B., Pantel, K. Cell-free nucleic acids as biomarkers in cancer patients. Nature Reviews Cancer. 11 (6), 426-437 (2011).
- Malyuchenko, N. V., et al. PARP1 Inhibitors: antitumor drug design. Acta Naturae. 7 (3), 27-37 (2015).
- Fleischhacker, M., Schmidt, B. Circulating nucleic acids (CNAs) and cancer-A survey. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1775 (1), 181-232 (2007).
- Jung, K., Fleischhacker, M., Rabien, A. Cell-free DNA in the blood as a solid tumor biomarker—A critical appraisal of the literature. Clinica Chimica Acta. 411 (21-22), 1611-1624 (2010).
- Frenkel-Morgenstern, M., et al. ChiTaRS: a database of human, mouse and fruit fly chimeric transcripts and RNA-sequencing data. Nucleic Acids Research. 41, 142-151 (2013).
- Frenkel-Morgenstern, M., et al. ChiTaRS 2.1--an improved database of the chimeric transcripts and RNA-seq data with novel sense-antisense chimeric RNA transcripts. Nucleic Acids Research. 43, 68-75 (2015).
- Gorohovski, A., et al. ChiTaRS-3.1-the enhanced chimeric transcripts and RNA-seq database matched with protein-protein interactions. Nucleic Acids Research. 45 (1), 790-795 (2017).
- Tate, J. G., et al. COSMIC: the Catalogue Of Somatic Mutations In Cancer. Nucleic Acids Research. 47 (1), 941-947 (2019).
- Brennan, C. W., et al. The somatic genomic landscape of glioblastoma. Cell. 155 (2), 462-477 (2013).
- Szopa, W., Burley, T. A., Kramer-Marek, G., Kaspera, W. Diagnostic and Therapeutic Biomarkers in Glioblastoma: Current Status and Future Perspectives. BioMed Research International. 2017, 1-13 (2017).
- Salesse, S., Verfaillie, C. M. BCR/ABL: from molecular mechanisms of leukemia induction to treatment of chronic myelogenous leukemia. Oncogene. 21 (56), 8547-8559 (2002).
- Frenkel-Morgenstern, M., Valencia, A. Novel domain combinations in proteins encoded by chimeric transcripts. Bioinformatics. 28 (12), 67-74 (2012).
- Frenkel-Morgenstern, M., et al. Chimeras taking shape: Potential functions of proteins encoded by chimeric RNA transcripts. Genome Research. 22 (7), 1231-1242 (2012).
- Simon, M., et al. TERT promoter mutations: a novel independent prognostic factor in primary glioblastomas. Neuro-Oncology. 17 (1), 45-52 (2015).
- Waitkus, M. S., Diplas, B. H., Yan, H. Isocitrate dehydrogenase mutations in gliomas. Neuro-Oncology. 18 (1), 16-26 (2016).
- Kindler, T., Meyer, R. G., Fischer, T. BCR-ABL as a target for novel therapeutic interventions. Expert Opinion on Therapeutic Targets. 6 (1), 85-101 (2002).
- Overman, M. J., et al. Use of research biopsies in clinical trials: are risks and benefits adequately discussed. Journal of Clinical Oncology Official Journal of the American Society of Clinical Oncology. 31 (1), 17-22 (2013).
- Vanderlaan, P. A., et al. Success and failure rates of tumor genotyping techniques in routine pathological samples with non-small-cell lung cancer. Lung Cancer. 84 (1), 39-44 (2014).
- Stewart, C. M., Tsui, D. W. Y. Circulating cell-free DNA for non-invasive cancer management. Cancer Genetics. 228-229, 169-179 (2018).
- Normanno, N., et al. The liquid biopsy in the management of colorectal cancer patients: Current applications and future scenarios. Cancer Treatment Reviews. 70, 1-8 (2018).
- Hufnagl, C., et al. Evaluation of circulating cell-free DNA as a molecular monitoring tool in patients with metastatic cancer. Oncology Letters. 19 (2), 1551-1558 (2020).
- Petit, J., et al. Cell-Free DNA as a Diagnostic Blood-Based Biomarker for Colorectal Cancer: A Systematic Review. The Journal of Surgical Research. 236, 184-197 (2019).
- Poulet, G., Massias, J., Taly, V. Liquid Biopsy: General Concepts. Acta Cytologica. 63 (6), 449-455 (2019).
- Alix-Panabières, C. The future of liquid biopsy. Nature. 579 (7800), 9 (2020).
- Eisenstein, M. Could liquid biopsies help deliver better treatment. Nature. 579 (7800), 6-8 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados