Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kanser Hastalarının Kan Plazma Örneklerinde Hücresiz DNA Tespiti
Bu Makalede
Özet
Bu yazıda kan toplama, plazma ve buffy kat ayırma, cfDNA ve germline DNA ekstraksiyonu, cfDNA veya germline DNA'nın nicelleştirilmesi ve cfDNA parça zenginleştirme analizi dahil olmak üzere invaziv olmayan sıvı biyopsi tekniği için ayrıntılı bir protokol sunuyoruz.
Özet
Kanser hastalarının tümörlerindeki mutasyonların belirlenmesi hastalık yönetiminde çok önemli bir adımdır. Bu mutasyonlar tümör tanısının yanı sıra kanser hastalarında tedavi seçimi ve yanıtı için biyobelirteç görevi görür. Tümör mutasyonlarını tespit etmek için mevcut altın standart yöntem, tümör biyopsileri yoluyla tümör DNA'sının genetik testini içerir. Ancak bu invaziv yöntemin tümör mutasyon repertuarının takip testi olarak tekrar tekrar yapılması zordur. Sıvı biyopsisi, tümör mutasyonlarını kullanımı kolay ve invaziv olmayan bir biyopsi yaklaşımı olarak tespit etmek için yeni ve gelişmekte olan bir tekniktir.
Kanser hücreleri hızla çoğalır. Buna paralel olarak, çok sayıda kanser hücresine apoptoz geçiriliyor. Bu hücrelerden elde edilen döküntüler, tümör DNA mutasyonları taşıyan hücresiz DNA (cfDNA) parçaları adı verilen ince parçalanmış DNA parçalarıyla birlikte hastanın dolaşım sistemine salınır. Bu nedenle, sıvı biyopsi tekniği kullanılarak CFDNA bazlı biyobelirteçlerin tanımlanması için kanser hastalarından kan örnekleri toplanır, ardından plazma ve buffy coat ayrılması yapılır. Daha sonra, plazma cfDNA'nın izolasyonu için işlenir ve ilgili buffy kat hastanın genomik DNA'sının izolasyonu için işlenir. Her iki nükleik asit örneği de daha sonra miktarları ve kaliteleri için kontrol edilir; ve yeni nesil dizileme (NGS) teknikleri kullanılarak mutasyonlar için analiz edildi.
Bu yazıda, sıvı biyopsisi için kan alma, plazma ve buffy kat ayırma, cfDNA ve germline DNA ekstraksiyonu, cfDNA veya germline DNA'nın nicelleştirilmesi ve cfDNA parça zenginleştirme analizi dahil olmak üzere ayrıntılı bir protokol sunuyoruz.
Giriş
Teknolojik gelişmeler yüzlerce kanser genomunun ve transkriptomlarının dizilimine yol açmıştır1. Bu, farklı kanser türleri 2'deki moleküler değişikliklerin manzaralarının anlaşılmasına katkıdabulunmuştur. Bu manzaralar üzerinde yapılan diğer çalışmalar, apoptoz yollarını seri olarak bozarak kanser veya tümör ilerlemesinde rol oynayan sıralı somatik değişiklikler ve gen-gen füzyonları3'ün karakterize olmasına yardımcı oldu4. Bu nedenle, somatik mutasyonlar ve gen-gen füzyonları, belirli bir tümör tip5için tek tek hastalarda biyobelirteç görevi görerek tümörler hakkında bilgi sağlayabilir , mevcut primer tümörlerin prognozunu6olarak tanımlayabilir, ikincil tümörleri moleküler değişikliklere göre kategorizeedebilir 7ve ilaçlanabilir tümör hedeflerini tanımlayabilir8. Bu tür bilgiler kanser hastaları için kişiselleştirilmiş tedavinin seçilmesinde ve olumlu ve olumsuz tedavi yanıtlarının belirlenmesinde kolaylaştırabilir9. Bununla birlikte, tümör dokusunun genomik profillenmesini tanımlamak için tümör materyali elde etmek invaziv bir prosedürdür10. Ayrıca, bir tümör biyopsisi heterojen tümörün sadece küçük bir kısmını içerir; ve bu nedenle, tüm tümörün moleküler profili için temsili olmayabilir11. Seri izleme ve tümör genotipleme, tümör biyopsi prosedürünün invazivliği ve bu prosedürlerden kaynaklanan güvenlik sorunları nedeniyle genellikle mümkün olmayan tümör dokularının tekrar tekrar toplanmasını gerektirir12.
Sıvı biyopsi tekniği ise son on yılda hassas onkolojide büyük ilgi gördü13,14. Esas olarak bu tekniğin invaziv olmamasından ve birden fazla zaman noktasında tekrarlanma olasılığından kaynaklanır, böylece hastalık kursları için kullanımı kolay ve güvenli bir izleme tekniği sağlar15,16. Sıvı biyopsisi, tümör hücrelerinin hızla çoğaldığı ve aynı anda birçoğunun apoptoz ve nekroz geçirdiği bir fenomene dayanmaktadır. Bu, apoptotik hücre kalıntılarının hastaların kanına salınmasına yol açar, apoptoz sırasında kesin boyutlarda kesilen DNA parçaları ile birlikte17. Kanserli olmayan hücrelerin apoptozları da hücresel kalıntılarının kana salınmasına yol açar, ancak bu hücrelerdeki apoptoz oranı tümör hücrelerinden nispeten daha düşüktür18. Sıvı biyopsi tekniğinin mantığı, kanda sürekli dolaşan DNA, RNA, proteinler ve tümör hücreleri14,19 gibi tümörle ilişkili molekülleri yakalamaktır. Bu moleküllerin analizi için Yeni Nesil Dizileme (NGS), dijital damlacık polimeraz zincir reaksiyonu (ddPCR), gerçek zamanlı PCR ve enzime bağlı immünosorbent test (ELISA) dahil olmak üzere çeşitli teknikler20 kullanılabilir. Sıvı biyopsi tekniği, tümör hücrelerinin özellikleri olan biyobelirteçlerin tanımlanmasını sağlar. Bu biyobelirteç molekülleri sadece bir tümörün belirli bölgelerinden değil, tümörün tüm bölümlerinden salınır21. Bu nedenle, sıvı biyopsisinde tanımlanan belirteçler, vücuttaki diğer tümörlere ek olarak, tüm heterojen tümörün moleküler profillemini temsil eder, böylece doku biyopsisi tabanlı tekniğe göre avantajlara sahiptir22.
CfDNA'nın dolaşımdaki kanda birkaç dakika ile 1-2 saat arasında değişen kısa bir yarı ömür süresivardır 23. Ancak cfDNA'nın kısa yarı ömrü, tedavi yanıtı ve dinamik tümör değerlendirmelerini değerlendirerek gerçek zamanlı analizleri kolaylaştırır. Tümörden türetilmiş cfDNA düzeyleri, cfDNA düzeyleri ile sağkalım sonuçları arasında bir ilişki olduğunu gösteren çeşitli çalışmalarla kanıtlanan tümör evresinin / boyutunun prognostikasyonunu göstermektedir24. Ayrıca, çalışmalar cfDNA'nın mevcut tümör belirteçlerinden daha iyi bir tahmin kapasitesine sahip olduğunu kanıtlamıştır25. CfDNA'nın prognostikasyonu kanser tedavisinden sonra daha da belirgindir, tedaviden sonra daha yüksek cfDNA seviyeleri, daha düşük bir sağkalım oranı ve tedaviye direnç ile iyi ilişkilidir. Tedaviyi takiben cfDNA'nın daha düşük seviyeleri genellikle pozitif tedavi yanıtına karşılık gelir. Ek olarak, cfDNA geleneksel algılama yöntemlerine göre tedavi yanıtının erken tespitini kolaylaştırır.
CfDNA, kanserle ilişkili mutasyonların erken teşhis olasılığını arttırır: erken evre hastalık15, semptomların başlangıcı26 ve kanser tanısından önce 2 yıla kadar27. CfDNA birden fazla tümör bölgesinden veya odaklardan salındığı için, analizi temsil ettiği tümör genomunun kapsamlı bir görünümünü sağlar28. Bu nedenle, cfDNA doku örneklerinde kaçırılmış olabilecek somatik mutasyonları tespit etmeyi sağlar29. Tümör içi heterojenlik ve subklonal mutasyonlar binlerce baza yayılan genomik bölgelerin derin dizilimi ile tespit edilebildiğinden, cfDNA'nın analizi farklı genomik imzalara sahip spesifik moleküler alt tiplerin ortaya çıkarılmasına olanak sağlar13. Doku örneği ile benzer düzeyde bilgi elde etmek için birçok katı biyopsiye ihtiyaç duyulacaktı.
Ayrıca, cerrahi tedavi ve/veya kemoterapi sonrası kolon, yumurtalık ve akciğer kanseri gibi lokalize bir hastalığı olan hastalarda cfDNA düzeylerinin kanser nüks ve tedavi sonuçları için güçlü bir prognostik belirteç olduğu gösterilmiştir20. Ayrıca, kolon, meme ve akciğer kanseri olan hastalarda, kandan cfDNA analizleri tümöre özgü değişiklikleri başarıyla tespit edebilir, bu da birkaç ay önceden nüksün kesin tahminine yol açtı13. Ayrıca, anti-EGFR tedavisi alan CRC'li hastalarda KRAS mutasyonları gibi tedavi direnci belirteçleri30; Çeşitli tedaviler ile tedavi sonrası meme kanseri olan hastalarda PIK3CA, MED1 veya EGFR gibi genler için VAF'lar31; ve EGFR hedefli TKIs32 ile tedavi edilen akciğer kanseri hastalarında EGFR T790M direnç mutasyonu cfDNA analizi ile de tanımlanabilir.
Özetle, cfDNA analizi onkoloji alanında hassas biyobelirteçleri tanımlamak için kullanılabilir13,33. Bu protokolde 3 glioma hastasının kan örnekleri ve 3 sağlıklı kontrolle WBC'lerden genomik DNA ve plazmadan CFDNA elde edildi. Glioma kanserinde, IDH, TERT, ATRX, EGFR ve TP53'teki mutasyonlar, glioma tümörlerinin erken tanısında yardımcı olabilecek, farklı glioma tümörlerini sınıflandırabilecek, bireysel hasta için doğru tedaviye rehberlik eden ve tedavi yanıtını anlayan prognostik belirteçler olarak hizmet vermektedir34,35. Bu genlerin mutasyon durumu kan türevi cfDNA kullanılarak tanımlanabilir. Bu yazıda, glioma kanserindeki mutasyonel değişiklikleri incelemek için kullanılan plazma türevi cfDNA'nın ayrıntılı bir protokolünü sunuyoruz12. Bu makalede açıklanan cfDNA tabanlı sıvı biyopsi protokolü, diğer birçok kanser türünde mutasyonel değişiklikleri incelemek için kullanılabilir. Ayrıca, yeni bir çalışma cfDNA bazlı sıvı biyopsinin 50 farklı kanser türünü tespit36.
Kan örneği toplama, depolama ve sevkiyat bu protokolde çok önemli adımlardır, çünkü bu adımlar sırasında kontrolsüz sıcaklık WBC'lerin lizizine neden olur, WBC'den plazmaya genomik DNA salınması ve prosedürün geri kalanını etkileyen cfDNA örneğinin kirlenmesine neden olur37. Kontrolsüz sıcaklığa bağlı hemoliz, PCR adımları38gibi cfDNA'nın aşağı akış numune hazırlama süreçlerini bozabilir. Serum plazma yerine yüksek oranda germline cfDNA içerir, ancak tümörle ilişkili cfDNA39için büyük bir arka plan gürültüsü sunar. Bu nedenle, tümörle ilişkili cfDNA'yı izole etmek için plazma uygun bir örnektir39. Kan alma tüpü içeren bir pıhtılaştırıcıya çekilen kan, plazmayı ayırmak ve CFDNA kontaminasyonünü önlemek için derhal veya iki saate kadar santrifüjlenmelidir. Bu protokolde, kan alma tüpleri içeren antikoagülanlara alternatif olan özel ticari cfDNA koruma kan alma tüpleri kullanılmaktadır (bkz. Malzeme Tablosu). Bu özel kan alma tüpleri cfDNA ve cfRNA'yı korur ve WBC'lerin lizizini ortam sıcaklığında 30 güne kadar ve 37 °C'de 8 güne kadar önler. Bu, bir kan örneği sevkiyatı sırasında ve plazma ve WBC ayrılana kadar uygun sıcaklığın korunmasını kolaylaştırır40.
Şu anda üç tür cfDNA ekstraksiyon metodolojisi vardır: faz izolasyonu, silikon-membran bazlı spin sütunu ve manyetik boncuk bazlı izolasyon41. Silikon-membran bazlı spin sütun yöntemi, diğer cfDNA ekstraksiyon yöntemlerine kıyasla yüksek bütünlüğe sahip yüksek miktarda cfDNA verdi42.
DNA'nın nicel değerlendirilmesi sıvı biyopsisinde temel bir gerekliliktir, kolay uygulanması ve geniş kullanımı için basit, uygun fiyatlı ve standartlaştırılmış bir prosedür geliştirmeye ihtiyaç vardır. CfDNA nicelemesi için yaygın olarak kullanılan üç yöntem spektrofotometrik, florometrik ve qPCR'dir. Florometrik yöntem doğruluk, maliyet ve iletim kolaylığı ile ilgili diğer yöntemlere göre daha iyi kanıtlanmıştır43.
CfDNA'nın bütünlüğü ve saflığı agarose elektroforez veya kılcal elektroforez ile tahmin edilebilir. Agarose elektroforez ne düşük cfDNA konsantrasyonunda hassasiyet gösterir ne de cfDNA'nın hassas parça boyutunu göstermek için yüksek çözünürlüğe sahiptir. Öte yandan, kılcal elektroforez, ilişkili zorlukların üstesinden gelmekle agarose elektroforez üzerinde bir avantaja sahiptir ve bu nedenle araştırmacılar tarafından cfDNA parça boyutu analizi için yaygın olarak kullanılmaktadır. Bu protokolde, izole edilmiş cfDNA'nın parça boyutu dağılımı otomatik kılcal elektroforez cihazı kullanılarak tahmin edilmiştir (bkz. Malzeme Tablosu).
Protokol
Kan alamadan önce, araştırmaya katılan deneklerden bilgilendirilmiş onay alınması ve alınması gerekir. Bu yazıda açıklanan araştırma Rabin Tıp Merkezi, İsrail etik komitesi (etik kod: 0039-17-RMC) ve Tıp Fakültesi Der Christian-Albrechts-Universität zu Kiel, Almanya etik komitesine (etik kod: D 405/14) uygun ve uygun olarak gerçeklenmiştir.
1. CfDNA veya cfRNA koruyucu tüplerde kan örneği toplama ve depolama
- Koruma tüplerini uygun şekilde etiketle
- Aşağıda açıklandığı gibi venipuncture için standart kurumsal protokole göre bir kan toplama seti ve bir tutucu kullanarak cf-DNA koruma tüpüne ~8 mL kan toplayın (bkz. Malzeme Tablosu).
NOT: Kan alma setinin kullanılması, kanın tüpten olası geri akışını önleyebilir.- Hastayı kolu aşağı doğru hizalayın.
- Tüp içeriğinin kapak veya iğne ucuna temas etmesini sağlarken, kapağı yukarı dönük olarak tüpü dik tutun.
- Tüpe kan akmaya başladığında turnikeyi yavaşça serbest bırakın.
- Tüp kanla doldurulduktan hemen sonra (maksimum kapasite: 8,4 mL tam kan), numuneyi stabilize etmek için tüpü hafifçe ters çevirin (tüpü tutan kolun bileğini 180 ° aşağı ve geri çevirin).
NOT: Inversion, koruyucunun numuneyle eşit şekilde karıştırılmasını sağlar. Ancak, plazma hazırlamadan önce bile içeriği tekrar sallamayın. Koruyucuların kan örneği ile yetersiz karıştırılması, içeriğin dengesinin bozulmasına ve mikro pıhtı veya hemoliz oluşumuna yol açar. Bu aşamada, plazma ayrımı için protokole hemen devam edilebilir veya kan dolu tüpler ortam sıcaklığında (15-25 ° C) 30 güne kadar ve 37 ° C'de 8 güne kadar bekleyebilir.
2. Plazma ve buffy ceket ayırma ve depolama
- Plazmayı ayırmak için kan dolu koruma tüpünü oda sıcaklığında 20 dakika boyunca 425 x g'da santrifüjlayın.
NOT: Adım 2.2 ve 2.3 bir biyogüvenlik kabininde yapılmalıdır. - Üst plazma tabakasını, alt katmanları bozmadan, 1 mL aliquots içinde taze bir tüpe dikkatlice pipetleyin.
- Alt katmandaki RBC'lerden kaçınırken, bir sonraki buffy katını taze bir tüpe (katman RBC peletlerinin üzerinde bir halka olarak görünür) dikkatlice aktarın.
- Plazma ile 3. adıma ve buffy coat ile 4. Gerekirse ayrılmış içeriği -80 °C'de saklayın.
3. Dolaşımdaki cfDNA'nın 1 mL plazmadan arındırılması
NOT: Bu adım ticari bir kit ile gerçekleştirilir (bkz. Malzeme Tablosu). Tüm tamponlar kit ile birlikte verilir.
- Tamponların ve reaktiflerin hazırlanması
DİkKAT: Numune hazırlama atıklarına doğrudan asidik çözeltiler veya çamaşır suyu eklemeyin. Çamaşır suyu veya asitlerle birleştirildiğinde Liziz tamponu, Bağlama tamponu ve Yıkama Tamponu-1'de bulunan guanidin tuzları oldukça reaktif bileşikler üretebilir.- Bağlama tamponu: 500 mL çalışma Bağlama tamponu yapmak için 300 mL Bağlama tampon konsantresini 200 mL%100 izopropanol ile karıştırın. Oda sıcaklığında saklayın.
NOT: Bağlayıcı tampon, dolaşımdaki nükleik asitlerin silika zara en uygun şekilde bağlanmasını sağlar. Bağlama tamponunun 500 mL'si sırasıyla 276, 138, 92, 69 veya 55 numune 1, 2, 3, 4 veya 5 mL plazmanın işlenmesi için yeterlidir ve oda sıcaklığında 1 yıl boyunca stabildir. - Yıkama Tamponu-1: 44 mL çalışan Wash Buffer-1 yapmak için 19 mL Yıkama Tampon-1 konsantresini 25 mL%96-100 etanol ile karıştırın. Oda sıcaklığında saklayın.
NOT: Yıkama Tamponu-1, silika zara bağlı kirleticileri ortadan kaldırır. 44 mL çalışma Yıkama Tamponu-1, 1/2/3/4/5 mL plazmanın 73 örneğinin işlenmesi için yeterlidir ve oda sıcaklığında 1 yıl boyunca stabildir. - Yıkama Tamponu-2: 43 mL çalışan Wash Buffer-2 yapmak için 30 mL%96-100 etanol ile 13 mL Yıkama Tampon-2 konsantresini iyice karıştırın. Oda sıcaklığında saklayın.
NOT: Yıkama Tamponu-2, silika zara bağlı kirleticileri ortadan kaldırır. 43 mL çalışma Yıkama Tampon-2, ~56 numune 1/2/3/4/5 mL plazmanın işlenmesi için yeterlidir ve oda sıcaklığında 1 yıl boyunca stabildir. - 310 μg lyophilized taşıyıcı RNA içeren bir tüpe, 0,2 μg/ μL'lik bir taşıyıcı RNA çözeltisi hazırlamak için 1.550 μL Elution tamponu ekleyin. Taşıyıcı RNA'yı iyice çözdükten sonra, çözeltiyi uygun aliquotlara bölün ve –30 °C ila –15 °C'de saklayın. Bu aliquotları 3 defadan fazla dondurmayın. Tablo S1'degösterildiği gibi Lizis arabelleğine, Elution arabelleği içinde çözünmüş yeniden inşa edilmiş taşıyıcı RNA'yı ekleyin.
NOT: Taşıyıcı RNA doğrudan Lizis tamponunda çözülmediği için, önce bir Elution arabelleği ve daha sonra Lysis Buffer içinde çözülmesi gerekir. İlk olarak, örnekte çok az hedef molekül bulunduğunda silika membran-nükleik asitlerin bağlanması artar. İkincisi, büyük miktarlarda taşıyıcı RNA varlığı nedeniyle RNA bozulması riski azalır.
- Bağlama tamponu: 500 mL çalışma Bağlama tamponu yapmak için 300 mL Bağlama tampon konsantresini 200 mL%100 izopropanol ile karıştırın. Oda sıcaklığında saklayın.
- İzolasyona başlamadan önce, kolonları ve numuneleri oda sıcaklığına getirin ve gerekirse steril fosfat tamponlu salin (PBS) ile numune hacimlerini 1 mL'ye ayarlayın. Sırasıyla 60 °C ve 56 °C'ye kadar 50 mL santrifüj tüpleri ve 2 mL toplama tüpü içeren 2 su banyosu veya ısıtma bloğu ön ısıtma.
- 50 mL santrifüj tüpüne 100 μL Proteinaz K, 1 mL plazma ve 1,0 μg taşıyıcı RNA içeren 0,8 mL Lizis tamponu ekleyin (adım 3.1.4'te hazırlanmıştır). Santrifüj tüpünü bir kapakla kapatın ve tüpte görünür bir girdap sağlarken, içeriği 30 s boyunca darbe girdabı ile karıştırın. İçeriğin kapsamlı bir şekilde karıştırılması verimli liziz için önemlidir.
NOT: Girdaplamadan hemen sonra, gecikmeden 3.4 adımına geçin. - Çözeltiyi 60 °C'de 30 dakika kuluçkaya yatırın.
- Kapağı çıkarın, boruya 1,8 mL bağlama tamponu ekleyin ve kapağı yerleştirdikten sonra 15-30 sn boyunca darbe girdabı ile iyice karıştırın.
- Elde eden karışımı buz üzerinde 5 dakika kuluçkaya yatırın ve silika membran sütununu vakum pompasına bağlı vakum cihazına yerleştirin. Ardından, numune sızıntısını önlemek için açık kolona 20 mL tüp genişletici sıkıca yerleştirin.
- İnkübe karışımı dikkatlice kolonun tüp genişleticisine dökün ve vakum pompasını kapatın. Tüm lysate karışımı kolonlardan tamamen geçtikten sonra, vakum pompasını kapatın, basıncı 0 mbar'a bırakın ve tüp genişleticiyi çıkarın ve atın.
NOT: Çapraz kontaminasyondan kaçınarak, boru genişletici bitişik sütunlara yayılmasını önlemek için dikkatlice atılmalıdır. - Artık lysate'yi çıkarmak için kolonu vakum aparatından çıkarın, toplama tüpüne yerleştirin ve oda sıcaklığında 30 s için 11.000 x g'da santrifüjlayın. Akışı atın.
- Sütuna 600 μL Yıkama Tamponu-1 ekleyin, oda sıcaklığında 1 dakika boyunca 11.000 x g'da santrifüjleyin, akışı atın.
- Sütuna 750 μL Yıkama Tamponu-2 ekleyin, oda sıcaklığında 1 dakika boyunca 11.000 x g'da santrifüjleyin ve akışı atın.
- 750 μL etanol ekleyin (%96-100) kolona, oda sıcaklığında 1 dakika boyunca 11.000 x g'da santrifüjlayın ve akışı atın.
- Sütunu temiz bir 2 mL toplama tüpüne yerleştirerek 3 dakika boyunca 20.000 x g'da santrifüj edin.
- Membran kolon tertibatını kapağı açık ve 56 °C'de 10 dakika kuluçkaya yatırarak yeni bir 2 mL toplama tüpüne yerleştirerek tamamen kurutun.
- Sütunu temiz bir 1,5 mL elution tüpüne yerleştirin. Kolon zarının ortasına 20–150 μL Elution tampon uygulayın ve kapak kapalıyken oda sıcaklığında 3 dakika kuluçkaya yatırın.
NOT: Elution tamponun oda sıcaklığına göre dengelenmiş olduğundan emin olun. 50 μL'den az elution tamponu kullanılması durumunda, zarın ortasına dikkatlice dağıtıldığından emin olun. Bu, bağlı DNA'nın tamamen yağlanmasına yardımcı olur. Ancak, elution hacmi sabit değildir ve aşağı akış uygulamalarına göre değiştirilebilir. Kurtarılan elüat 5 μL'ye kadar ve kesinlikle sütuna uygulanan elution hacminden daha az olabilir. - Geri kazanılan elüjeni nükleik asitleri elüe etmek için 1 dakika boyunca 20.000 x g'da bir mikrosantrifüjde santrifüj edin ve -20 °C'de saklayın.
4. Buffy coat'dan genomik DNA'nın saflaştırılması
NOT: Bu protokolde kullanılan ticari kit Malzeme Tablosunda belirtilmiştir. Aşağıdaki protokolde belirtilen tamponlar ve reaktifler, yani Lizis tamponU A, Lizis tamponU B, Yıkama tamponu X, Yıkama Tamponu Y, Proteinaz Tamponu, Elution tamponu ve Proteinaz K bu ticari kitin bir parçasıdır.
- Tamponların ve reaktiflerin hazırlanması
DİkKAT: Numune hazırlama atıklarına doğrudan asidik çözeltiler veya çamaşır suyu eklemeyin. Lysis tampon B ve Wash tampon X'te bulunan guanidin tuzları çamaşır suyu veya asitlerle birleştirildiğinde oldukça reaktif bileşikler üretebilir.- Yıkama Tamponu Y: 12 mL Yıkama Tamponu Y konsantresinin 48 mL etanol (%96-100) ile karıştırılması 60 mL çalışma Yıkama Tamponu Y. Oda sıcaklığında saklayın.
NOT: 60 mL çalışma Yıkama Tamponu Y, 100 buffy kat numunesinin işlenmesi için yeterlidir ve 1 yıl boyunca stabildir. - Proteinaz K: 30 mg liyofilize Proteinaz K'yi 1,35 mL Proteinaz Tamponu içine eriterek Proteinaz K çözeltisi hazırlayın.
NOT: Proteinaz K'nin toplam çalışma çözeltisi, 52 buffy kat numunesinin işlenmesi için yeterlidir. Proteinaz K çalışma çözeltisi -20 °C'de en az 6 ay saklanabilir.
- Yıkama Tamponu Y: 12 mL Yıkama Tamponu Y konsantresinin 48 mL etanol (%96-100) ile karıştırılması 60 mL çalışma Yıkama Tamponu Y. Oda sıcaklığında saklayın.
- Yordamın başlatılmasından önceki adımlar
- Buffy paltoyu oda sıcaklığına dengele.
- Isı bloğunu veya su banyoyu 56 °C'ye ayarlayın.
- 200 μL'lik son bir hacim elde etmek için Lysis tamponU A'daki buffy coat'ı askıya alın. Daha sonra 25 μL Proteinaz K çözeltisi ve 200 μL Lysis tampon B ekleyin. Numunelerin tamamen liziz çözeltisi ile kaplanın.
NOT: Numune serilerinin işlenmesi için, Proteinaz K ve Lizis tamponU A işlemden 10-15 dakika önce önceden karıştırılabilir, ancak proteinaz K substrat olmadan Liziz tamponU A'da kendini sindirir. - Yukarıdaki karışıma 210 μL% 96-100 etanol ekleyin ve güçlü bir şekilde girdap ekleyin.
NOT: Etanol ilavesi telli bir çökeltebilir; ancak, bu DNA izolasyonu etkilemez. Aşağıdaki adımlarda gösterildiği gibi, çökeltmeyi sütuna da yüklediğinden emin olun. - Tüm numuneyi bir toplama tüpüne yerleştirilen silika sütununa yükleyin. 11.000 x g'da1 dakika santrifüj. Sütunu yeni bir toplama tüpüne yerleştirin ve önceki tüpü akışla birlikte atın.
NOT: Numune matristen tamamen çizilmezse santrifüjleme adımını tekrarlayın. - 500 μL Yıkama tamponu X ekleyin, 11.000 x g'da 1 dakika santrifüj ekleyin ve akışı atın.
- Sütunu toplama tüpüne yerleştirin, sütuna 600 μL Yıkama Tamponu Y ekleyin, 11.000 x g'da 1 dakika santrifüjleyin ve akışı atın.
- Yine, sütunu toplama tüpüne yerleştirin ve silika zarını kurutmak için sütunu 20.000 x g'da 1 dakika santrifüjlayın.
- Kolonu oda sıcaklığında 1 dakika kuluçkaya yatırın, 1,5 mL mikrosantrifüj tüpüne yerleştirin ve ardından 100 μL Elution tamponu ekleyin. Ardından, DNA'yı 11.000 x g'da 1 dakika santrifüjleyarak elüte edin ve -20 °C'de saklayın.
5. Florometre kullanılarak cfDNA ve genomik DNA'nın nicelleştirilmesi
- İletişim kuralını başlatmadan önce aşağıdaki adımları uygulayın.
- 2 μL eluted genomik DNA'yı (adım 4.9'dan itibaren) ultra saf çekirdeksiz su ile 1:10 oranlarında seyreltin. Beklenen düşük konsantrasyonlar nedeniyle, cfDNA örneklerini adım 3.15'ten seyreltmeyin.
- Test Standart #1 ve test Standart #2 oda sıcaklığına dengelayın.
- 0,5 mL boyutunda toplam 6 adet ince duvarlı şeffaf tüp hazırlayın.
NOT: Sunulan protokol 2 cfDNA ve 2 genomik DNA örneğinin ölçülmesi içindir, bu nedenle 4 örnek için 4 tüp ve bu test 2 standart gerektirir. - Tüpün kapaklarını etiketle.
NOT: Tüpün yan tarafındaki etiketleme okumayı engelleyebilir. Ek olarak, test standart tüpleri dikkatlice etiketlenir, çünkü florometrenin kalibrasyonu standartların doğru sırada olduğunu gerektirir. - Çalışma çözeltisini hazırlamak için tahlil reaktifini 1:200'de Test arabelleği ile seyreltin. 4 numune ve 2 standart için, 1.200 μL (her tüpte 200 μL) çalışma çözeltisi yapmak için 6 μL test reaktifi artı 1.194 μL Tahlil tamponu kullanın.
NOT: Cam kap kullanmayın, bunun yerine temiz bir plastik tüp kullanın. Her tüp son hacmin yaklaşık 200 μL'sini içermelidir (test standart tüpü çalışma çözeltisinin 190 μL'sini içermelidir ve numune tüpü çalışma çözeltisinin 180-199 μL'sini içermelidir). Tüm tahlil standartlarına ve numunelere uyum sağlayacak yeterli çalışma çözümü hazırlanmalıdır. - Çalışma test standart tüplerinde, 190 μL çalışma çözeltisi ve 10 μL test standardı ekleyin ve çözeltiyi 2-3 sn için girdapla karıştırın. Çözelti içinde kabarcıkların oluşumundan kaçının.
- Örnek tüplere 198 μL çalışma çözeltisi ve 2 μL cfDNA veya genomik DNA ekleyin. Çözeltiyi 2-3 sn boyunca girdapla karıştırın ve 2 dakika boyunca oda sıcaklığında inkübe tutun.
- Florometre aletinin 'Giriş' ekranında, 'DNA' ya basın ve 'dsDNA Yüksek HassasiyetLi Test'i seçin, 'Standartlar' ekranını görüntülemek için, ardından standartları okumak için florometre 'Standartları' ekranında 'Evet' tuşuna basın.
- Numune haznesinde, test Standart #1 tüpünü takın, kapağı kapatın ve'Oku'tuşuna basın. Okuma tamamlandıktan sonra tüpü çıkarın (yaklaşık 3 s) ve Standart #2 için aynı adımı tekrarlayın.
- Kalibrasyon işlemi tamamlandıktan sonra bir örnek ekran görüntülenir, ardından bir numune tüpü yerleştirin ve '5.8' adımını tekrarlayın. "Örnek ekran" daha sonra numune tüpünde seyreltme sonrası numunenin konsantrasyonuna karşılık gelen bir değer görüntüler.
- Her örnek için, tüm örnekler okunana kadar '5.9' adımlarını yineleyin.
- Örneğin gerçek konsantrasyonu hesaplamak için aşağıdaki denklemi kullanın.
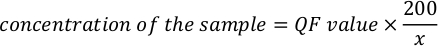
NOT: Tahlil değerleri ng/mL'dedir ve tahlil tüpünde seyreltme sonrası konsantrasyona karşılık gelir. Yukarıdaki adım 5.11'de belirtilen denklem, QF değeri florometre aletinin verdiği değerdir ve x, test tüpüne eklenen numunenin mikrolitre sayısıdır. Denklem tarafından oluşturulan QF değerlerinin birimleri florometre tarafından sağlanan değere benzer. Örneğin, florometrenin değeri ng/mL ise, denklem tarafından hesaplanan konsantrasyonun birimleri ng/mL'dir.
6. cfDNA'nın parça analizörü ile DNA parça boyutu dağılımı
- İşlemi başlatmadan önceki adım: DNA boya konsantresini ve DNA jel matrisini 30 dakika boyunca oda sıcaklığına aşındırın.
- Jel boya karışımının hazırlanması
DİkKAT: DMSO'nun organik moleküllerin dokulara girişini kolaylaştırdığı bilindiğinden çözeltileri dikkatli kullanın.- DNA boya konsantresi şişesini 10 sn boyunca girdaplayarak DMSO'yu iyice çözün. Pipet bu konsantrenin 15 μL'sini DNA jel matrisi şişesine dökülür ve karanlıkta 4 °C'de depolar.
- Yine, jel ve boyanın karıştırılması görselleştirilene kadar 10 s boyunca kapaklı şişeyi girdaplayın.
- Karışımı bir spin filtresine üst hazneye dökün.
- Oda sıcaklığında 10 dakika boyunca 2.240 x g ± %20 oranında spin filtresini mikrosantrifüjleyin.
- Hazırlanan jel boyayı tüpte etiketleyin ve iyi laboratuvar uygulamalarına göre filtreyi atın. Tüpü etiketle ve hazırlık tarihini kaydet.
NOT: Filtratları iyi laboratuvar uygulamalarına göre atın. Jel boya karışımı 5 Adet Yüksek Hassasiyetli (HS) DNA çipi için kullanılabilir. 1 saatten fazla kullanılmamışsa, 4 °C'de saklayın. Karanlıkta 6 haftaya kadar depolama mümkündür.
- Jel boya karışımını yüklemek için talaş astar istasyonunun taban plakasının konumunu sağlayın ve klipsi en düşük konumda ayarlayın.
- Işığa maruz kalmayı izlerken jel boya karışımını 30 dakika boyunca oda sıcaklığına dengelayın.
- Kapalı bir torbadan yeni bir HS DNA çipi alın ve talaş astar istasyonuna yerleştirin, ardından jel boya karışımının 9.0 μL'lik kısmını çıkarın ve çipin altına 'G' olarak işaretlenmiş olarak dağıtın.
NOT: Şişenin dibinde birikebilecek parçacıkları önleyerek jel boya karışımını çizin. Jel boya karışımını HS DNA çipine iyice dağıtırken, büyük hava kabarcıklarının oluşumunu önlemek için pipetin ucunu tamamen yerleştirin. Ayrıca, kuyunun kenarlarındaki pipete dokunmak kötü sonuçlar üretecektir. - Pistonu 1 mL'ye yerleştirin ve talaş astar istasyonunu kapatın. Mandal tıklamalarının kilidini emin olun ve zamanlayıcıyı 60 s'ye ayarlayın, ardından pistonu klips tarafından tutulana kadar bastırın ve tam olarak 60 s'den sonra pistonu klips bırakma mekanizmasıyla serbest bırakın.
- Piston en az 0,3 mL işaretine geri çekildiğinde, 5 s bekleyin ve ardından yavaşça 1 mL konumuna geri çekin, ardından talaş astar istasyonunu açın ve jel boya karışımının 9,0 μL'lik kısmını tekrar çıkarın ve HS DNA çipinin altına 'G' olarak işaretlenmiş olarak dağıtın.
- DNA işaretleyicisini yüklemek için, DNA işaretleyicisinin 5 μL'lik kısmını merdiven sembolüyle işaretlenmiş kuyuya dağıtın. Tüm 11 numune kuyusu için prosedürü tekrarlayın.
- Merdiveni ve örnekleri yüklemek için, dna merdiveninin 1 μL'sini kuyuya dağıtın, merdiven sembolüyle işaretleyin ve ardından tüm 11 numune kuyusuna 1 μL numune (kullanılmış kuyular) veya 1 μL marker (kullanılmayan kuyular) ekleyin.
- Çipi adaptöre yatay olarak yerleştirerek 2.400 rpm'de 60 s için HS DNA çipini Vortex. HS DNA çipini sabitleyen şişkinliğin girdap sırasında zarar görmemesini sağlayın.
- HS DNA çipini parça analiz cihazına takmak için kapağı açın ve elektrot kartuşunun düzgün takıldığından emin olun ve talaş seçici parça analiz cihazında 'dsHigh Sensitivity DNA' olarak konumlandırılmıştır.
- HS DNA çipini sadece tek yönlü olarak sığan kapaye dikkatlice monte edin, ardından elektrot kartuşunun HS DNA çipinin kuyularına tam olarak uyduğundan emin olarak kapağı kaybedin.
- Parça analizörü yazılım ekranındaki ekran, eklenen HS DNA çipini ve kapalı kapağı, ekranın sol üst kısmındaki yonga simgesinden gösterir.
- HS DNA çipi çalışmasını başlatmak için, gösterge ekranındaki 'Tahlisin' menüsünden dsDNA Yüksek HassasiyetliTahliliseçin, ardından örnek adlar ve yorumlar gibi bilgileri besleyerek örnek adlar tablosunu düzgün bir şekilde doldurun ve ekranın sağ üst tarafında yer alan'Başlat' butonuna tıklayarak çip çalışmasını başlatın.
- HS DNA çipi çalıştırıldıktan sonra elektrot temizliği: Test tamamlanır tamamlanmaz kullanılmış HS DNA çipini derhal çıkarın ve iyi laboratuvar uygulamalarına göre atın. Elektrotların önceki testten arta kalan kalıntılar olmadan temiz olduğundan emin olmak için aşağıdaki prosedürü uygulayın.
- Elektrot temizleyici kuyularından birine yavaşça 350 μL deiyonize analiz sınıfı su doldurun ve kapağı açarak elektrot temizleyiciyi parça analiz cihazına yerleştirin ve ardından kapağı kapatın ve yaklaşık 10 s bekleyin.
- Kapağı açarak elektrot temizleyiciyi çıkarın ve kapağı kapatmadan önce elektrotlardaki suyun buharlaşması için 10 s daha bekleyin.
Sonuçlar
Plazma Ayırma
CfDNA veya cfRNA koruyucu tüplerde toplanan 8,5-9 mL kan, hacim olarak yaklaşık 4 mL plazma verir. EDTA tüplerinde toplanan kandan ayrılan plazma hacmi sıcaklığa bağlı olarak değişebilir. Kan içeren EDTA tüplerinin 37 °C'den yüksek bir sıcaklıkta maruz kalması plazma hacmi veriminin düşmesine yol açar44.
Florometre Tahlil Sonuçları
glioma hastalarının her birinin 1 mL plazmasında cfDNA kon...
Tartışmalar
Bir hastanın kanının bir tüpte toplanması, sevkıyat ve depolanmasının sıvı biyopsisinde ilk adımlar çok önemli olduğunu. Yanlış kullanım plazmanın kalitesini bozabilir ve bu nedenle sıvı biyopsi sonuçlarına müdahale edebilir47. Bir EDTA kan tüpünde kan örneği toplanırsa, WBC'lerin lizizini önlemek ve genomik DNA'sının plazma48'esalınmasını önlemek için plazmanın kan toplandıktan sonraki iki saat içinde ayrılması gerekir. WBC'ler daha...
Açıklamalar
Yazarlar rakip finansal çıkarları olmadığını beyan ederler.
Teşekkürler
Yazarlar, Kanser Genomik ve Karmaşık Hastalıkların Biyo-Bilgisayar Laboratuvarı üyelerine, keskin gözlemsel girdileri ve bu projenin farklı aşamalarında birden fazla tartışmaya katılımları için teşekkür eder. Finansman desteği, İsrail Kanser Derneği 'ni (M.F-M 2017-2019 için ICA hibesi) ve İsrail İnovasyon Otoritesi'nin Kamin hibesini (M.F-M. için) içerir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2100 Bioanalyzer Instrument | Agilent Technologies, Inc. | G2939BA | The 2100 Bioanalyzer system is an established automated electrophoresis tool for the sample quality control of biomolecules. |
| Adjustable Clip for Priming Station | Agilent Technologies, Inc. | 5042-1398 | Used in combination with syringe to apply defined pressure for chip priming. |
| Agilent High Sensitivity DNA Kit | Agilent Technologies, Inc. | 5067-4626 | The High Sensitivity DNA assays are often used for sample quality control for next-generation sequencing libraries |
| cf-DNA/cf-RNA Preservative Tubes | Norgen Biotek Corp. | 63950 | Norgen's cf-DNA/cf-RNA Preservative Tubes are closed, evacuated plastic tubes for the collection and the preservation of cf-DNA, circulating tumor DNA, cf-RNA and circulating tumor cells in human whole blood samples during storage and shipping |
| Chip Priming Station | Agilent Technologies, Inc. | 5065-4401 | Used to load gel matrix into a chip with a syringe provided with each assay kit— used for RNA, DNA, and protein assays. Includes priming station, stop watch, and 1 syringe clip |
| Electrode Cleaner Kit | Agilent Technologies, Inc. | 5065-9951 | Prevents cross-contamination. Removes bacterial or protein contaminants from electrodes. |
| Filters for Gel Matrix | Agilent Technologies, Inc. | 185-5990 | Used for proper mixing of DNA dye concentrate and DNA gel matrix |
| IKA Basic Chip Vortex | IKA-Werke GmbH & Co. KG | MS-3-S36 | Used for proper mixing of DNA ladder and DNA sample on Bioanalyzer assay chips |
| NucleoSpin Tissue kit | MACHEREY-NAGEL | 740952.5 | With the NucleoSpin Tissue kit, genomic DNA can be prepared from tissue, cells (e.g., bacteria), and many other sources. |
| QIAamp circulating nucleic acid kit | Qiagen | 55114 | The QIAamp Circulating Nucleic Acid Kit enables efficient purification of these circulating nucleic acids from human plasma or serum and other cell-free body fluids. |
| QIAvac 24 Plus vacuum manifold | Qiagen | 19413 | The QIAvac 24 Plus vacuum manifold is designed for vacuum processing of QIAGEN columns in parallel. |
| QIAvac Connecting System | Qiagen | 19419 | In combination with the QIAvac Connecting System, the QIAvac 24 Plus vacuum manifold can be used as a flow-through system. The sample flow-through, containing possibly infectious material, is collected in a separate waste bottle. |
| Qubit 2.0 fluorometer | Invitrogen | Q32866 | The Qubit 2.0 Fluorometer is an easy-to-use, analytical instrument designed to work with the Qubit assays for DNA, RNA, and protein quantitation. |
| Qubit assay tubes | Thermo Fisher Scientific | Q32856 | Qubit assay tubes are 500 µL thin-walled polypropylene tubes for use with the Qubit Fluorometer. |
| Qubit dsDNA HS Assay Kit | Thermo Fisher Scientific | Q32851 | The Qubit dsDNA HS (High Sensitivity) Assay Kit is designed specifically for use with the Qubit Fluorometer. The assay is highly selective for double-stranded DNA (dsDNA) over RNA and is designed to be accurate for initial sample concentrations from 10 pg/µL to 100 ng/µL. |
| Vacuum Pump | Qiagen | 84010 | used for vacuum processing of QIAGEN columns |
| Miscellaneous | |||
| 50 ml centrifuge tubes | |||
| Crushed ice | |||
| Ethanol (96–100%) | |||
| Heating block or similar at 56 °C (capable of holding 2 ml collection tubes) | |||
| Isopropanol (100%) | |||
| Microcentrifuge | |||
| Phosphate-buffered saline (PBS) | |||
| Pipettes (adjustable) | |||
| Sterile pipette tips (pipette tips with aerosol barriers are recommended to help prevent cross-contamination) | |||
| Water bath or heating block capable of holding 50 mL centrifuge tubes at 60 °C |
Referanslar
- Campbell, P. J., et al. Pan-cancer analysis of whole genomes. Nature. 578 (7793), 82-93 (2020).
- Liotta, L., Petricoin, E. Molecular profiling of human cancer. Nature Reviews Genetics. 1 (1), 48-56 (2000).
- Balamurali, D., et al. ChiTaRS 5.0: the comprehensive database of chimeric transcripts matched with druggable fusions and 3D chromatin maps. Nucleic Acids Research. 48 (1), 825-834 (2019).
- Trédan, O., et al. Molecular screening program to select molecular-based recommended therapies for metastatic cancer patients: Analysis from the ProfiLER trial. Annals of Oncology. 30 (5), 757-765 (2019).
- Oliveira, K. C. S., et al. Current perspectives on circulating tumor DNA, precision medicine, and personalized clinical management of cancer. Molecular Cancer Research. 18 (4), 517-528 (2020).
- Siegal, T. Clinical impact of molecular biomarkers in gliomas. Journal of Clinical Neuroscience. 22 (3), 437-444 (2015).
- Komori, T. The 2016 WHO Classification of Tumours of the Central Nervous System: The Major Points of Revision. Neurologia medico-chirurgica. 57 (7), 301-311 (2017).
- Duffy, M. J., O'Donovan, N., Crown, J. Use of molecular markers for predicting therapy response in cancer patients. Cancer Treatment Reviews. 37 (2), 151-159 (2011).
- Saenz-Antoñanzas, A., et al. Liquid Biopsy in Glioblastoma: Opportunities, Applications and Challenges. Cancers. 11 (7), 950 (2019).
- Marrugo-Ramírez, J., Mir, M., Samitier, J. Blood-Based Cancer Biomarkers in Liquid Biopsy: A Promising Non-Invasive Alternative to Tissue Biopsy. International Journal of Molecular Sciences. 19 (10), 2877 (2018).
- Pantel, K., Alix-Panabières, C. Liquid biopsy in 2016: Circulating tumour cells and cell-free DNA in gastrointestinal cancer. Nature Reviews Gastroenterology & Hepatology. 14 (2), 73-74 (2017).
- Bronkhorst, A. J., et al. The emerging role of cell-free DNA as a molecular marker for cancer management. Biomolecular Detection and Quantification. 17, 100087 (2019).
- Cescon, D. W., Bratman, S. V., Chan, S. M., Siu, L. L. Circulating tumor DNA and liquid biopsy in oncology. Nature Cancer. 1 (3), 276-290 (2020).
- Palmirotta, R., et al. Liquid biopsy of cancer: a multimodal diagnostic tool in clinical oncology. Therapeutic Advances in Medical Oncology. 10, 175883591879463 (2018).
- Cohen, J. D. J., et al. Detection and localization of surgically resectable cancers with a multi-analyte blood test. Science. 359 (6378), 926-930 (2018).
- Wan, J. C. M., et al. Liquid biopsies come of age: towards implementation of circulating tumour DNA. Nature Reviews Cancer. 17 (4), 223-238 (2017).
- Heitzer, E., Haque, I. S., Roberts, C. E. S., Speicher, M. R. Current and future perspectives of liquid biopsies in genomics-driven oncology. Nature Reviews Genetics. 20 (2), 71-88 (2018).
- Thierry, A. R., et al. Origins, structures, and functions of circulating DNA in oncology. Cancer and Metastasis Reviews. 35 (3), 347-376 (2016).
- Buscail, E., et al. High Clinical Value of Liquid Biopsy to Detect Circulating Tumor Cells and Tumor Exosomes in Pancreatic Ductal Adenocarcinoma Patients Eligible for Up-Front Surgery. Cancers. 11 (11), 1656 (2019).
- Heitzer, E., Ulz, P., Geigl, J. B. Circulating Tumor DNA as a Liquid Biopsy for Cancer. Clinical Chemistry. 61 (1), 112-123 (2015).
- Kustanovich, A., Schwartz, R., Peretz, T., Grinshpun, A. Life and death of circulating cell-free DNA. Cancer Biology and Therapy. 20 (8), 1057-1067 (2019).
- Crowley, E., Di Nicolantonio, F., Loupakis, F., Bardelli, A. Liquid biopsy: monitoring cancer-genetics in the blood. Nature Reviews Clinical Oncology. 10 (8), 472-484 (2013).
- Celec, P., et al. Cell-free DNA: the role in pathophysiology and as a biomarker in kidney diseases. Expert Reviews in Molecular Medicine. 20, (2018).
- Gautschi, O., et al. Origin and prognostic value of circulating KRAS mutations in lung cancer patients. Cancer Letters. 254 (2), 265-273 (2007).
- Bidard, F., et al. Detection rate and prognostic value of circulating tumor cells and circulating tumor DNA in metastatic uveal melanoma. International Journal of Cancer. 134 (5), 1207-1213 (2013).
- Chan, K. C. A., et al. Analysis of Plasma Epstein–Barr Virus DNA to Screen for Nasopharyngeal Cancer. New England Journal of Medicine. 377 (6), 513-522 (2017).
- Mao, L., et al. Detection of Oncogene Mutations in Sputum Precedes Diagnosis of Lung Cancer. Cancer Research. 54 (7), 1634-1637 (1994).
- De Mattos-Arruda, L., et al. Cerebrospinal fluid-derived circulating tumour DNA better represents the genomic alterations of brain tumours than plasma. Nature communications. 6 (1), 8839 (2015).
- Khier, S., Lohan, L. Kinetics of circulating cell-free DNA for biomedical applications: critical appraisal of the literature. Future science OA. 4 (4), 295 (2018).
- Misale, S., et al. Resistance to Anti-EGFR therapy in colorectal cancer: From heterogeneity to convergent evolution. Cancer Discovery. 4 (11), 1269-1280 (2014).
- Beddowes, E., Sammut, S. J., Gao, M., Caldas, C. Predicting treatment resistance and relapse through circulating DNA. Breast. 34, 31-35 (2017).
- Sacher, A. G., et al. Prospective Validation of Rapid Plasma Genotyping for the Detection of EGFR and KRAS Mutations in Advanced Lung Cancer. JAMA oncology. 2 (8), 1014-1022 (2016).
- Vaidyanathan, R., et al. Cancer diagnosis: from tumor to liquid biopsy and beyond. Lab on a Chip. 19 (1), 11-34 (2019).
- Kelly, P. Gliomas: Survival, origin and early detection. Surgical Neurology International. 1 (1), 96 (2010).
- Faria, G., Silva, E., Da Fonseca, C., Quirico-Santos, T. Circulating Cell-Free DNA as a Prognostic and Molecular Marker for Patients with Brain Tumors under Perillyl Alcohol-Based Therapy. International Journal of Molecular Sciences. 19 (6), 1610 (2018).
- Liu, M. C., et al. Sensitive and specific multi-cancer detection and localization using methylation signatures in cell-free DNA. Annals of Oncology. 31 (6), 745-759 (2020).
- Enko, D., Halwachs-Baumann, G., Kriegshäuser, G. Plasma free DNA: Evaluation of temperature-associated storage effects observed for roche cell-free DNA collection tubes. Biochemia Medica. 29 (1), 153-156 (2019).
- Streleckiene, G., et al. Effects of Quantification Methods Isolation Kits, Plasma Biobanking, and Hemolysis on Cell-Free DNA Analysis in Plasma. Biopreservation and Biobanking. 17 (6), 553-561 (2019).
- Thress, K. S., et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M. Nature Medicine. 21 (6), 560-562 (2015).
- Ward Gahlawat, A., et al. Evaluation of Storage Tubes for Combined Analysis of Circulating Nucleic Acids in Liquid Biopsies. International Journal of Molecular Sciences. 20 (3), 704 (2019).
- Lu, J. L., Liang, Z. Y. Circulating free DNA in the era of precision oncology: Pre- and post-analytical concerns. Chronic Diseases and Translational Medicine. 2 (4), 223-230 (2016).
- Iyapparaj, P., et al. Optimization of bacteriocin production by Lactobacillus sp. MSU3IR against shrimp bacterial pathogens. Aquatic Biosystems. 9 (1), 12 (2013).
- Ponti, G., et al. The value of fluorimetry (Qubit) and spectrophotometry (NanoDrop) in the quantification of cell-free DNA (cfDNA) in malignant melanoma and prostate cancer patients. Clinica Chimica Acta. 479, 14-19 (2018).
- Medina Diaz, I., et al. Performance of Streck cfDNA blood collection tubes for liquid biopsy testing. PLoS One. 11 (11), 0166354 (2016).
- Perkins, G., et al. Multi-Purpose Utility of Circulating Plasma DNA Testing in Patients with Advanced Cancers. PLoS One. 7 (11), 47020 (2012).
- Mouliere, F., et al. Multi-marker analysis of circulating cell-free DNA toward personalized medicine for colorectal cancer. Molecular Oncology. 8 (5), 927-941 (2014).
- Trigg, R. M., Martinson, L. J., Parpart-Li, S., Shaw, J. A. Factors that influence quality and yield of circulating-free DNA: A systematic review of the methodology literature. Heliyon. 4 (7), 00699 (2018).
- Risberg, B., et al. Effects of Collection and Processing Procedures on Plasma Circulating Cell-Free DNA from Cancer Patients. Journal of Molecular Diagnostics. 20 (6), 883-892 (2018).
- Markus, H., et al. Evaluation of pre-analytical factors affecting plasma DNA analysis. Scientific Reports. 8 (1), 7375 (2018).
- Chen, Z., et al. Comprehensive Evaluation of the Factors Affecting Plasma Circulating Cell-Free DNA Levels and Their Application in Diagnosing Nonsmall Cell Lung Cancer. Genetic Testing and Molecular Biomarkers. 23 (4), 270-276 (2019).
- Schwarzenbach, H., Hoon, D. S. B., Pantel, K. Cell-free nucleic acids as biomarkers in cancer patients. Nature Reviews Cancer. 11 (6), 426-437 (2011).
- Malyuchenko, N. V., et al. PARP1 Inhibitors: antitumor drug design. Acta Naturae. 7 (3), 27-37 (2015).
- Fleischhacker, M., Schmidt, B. Circulating nucleic acids (CNAs) and cancer-A survey. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1775 (1), 181-232 (2007).
- Jung, K., Fleischhacker, M., Rabien, A. Cell-free DNA in the blood as a solid tumor biomarker—A critical appraisal of the literature. Clinica Chimica Acta. 411 (21-22), 1611-1624 (2010).
- Frenkel-Morgenstern, M., et al. ChiTaRS: a database of human, mouse and fruit fly chimeric transcripts and RNA-sequencing data. Nucleic Acids Research. 41, 142-151 (2013).
- Frenkel-Morgenstern, M., et al. ChiTaRS 2.1--an improved database of the chimeric transcripts and RNA-seq data with novel sense-antisense chimeric RNA transcripts. Nucleic Acids Research. 43, 68-75 (2015).
- Gorohovski, A., et al. ChiTaRS-3.1-the enhanced chimeric transcripts and RNA-seq database matched with protein-protein interactions. Nucleic Acids Research. 45 (1), 790-795 (2017).
- Tate, J. G., et al. COSMIC: the Catalogue Of Somatic Mutations In Cancer. Nucleic Acids Research. 47 (1), 941-947 (2019).
- Brennan, C. W., et al. The somatic genomic landscape of glioblastoma. Cell. 155 (2), 462-477 (2013).
- Szopa, W., Burley, T. A., Kramer-Marek, G., Kaspera, W. Diagnostic and Therapeutic Biomarkers in Glioblastoma: Current Status and Future Perspectives. BioMed Research International. 2017, 1-13 (2017).
- Salesse, S., Verfaillie, C. M. BCR/ABL: from molecular mechanisms of leukemia induction to treatment of chronic myelogenous leukemia. Oncogene. 21 (56), 8547-8559 (2002).
- Frenkel-Morgenstern, M., Valencia, A. Novel domain combinations in proteins encoded by chimeric transcripts. Bioinformatics. 28 (12), 67-74 (2012).
- Frenkel-Morgenstern, M., et al. Chimeras taking shape: Potential functions of proteins encoded by chimeric RNA transcripts. Genome Research. 22 (7), 1231-1242 (2012).
- Simon, M., et al. TERT promoter mutations: a novel independent prognostic factor in primary glioblastomas. Neuro-Oncology. 17 (1), 45-52 (2015).
- Waitkus, M. S., Diplas, B. H., Yan, H. Isocitrate dehydrogenase mutations in gliomas. Neuro-Oncology. 18 (1), 16-26 (2016).
- Kindler, T., Meyer, R. G., Fischer, T. BCR-ABL as a target for novel therapeutic interventions. Expert Opinion on Therapeutic Targets. 6 (1), 85-101 (2002).
- Overman, M. J., et al. Use of research biopsies in clinical trials: are risks and benefits adequately discussed. Journal of Clinical Oncology Official Journal of the American Society of Clinical Oncology. 31 (1), 17-22 (2013).
- Vanderlaan, P. A., et al. Success and failure rates of tumor genotyping techniques in routine pathological samples with non-small-cell lung cancer. Lung Cancer. 84 (1), 39-44 (2014).
- Stewart, C. M., Tsui, D. W. Y. Circulating cell-free DNA for non-invasive cancer management. Cancer Genetics. 228-229, 169-179 (2018).
- Normanno, N., et al. The liquid biopsy in the management of colorectal cancer patients: Current applications and future scenarios. Cancer Treatment Reviews. 70, 1-8 (2018).
- Hufnagl, C., et al. Evaluation of circulating cell-free DNA as a molecular monitoring tool in patients with metastatic cancer. Oncology Letters. 19 (2), 1551-1558 (2020).
- Petit, J., et al. Cell-Free DNA as a Diagnostic Blood-Based Biomarker for Colorectal Cancer: A Systematic Review. The Journal of Surgical Research. 236, 184-197 (2019).
- Poulet, G., Massias, J., Taly, V. Liquid Biopsy: General Concepts. Acta Cytologica. 63 (6), 449-455 (2019).
- Alix-Panabières, C. The future of liquid biopsy. Nature. 579 (7800), 9 (2020).
- Eisenstein, M. Could liquid biopsies help deliver better treatment. Nature. 579 (7800), 6-8 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır