Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Обнаружение ДНК без клеток в образцах плазмы крови онкологических больных
В этой статье
Резюме
В этой статье мы представляем подробный протокол для неинвазивной жидкостной биопсии техники, в том числе сбора крови, плазмы и баффи пальто разделения, cfDNA и зародышевой ДНК извлечения, количественной оценки cfDNA или зародышевой ДНК, и cfDNA анализ обогащения фрагментов.
Аннотация
Выявление мутаций в опухолях онкологических больных является очень важным шагом в лечении заболеваний. Эти мутации служат биомаркерами для диагностики опухоли, а также для отбора лечения и его реакции у онкологических больных. Нынешний метод золотого стандарта для обнаружения мутаций опухоли включает в себя генетический тест ДНК опухоли с помощью биопсии опухоли. Тем не менее, этот инвазивный метод трудно выполнить повторно в качестве последующего теста опухолевых мутационных репертуара. Биопсия жидкости является новым и новым методом для обнаружения мутаций опухоли в качестве простого в использовании и неинвазивного подхода к биопсии.
Раковые клетки быстро размножаются. Параллельно многочисленные раковые клетки подвергаются апоптозу. Мусор из этих клеток высвобождается в кровеносную систему пациента, вместе с мелко фрагментированными фрагментами ДНК, называемыми фрагментами ДНК без клеток (cfDNA), которые несут мутации ДНК опухоли. Поэтому для выявления биомаркеров на основе cfDNA с использованием метода жидкой биопсии, образцы крови собираются у онкологических больных, а затем разделение плазмы и баффи пальто. Далее плазма обрабатывается для изоляции cfDNA, и соответствующие баффи пальто обрабатывается для изоляции геномной ДНК пациента. Оба образца нуклеиновой кислоты затем проверяются на их количество и качество; и проанализированы на мутации с использованием методов секвенирования нового поколения (NGS).
В этой рукописи мы представляем подробный протокол для жидкой биопсии, включая сбор крови, плазму и разделение буйного пальто, cfDNA и извлечение ДНК зародышей, количественную оценку ДНК cfDNA или зародышевой линии, а также анализ обогащения фрагментов cfDNA.
Введение
Технологические достижения привели к секвенированию сотен геномов рака и транскриптомов1. Это способствовало пониманию ландшафтов молекулярных изменений в различных типах рака2. Дальнейшие исследования этих ландшафтов помогли охарактеризовать последовательные соматические изменения игенно-генные слияния 3, которые участвуют в раке или прогрессировании опухоли, последовательно нарушая пути апоптоза4. Таким образом, соматические мутации и генно-генные синтезы могут предоставить информацию об опухолях, выступая в качестве биомаркеров у отдельныхпациентов для конкретного типа опухоли 5, выявление существующих первичныхпрогнозов опухоли 6, классификация вторичных опухолей наоснове молекулярных изменений 7, и выявление наркотических целейопухоли 8. Такая информация может способствовать выбору персонализированного лечения онкологических больных и в определении положительных и отрицательных ответов налечение 9. Однако получение опухолевого материала для выявления геномного профилирования опухолевой ткани является инвазивнойпроцедурой 10. Кроме того, биопсия опухоли состоит лишь из небольшой части неоднородной опухоли; и, следовательно, не может быть репрезентативным для молекулярного профиля всей опухоли11. Серийный мониторинг и генотипирование опухоли требуют повторного сбора опухолевых тканей, что, как правило, не представляется возможным из-за инвазивности процедуры биопсии опухоли и вопросов безопасности, которые возникают врезультате таких процедур 12.
Техника жидкой биопсии, с другой стороны, получила огромное внимание в точной онкологии за последнеедесятилетие 13,14. Это в основном из-за неинвазивности этого метода, и возможность его повторения в нескольких точках времени, тем самым позволяя простой в использовании и безопасный метод мониторинга длякурсов болезни 15,16. Биопсия жидкости основана на явлении, что опухолевые клетки размножаются быстро, и одновременно многие из них проходят апоптоз и некроз. Это приводит к высвобождению апоптотических клеточных обломков в кровь пациентов, а также фрагменты ДНК, которые вырезаны в точных размерах во время апоптоза17. Апоптоз не раковых клеток также приводит к высвобождению его клеточного мусора в кровь, однако, скорость апоптоза в этих клетках относительно намного ниже, чем опухолевыеклетки 18. Рациональным методом жидкой биопсии является захват связанных с опухолью молекул, таких как ДНК, РНК, белки иопухолевые клетки 14,19, которые постоянно циркулируют в крови. Различныеметоды 20 могут быть использованы для анализа этих молекул, включая секвенирование следующего поколения (NGS), цифровую реакцию цепи полимеразы капли (ddPCR), ПЦР в режиме реального времени и связанный с ферментами иммуносорбентный анализ (ELISA). Методика биопсии жидкости позволяет выявлять биомаркеры, которые являются характеристиками опухолевых клеток. Эти молекулы биомаркера высвобождаются не только из определенных частей опухоли, но и из всех частей опухоли21. Таким образом, маркеры, выявленные в жидкой биопсии представляет собой молекулярное профилирование всей неоднородной опухоли, в дополнение к другим опухолям в организме, таким образом, имея преимущества перед биопсией тканей наоснове техники 22.
CfDNA имеет короткий период полу-жизни в циркулирующей крови, начиная от нескольких минут до 1-2 часов23. Тем не менее, короткое время полуиллиард cfDNA облегчает анализы в режиме реального времени путем оценки реакции лечения и динамических оценок опухоли. Опухолевые уровни cfDNA указывают на прогнозирование стадии/размера опухоли, о чем свидетельствует несколько исследований, которые показали связь между уровнями cfDNA и исходамивыживания 24. Кроме того, исследования доказали, что cfDNA имеет лучшую способность прогнозирования, чем существующие маркерыопухоли 25. Прогнозирование cfDNA еще более выраженным после лечения рака, более высокие уровни cfDNA после лечения хорошо коррелирует со снижением скорости выживания, и устойчивость к лечению. Принимая во время, более низкие уровни cfDNA после терапии вообще соответствует с положительной реакцией обработки. Кроме того, cfDNA облегчает раннее выявление ответных мер лечения, чем традиционные методы обнаружения.
cfDNA увеличивает возможность раннего выявления связанных с раком мутаций: во времяранней стадии заболевания 15,появление симптомов 26 и до диагностики рака до 2лет 27. Как cfDNA высвобождается из нескольких областей опухоли или очагов, его анализ обеспечивает всеобъемлющее представление генома опухоли он представляет28. Таким образом, cfDNA позволяет обнаружить соматические мутации, которые, возможно, были пропущены в образцахтканей 29. Поскольку внутриохоуловидная неоднородность и субклональные мутации могут быть обнаружены путем глубокого секвенирования геномных областей, охватывающих тысячи баз, следовательно, анализ cfDNA позволяет выявить конкретные молекулярные подтипы с различными геномнымисигнатурами 13. Для получения аналогичного уровня информации через образец ткани было бы необходимо много твердых биопсий.
Кроме того, уровни cfDNA у пациентов с локализованным заболеванием, таким как толстой кишки, яичников и рака легких после хирургического лечения и / или химиотерапии, показали, что мощный прогностический маркер для рецидива рака ирезультатов лечения 20. Кроме того, у пациентов с раком толстой кишки, молочной железы и легких анализы cfDNA из крови могли успешно обнаружить опухолевые изменения, которые привели к точному прогнозированию рецидива занесколько месяцев до 13. Кроме того, маркеры устойчивости к лечению, такие как мутации KRAS у пациентов с CRC, получающих анти-EGFRтерапию 30; VAFs для генов, таких как PIK3CA, MED1 или EGFR у пациентов с раком молочной железы после лечения с различными методамилечения 31; и EGFR T790M резистентности мутации у больных раком легких лечение EGFR-целевыхTKIs 32 также могут быть определены с помощью анализа cfDNA.
Таким образом, анализ cfDNA может быть использован для выявления точных биомаркеров в областионкологии 13,33. В этом протоколе, образцы крови 3 пациентов глиомы и 3 здоровых контроля были обработаны для получения геномной ДНК из WBCs и cfDNA из плазмы. При раке глиомы мутации в IDH, TERT, ATRX, EGFR и TP53 служат как диагностическими, так и прогностические маркеры, которые могут помочь в ранней диагностике опухолей глиомы, классификации различных типов опухолей глиомы, руководстве точное лечение для отдельного пациента и пониманиереакции лечения 34,35. Мутационный статус этих генов можно определить с помощью с помощью сфДНК, полученной из крови. В этой рукописи мы представляем подробный протокол плазменного cfDNA, который был использован для изучения мутационных изменений в раке глиомы12. Такой протокол жидкой биопсии на основе cfDNA, разъясняясь в этой статье, может быть использован для изучения мутационных изменений во многих других видах рака. Кроме того, недавнее исследование показало, что cfDNA основе жидкой биопсии может обнаружить 50 различных видов рака36.
Сбор образцов крови, хранение и отгрузка являются важными шагами в этом протоколе, так как неконтролируемая температура во время этих шагов вызывает лиз WBCs, что приводит к выпуску геномной ДНК из WBC в плазму и вызывает загрязнение образца cfDNA, который влияет на остальную частьпроцедуры 37. Гемолиз из-за неконтролируемой температуры может ухудшить вниз по течению процессы подготовки образца cfDNA, такие как ПЦРшаги 38. Сыворотка содержит высокую долю зародышевой cfDNA, а не плазмы, хотя она представляет собой большой фоновый шум для опухолевых cfDNA39. Таким образом, для изоляции опухолевых cfDNA, плазма является подходящим образцом39. Кровь, нарисованная в антикоагулянте, содержащем трубку для сбора крови, должна быть центрифугирована немедленно или в течение двух часов, чтобы отделить плазму и избежать загрязнения cfDNA. В этом протоколе используются специальные коммерческие трубки для сбора крови cfDNA (см. таблицу материалов),которые являются альтернативой антикоагулянту, содержащем трубки для сбора крови. Эти выделенные трубки сбора крови сохраняют cfDNA и cfRNA, и предотвращает лиз WBCs на срок до 30 дней при температуре окружающей среды, и до 8 дней при температуре 37 градусов по Цельсию. Это облегчает поддержание соответствующей температуры во время отгрузки образца крови и до тех пор, пока плазма и WBC разделены40.
Есть три типа методов извлечения cfDNA в настоящее время доступны: фазовая изоляция, кремниевая мембрана на основе спина колонки, и магнитной бисером на основеизоляции 41. Силиконовая мембрана на основе спина колонки метод дал большое количество cfDNA с высокой целостностью по сравнению с другими методами извлечения cfDNA42.
Количественная оценка ДНК является одним из основных требований в жидкой биопсии, необходимо разработать простую, доступную и стандартизированную процедуру для их легкой реализации и широкого использования. Три широко используемых метода количественной оценки cfDNA являются спектрофотометрические, флюориметрические и qPCR. Фторметрический метод оказался лучше по отношению к другим методам, касающимся точности, стоимости и простоты проведения43.
Целостность и чистоту cfDNA можно оценить либо по агарозовому электрофорезу, либо по капиллярной электрофорезу. Электрофорез агарозы не показывает чувствительности при низкой концентрации cfDNA и не имеет высокого разрешения, чтобы показать точный размер фрагмента cfDNA. С другой стороны, капиллярный электрофорез имеет преимущество перед электрофорезом агарозы, преодолевая связанные с этим проблемы и, следовательно, широко используемый исследователями для анализа размера фрагмента cfDNA. В этом протоколе распределение размера фрагмента изолированной cfDNA оценивалось с помощью автоматизированного капиллярного электрофореза (см. таблицу материалов).
протокол
Перед сбором крови требуется информированное согласие субъектов, участвующих в исследовании, которые должны быть получены. Исследование, описанное в этой рукописи, было проведено в соответствии с медицинским центром Рабина, Комитетом по этике Израиля (этический кодекс: 0039-17-RMC) и медицинским факультетом Der Christian-Albrechts-Universit't zu Kiel, комитет по этике Германии (этический кодекс: D 405/14).
1. Сбор и хранение образцов крови в сфДНК или cfRNA консервантных трубках
- Правильно обозначить сохранение труб
- Соберите 8 мл крови в трубку сохранения cf-ДНК (см. Таблицу материалов), используя набор сбора крови и держатель, в соответствии со стандартным институциональным протоколом для venipuncture, как описано ниже.
ПРИМЕЧАНИЕ: Использование набора сбора крови может предотвратить возможный отток крови из трубки.- Выровнять пациента с рукой в нисходящем положении.
- Держите трубку вертикально, с крышкой лицом вверх, обеспечивая при этом, чтобы содержимое трубки не касались крышки или кончика иглы.
- Как кровь начинает течь в трубку, отпустите турникет медленно.
- Сразу после того, как трубка наполняется кровью (максимальная емкость: 8,4 мл всей крови), аккуратно инвертировать трубку (поверните запястье руки, которая держит трубку на 180 градусов вниз и назад) 5 раз, чтобы стабилизировать образец.
ПРИМЕЧАНИЕ: Инверсия гарантирует, что консервант смешивается равномерно с образцом. Тем не менее, не трясти содержимое снова, даже до плазмы подготовки. Недостаточное смешивание консервантов с образцом крови приводит к дестабилизации содержимого и образованию микрогу тромбов или гемолизиса. На этом этапе протокол может быть продолжен немедленно для разделения плазмы или заполненные кровью трубки могут ждать до 30 дней при температуре окружающей среды (15-25 градусов по Цельсию), и до 8 дней при температуре 37 градусов по Цельсию.
2. Плазма и баффи пальто разделения и хранения
- Центрифуга заполненные кровью трубки сохранения на 425 х г в течение 20 мин при комнатной температуре, чтобы отделить плазму.
ПРИМЕЧАНИЕ: Шаги 2.2 и 2.3 должны выполняться в кабинете биобезопасности. - Тщательно пипетка из верхнего слоя плазмы в свежую трубку в 1 мл aliquots, не нарушая нижних слоев.
- Тщательно перенесите следующий слой буйного пальто в свежую трубку (слой отображается как кольцо над гранулами РБК), избегая при этом РБК в нижнем слое.
- Приступайте к шагу 3 с плазмой и шаг 4 с баффи пальто. При необходимости храните отделенный содержимое при -80 градусов по Цельсию.
3. Очистка циркулирующего cfDNA от 1 мл плазмы
ПРИМЕЧАНИЕ: Этот шаг выполняется с коммерческим комплектом (см. таблицу материалов). Все буферы обеспечены комплектом.
- Подготовка буферов и реагентов
ВНИМАНИЕ: Не добавляйте кислые растворы или отбеливатель непосредственно в отходы подготовки образца. Соли гуанидина, присутствующие в буфере Lysis, буфере связывания и буфере мытья-1 в сочетании с отбеливателем или кислотами, могут производить высокореактивные соединения.- Связывающий буфер: Смешайте 300 мл буферного концентрата Binding с 200 мл 100% изопропанола, чтобы сделать 500 мл рабочего буфера Binding. Хранить при комнатной температуре.
ПРИМЕЧАНИЕ: Связывание буфера позволяет оптимально связывать циркулирующие нуклеиновые кислоты с кремнеземной мембраной. 500 мл связывающего буфера достаточно для обработки 276, 138, 92, 69 или 55 образцов 1, 2, 3, 4 или 5 мл плазмы соответственно и стабильны в течение 1 года при комнатной температуре. - Вымойте буфер-1: Смешайте 19 мл концентрата Wash Buffer-1 с 25 мл этанола 96-100%, чтобы сделать 44 мл работающего буфера для мытья-1. Хранить при комнатной температуре.
ПРИМЕЧАНИЕ: Wash Buffer-1 устраняет загрязняющие вещества, связанные с кремнеземной мембраной. 44 мл работающего wash Buffer-1 достаточно для обработки 73 образцов 1/2/3/4/5 мл плазмы и стабилен в течение 1 года при комнатной температуре. - Вымойте Buffer-2: Хорошо смешайте концентрат 13 мл для мытья буфера-2 с 30 мл этанола 96-100%, чтобы сделать 43 мл работающего буфера для мытья-2. Хранить при комнатной температуре.
ПРИМЕЧАНИЕ: Wash Buffer-2 устраняет загрязняющие вещества, связанные с кремнеземной мембраной. 43 мл работающего wash Buffer-2 достаточно для обработки 56 образцов 1/2/3/4/5 мл плазмы и стабилен в течение 1 года при комнатной температуре. - К трубке, содержащей 310 мкг лиофилизированной РНК носителя, добавьте 1550 МКЛ буфера Elution, чтобы подготовить решение РНК носителя 0,2 мкг/ОЛ. После тщательного растворения РНК носителя разделите раствор на подходящие алициты и храните при -30 градусов по Цельсию до -15 градусов по Цельсию. Не замораживайте-оттаивать эти алициты более 3 раз. К буферу Lysis, как показано в таблице S1,добавьте восстановленную РНК-носителя, растворенного в буфере Elution.
ПРИМЕЧАНИЕ: Поскольку РНК носителя не растворяется непосредственно в буфере Lysis, она должна быть распущена сначала в буфере Elution, а затем в буфере Lysis. Во-первых, связывание кремнеземных мембранных нуклеиновых кислот усиливается, когда в образце присутствует очень мало молекул-мишеней. Во-вторых, риск деградации РНК снижается из-за наличия большого количества РНК-носителя.
- Связывающий буфер: Смешайте 300 мл буферного концентрата Binding с 200 мл 100% изопропанола, чтобы сделать 500 мл рабочего буфера Binding. Хранить при комнатной температуре.
- Перед началом изоляции довелите колонны и образцы до комнатной температуры и при необходимости отрегулируйте объемы выборки до 1 мл со стерильным фосфатно-буферным солевым раствором (PBS). Предварительно нагрейте 2 водяные ванны или нагревательные блоки, которые содержат 50 мл центрифуг труб и 2 мл трубки сбора до 60 градусов по Цельсию и 56 градусов по Цельсию, соответственно.
- К 50-метровой центрифуге добавьте 100 МКЛ протеиназы K, 1 мл плазмы и 0,8 мл буфера лиза, содержащего 1,0 мкг РНК носителя (подготовлено в шаге 3.1.4). Закройте центрифугу трубку крышкой и смешайте содержимое с помощью импульсного вихря на 30 с, обеспечивая при этом видимый вихрь в трубке. Тщательное смешивание содержимого имеет важное значение для эффективного лиза.
ПРИМЕЧАНИЕ: Сразу после вихря, перейти к шагу 3.4, без промедления. - Инкубировать раствор при 60 градусов по Цельсию в течение 30 мин.
- Снимите крышку, добавьте 1,8 мл связывающего буфера в трубку и тщательно перемешайте с импульсным вихрем в течение 15-30 с после размещения крышки.
- Инкубировать полученную смесь в течение 5 минут на льду и вставить колонку кремнеземной мембраны в вакуумный аппарат, который подключен к вакуумной насос. Затем твердо вставьте удлинитель трубки 20 мл в открытую колонку, чтобы предотвратить утечку образца.
- Аккуратно вылейте инкубацию смеси в трубчатый удлинитель колонны и включите вакуумный насос. Ведь лисаторная смесь полностью проходит через колонны, выключает вакуумный насос, высвобождает давление до 0 мбара, а также снимает и отбрасывает расширитетель трубки.
ПРИМЕЧАНИЕ: Избегая перекрестного загрязнения, расширитетель трубки должен быть тщательно отброшен, чтобы предотвратить его распространение на соседние колонны. - Снимите колонку с вакуумного аппарата, вставьте в коллекторную трубку и центрифугу при температуре 11 000 х г при комнатной температуре, чтобы удалить остаточный лисат. Отбросьте поток через.
- Добавьте 600 МКЛ wash Buffer-1 в столбец, центрифугу при температуре 11 000 х г в течение 1 мин при комнатной температуре, отбросьте протеку.
- Добавьте 750 МКЛ Wash Buffer-2 к столбецу, центрифугу при температуре 11 000 х г в течение 1 мин при комнатной температуре и отбросьте протеку.
- Добавьте 750 мл этанола (96–100%) к столбу, центрифуге на 11000 х г в течение 1 мин при комнатной температуре и отказаться от потока через.
- Центрифуга колонки на 20000 х г в течение 3 минут, поместив его в чистую трубку сбора 2 мл.
- Высушите сборку мембранной колонки полностью, поместив ее в новую трубку для сбора 2 мл с открытой крышкой и инкубационой при 56 градусов по Цельсию в течение 10 минут.
- Поместите столбец в чистую трубку 1,5 мл elution. К центру мембраны колонки нанесите 20-150 мкл буфера Elution и инкубировать при комнатной температуре в течение 3 минут с закрытой крышкой.
ПРИМЕЧАНИЕ: Убедитесь, что буфер Elution уравновешен до комнатной температуры. В случае использования элюционного буфера менее 50 мкл убедитесь, что он тщательно распределяется по центру мембраны. Это помогает с полным элевации связаны ДНК. Тем не менее, объем elution не является фиксированным и может быть изменен в соответствии с приложениями ниже по течению. Восстановленный элуат может быть до 5 йл и, конечно, меньше, чем объем элюции, применяемый к столбецу. - Центрифуга восстановленного элуата в микроцентрифуге при 20 000 х г в течение 1 мин, чтобы утаить нуклеиновые кислоты, и хранить при -20 градусов по Цельсию.
4. Очистка геномной ДНК от баффи пальто
ПРИМЕЧАНИЕ: Коммерческий комплект, используемый в этом протоколе, упоминается в таблице материалов. Буферы и реагенты, упомянутые в ниже протоколе, т.е. буфер Lysis A, буфер Lysis B, буфер мытья X, Wash Buffer Y, Proteinase Buffer, буфер Elution и Proteinase K являются частью этого коммерческого комплекта.
- Подготовка буферов и реагентов
ВНИМАНИЕ: Не добавляйте кислые растворы или отбеливатель непосредственно в отходы подготовки образца. Соли гуанидина, присутствующие в буфере Lysis B и Wash buffer X в сочетании с отбеливателем или кислотами, могут производить высокореактивные соединения.- Вымойте буфер Y: Хорошо смешайте 12 мл концентрата Wash Buffer Y с этанолом 48 мл (96-100%) для получения 60 мл рабочего wash Buffer Y. Store при комнатной температуре.
ПРИМЕЧАНИЕ: 60 мл рабочего Wash Buffer Y достаточно для обработки 100 баффи образцов пальто и стабильна в течение 1 года. - Протеиназа K: Приготовьте раствор протеиназы K, растворив 30 мг лиофильной протеиназы K в 1,35 мл буфера протеиназы.
ПРИМЕЧАНИЕ: Общее рабочее решение Proteinase K достаточно для обработки 52 баффи образцов пальто. Рабочий раствор Proteinase K может храниться не менее 6 месяцев при -20 градусах Цельсия.
- Вымойте буфер Y: Хорошо смешайте 12 мл концентрата Wash Buffer Y с этанолом 48 мл (96-100%) для получения 60 мл рабочего wash Buffer Y. Store при комнатной температуре.
- Шаги до начала процедуры
- Equilibrate баффи пальто до комнатной температуры.
- Установите тепловой блок или водяную баню при температуре 56 градусов по Цельсию.
- Приостановить баффи пальто в буфере Lysis A, чтобы получить окончательный объем 200 КЛ. Затем добавьте 25 МКЛ раствора Proteinase K и 200 МКЛ буфера лиза B. Смешайте вихрем и инкубировать при 70 градусах по Цельсию в течение 10-15 мин. Убедитесь, что образцы полностью покрыты раствором лиза.
ПРИМЕЧАНИЕ: Для обработки серии образцов буфер Proteinase K и Lysis A может быть предварительно смешан за 10-15 минут до процедуры, но не до этого, так как протеиназа K переваривается в буфере Lysis A без субстрата. - Добавьте 210 Л 96-100% этанола в вышеупомяую смесь и вихрь энергично.
ПРИМЕЧАНИЕ: Добавление этанола может образовывать тягучий осадок; однако, это не повлияет на изоляцию ДНК. Обязательно загрузите осадок и на столбец, как показано на следующих шагах. - Загрузите весь образец на колонку кремнезема, помещенную в трубку для сбора. Центрифуга в течение 1 мин при 11000 х г. Поместите столбец в новую трубку сбора и отбросьте предыдущую трубку вместе с протекаемой трубкой.
ПРИМЕЧАНИЕ: Повторите шаг центрифугации, если образец не нарисован полностью через матрицу. - Добавьте 500 МКЛ буфера вымой X, центрифугу на 1 мин при 11 000 х г и отбросьте протеку.
- Поместите столбец в трубку сбора, добавьте 600 йл Wash Buffer Y на колонну, центрифугу на 1 мин при 11 000 х г и отбросьте протечку.
- Опять же, поместите колонку в трубку сбора, и центрифуга колонки в течение 1 мин при 20000 х г, чтобы высушить кремнезем мембраны.
- Инкубировать столбец при комнатной температуре в течение 1 мин, поместить в 1,5 мл микроцентрифуг трубки, а затем добавить 100 йл буфера Elution. Затем, elute ДНК путем центрифугирования в течение 1 мин при 11000 х г и хранить при -20 градусов по Цельсию.
5. Количественная оценка cfDNA и геномной ДНК с помощью флюорометра
- Перед запуском протокола выполните следующие шаги.
- Разбавить 2 МКЛ элетонной геномной ДНК (от шага 4.9) в пропорциях 1:10 с ультрапурной нуклеазной водой. Из-за ожидаемых низких концентраций, не разбавлять образцы cfDNA от шага 3.15.
- Equilibrate анализа Стандартный #1 анализа Стандартный #2 комнатной температуры.
- Подготовь в общей сложности 6 тонкостенных чистых труб размером 0,5 мл.
ПРИМЕЧАНИЕ: Протокол представлен для количественной оценки 2 cfDNA и 2 геномных образцов ДНК, поэтому, 4 трубки для 4 образцов, и этот анализ требует 2 стандартов. - Этикетка крышки трубки.
ПРИМЕЧАНИЕ: Маркировка на стороне трубки может помешать чтению. Кроме того, анализ стандартных труб помечены тщательно, так как калибровка флюорометра требует, чтобы стандарты были в правильном порядке. - Разбавить реагент анализа в 1:200 буфером Assay для подготовки рабочего решения. Для 4 образцов и 2 стандартов используйте 6 МКЛ анализного реагента плюс 1194 МКЛ буфера Assay, чтобы сделать 1200 МКЛ (200 йЛ в каждой трубке) рабочего раствора.
ПРИМЕЧАНИЕ: Не используйте стеклянный контейнер, вместо этого используйте чистую пластиковую трубку. Каждая трубка должна содержать около 200 МКЛ конечного объема (стандартная трубка анализа должна содержать 190 мкл рабочего раствора, а пробная трубка должна содержать 180-199 МЛ рабочего раствора). Необходимо подготовить достаточное рабочее решение для учета всех стандартов анализа и образцов. - В стандартных трубках рабочего анализа добавьте 190 МКЛ рабочего раствора и 10 МКЛ стандарта анализа и смешайте раствор вихрем для 2-3 с. Избегайте образования пузырьков в растворе.
- В пробные трубки добавьте 198 рабочих растворов и 2 МКЛ cfDNA или геномной ДНК. Смешайте раствор вихрем в течение 2-3 с, и держать его инкубируется при комнатной температуре в течение 2 минут.
- На экране«Домашнего»флюорометра нажмите«ДНК»и выберите« DSDNA High Sensitivity Assay»,чтобы отобразить экран«Стандарты»,а затем нажмите«Да»на экране стандартов флюорометра, чтобы прочитать стандарты.
- В образец камеры, вставьте анализ Стандартный #1 трубки, закрыть крышку, и нажмите 'Читать'. Удалите трубку после завершения чтения (примерно 3 с) и повторите тот же шаг для стандартного #2.
- Образец экрана отображается после завершения процесса калибровки, затем вставьте образец трубки и повторите шаг '5.8'. Затем "образец экрана" будет отображать значение, которое соответствует концентрации образца после разбавления в пробной трубке.
- Для каждого образца повторите шаг '5.9', пока не будут прочитаны все образцы.
- Используйте следующее уравнение для расчета фактической концентрации образца.
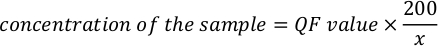
ПРИМЕЧАНИЕ: Значения анализа находятся в ng/mL и соответствуют концентрации после разбавления в трубке анализа. Уравнение, упомянутое в вышеупомянутом шаге 5.11, значение qF — это значение, данное флюорометрным инструментом, и x — это количество микролитров образца, добавленных в анализную трубку. Единицы значений КФ, генерируемые уравнением, аналогичны значению, предоставляемому флюорометром. Например, если значение флюорометра находится в ng/mL, единицы концентрации, рассчитанной по уравнению, являются ng/mL.
6. Распределение размера фрагмента ДНК cfDNA анализатором фрагментов
- Шаг перед началом процедуры: Equilibrate концентрат красителя ДНК и матрицы геля ДНК до комнатной температуры в течение 30 мин.
- Приготовление смеси гель-красителя
ВНИМАНИЕ: Обрабатывать решения с осторожностью, как DMSO, как известно, облегчить вход органических молекул в ткани.- Тщательно оттаивать DMSO путем вихревого концентрата красителя ДНК в течение 10 с. Pipette из 15 йл этого концентрата в матричный флакон геля ДНК и хранить при 4 градусов по Цельсию в темноте.
- Опять же, вихрь ограничен флакон на 10 с, пока смешивание геля и красителя визуализированы.
- Налейте смесь на фильтр спина к верхнему сосуду.
- Микроцентрифуг спинового фильтра при температуре 2240 х г ± 20% в течение 10 мин при комнатной температуре.
- Этикетка подготовленный гель-краситель в трубке и отказаться от фильтра, в соответствии с передовой лабораторной практики. Наклеить этикетку на трубку и записать дату приготовления.
ПРИМЕЧАНИЕ: Отбросьте фильтрат в соответствии с передовой лабораторной практикой. Смесь гель-красителя может быть использована для 5 чипов ДНК высокой чувствительности (HS). Если не используется более 1 ч, хранить при 4 градусов по Цельсию. Хранение в темное время суток возможно на срок до 6 недель.
- Для загрузки смеси гель-красителя обеспечите положение базовой пластины станции грунтовки чипа и отрегулируйте зажим в самом низком положении.
- Equilibrate гель-краситель смесь комнатной температуры в течение 30 минут, при мониторинге воздействия света.
- Возьмите новый чип ДНК HS из запечатанного мешка и поместите его на чип грунтовки станции, а затем удалить 9,0 мл смеси гель-красителя и обойтись его в нижней части чипа хорошо, помечены как "G".
ПРИМЕЧАНИЕ: Нарисуйте смесь гель-красителя, избегая частиц, которые могут накапливаться в нижней части флакона. При раздаче гель-красителя смесь в чип ДНК HS хорошо, вставьте кончик пипетки полностью, чтобы предотвратить образование крупных пузырьков воздуха. Кроме того, прикосновение к пипетки по краям колодец даст плохие результаты. - Распоить поршень на 1 мл и закрыть чип грунтовки станции. Убедитесь, что блокировка защелки кликов и установить таймер до 60 с, а затем нажмите поршень вниз, пока он не удерживается клип, и ровно после 60 с, отпустите поршень с клип-релиз механизма.
- Когда поршень отступает по крайней мере до отметки 0,3 мл, подождите 5 с, а затем медленно отступить в положение 1 мл, затем откройте чип грунтовки станции и снова удалить 9,0 МКЛ гель-красителя смеси и обойтись в нижней части чипа ДНК ГС хорошо, помечены как "G".
- Чтобы загрузить маркер ДНК, выпейте 5 МКЛ маркера ДНК в колодец, отмеченный символом лестницы. Повторите процедуру для всех 11 проб скважин.
- Для загрузки лестницы и образцов, обойтись 1 йл ДНК лестницы в колодец, отмеченный символ лестницы, а затем добавить 1 йл образца (использованные скважины) или 1 йл маркера (неиспользованные скважины) во всех 11 образцов скважин.
- Vortex чип ДНК HS для 60 с при 2400 об / мин, поместив чип горизонтально в адаптер. Убедитесь, что выпуклость, которая фиксирует чип ДНК HS, не повреждена во время вихря.
- Чтобы вставить чип ДНК HS в инструмент анализатора фрагментов, откройте крышку и убедитесь, что картридж электрода правильно вставлен, а селектор чипа расположен на 'dsHigh Sensitivity DNA' в инструменте анализатора фрагментов.
- Тщательно смонтировать чип ДНК HS в сосуд, который подходит только в одну сторону, а затем потерять крышку, гарантируя, что электрод картридж вписывается точно в колодцы чипа ДНК HS.
- Дисплей на экране программного обеспечения анализатора фрагментов указывает на вставленный чип HS DNA и закрытую крышку через значок чипа в левом верхнем левом верхнем слева от экрана.
- Чтобы инициировать запуск чипа ДНК HS, выберите анализ высокой чувствительности dsDNA из меню'Assay'на экране инструмента, затем правильно заполните таблицу имен образцов, подавая информацию, такую как имена образцов и комментарии, и запустите чип, нажав кнопку'Start' в правом верхнем правом верхнем справа от экрана.
- Электродел очистки после запуска чипа ДНК HS: Немедленно удалите использованный чип ДНК HS, как только анализ будет завершен и избавиться от него в соответствии с передовой лабораторной практикой. Выполните следующую процедуру, чтобы обеспечить чистоту электродов, без остатков остатков от предыдущего анализа.
- Заполните медленно 350 йл деионизированной воды аналитического класса в один из электродных чистых скважин и поместите электродный очиститель в инструмент анализатора фрагментов, открыв крышку, а затем закройте крышку и подождите около 10 с.
- Удалите электродный очиститель, открыв крышку и подождите еще 10 с, чтобы вода на электродах испарилась перед закрытием крышки.
Результаты
Разделение плазмы
8,5-9 мл крови, собранной в cfDNA или cfRNA консервантных трубок дает около 4 мл плазмы в объеме. Объем плазмы, отделенной от крови, собранной в трубках ЭДТА, может варьироваться в зависимости от температуры. Воздействие EDTA трубки, содержащие кровь при температуре вы...
Обсуждение
Сбор крови пациента в трубке, отгрузка и хранение являются важными первоначальными шагами в жидкой биопсии. Неправильное обращение может ухудшить качество плазмы и, следовательно, может помешать результатам жидкой биопсии47. Если образец крови собран в трубке крови ЭДТА, п...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Авторы хотели бы поблагодарить членов Лаборатории геномики рака и биокомпутирования сложных заболеваний за их активный наблюдательный вклад и участие в многочисленных дискуссиях на различных этапах этого проекта. Поддержка финансирования включает в себя Израильскую ассоциацию рака (грант ICA на M.F-M 2017-2019) и грант Камина Израильского инновационного управления (для M.F-M.).
Материалы
| Name | Company | Catalog Number | Comments |
| 2100 Bioanalyzer Instrument | Agilent Technologies, Inc. | G2939BA | The 2100 Bioanalyzer system is an established automated electrophoresis tool for the sample quality control of biomolecules. |
| Adjustable Clip for Priming Station | Agilent Technologies, Inc. | 5042-1398 | Used in combination with syringe to apply defined pressure for chip priming. |
| Agilent High Sensitivity DNA Kit | Agilent Technologies, Inc. | 5067-4626 | The High Sensitivity DNA assays are often used for sample quality control for next-generation sequencing libraries |
| cf-DNA/cf-RNA Preservative Tubes | Norgen Biotek Corp. | 63950 | Norgen's cf-DNA/cf-RNA Preservative Tubes are closed, evacuated plastic tubes for the collection and the preservation of cf-DNA, circulating tumor DNA, cf-RNA and circulating tumor cells in human whole blood samples during storage and shipping |
| Chip Priming Station | Agilent Technologies, Inc. | 5065-4401 | Used to load gel matrix into a chip with a syringe provided with each assay kit— used for RNA, DNA, and protein assays. Includes priming station, stop watch, and 1 syringe clip |
| Electrode Cleaner Kit | Agilent Technologies, Inc. | 5065-9951 | Prevents cross-contamination. Removes bacterial or protein contaminants from electrodes. |
| Filters for Gel Matrix | Agilent Technologies, Inc. | 185-5990 | Used for proper mixing of DNA dye concentrate and DNA gel matrix |
| IKA Basic Chip Vortex | IKA-Werke GmbH & Co. KG | MS-3-S36 | Used for proper mixing of DNA ladder and DNA sample on Bioanalyzer assay chips |
| NucleoSpin Tissue kit | MACHEREY-NAGEL | 740952.5 | With the NucleoSpin Tissue kit, genomic DNA can be prepared from tissue, cells (e.g., bacteria), and many other sources. |
| QIAamp circulating nucleic acid kit | Qiagen | 55114 | The QIAamp Circulating Nucleic Acid Kit enables efficient purification of these circulating nucleic acids from human plasma or serum and other cell-free body fluids. |
| QIAvac 24 Plus vacuum manifold | Qiagen | 19413 | The QIAvac 24 Plus vacuum manifold is designed for vacuum processing of QIAGEN columns in parallel. |
| QIAvac Connecting System | Qiagen | 19419 | In combination with the QIAvac Connecting System, the QIAvac 24 Plus vacuum manifold can be used as a flow-through system. The sample flow-through, containing possibly infectious material, is collected in a separate waste bottle. |
| Qubit 2.0 fluorometer | Invitrogen | Q32866 | The Qubit 2.0 Fluorometer is an easy-to-use, analytical instrument designed to work with the Qubit assays for DNA, RNA, and protein quantitation. |
| Qubit assay tubes | Thermo Fisher Scientific | Q32856 | Qubit assay tubes are 500 µL thin-walled polypropylene tubes for use with the Qubit Fluorometer. |
| Qubit dsDNA HS Assay Kit | Thermo Fisher Scientific | Q32851 | The Qubit dsDNA HS (High Sensitivity) Assay Kit is designed specifically for use with the Qubit Fluorometer. The assay is highly selective for double-stranded DNA (dsDNA) over RNA and is designed to be accurate for initial sample concentrations from 10 pg/µL to 100 ng/µL. |
| Vacuum Pump | Qiagen | 84010 | used for vacuum processing of QIAGEN columns |
| Miscellaneous | |||
| 50 ml centrifuge tubes | |||
| Crushed ice | |||
| Ethanol (96–100%) | |||
| Heating block or similar at 56 °C (capable of holding 2 ml collection tubes) | |||
| Isopropanol (100%) | |||
| Microcentrifuge | |||
| Phosphate-buffered saline (PBS) | |||
| Pipettes (adjustable) | |||
| Sterile pipette tips (pipette tips with aerosol barriers are recommended to help prevent cross-contamination) | |||
| Water bath or heating block capable of holding 50 mL centrifuge tubes at 60 °C |
Ссылки
- Campbell, P. J., et al. Pan-cancer analysis of whole genomes. Nature. 578 (7793), 82-93 (2020).
- Liotta, L., Petricoin, E. Molecular profiling of human cancer. Nature Reviews Genetics. 1 (1), 48-56 (2000).
- Balamurali, D., et al. ChiTaRS 5.0: the comprehensive database of chimeric transcripts matched with druggable fusions and 3D chromatin maps. Nucleic Acids Research. 48 (1), 825-834 (2019).
- Trédan, O., et al. Molecular screening program to select molecular-based recommended therapies for metastatic cancer patients: Analysis from the ProfiLER trial. Annals of Oncology. 30 (5), 757-765 (2019).
- Oliveira, K. C. S., et al. Current perspectives on circulating tumor DNA, precision medicine, and personalized clinical management of cancer. Molecular Cancer Research. 18 (4), 517-528 (2020).
- Siegal, T. Clinical impact of molecular biomarkers in gliomas. Journal of Clinical Neuroscience. 22 (3), 437-444 (2015).
- Komori, T. The 2016 WHO Classification of Tumours of the Central Nervous System: The Major Points of Revision. Neurologia medico-chirurgica. 57 (7), 301-311 (2017).
- Duffy, M. J., O'Donovan, N., Crown, J. Use of molecular markers for predicting therapy response in cancer patients. Cancer Treatment Reviews. 37 (2), 151-159 (2011).
- Saenz-Antoñanzas, A., et al. Liquid Biopsy in Glioblastoma: Opportunities, Applications and Challenges. Cancers. 11 (7), 950 (2019).
- Marrugo-Ramírez, J., Mir, M., Samitier, J. Blood-Based Cancer Biomarkers in Liquid Biopsy: A Promising Non-Invasive Alternative to Tissue Biopsy. International Journal of Molecular Sciences. 19 (10), 2877 (2018).
- Pantel, K., Alix-Panabières, C. Liquid biopsy in 2016: Circulating tumour cells and cell-free DNA in gastrointestinal cancer. Nature Reviews Gastroenterology & Hepatology. 14 (2), 73-74 (2017).
- Bronkhorst, A. J., et al. The emerging role of cell-free DNA as a molecular marker for cancer management. Biomolecular Detection and Quantification. 17, 100087 (2019).
- Cescon, D. W., Bratman, S. V., Chan, S. M., Siu, L. L. Circulating tumor DNA and liquid biopsy in oncology. Nature Cancer. 1 (3), 276-290 (2020).
- Palmirotta, R., et al. Liquid biopsy of cancer: a multimodal diagnostic tool in clinical oncology. Therapeutic Advances in Medical Oncology. 10, 175883591879463 (2018).
- Cohen, J. D. J., et al. Detection and localization of surgically resectable cancers with a multi-analyte blood test. Science. 359 (6378), 926-930 (2018).
- Wan, J. C. M., et al. Liquid biopsies come of age: towards implementation of circulating tumour DNA. Nature Reviews Cancer. 17 (4), 223-238 (2017).
- Heitzer, E., Haque, I. S., Roberts, C. E. S., Speicher, M. R. Current and future perspectives of liquid biopsies in genomics-driven oncology. Nature Reviews Genetics. 20 (2), 71-88 (2018).
- Thierry, A. R., et al. Origins, structures, and functions of circulating DNA in oncology. Cancer and Metastasis Reviews. 35 (3), 347-376 (2016).
- Buscail, E., et al. High Clinical Value of Liquid Biopsy to Detect Circulating Tumor Cells and Tumor Exosomes in Pancreatic Ductal Adenocarcinoma Patients Eligible for Up-Front Surgery. Cancers. 11 (11), 1656 (2019).
- Heitzer, E., Ulz, P., Geigl, J. B. Circulating Tumor DNA as a Liquid Biopsy for Cancer. Clinical Chemistry. 61 (1), 112-123 (2015).
- Kustanovich, A., Schwartz, R., Peretz, T., Grinshpun, A. Life and death of circulating cell-free DNA. Cancer Biology and Therapy. 20 (8), 1057-1067 (2019).
- Crowley, E., Di Nicolantonio, F., Loupakis, F., Bardelli, A. Liquid biopsy: monitoring cancer-genetics in the blood. Nature Reviews Clinical Oncology. 10 (8), 472-484 (2013).
- Celec, P., et al. Cell-free DNA: the role in pathophysiology and as a biomarker in kidney diseases. Expert Reviews in Molecular Medicine. 20, (2018).
- Gautschi, O., et al. Origin and prognostic value of circulating KRAS mutations in lung cancer patients. Cancer Letters. 254 (2), 265-273 (2007).
- Bidard, F., et al. Detection rate and prognostic value of circulating tumor cells and circulating tumor DNA in metastatic uveal melanoma. International Journal of Cancer. 134 (5), 1207-1213 (2013).
- Chan, K. C. A., et al. Analysis of Plasma Epstein–Barr Virus DNA to Screen for Nasopharyngeal Cancer. New England Journal of Medicine. 377 (6), 513-522 (2017).
- Mao, L., et al. Detection of Oncogene Mutations in Sputum Precedes Diagnosis of Lung Cancer. Cancer Research. 54 (7), 1634-1637 (1994).
- De Mattos-Arruda, L., et al. Cerebrospinal fluid-derived circulating tumour DNA better represents the genomic alterations of brain tumours than plasma. Nature communications. 6 (1), 8839 (2015).
- Khier, S., Lohan, L. Kinetics of circulating cell-free DNA for biomedical applications: critical appraisal of the literature. Future science OA. 4 (4), 295 (2018).
- Misale, S., et al. Resistance to Anti-EGFR therapy in colorectal cancer: From heterogeneity to convergent evolution. Cancer Discovery. 4 (11), 1269-1280 (2014).
- Beddowes, E., Sammut, S. J., Gao, M., Caldas, C. Predicting treatment resistance and relapse through circulating DNA. Breast. 34, 31-35 (2017).
- Sacher, A. G., et al. Prospective Validation of Rapid Plasma Genotyping for the Detection of EGFR and KRAS Mutations in Advanced Lung Cancer. JAMA oncology. 2 (8), 1014-1022 (2016).
- Vaidyanathan, R., et al. Cancer diagnosis: from tumor to liquid biopsy and beyond. Lab on a Chip. 19 (1), 11-34 (2019).
- Kelly, P. Gliomas: Survival, origin and early detection. Surgical Neurology International. 1 (1), 96 (2010).
- Faria, G., Silva, E., Da Fonseca, C., Quirico-Santos, T. Circulating Cell-Free DNA as a Prognostic and Molecular Marker for Patients with Brain Tumors under Perillyl Alcohol-Based Therapy. International Journal of Molecular Sciences. 19 (6), 1610 (2018).
- Liu, M. C., et al. Sensitive and specific multi-cancer detection and localization using methylation signatures in cell-free DNA. Annals of Oncology. 31 (6), 745-759 (2020).
- Enko, D., Halwachs-Baumann, G., Kriegshäuser, G. Plasma free DNA: Evaluation of temperature-associated storage effects observed for roche cell-free DNA collection tubes. Biochemia Medica. 29 (1), 153-156 (2019).
- Streleckiene, G., et al. Effects of Quantification Methods Isolation Kits, Plasma Biobanking, and Hemolysis on Cell-Free DNA Analysis in Plasma. Biopreservation and Biobanking. 17 (6), 553-561 (2019).
- Thress, K. S., et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M. Nature Medicine. 21 (6), 560-562 (2015).
- Ward Gahlawat, A., et al. Evaluation of Storage Tubes for Combined Analysis of Circulating Nucleic Acids in Liquid Biopsies. International Journal of Molecular Sciences. 20 (3), 704 (2019).
- Lu, J. L., Liang, Z. Y. Circulating free DNA in the era of precision oncology: Pre- and post-analytical concerns. Chronic Diseases and Translational Medicine. 2 (4), 223-230 (2016).
- Iyapparaj, P., et al. Optimization of bacteriocin production by Lactobacillus sp. MSU3IR against shrimp bacterial pathogens. Aquatic Biosystems. 9 (1), 12 (2013).
- Ponti, G., et al. The value of fluorimetry (Qubit) and spectrophotometry (NanoDrop) in the quantification of cell-free DNA (cfDNA) in malignant melanoma and prostate cancer patients. Clinica Chimica Acta. 479, 14-19 (2018).
- Medina Diaz, I., et al. Performance of Streck cfDNA blood collection tubes for liquid biopsy testing. PLoS One. 11 (11), 0166354 (2016).
- Perkins, G., et al. Multi-Purpose Utility of Circulating Plasma DNA Testing in Patients with Advanced Cancers. PLoS One. 7 (11), 47020 (2012).
- Mouliere, F., et al. Multi-marker analysis of circulating cell-free DNA toward personalized medicine for colorectal cancer. Molecular Oncology. 8 (5), 927-941 (2014).
- Trigg, R. M., Martinson, L. J., Parpart-Li, S., Shaw, J. A. Factors that influence quality and yield of circulating-free DNA: A systematic review of the methodology literature. Heliyon. 4 (7), 00699 (2018).
- Risberg, B., et al. Effects of Collection and Processing Procedures on Plasma Circulating Cell-Free DNA from Cancer Patients. Journal of Molecular Diagnostics. 20 (6), 883-892 (2018).
- Markus, H., et al. Evaluation of pre-analytical factors affecting plasma DNA analysis. Scientific Reports. 8 (1), 7375 (2018).
- Chen, Z., et al. Comprehensive Evaluation of the Factors Affecting Plasma Circulating Cell-Free DNA Levels and Their Application in Diagnosing Nonsmall Cell Lung Cancer. Genetic Testing and Molecular Biomarkers. 23 (4), 270-276 (2019).
- Schwarzenbach, H., Hoon, D. S. B., Pantel, K. Cell-free nucleic acids as biomarkers in cancer patients. Nature Reviews Cancer. 11 (6), 426-437 (2011).
- Malyuchenko, N. V., et al. PARP1 Inhibitors: antitumor drug design. Acta Naturae. 7 (3), 27-37 (2015).
- Fleischhacker, M., Schmidt, B. Circulating nucleic acids (CNAs) and cancer-A survey. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1775 (1), 181-232 (2007).
- Jung, K., Fleischhacker, M., Rabien, A. Cell-free DNA in the blood as a solid tumor biomarker—A critical appraisal of the literature. Clinica Chimica Acta. 411 (21-22), 1611-1624 (2010).
- Frenkel-Morgenstern, M., et al. ChiTaRS: a database of human, mouse and fruit fly chimeric transcripts and RNA-sequencing data. Nucleic Acids Research. 41, 142-151 (2013).
- Frenkel-Morgenstern, M., et al. ChiTaRS 2.1--an improved database of the chimeric transcripts and RNA-seq data with novel sense-antisense chimeric RNA transcripts. Nucleic Acids Research. 43, 68-75 (2015).
- Gorohovski, A., et al. ChiTaRS-3.1-the enhanced chimeric transcripts and RNA-seq database matched with protein-protein interactions. Nucleic Acids Research. 45 (1), 790-795 (2017).
- Tate, J. G., et al. COSMIC: the Catalogue Of Somatic Mutations In Cancer. Nucleic Acids Research. 47 (1), 941-947 (2019).
- Brennan, C. W., et al. The somatic genomic landscape of glioblastoma. Cell. 155 (2), 462-477 (2013).
- Szopa, W., Burley, T. A., Kramer-Marek, G., Kaspera, W. Diagnostic and Therapeutic Biomarkers in Glioblastoma: Current Status and Future Perspectives. BioMed Research International. 2017, 1-13 (2017).
- Salesse, S., Verfaillie, C. M. BCR/ABL: from molecular mechanisms of leukemia induction to treatment of chronic myelogenous leukemia. Oncogene. 21 (56), 8547-8559 (2002).
- Frenkel-Morgenstern, M., Valencia, A. Novel domain combinations in proteins encoded by chimeric transcripts. Bioinformatics. 28 (12), 67-74 (2012).
- Frenkel-Morgenstern, M., et al. Chimeras taking shape: Potential functions of proteins encoded by chimeric RNA transcripts. Genome Research. 22 (7), 1231-1242 (2012).
- Simon, M., et al. TERT promoter mutations: a novel independent prognostic factor in primary glioblastomas. Neuro-Oncology. 17 (1), 45-52 (2015).
- Waitkus, M. S., Diplas, B. H., Yan, H. Isocitrate dehydrogenase mutations in gliomas. Neuro-Oncology. 18 (1), 16-26 (2016).
- Kindler, T., Meyer, R. G., Fischer, T. BCR-ABL as a target for novel therapeutic interventions. Expert Opinion on Therapeutic Targets. 6 (1), 85-101 (2002).
- Overman, M. J., et al. Use of research biopsies in clinical trials: are risks and benefits adequately discussed. Journal of Clinical Oncology Official Journal of the American Society of Clinical Oncology. 31 (1), 17-22 (2013).
- Vanderlaan, P. A., et al. Success and failure rates of tumor genotyping techniques in routine pathological samples with non-small-cell lung cancer. Lung Cancer. 84 (1), 39-44 (2014).
- Stewart, C. M., Tsui, D. W. Y. Circulating cell-free DNA for non-invasive cancer management. Cancer Genetics. 228-229, 169-179 (2018).
- Normanno, N., et al. The liquid biopsy in the management of colorectal cancer patients: Current applications and future scenarios. Cancer Treatment Reviews. 70, 1-8 (2018).
- Hufnagl, C., et al. Evaluation of circulating cell-free DNA as a molecular monitoring tool in patients with metastatic cancer. Oncology Letters. 19 (2), 1551-1558 (2020).
- Petit, J., et al. Cell-Free DNA as a Diagnostic Blood-Based Biomarker for Colorectal Cancer: A Systematic Review. The Journal of Surgical Research. 236, 184-197 (2019).
- Poulet, G., Massias, J., Taly, V. Liquid Biopsy: General Concepts. Acta Cytologica. 63 (6), 449-455 (2019).
- Alix-Panabières, C. The future of liquid biopsy. Nature. 579 (7800), 9 (2020).
- Eisenstein, M. Could liquid biopsies help deliver better treatment. Nature. 579 (7800), 6-8 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены