É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Detecção de DNA livre de células em amostras de plasma de sangue de pacientes com câncer
Neste Artigo
Resumo
Neste artigo apresentamos um protocolo detalhado para a técnica de biópsia líquida não invasiva, incluindo coleta de sangue, separação de plasma e casaco buffy, extração de DNA cfDNA e germinal, quantificação de DNA cfDNA ou germinal, e análise de enriquecimento de fragmentos cfDNA.
Resumo
Identificar mutações em tumores de pacientes com câncer é um passo muito importante no manejo da doença. Essas mutações servem como biomarcadores para o diagnóstico de tumor, bem como para a seleção do tratamento e sua resposta em pacientes com câncer. O método padrão-ouro atual para detectar mutações tumorais envolve um teste genético do DNA tumoral por meio de biópsias tumorais. No entanto, este método invasivo é difícil de ser realizado repetidamente como um teste de acompanhamento do repertório mutacional tumoral. A biópsia líquida é uma técnica nova e emergente para detectar mutações tumorais como uma abordagem de biópsia fácil de usar e não invasiva.
As células cancerígenas se multiplicam rapidamente. Paralelamente, inúmeras células cancerígenas sofrem apoptose. Detritos dessas células são liberados no sistema circulatório de um paciente, juntamente com pedaços de DNA finamente fragmentados, chamados fragmentos de DNA livre de células (CFDNA), que carregam mutações de DNA tumoral. Portanto, para identificar biomarcadores à base de CFDNA utilizando a técnica de biópsia líquida, amostras de sangue são coletadas dos pacientes com câncer, seguidas pela separação de plasma e casaco buffy. Em seguida, o plasma é processado para o isolamento do CFDNA, e o respectivo casaco buffy é processado para o isolamento do DNA genômico de um paciente. Ambas as amostras de ácido nucleico são então verificadas quanto à sua quantidade e qualidade; e analisado para mutações usando técnicas de sequenciamento de última geração (NGS).
Neste manuscrito, apresentamos um protocolo detalhado para biópsia líquida, incluindo coleta de sangue, plasma e separação de casacos buffy, extração de DNA cfDNA e germinal, quantificação de DNA cfDNA ou germinal, e análise de enriquecimento de fragmentos cfDNA.
Introdução
Os avanços tecnológicos levaram ao sequenciamento de centenas de genomas cancerígenos e transcritos1. Isso contribuiu para a compreensão das paisagens das mudanças moleculares em diferentes tipos de câncer2. Outros estudos sobre essas paisagens ajudaram a caracterizar as alterações sommáticas sequenciais e as fusões gene-gene3 que estão envolvidas na progressão do câncer ou tumor, interrompendo seriamente as vias de apoptose4. Portanto, mutações somáticas e fusões gene-gene podem fornecer informações sobre tumores servindo como biomarcadores em pacientes individuais para um determinado tumor tipo5, identificando o prognóstico de tumores primários existentes6,categorizando tumores secundários baseados em alterações moleculares7e identificando alvos tumorais drogados8. Essas informações podem facilitar na seleção do tratamento personalizado para pacientes com câncer e na determinação de respostas positivas e negativas ao tratamento9. No entanto, a obtenção de material tumoral para identificação de perfil genômico do tecido tumoral é um procedimento invasivo10. Além disso, uma biópsia tumoral compreende apenas uma pequena parte de um tumor heterogêneo; e pode, portanto, não ser representativo para o perfil molecular de todo o tumor11. O monitoramento serial e a genotipagem tumoral requerem uma coleta repetida de tecidos tumorais, o que, geralmente, não é viável devido à invasão do procedimento de biópsia tumoral e às questões de segurança decorrentes desses procedimentos12.
A técnica de biópsia líquida, por outro lado, ganhou uma tremenda atenção na oncologia de precisão na última década13,14. Deve-se principalmente à não invasiva dessa técnica, e à possibilidade de ser repetida em vários momentos, possibilitando assim uma técnica de monitoramento fácil de usar e segura para os cursos da doença15,16. A biópsia líquida é baseada em um fenômeno que as células tumorais se multiplicam rapidamente, e simultaneamente muitas delas sofrem apoptose e necrose. Isso leva à liberação de detritos celulares apoptóticos no sangue dos pacientes, juntamente com os fragmentos de DNA que são cortados em tamanhos precisos durante a apoptose17. A apoptose de células não cancerosas também leva à liberação de seus detritos celulares no sangue, no entanto, a taxa de apoptose nessas células é relativamente muito menor do que as células tumorais18. O racional da técnica de biópsia líquida é capturar moléculas associadas ao tumor, como DNA, RNA, proteínas e células tumorais14,19 que circulam continuamente no sangue. Várias técnicas20 podem ser usadas para a análise dessas moléculas, incluindo Sequenciamento de Próxima Geração (NGS), reação em cadeia de polimerase de gotícula digital (ddPCR), PCR em tempo real e ensaio imunosorbente ligado à enzima (ELISA). A técnica de biópsia líquida permite identificar biomarcadores que são características das células tumorais. Essas moléculas biomarcadores não são apenas liberadas de partes específicas de um tumor, mas sim de todas as partes do tumor21. Assim, os marcadores identificados na biópsia líquida representam o perfil molecular de todo um tumor heterogêneo, além de outros tumores no corpo, tendo vantagens sobre a técnica baseada em biópsiatecidual 22.
O cfDNA tem um curto tempo de meia-vida no sangue circulante que varia de alguns minutos a 1-2 horas23. No entanto, o curto tempo de meia-vida do CFDNA facilita análises em tempo real, avaliando a resposta ao tratamento e avaliações dinâmicas do tumor. Os níveis de CFDNA derivados do tumor indicam prognóstico do estágio/tamanho do tumor evidenciado por diversos estudos, que mostraram relação entre os níveis de CFDNA e os desfechos de sobrevivência24. Além disso, estudos comprovaram que o CFDNA tem uma melhor capacidade de previsão do que os marcadores tumorais existentes25. O prognóstico do CFDNA é ainda mais acentuado após o tratamento do câncer, níveis mais elevados de CFDNA após o tratamento correlaciona-se bem com uma taxa reduzida de sobrevivência e resistência ao tratamento. Considerando que os níveis mais baixos de CFDNA após a terapia geralmente correspondem à resposta positiva ao tratamento. Além disso, o CFDNA facilita a detecção precoce da resposta ao tratamento do que os métodos tradicionais de detecção.
O CFDNA aumenta a possibilidade de detecção precoce de mutações associadas ao câncer: durante a doença em estágio inicial15, o aparecimento dos sintomas26 e antes do diagnóstico de câncer até 2 anos27. Como o CFDNA é liberado de múltiplas regiões tumorais ou focos, sua análise fornece uma visão abrangente do genoma tumoral que representa28. Portanto, o CFDNA permite detectar mutações somáticas que podem ter sido perdidas nas amostras de tecido29. Como a heterogeneidade intra-tumoral e mutações subclonais podem ser detectadas pelo sequenciamento profundo de regiões genômicas que abrangem milhares de bases, daí a análise do CFDNA permite descobrir subtipos moleculares específicos com assinaturas genômicas distintas13. Para obter um nível semelhante de informação através da amostra de tecido muitas biópsias sólidas teriam sido necessárias.
Além disso, os níveis de CFDNA em pacientes com uma doença localizada, como câncer de cólon, ovário e pulmão após tratamento cirúrgico e/ou quimioterapia, demonstraram ser um poderoso marcador prognóstico para a recidiva do câncer e os resultados do tratamento20. Além disso, em pacientes com câncer de cólon, mama e pulmão, análises de CFNA do sangue puderam detectar com sucesso as alterações específicas do tumor, o que levou à previsão precisa de recidiva com vários meses de antecedência13. Além disso, os marcadores de resistência ao tratamento, como mutações kras em pacientes com CRC recebendo terapia anti-EGFR30; VAFs para genes como PIK3CA, MED1 ou EGFR em pacientes com câncer de mama após o tratamento com várias terapias31; e a mutação de resistência EGFR T790M em pacientes com câncer de pulmão tratada com TKIs32 direcionados ao EGFR também podem ser identificadas pela análise de CFDNA.
Em resumo, a análise cfDNA pode ser utilizada para identificar biomarcadores precisos no campo da oncologia13,33. Neste protocolo, amostras de sangue de 3 pacientes com glioma e 3 controles saudáveis foram processadas para obter DNA genômico de WBCs e CFDNA do plasma. No câncer de glioma, mutações em IDH, TERT, ATRX, EGFR e TP53 servem como diagnóstico, bem como marcadores prognósticos que podem ajudar no diagnóstico precoce de tumores glioma, classificando diferentes tipos de tumores de glioma, orientando o tratamento preciso para o paciente individual e entendendo a resposta ao tratamento34,35. O status mutacional desses genes pode ser identificado usando cfDNA derivado do sangue. Neste manuscrito, apresentamos um protocolo detalhado de CFDNA derivado do plasma que tem sido usado para estudar alterações mutacionais no câncer de glioma12. Esse protocolo de biópsia líquida baseado em CFDNA explicado neste artigo pode ser usado para estudar alterações mutacionais em muitos outros tipos de câncer. Além disso, um estudo recente mostrou que a biópsia líquida baseada em CFDNA pode detectar 50 tipos diferentes decânceres 36.
A coleta, o armazenamento e o envio de amostras de sangue são etapas cruciais neste protocolo, pois a temperatura descontrolada durante essas etapas causa lise dos WBCs, levando à liberação de DNA genômico do WBC no plasma e causando contaminação da amostra de CFDNA, que afeta o resto do procedimento37. A hemólise devido à temperatura descontrolada pode prejudicar os processos de preparação da amostra a jusante do CFDNA, como as etapas38do PCR . O soro contém uma alta proporção de cfDNA germinal em vez de plasma, embora apresente um grande ruído de fundo para cfDNA39associada ao tumor . Portanto, para isolar o CFDNA associado ao tumor, o plasma é uma amostra adequada39. O sangue extraído em um anticoagulante contendo tubo de coleta de sangue deve ser centrifutor imediatamente ou dentro de até duas horas, para separar o plasma e evitar a contaminação por CFDNA. Neste protocolo são utilizados tubos comerciais dedicados de coleta de sangue cfDNA (ver Tabela de Materiais),que são uma alternativa ao anticoagulante contendo tubos de coleta de sangue. Estes tubos dedicados de coleta de sangue preservam cfDNA e cfRNA, e previne a lise de WBCs por até 30 dias a temperatura ambiente, e até 8 dias a 37 °C. Isso facilita a manutenção da temperatura apropriada durante um carregamento de amostras de sangue e até que o plasma e o WBC sejam separados40.
Existem três tipos de metodologias de extração de CFDNA atualmente disponíveis: isolamento de fase, coluna de spin baseada em membrana de silício e isolamento à base de contasmagnéticas 41. O método da coluna spin baseada em membrana de silício rendeu uma alta quantidade de cfDNA com alta integridade em comparação com outros métodos de extração de CFDNA42.
A avaliação quantitativa do DNA é um requisito fundamental na biópsia líquida, há a necessidade de desenvolver um procedimento simples, acessível e padronizado para sua fácil implementação e amplo uso. Três métodos comumente utilizados para quantificação de CFDNA são espectrofotométrico, fluorimétrico e qPCR. O método fluorimétrico é comprovado melhor em relação aos outros métodos relativos à precisão, custo e facilidade de condução43.
A integridade e pureza do CFDNA podem ser estimadas por eletroforese agarose ou eletroforese capilar. A eletroforese agarose não mostra sensibilidade na baixa concentração de CFDNA nem tem alta resolução para mostrar o tamanho preciso do fragmento de cfDNA. Por outro lado, a eletroforese capilar tem uma vantagem sobre a eletroforese agarose, superando os desafios associados e, portanto, amplamente utilizada pelos pesquisadores para a análise do tamanho do fragmento de CFDNA. Neste protocolo, a distribuição do tamanho do fragmento do CFDNA isolado foi estimada utilizando um instrumento automatizado de eletroforese capilar (ver Tabela de Materiais).
Protocolo
Antes da coleta de sangue, é necessário o consentimento informado dos sujeitos participantes da pesquisa e deve ser obtido. A pesquisa descrita neste manuscrito foi realizada de acordo com o Rabin Medical Center, o Comitê de Ética de Israel (código de ética: 0039-17-RMC) e a Faculdade de Medicina Der Christian-Albrechts-Universität zu Kiel, comitê de ética da Alemanha (código de ética: D 405/14).
1. Coleta e armazenamento de amostras de sangue em tubos de conservante cfDNA ou cfRNA
- Rotule corretamente os tubos de preservação
- Colete ~8 mL de sangue no tubo de preservação cf-DNA (ver Tabela de Materiais),utilizando um conjunto de coleta de sangue e um suporte, conforme o protocolo institucional padrão para venipuntura conforme descrito abaixo.
NOTA: O uso de um conjunto de coleta de sangue pode impedir um possível refluxo do sangue do tubo.- Alinhe o paciente com o braço em posição descendente.
- Segure o tubo ereto, com a tampa virada para cima, garantindo que o conteúdo do tubo não toque na tampa ou na ponta da agulha.
- À medida que o sangue começa a fluir para o tubo, solte o torniquete lentamente.
- Imediatamente após o tubo ser preenchido com sangue (capacidade máxima: 8,4 mL de sangue inteiro), inverta suavemente o tubo (gire o pulso do braço que está segurando o tubo em 180° para baixo e para trás) 5 vezes para estabilizar a amostra.
NOTA: A inversão garante que o conservante seja misturado uniformemente com a amostra. No entanto, não agite o conteúdo novamente, mesmo antes da preparação do plasma. A mistura insuficiente de conservantes com a amostra de sangue leva à desestabilização do conteúdo e à formação de micro coágulos ou hemólise. Nesta fase, o protocolo pode ser continuado imediatamente para separação de plasma ou tubos cheios de sangue podem esperar até 30 dias à temperatura ambiente (15-25 °C), e até 8 dias a 37 °C.
2. Separação e armazenamento de casacos de plasma e buffy
- Centrifugar o tubo de preservação cheio de sangue a 425 x g por 20 minutos à temperatura ambiente para separar o plasma.
NOTA: As etapas 2.2 e 2.3 devem ser realizadas em um gabinete de biossegurança. - Pipeta cuidadosamente a camada de plasma superior para um tubo fresco em alíquotas de 1 mL, sem perturbar as camadas inferiores.
- Transfira cuidadosamente a próxima camada de casaco buffy para um tubo fresco (a camada aparece como um anel acima das pelotas RBC), evitando RBCs na camada inferior.
- Vá para o passo 3 com plasma e passo 4 com o casaco buffy. Se necessário, armazene o conteúdo separado a -80 °C.
3. Purificação de cfDNA circulante de 1 mL de plasma
NOTA: Esta etapa é realizada com um kit comercial (ver Tabela de Materiais). Todos os buffers são fornecidos com o kit.
- Preparação de tampões e reagentes
ATENÇÃO: Não adicione soluções ácidas ou alvejante diretamente aos resíduos de preparação da amostra. Os sais de guanidina presentes no tampão de lysis, tampão de ligação e buffer de lavagem-1 quando combinados com alvejante ou ácidos podem produzir compostos altamente reativos.- Tampão de ligação: Misture 300 mL de concentrado tampão de ligação com 200 mL de isopropanol de 100% para fazer 500 mL de buffer de ligação de funcionamento. Armazene à temperatura ambiente.
NOTA: O tampão de ligação permite a ligação ideal dos ácidos nucleicos circulantes à membrana de sílica. 500 mL do tampão de ligação é suficiente para o processamento de 276, 138, 92, 69 ou 55 amostras de 1, 2, 3, 4 ou 5 mL de plasma, respectivamente, e é estável por 1 ano à temperatura ambiente. - Wash Buffer-1: Misture 19 mL de concentrado Wash Buffer-1 com 25 mL de 96-100% de etanol para fazer 44 mL de wash buffer-1. Armazene à temperatura ambiente.
NOTA: O Buffer-1 elimina os contaminantes ligados à membrana de sílica. 44 mL de wash buffer-1 de trabalho é suficiente para processar 73 amostras de 1/2/3/4/5 mL de plasma e está estável por 1 ano à temperatura ambiente. - Wash Buffer-2: Misture bem 13 mL De concentrado tampão-2 com 30 mL de 96-100% de etanol para fazer 43 mL de wash buffer-2. Armazene à temperatura ambiente.
NOTA: O Buffer-2 elimina os contaminantes ligados à membrana de sílica. 43 mL de wash buffer-2 de trabalho é suficiente para processar ~56 amostras de 1/2/3/4/5 mL de plasma e está estável por 1 ano à temperatura ambiente. - A um tubo contendo RNA portador liofilizado de 310 μg, adicione 1.550 μL de tampão de Elução, para preparar uma solução de RNA portadora de 0,2 μg/μL. Depois de dissolver completamente o RNA da transportadora, divida a solução para alíquotas adequadas e armazene a -30 °C a -15 °C. Não congele essas alíquotas mais de 3 vezes. Ao buffer de Lise, como mostrado na Tabela S1,adicione o RNA da transportadora reconstituída dissolvido no buffer de Elução.
NOTA: Como o RNA da operadora não se dissolve diretamente no buffer Lysis, ele precisa ser dissolvido primeiro em um buffer de elução e, em seguida, no Lysis Buffer. Em primeiro lugar, a ligação de ácidos nucleicos de membrana sílica é aprimorada quando há muito poucas moléculas-alvo presentes na amostra. Em segundo lugar, o risco de degradação do RNA é reduzido devido à presença de grandes quantidades de RNA portadora.
- Tampão de ligação: Misture 300 mL de concentrado tampão de ligação com 200 mL de isopropanol de 100% para fazer 500 mL de buffer de ligação de funcionamento. Armazene à temperatura ambiente.
- Antes de iniciar o isolamento, leve as colunas e amostras à temperatura ambiente e ajuste os volumes amostrais para 1 mL com soro fisiológico estéril tamponado (PBS), se necessário. Pré aqueça 2 banhos de água ou blocos de aquecimento que contenham tubos de centrífugas de 50 mL e tubos de coleta de 2 mL a 60 °C e 56 °C, respectivamente.
- A um tubo centrífuga de 50 mL, adicione 100 μL de Proteinase K, plasma de 1 mL e 0,8 mL de tampão de Lysis contendo 1,0 μg de RNA portador (preparado na etapa 3.1.4). Feche o tubo de centrífuga com uma tampa e misture o conteúdo por vórtice de pulso por 30 s, ao mesmo tempo em que garante um vórtice visível no tubo. A mistura completa do conteúdo é importante para uma lise eficiente.
NOTA: Imediatamente após o vórtice, proceda à etapa 3.4, sem demora. - Incubar a solução a 60 °C por 30 min.
- Remova a tampa, adicione 1,8 mL do tampão de ligação ao tubo e misture completamente com vórtice de pulso para 15-30 s depois de colocar a tampa.
- Incubar a mistura resultante por 5 minutos no gelo e inserir a coluna da membrana de sílica no aparelho de vácuo que está conectado à bomba de vácuo. Em seguida, insira firmemente um extensor de tubo de 20 mL na coluna aberta para evitar vazamento de amostras.
- Despeje cuidadosamente a mistura incubada no extensor do tubo da coluna e ligue a bomba de vácuo. Depois de toda a mistura de lisato completamente correr através das colunas, desligue a bomba de vácuo, solte a pressão para 0 mbar e remova e descarte o extensor do tubo.
NOTA: Evitando contaminação cruzada, o extensor do tubo deve ser descartado cuidadosamente, para evitar que se espalhe sobre colunas adjacentes. - Remova a coluna do aparelho de vácuo, insira no tubo de coleta e centrífugas a 11.000 x g por 30 s à temperatura ambiente, para remover qualquer lise residual. Descarte o fluxo.
- Adicione 600 μL de Wash Buffer-1 na coluna, centrífuga a 11.000 x g por 1 min a temperatura ambiente, descarte o fluxo.through.
- Adicione 750 μL de Wash Buffer-2 à coluna, centrífuga a 11.000 x g por 1 min a temperatura ambiente e descarte o fluxo.through.
- Adicione 750 μL de etanol (96-100%) à coluna, centrífuga a 11.000 x g por 1 min a temperatura ambiente e descarte o fluxo..
- Centrifugar a coluna a 20.000 x g por 3 min, colocando-a em um tubo de coleta de 2 mL limpo.
- Seque completamente o conjunto da coluna de membrana colocando-a em um novo tubo de coleta de 2 mL com a tampa aberta e incubando a 56 °C por 10 minutos.
- Coloque a coluna em um tubo de eluição limpo de 1,5 mL. No centro da membrana da coluna, aplique 20-150 μL de tampão de elução e incubar à temperatura ambiente por 3 minutos com a tampa fechada.
NOTA: Certifique-se de que o buffer de elução está equilibrado à temperatura ambiente. Em caso de uso do tampão de elução inferior a 50 μL, certifique-se de que ele seja dispensado cuidadosamente no centro da membrana. Isso ajuda com a elução completa do DNA vinculado. No entanto, o volume de elução não é fixo e pode ser alterado de acordo com as aplicações a jusante. O eluato recuperado pode ser de até 5 μL e certamente menor do que o volume de elução aplicado à coluna. - Centrifugar o eluato recuperado em uma microcentrifuuge a 20.000 x g por 1 min para eluto os ácidos nucleicos, e armazenar a -20 °C.
4. Purificação de DNA genômico do casaco buffy
NOTA: O kit comercial utilizado neste protocolo é mencionado na Tabela de Materiais. Buffers e reagentes mencionados no protocolo abaixo, ou seja, tampão de Lysis A, tampão de Lysis B, buffer de lavagem X, Wash Buffer Y, Proteinase Buffer, Buffer de Elução e Proteinase K fazem parte deste kit comercial.
- Preparação dos buffers e reagentes
ATENÇÃO: Não adicione soluções ácidas ou alvejante diretamente aos resíduos de preparação da amostra. Os sais de guanidina presentes no tampão de lysis B e wash buffer X quando combinados com alvejante ou ácidos, podem produzir compostos altamente reativos.- Wash Buffer Y: Misture bem 12 mL de concentrado Wash Buffer Y com 48 mL de etanol (96-100%) para obter 60 mL de lavagem de lavagem de trabalho Y. Armazenar à temperatura ambiente.
NOTA: 60 mL de wash buffer Y de trabalho é suficiente para processar 100 amostras de casaco buffy e está estável por 1 ano. - Proteinase K: Prepare a solução Proteinase K dissolvendo 30 mg de Proteinase K liofilizada em 1,35 mL de Proteinase Buffer.
NOTA: A solução de trabalho total da Proteinase K é suficiente para processar 52 amostras de casacos buffy. A solução de trabalho Proteinase K pode ser armazenada por pelo menos 6 meses a -20 °C.
- Wash Buffer Y: Misture bem 12 mL de concentrado Wash Buffer Y com 48 mL de etanol (96-100%) para obter 60 mL de lavagem de lavagem de trabalho Y. Armazenar à temperatura ambiente.
- Etapas antes do início do procedimento
- Equilibre o casaco de buffy à temperatura ambiente.
- Coloque o bloco de calor ou banho de água a 56 °C.
- Suspenda o casaco buffy no tampão de Lysis A para obter um volume final de 200 μL. Em seguida, adicione 25 μL de solução Proteinase K e 200 μL de tampão de lysis B. Misture por vórtice e incubar a 70 °C por 10-15 min. Certifique-se de que as amostras estão completamente cobertas com a solução de lise.
NOTA: Para a série de processamento de amostras, proteinase K e tampão de lise A podem ser pré-misturadas 10-15 minutos antes do procedimento, mas não mais antes disso, como Proteinase K auto-digerir em Lysis buffer A sem substrato. - Adicione 210 μL de 96-100% de etanol à mistura acima e vórtice vigorosamente.
NOTA: A adição de etanol pode formar um precipitado; no entanto, isso não afetará o isolamento do DNA. Certifique-se de carregar o precipitado também na coluna, como mostrado nas etapas seguintes. - Coloque toda a amostra na coluna de sílica colocada em um tubo de coleta. Centrífuga por 1 min a 11.000 x g. Coloque a coluna em um novo tubo de coleta e descarte o tubo anterior junto com o fluxo.
NOTA: Repita a etapa de centrifugação se a amostra não for completamente desenhada através da matriz. - Adicione 500 μL de wash buffer X, centrífuga por 1 min a 11.000 x g, e descarte o fluxo-through.
- Coloque a coluna no tubo de coleta, adicione 600 μL de Wash Buffer Y na coluna, centrífuga por 1 min a 11.000 x g e descarte o fluxo-through.
- Novamente, coloque a coluna no tubo de coleta e centrífugue a coluna por 1 min a 20.000 x g para secar a membrana de sílica.
- Incubar a coluna em temperatura ambiente por 1 min, colocada em um tubo de microcentrifuuge de 1,5 mL e, em seguida, adicionar 100 μL de tampão de eluição. Em seguida, elute o DNA por centrifugação por 1 min a 11.000 x g e armazenar a -20 °C.
5. Quantificação do DNA cfDNA e genômico usando fluorômetro
- Antes de iniciar o protocolo, execute as seguintes etapas.
- Diluir 2 μL de DNA genômico elucido (a partir da etapa 4.9) em proporções de 1:10 com água ultrapura sem nuclease. Devido às baixas concentrações esperadas, não diluir amostras de CFDNA a partir da etapa 3.15.
- Equilibre o ensaio Padrão #1 e teste Padrão #2 à temperatura ambiente.
- Prepare um total de 6 tubos claros de paredes finas de tamanho de 0,5 mL.
NOTA: O protocolo apresentado é para quantificação de 2 amostras de DNA cfDNA e 2 genômicas, portanto, 4 tubos para 4 amostras e este ensaio requer 2 normas. - Rotule as tampas do tubo.
NOTA: A rotulagem na lateral do tubo pode interferir na leitura. Além disso, os tubos padrão de ensaio são rotulados cuidadosamente, uma vez que a calibração do fluorômetro exige que as normas estejam na ordem correta. - Diluir o reagente de ensaio em 1:200 com o buffer Assay para preparar a solução de trabalho. Para 4 amostras e 2 padrões, use 6 μL de reagente de ensaio mais 1.194 μL de tampão de ensaio para fazer 1.200 μL (200 μL em cada tubo) de solução de trabalho.
NOTA: Não use um recipiente de vidro, em vez disso, use um tubo plástico limpo. Cada tubo deve conter aproximadamente 200 μL do volume final (um tubo padrão de ensaio deve conter 190 μL da solução de trabalho, e o tubo de amostra deve conter 180-199 μL da solução de trabalho). A solução de trabalho suficiente deve ser preparada para acomodar todos os padrões e amostras de ensaio. - Nos tubos padrão de ensaio de funcionamento, adicione 190 μL de solução de trabalho e 10 μL padrão de ensaio e misture a solução com vórtice para 2-3 s. Evite a formação de bolhas dentro da solução.
- Nos tubos de amostra, adicione 198 μL de solução de trabalho e 2 μL de CFDNA ou DNA genômico. Misture a solução por vórtice para 2-3 s, e mantenha-a incubada à temperatura ambiente por 2 minutos.
- Na tela 'Home' do instrumento fluorômetro, pressione 'DNA' e selecione 'dsDNA High Sensitivity Assay', para exibir a tela 'Standards' e, em seguida, pressione 'Sim' na tela 'Standards 'fluorometer' para ler os padrões.
- Na câmara de amostra, insira o tubo de #1 padrão de ensaio, feche a tampa epressione' Leia '. Remova o tubo assim que a leitura estiver concluída (aproximadamente 3 s) e repita o mesmo passo para #2 Padrão.
- Uma tela de amostra é exibida após a conclusão do processo de calibração e, em seguida, insira um tubo de amostra e repita a etapa '5.8'. A "tela de amostra" exibirá então um valor que corresponde à concentração da amostra após a diluição no tubo de amostra.
- Para cada amostra repetir a etapa '5.9', até que todas as amostras sejam lidas.
- Use a seguinte equação para calcular a concentração real da amostra.
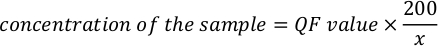
NOTA: Os valores do ensaio estão em ng/mL e correspondem à concentração após a diluição no tubo de ensaio. Equação mencionada na etapa acima 5.11, o valor QF é o valor dado pelo instrumento fluorômetro, e x é o número de microliters de amostra adicionado ao tubo de ensaio. As unidades para valores de QF gerados pela equação são semelhantes ao valor fornecido pelo fluorômetro. Por exemplo, se o valor do fluorômetro estiver em ng/mL, as unidades para a concentração calculada pela equação são ng/mL.
6. Distribuição do tamanho do tamanho do fragmento de DNA do CFDNA por analisador de fragmentos
- O passo antes de iniciar o procedimento: Equilibre o concentrado de corante de DNA e a matriz de gel de DNA à temperatura ambiente por 30 minutos.
- Preparação da mistura gel-corante
ATENÇÃO: Manuseie soluções com cautela, pois o DMSO é conhecido por facilitar a entrada de moléculas orgânicas nos tecidos.- Descongele completamente o DMSO vórtice do frasco de concentrado de corante de DNA para 10 s. Pipeta fora 15 μL deste concentrado em um frasco de matriz de gel de DNA e armazenar a 4 °C no escuro.
- Novamente, o vórtice do frasco tampado por 10 s até a mistura do gel e corante é visualizado.
- Despeje a mistura em um filtro de giro até o recipiente superior.
- Microcentrifugar o filtro de giro a 2.240 x g ± 20% por 10 min a temperatura ambiente.
- Rotule o gel-corante preparado no tubo e descarte o filtro, conforme boas práticas laboratoriais. Rotule o tubo e grave a data da preparação.
NOTA: Descarte o filtrado de acordo com boas práticas laboratoriais. A mistura de gel-corante pode ser usada para 5 chips de DNA de alta sensibilidade (HS). Se não foriado por mais de 1h, armazene a 4 °C. O armazenamento no escuro é possível por até 6 semanas.
- Para carregar a mistura gel-corante, certifique-se da posição da placa base da estação de escoramento do chip e ajuste o clipe na posição mais baixa.
- Equilibre a mistura de gel-corante à temperatura ambiente por 30 minutos, enquanto monitora a exposição à luz.
- Pegue um novo chip de DNA HS de um saco selado e coloque-o na estação de escoramento de chips, em seguida, remova 9,0 μL da mistura de gel-corante e dispense-o na parte inferior do chip bem, marcado como 'G'.
NOTA: Desenhe a mistura gel-corante, evitando partículas que possam se acumular na parte inferior do frasco. Ao dispensar bem a mistura de gel-corante no chip de DNA HS, insira a ponta da pipeta completamente, para evitar a formação de grandes bolhas de ar. Além disso, tocar a pipeta nas bordas do poço produzirá resultados ruins. - Posicione o êmbolo a 1 mL e feche a estação de escoramento de chips. Certifique-se de que a trava clique e defina o temporizador para 60 s, em seguida, pressione o êmbolo para baixo até que ele seja mantido pelo clipe, e exatamente depois dos anos 60, solte o êmbolo com o mecanismo de liberação do clipe.
- Quando o êmbolo recuar pelo menos para a marca de 0,3 mL, espere por 5 s e, em seguida, puxe lentamente de volta para a posição de 1 mL, em seguida, abra a estação de escoramento do chip e remova novamente 9,0 μL da mistura de corante de gel e dispense bem na parte inferior do chip de DNA HS, marcado como 'G'.
- Para carregar o marcador de DNA, dispense 5 μL do marcador de DNA no poço, marcado com o símbolo da escada. Repita o procedimento para todos os 11 poços amostrais.
- Para carregar a escada e as amostras, dispense 1 μL da escada de DNA no poço, marcado com o símbolo da escada e, em seguida, adicione 1 μL de amostra (poços usados) ou 1 μL de marcador (poços não utilizados) em todos os 11 poços amostrais.
- Vórtice o chip de DNA HS para 60 s a 2.400 rpm colocando o chip horizontalmente no adaptador. Certifique-se de que a protuberância que corrige o chip de DNA HS não esteja danificada durante o vórtice.
- Para inserir o chip de DNA HS no instrumento analisador de fragmentos, abra a tampa e certifique-se de que o cartucho de eletrodo esteja devidamente inserido, e o seletor de chip esteja posicionado para 'dsHigh Sensitivity DNA' no instrumento analisador de fragmentos.
- Monte cuidadosamente o chip de DNA HS no recipiente, que se encaixa apenas de uma maneira, em seguida, perca a tampa, garantindo que o cartucho de eletrodo se encaixe exatamente nos poços do chip de DNA HS.
- O display na tela de software do analisador de fragmentos indica o chip de DNA HS inserido e a tampa fechada, através do ícone do chip no canto superior esquerdo da tela.
- Para iniciar a execução do chip de DNA HS, selecione o ensaio dsDNA high sensitivity do menu 'Assay' na tela do instrumento e, em seguida, preencha adequadamente a tabela de nomes de amostra, alimentando informações como nomes de amostras e comentários e inicie a execução do chip clicando no botão'Iniciar' no canto superior direito da tela.
- Limpeza de eletrodo após uma execução de um chip de DNA HS: Remova imediatamente o chip de DNA HS usado, assim que o ensaio for concluído e elimine-o de acordo com boas práticas laboratoriais. Realize o seguinte procedimento para garantir que os eletrodos estejam limpos, sem sobras de resíduos do ensaio anterior.
- Encha lentamente 350 μL de água de nível de análise deionizada em um dos poços de limpeza de eletrodos e coloque o limpador de eletrodos no instrumento analisador de fragmentos abrindo a tampa e, em seguida, feche a tampa e espere cerca de 10 s.
- Retire o limpador de eletrodos abrindo a tampa e espere por mais 10 s, para que a água dos eletrodos evapore antes de fechar a tampa.
Resultados
Separação plasmática
O sangue de 8,5-9 mL coletado em tubos de conservação cfDNA ou cfRNA produz cerca de ~4 mL de plasma em volume. O volume de plasma separado do sangue coletado nos tubos EDTA pode variar dependendo da temperatura. A exposição de tubos EDTA contendo sangue a uma temperatura superior a 37 °C leva à diminuição do volume de plasma44.
Resultados do ensaio do ensaio do fluorômetro
a concentração de CFDN...
Discussão
A coleta de sangue de um paciente em um tubo, embarque e armazenamento são etapas iniciais cruciais na biópsia líquida. O manuseio inadequado pode prejudicar a qualidade do plasma e, portanto, pode interferir nos resultados da biópsia líquida47. Se uma amostra de sangue for coletada em um tubo sanguíneo EDTA, o plasma deve ser separado dentro de duas horas de coleta de sangue para evitar a lise dos WBCs e liberar seu DNA genômico no plasma48. Os WBCs também podem so...
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Os autores gostariam de agradecer aos membros do Laboratório de Genômica do Câncer e Biocomumia de Doenças Complexas por seus agudos insumos observacionais e sua participação em múltiplas discussões em diferentes etapas deste projeto. O apoio ao financiamento inclui a Israel Cancer Association (bolsa ICA para m.F-M 2017-2019) e a bolsa Kamin da Israel Innovation Authority (para m.F-M.).
Materiais
| Name | Company | Catalog Number | Comments |
| 2100 Bioanalyzer Instrument | Agilent Technologies, Inc. | G2939BA | The 2100 Bioanalyzer system is an established automated electrophoresis tool for the sample quality control of biomolecules. |
| Adjustable Clip for Priming Station | Agilent Technologies, Inc. | 5042-1398 | Used in combination with syringe to apply defined pressure for chip priming. |
| Agilent High Sensitivity DNA Kit | Agilent Technologies, Inc. | 5067-4626 | The High Sensitivity DNA assays are often used for sample quality control for next-generation sequencing libraries |
| cf-DNA/cf-RNA Preservative Tubes | Norgen Biotek Corp. | 63950 | Norgen's cf-DNA/cf-RNA Preservative Tubes are closed, evacuated plastic tubes for the collection and the preservation of cf-DNA, circulating tumor DNA, cf-RNA and circulating tumor cells in human whole blood samples during storage and shipping |
| Chip Priming Station | Agilent Technologies, Inc. | 5065-4401 | Used to load gel matrix into a chip with a syringe provided with each assay kit— used for RNA, DNA, and protein assays. Includes priming station, stop watch, and 1 syringe clip |
| Electrode Cleaner Kit | Agilent Technologies, Inc. | 5065-9951 | Prevents cross-contamination. Removes bacterial or protein contaminants from electrodes. |
| Filters for Gel Matrix | Agilent Technologies, Inc. | 185-5990 | Used for proper mixing of DNA dye concentrate and DNA gel matrix |
| IKA Basic Chip Vortex | IKA-Werke GmbH & Co. KG | MS-3-S36 | Used for proper mixing of DNA ladder and DNA sample on Bioanalyzer assay chips |
| NucleoSpin Tissue kit | MACHEREY-NAGEL | 740952.5 | With the NucleoSpin Tissue kit, genomic DNA can be prepared from tissue, cells (e.g., bacteria), and many other sources. |
| QIAamp circulating nucleic acid kit | Qiagen | 55114 | The QIAamp Circulating Nucleic Acid Kit enables efficient purification of these circulating nucleic acids from human plasma or serum and other cell-free body fluids. |
| QIAvac 24 Plus vacuum manifold | Qiagen | 19413 | The QIAvac 24 Plus vacuum manifold is designed for vacuum processing of QIAGEN columns in parallel. |
| QIAvac Connecting System | Qiagen | 19419 | In combination with the QIAvac Connecting System, the QIAvac 24 Plus vacuum manifold can be used as a flow-through system. The sample flow-through, containing possibly infectious material, is collected in a separate waste bottle. |
| Qubit 2.0 fluorometer | Invitrogen | Q32866 | The Qubit 2.0 Fluorometer is an easy-to-use, analytical instrument designed to work with the Qubit assays for DNA, RNA, and protein quantitation. |
| Qubit assay tubes | Thermo Fisher Scientific | Q32856 | Qubit assay tubes are 500 µL thin-walled polypropylene tubes for use with the Qubit Fluorometer. |
| Qubit dsDNA HS Assay Kit | Thermo Fisher Scientific | Q32851 | The Qubit dsDNA HS (High Sensitivity) Assay Kit is designed specifically for use with the Qubit Fluorometer. The assay is highly selective for double-stranded DNA (dsDNA) over RNA and is designed to be accurate for initial sample concentrations from 10 pg/µL to 100 ng/µL. |
| Vacuum Pump | Qiagen | 84010 | used for vacuum processing of QIAGEN columns |
| Miscellaneous | |||
| 50 ml centrifuge tubes | |||
| Crushed ice | |||
| Ethanol (96–100%) | |||
| Heating block or similar at 56 °C (capable of holding 2 ml collection tubes) | |||
| Isopropanol (100%) | |||
| Microcentrifuge | |||
| Phosphate-buffered saline (PBS) | |||
| Pipettes (adjustable) | |||
| Sterile pipette tips (pipette tips with aerosol barriers are recommended to help prevent cross-contamination) | |||
| Water bath or heating block capable of holding 50 mL centrifuge tubes at 60 °C |
Referências
- Campbell, P. J., et al. Pan-cancer analysis of whole genomes. Nature. 578 (7793), 82-93 (2020).
- Liotta, L., Petricoin, E. Molecular profiling of human cancer. Nature Reviews Genetics. 1 (1), 48-56 (2000).
- Balamurali, D., et al. ChiTaRS 5.0: the comprehensive database of chimeric transcripts matched with druggable fusions and 3D chromatin maps. Nucleic Acids Research. 48 (1), 825-834 (2019).
- Trédan, O., et al. Molecular screening program to select molecular-based recommended therapies for metastatic cancer patients: Analysis from the ProfiLER trial. Annals of Oncology. 30 (5), 757-765 (2019).
- Oliveira, K. C. S., et al. Current perspectives on circulating tumor DNA, precision medicine, and personalized clinical management of cancer. Molecular Cancer Research. 18 (4), 517-528 (2020).
- Siegal, T. Clinical impact of molecular biomarkers in gliomas. Journal of Clinical Neuroscience. 22 (3), 437-444 (2015).
- Komori, T. The 2016 WHO Classification of Tumours of the Central Nervous System: The Major Points of Revision. Neurologia medico-chirurgica. 57 (7), 301-311 (2017).
- Duffy, M. J., O'Donovan, N., Crown, J. Use of molecular markers for predicting therapy response in cancer patients. Cancer Treatment Reviews. 37 (2), 151-159 (2011).
- Saenz-Antoñanzas, A., et al. Liquid Biopsy in Glioblastoma: Opportunities, Applications and Challenges. Cancers. 11 (7), 950 (2019).
- Marrugo-Ramírez, J., Mir, M., Samitier, J. Blood-Based Cancer Biomarkers in Liquid Biopsy: A Promising Non-Invasive Alternative to Tissue Biopsy. International Journal of Molecular Sciences. 19 (10), 2877 (2018).
- Pantel, K., Alix-Panabières, C. Liquid biopsy in 2016: Circulating tumour cells and cell-free DNA in gastrointestinal cancer. Nature Reviews Gastroenterology & Hepatology. 14 (2), 73-74 (2017).
- Bronkhorst, A. J., et al. The emerging role of cell-free DNA as a molecular marker for cancer management. Biomolecular Detection and Quantification. 17, 100087 (2019).
- Cescon, D. W., Bratman, S. V., Chan, S. M., Siu, L. L. Circulating tumor DNA and liquid biopsy in oncology. Nature Cancer. 1 (3), 276-290 (2020).
- Palmirotta, R., et al. Liquid biopsy of cancer: a multimodal diagnostic tool in clinical oncology. Therapeutic Advances in Medical Oncology. 10, 175883591879463 (2018).
- Cohen, J. D. J., et al. Detection and localization of surgically resectable cancers with a multi-analyte blood test. Science. 359 (6378), 926-930 (2018).
- Wan, J. C. M., et al. Liquid biopsies come of age: towards implementation of circulating tumour DNA. Nature Reviews Cancer. 17 (4), 223-238 (2017).
- Heitzer, E., Haque, I. S., Roberts, C. E. S., Speicher, M. R. Current and future perspectives of liquid biopsies in genomics-driven oncology. Nature Reviews Genetics. 20 (2), 71-88 (2018).
- Thierry, A. R., et al. Origins, structures, and functions of circulating DNA in oncology. Cancer and Metastasis Reviews. 35 (3), 347-376 (2016).
- Buscail, E., et al. High Clinical Value of Liquid Biopsy to Detect Circulating Tumor Cells and Tumor Exosomes in Pancreatic Ductal Adenocarcinoma Patients Eligible for Up-Front Surgery. Cancers. 11 (11), 1656 (2019).
- Heitzer, E., Ulz, P., Geigl, J. B. Circulating Tumor DNA as a Liquid Biopsy for Cancer. Clinical Chemistry. 61 (1), 112-123 (2015).
- Kustanovich, A., Schwartz, R., Peretz, T., Grinshpun, A. Life and death of circulating cell-free DNA. Cancer Biology and Therapy. 20 (8), 1057-1067 (2019).
- Crowley, E., Di Nicolantonio, F., Loupakis, F., Bardelli, A. Liquid biopsy: monitoring cancer-genetics in the blood. Nature Reviews Clinical Oncology. 10 (8), 472-484 (2013).
- Celec, P., et al. Cell-free DNA: the role in pathophysiology and as a biomarker in kidney diseases. Expert Reviews in Molecular Medicine. 20, (2018).
- Gautschi, O., et al. Origin and prognostic value of circulating KRAS mutations in lung cancer patients. Cancer Letters. 254 (2), 265-273 (2007).
- Bidard, F., et al. Detection rate and prognostic value of circulating tumor cells and circulating tumor DNA in metastatic uveal melanoma. International Journal of Cancer. 134 (5), 1207-1213 (2013).
- Chan, K. C. A., et al. Analysis of Plasma Epstein–Barr Virus DNA to Screen for Nasopharyngeal Cancer. New England Journal of Medicine. 377 (6), 513-522 (2017).
- Mao, L., et al. Detection of Oncogene Mutations in Sputum Precedes Diagnosis of Lung Cancer. Cancer Research. 54 (7), 1634-1637 (1994).
- De Mattos-Arruda, L., et al. Cerebrospinal fluid-derived circulating tumour DNA better represents the genomic alterations of brain tumours than plasma. Nature communications. 6 (1), 8839 (2015).
- Khier, S., Lohan, L. Kinetics of circulating cell-free DNA for biomedical applications: critical appraisal of the literature. Future science OA. 4 (4), 295 (2018).
- Misale, S., et al. Resistance to Anti-EGFR therapy in colorectal cancer: From heterogeneity to convergent evolution. Cancer Discovery. 4 (11), 1269-1280 (2014).
- Beddowes, E., Sammut, S. J., Gao, M., Caldas, C. Predicting treatment resistance and relapse through circulating DNA. Breast. 34, 31-35 (2017).
- Sacher, A. G., et al. Prospective Validation of Rapid Plasma Genotyping for the Detection of EGFR and KRAS Mutations in Advanced Lung Cancer. JAMA oncology. 2 (8), 1014-1022 (2016).
- Vaidyanathan, R., et al. Cancer diagnosis: from tumor to liquid biopsy and beyond. Lab on a Chip. 19 (1), 11-34 (2019).
- Kelly, P. Gliomas: Survival, origin and early detection. Surgical Neurology International. 1 (1), 96 (2010).
- Faria, G., Silva, E., Da Fonseca, C., Quirico-Santos, T. Circulating Cell-Free DNA as a Prognostic and Molecular Marker for Patients with Brain Tumors under Perillyl Alcohol-Based Therapy. International Journal of Molecular Sciences. 19 (6), 1610 (2018).
- Liu, M. C., et al. Sensitive and specific multi-cancer detection and localization using methylation signatures in cell-free DNA. Annals of Oncology. 31 (6), 745-759 (2020).
- Enko, D., Halwachs-Baumann, G., Kriegshäuser, G. Plasma free DNA: Evaluation of temperature-associated storage effects observed for roche cell-free DNA collection tubes. Biochemia Medica. 29 (1), 153-156 (2019).
- Streleckiene, G., et al. Effects of Quantification Methods Isolation Kits, Plasma Biobanking, and Hemolysis on Cell-Free DNA Analysis in Plasma. Biopreservation and Biobanking. 17 (6), 553-561 (2019).
- Thress, K. S., et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M. Nature Medicine. 21 (6), 560-562 (2015).
- Ward Gahlawat, A., et al. Evaluation of Storage Tubes for Combined Analysis of Circulating Nucleic Acids in Liquid Biopsies. International Journal of Molecular Sciences. 20 (3), 704 (2019).
- Lu, J. L., Liang, Z. Y. Circulating free DNA in the era of precision oncology: Pre- and post-analytical concerns. Chronic Diseases and Translational Medicine. 2 (4), 223-230 (2016).
- Iyapparaj, P., et al. Optimization of bacteriocin production by Lactobacillus sp. MSU3IR against shrimp bacterial pathogens. Aquatic Biosystems. 9 (1), 12 (2013).
- Ponti, G., et al. The value of fluorimetry (Qubit) and spectrophotometry (NanoDrop) in the quantification of cell-free DNA (cfDNA) in malignant melanoma and prostate cancer patients. Clinica Chimica Acta. 479, 14-19 (2018).
- Medina Diaz, I., et al. Performance of Streck cfDNA blood collection tubes for liquid biopsy testing. PLoS One. 11 (11), 0166354 (2016).
- Perkins, G., et al. Multi-Purpose Utility of Circulating Plasma DNA Testing in Patients with Advanced Cancers. PLoS One. 7 (11), 47020 (2012).
- Mouliere, F., et al. Multi-marker analysis of circulating cell-free DNA toward personalized medicine for colorectal cancer. Molecular Oncology. 8 (5), 927-941 (2014).
- Trigg, R. M., Martinson, L. J., Parpart-Li, S., Shaw, J. A. Factors that influence quality and yield of circulating-free DNA: A systematic review of the methodology literature. Heliyon. 4 (7), 00699 (2018).
- Risberg, B., et al. Effects of Collection and Processing Procedures on Plasma Circulating Cell-Free DNA from Cancer Patients. Journal of Molecular Diagnostics. 20 (6), 883-892 (2018).
- Markus, H., et al. Evaluation of pre-analytical factors affecting plasma DNA analysis. Scientific Reports. 8 (1), 7375 (2018).
- Chen, Z., et al. Comprehensive Evaluation of the Factors Affecting Plasma Circulating Cell-Free DNA Levels and Their Application in Diagnosing Nonsmall Cell Lung Cancer. Genetic Testing and Molecular Biomarkers. 23 (4), 270-276 (2019).
- Schwarzenbach, H., Hoon, D. S. B., Pantel, K. Cell-free nucleic acids as biomarkers in cancer patients. Nature Reviews Cancer. 11 (6), 426-437 (2011).
- Malyuchenko, N. V., et al. PARP1 Inhibitors: antitumor drug design. Acta Naturae. 7 (3), 27-37 (2015).
- Fleischhacker, M., Schmidt, B. Circulating nucleic acids (CNAs) and cancer-A survey. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1775 (1), 181-232 (2007).
- Jung, K., Fleischhacker, M., Rabien, A. Cell-free DNA in the blood as a solid tumor biomarker—A critical appraisal of the literature. Clinica Chimica Acta. 411 (21-22), 1611-1624 (2010).
- Frenkel-Morgenstern, M., et al. ChiTaRS: a database of human, mouse and fruit fly chimeric transcripts and RNA-sequencing data. Nucleic Acids Research. 41, 142-151 (2013).
- Frenkel-Morgenstern, M., et al. ChiTaRS 2.1--an improved database of the chimeric transcripts and RNA-seq data with novel sense-antisense chimeric RNA transcripts. Nucleic Acids Research. 43, 68-75 (2015).
- Gorohovski, A., et al. ChiTaRS-3.1-the enhanced chimeric transcripts and RNA-seq database matched with protein-protein interactions. Nucleic Acids Research. 45 (1), 790-795 (2017).
- Tate, J. G., et al. COSMIC: the Catalogue Of Somatic Mutations In Cancer. Nucleic Acids Research. 47 (1), 941-947 (2019).
- Brennan, C. W., et al. The somatic genomic landscape of glioblastoma. Cell. 155 (2), 462-477 (2013).
- Szopa, W., Burley, T. A., Kramer-Marek, G., Kaspera, W. Diagnostic and Therapeutic Biomarkers in Glioblastoma: Current Status and Future Perspectives. BioMed Research International. 2017, 1-13 (2017).
- Salesse, S., Verfaillie, C. M. BCR/ABL: from molecular mechanisms of leukemia induction to treatment of chronic myelogenous leukemia. Oncogene. 21 (56), 8547-8559 (2002).
- Frenkel-Morgenstern, M., Valencia, A. Novel domain combinations in proteins encoded by chimeric transcripts. Bioinformatics. 28 (12), 67-74 (2012).
- Frenkel-Morgenstern, M., et al. Chimeras taking shape: Potential functions of proteins encoded by chimeric RNA transcripts. Genome Research. 22 (7), 1231-1242 (2012).
- Simon, M., et al. TERT promoter mutations: a novel independent prognostic factor in primary glioblastomas. Neuro-Oncology. 17 (1), 45-52 (2015).
- Waitkus, M. S., Diplas, B. H., Yan, H. Isocitrate dehydrogenase mutations in gliomas. Neuro-Oncology. 18 (1), 16-26 (2016).
- Kindler, T., Meyer, R. G., Fischer, T. BCR-ABL as a target for novel therapeutic interventions. Expert Opinion on Therapeutic Targets. 6 (1), 85-101 (2002).
- Overman, M. J., et al. Use of research biopsies in clinical trials: are risks and benefits adequately discussed. Journal of Clinical Oncology Official Journal of the American Society of Clinical Oncology. 31 (1), 17-22 (2013).
- Vanderlaan, P. A., et al. Success and failure rates of tumor genotyping techniques in routine pathological samples with non-small-cell lung cancer. Lung Cancer. 84 (1), 39-44 (2014).
- Stewart, C. M., Tsui, D. W. Y. Circulating cell-free DNA for non-invasive cancer management. Cancer Genetics. 228-229, 169-179 (2018).
- Normanno, N., et al. The liquid biopsy in the management of colorectal cancer patients: Current applications and future scenarios. Cancer Treatment Reviews. 70, 1-8 (2018).
- Hufnagl, C., et al. Evaluation of circulating cell-free DNA as a molecular monitoring tool in patients with metastatic cancer. Oncology Letters. 19 (2), 1551-1558 (2020).
- Petit, J., et al. Cell-Free DNA as a Diagnostic Blood-Based Biomarker for Colorectal Cancer: A Systematic Review. The Journal of Surgical Research. 236, 184-197 (2019).
- Poulet, G., Massias, J., Taly, V. Liquid Biopsy: General Concepts. Acta Cytologica. 63 (6), 449-455 (2019).
- Alix-Panabières, C. The future of liquid biopsy. Nature. 579 (7800), 9 (2020).
- Eisenstein, M. Could liquid biopsies help deliver better treatment. Nature. 579 (7800), 6-8 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados