Method Article
Ablación focal del laser del cáncer de próstata: Un procedimiento de la oficina
En este artículo
Resumen
Este artículo presenta y describe un tratamiento del paciente no internado para el cáncer de próstata usando la ablación focal del laser. La colocación del catéter láser es guiada por imágenes de fusión de ultrasonido MRI de una manera similar a la biopsia con aguja de próstata. El tratamiento se supervisa en tiempo real con una sonda térmica, colocada junto a la fibra láser.
Resumen
En este artículo, describimos e ilustramos un procedimiento del paciente no internado para la ablación focal del laser (FLA) del cáncer de próstata (PCa). El procedimiento es conceptualmente similar a una biopsia de fusión y se realiza bajo anestesia local en un entorno clínico; el tiempo de tratamiento suele ser inferior a una hora. La inserción del láser es guiada por ultrasonido; La lesión que apunta está vía la fusión de resonancia magnética del proyección de imagen-ultrasonido (MRI/US), como en biopsia apuntada de la próstata. El monitoreo de la ablación en tiempo real se logra utilizando una sonda térmica adyacente a la fibra láser. El video muestra la planificación del procedimiento, la preparación del paciente, varios pasos durante el procedimiento y el monitoreo del tratamiento. La seguridad, la viabilidad y la eficacia de este enfoque se han establecido durante un ensayo anterior. La FLA ambulatoria bajo anestesia local es una opción para el tratamiento del cáncer de próstata de riesgo intermedio.
Introducción
El cáncer de próstata (PCa) es la malignidad interna más común de los hombres de los E.E.U.U.1. Se esperan aproximadamente 190.000 nuevos casos y 33.000 muertes durante 2020, lo que la convierte en la segunda causa más común de muerte por cáncer en hombres2. La mayoría de los casos de PCa son curables si se tratan mientras se localizan en la próstata. Sin embargo, la identificación del cáncer dentro de la próstata no es a menudo posible con proyección de imagen convencional del ultrasonido (los E.E.U.U.); así, el tratamiento ha implicado tradicionalmente cirugía o la radiación de la glándula entera. El paradigma de la 'entero-glándula' se ha alterado con la introducción de la proyección de imagen de resonancia magnética (MRI), que, en contraste con los E.E.U.U., permite la localización del PCa y de la biopsia apuntada3,4,5,6. Mientras que mri subestima probablemente el multifocality de PCa7,y puede faltar pequeñas lesiones8,puede identificar confiablemente la lesión del índice, que es casi siempre el conductor de la enfermedad metastática9,10.
La identificación confiable de MRI de las lesiones del índice ha proporcionado una trayectoria para el tratamiento focal del PCa (es decir, ablación parcial de la glándula (PGA)). El objetivo de PGA es destruir la lesión del índice mientras que preserva el órgano y así minimizando efectos secundarios. La ablación focal del laser (FLA), que emplea energía ligera para destruir el tejido con necrosis coagulativa11,12,es una forma de PGA. La eficacia de la energía del laser para ablatar el tejido de la próstata fue establecida en 199313,sugiriendo la colocación de las fibras del laser en los cánceres de próstata para ese propósito. Usando MRI para la dirección de la colocación de la fibra y de la termografía de MRI para la supervisión del tratamiento (es decir, tratamiento en el agujero), los índices de éxito a corto plazo de FLA aparecen acercarse a los de la cirugía o dela radiación 5,6,12,14, 15,16,17,18,19. Sin embargo, los procedimientos con láser realizados en el orificio, o dentro de un tubo de RESONANCIA MAGNÉTICA, a menudo son engorrosos, costosos, lentos y requieren muchos recursos. Y los procedimientos en el orificio solo son realizados por radiólogos capacitados en subespecialidad.
Como alternativa a la FLA en el orificio, la viabilidad de realizar la FLA en un entorno clínico---utilización de la fusión MRI /US para orientación y una sonda de temperatura intersticial para el monitoreo del tratamiento--- ha estado bajo estudio en UCLA desde 201419,20. El procedimiento fla en un entorno clínico ha demostrado ser similar a la de la biopsia dirigida, sustituyendo una fibra láser por una aguja de biopsia. En comparación con hifu y crioterapia, que son los otros métodos actualmente disponibles de PGA, el método láser descrito aquí es rápido y barato, sin necesidad de un quirófano o anestesia general.
Este artículo tiene como objetivo describir y demostrar fla ambulatorio bajo anestesia local en una clínica de urología. Los urólogos que están familiarizados con la fusión de MRI/US para la biopsia dirigida apreciarán las similitudes de fla con el procedimiento de biopsia. Los objetivos secundarios incluyen la descripción de los elementos técnicos que facilitan la facilidad de uso y la descripción de los beneficios de la terapia focal.
Protocolo
NOTA: Los métodos descritos aquí son los utilizados en UCLA para realizar fla de la próstata. El proyecto de investigación, incluido el protocolo, fue aprobado por la junta de revisión institucional (IRB) de la UCLA. Todos los pacientes han tenido biopsia apuntada de la próstata, en la cual el MRI ha sido interpretado por un uro-radiólogo experimentado. Las lesiones visibles en MRI fueron biopsiadas dentro de la región del interés (ROI) y fuera del ROI usando una plantilla sistemática. Las biopsias positivas y la región de interés de MRI se utilizan para planificar el tratamiento con la ablación del laser para tratar la lesión del índice y para crear un margen del tejido tratado alrededor del tumor, dado que MRI subestima el tamaño del tumor. 21 Solamente consideran elegibles para el tratamiento a los pacientes con cáncer de próstata de riesgo intermedio (GG2-3 PSA < 20, estadio < T2), un roi de índice único y ningún cáncer de próstata contralateral clínicamente significativo. Los pacientes con diátesis hemorrágica o incapacidad para tolerar el tratamiento sin sedación se consideran no elegibles.
1. Planificación del tratamiento
- Antes del tratamiento, planifique los objetivos de ablaciones utilizando la entrada de la resonancia magnética y las coordenadas de la biopsia.
- Realice la planificación del tratamiento con el software proporcionado.
2. Preparación de la sala de procedimientos
- Muestre una señal de advertencia láser fuera de la sala de procedimientos.
- Coloque la estación de trabajo para un acceso cómodo.
- Encierte la estación de trabajo, el dispositivo de fusión y el ultrasonido transrectal.
- Ingrese la credencial de inicio de sesión y seleccione el paciente deseado de la lista de trabajo predeterminada que contiene los planes no ejecutados.
NOTA: Se pueden agregar nuevos planes de tratamiento a través de una conexión USB o a Internet como se detalla en el manual del usuario. - Cuelgue una bolsa de solución salina del gancho designado en la estación de trabajo; también se adjunta una bolsa de retorno salino de residuos.
- Prime la tubería salina permitiendo el flujo por gravedad del fluido antes de bloquear la tubería. La solución salina se conecta a la bomba peristáltica y se cuelga para su uso posterior durante el procedimiento.
3. Preparación de la sonda TRUS
- Aplique la jalea del ultrasonido directamente a una sonda limpia de TRUS.
NOTA: En UCLA, todas las sondas TRUS se desinfectan a través de un sistema automatizado con solución de peróxido de hidrógeno vaporizado. - Coloque un condón sobre la jalea de ultrasonido en la sonda TRUS y colótelo en la base usando una banda elástica.
NOTA: Según la práctica estándar, intente eliminar las burbujas de aire atrapadas debajo del condón. - Coloque una guía multicanal sobre el condón y encerrarlo en su lugar con la abrazadera de metal. Un segundo condón con jalea de ultrasonido interno se puede colocar sobre la guía multicanal para aumentar la comodidad del paciente.
4. Preparación del paciente
- Indique al paciente que limpie su bóveda rectal con y enema en la mañana de la biopsia.
- Asegurarse de que el paciente ha obtenido antibióticos profilácticos 60 minutos antes del procedimiento22.
NOTA: En UCLA, 1 g de Ertapenem se administra por vía intramuscular 60 minutos antes del procedimiento. Esta decisión fue tomada basó en el antibiograma de UCLA y había prevenido episodios sépticos de la poste-biopsia durante las 1500 biopsias transrectales pasadas. 23 Dado este éxito, elegimos usarlo también para la ablación transrectal del laser. - Proporcione a los pacientes acetaminofén 1000 mg PO, Ketorolaco 30 mg IM y, opcionalmente, pero recomendado Diazepam 10 mg PO, 60 minutos antes del procedimiento.
NOTA: Los pacientes pueden experimentar un deseo moderado de vacío o presión en el pene durante el procedimiento. En nuestra experiencia, ningún narcótico es beneficioso. - Los pacientes pueden encontrar útil llevar música personal y auriculares como un ansiolítico adicional.
- Coloque al paciente en la posición de decúbito lateral izquierdo en cuanto a la biopsia transrectal.
- Registre los signos vitales del paciente antes de comenzar el procedimiento y a intervalos de 30 minutos.
5. Administración de bloqueo nervioso prostático
- Inserte la sonda TRUS lubricada hasta que el centro de la próstata sea claramente visible.
- Optimice la ganancia del ultrasonido, la compensación de la ganancia de tiempo (controles deslizantes de TGC a la derecha de la mayoría de los ultrasonidos), la profundidad y el enfoque para que la próstata se centre dentro del monitor de visualización del ultrasonido.
NOTA: La ganancia óptima da como resultado una imagen de color gris medio dentro de la zona periférica. Los deslizadores TGC se establecen mejor en un ángulo inclinado gradualmente para compensar la atenuación de la onda de los tejidos distantes. La profundidad y el enfoque del ultrasonido dependerán del tamaño de la próstata. El foco se debe fijar a la zona periférica para optimizar la visualización de marcadores acústicos en el catéter del laser. - Active la guía de biopsia en pantalla y coloque una aguja espinal de calibre 22 a través del centro de la guía multicanal para anestesiar la próstata.
NOTA: En UCLA anestesiamos la próstata en el plano sagital colocando 10-20 mL de lidocaína/marcaína en la unión de la próstata y las vesículas seminales. La infiltración correcta causará una separación de las vesículas seminales y la próstata de la pared rectal.
6. Fusión MRI-US
- Coloque el sistema de fusión de imágenes y la estación de trabajo lo suficientemente cerca del paciente para visualizar las pantallas de la estación de trabajo mientras también observa al paciente.
- Si utiliza artemisa, utilice una técnica para el acoplamiento y el registro de imágenes descrita anteriormente. 24.
7. Adquisición de objetivos
- Navegue por el ultrasonido hasta el centro del primer sitio de ablación utilizando objetivos digitales suministrados por el dispositivo de fusión. Este proceso es similar a guiar el ultrasonido a una región de MRI de interés durante la biopsia de fusión.
NOTA: Cada sitio de ablación se determina a partir de la región de resonancia magnética de interés y los núcleos de biopsia positivos (Figura 1). El plan de tratamiento del paciente debe transferirse a la estación de trabajo y al dispositivo de fusión durante la preparación de la sala de procedimientos descrita anteriormente. - Seleccione la zona de ablación actual.
8. Colocación del catéter láser y la sonda de temperatura
- Coloque el catéter láser de calibre 14 en la cámara central de la guía multicanal.
NOTA: La guía multicanal está curvada para proporcionar una ligera fricción, evitando así que los elementos de tratamiento se deslicen hacia atrás durante la ablación. Supere esta fricción girando hacia adelante y hacia atrás mientras avanza el catéter láser hacia la próstata. - Avance el catéter láser hasta que se visualicen cuatro bandas ecogénicas y se alineen con el marcador de profundidad en pantalla. Para una ablación de zona periférica, los marcadores serán de varios mm fuera de la cápsula prostática(Figura 2).
NOTA: En el caso de una cápsula posterior fibrosa, el catéter láser puede desviarse en lugar de atravesar la cápsula prostática. Cualquier deflexión será visible en el ultrasonido durante la inserción. En caso de que se produzca una desviación, retire el catéter láser e inserte un líder, como la sonda térmica resistente, para crear una abertura piloto en la cápsula. El catéter láser se puede entonces avanzar según lo planeado. - Inserte la sonda térmica a la izquierda o a la derecha del catéter láser dependiendo del plan de tratamiento. A la profundidad correcta, la sonda térmica se entrelazan con el mango del catéter láser, lo que le permite alinearse en la orientación correcta.
NOTA: Después de la colocación, compruebe que la ranura de la sonda térmica se asenta en el mango del catéter láser. La sonda térmica se bloqueará magnéticamente en su lugar y evitará la rotación durante el tratamiento. - Conecte el tubo intravenoso cebado de la bolsa salina al puerto de entrada proximal en el catéter láser.
- Conecte la solución salina que regresa desde el puerto de salida distal a una bolsa de drenaje transparente para que se pueda visualizar el líquido que regresa.
NOTA: La solución salina circulante alrededor del catéter láser enfriará la fibra durante el tratamiento
9. Realice la lista de verificación de seguridad
- Mientras esté en la pantalla de monitoreo del tratamiento, seleccione el sitio de ablación deseado. Una vez seleccionada la ablación adecuada, pulse 'CONFIRMAR SELECCIÓN'. Una lista de comprobación de seguridad ocupará ahora el lado izquierdo del monitor de la estación de trabajo.
NOTA: Este paso comenzará a circular solución salina a través del catéter láser. Las pequeñas burbujas introducidas al conectar los tubos intravenosos son inicialmente visibles en el ultrasonido alrededor del láser. Esto puede actuar como una comprobación adicional para la posición del catéter láser. - Siga la lista de verificación de seguridad, marcando las casillas una vez completadas.
- Asegúrese de que todas las personas en la habitación se pongan gafas de seguridad láser, incluido el paciente.
- El sistema informático de la estación de trabajo comprobará automáticamente la sonda térmica para asegurarse de que todos los termopares están leyendo temperaturas corporales uniformes entre 30 - 40 °C.
- Confirme que las cuatro bandas ecogénicas de los catéteres láser están ubicadas en la cápsula prostática, ya que la colocación de la sonda térmica puede alejar la próstata del catéter láser.
NOTA: La zona de ablación comienza 5 mm distal a los marcadores ecogénicos y se extiende otros 27 mm de longitud y 18 mm de diámetro (máximo).
10. Realización de la ablación del tejido láser
- Una vez completada la lista de verificación de seguridad pulse 'START LASER' para comenzar la ablación.
- Monitoree el progreso del tratamiento en tiempo real utilizando lecturas de temperatura, temporizador y mapa de daños.
NOTA: Evalúe la temperatura del tejido utilizando el gráfico multilíneo a la izquierda del modelo de próstata. La temperatura rectal está marcada en blanco y no debe exceder los 42 °C. La temperatura en la punta del catéter láser está marcada en azul (Figura 3). El láser se apagará automáticamente si la punta del láser supera los 75 °C o la pared rectal supera los 42 °C.
NOTA: Una vez que el láser está activo, monitoree el tiempo de tratamiento en cada sitio de ablación usando la barra roja en la parte superior de la pantalla. Un mapa de daños proporciona una representación 3D del tejido tratado en función de la temperatura y el tiempo.
NOTA: Tenga en cuenta los cambios en el ultrasonido de modo B. El tejido prostático generalmente no cambia de apariencia durante la ablación con láser. Con los tratamientos en serie, el tejido puede adoptar una apariencia hipoecoica, pero la visualización de los Estados Unidos sirve principalmente para el posicionamiento del láser.
NOTA: Monitor para las características de ultrasonido referentes de la siguiente manera:- Las micro burbujas arremolinadas que se forman más allá de las bandas ecogénicas del catéter láser pueden indicar una fuga en la solución salina circulante debido al supercalentamiento. Si bien esto no tiene ningún impacto en la seguridad, el progreso del tratamiento puede ralentizarse.
- Un aumento en la naturaleza hyperechoic o el "blanqueamiento" de la grasa rectal puede ocurrir si el catéter del laser se tira inadvertidamente hacia atrás, causando la calefacción de la grasa perirrectal.
- Si cualquiera de estos hallazgos de ultrasonido se observan tratamiento con láser debe ser detenido.
- El láser se detiene automáticamente una vez que se agota el temporizador, pero un profesional puede optar por poner fin a la ablación manualmente pulsando 'DETENER EL LÁSER'. La solución salina continuará fluyendo, enfriando la punta del láser.
NOTA: Considere la posibilidad de detener la ablación temprano si las temperaturas se estancan por encima de 55 °C durante más de 60 segundos. - Mantenga el catéter láser y la sonda térmica en su lugar hasta que la temperatura del catéter láser haya caído por debajo de 42 °C, evitando así el calentamiento de la pared rectal durante la retirada del catéter láser.
11. Ablaciones posteriores
- Coloque el ultrasonido en el siguiente sitio de ablación utilizando los objetivos digitales suministrados por el dispositivo de fusión.
- Evalúe si las imágenes vivas del ultrasonido permanecen registradas a la próstata MRI, y realice una remuneración del movimiento si es necesario.
NOTA: Si se utiliza la Artemisa, la técnica de compensación de movimiento se describe en el vídeo al que se ha hecho referencia anteriormente. 24. - En la pantalla de monitoreo del tratamiento, el sitio de ablación inicial ahora estará atenuado; sin embargo, puede ser tratado de nuevo si se considera necesario.
- Seleccione el siguiente sitio de ablación en el lado izquierdo de la pantalla y repita el proceso descrito en los pasos 8 a 10.
12. Concluir sesión de tratamiento
- Una vez que todos los sitios de ablación han sido tratados, aparecerá un botón 'TERMINAR TRATAMIENTO'. Al presionar este botón se mostrará una pantalla de revisión del tratamiento que muestra métricas cuantitativas para la sesión de tratamiento.
- Retire la sonda TRUS del recto del paciente. Se puede aplicar presión manual a la pared rectal que reborda la próstata para facilitar la hemostasia.
Resultados
Los resultados publicados del FLA se muestran en el Cuadro 2. Se incluyen una variedad de métodos y tecnologías. Más de 400 pacientes que se han sometido a diversas formas de FLA para el tratamiento de PCa se encuentran dentro de la base de datos seer. 25 Para cuantificar el número y las características de la FLA reportada en la literatura se realizó una revisión sistemática de Medline y de la Biblioteca Cochrane. Nuestra búsqueda fue realizada usando términos de la búsqueda del entero-campo incluyendo la "ablación focal del laser" y el "cáncer de próstata." En total, se revisaron 247 títulos y resúmenes. Solamente los casos que divulgaban la ablación focal del laser, MRI, y los resultados oncológicos fueron incluidos. 13 publicaciones revisadas por pares calificaron para su inclusión, representando a un total de 333 pacientes (Tabla 1).
El tratamiento se realizó con un láser de diodo de 980 nm en todos los estudios, pero 2. 26,27 Los parámetros de tratamiento consistieron en niveles de potencia entre 6 - 18 vatios y tiempos de tratamiento que abarcan de 1 a 4 minutos por sitio de ablación (Tabla 1). La monitorización de la temperatura del tratamiento se suministró por termometría por RMN en 9 estudios y por mediciones directas de sonda de temperatura en 3 estudios (Tabla 1). Todos los estudios se realizaron en el taladro, excepto los de Lindner y el estudio posterior de Natarajan. 20,26, 27
La línea de fondo mediana PSA para la cohorte era 5,7 (gama 1,1 - 14,8). Después de FLA, el PSA mediano en 3, 6, 12 y 24 meses era 3,9, 5,5, 3,8, y 3,9 respectivamente. La mediana del IPSS basal para la cohorte fue de 6. Después de fla, ipss mediano en 3, 6, 12 y 24 meses era 5, 5,5, 7,3 y 11,5 respectivamente. La mediana de SHIM basal para la cohorte fue de 20. Después de FLA, el SHIM mediano en 3, 6, 12 y 24 meses era 19, 18, 20, y 19 respectivamente.
En todos los estudios, las complicaciones se informaron de manera inconsistente; sin embargo había solamente una complicación clasificada por los autores como grado III (una infección de zona urinaria). 16 Los autores no especificaron las características que clasificaron esto como un evento de grado III. Dos fístulas recto-uretrales, ambas cerrando espontáneamente después de la cateterización prolongada,16 fueron divulgadas como eventos adversos del grado II.
El seguimiento oncológico se agrupó por período de seguimiento: menos de 6 meses, un año y dos años (Tabla 2). La biopsia de la carta recordativa fue realizada por MRI dirigió biopsia del en-agujero en 4 estudios, y biopsia de la fusión de MRI-US en 6 estudios. Dos estudios utilizaron biopsia sistemática y dos estudios realizaron investigaciones de "tratamiento y reseque" donde se evaluó la muestra de prostatectomía. El éxito del tratamiento fue definido según un protocolo del consenso de Delphi. 28 El éxito en el campo se definió como la ausencia de ≥ GG2 PCa dentro del sitio de ablación previa. La falla fuera de campo se definió como ≥ GG2 fuera del área de ablación previa. Entre los pacientes con resultados de biopsia de seguimiento, el éxito general en el campo después del tratamiento a los 6 meses (N = 83), 1 año (N = 64) y 2 años (N = 39) fue del 83%, 83% y 59% respectivamente (Tabla 2).
En UCLA, fla de la próstata se ha realizado en tres ensayos clínicos sucesivos a partir de 2014. 29-31 18 hombres con el cáncer de próstata del riesgo intermedio han experimentado FLA, ocho en-agujero y 10 en clínica, sin ningunos eventos adversos del grado III. Actualmente, otros 10 hombres se están sometiendo a FLA utilizando el dispositivo demostrado. Evaluaron a 31 todos los pacientes antes de FLA con un 3T MRI (bobina del cuerpo), y biopsia de la fusión de MRI-US con el muestreo del ROI y de la biopsia sistemática en el plazo de 6 meses del tratamiento. Las biopsias de la línea de fondo y de la carta recordativa fueron realizadas bajo dirección de la fusión de MRI/US usando el sistema de la fusión de Artemis con el seguimiento de todos los sitios de la biopsia.
Tabla 1. Estudios divulgados de la ablación focal del laser.
| Número de referencia | autor | año | N | Edad media (rango) | Potencia láser | Tiempo de Rx (seg.) | Margen planificado | Procedimiento en el taladro | Monitoreo de temperatura | Línea de base Gleason | ||||
| 3+3 | 3+4 | 4+3 | 4+4 | |||||||||||
| 26 | Lindner | 2009 | 12 | 56.5 (51-52) | - | 120 | - | No | Sonda de temperatura | 12 | 0 | 0 | 0 | |
| 27 | Lindner | 2010 | 4 | 66 (61-73) | - | 120 | - | No | Sonda de temperatura | 2 | 0 | 1 | 1 | |
| 5 | Oto | 2013 | 9 | 61 (52-77) | 6 - 15 W | - | - | Sí | Termometría por RMN | 8 | 1 | 0 | 0 | |
| 12 | sotavento | 2014 | 23 | - | 8 W | 30-60 | - | Sí | Termometría por RMN | - | - | - | - | |
| 6 | Lepor | 2015 | 25 | 66 (49-84) | - | - | - | Sí | Termometría por RMN | 11 | 13 | 1 | 0 | |
| 18 | Al Barqawi | 2015 | 7 | 61 (56-69) | - | 90 | - | Sí | Termometría por RMN | 7 | 0 | 0 | 0 | |
| 15 | Bomers | 2016 | 5 | 66 (58-70) | - | - | 9 milímetros | Sí | Termometría por RMN | 2 | 2 | 1 | 0 | |
| 14 | Eggener | 2016 | 27 | 62 (-) | 6 - 15 W | 60-120 | 0 -7,5 mm | Sí | Termometría por RMN | 23 | 3 | 1 | 0 | |
| 19 | Natarajan | 2016 | 8 | 63 (54-72) | 11 - 14 W | 180 | Personalizado* | Sí | Sonda de temperatura # | 1 | 7 | 0 | 0 | |
| 20 | Natarajan | 2017 | 10 | 65 (52-74) | 13,75 W | 180 | Personalizado* | No | Sonda de temperatura | 2 | 8 | 0 | 0 | |
| 35 | Chao | 2018 | 34 | 69 (52-88) | - | - | - | Sí | Termometría por RMN | 16 | 16 | 2 | 0 | |
| 17 | Al Hakeem | 2019 | 49 | 63 (51-73) | 10 - 15 W | 120 | 9 milímetros | Sí | Termometría por RMN | 13 | 29 | 7 | 0 | |
| 16 | Walser | 2019 | 120 | 60 (45-86) | 17 - 18 W | 180-240 | 5 milímetros | Sí | Termometría por RMN | 37 | 56 | 27 | 0 | |
Tabla 1: Guión (-) indica información no disponible en el manuscrito publicado. * indica que cada margen se planificó individualmente. # indica que el monitoreo se realizó tanto con una sonda de temperatura como con termometría por RMN.
Tabla 2. Resultados de la ablación focal con láser.
| Número de referencia | Primer Autor | Método de biopsia de seguimiento | Biopsia de seguimiento | ≤ 6 Meses | 12 Meses | 24 Meses | Eventos adversos | ||||||
| éxito | fracaso | éxito | fracaso | éxito | fracaso | Yo | Ii | Iii | |||||
| 26 | Lindner | MRI dirigido bx | 12 | 12 | 0 | - | - | - | - | 2 | 0 | 0 | |
| 27 | Lindner | prostatectomía | 4 | 2 | 2 | - | - | - | - | - | - | - | |
| 5 | Oto | MRI/US Bx | 9 | 9 | 0 | - | - | - | - | 1 | 1 | 0 | |
| 12 | sotavento | MRI/US Bx | 13 | - | - | 12 | 1 | - | - | - | - | - | |
| 6 | Lepor | MRI dirigido bx | 21 | 20 | 1 | - | - | - | - | 0 | 0 | 0 | |
| 18 | Al Barqawi | Bx sistemático | 5 | - | - | 5 | 00 | - | - | - | 1 | 0 | |
| 15 | Bomers | prostatectomía | 5 | 1 | 4 | - | - | - | - | - | - | - | |
| 14 | Eggener | MRI dirigido bx # | 27 | 27 | - | 7 | 31 | - | - | 7 | 2 | 0 | |
| 19 | Natarajan | MRI/US Bx | 8 | 6 | 53 | - | - | - | - | 23 | 7 | 0 | |
| 20 | Natarajan | MRI/US Bx | 10 | 6 | 40 | - | - | - | - | 38 | 6 | 0 | |
| 35 | Chao | MRI/US Bx | 22 | - | - | - | - | 13 | 9 | - | - | - | |
| 17 | Al Hakeem | MRI/US Bx | 49 | - | - | 40 | 91 | - | - | 34 | 11 | 0 | |
| 16 | Walser | MRI dirigido bx | 44* | - | - | - | - | 26 | 18 | 8 | 8 | 1 | |
Notas a pie de página Cuadro 2. Éxito = ausencia de cáncer de próstata ≥ GG2 dentro de la zona de ablación. Fracaso = presencia de cáncer de próstata ≥ GG2: total y fuera de campo (número de subíndice). # indica que la biopsia guiada por RMN se utilizó para la biopsia de 6 meses, pero solo se utilizó la biopsia sistemática para la biopsia de 12 meses. * indica que sólo los pacientes con una reducción del PSA de < del 50% y una RESONANCIA MAGNÉTICA posta de ablación positiva se sometieron a biopsia; 76 pacientes no experimentaron biopsia.
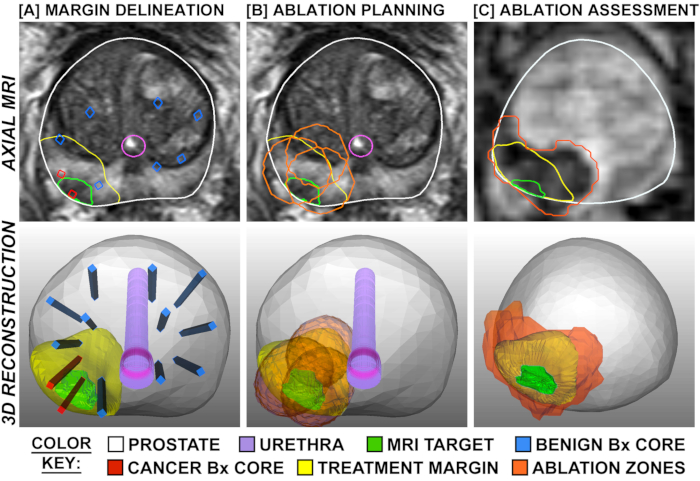
Figura 1:Planificación y evaluación del tratamiento, que se muestra a través de superposiciones en mri transversal (fila superior) y en 3D (fila inferior). La columna A muestra la delineación de los márgenes de tratamiento, que se expanden alrededor de la diana de RMN con cáncer positivo y están limitados por núcleos de biopsia sistemática negativos cercanos (azul). La columna B muestra la planificación de las ubicaciones de ablación de tal manera que los márgenes de tratamiento se superponen para evitar áreas de "salto". La columna C muestra imágenes ponderadas por perfusión recogidas 2 horas después del tratamiento, demostrando la correspondencia entre la extensión de ablación planificada y observada. Haga clic aquí para ver una versión más amplia de esta figura.
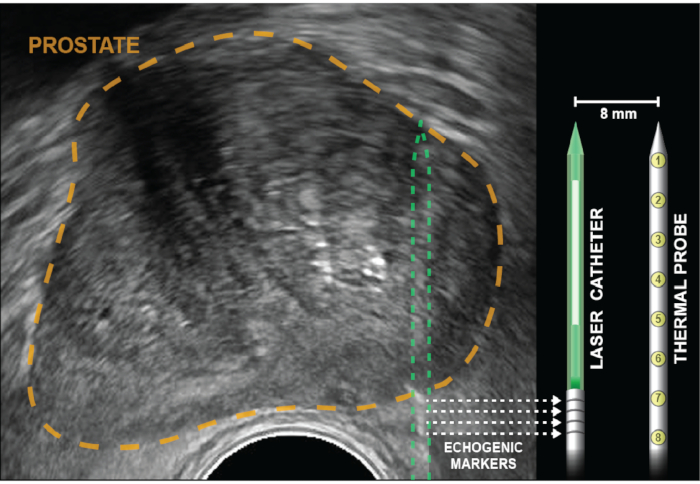
Figura 2: Ecografía axial con próstata delineada en oro. Los reflectores de cubo de esquina (bandas ecogénicas), indicados por flechas punteadas, se grabaron en el catéter láser a 5 mm del difusor (blanco). La sonda de temperatura se inserta a la misma profundidad que la fibra láser, luego se bloquea en su lugar y permanece paralela al láser a 8 mm de distancia, fuera del plano de visión de ee. UU. Ocho sensores térmicos, que están dentro de la sonda separados 4 mm, proporcionan registros de temperatura en puntos desde la base de las bandas ecogénicas hasta la punta del catéter láser. Las mediciones de temperatura más cercanas a la pared rectal son proporcionadas por mediciones térmicas en la base de la sonda de temperatura (posiciones 6-8). Haga clic aquí para ver una versión más amplia de esta figura.

Figura 3:Registros de temperatura durante la ablación focal con láser para dos ablaciones sucesivas. Eje Y = temperatura en Celsius. Eje X = tiempo en minutos. Barras sombreadas verticales = períodos de activación láser. Línea azul = temperatura 8mm desde la punta de la fibra láser (termopar distal). Línea blanca = temperatura 8 mm desde el termopar proximal más cercano a la pared rectal. Una temperatura de 60 grados centígrados, lograda incluso brevemente, asegura necrosis de la coagulación. Haga clic aquí para ver una versión más amplia de esta figura.
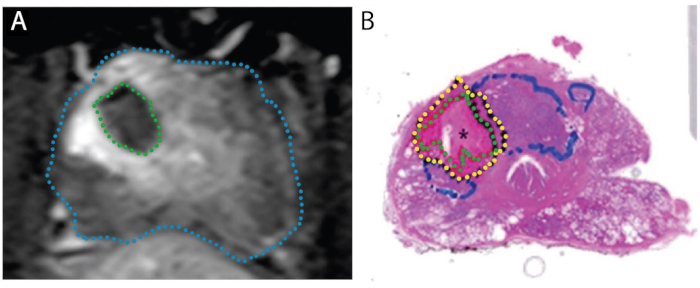
Figura 4:Imágenes que demuestran la concordancia de la zona de ablación en la RMN post-tratamiento (A) con la zona necrótica real en la muestra de montaje completo (B). El paciente es un hombre de 67 años con PCa en la zona de transición correcta, puntuación de Gleason 3 + 4 = 7, participando en un ensayo de "tratar y resecar". A. Imagen postablación axial T1-weighted contrast-enhanced, que muestra el defecto de perfusión causado por el tratamiento con láser (verde). B. Mancha de H&E de montura entera de la próstata. El tejido necrótico se delinea en verde, el tejido peri-necrótico en amarillo, y el tumor intacto (no tratado) en azul. Reproducido bajo una licencia Creative Commons de Bomers et al, World Journal of Urology. 15 Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El propósito del actual trabajo es describir e ilustrar un método para realizar la ablación focal del laser (FLA) del cáncer de próstata (PCa). El método difiere de otros métodos de terapia focal, ya que está destinado a realizarse bajo anestesia local en un entorno clínico. El método FLA que se muestra aquí se introdujo en 2017,20 y se ha refinado continuamente desde entonces. Por lo tanto, el procedimiento descrito en este documento puede ser de valor para los futuros investigadores.
El tratamiento con láser del tejido prostático parece datarse de la investigación de McNicholas y sus colegas, que trabajan en el University College de Londres, que demostraron en 1993 que la necrosis focal de la coagulación podría producirse en próstatas caninas con un Nd: Dispositivo YAG. 32 Presagiando el futuro, estos autores postularon que la técnica "... puede resultar de valor... para la destrucción de pequeños tumores prostáticos focales". Posteriormente, la ablación con láser de PCa en el hombre fue descrita en 2009 por Lindner et al de la Universidad de Toronto. 26 En ese esfuerzo pionero, Lindner combinó la modalidad emergente de la próstata MRI con el software temprano de la imagen-fusión y las puntas de prueba termales convencionales para apuntar con éxito el cáncer y para supervisar la ablación del laser en 12 hombres.
Puesto que la mayoría del PCa importante se puede visualizar con MRI multi-paramétrico contemporáneo, la blanco y el tratamiento del en-agujero de lesiones visibles pudieron ser una extensión directa del procedimiento de diagnóstico. la blanco del En-agujero de la lesión es directa, y SR. termometría permite la supervisión alejada de la ablación. Raz et al informaron dos de estos tratamientos en 2010. 33 En 2013, Oto y sus colegas informaron una serie de tratamientos con FLA en el orificio (N = 9). 5 La adopción de FLA en el orificio ha sido facilitada por el hardware desarrollado para ese propósito, según lo informado por Natarajan et al en 2016. 19 Varios radiólogos, utilizando una fibra láser refrigerada por agua para evitar la carbonización, han adoptado el método de perforación; y ahora se han reportado cientos de tratamientos fla en el agujero (Walser, Feller, Sperling/Lepor). 6,16,34,35
Mientras que los resultados oncológicos a corto plazo de la FLA en el agujero pueden ser favorables (Tabla 1), no es probable que el procedimiento se adopte ampliamente, debido a los factores limitantes descritos en la introducción. Por otra parte, SR. termometría para la supervisión del tratamiento exhibe un número de limitaciones importantes. 19 Basándose en una experiencia de una década con los procedimientos de biopsia por fusión de MRI/US (N ~ 4000), teorizamos que una fibra láser podría ser dirigida a una lesión de cáncer, de manera similar a la inserción de una aguja de biopsia, y que la supervisión del tratamiento se podría lograr directamente con sondas térmicas. Así, después de la experiencia del en-agujero, diez pacientes experimentaron FLA fuera de-agujero en la clínica de la urología de UCLA, usando solamente anestesia local, la dirección de la fusión de MRI/US, y la supervisión de la termal-punta de prueba. 20 No sólo se demostró la seguridad y la viabilidad del nuevo método, sino que entre estos últimos pacientes tratados, no se pudo encontrar evidencia de PCa en la biopsia posterior.
El efecto tisular de la FLA se ha aclarado en dos estudios, en los que la prostatectomía radical planificada se realizó 1-3 semanas después del procedimiento con láser (N = 9), es decir, un modelo de "tratamiento y reseque" (Figura 4). 15,27 En los 9 pacientes, el volumen de tejido necrótico encontrado en la próstata se aproximó al volumen estimado por la RM obtenida tras la finalización del tratamiento. Cuando se seccionaron las próstatas enteras, se observó una transición abrupta entre la necrosis y las células intactas de 1-5 mm fuera del área de ablación con láser (Figura 1). Los márgenes nítidos y la precisión de las zonas de ablación tienen implicaciones importantes para la exactitud del registro de MRI/US y del planeamiento de tratamiento.
Una parte importante del sistema Avenda es el software de planificación del tratamiento. Para que la FLA sea efectiva, la planificación debe incluir no solo la ubicación de la lesión, sino también el volumen de tejido necesario para la destrucción completa del tumor. El volumen de la ablación no puede ser simplemente el volumen de la MRI-lesión, porque el volumen real del tumor excede el de la lesión MRI-visible por un promedio de 3 dobleces. 21 Por otra parte, el cáncer extiende a menudo en dedo-como las proyecciones irregulares, que harían poco fiable cualquier margen de seguridad uniforme basado solamente en proyección de imagen (e.g., 1 cm más allá del límite de la lesión MRI-visible). El sistema Avenda incluye un software de planificación de tratamiento que utiliza no solo la lesión visible por RMN, sino también el seguimiento 3D de los sitios de biopsia (positivos y negativos) para proporcionar una ubicación precisa del volumen mínimo de ablación que abarcará completamente el cáncer. Un ejemplo de dicha planificación del tratamiento se ve en la Figura 3.
En conclusión, fla es un método seguro, factible para erradicar el cáncer de próstata en un entorno clínico bajo anestesia local. Los pasos del procedimiento se muestran en el video que lo acompaña. La colocación exacta de la fibra del laser en una lesión MRI-visible se logra usando la fusión de MRI/US, tanto como las agujas de la biopsia se colocan en tales lesiones. El monitoreo del tratamiento en tiempo real se realiza a través de una sonda térmica adyacente a la fibra láser. El software de planificación del tratamiento, que emplea volúmenes de lesiones de mri y localizaciones rastreadas del sitio de la biopsia para ayudar al operador a determinar los márgenes del tratamiento, es una parte importante del sistema. Fla de la En-clínica según lo descrito e ilustrado en este artículo aparece proporcionar una opción focal atractiva de la terapia no previamente disponible.
Divulgaciones
El Dr. Marks y el Dr. Natarajan son cofundadores de Avenda Health.
Materiales
| Name | Company | Catalog Number | Comments |
| Fusion Guidance System | NA | Artemis Displayed in Video | |
| Laser Catheter | Avenda Health | ||
| Orion Workstation | Avenda Health | ||
| Thermal Probe | Avenda Health | ||
| Transrectal Probe | NA | Not Platform Dependent | |
| Ultrasound | NA | Not Platform Dependent |
Referencias
- Cooperberg, M. R., Carroll, P. R. Trends in management for patients with localized prostate cancer, 1990-2013. JAMA - Journal of the American Medical Association. 314 (1), 80-82 (2015).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Connor, M. J., Gorin, M. A., Ahmed, H. U., Nigam, R. Focal therapy for localized prostate cancer in the era of routine multi-parametric MRI. Prostate Cancer and Prostatic Diseases. , 1-12 (2020).
- Ahmed, H. U., et al. Focal Therapy for Localized Prostate Cancer: A Phase I/II Trial. The Journal of Urology. 185, 1246-1255 (2011).
- Oto, A., et al. MR imaging-guided focal laser ablation for prostate cancer: Phase I trial. Radiology. 267 (3), 932-940 (2013).
- Lepor, H., Llukani, E., Sperling, D., Fütterer, J. J. Complications, Recovery, and Early Functional Outcomes and Oncologic Control Following In-bore Focal Laser Ablation of Prostate Cancer. European Urology. 68 (6), 924-926 (2015).
- Johnson, D. C., et al. Detection of Individual Prostate Cancer Foci via Multiparametric Magnetic Resonance Imaging. European Urology. 75 (5), 712-720 (2019).
- Johnson, D. C., et al. Do contemporary imaging and biopsy techniques reliably identify unilateral prostate cancer? Implications for hemiablation patient selection. Cancer. 125 (17), 2955-2964 (2019).
- Liu, W., et al. Copy number analysis indicates monoclonal origin of lethal metastatic prostate cancer. Nature Medicine. 15 (5), 559-565 (2009).
- Ahmed, H. U. The Index Lesion and the Origin of Prostate Cancer. New England Journal of Medicine. 361 (17), 1704-1706 (2009).
- Stafford, R. J., et al. Magnetic resonance guided, focal laser induced interstitial thermal therapy in a canine prostate model. Journal of Urology. 184 (4), 1514-1520 (2010).
- Lee, T., Mendhiratta, N., Sperling, D., Lepor, H. Focal laser ablation for localized prostate cancer: principles, clinical trials, and our initial experience. Reviews in urology. 16 (2), 55-66 (2014).
- Johnson, D. E., Cromeens, D. M., Price, R. E. Interstitial laser prostatectomy. Lasers in Surgery and Medicine. 14 (4), 299-305 (1994).
- Eggener, S. E., Yousuf, A., Watson, S., Wang, S., Oto, A. Phase II Evaluation of Magnetic Resonance Imaging Guided Focal Laser Ablation of Prostate Cancer. Journal of Urology. 196 (6), 1670-1675 (2016).
- Bomers, J. G. R. R., et al. MRI-guided focal laser ablation for prostate cancer followed by radical prostatectomy: correlation of treatment effects with imaging. World Journal of Urology. 35 (5), 703-711 (2017).
- Walser, E., et al. Focal Laser Ablation of Prostate Cancer: Results in 120 Patients with Low- to Intermediate-Risk Disease. Journal of Vascular and Interventional Radiology. 30 (3), 401-409 (2019).
- Al-Hakeem, Y., Raz, O., Gacs, Z., Maclean, F., Varol, C. Magnetic resonance image-guided focal laser ablation in clinically localized prostate cancer: safety and efficacy. ANZ Journal of Surgery. 89 (12), 1610-1614 (2019).
- Barqawi, A., Krughoff, K., Li, H., Patel, N. U. Initial Experience of Targeted Focal Interstitial Laser Ablation of Prostate Cancer with MRI Guidance. Current Urology. 8 (4), 199-207 (2014).
- Natarajan, S., et al. Focal Laser Ablation of Prostate Cancer: Phase I Clinical Trial. Journal of Urology. 196 (1), 68-75 (2016).
- Natarajan, S., et al. Focal Laser Ablation of Prostate Cancer: Feasibility of Magnetic Resonance Imaging-Ultrasound Fusion for Guidance. Journal of Urology. 198 (4), 839-847 (2017).
- Priester, A., et al. Magnetic Resonance Imaging Underestimation of Prostate Cancer Geometry: Use of Patient Specific Molds to Correlate Images with Whole Mount Pathology. Journal of Urology. 197 (2), 320-326 (2017).
- Lightner, D. J., Wymer, K., Sanchez, J., Kavoussi, L. Best Practice Statement on Urologic Procedures and Antimicrobial Prophylaxis. Journal of Urology. 203 (2), 351-356 (2020).
- Jones, T. A., Radtke, J. P., Hadaschik, B., Marks, L. S. Optimizing safety and accuracy of prostate biopsy. Current Opinion in Urology. 26 (5), 472-480 (2016).
- Jayadevan, R., Zhou, S., Priester, A. M., Delfin, M., Marks, L. S. Use of MRI-ultrasound fusion to achieve targeted prostate biopsy. Journal of Visualized Experiments. (146), e59231 (2019).
- Zheng, X., et al. Focal Laser Ablation Versus Radical Prostatectomy for Localized Prostate Cancer: Survival Outcomes From a Matched Cohort. Clinical Genitourinary Cancer. 17 (6), 464-469 (2019).
- Lindner, U., et al. Image Guided Photothermal Focal Therapy for Localized Prostate Cancer: Phase I Trial. Journal of Urology. 182, 1371-1377 (2009).
- Lindner, U., et al. Focal Laser Ablation for Prostate Cancer Followed by Radical Prostatectomy: Validation of Focal Therapy and Imaging Accuracy. European Urology. 57 (6), 1111-1114 (2010).
- van Luijtelaar, A., et al. Focal laser ablation as clinical treatment of prostate cancer: report from a Delphi consensus project. World Journal of Urology. 37, 2147-2153 (2019).
- . Use of Laser Interstitial Thermal Therapy in the Focal Treatment of Localized Prostate Cancer - NCT02224911 Available from: https://clinicaltrials.gov/ct2/show/NCT02224911 (2020)
- . Focal Laser Ablation of Prostate Tissue - NCT02357121 Available from: https://clinicaltrials.gov/ct2/show/NCT02357121 (2020)
- . Focal Laser Ablation of Prostate Cancer -NCT04305925 Available from: https://clinicaltrials.gov/ct2/show/NCT04305925 (2020)
- McNICHOLAS, T. A., STEGER, A. C., BOWN, S. G. Interstitial Laser Coagulation of the Prostate An Experimental Study. British Journal of Urology. 71 (4), 439-444 (1993).
- Raz, O., et al. Real-Time Magnetic Resonance Imaging-Guided Focal Laser Therapy in Patients with Low-Risk Prostate Cancer. European Urology. 58 (1), 173-177 (2010).
- . Transrectally delivered, outpatient MRI-guided laser focal therapy of prostate cancer: 9.5 year interim results of NCT #02243033, Presentation at the AdMeTech 4th Global Summit on Precision Diagnosis and Treatment of Prostate Cancer Available from: https://www.admetech.org/wp-content/uploads/2019/08/DMI-FOCAL-Tx-2019-NCT-02243033.FINAL_.pdf (2020)
- Chao, B., Llukani, E., Lepor, H. Two-year Outcomes Following Focal Laser Ablation of Localized Prostate Cancer. European Urology Oncology. 1 (2), 129-133 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados