Method Article
Ablation focale de laser du cancer de la prostate : Une procédure de bureau
Dans cet article
Résumé
Cet article présente et décrit un traitement de patient pour le cancer de la prostate utilisant l’ablation focale de laser. Le placement de cathéter de laser est guidé par la formation image de fusion de MRI-ultrason d’une mode semblable à la biopsie d’aiguille de prostate. Le traitement est surveillé en temps réel avec une sonde thermique, placée à côté de la fibre laser.
Résumé
En cet article, nous décrivons et trons illustrer un procédé de patient pour l’ablation focale de laser (FLA) du cancer de la prostate (PCa). La procédure est conceptuellement semblable à une biopsie de fusion et est exécutée sous l’anesthésie locale dans un arrangement de clinique ; le temps de traitement est habituellement inférieur à une heure. L’insertion laser est guidée par ultrasons; Le ciblage de lésion est par l’intermédiaire de la fusion de résonance magnétique de formation image-ultrason (MRI/US), comme dans la biopsie visée de prostate. La surveillance de l’ablation en temps réel est réalisée à l’aide d’une sonde thermique adjacente à la fibre laser. La vidéo montre la planification de la procédure, la préparation du patient, les différentes étapes de la procédure et la surveillance du traitement. L’innocuité, la faisabilité et l’efficacité de cette approche ont été établies au cours d’un essai précédent. Le FLA ambulatoire sous l’anesthésie locale est une option pour la gestion du cancer de la prostate à risque intermédiaire.
Introduction
Le cancer de la prostate (PCa) est la malignité interne la plus commune chez les hommes américains1. Environ 190 000 nouveaux cas et 33 000 décès sont attendus en 2020, ce qui en fait la deuxième cause la plus fréquente de décès par cancer chez les hommes2. La plupart des cas de PCa sont guérissables s’ils sont traités alors qu’ils sont localisés à la prostate. Cependant, l’identification du cancer dans la prostate n’est souvent pas possible avec l’imagerie conventionnelle d’ultrason (US) ; ainsi, le traitement a traditionnellement impliqué la chirurgie ou la radiation de la glande entière. Le paradigme de la « glande entière » a été modifié avec l’introduction de l’imagerie par résonance magnétique (IRM), qui, contrairement aux États-Unis, permet la localisation du PCa et la biopsie ciblée3,4,5,6. Alors que l’IRM sous-estime probablement la multifocité de PCa7,et peut manquer de petites lésions8,il peut identifier de manière fiable la lésion index, qui est presque toujours le moteur de la maladie métastatique9,10.
L’identification fiable d’IRM des lésions index a fourni un chemin pour le traitement focal du PCa (c.-à-d., ablation partielle de glande (PGA)). Le but de la PGA est de détruire la lésion d’index tout en préservant l’organe et en minimisant ainsi les effets secondaires. L’ablation focale au laser (FLA), qui emploie l’énergie lumineuse pour détruire les tissus par nécrose coagulative11,12,est une forme de PGA. L’efficacité de l’énergie laser pour abréger le tissu de prostate a été établie en 199313,suggérant le placement des fibres laser dans les cancers de la prostate à cet effet. En utilisant l’IRM pour guider le placement des fibres et la thermographie IRM pour la surveillance du traitement (c.-à-d. traitement en forage), les taux de réussite à court terme de la FLA semblent se rapprocher de ceux de la chirurgie ou de la radiothérapie5,6,12,14,15,16,17,18,19. Cependant, les procédures laser effectuées en alésage, ou dans un tube d’IRM, sont souvent lourdes, coûteuses, longues et gourmandes en ressources. Et les procédures d’alésage ne sont effectuées que par des radiologues formés sous-spécialisés.
Comme alternative à la FLA en alésage, la faisabilité d’effectuer la FLA dans un cadre clinique---utilisant la fusion IRM / US pour guider et une sonde de température interstitielle pour la surveillance du traitement--- est à l’étude à UCLA depuis 201419,20. Le procédé de FLA dans un arrangement de clinique s’est avéré semblable à celui de la biopsie visée, substituant une fibre de laser pour une aiguille de biopsie. En comparaison avec HIFU et la cryothérapie, qui sont les autres méthodes actuellement disponibles de PGA, la méthode laser décrite ici est rapide et peu coûteuse, sans besoin d’une salle d’opération ou d’une anesthésie générale.
Cet article vise à décrire et à démontrer fla patient sous l’anesthésie locale dans une clinique d’urologie. Les urologues qui sont au courant de la fusion MRI/US pour la biopsie visée apprécieront les similitudes de FLA au procédé de biopsie. Les objectifs secondaires comprennent la description des éléments techniques qui facilitent la facilité d’utilisation et la description des avantages de la thérapie focale.
Protocole
REMARQUE: Les méthodes décrites ici sont celles utilisées à UCLA pour exécuter FLA de la prostate. Le projet de recherche, y compris le protocole, a été approuvé par le comité d’examen institutionnel (IRB) de l’UCLA. Tous les patients ont eu la biopsie visée de la prostate, dans laquelle le MRI a été interprété par un uro-radiologist expérimenté. Des lésions visibles sur MRI ont été biopsiées dans la région d’intérêt (ROI) et en dehors du ROI utilisant un modèle systématique. Les biopsies positives et la région d’intérêt d’IRM sont employées pour planifier le traitement avec l’ablation de laser afin de traiter la lésion index et de créer une marge de tissu traité autour de la tumeur, étant donné que MRI sous-estime la taille de la tumeur. 21 Seulement des patients présentant le cancer de la prostate de risque intermédiaire (GG2-3 PSA < 20, étape < T2), un roi simple d’index et aucun cancer de la prostate cliniquement significatif contralatéral sont considérés éligibles pour le traitement. Les patients présentant une diathèse hémorragique ou une incapacité à tolérer un traitement sans sédation sont considérés comme inéligibles.
1. Planification du traitement
- Avant le traitement, planifier les ablations cible à l’aide de l’entrée de l’IRM et des coordonnées de biopsie.
- Effectuez la planification du traitement avec le logiciel fourni.
2. Préparation de la salle de procédure
- Affichez un panneau d’avertissement laser à l’extérieur de la salle d’intervention.
- Positionnez le poste de travail pour un accès confortable.
- Mise sous tension du poste de travail, du dispositif de fusion et des ultrasons transrectaux.
- Entrez les informations d’identification de connexion et sélectionnez le patient souhaité dans la liste de travail par défaut contenant les plans non exécutés.
REMARQUE: De nouveaux plans de traitement peuvent être ajoutés via une connexion USB ou Internet comme indiqué dans le manuel d’utilisation. - Accrocher un sac de solution saline au crochet désigné sur le poste de travail; un sac de retour salin de déchets est également attaché.
- Amorcez le tube salin en permettant l’écoulement par gravité du fluide avant de verrouiller le tube. La solution saline est ensuite connectée à la pompe péristaltique et suspendue pour une utilisation ultérieure pendant la procédure.
3. Préparation de la sonde TRUS
- Appliquez de la gelée à ultrasons directement sur une sonde TRUS propre.
REMARQUE: À UCLA, toutes les sondes TRUS sont désinfectées via un système automatisé avec une solution de peroxyde d’hydrogène vaporisée. - Placez un condom sur la gelée à ultrasons sur la sonde TRUS et fixez-le à la base à l’aide d’un élastique.
NOTA : Selon la pratique courante, tenter d’enlever les bulles d’air piégées sous le condom. - Placez un guide multicanal sur le condom et verrouillez-le en place à l’aide de la pince métallique. Un deuxième condom avec de la gelée d’ultrason interne peut être placé sur le guide multicanal pour augmenter le confort du patient.
4. Préparation du patient
- Demandez au patient de nettoyer sa voûte rectale avec et lavement le matin de la biopsie.
- Assurez-vous que le patient a obtenu des antibiotiques prophylactiques 60 minutes avant la procédure22.
REMARQUE: À UCLA, 1 g d’Ertapenem est administré par voie intramusculaire 60 minutes avant la procédure. Cette décision a été prise basée sur l’antibiogram d’UCLA et avait empêché des épisodes septiques de poteau-biopsie au cours des 1500 dernières biopsies transrectal. 23 Compte tenu de ce succès, nous avons choisi de l’utiliser également pour l’ablation au laser transrectal. - Fournir aux patients de l’acétaminophène 1000 mg PO, du kétorolac 30 mg IM et, éventuellement, du diazépam 10 mg PO, mais recommandé, 60 minutes avant la procédure.
REMARQUE: Les patients peuvent éprouver un désir modéré de vider ou de pression dans le pénis pendant la procédure. D’après notre expérience, aucun stupéfiant n’est bénéfique. - Les patients peuvent trouver utile d’apporter de la musique personnelle et des écouteurs comme anxiolytique supplémentaire.
- Placez le patient dans la position latérale gauche decubitus comme pour la biopsie transrectal.
- Enregistrer les signes vitaux du patient avant de commencer l’intervention et à des intervalles de 30 minutes.
5. Administration de bloc nerveux prostatique
- Insérez la sonde TRUS lubrifiée jusqu’à ce que le centre de la prostate soit clairement visible.
- Optimisez le gain d’ultrasons, la compensation de gain de temps (curseurs TGC à droite de la plupart des ultrasons), la profondeur et la mise au point afin que la prostate soit centrée dans le moniteur de visualisation d’ultrasons.
REMARQUE : le gain optimal se traduit par une image gris moyen dans la zone périphérique. Les curseurs TGC sont mieux réglés à un angle progressivement incliné pour compenser l’atténuation des ondes des tissus éloignés. La profondeur et la concentration des ultrasons dépendront de la taille de la prostate. L’accent doit être mis sur la zone périphérique pour optimiser la visualisation des marqueurs acoustiques sur le cathéter laser. - Activez le guide de biopsie à l’écran et placez une aiguille spinale de calibre 22 au centre du guide multicanal pour anesthésier la prostate.
REMARQUE: À UCLA nous anesthésions la prostate dans le plan sagittal en plaçant 10-20 ml de lidocaïne/marcaine à la jonction de la prostate et des vésicules séminales. Une infiltration correcte entraînera une séparation des vésicules séminales et de la prostate de la paroi rectale.
6. Fusion IRM-US
- Placez le système de fusion d’imagerie et le poste de travail suffisamment près du patient afin de visualiser les écrans du poste de travail tout en observant le patient.
- Si vous utilisez l’Artemis, utilisez une technique d’ancrage et d’enregistrement d’image décrite précédemment. 24 ans
7. Acquisition de cibles
- Naviguez les ultrasons jusqu’au centre du premier site d’ablation à l’aide de cibles numériques fournies par le dispositif de fusion. Ce processus est similaire à guider l’échographie vers une région d’IRM d’intérêt lors de la biopsie de fusion.
REMARQUE : Chaque site d’ablation est déterminé à partir de la région d’IRM d’intérêt et des carottes de biopsie positives(figure 1). Le plan de traitement du patient doit être transféré au poste de travail et au dispositif de fusion pendant la préparation de la salle d’intervention décrite ci-dessus. - Sélectionnez la zone d’ablation actuelle.
8. Placement du cathéter laser et de la sonde de température
- Placez le cathéter laser de calibre 14 dans la chambre centrale du guide multicanal.
REMARQUE: Le guide multicanal est incurvé pour fournir un léger frottement empêchant ainsi les éléments de traitement de glisser vers l’arrière pendant l’ablation. Surmontez cette friction en tournant d’avant en arrière tout en avançant le cathéter laser dans la prostate. - Avancez le cathéter laser jusqu’à ce que quatre bandes échogéniques soient visualisées et alignées avec le marqueur de profondeur à l’écran. Pour une ablation de zone périphérique, les marqueurs seront de plusieurs mm à l’extérieur de la capsule prostatique (Figure 2).
REMARQUE: Dans le cas d’une capsule postérieure fibreuse, le cathéter laser peut dévier plutôt que de traverser la capsule de prostate. Toute déviation sera visible sur l’échographie lors de l’insertion. En cas de déviation, retirez le cathéter laser et insérez un leader, tel que la sonde thermique robuste, pour créer une ouverture pilote dans la capsule. Le cathéter laser peut alors être avancé comme prévu. - Insérez la sonde thermique à gauche ou à droite du cathéter laser selon le plan de traitement. À la bonne profondeur, la sonde thermique s’emboîte avec la poignée du cathéter laser, ce qui lui permet de s’aligner dans la bonne orientation.
REMARQUE: Après le placement, vérifiez que la fente sur la sonde thermique est assise dans la poignée du cathéter laser. La sonde thermique se verrouille magnétiquement en place et empêche la rotation pendant le traitement. - Connectez le tube intraveineux amorcé du sac salin au port d’entrée proximal sur le cathéter laser.
- Connectez la solution saline de retour de l’orifice d’écoulement distal à un sac de drainage transparent afin que le liquide de retour puisse être visualisé.
REMARQUE: La circulation d’une solution saline autour du cathéter laser refroidira la fibre pendant le traitement
9. Exécuter la liste de contrôle de sécurité
- Pendant que vous passez sur l’écran de surveillance du traitement, sélectionnez le site d’ablation souhaité. Une fois l’ablation appropriée sélectionnée, appuyez sur « CONFIRMER LA SÉLECTION ». Une liste de vérification de sécurité occupera maintenant le côté gauche du moniteur du poste de travail.
REMARQUE: Cette étape commencera à faire circuler une solution saline à travers le cathéter laser. Les petites bulles introduites lors de la connexion des tubes intraveineux sont initialement visibles aux ultrasons autour du laser. Cela peut agir comme une vérification supplémentaire de la position du cathéter laser. - Suivez la liste de vérification de sécurité, en cochant les cases une fois terminées.
- Assurez-vous que toutes les personnes dans la pièce enfilent des lunettes de sécurité laser, y compris le patient.
- Le système informatique du poste de travail vérifiera automatiquement la sonde thermique pour s’assurer que tous les thermocouples lisent des températures corporelles uniformes comprises entre 30 et 40 °C.
- Confirmez que les quatre bandes echogenic des cathéters de laser sont situées à la capsule de prostate, car le placement de la sonde thermique peut pousser la prostate loin du cathéter de laser.
REMARQUE: La zone d’ablation commence à 5 mm distal aux marqueurs échogéniques et s’étend encore 27 mm de longueur et 18 mm de diamètre (maximum).
10. Exécution de l’ablation des tissus au laser
- Une fois la liste de contrôle de sécurité terminée, appuyez sur « START LASER » pour commencer l’ablation.
- Surveillez l’avancement du traitement en temps réel à l’aide de relevés de température, d’une minuterie et d’une carte des dommages.
REMARQUE: Évaluez la température de tissu utilisant le graphique multiligne à gauche du modèle de prostate. La température rectale est marquée en blanc et ne doit pas dépasser 42 °C. La température à l’extrémité du cathéter laser est indiquée en bleu (Figure 3). Le laser s’éteint automatiquement si la pointe du laser dépasse 75 °C ou si la paroi rectale dépasse 42 °C.
REMARQUE: Une fois que le laser est actif, surveillez le temps de traitement à chaque site d’ablation à l’aide de la barre rouge en haut de l’écran. Une carte des dommages donne une représentation 3D des tissus traités en fonction de la température et du temps.
REMARQUE: Notez les changements sur les ultrasons en mode B. Le tissu de prostate ne change habituellement pas dans l’apparence pendant l’ablation au laser. Avec les traitements périodiques le tissu peut prendre un aspect hypoechoic, mais la visualisation des ÉTATS-UNIS sert principalement pour le positionnement du laser.
REMARQUE: Surveiller les caractéristiques d’échographie concernant comme suit:- Des micro-bulles tourbillonnantes se formant au-delà des bandes de cathéter échogénique du laser peuvent indiquer une fuite dans une solution saline circulante due à un superchauffage. Bien que cela n’ait aucun impact sur la sécurité, les progrès du traitement peuvent être ralentis.
- Une augmentation de la nature hyperechoic ou du « blanchiment » de la graisse rectale peut se produire si le cathéter de laser est par inadvertance tiré en arrière, causant le chauffage de la graisse perirectal.
- Si l’un ou l’autre de ces résultats d’ultrason est observé, le traitement au laser doit être arrêté.
- Le laser s’arrête automatiquement une fois que la minuterie est à court, mais un praticien peut choisir de mettre fin à l’ablation manuellement en appuyant sur « ARRÊTER LE LASER ». La solution saline continuera de s’écouler, refroidissant la pointe laser.
REMARQUE : Envisager d’arrêter l’ablation tôt si les températures se stabilisent au-dessus de 55 °C pendant plus de 60 secondes. - Maintenez le cathéter laser et la sonde thermique en place jusqu’à ce que la température du cathéter laser soit tombée en dessous de 42 °C, empêchant ainsi le chauffage rectal de la paroi pendant le retrait du cathéter laser.
11. Ablations subséquentes
- Placez l’échographie sur le site d’ablation suivant à l’aide des cibles numériques fournies par le dispositif de fusion.
- Évaluer si les images échographiques vivantes restent enregistrées à l’IRM de la prostate et effectuer une compensation de mouvement si nécessaire.
REMARQUE: Si vous utilisez l’Artemis, la technique de compensation de mouvement est décrite dans la vidéo référencée précédemment. 24 ans - Sur l’écran de surveillance du traitement, le site d’ablation initial sera maintenant grisé; cependant, il peut être traité à nouveau si cela est jugé nécessaire.
- Sélectionnez le site d’ablation suivant sur le côté gauche de l’écran et répétez le processus décrit aux étapes 8 à 10.
12. Conclure la séance de traitement
- Une fois que tous les sites d’ablation ont été traités, un bouton « TERMINER LE TRAITEMENT » apparaîtra. En appuyant sur ce bouton, vous verrez un écran de révision du traitement qui affiche les mesures quantitatives pour la séance de traitement.
- Retirer la sonde TRUS du rectum du patient. La pression manuelle peut être appliquée au mur rectal au-dessus de la prostate pour faciliter le hemostasis.
Résultats
Les résultats publiés de FLA sont présentés dans le tableau 2. Une variété de méthodes et de technologies sont incluses. Plus de 400 patients qui ont subi diverses formes de FLA pour le traitement du PCa se trouvent dans la base de données SEER. 25 Pour quantifier le nombre et les caractéristiques de FLA rapportés dans la littérature, nous avons effectué une revue systématique de Medline et de la Cochrane Library. Notre recherche a été effectuée à l’aide de termes de recherche sur tout le terrain, y compris « ablation focale au laser » et « cancer de la prostate ». Au total, 247 titres et résumés ont été examinés. Seulement des cas rapportant l’ablation focale de laser, le MRI, et les résultats oncologiques ont été inclus. 13 publications évaluées par des pairs ont été admissibles à l’inclusion, représentant 333 patients au total (tableau 1).
Le traitement a été exécuté avec un laser de diode de 980 nanomètre dans toutes les études sauf 2. 26,27 Les paramètres de traitement étaient constitués de niveaux de puissance compris entre 6 et 18 Watts et de temps de traitement s’étendant sur 1 à 4 minutes par site d’ablation (tableau 1). La surveillance de la température de traitement a été assurée par thermométrie IRM dans 9 études et par sonde de température directe dans 3 études (tableau 1). Toutes les études ont été réalisées en forage, à l’exception de celles de Lindner et de l’étude ultérieure de Natarajan. 20,26,27
La ligne de base médiane PSA pour la cohorte était 5,7 (gamme 1.1 - 14.8). Après FLA, la PSA médiane à 3, 6, 12 et 24 mois était 3,9, 5,5, 3,8, et 3,9 respectivement. L’IPSS de base médian pour la cohorte était de 6. Après FLA, ipss médian à 3, 6, 12 et 24 mois était 5, 5,5, 7,3 et 11,5 respectivement. Le SHIM de référence médian pour la cohorte était de 20. Après FLA, shim médian à 3, 6, 12 et 24 mois était 19, 18, 20, et 19 respectivement.
Dans toutes les études, les complications n’ont pas été signalées de manière uniforme; cependant il y avait seulement une complication classifiée par les auteurs en tant que catégorie III (une infection d’appareil urinaire). 16 Les auteurs n’ont pas précisé les caractéristiques qui ont classé cet événement comme un événement de grade III. Deux fistules recto-urétrales, les deux fermant spontanément après cathéterisation prolongée,16 ont été rapportées en tant qu’événements défavorables de la catégorie II.
Le suivi oncologique a été regroupé par période de suivi : moins de 6 mois, un an et deux ans (tableau 2). La biopsie de suivi a été exécutée par biopsie guidée par MRI dans-alésage dans 4 études, et biopsie de fusion DE MRI-US dans 6 études. Deux études ont utilisé la biopsie systématique et deux études ont réalisé des investigations de « traiter-et-réséquer » où le spécimen de prostatectomy a été évalué. Le succès du traitement a été défini selon un protocole de consensus delphi. 28 Le succès sur le terrain a été défini comme l’absence de PCa GG2 ≥ dans le site d’ablation antérieur. La défaillance hors champ a été définition comme ≥ GG2 en dehors de la zone d’ablation antérieure. Parmi les patients présentant des résultats de biopsie de suivi, le succès global sur le terrain après le traitement à 6 mois (N = 83), 1 an (N = 64) et 2 ans (N = 39) était de 83%, 83% et 59% respectivement (tableau 2).
À l’UCLA, la FLA de la prostate a été réalisée dans trois essais cliniques successifs à partir de 2014. 29-31 18 hommes avec le cancer de la prostate de risque intermédiaire ont subi FLA, huit dans-alésage et 10 dans la clinique, sans aucun événement défavorable de la catégorie III. Actuellement, 10 hommes supplémentaires subissent une FLA à l’aide du dispositif démontré. 31 Tous les patients ont été évalués avant FLA avec un MRI 3T (enroulement de corps), et une biopsie de fusion MRI-US avec le prélèvement du ROI et de la biopsie systématique dans les 6 mois du traitement. Des biopsies de ligne de base et de suivi ont été exécutées sous des conseils de fusion de MRI/US utilisant le système de fusion d’Artemis avec le suivi de tous les emplacements de biopsie.
Tableau 1. Études rapportées d’ablation focale de laser.
| Numéro de référence | auteur | année | N | Âge médian (fourchette) | Puissance laser | Temps Rx (sec) | Marge prévue | Procédure d’alésage | Surveillance de la température | Ligne de base Gleason | ||||
| 3+3 | 3+4 | 4+3 | 4+4 | |||||||||||
| 26 | Lindner | 2009 | 12 | 56.5 (51-52) | - | 120 | - | Non | Sonde de température | 12 | 0 | 0 | 0 | |
| 27 | Lindner | 2010 | 4 | 66 (61-73) | - | 120 | - | Non | Sonde de température | 2 | 0 | 1 | 1 | |
| 5 | Oto | 2013 | 9 | 61 (52-77) | 6 à 15 W | - | - | oui | Thermométrie IRM | 8 | 1 | 0 | 0 | |
| 12 | Lee | 2014 | 23 | - | 8 W | 30-60 | - | oui | Thermométrie IRM | - | - | - | - | |
| 6 | Lépor | 2015 | 25 | 66 (49-84) | - | - | - | oui | Thermométrie IRM | 11 | 13 | 1 | 0 | |
| 18 | Al Barqawi | 2015 | 7 | 61 (56-69) | - | 90 | - | oui | Thermométrie IRM | 7 | 0 | 0 | 0 | |
| 15 | Bomers | 2016 | 5 | 66 (58-70) | - | - | 9 mm | oui | Thermométrie IRM | 2 | 2 | 1 | 0 | |
| 14 | Eggener | 2016 | 27 | 62 (-) | 6 à 15 W | 60-120 | 0 à 7,5 mm | oui | Thermométrie IRM | 23 | 3 | 1 | 0 | |
| 19 | Natarajan | 2016 | 8 | 63 (54-72) | 11 à 14 W | 180 | Personnalisé* | oui | Sonde de température # | 1 | 7 | 0 | 0 | |
| 20 | Natarajan | 2017 | 10 | 65 (52-74) | 13,75 W | 180 | Personnalisé* | Non | Sonde de température | 2 | 8 | 0 | 0 | |
| 35 | Chao | 2018 | 34 | 69 (52-88) | - | - | - | oui | Thermométrie IRM | 16 | 16 | 2 | 0 | |
| 17 | Al Hakeem | 2019 | 49 | 63 (51-73) | 10 à 15 W | 120 | 9 mm | oui | Thermométrie IRM | 13 | 29 | 7 | 0 | |
| 16 | Walser, | 2019 | 120 | 60 (45-86) | 17 - 18 W | 180-240 | 5 mm | oui | Thermométrie IRM | 37 | 56 | 27 | 0 | |
Tableau 1 : Le tiret (-) indique l’information qui n’est pas disponible dans le manuscrit publié. * indique que chaque marge a été planifiée individuellement. # indique que la surveillance a été effectuée à l’avec une sonde de température et une thermométrie IRM.
Tableau 2. Résultats de l’ablation focale de laser.
| Numéro de référence | Premier auteur | Méthode de biopsie de suivi | Biopsie de suivi | ≤ 6 mois | 12 mois | 24 mois | Indésirables | ||||||
| succès | échec | succès | échec | succès | échec | Je | Ii | Iii | |||||
| 26 | Lindner | Bx guidé par IRM | 12 | 12 | 0 | - | - | - | - | 2 | 0 | 0 | |
| 27 | Lindner | prostatectomie | 4 | 2 | 2 | - | - | - | - | - | - | - | |
| 5 | Oto | IRM/US Bx | 9 | 9 | 0 | - | - | - | - | 1 | 1 | 0 | |
| 12 | Lee | IRM/US Bx | 13 | - | - | 12 | 1 | - | - | - | - | - | |
| 6 | Lépor | Bx guidé par IRM | 21 | 20 | 1 | - | - | - | - | 0 | 0 | 0 | |
| 18 | Al Barqawi | Bx systématique | 5 | - | - | 5 | 00 | - | - | - | 1 | 0 | |
| 15 | Bomers | prostatectomie | 5 | 1 | 4 | - | - | - | - | - | - | - | |
| 14 | Eggener | Bx guidé par IRM # | 27 | 27 | - | 7 | 31 | - | - | 7 | 2 | 0 | |
| 19 | Natarajan | IRM/US Bx | 8 | 6 | 53 | - | - | - | - | 23 | 7 | 0 | |
| 20 | Natarajan | IRM/US Bx | 10 | 6 | 40 | - | - | - | - | 38 | 6 | 0 | |
| 35 | Chao | IRM/US Bx | 22 | - | - | - | - | 13 | 9 | - | - | - | |
| 17 | Al Hakeem | IRM/US Bx | 49 | - | - | 40 | 91 | - | - | 34 | 11 | 0 | |
| 16 | Walser, | Bx guidé par IRM | 44* | - | - | - | - | 26 | 18 | 8 | 8 | 1 | |
Notes de bas de page Tableau 2. Succès = absence de ≥ cancer de la prostate GG2 dans la zone d’ablation. Échec = présence d'≥ cancer de la prostate GG2 : total et hors champ (numéro d’indice). # indique que la biopsie guidée par IRM a été utilisée pour une biopsie de 6 mois, mais seule une biopsie systématique a été utilisée pour une biopsie de 12 mois. * indique que seuls les patients présentant une réduction de l’APS de < 50% et une IRM post ablation positive ont subi une biopsie; 76 patients n’ont pas subi la biopsie.
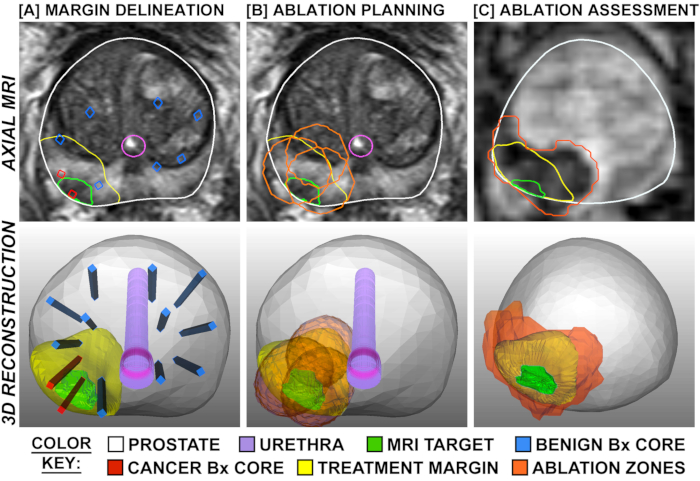
Figure 1: Planification et évaluation du traitement, représentées par superpositions sur IRM transversale (rangée du haut) et en 3D (rangée du bas). La colonne A montre la délimitation des marges de traitement, qui sont élargies autour de la cible d’IRM cancer-positive et limitées par les noyaux de biopsie systématique négatifs à proximité (bleu). La colonne B montre la planification des lieux d’ablation de manière à ce que les marges de traitement se chevauchent pour éviter de « sauter » des zones. La colonne C montre la formation image perfusion-pesée recueillie 2 heures après le traitement, démontrant la correspondance entre l’ampleur prévue et observée d’ablation. Veuillez cliquer ici pour voir une version plus grande de cette figure.
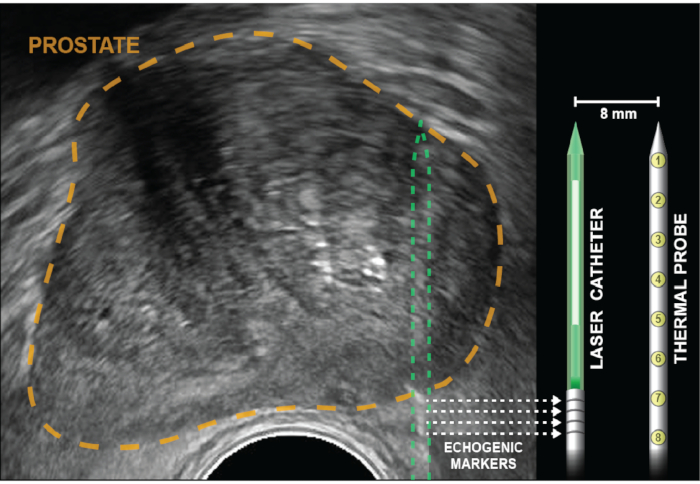
Ill. 2: Échographie axiale avec prostate en or. Les réflecteurs de cube d’angle (bandes échogéniques), indiqués par des flèches pointillées, sont gravés dans le cathéter laser à 5 mm du diffuseur (blanc). La sonde de température est insérée à la même profondeur que la fibre laser, puis verrouillée en place et reste parallèle au laser à 8 mm l’une de l’autre, hors du plan de vue américain. Huit capteurs thermiques, qui se trouvent à l’intérieur de la sonde à 4 mm d’intervalle, fournissent des enregistrements de température en des points allant de la base des bandes échogéniques à l’extrémité du cathéter laser. Les mesures de température les plus proches de la paroi rectale sont fournies par des mesures thermiques à la base de la sonde de température (positions 6-8). Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 3: Enregistrements de température lors de l’ablation focale au laser pour deux ablations successives. Axe des Y = température en degrés Celsius. Axe X = temps en minutes. Barres ombragées verticales = périodes d’activation laser. Ligne bleue = température 8mm de l’extrémité de la fibre laser (thermocouple distal). Ligne blanche = température de 8 mm du thermocouple proximal le plus proche de la paroi rectale. Une température de 60 degrés Celsius, atteinte même brièvement, assure la nécrose de la coagulation. Veuillez cliquer ici pour voir une version plus grande de cette figure.
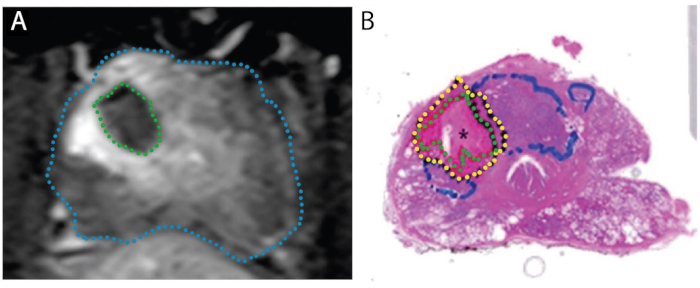
Figure 4: Images démontrant la concordance de la zone d’ablation lors de l’IRM post-traitement (A) avec la zone nécrotique réelle sur un échantillon de montage entier (B). Le patient est un homme de 67 ans avec PCa dans la zone de transition droite, score de Gleason 3 + 4 = 7, participant à un essai « traiter et réséquer ». A. Image contraster-augmentée axiale de T1-weighted de Poteau-ablation, montrant le défaut de perfusion provoqué par traitement de laser (vert). B. Tache de H&E de Tout-montage de la prostate. Le tissu nécrotique est délimité en vert, le tissu périnecrotique en jaune et la tumeur intacte (non traitée) en bleu. Reproduit sous une licence Creative Commons de Bomers et al, World Journal of Urology. 15 Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le but du présent travail est de décrire et d’illustrer une méthode pour exécuter l’ablation focale de laser (FLA) du cancer de la prostate (PCa). La méthode diffère des autres méthodes de thérapie focale, car elle est destinée à être réalisée sous anesthésie locale dans un cadre clinique. La méthode FLA présentée ici a été introduite en 2017,20 et a été continuellement affinée depuis lors. Ainsi, la procédure décrite dans ce document peut être utile aux futurs investigateurs.
Le traitement au laser du tissu prostatique semble dater de la recherche de McNicholas et de ses collègues, travaillant à l’University College londonien, qui a démontré en 1993 que la nécrose focale de coagulation pourrait être produite dans les prostates canines avec un dispositif ND: YAG. 32 Préfigurant l’avenir, ces auteurs postulent que la technique « ... peut s’avérer utile... pour la destruction des petites tumeurs prostatiques focales. Par la suite, l’ablation au laser de l’AGP chez l’homme a été décrite en 2009 par Lindner et coll. de l’Université de Toronto. 26 Dans cet effort pionnier, Lindner a combiné la modalité émergente de la prostate MRI avec le logiciel tôt d’image-fusion et les sondes thermiques conventionnelles pour cibler avec succès le cancer et surveiller l’ablation de laser chez 12 hommes.
Puisque le PCa le plus important peut être visualisé avec MRI multi-paramétrique contemporain, le ciblage et le traitement dans-alésage des lésions évidentes pourraient être une prolongation simple du procédé diagnostique. Le ciblage d’in-alésage de la lésion est direct, et M. thermométrie permet la surveillance à distance de l’ablation. Raz et coll. ont signalé deux traitements de ce type en 2010. 33 Une série de traitements fla dans l’alésage (N = 9) a été rapportée par Oto et ses collègues en 2013. 5 L’adoption de la FLA dans l’alésage a été facilitée par le matériel développé à cette fin, comme l’ont signalé Natarajan et coll. en 2016. 19 Un certain nombre de radiologues, utilisant une fibre laser refroidie à l’eau pour prévenir la carbonisation, ont adopté la méthode de l’alésage; et des centaines de traitements FLA dans-alésage ont maintenant été rapportés (Walser, Feller, Sperling/Lepor). 6,16,34,35
Bien que les résultats oncologiques à court terme de la FLA dans l’alésage puissent être favorables (tableau 1), la procédure n’est pas susceptible de devenir largement adoptée, en raison des facteurs limitatifs décrits dans l’introduction. D’ailleurs, M. thermométrie pour la surveillance de traitement montre un certain nombre de limitations importantes. 19 S’appuyant sur une expérience de dix ans avec des procédures de biopsie de fusion MRI/US (N~4000), nous avons théorisé qu’une fibre laser pourrait être visée dans une lésion cancéreuse, de la même manière que l’insertion d’une aiguille de biopsie, et que la surveillance du traitement pourrait être accomplie directement avec des sondes thermiques. Ainsi, suivant l’expérience d’in-bore, dix patients ont subi le FLA de hors-alésage dans la clinique d’urologie d’UCLA, utilisant seulement l’anesthésie locale, les conseils de fusion de MRI/US, et la surveillance de thermal-sonde. 20 Non seulement l’innocuité et la faisabilité de la nouvelle méthode ont été démontrées, mais parmi ces derniers patients traités, aucune preuve de PCa n’a pu être trouvée lors de la biopsie ultérieure.
L’effet tissulaire de fla a été clarifié dans deux études, où la prostatectomie radicale prévue a été exécutée 1-3 semaines après la procédure de laser (N =9), c.-à-d., un modèle « traiter-et-réséquer » (Figure 4). 15,27 Dans chacun des 9 patients, le volume de tissu nécrotique trouvé dans la prostate s’est approché du volume estimé par l’IRM obtenue après achèvement du traitement. Lorsque les prostates entières ont été sectionnés, une transition brusque a été observée entre la nécrose et les cellules intactes à 1-5 mm en dehors de la zone d’ablation au laser (figure 1). Les marges croustillantes et la précision des zones d’ablation ont des implications importantes pour l’exactitude de l’enregistrement MRI/US et de la planification de traitement.
Une partie importante du système Avenda est le logiciel de planification du traitement. Pour une FLA efficace, la planification doit inclure non seulement l’emplacement de la lésion, mais également le volume de tissu nécessaire à la destruction complète de la tumeur. Le volume d’ablation ne peut pas simplement être le volume de MRI-lésion, parce que le volume réel de tumeur dépasse celui de la lésion MRI-visible par une moyenne de 3 fois. 21 De plus, le cancer se prolonge souvent dans des projections irrégulières en forme de doigts, ce qui rendrait peu fiable toute marge de sécurité uniforme basée uniquement sur l’imagerie (p. ex., 1 cm au-delà de la limite de la lésion visible par IRM). Le système Avenda comprend un logiciel de planification de traitement qui utilise non seulement la lésion visible par IRM, mais aussi le suivi 3D des sites de biopsie (positifs et négatifs) pour fournir un placement précis du volume minimal d’ablation qui englobera pleinement le cancer. Un exemple d’une telle planification de traitement est vu à la figure 3.
En conclusion, FLA est une méthode sûre et faisable pour éradiquer le cancer de la prostate dans un arrangement de clinique sous l’anesthésie locale. Les étapes de la procédure sont montrées dans la vidéo d’accompagnement. Le placement précis de la fibre de laser dans une lésion MRI-évidente est accompli utilisant la fusion MRI/US, tout comme les aiguilles de biopsie sont placées dans de telles lésions. La surveillance du traitement en temps réel est effectuée via une sonde thermique adjacente à la fibre laser. Le logiciel de planification du traitement, qui utilise les volumes de lésions provenant de l’IRM et des emplacements de sites de biopsie suivis pour aider l’opérateur à déterminer les marges de traitement, est une partie importante du système. Fla d’in-clinique comme décrit et illustré en cet article semble fournir une option focale attrayante de thérapie non précédemment disponible.
Déclarations de divulgation
Le Dr Marks et le Dr Natarajan sont cofondateurs d’Avenda Health.
matériels
| Name | Company | Catalog Number | Comments |
| Fusion Guidance System | NA | Artemis Displayed in Video | |
| Laser Catheter | Avenda Health | ||
| Orion Workstation | Avenda Health | ||
| Thermal Probe | Avenda Health | ||
| Transrectal Probe | NA | Not Platform Dependent | |
| Ultrasound | NA | Not Platform Dependent |
Références
- Cooperberg, M. R., Carroll, P. R. Trends in management for patients with localized prostate cancer, 1990-2013. JAMA - Journal of the American Medical Association. 314 (1), 80-82 (2015).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Connor, M. J., Gorin, M. A., Ahmed, H. U., Nigam, R. Focal therapy for localized prostate cancer in the era of routine multi-parametric MRI. Prostate Cancer and Prostatic Diseases. , 1-12 (2020).
- Ahmed, H. U., et al. Focal Therapy for Localized Prostate Cancer: A Phase I/II Trial. The Journal of Urology. 185, 1246-1255 (2011).
- Oto, A., et al. MR imaging-guided focal laser ablation for prostate cancer: Phase I trial. Radiology. 267 (3), 932-940 (2013).
- Lepor, H., Llukani, E., Sperling, D., Fütterer, J. J. Complications, Recovery, and Early Functional Outcomes and Oncologic Control Following In-bore Focal Laser Ablation of Prostate Cancer. European Urology. 68 (6), 924-926 (2015).
- Johnson, D. C., et al. Detection of Individual Prostate Cancer Foci via Multiparametric Magnetic Resonance Imaging. European Urology. 75 (5), 712-720 (2019).
- Johnson, D. C., et al. Do contemporary imaging and biopsy techniques reliably identify unilateral prostate cancer? Implications for hemiablation patient selection. Cancer. 125 (17), 2955-2964 (2019).
- Liu, W., et al. Copy number analysis indicates monoclonal origin of lethal metastatic prostate cancer. Nature Medicine. 15 (5), 559-565 (2009).
- Ahmed, H. U. The Index Lesion and the Origin of Prostate Cancer. New England Journal of Medicine. 361 (17), 1704-1706 (2009).
- Stafford, R. J., et al. Magnetic resonance guided, focal laser induced interstitial thermal therapy in a canine prostate model. Journal of Urology. 184 (4), 1514-1520 (2010).
- Lee, T., Mendhiratta, N., Sperling, D., Lepor, H. Focal laser ablation for localized prostate cancer: principles, clinical trials, and our initial experience. Reviews in urology. 16 (2), 55-66 (2014).
- Johnson, D. E., Cromeens, D. M., Price, R. E. Interstitial laser prostatectomy. Lasers in Surgery and Medicine. 14 (4), 299-305 (1994).
- Eggener, S. E., Yousuf, A., Watson, S., Wang, S., Oto, A. Phase II Evaluation of Magnetic Resonance Imaging Guided Focal Laser Ablation of Prostate Cancer. Journal of Urology. 196 (6), 1670-1675 (2016).
- Bomers, J. G. R. R., et al. MRI-guided focal laser ablation for prostate cancer followed by radical prostatectomy: correlation of treatment effects with imaging. World Journal of Urology. 35 (5), 703-711 (2017).
- Walser, E., et al. Focal Laser Ablation of Prostate Cancer: Results in 120 Patients with Low- to Intermediate-Risk Disease. Journal of Vascular and Interventional Radiology. 30 (3), 401-409 (2019).
- Al-Hakeem, Y., Raz, O., Gacs, Z., Maclean, F., Varol, C. Magnetic resonance image-guided focal laser ablation in clinically localized prostate cancer: safety and efficacy. ANZ Journal of Surgery. 89 (12), 1610-1614 (2019).
- Barqawi, A., Krughoff, K., Li, H., Patel, N. U. Initial Experience of Targeted Focal Interstitial Laser Ablation of Prostate Cancer with MRI Guidance. Current Urology. 8 (4), 199-207 (2014).
- Natarajan, S., et al. Focal Laser Ablation of Prostate Cancer: Phase I Clinical Trial. Journal of Urology. 196 (1), 68-75 (2016).
- Natarajan, S., et al. Focal Laser Ablation of Prostate Cancer: Feasibility of Magnetic Resonance Imaging-Ultrasound Fusion for Guidance. Journal of Urology. 198 (4), 839-847 (2017).
- Priester, A., et al. Magnetic Resonance Imaging Underestimation of Prostate Cancer Geometry: Use of Patient Specific Molds to Correlate Images with Whole Mount Pathology. Journal of Urology. 197 (2), 320-326 (2017).
- Lightner, D. J., Wymer, K., Sanchez, J., Kavoussi, L. Best Practice Statement on Urologic Procedures and Antimicrobial Prophylaxis. Journal of Urology. 203 (2), 351-356 (2020).
- Jones, T. A., Radtke, J. P., Hadaschik, B., Marks, L. S. Optimizing safety and accuracy of prostate biopsy. Current Opinion in Urology. 26 (5), 472-480 (2016).
- Jayadevan, R., Zhou, S., Priester, A. M., Delfin, M., Marks, L. S. Use of MRI-ultrasound fusion to achieve targeted prostate biopsy. Journal of Visualized Experiments. (146), e59231 (2019).
- Zheng, X., et al. Focal Laser Ablation Versus Radical Prostatectomy for Localized Prostate Cancer: Survival Outcomes From a Matched Cohort. Clinical Genitourinary Cancer. 17 (6), 464-469 (2019).
- Lindner, U., et al. Image Guided Photothermal Focal Therapy for Localized Prostate Cancer: Phase I Trial. Journal of Urology. 182, 1371-1377 (2009).
- Lindner, U., et al. Focal Laser Ablation for Prostate Cancer Followed by Radical Prostatectomy: Validation of Focal Therapy and Imaging Accuracy. European Urology. 57 (6), 1111-1114 (2010).
- van Luijtelaar, A., et al. Focal laser ablation as clinical treatment of prostate cancer: report from a Delphi consensus project. World Journal of Urology. 37, 2147-2153 (2019).
- . Use of Laser Interstitial Thermal Therapy in the Focal Treatment of Localized Prostate Cancer - NCT02224911 Available from: https://clinicaltrials.gov/ct2/show/NCT02224911 (2020)
- . Focal Laser Ablation of Prostate Tissue - NCT02357121 Available from: https://clinicaltrials.gov/ct2/show/NCT02357121 (2020)
- . Focal Laser Ablation of Prostate Cancer -NCT04305925 Available from: https://clinicaltrials.gov/ct2/show/NCT04305925 (2020)
- McNICHOLAS, T. A., STEGER, A. C., BOWN, S. G. Interstitial Laser Coagulation of the Prostate An Experimental Study. British Journal of Urology. 71 (4), 439-444 (1993).
- Raz, O., et al. Real-Time Magnetic Resonance Imaging-Guided Focal Laser Therapy in Patients with Low-Risk Prostate Cancer. European Urology. 58 (1), 173-177 (2010).
- . Transrectally delivered, outpatient MRI-guided laser focal therapy of prostate cancer: 9.5 year interim results of NCT #02243033, Presentation at the AdMeTech 4th Global Summit on Precision Diagnosis and Treatment of Prostate Cancer Available from: https://www.admetech.org/wp-content/uploads/2019/08/DMI-FOCAL-Tx-2019-NCT-02243033.FINAL_.pdf (2020)
- Chao, B., Llukani, E., Lepor, H. Two-year Outcomes Following Focal Laser Ablation of Localized Prostate Cancer. European Urology Oncology. 1 (2), 129-133 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon