Method Article
Ablazione laser focale del cancro alla prostata: una procedura d'ufficio
In questo articolo
Riepilogo
Questo articolo presenta e descrive un trattamento ambulatoriale per il cancro alla prostata utilizzando l'ablazione laser focale. Il posizionamento del catetere laser è guidato dall'imaging fusion a ultrasuoni 1000 in modo simile alla biopsia dell'ago prostatico. Il trattamento viene monitorato in tempo reale con una sonda termica, posizionata adiacente alla fibra laser.
Abstract
In questo articolo descriviamo e illustriamo una procedura ambulatoriale per l'ablazione laser focale (FLA) del cancro alla prostata (PCa). La procedura è concettualmente simile a una biopsia di fusione e viene eseguita in anestesia locale in un ambiente clinico; il tempo di trattamento è di solito inferiore a un'ora. L'inserimento laser è guidato da ultrasuoni; il targeting per lesione avviene tramite fusione a risonanza magnetica ad ultrasuoni (MRI/US), come nella biopsia prostatica mirata. Il monitoraggio dell'ablazione in tempo reale si ottiene utilizzando una sonda termica adiacente alla fibra laser. Il video mostra la pianificazione della procedura, la preparazione del paziente, vari passaggi durante la procedura e il monitoraggio del trattamento. La sicurezza, la fattibilità e l'efficacia di questo approccio sono state stabilite durante una precedente sperimentazione. L'FLA ambulatoriale in anestesia locale è un'opzione per la gestione del cancro alla prostata a rischio intermedio.
Introduzione
Il cancro alla prostata (PCa) è la malignità interna più comune negli uomini statunitensi1. Circa 190.000 nuovi casi e 33.000 decessi sono attesi nel corso del 2020, rendendola la seconda causa più comune di morte per cancro negli uomini2. La maggior parte dei casi di PCa sono curabili se trattati mentre sono localizzati alla prostata. Tuttavia, identificare il cancro all'interno della prostata spesso non è possibile con l'imaging convenzionale ad ultrasuoni (USA); pertanto, il trattamento ha tradizionalmente comportato la chirurgia o le radiazioni dell'intera ghiandola. Il paradigma "terra intera" è stato modificato con l'introduzione della risonanza magnetica (MRI), che, a differenza degli Stati Uniti, consente la localizzazione di PCa e biopsia mirata3,4,5,6. Mentre la risonanza prima di valutazione probabilmente sottovaluta la multifocalità di PCa7e può perdere piccolelesioni 8, può identificare in modo affidabile la lesione dell'indice, che è quasi sempre il driver della malattia metastatica9,10.
L'identificazione affidabile della MENTO delle lesioni indice ha fornito un percorso per il trattamento focale della PCa (ad esempio, ablazione parziale della ghiandola (PGA)). Lo scopo della PGA è quello di distruggere la lesione dell'indice preservando l'organo e riducendo così al minimo gli effetti collaterali. L'ablazione laser focale (FLA), che impiega energia luminosa per distruggere i tessuti attraverso la necrosicoagulativa 11,12, è una forma di PGA. L'efficacia dell'energia laser per abiare il tessuto prostatico è stata stabilita nel1993 13,suggerendo il posizionamento delle fibre laser nei tumori della prostata a tale scopo. Utilizzando la risonanza prima per la guida del posizionamento delle fibre e la termografia della risonanza prima per il monitoraggio del trattamento (cioè il trattamento al foro), i tassi di successo a breve termine della FLA sembrano avvicinarsi a quelli della chirurgia odelle radiazioni 5,6,12,14,15,16,17,18,19. Tuttavia, le procedure laser eseguite all'interno del foro o all'interno di un tubo di risonanza intensiva sono spesso ingombranti, costose, dispendiose in termini di tempo e ad alta intensità di risorse. E le procedure di in-bore vengono eseguite solo da radiologi addestrati sotto-speciali.
In alternativa alla FLA in-bore, la fattibilità di eseguire FLA in un ambiente clinico---utilizzando la fusione MRI / US per la guida e una sonda di temperatura interstiziale per il monitoraggio del trattamento--- è allo studio presso UCLA dal 201419,20. La procedura FLA in un ambiente clinico si è dimostrata simile a quella della biopsia mirata, sostituendo una fibra laser con un ago di biopsia. Rispetto all'HIFU e alla crioterapia, che sono gli altri metodi attualmente disponibili di PGA, il metodo laser qui descritto è rapido ed economico, senza bisogno di una sala operatoria o di un'anestesia generale.
Questo articolo ha lo scopo di descrivere e dimostrare la FLA ambulatoriale sotto anestesia locale in una clinica di urologia. Gli urologi che hanno familiarità con la fusione 10/USA per la biopsia mirata apprezzeranno le somiglianze della FLA con la procedura di biopsia. Gli obiettivi secondari includono la descrizione di elementi tecnici che facilitano la facilità d'uso e la descrizione dei benefici della terapia focale.
Protocollo
NOTA: I metodi descritti qui sono quelli utilizzati alla UCLA per eseguire FLA della prostata. Il progetto di ricerca, compreso il protocollo, è stato approvato dall'UCLA Institutional Review Board (IRB). Tutti i pazienti hanno avuto una biopsia mirata della prostata, in cui la risonanza prima è stata interpretata da un uro-radiologo esperto. Le lesioni visibili sulla risonanza valutazione sono state biopsiate all'interno della regione di interesse (ROI) e al di fuori del ROI utilizzando un modello sistematico. Le biopsie positive e la regione di interesse della risonanza prima vengono utilizzate per pianificare il trattamento con ablazione laser al fine di trattare la lesione dell'indice e creare un margine di tessuto trattato intorno al tumore, dato che la risonanza prima sottovaluta le dimensioni del tumore. 21 Solo i pazienti con tumore alla prostata a rischio intermedio (GG2-3 PSA < 20, Stage < T2), un ROI a indice singolo e nessun cancro alla prostata clinicamente significativo contralaterale sono considerati idonei per il trattamento. I pazienti con diatesi emorragica o incapacità di tollerare il trattamento senza sedazione sono considerati non ammissibili.
1. Pianificazione del trattamento
- Prima del trattamento, pianificare gli obiettivi di ablations utilizzando l'input delle coordinate di risonanza e biopsia.
- Eseguire la pianificazione del trattamento con il software fornito.
2. Preparazione della sala procedurale
- Visualizzare un segnale di avviso laser all'esterno della sala procedure.
- Posizionare la postazione di lavoro per un accesso confortevole.
- Alimentazione sulla postazione di lavoro, dispositivo di fusione ed ecografia transrettale.
- Immettere le credenziali di accesso e selezionare il paziente desiderato dall'elenco di lavoro predefinito contenente piani non esecuti.
NOTA: I nuovi piani di trattamento possono essere aggiunti tramite una connessione USB o Internet come descritto nel manuale d'uso. - Appendere un sacchetto di salina dal gancio designato sulla postazione di lavoro; è attaccato anche un sacchetto di ritorno salino di scarto.
- Innescare il tubo salino consentendo il flusso gravitazionale del fluido prima di bloccare il tubo. La salina viene quindi collegata alla pompa peristaltica e appesa per un uso successivo durante la procedura.
3. Preparazione sonda TRUS
- Applicare la gelatina ad ultrasuoni direttamente su una sonda TRUS pulita.
NOTA: Alla UCLA, tutte le sonde TRUS vengono disinfettate tramite un sistema automatizzato con soluzione di perossido di idrogeno vaporizzato. - Montare un preservativo sulla gelatina ad ultrasuoni sulla sonda TRUS e fissarlo alla base utilizzando un elastico.
NOTA: Secondo la pratica standard tentare di rimuovere le bolle d'aria intrappolate sotto il preservativo. - Posizionare una guida multicanale sul preservativo e bloccarla in posizione utilizzando il morsetto metallico. Un secondo preservativo con gelatina ad ultrasuoni interna può essere posizionato sopra la guida multicanale per aumentare il comfort del paziente.
4. Preparazione del paziente
- Dirigere il paziente per pulire la volta rettale con edema la mattina della biopsia.
- Assicurarsi che il paziente abbia ottenuto antibiotici profilattici 60 minuti prima della procedura22.
NOTA: All'UCLA, 1 g di Ertapenem viene somministrato per via intramuscolare 60 minuti prima della procedura. Questa decisione è stata presa sulla base dell'antibiogramma dell'UCLA e aveva impedito episodi settici post-biopsia nelle ultime 1500 biopsie transrettali. 23 Dato questo successo, abbiamo scelto di utilizzarlo anche per l'ablazione laser transrettale. - Fornire ai pazienti con Acetaminofene 1000 mg di PO, Ketorolac 30 mg di messaggistica istantanea e, facoltativamente, ma consigliato Diazepam 10 mg di PO, 60 minuti prima della procedura.
NOTA: I pazienti possono sperimentare un moderato desiderio di vuoto o pressione nel pene durante la procedura. Nella nostra esperienza, nessun narcotico è benefico. - I pazienti possono trovare utile portare musica personale e cuffie come ansiolitico aggiuntivo.
- Posizionare il paziente nella posizione del decubito laterale sinistro come per la biopsia transrettale.
- Registrare i segni vitali del paziente prima di iniziare la procedura e a intervalli di 30 minuti.
5. Somministrazione di blocco nervoso prostatico
- Inserire la sonda TRUS lubrificata fino a quando il centro della prostata non è chiaramente visibile.
- Ottimizzare il guadagno ecografico, la compensazione del guadagno di tempo (cursori TGC a destra della maggior parte degli ultrasuoni), la profondità e la messa a fuoco in modo che la prostata sia centrata all'interno del monitor di visualizzazione ad ultrasuoni.
NOTA: il guadagno ottimale si traduce in un'immagine medio-grigia all'interno della zona periferica. I cursori TGC sono meglio impostati con un angolo gradualmente inclinato per compensare l'attenuazione delle onde dei tessuti distanti. La profondità e la messa a fuoco degli ultrasuoni dipenderanno dalle dimensioni della prostata. La messa a fuoco deve essere impostata sulla zona periferica per ottimizzare la visualizzazione dei marcatori acustici sul catetere laser. - Attivare la guida alla biopsia sullo schermo e posizionare un ago spinale calibro 22 attraverso il centro della guida multicanale per anestetizzare la prostata.
NOTA: Alla UCLA anestetizziamo la prostata nel piano sagittale posizionando 10-20 mL di Lidocaina/Marcaina alla giunzione della prostata e delle vescicole seminali. La corretta infiltrazione causerà una separazione delle vescicole seminali e della prostata dalla parete rettale.
6. Fusione MRI-US
- Posizionare il sistema di fusione per immagini e la postazione di lavoro abbastanza vicini al paziente per visualizzare gli schermi della postazione di lavoro osservando anche il paziente.
- Se si utilizza Artemis, utilizzare una tecnica per l'ancoraggio e la registrazione delle immagini descritte in precedenza. 24 di cui 24
7. Acquisizione target
- Naviga l'ecografia al centro del primo sito di ablazione utilizzando bersagli digitali forniti dal dispositivo di fusione. Questo processo è simile a guidare l'ecografia verso una regione di interesse della risonanza prima durante la biopsia da fusione.
NOTA: Ogni sito di ablazione è determinato dalla regione di interesse della MI e dai nuclei positivi di biopsia(figura 1). Il piano di trattamento del paziente deve essere trasferito sul posto di lavoro e sul dispositivo di fusione durante la preparazione della sala di procedura sopra descritta. - Selezionare la zona di ablazione corrente.
8. Posizionamento del catetere laser e della sonda di temperatura
- Posizionare il catetere laser a 14 gauge nella camera centrale della guida multicanale.
NOTA: La guida multicanale è curva per fornire un leggero attrito impedendo così agli elementi di trattamento di scivolare all'indietro durante l'ablazione. Supera questo attrito ruotando avanti e indietro mentre avanzi il catetere laser nella prostata. - Far avanzare il catetere laser fino a visualizzare e allineare quattro bande ecogeniche con il marcatore di profondità sullo schermo. Per un'ablazione della zona periferica, i marcatori saranno diversi mm al di fuori della capsula prostatica (Figura 2).
NOTA: Nel caso di una capsula posteriore fibrosa, il catetere laser può deviare piuttosto che attraversare la capsula prostatica. Qualsiasi deflessione sarà visibile sull'ecografia durante l'inserimento. In caso di deflessione, rimuovere il catetere laser e inserire un leader, come la robusta sonda termica, per creare un'apertura pilota nella capsula. Il catetere laser può quindi essere avanzato come previsto. - Inserire la sonda termica a sinistra o a destra del catetere laser a seconda del piano di trattamento. Alla profondità corretta, la sonda termica si intreccia con la maniglia del catetere laser, consentendogli di allinearsi nell'orientamento corretto.
NOTA: Dopo il posizionamento, verificare che lo slot sulla sonda termica sia seduto nella maniglia del catetere laser. La sonda termica si bloccherà magneticamente in posizione e impedirà la rotazione durante il trattamento. - Collegare i tubi endoveno innescati dal sacchetto salino alla porta di afflusso prossimale sul catetere laser.
- Collegare la salina di ritorno dalla porta di deflusso distale a un sacchetto di drenaggio trasparente in modo che il fluido di ritorno possa essere visualizzato.
NOTA: La soluzione salina circolante attorno al catetere laser raffreddirà la fibra durante il trattamento
9. Eseguire l'elenco di controllo di sicurezza
- Durante la schermata di monitoraggio del trattamento, selezionare il sito di ablazione desiderato. Una volta selezionata l'ablazione appropriata, premere 'CONFERMA SELEZIONE'. Un elenco di controllo di sicurezza occuperà ora il lato sinistro del monitor della workstation.
NOTA: Questo passaggio inizierà a circolare attraverso il catetere laser. Piccole bolle introdotte quando si collegano i tubi per via endovenosa sono inizialmente visibili sugli ultrasuoni intorno al laser. Questo può fungere da controllo aggiuntivo per la posizione del catetere laser. - Segui l'elenco di controllo di sicurezza, spuntando le caselle una volta completate.
- Assicurarsi che tutte le persone nella stanza indossano occhiali di sicurezza laser, incluso il paziente.
- Il sistema informatico della workstation controllerà automaticamente la sonda termica per garantire che tutte le termocopiazioni leggono temperature corporee uniformi tra 30 e 40 °C.
- Verificare che le quattro bande ecogeniche dei cateteri laser si trovino nella capsula prostatica, poiché il posizionamento della sonda termica può allontanare la prostata dal catetere laser.
NOTA: La zona di ablazione inizia 5 mm distali ai marcatori ecogenici e si estende per altri 27 mm di lunghezza e 18 mm di diametro (massimo).
10. Esecuzione dell'ablazione dei tessuti laser
- Una volta completata la lista di controllo di sicurezza, premere 'START LASER' per iniziare l'ablazione.
- Monitora i progressi del trattamento in tempo reale utilizzando letture della temperatura, timer e mappa dei danni.
NOTA: Valutare la temperatura dei tessuti utilizzando il grafico multi-linea a sinistra del modello prostatico. La temperatura rettale è marcata in bianco e non deve superare i 42 °C. La temperatura sulla punta del catetere laser è contrassegnata in blu (Figura 3). Il laser si spegnerà automaticamente se la punta del laser supera i 75 °C o se la parete rettale supera i 42 °C.
NOTA: Una volta che il laser è attivo, monitorare il tempo di trattamento in ogni sito di ablazione utilizzando la barra rossa nella parte superiore dello schermo. Una mappa dei danni fornisce una rappresentazione 3D del tessuto trattato in base alla temperatura e al tempo.
NOTA: Nota le modifiche apportate agli ultrasuoni in modalità B. Il tessuto prostatico di solito non cambia aspetto durante l'ablazione laser. Con i trattamenti seriali il tessuto può assumere un aspetto ipoecoico, ma la visualizzazione statunitense serve principalmente per il posizionamento del laser.
NOTA: Monitor per quanto riguarda le caratteristiche ecografiche come segue:- Micro bolle vorticose che si formano oltre le bande catetero laser ecogeniche possono indicare una perdita nella soluzione salina circolante a causa del surriscaldamento. Sebbene ciò non abbia alcun impatto sulla sicurezza, i progressi del trattamento possono essere rallentati.
- Un aumento della natura iperecoica o uno "sbiancamento" del grasso rettale possono verificarsi se il catetere laser viene inavvertitamente tirato indietro, causando il riscaldamento del grasso perirettale.
- Se uno di questi risultati ecografico viene osservato, il trattamento laser deve essere interrotto.
- Il laser si arresta automaticamente una volta che il timer si esaurisca, ma un praticante può scegliere di terminare manualmente l'ablazione premendo "STOP THE LASER". La salina continuerà a fluire, raffreddando la punta del laser.
NOTA: Prendere in considerazione l'interruzione anticipata dell'ablazione se le temperature si altiano sopra i 55 °C per più di 60 secondi. - Mantenere il catetere laser e la sonda termica in posizione fino a quando la temperatura del catetere laser è scesa al di sotto dei 42 °C, impedendo così il riscaldamento della parete rettale durante il ritiro del catetere laser.
11. Ablations successive
- Posizionare l'ecografia nel sito di ablazione successivo utilizzando i bersagli digitali forniti dal dispositivo di fusione.
- Valutare se le immagini ecografiche dal vivo rimangono registrate nella risonanza testr e, se necessario, eseguire un compenso del movimento.
NOTA: Se si utilizza Artemis, la tecnica per la compensazione del movimento è descritta nel video a cui si fa riferimento in precedenza. 24 di cui 24 - Nella schermata di monitoraggio del trattamento, il sito di ablazione iniziale sarà ora disattivato; tuttavia può essere trattato di nuovo se ritenuto necessario.
- Selezionare il sito di ablazione successivo dal lato sinistro dello schermo e ripetere il processo descritto nei passaggi da 8 a 10.
12. Concludere la sessione di trattamento
- Una volta trattati tutti i siti di ablazione, apparirà un pulsante "FINISH TREATMENT". Premendo questo pulsante verrà visualizzata una schermata di revisione del trattamento che visualizza le metriche quantitative per la sessione di trattamento.
- Rimuovere la sonda TRUS dal retto del paziente. La pressione manuale può essere applicata alla parete rettale sovrascriva la prostata per facilitare l'emostasi.
Risultati
I risultati pubblicati della FLA sono riportati nella tabella 2. Sono inclusi diversi metodi e tecnologie. Più di 400 pazienti che hanno subito varie forme di FLA per il trattamento della PCa si trovano all'interno del database SEER. 25 Per quantificare il numero e le caratteristiche della FLA riportati in letteratura abbiamo effettuato una revisione sistematica di Medline e della Cochrane Library. La nostra ricerca è stata eseguita utilizzando termini di ricerca su tutto il campo tra cui "ablazione laser focale" e "cancro alla prostata". In totale sono stati esaminati 247 titoli e abstract. Sono stati inclusi solo i casi che segnalavano ablazione laser focale, risonanza prima e risultati oncologici. 13 pubblicazioni peer-reviewed qualificate per l'inclusione, che rappresentano 333 pazienti totali (tabella 1).
Il trattamento è stato eseguito con un laser a diodi a 980 nm in tutti gli studi tranne 2. 26,27 I parametri di trattamento consistevano in livelli di potenza tra 6 - 18 Watt e tempi di trattamento che si estendeva da 1 a 4 minuti per sito di ablazione (tabella 1). Il monitoraggio della temperatura di trattamento è stato fornito dalla termometria MRI in 9 studi e dalle misurazioni dirette delle sonde di temperatura in 3 studi (tabella 1). Tutti gli studi sono stati eseguiti all'interno del foro, ad eccezione di quelli di Lindner e del successivo studio di Natarajan. 20,26,27 anni
Il PSA mediano di base per la coorte era di 5,7 (intervallo 1,1 - 14,8). Dopo fla, psa mediana a 3, 6, 12 e 24 mesi era rispettivamente 3,9, 5,5, 3,8 e 3,9. L'IPSS di base mediana per la coorte era 6. A seguito della FLA, l'IPSS mediana a 3, 6, 12 e 24 mesi era rispettivamente di 5, 5,5, 7,3 e 11,5. Lo SHIM mediano di base per la coorte era di 20. A seguito della FLA, lo SHIM mediano a 3, 6, 12 e 24 mesi era rispettivamente di 19, 18, 20 e 19 mesi.
In tutti gli studi, le complicazioni sono state riportate in modo incoerente; tuttavia c'era solo una complicazione classificata dagli autori come grado III (un'infezione del tratto urinario). 16 Gli autori non hanno specificato le caratteristiche che lo classificavano come evento di III grado. Due fistole retto-uretrali, entrambe che si chiudono spontaneamente dopo una cateterizzazione prolungata,16 sono state segnalate come eventi avversi di II grado.
Il follow-up oncologico è stato raggruppato per periodo di follow-up: meno di 6 mesi, un anno e due anni (tabella 2). La biopsia di follow-up è stata eseguita dalla biopsia guidata da MRI in-bore in 4 studi e dalla biopsia da fusione MRI-US in 6 studi. Due studi hanno utilizzato la biopsia sistematica e due studi hanno condotto indagini "treat-and-resect" in cui è stato valutato il campione di prostatectomia. Il successo del trattamento è stato definito secondo un protocollo di consenso Delphi. 28 Il successo sul campo è stato definito come l'assenza di ≥ GG2 PCa all'interno del sito di ablazione precedente. Il fallimento fuori dal campo è stato definito come ≥ GG2 al di fuori dell'area di ablazione precedente. Tra i pazienti con risultati di biopsia di follow-up, il successo complessivo sul campo dopo il trattamento a 6 mesi (N=83), 1 anno (N=64) e 2 anni (N=39) è stato rispettivamente dell'83%, 83% e 59% (tabella 2).
Alla UCLA, l'FLA della prostata è stata eseguita in tre successivi studi clinici a partire dal 2014. 29-31 18 uomini con tumore alla prostata a rischio intermedio hanno subito FLA, otto in-bore e 10 in clinica, senza eventi avversi di iii grado. Attualmente, altri 10 uomini sono sottoposti a FLA utilizzando il dispositivo dimostrato. 31 Tutti i pazienti sono stati valutati prima della FLA con una risonanza magnetica 3T (bobina corporea) e biopsia di fusione MRI-US con campionamento dal ROI e biopsia sistematica entro 6 mesi dal trattamento. Sia le biopsie di base che le biopsie di follow-up sono state eseguite sotto la guida alla fusione MRI/US utilizzando il sistema di fusione Artemis con il monitoraggio di tutti i siti di biopsia.
La tabella 1. Studi riportati di ablazione laser focale.
| Numero di riferimento | autore | anno | N | Età mediana (range) | Potenza laser | Tempo Rx (sec) | Margine pianificato | Procedura in-bore | Monitoraggio della temperatura | Gleason di base | ||||
| 3+3 | 3+4 | 4+3 | 4+4 | |||||||||||
| 26 | Lindner | 2009 | 12 | 56.5 (51-52) | - | 120 | - | No | Sonda di temperatura | 12 | 0 | 0 | 0 | |
| 27 | Lindner | 2010 | 4 | 66 (61-73) | - | 120 | - | No | Sonda di temperatura | 2 | 0 | 1 | 1 | |
| 5 | oto | 2013 | 9 | 61 (52-77) | 6 - 15 W | - | - | sì | Termometria MRI | 8 | 1 | 0 | 0 | |
| 12 | sottovento | 2014 | 23 | - | 8 W | 30-60 | - | sì | Termometria MRI | - | - | - | - | |
| 6 | Lepor | 2015 | 25 | 66 (49-84) | - | - | - | sì | Termometria MRI | 11 | 13 | 1 | 0 | |
| 18 | Al-Barqawi | 2015 | 7 | 61 (56-69) | - | 90 | - | sì | Termometria MRI | 7 | 0 | 0 | 0 | |
| 15 | Bomers | 2016 | 5 | 66 (58-70) | - | - | 9 mm | sì | Termometria MRI | 2 | 2 | 1 | 0 | |
| 14 | Eggener | 2016 | 27 | 62 (-) | 6 - 15 W | 60-120 | 0 -7,5 mm | sì | Termometria MRI | 23 | 3 | 1 | 0 | |
| 19 | Natarajan | 2016 | 8 | 63 (54-72) | 11 - 14 W | 180 | Personalizzato* | sì | Sonda di temperatura # | 1 | 7 | 0 | 0 | |
| 20 | Natarajan | 2017 | 10 | 65 (52-74) | 13,75 W | 180 | Personalizzato* | No | Sonda di temperatura | 2 | 8 | 0 | 0 | |
| 35 | Chao | 2018 | 34 | 69 (52-88) | - | - | - | sì | Termometria MRI | 16 | 16 | 2 | 0 | |
| 17 | Al-Hakeem | 2019 | 49 | 63 (51-73) | 10 - 15 W | 120 | 9 mm | sì | Termometria MRI | 13 | 29 | 7 | 0 | |
| 16 | Walser | 2019 | 120 | 60 (45-86) | 17 - 18 W | 180-240 | 5 mm | sì | Termometria MRI | 37 | 56 | 27 | 0 | |
Tabella 1: Dash (-) indica le informazioni non disponibili all'interno del manoscritto pubblicato. * indica che ogni margine è stato pianificato individualmente. # indica che il monitoraggio è stato eseguito sia con una sonda di temperatura che con una termometria MRI.
La tabella 2. Risultati dell'ablazione laser focale.
| Numero di riferimento | Primo autore | Metodo di biopsia follow-up | Follow-up Biopsia | ≤ 6 mesi | 12 mesi | 24 mesi | Eventi avversi | ||||||
| successo | fallimento | successo | fallimento | successo | fallimento | io | Ii | Iii | |||||
| 26 | Lindner | Risonanza prima del titolo Bx | 12 | 12 | 0 | - | - | - | - | 2 | 0 | 0 | |
| 27 | Lindner | prostatectomia | 4 | 2 | 2 | - | - | - | - | - | - | - | |
| 5 | oto | Risonanza TA/US Bx | 9 | 9 | 0 | - | - | - | - | 1 | 1 | 0 | |
| 12 | sottovento | Risonanza TA/US Bx | 13 | - | - | 12 | 1 | - | - | - | - | - | |
| 6 | Lepor | Risonanza prima del titolo Bx | 21 | 20 | 1 | - | - | - | - | 0 | 0 | 0 | |
| 18 | Al-Barqawi | Bx sistematico | 5 | - | - | 5 | 0 0 dicui 0 | - | - | - | 1 | 0 | |
| 15 | Bomers | prostatectomia | 5 | 1 | 4 | - | - | - | - | - | - | - | |
| 14 | Eggener | Risonanza prima del titolo Bx # | 27 | 27 | - | 7 | 3 1 dicui all'articolo 3, paragrafo | - | - | 7 | 2 | 0 | |
| 19 | Natarajan | Risonanza TA/US Bx | 8 | 6 | 5 3 dicui all'articolo 3 del consiglio di | - | - | - | - | 23 | 7 | 0 | |
| 20 | Natarajan | Risonanza TA/US Bx | 10 | 6 | 40 la commissione per la | - | - | - | - | 38 | 6 | 0 | |
| 35 | Chao | Risonanza TA/US Bx | 22 | - | - | - | - | 13 | 9 | - | - | - | |
| 17 | Al-Hakeem | Risonanza TA/US Bx | 49 | - | - | 40 | 9 1 dicui all'articolo 1 | - | - | 34 | 11 | 0 | |
| 16 | Walser | Risonanza prima del titolo Bx | 44* | - | - | - | - | 26 | 18 | 8 | 8 | 1 | |
Note a piè di pagina Tabella 2. Successo = assenza di ≥ GG2 all'interno della zona di ablazione. Fallimento = presenza ≥ cancro alla prostata GG2: totale e fuori campo (numero pedice). # indica che la biopsia guidata da 12 mesi è stata utilizzata per la biopsia di 6 mesi, ma solo la biopsia sistematica è stata utilizzata per la biopsia di 12 mesi. * indica che solo i pazienti con una riduzione psa del < 50% e la risonanza prima della valutazione post-ablazione positiva sono stati sottoposti a biopsia; 76 pazienti non sono stati sottoposti a biopsia.
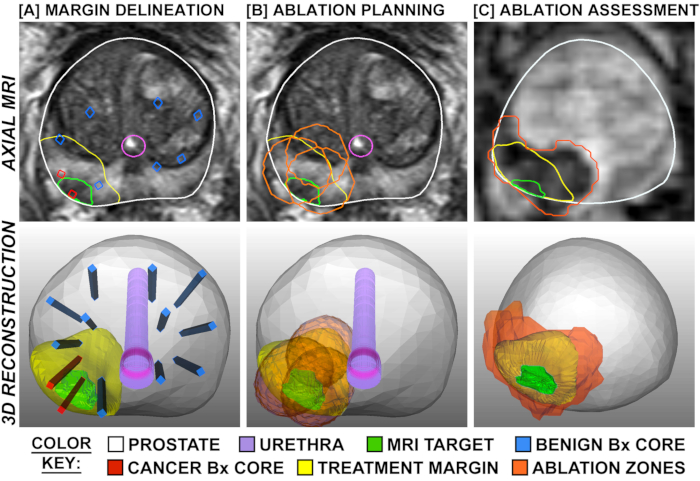
Figura 1: Pianificazione e valutazione del trattamento, mostrata tramite sovrapposizioni su risonanza prima trasversale (riga superiore) e in 3D (riga inferiore). La colonna A mostra la delimitazione dei margini di trattamento, che vengono espansi attorno al bersaglio di risonanza prima positiva al cancro e delimitati da nuclei di biopsia sistematica negativi nelle vicinanze (blu). La colonna B mostra la pianificazione delle posizioni di ablazione in modo che i margini di trattamento siano sovrapposti per evitare aree di "salto". La colonna C mostra l'imaging ponderato per la perfusione raccolto 2 ore dopo il trattamento, dimostrando la corrispondenza tra l'estensione di ablazione pianificata e osservata. Clicca qui per visualizzare una versione più grande di questa figura.
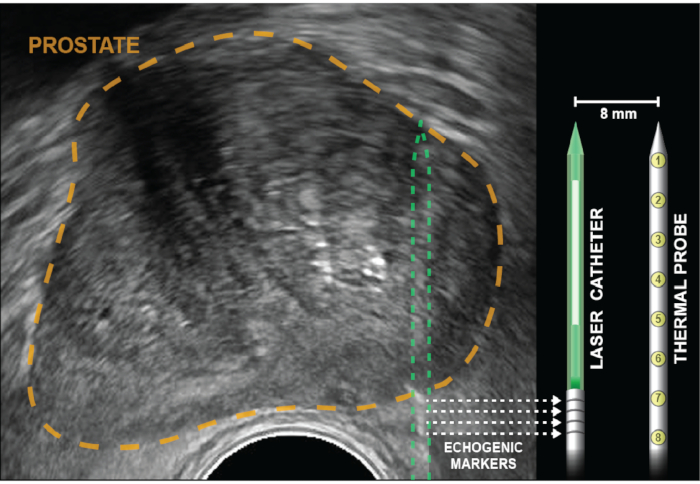
Figura 2: Ecografia assiale con prostata delineata in oro. I riflettori a cubo d'angolo (bande ecogeniche), indicati da frecce punteggiate, vengono incisi nel catetere laser a 5 mm dal diffusore (bianco). La sonda di temperatura viene inserita alla stessa profondità della fibra laser, quindi bloccata in posizione e rimane parallela al laser distante 8 mm, fuori dal piano visivo degli Stati Uniti. Otto sensori termici, che si trovano all'interno della sonda distanti 4 mm, forniscono registrazioni di temperatura in punti dalla base delle bande ecogeniche alla punta del catetere laser. Le misurazioni della temperatura più vicine alla parete rettale sono fornite da misurazioni termiche alla base della sonda di temperatura (posizioni 6-8). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Registrazioni di temperatura durante l'ablazione laser focale per due ablazioni successive. Asse Y = temperatura in Celsius. Asse X = tempo in minuti. Barre ombreggiate verticali = periodi di attivazione laser. Linea blu = temperatura 8mm dalla punta della fibra laser (termocopia distale). Linea bianca = temperatura 8 mm dal termoaccoppio prossimale più vicino alla parete rettale. Una temperatura di 60 gradi Celsius, raggiunta anche brevemente, assicura necrosi coagulazione. Clicca qui per visualizzare una versione più grande di questa figura.
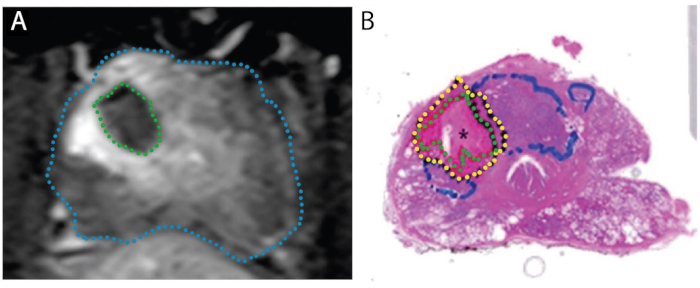
Figura 4: Immagini che dimostrano la concordanza della zona di ablazione sulla risonanza prima del trattamento (A) con zona necrotica effettiva su campione a montaggio intero (B). Il paziente è un maschio di 67 anni con PCa nella zona di transizione destra, Gleason punteggio 3 + 4 = 7, partecipando a uno studio "trattamento e resect". A. Immagine migliorata a contrasto assiale T1 post-ablazione, che mostra un difetto di perfusione causato dal trattamento laser (verde). B. Macchia H&E a montaggio intero della prostata. Il tessuto necrotico è delineato in verde, il tessuto peri-necrotico in giallo e il tumore intatto (non trattato) in blu. Riprodotto sotto licenza Creative Commons da Bomers et al, World Journal of Urology. 15 Clicca qui per vedere una versione più grande di questa figura.
Discussione
Lo scopo del presente lavoro è quello di descrivere e illustrare un metodo per eseguire l'ablazione laser focale (FLA) del cancro alla prostata (PCa). Il metodo differisce dagli altri metodi di terapia focale, in quanto è destinato ad essere eseguito in anestesia locale in un ambiente clinico. Il metodo FLA qui mostrato è stato introdotto nel 2017,20 ed è stato continuamente perfezionato da quel momento. Pertanto, la procedura descritta in questo documento può essere di valore per i futuri ricercatori.
Il trattamento laser del tessuto prostatico sembra datare alla ricerca di McNicholas e colleghi, che lavorano all'University College di Londra, che hanno dimostrato nel 1993 che la necrosi della coagulazione focale potrebbe essere prodotta nelle prostate canine con un dispositivo Nd:YAG. 32 Prefigurando il futuro, questi autori postularono che la tecnica "... può rivelarsi di valore... per la distruzione di piccoli tumori prostatica focali. Successivamente, l'ablazione laser di PCa nell'uomo è stata descritta nel 2009 da Lindner et al dell'Università di Toronto. 26 In questo sforzo pionieristico, Lindner ha combinato la modalità emergente della risonanza prostatica con il primo software di fusione delle immagini e sonde termiche convenzionali per colpire con successo il cancro e monitorare l'ablazione laser in 12 uomini.
Poiché la PCa più importante può essere visualizzato con la risonanza prima mondiale multi-parametrica contemporanea, il targeting interno al foro e il trattamento delle lesioni visibili potrebbero essere una semplice estensione della procedura diagnostica. Il targeting interno alla lesione è diretto e la termometria MR consente il monitoraggio remoto dell'ablazione. Raz et al ha riportato due di questi trattamenti nel 2010. 33 Una serie di trattamenti FLA in-bore (N=9) è stata segnalata da Oto e colleghi nel 2013. 5 L'adozione della FLA in-bore è stata facilitata dall'hardware sviluppato a tal fine, come riportato da Natarajan et al nel 2016. 19 Un certo numero di radiologi, utilizzando una fibra laser raffreddata ad acqua per prevenire la carbonaro, hanno adottato il metodo di in-bore; e centinaia di trattamenti FLA in-bore sono stati segnalati ora (Walser, Feller, Sperling / Lepor). 6,16,34,35
Mentre i risultati oncologici a breve termine della FLA inacita possono essere favorevoli (tabella 1), è probabile che la procedura venga ampiamente adottata, a causa dei fattori limitanti descritti nell'introduzione. Inoltre, la termometria MR per il monitoraggio del trattamento presenta una serie di importanti limitazioni. 19 Sulla base di un'esperienza decennale con le procedure di biopsia da fusione MRI/US (N~4000), abbiamo teorizzato che una fibra laser potesse essere presa di mira in una lesione tumorali, in modo simile all'inserimento di un ago di biopsia, e che il monitoraggio del trattamento potesse essere effettuato direttamente con sonde termiche. Così, a seguito dell'esperienza in-bore, dieci pazienti sono stati sottoposti a FLA fuori dal foro nella clinica di urologia UCLA, utilizzando solo anestesia locale, guida alla fusione MRI / US e monitoraggio delle sonde termiche. 20 Non solo è stata dimostrata la sicurezza e la fattibilità del nuovo metodo, ma tra questi ultimi pazienti trattati non è stata riscontrata alcuna prova di PCa nella successiva biopsia.
L'effetto tissutale della FLA è stato chiarito in due studi, in cui la prostatectomia radicale pianificata è stata eseguita 1-3 settimane dopo la procedura laser (N=9), vale a dire un modello "trattamento e resect" (Figura 4). 15,27 In tutti e 9 i pazienti, il volume del tessuto necrotico trovato nella prostata si è approssimato al volume stimato dalla risonanza prima della risonanza prima del completamento del trattamento. Quando l'intera prostata è stata seslata, si è osservata una brusca transizione tra necrosi e cellule intatte 1-5 mm al di fuori dell'area di ablazione laser (Figura 1). I margini nitidi e la precisione delle zone di ablazione hanno importanti implicazioni per l'accuratezza della registrazione e della pianificazione del trattamento mri/US.
Una parte importante del sistema Avenda è il software di pianificazione del trattamento. Per un FLA efficace, la pianificazione deve includere non solo la posizione della lesione, ma anche il volume di tessuto necessario per la completa distruzione del tumore. Il volume di ablazione non può essere semplicemente il volume della lesione MRI, perché il volume tumorale effettivo supera quello della lesione visibile alla risonanza prima di una media di 3 volte. 21 Inoltre, il cancro si estende spesso in proiezioni irregolari simili a dita, il che renderebbe inaffidabile qualsiasi margine di sicurezza uniforme basato esclusivamente sull'imaging (ad esempio, 1 cm oltre il limite della lesione visibile alla risonanza magnetica). Il sistema Avenda include un software di pianificazione del trattamento che utilizza non solo la lesione visibile alla risonanza prima e risposta, ma anche il monitoraggio 3D dei siti di biopsia (positivi e negativi) per fornire un posizionamento accurato del volume minimo di ablazione che comprenderà pienamente il cancro. Un esempio di tale pianificazione del trattamento è visto nella figura 3.
In conclusione, l'FLA è un metodo sicuro e fattibile per sradicare il cancro alla prostata in una clinica in anestesia locale. I passaggi della procedura sono mostrati nel video di accompagnamento. Il posizionamento accurato della fibra laser in una lesione visibile alla risonanza prima è effettuato utilizzando la fusione MRI / US, così come gli aghi di biopsia sono posizionare in tali lesioni. Il monitoraggio del trattamento in tempo reale avviene tramite una sonda termica adiacente alla fibra laser. Il software di pianificazione del trattamento, che utilizza volumi di lesione dalla risonanza prima e dalle sedi dei siti di biopsia tracciati per aiutare l'operatore a determinare i margini di trattamento, è una parte importante del sistema. La FLA in clinica come descritto e illustrato in questo articolo sembra fornire un'opzione di terapia focale attraente non disponibile in precedenza.
Divulgazioni
Il Dr. Marks e il Dr. Natarajan sono co-fondatori di Avenda Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Fusion Guidance System | NA | Artemis Displayed in Video | |
| Laser Catheter | Avenda Health | ||
| Orion Workstation | Avenda Health | ||
| Thermal Probe | Avenda Health | ||
| Transrectal Probe | NA | Not Platform Dependent | |
| Ultrasound | NA | Not Platform Dependent |
Riferimenti
- Cooperberg, M. R., Carroll, P. R. Trends in management for patients with localized prostate cancer, 1990-2013. JAMA - Journal of the American Medical Association. 314 (1), 80-82 (2015).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Connor, M. J., Gorin, M. A., Ahmed, H. U., Nigam, R. Focal therapy for localized prostate cancer in the era of routine multi-parametric MRI. Prostate Cancer and Prostatic Diseases. , 1-12 (2020).
- Ahmed, H. U., et al. Focal Therapy for Localized Prostate Cancer: A Phase I/II Trial. The Journal of Urology. 185, 1246-1255 (2011).
- Oto, A., et al. MR imaging-guided focal laser ablation for prostate cancer: Phase I trial. Radiology. 267 (3), 932-940 (2013).
- Lepor, H., Llukani, E., Sperling, D., Fütterer, J. J. Complications, Recovery, and Early Functional Outcomes and Oncologic Control Following In-bore Focal Laser Ablation of Prostate Cancer. European Urology. 68 (6), 924-926 (2015).
- Johnson, D. C., et al. Detection of Individual Prostate Cancer Foci via Multiparametric Magnetic Resonance Imaging. European Urology. 75 (5), 712-720 (2019).
- Johnson, D. C., et al. Do contemporary imaging and biopsy techniques reliably identify unilateral prostate cancer? Implications for hemiablation patient selection. Cancer. 125 (17), 2955-2964 (2019).
- Liu, W., et al. Copy number analysis indicates monoclonal origin of lethal metastatic prostate cancer. Nature Medicine. 15 (5), 559-565 (2009).
- Ahmed, H. U. The Index Lesion and the Origin of Prostate Cancer. New England Journal of Medicine. 361 (17), 1704-1706 (2009).
- Stafford, R. J., et al. Magnetic resonance guided, focal laser induced interstitial thermal therapy in a canine prostate model. Journal of Urology. 184 (4), 1514-1520 (2010).
- Lee, T., Mendhiratta, N., Sperling, D., Lepor, H. Focal laser ablation for localized prostate cancer: principles, clinical trials, and our initial experience. Reviews in urology. 16 (2), 55-66 (2014).
- Johnson, D. E., Cromeens, D. M., Price, R. E. Interstitial laser prostatectomy. Lasers in Surgery and Medicine. 14 (4), 299-305 (1994).
- Eggener, S. E., Yousuf, A., Watson, S., Wang, S., Oto, A. Phase II Evaluation of Magnetic Resonance Imaging Guided Focal Laser Ablation of Prostate Cancer. Journal of Urology. 196 (6), 1670-1675 (2016).
- Bomers, J. G. R. R., et al. MRI-guided focal laser ablation for prostate cancer followed by radical prostatectomy: correlation of treatment effects with imaging. World Journal of Urology. 35 (5), 703-711 (2017).
- Walser, E., et al. Focal Laser Ablation of Prostate Cancer: Results in 120 Patients with Low- to Intermediate-Risk Disease. Journal of Vascular and Interventional Radiology. 30 (3), 401-409 (2019).
- Al-Hakeem, Y., Raz, O., Gacs, Z., Maclean, F., Varol, C. Magnetic resonance image-guided focal laser ablation in clinically localized prostate cancer: safety and efficacy. ANZ Journal of Surgery. 89 (12), 1610-1614 (2019).
- Barqawi, A., Krughoff, K., Li, H., Patel, N. U. Initial Experience of Targeted Focal Interstitial Laser Ablation of Prostate Cancer with MRI Guidance. Current Urology. 8 (4), 199-207 (2014).
- Natarajan, S., et al. Focal Laser Ablation of Prostate Cancer: Phase I Clinical Trial. Journal of Urology. 196 (1), 68-75 (2016).
- Natarajan, S., et al. Focal Laser Ablation of Prostate Cancer: Feasibility of Magnetic Resonance Imaging-Ultrasound Fusion for Guidance. Journal of Urology. 198 (4), 839-847 (2017).
- Priester, A., et al. Magnetic Resonance Imaging Underestimation of Prostate Cancer Geometry: Use of Patient Specific Molds to Correlate Images with Whole Mount Pathology. Journal of Urology. 197 (2), 320-326 (2017).
- Lightner, D. J., Wymer, K., Sanchez, J., Kavoussi, L. Best Practice Statement on Urologic Procedures and Antimicrobial Prophylaxis. Journal of Urology. 203 (2), 351-356 (2020).
- Jones, T. A., Radtke, J. P., Hadaschik, B., Marks, L. S. Optimizing safety and accuracy of prostate biopsy. Current Opinion in Urology. 26 (5), 472-480 (2016).
- Jayadevan, R., Zhou, S., Priester, A. M., Delfin, M., Marks, L. S. Use of MRI-ultrasound fusion to achieve targeted prostate biopsy. Journal of Visualized Experiments. (146), e59231 (2019).
- Zheng, X., et al. Focal Laser Ablation Versus Radical Prostatectomy for Localized Prostate Cancer: Survival Outcomes From a Matched Cohort. Clinical Genitourinary Cancer. 17 (6), 464-469 (2019).
- Lindner, U., et al. Image Guided Photothermal Focal Therapy for Localized Prostate Cancer: Phase I Trial. Journal of Urology. 182, 1371-1377 (2009).
- Lindner, U., et al. Focal Laser Ablation for Prostate Cancer Followed by Radical Prostatectomy: Validation of Focal Therapy and Imaging Accuracy. European Urology. 57 (6), 1111-1114 (2010).
- van Luijtelaar, A., et al. Focal laser ablation as clinical treatment of prostate cancer: report from a Delphi consensus project. World Journal of Urology. 37, 2147-2153 (2019).
- . Use of Laser Interstitial Thermal Therapy in the Focal Treatment of Localized Prostate Cancer - NCT02224911 Available from: https://clinicaltrials.gov/ct2/show/NCT02224911 (2020)
- . Focal Laser Ablation of Prostate Tissue - NCT02357121 Available from: https://clinicaltrials.gov/ct2/show/NCT02357121 (2020)
- . Focal Laser Ablation of Prostate Cancer -NCT04305925 Available from: https://clinicaltrials.gov/ct2/show/NCT04305925 (2020)
- McNICHOLAS, T. A., STEGER, A. C., BOWN, S. G. Interstitial Laser Coagulation of the Prostate An Experimental Study. British Journal of Urology. 71 (4), 439-444 (1993).
- Raz, O., et al. Real-Time Magnetic Resonance Imaging-Guided Focal Laser Therapy in Patients with Low-Risk Prostate Cancer. European Urology. 58 (1), 173-177 (2010).
- . Transrectally delivered, outpatient MRI-guided laser focal therapy of prostate cancer: 9.5 year interim results of NCT #02243033, Presentation at the AdMeTech 4th Global Summit on Precision Diagnosis and Treatment of Prostate Cancer Available from: https://www.admetech.org/wp-content/uploads/2019/08/DMI-FOCAL-Tx-2019-NCT-02243033.FINAL_.pdf (2020)
- Chao, B., Llukani, E., Lepor, H. Two-year Outcomes Following Focal Laser Ablation of Localized Prostate Cancer. European Urology Oncology. 1 (2), 129-133 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon