Method Article
Ablação focal a laser do câncer de próstata: um procedimento de escritório
Neste Artigo
Resumo
Este artigo apresenta e descreve um tratamento ambulatorial para câncer de próstata usando ablação a laser focal. A colocação do cateter a laser é guiada por imagens de fusão de ressonância magnética-ultrassom de forma semelhante à biópsia da agulha da próstata. O tratamento é monitorado em tempo real com uma sonda térmica, colocada adjacente à fibra laser.
Resumo
Neste artigo, descrevemos e ilustramos um procedimento ambulatorial para ablação a laser focal (FLA) do câncer de próstata (PCa). O procedimento é conceitualmente semelhante a uma biópsia de fusão e é realizado sob anestesia local em ambiente clínico; o tempo de tratamento geralmente é inferior a uma hora. A inserção a laser é guiada por ultrassom; o alvo da lesão é através da fusão ressonância magnética de imagem-ultrassom (MRI/EUA), como na biópsia da próstata direcionada. O monitoramento da ablação em tempo real é realizado utilizando uma sonda térmica adjacente à fibra laser. O vídeo demonstra planejamento do procedimento, preparação do paciente, várias etapas durante o procedimento e monitoramento do tratamento. A segurança, a viabilidade e a eficácia dessa abordagem foram estabelecidas durante um julgamento anterior. Fla ambulatorial sob anestesia local é uma opção para o manejo de câncer de próstata de risco intermediário.
Introdução
O câncer de próstata (PCa) é a malignidade interna mais comum em homens americanos1. Cerca de 190.000 novos casos e 33.000 mortes são esperados durante 2020, tornando-se a segunda causa mais comum de morte por câncer em homens2. A maioria dos casos de PCa são curáveis se tratados enquanto localizados na próstata. No entanto, identificar o câncer dentro da próstata muitas vezes não é possível com a imagem convencional de ultrassom (EUA); assim, o tratamento tem tradicionalmente envolvido cirurgia ou radiação de toda a glândula. O paradigma "toda a glândula" foi alterado com a introdução de ressonância magnética (RM), que, ao contrário dos EUA, permite a localização de PCa e biópsia direcionada3,4,5,6. Enquanto a ressonância magnética provavelmente subestima a multifocalidade da PCa7, e pode perder pequenas lesões8, pode identificar de forma confiável a lesão do índice, que é quase sempre o condutor da doença metastática9,10.
A identificação confiável da ressonância magnética das lesões do índice forneceu um caminho para o tratamento focal da PCa (ou seja, ablação parcial da glândula (PGA)). O objetivo da PGA é destruir a lesão do índice, preservando o órgão e, assim, minimizando os efeitos colaterais. A ablação a laser focal (FLA), que emprega energia leve para destruir tecido através da necrose coagulativa11,12,é uma forma de PGA. A eficácia da energia laser para ablatar o tecido da próstata foi estabelecida em 199313,sugerindo a colocação de fibras laser em cânceres de próstata para esse fim. Utilizando ressonância magnética para orientação de colocação de fibras e termografia de ressonância magnética para monitoramento do tratamento (ou seja, tratamento in-bore), as taxas de sucesso de ar de curto prazo de FLA parecem aproximar-se das da cirurgia ou radiação5,6,12,14,15,16,17,18,19. No entanto, os procedimentos a laser realizados dentro do furo, ou dentro de um tubo de ressonância magnética, são muitas vezes complicados, caros, demorados e intensivos em recursos. E os procedimentos in-bore são realizados apenas por radiologistas treinados por subespesas.
Como alternativa ao FLA in-bore, a viabilidade de realizar FLA em um ambiente clínico---utilizando a fusão mri/EUA para orientação e uma sonda de temperatura intersticiais para monitoramento de tratamento--- está em estudo na UCLA desde 201419,20. O procedimento FLA em um ambiente clínico provou ser semelhante ao da biópsia direcionada, substituindo uma fibra laser por uma agulha de biópsia. Em comparação com hifu e crioterapia, que são os outros métodos atualmente disponíveis de PGA, o método laser descrito aqui é rápido e barato, sem necessidade de uma sala de cirurgia ou anestesia geral.
Este artigo tem como objetivo descrever e demonstrar FLA ambulatorial sob anestesia local em uma clínica de urologia. Os urologistas familiarizados com a fusão de ressonância magnética/EUA para biópsia direcionada apreciarão as semelhanças do FLA com o procedimento de biópsia. Os objetivos secundários incluem descrever elementos técnicos que facilitam a facilidade de uso e descrever benefícios da terapia focal.
Protocolo
NOTA: Os métodos descritos aqui são os utilizados na UCLA para a realização de FLA da próstata. O projeto de pesquisa, incluindo o protocolo, foi aprovado pelo Conselho de Revisão Institucional da UCLA (IRB). Todos os pacientes fizeram biópsia direcionada da próstata, na qual a ressonância magnética foi interpretada por um uro-radiologista experiente. As lesões visíveis na Ressonância Magnética foram biópsias dentro da região de interesse (ROI) e fora do ROI utilizando um modelo sistemático. As biópsias positivas e a região de ressonância magnética de interesse são utilizadas para planejar o tratamento com ablação a laser, a fim de tratar a lesão do índice e criar uma margem de tecido tratado ao redor do tumor, uma vez que a ressonância magnética subestima o tamanho do tumor. 21 Apenas pacientes com câncer de próstata de risco intermediário (GG2-3 PSA < 20, Estágio < T2), um ROI de índice único e nenhum câncer de próstata clinicamente significativo contralateral são considerados elegíveis para o tratamento. Pacientes com diásces hemorrágulas ou incapacidade de tolerar tratamento sem sedação são considerados inelegíveis.
1. Planejamento do tratamento
- Antes do tratamento, planeje metas de ablações usando entrada das coordenadas de ressonância magnética e biópsia.
- Realize o planejamento do tratamento com o software fornecido.
2. Preparação da Sala Processual
- Exibir um sinal de aviso a laser fora da sala de procedimento.
- Posicione a estação de trabalho para um acesso confortável.
- Energia na estação de trabalho, dispositivo de fusão e ultrassom transretal.
- Digite a credencial de login e selecione o paciente desejado na lista de trabalho padrão contendo planos nãoexecutados.
NOTA: Novos planos de tratamento podem ser adicionados através de uma conexão USB ou internet conforme detalhado no manual do usuário. - Pendure um saco de soro fisiológico do gancho designado na estação de trabalho; um saco de devolução de soro fisiológico também é anexado.
- Prime a tubulação salina permitindo o fluxo gravitacional de fluido antes de travar o tubo. A solução salina é então conectada à bomba peristáltica e pendurada para uso posterior durante o procedimento.
3. Preparação da sonda TRUS
- Aplique geleia de ultrassom diretamente em uma sonda TRUS limpa.
NOTA: Na UCLA, todas as sondas TRUS são desinfetadas através de um sistema automatizado com solução vaporizada de peróxido de hidrogênio. - Coloque um preservativo sobre a geleia de ultrassom na sonda TRUS e fixe-a na base usando um elástico.
NOTA: Por prática padrão tente remover bolhas de ar presas sob o preservativo. - Coloque um guia multicanal sobre o preservativo e bloqueie-o no lugar usando o grampo de metal. Um segundo preservativo com geleia de ultrassom interno pode ser colocado sobre o guia multicanal para aumentar o conforto do paciente.
4. Preparação do paciente
- Direcione o paciente para limpar o cofre retal com enema na manhã da biópsia.
- Certifique-se de que o paciente tenha obtido antibióticos profiláticos 60 minutos antes do procedimento22.
NOTA: Na UCLA, 1 g de Ertapenem é administrado intramuscularmente 60 minutos antes do procedimento. Esta decisão foi tomada com base no antibiograma da UCLA e impediu episódios sépticos pós-biópsia nas últimas 1500 biópsias transretais. 23 Dado esse sucesso, optou-se por usá-lo também para ablação a laser transretal. - Forneça aos pacientes acetaminofeno 1000 mg PO, Ketorolac 30 mg IM, e opcionalmente, mas recomendado Diazepam 10 mg PO, 60 minutos antes do procedimento.
NOTA: Os pacientes podem experimentar um desejo moderado de anular ou pressionar o pênis durante o procedimento. Em nossa experiência, nenhum narcótico é benéfico. - Os pacientes podem achar útil trazer música pessoal e fones de ouvido como um ansiolítico adicional.
- Coloque o paciente na posição de decúbito lateral esquerdo quanto à biópsia transretal.
- Regissão dos sinais vitais do paciente antes do início do procedimento e em intervalos de 30 minutos.
5. Administração de bloqueio nervoso prostático
- Insira a sonda TRUS lubrificada até que o centro da próstata esteja claramente visível.
- Otimize o ganho de ultrassom, compensação de ganho de tempo (controles deslizantes TGC à direita da maioria dos ultrassons), profundidade e foco para que a próstata esteja centrada dentro do monitor de visualização do ultrassom.
NOTA: O ganho ideal resulta em uma imagem cinza-média dentro da zona periférica. Os controles deslizantes TGC são melhor definidos em um ângulo gradualmente inclinado para compensar a atenuação de ondas de tecidos distantes. A profundidade e o foco do ultrassom dependerão do tamanho da próstata. O foco deve ser definido na zona periférica para otimizar a visualização de marcadores acústicos no cateter laser. - Ative o guia de biópsia na tela e coloque uma agulha espinhal de calibre 22 através do centro do guia multicanal para anestesiar a próstata.
NOTA: Na UCLA anestesiamos a próstata no plano sagital colocando 10-20 mL de Lidocaína/Marcaine na junção da próstata e vesículas seminal. A infiltração correta causará a separação das vesículas seminais e da próstata da parede retal.
6. Fusão MRI-EUA
- Posicione o sistema de fusão de imagens e a estação de trabalho perto o suficiente do paciente, a fim de visualizar as telas da estação de trabalho, observando também o paciente.
- Se estiver usando o Artemis, use uma técnica para acoplamento e registro de imagem previamente descrita. 24
7. Aquisição de alvos
- Navegue pelo ultrassom até o centro do primeiro local de ablação usando alvos digitais fornecidos pelo dispositivo de fusão. Este processo é semelhante ao guia do ultrassom para uma região de ressonância magnética de interesse durante a biópsia de fusão.
NOTA: Cada local de ablação é determinado a partir da região de ressonância magnética de interesse e núcleos de biópsia positivos(Figura 1). O plano de tratamento do paciente deve ser transferido para a estação de trabalho e dispositivo de fusão durante a preparação da sala de procedimento descrita acima. - Selecione a zona de ablação atual.
8. Colocação de cateter a laser e sonda de temperatura
- Coloque o cateter laser de calibre 14 na câmara central do guia multicanal.
NOTA: O guia multicanal é curvado para proporcionar um leve atrito, evitando que os elementos do tratamento deslizem para trás durante a ablação. Supere esse atrito girando para frente e para trás enquanto avança o cateter laser para dentro da próstata. - Avance o cateter laser até que quatro bandas ecogênicas sejam visualizadas e alinhadas com o marcador de profundidade na tela. Para uma ablação de zona periférica, os marcadores serão vários mm fora da cápsula da próstata(Figura 2).
NOTA: No caso de uma cápsula posterior fibrosa, o cateter laser pode desviar em vez de atravessar a cápsula da próstata. Qualquer deflexão será visível no ultrassom durante a inserção. Caso ocorra deflexão, remova o cateter laser e insira um líder, como a sonda térmica resistente, para criar uma abertura piloto na cápsula. O cateter laser pode então ser avançado como planejado. - Insira a sonda térmica à esquerda ou à direita do cateter laser, dependendo do plano de tratamento. Na profundidade correta, a sonda térmica se entrelaça com a alça do cateter laser, permitindo que ela se alinhe na orientação correta.
NOTA: Após a colocação, verifique se a ranhura da sonda térmica está sentada na alça do cateter laser. A sonda térmica travará magneticamente no lugar e evitará a rotação durante o tratamento. - Conecte tubos intravenosos preparados do saco salino à porta de entrada proximal no cateter laser.
- Conecte o soro fisiológico que retorna da porta de saída distal a um saco de drenagem transparente para que o fluido de retorno possa ser visualizado.
NOTA: A solução salina circulante ao redor do cateter laser esfriará a fibra durante o tratamento
9. Realize a lista de verificação de segurança
- Enquanto estiver na tela de monitoramento do tratamento, selecione o local de ablação desejado. Uma vez selecionada a ablação apropriada, pressione 'CONFIRMAR SELEÇÃO'. Uma lista de verificação de segurança ocupará agora o lado esquerdo do monitor da estação de trabalho.
NOTA: Esta etapa começará a circular soro fisiológico através do cateter laser. Pequenas bolhas introduzidas ao conectar os tubos intravenosos são inicialmente visíveis no ultrassom ao redor do laser. Isso pode funcionar como uma verificação adicional para a posição do cateter laser. - Siga a lista de verificação de segurança, marcando as caixas uma vez concluídas.
- Certifique-se de que todos os indivíduos na sala usam óculos de segurança a laser, incluindo o paciente.
- O sistema do computador da estação de trabalho verificará automaticamente a sonda térmica para garantir que todos os termopares estejam lendo temperaturas corporais uniformes entre 30 e 40 °C.
- Confirme que as quatro bandas ecogênicas dos cateteres laser estão localizadas na cápsula da próstata, pois a colocação da sonda térmica pode afastar a próstata do cateter laser.
NOTA: A zona de ablação começa 5 mm distal aos marcadores ecogênicos e estende outros 27 mm de comprimento e 18 mm de diâmetro (máximo).
10. Realizando a ablação do tecido laser
- Uma vez que a lista de verificação de segurança esteja completa pressione 'START LASER' para iniciar a ablação.
- Monitore o progresso do tratamento em tempo real usando leituras de temperatura, temporizador e mapa de danos.
NOTA: Avalie a temperatura do tecido utilizando o gráfico multi-linha à esquerda do modelo de próstata. A temperatura retal é marcada em branco e não deve exceder 42 °C. A temperatura na ponta do cateter laser está marcada em azul(Figura 3). O laser desligará automaticamente se a ponta laser exceder 75 °C ou a parede retal exceder 42°C.
NOTA: Uma vez que o laser esteja ativo, monitore o tempo de tratamento em cada local de ablação usando a barra vermelha na parte superior da tela. Um mapa de danos dá uma representação 3D do tecido tratado com base na temperatura e no tempo.
NOTA: Alterações de nota no ultrassom do modo B. O tecido da próstata geralmente não muda na aparência durante a ablação a laser. Com tratamentos seriais, o tecido pode assumir uma aparência hipoecóica, mas a visualização dos EUA serve principalmente para o posicionamento do laser.
NOTA: Monitor para as características de ultrassom a seguir:- Micro bolhas girando se formando além das bandas de cateter laser ecogênicos podem indicar um vazamento na solução salina circulante devido ao superaquecimento. Embora isso não tenha impacto na segurança, o progresso do tratamento pode ser retardado.
- Um aumento na natureza hiperecóica ou "clareamento" da gordura retal pode ocorrer se o cateter laser for inadvertidamente puxado para trás, causando aquecimento da gordura perirectal.
- Se algum desses achados de ultrassom for observado, o tratamento a laser deve ser interrompido.
- O laser pára automaticamente quando o temporizador se esgota, mas um praticante pode optar por acabar com a ablação manualmente pressionando 'STOP THE LASER'. A solução salina continuará a fluir, esfriando a ponta laser.
NOTA: Considere parar a ablação mais cedo se as temperaturas subirem acima de 55 °C por mais de 60 segundos. - Mantenha o cateter laser e a sonda térmica no lugar até que a temperatura do cateter laser tenha caído abaixo de 42 °C, impedindo assim o aquecimento da parede retal durante a retirada do cateter laser.
11. Ablações subsequentes
- Posicione o ultrassom no próximo local de ablação usando os alvos digitais fornecidos pelo dispositivo de fusão.
- Avalie se as imagens de ultrassom ao vivo permanecem registradas na ressonância magnética da próstata e realize uma compensação por movimento, se necessário.
NOTA: Se usar o Artemis, a técnica de compensação de movimento é descrita no vídeo anteriormente referenciado. 24 - Na tela de monitoramento do tratamento, o local inicial de ablação será agora acinzentado; no entanto, pode ser tratado novamente, se considerado necessário.
- Selecione o próximo site de ablação do lado esquerdo da tela e repita o processo descrito nas etapas 8 - 10.
12. Concluir sessão de tratamento
- Uma vez que todos os locais de ablação tenham sido tratados, um botão 'FINISH TREATMENT' aparecerá. A pressão deste botão exibirá uma tela de revisão de tratamento que exibe métricas quantitativas para a sessão de tratamento.
- Remova a sonda TRUS do reto do paciente. A pressão manual pode ser aplicada na parede retal sobrepondo a próstata para facilitar a hemostasia.
Resultados
Os resultados publicados da FLA são mostrados na Tabela 2. Uma variedade de métodos e tecnologias estão incluídos. Mais de 400 pacientes submetidos a várias formas de FLA para tratamento de PCa são encontrados no banco de dados da SEER. 25 Para quantificar o número e as características do FLA relatados na literatura realizamos uma revisão sistemática da Medline e da Biblioteca Cochrane. Nossa pesquisa foi realizada usando termos de busca em campo inteiro, incluindo "ablação a laser focal" e "câncer de próstata". No total, 247 títulos e resumos foram revisados. Foram incluídos apenas casos relatando ablação focal a laser, ressonância magnética e desfechos oncológicos. 13 publicações revisadas por pares qualificadas para inclusão, representando 333 pacientes totais (Tabela 1).
O tratamento foi realizado com um laser de diodo de 980 nm em todos, exceto 2 estudos. 26,27 Parâmetros de tratamento consistiu em níveis de potência entre 6 - 18 Watts e tempos de tratamento que abrangem 1 - 4 minutos por local de ablação (Tabela 1). O monitoramento da temperatura do tratamento foi fornecido pela termemetria de ressonância magnética em 9 estudos e por medições diretas de sonda de temperatura em 3 estudos (Tabela 1). Todos os estudos foram realizados in-bore, exceto os de Lindner e o estudo posterior de Natarajan. 20,26,27
A média da linha de base PSA para a coorte foi de 5,7 (faixa 1,1 - 14,8). Após o FLA, a média de PSA em 3, 6, 12 e 24 meses foi de 3,9, 5,5, 3,8 e 3,9, respectivamente. O IPSS médio da linha de base para a coorte foi de 6. Na sequência do FLA, a mediana do IPSS em 3, 6, 12 e 24 meses foi de 5, 5,5, 7,3 e 11,5, respectivamente. A linha de base mediana SHIM para a coorte foi de 20. Após o FLA, a mediana do SHIM em 3, 6, 12 e 24 meses foi de 19, 18, 20 e 19, respectivamente.
Em todos os estudos, as complicações foram relatadas inconsistentemente; no entanto, houve apenas uma complicação classificada pelos autores como Grau III (infecção do trato urinário). 16 Os autores não especificaram as características que classificaram isso como um evento grau III. Duas fístulas recto-uretrais, ambas fechando espontaneamente após cateterismo prolongado,16 foram relatadas como eventos adversos grau II.
O seguimento oncológico foi agrupado pelo período de seguimento: menos de 6 meses, um ano e dois anos (Tabela 2). A biópsia de seguimento foi realizada por biópsia guiada por ressonância magnética em 4 estudos, e biópsia de fusão mri-EUA em 6 estudos. Dois estudos utilizaram biópsia sistemática e dois estudos realizaram investigações de "tratar e ressectar" onde a amostra de prostatectomia foi avaliada. O sucesso do tratamento foi definido de acordo com um protocolo de consenso de Delfos. 28 O sucesso em campo foi definido como a ausência de ≥ GG2 PCa dentro do local de ablação anterior. A falha fora de campo foi definida como ≥ GG2 fora da área de ablação prévia. Entre os pacientes com resultados de biópsia de seguimento, o sucesso geral no campo após o tratamento aos 6 meses (N=83), 1 ano (N=64) e 2 anos (N=39) foi de 83%, 83% e 59% respectivamente (Tabela 2).
Na UCLA, o FLA da próstata foi realizado em três ensaios clínicos sucessivos a partir de 2014. 29-31 18 homens com câncer de próstata de risco intermediário foram submetidos a FLA, oito in-bore e 10 em clínica, sem qualquer evento adverso grau III. Atualmente, mais 10 homens estão sendo submetidos ao FLA usando o dispositivo demonstrado. 31 Todos os pacientes foram avaliados antes da FLA com ressonância magnética 3T (bobina corporal) e biópsia de fusão mri-EUA com amostragem do ROI e biópsia sistemática dentro de 6 meses após o tratamento. As biópsias de base e de acompanhamento foram realizadas sob orientação de fusão de ressonância magnética/EUA usando o sistema de fusão Artemis com rastreamento de todos os locais de biópsia.
Mesa 1. Estudos relatados de ablação a laser focal.
| Número de referência | autor | ano | n | Idade Mediana (Faixa) | Potência laser | Rx Time (seg) | Margem Planejada | Procedimento in-bore | Monitoramento de temperatura | Gleason-de-linha de base | ||||
| 3+3 | 3+4 | 4+3 | 4+4 | |||||||||||
| 26 | Lindner | 2009 | 12 | 56.5 (51-52) | - | 120 | - | Não | Sonda de temperatura | 12 | 0 | 0 | 0 | |
| 27 | Lindner | 2010 | 4 | 66 (61-73) | - | 120 | - | Não | Sonda de temperatura | 2 | 0 | 1 | 1 | |
| 5 | Oto | 2013 | 9 | 61 (52-77) | 6 - 15 W | - | - | sim | Termrometria de ressonância magnética | 8 | 1 | 0 | 0 | |
| 12 | Lee | 2014 | 23 | - | 8 W | 30-60 | - | sim | Termrometria de ressonância magnética | - | - | - | - | |
| 6 | Lepor | 2015 | 25 | 66 (49-84) | - | - | - | sim | Termrometria de ressonância magnética | 11 | 13 | 1 | 0 | |
| 18 | Al Barqawi | 2015 | 7 | 61 (56-69) | - | 90 | - | sim | Termrometria de ressonância magnética | 7 | 0 | 0 | 0 | |
| 15 | Bomers | 2016 | 5 | 66 (58-70) | - | - | 9 mm | sim | Termrometria de ressonância magnética | 2 | 2 | 1 | 0 | |
| 14 | Eggener | 2016 | 27 | 62 (-) | 6 - 15 W | 60-120 | 0 -7,5 mm | sim | Termrometria de ressonância magnética | 23 | 3 | 1 | 0 | |
| 19 | Natarajan | 2016 | 8 | 63 (54-72) | 11 - 14 W | 180 | Personalizado* | sim | Sonda de temperatura # | 1 | 7 | 0 | 0 | |
| 20 | Natarajan | 2017 | 10 | 65 (52-74) | 13.75 W | 180 | Personalizado* | Não | Sonda de temperatura | 2 | 8 | 0 | 0 | |
| 35 | Chao | 2018 | 34 | 69 (52-88) | - | - | - | sim | Termrometria de ressonância magnética | 16 | 16 | 2 | 0 | |
| 17 | Al Hakeem | 2019 | 49 | 63 (51-73) | 10 - 15 W | 120 | 9 mm | sim | Termrometria de ressonância magnética | 13 | 29 | 7 | 0 | |
| 16 | Walser | 2019 | 120 | 60 (45-86) | 17 - 18 W | 180-240 | 5 mm | sim | Termrometria de ressonância magnética | 37 | 56 | 27 | 0 | |
Tabela 1: Traço (-) indica informações não disponíveis no manuscrito publicado. * indica que cada margem foi planejada individualmente. # indica que o monitoramento foi realizado com uma sonda de temperatura e termometria de ressonância magnética.
Mesa 2. Resultados da ablação focal do laser.
| Número de referência | Primeiro Autor | Método de biópsia de acompanhamento | Faça a biópsia de acompanhamento | ≤ 6 meses | 12 meses | 24 meses | Eventos Adversos | ||||||
| êxito | fracasso | êxito | fracasso | êxito | fracasso | eu | Ii | Iii | |||||
| 26 | Lindner | Bx guiado por ressonância magnética | 12 | 12 | 0 | - | - | - | - | 2 | 0 | 0 | |
| 27 | Lindner | Prostatectomia | 4 | 2 | 2 | - | - | - | - | - | - | - | |
| 5 | Oto | MRI/US Bx | 9 | 9 | 0 | - | - | - | - | 1 | 1 | 0 | |
| 12 | Lee | MRI/US Bx | 13 | - | - | 12 | 1 | - | - | - | - | - | |
| 6 | Lepor | Bx guiado por ressonância magnética | 21 | 20 | 1 | - | - | - | - | 0 | 0 | 0 | |
| 18 | Al Barqawi | Bx Sistemático | 5 | - | - | 5 | 00 | - | - | - | 1 | 0 | |
| 15 | Bomers | Prostatectomia | 5 | 1 | 4 | - | - | - | - | - | - | - | |
| 14 | Eggener | Bx guiado por ressonância magnética # | 27 | 27 | - | 7 | 31 | - | - | 7 | 2 | 0 | |
| 19 | Natarajan | MRI/US Bx | 8 | 6 | 53 | - | - | - | - | 23 | 7 | 0 | |
| 20 | Natarajan | MRI/US Bx | 10 | 6 | 40 | - | - | - | - | 38 | 6 | 0 | |
| 35 | Chao | MRI/US Bx | 22 | - | - | - | - | 13 | 9 | - | - | - | |
| 17 | Al Hakeem | MRI/US Bx | 49 | - | - | 40 | 91 | - | - | 34 | 11 | 0 | |
| 16 | Walser | Bx guiado por ressonância magnética | 44* | - | - | - | - | 26 | 18 | 8 | 8 | 1 | |
Notas de rodapé Tabela 2. Sucesso = ausência de ≥ câncer de próstata GG2 dentro da zona de ablação. Falha = presença de ≥ câncer de próstata GG2: total e fora de campo (número subscrito). # indica que a biópsia guiada pela ressonância magnética foi utilizada durante a biópsia de 6 meses, mas apenas a biópsia sistemática foi utilizada para biópsia de 12 meses. * indica que apenas pacientes com redução de PSA de < 50% e ressonância magnética pós-ablação positiva foram submetidos à biópsia; 76 pacientes não fizeram biópsia.
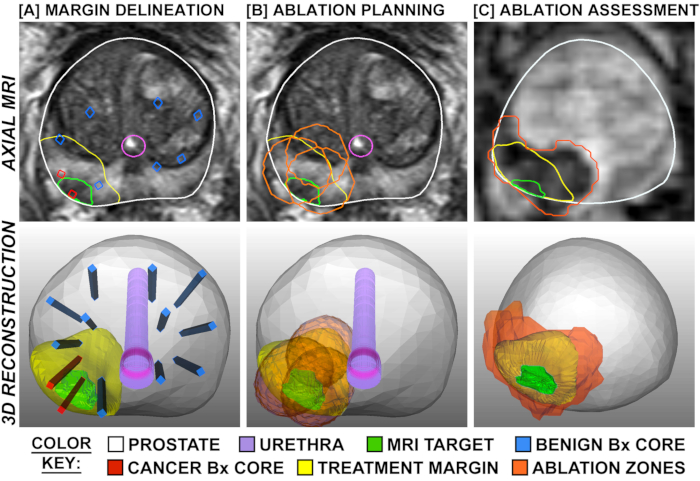
Figura 1: Planejamento e Avaliação do Tratamento, mostrados via sobreposições em RM transversal (linha superior) e em 3D (linha inferior). A coluna A mostra o delineamento das margens de tratamento, que são expandidas em torno da meta de ressonância magnética positiva do câncer e delimitadas por núcleos de biópsia sistemática negativa nas proximidades (azul). A coluna B mostra o planejamento de locais de ablação de tal forma que as margens de tratamento são sobrepostas para evitar áreas de 'salto'. A coluna C mostra imagens ponderadas por perfusão coletadas 2 horas após o tratamento, demonstrando correspondência entre a extensão planejada e observada de ablação. Clique aqui para ver uma versão maior desta figura.
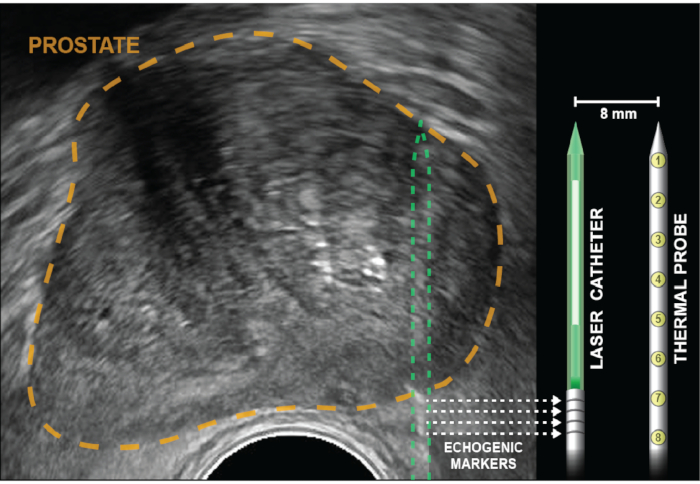
Figura 2: Ultrassom axial com próstata delineada em ouro. Os refletores de cubos de canto (bandas ecogênicas), indicados por setas pontilhadas, são gravados no cateter laser 5 mm do difusor (branco). A sonda de temperatura é inserida na mesma profundidade que a fibra laser, então travada no lugar e permanece paralela ao laser de 8 mm de distância, fora do plano de visão dos EUA. Oito sensores térmicos, que estão dentro da sonda a 4 mm de distância, fornecem gravações de temperatura em pontos desde a base das bandas ecogênicas até a ponta do cateter laser. As medições de temperatura mais próximas à parede retal são fornecidas por medições térmicas na base da sonda de temperatura (posições 6-8). Clique aqui para ver uma versão maior desta figura.

Figura 3: Gravações de temperatura durante a ablação de laser focal para duas ablações sucessivas. Eixo Y = temperatura em Celsius. Eixo X = tempo em minutos. Barras sombreadas verticais = períodos de ativação a laser. Linha azul = temperatura 8mm a partir da ponta da fibra laser (termopar distal). Linha branca = temperatura de 8 mm de termopar proximal mais próximo da parede retal. Uma temperatura de 60 graus Celsius, alcançada ainda brevemente, garante necrose de coagulação. Clique aqui para ver uma versão maior desta figura.
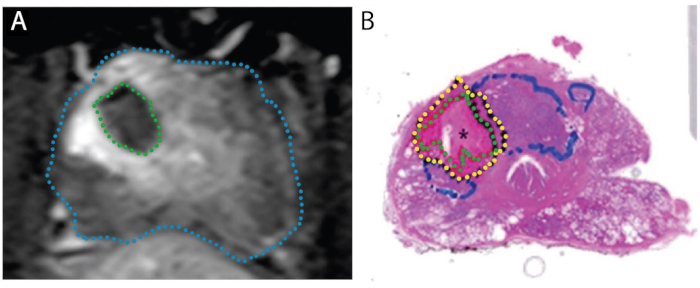
Figura 4: Imagens demonstrando concordância da zona de ablação na ressonância magnética pós-tratamento (A) com zona necrosada real em espécime de montagem inteira (B). O paciente é homem de 67 anos com PCa na zona de transição direita, Gleason nota 3 + 4 = 7, participando de um teste de 'tratar e ressectar'. A. Imagem axial de contraste ponderada por T1 pós-ablation, mostrando defeito de perfusão causado pelo tratamento a laser (verde). B. Mancha de H&E da próstata. O tecido necrosado é delineado em verde, o tecido peri-necrosado em amarelo, e tumor intacto (não tratado) em azul. Reproduzido sob uma licença Creative Commons de Bomers et al, World Journal of Urology. 15 Clique aqui para ver uma versão maior desta figura.
Discussão
O objetivo do presente trabalho é descrever e ilustrar um método para a realização da ablação a laser focal (FLA) do câncer de próstata (PCa). O método difere de outros métodos de terapia focal, pois pretende-se ser realizado sob anestesia local em ambiente clínico. O método FLA aqui mostrado foi introduzido em 2017,20 e tem sido continuamente refinado desde então. Assim, o procedimento descrito neste artigo pode ser de valor para futuros investigadores.
O tratamento a laser do tecido da próstata parece datar da pesquisa de McNicholas e colegas, trabalhando na University College London, que demonstrou em 1993 que a necrose da coagulação focal poderia ser produzida em próstatas caninas com um dispositivo Nd:YAG. 32 Prevendo o futuro, esses autores postularam que a técnica "... pode provar de valor... para a destruição de pequenos tumores prostáticos focais." Posteriormente, a ablação a laser de PCa no homem foi descrita em 2009 por Lindner et al da Universidade de Toronto. 26 Nesse esforço pioneiro, Lindner combinou a modalidade emergente de ressonância magnética da próstata com o software de fusão de imagens precoce e sondas térmicas convencionais para atingir com sucesso o câncer e monitorar a ablação a laser em 12 homens.
Uma vez que a PCa mais importante pode ser visualizada com ressonância magnética multi-paramétrica contemporânea, a segmentação in-bore e o tratamento de lesões visíveis podem ser uma extensão direta do procedimento diagnóstico. O alvo in-bore da lesão é direto, e a termometria de MR permite o monitoramento remoto da ablação. Raz et al relataram dois desses tratamentos em 2010. 33 Uma série de tratamentos de FLA in-bore (N=9) foi relatada por Oto e colegas em 2013. 5 A adoção do FLA in-bore foi facilitada por hardware desenvolvido para esse fim, conforme relatado por Natarajan et al em 2016. 19 Um número de radiologistas, utilizando uma fibra laser resfriada com água para evitar carbonização, adotou o método in-bore; e centenas de tratamentos FLA in-bore já foram relatados (Walser, Feller, Sperling/Lepor). 6,16,34,35
Embora os desfechos oncológicos de curto prazo do FLA in-bore possam ser favoráveis (Tabela 1), é provável que o procedimento não se torne amplamente adotado, devido a fatores limitantes descritos na introdução. Além disso, a termometria de RM para monitoramento do tratamento apresenta uma série de limitações importantes. 19 Com uma experiência de uma década com procedimentos de biópsia de fusão de ressonância magnética/EUA (N~4000), teorizamos que uma fibra laser poderia ser direcionada para uma lesão de câncer, semelhante à inserção de uma agulha de biópsia, e que o monitoramento do tratamento poderia ser realizado diretamente com sondas térmicas. Assim, após a experiência interna, dez pacientes foram submetidos ao FLA fora do ar na clínica de urologia da UCLA, utilizando apenas anestesia local, orientação de fusão de ressonância magnética/EUA e monitoramento de sondas térmicas. 20 Não só a segurança e a viabilidade do novo método foram demonstradas, mas entre os últimos pacientes tratados, nenhuma evidência de PCa foi encontrada na biópsia subsequente.
O efeito tecidual da FLA foi esclarecido em dois estudos, onde a prostatectomia radical planejada foi realizada 1-3 semanas após o procedimento a laser (N=9), ou seja, um modelo de "tratar e ressectar" (Figura 4). 15,27 Em todos os 9 pacientes, o volume de tecido necrosado encontrado na próstata aproximou-se do volume estimado pela Ressonância Magnética obtido após a conclusão do tratamento. Quando toda a próstata foi seccionada, foi observada uma transição abrupta entre necrose e células intactas de 1 a 5 mm fora da área de ablação a laser (Figura 1). As margens nítidas e a precisão das zonas de ablação têm implicações importantes para a precisão do planejamento de registro e tratamento da ressonância magnética/EUA.
Uma parte importante do sistema Avenda é o software de planejamento de tratamento. Para um FLA eficaz, o planejamento precisa incluir não apenas a localização da lesão, mas também o volume de tecido necessário para a destruição completa do tumor. O volume de ablação não pode ser simplesmente o volume de ressonância magnética- lesão, porque o volume real do tumor excede o da lesão visível da ressonância magnética em uma média de 3 vezes. 21 Além disso, o câncer muitas vezes se estende em projeções irregulares semelhantes a dedos, o que tornaria não confiável qualquer margem de segurança uniforme baseada apenas em imagens (por exemplo, 1 cm além do limite da lesão visível da ressonância magnética). O sistema Avenda inclui um software de planejamento de tratamento que utiliza não apenas a lesão visível da ressonância magnética, mas também o rastreamento 3D de locais de biópsia (positivo e negativo) para fornecer uma colocação precisa do volume mínimo de ablação que abrangerá totalmente o câncer. Um exemplo desse planejamento de tratamento é visto na Figura 3.
Em conclusão, o FLA é um método seguro e viável para erradicar o câncer de próstata em uma clínica sob anestesia local. As etapas do procedimento são mostradas no vídeo que acompanha. A colocação precisa da fibra laser em uma lesão visível de ressonância magnética é realizada usando a fusão mri/EUA, assim como agulhas de biópsia são colocadas em tais lesões. O monitoramento do tratamento em tempo real é realizado através de uma sonda térmica adjacente à fibra laser. O software de planejamento de tratamento, que emprega volumes de lesões de ressonância magnética e locais de biópsia rastreados para ajudar o operador a determinar as margens de tratamento, é uma parte importante do sistema. Fla in-clinic como descrito e ilustrado neste artigo parece fornecer uma opção de terapia focal atraente não disponível anteriormente.
Divulgações
Dr. Marks e Dr. Natarajan são co-fundadores da Avenda Health.
Materiais
| Name | Company | Catalog Number | Comments |
| Fusion Guidance System | NA | Artemis Displayed in Video | |
| Laser Catheter | Avenda Health | ||
| Orion Workstation | Avenda Health | ||
| Thermal Probe | Avenda Health | ||
| Transrectal Probe | NA | Not Platform Dependent | |
| Ultrasound | NA | Not Platform Dependent |
Referências
- Cooperberg, M. R., Carroll, P. R. Trends in management for patients with localized prostate cancer, 1990-2013. JAMA - Journal of the American Medical Association. 314 (1), 80-82 (2015).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Connor, M. J., Gorin, M. A., Ahmed, H. U., Nigam, R. Focal therapy for localized prostate cancer in the era of routine multi-parametric MRI. Prostate Cancer and Prostatic Diseases. , 1-12 (2020).
- Ahmed, H. U., et al. Focal Therapy for Localized Prostate Cancer: A Phase I/II Trial. The Journal of Urology. 185, 1246-1255 (2011).
- Oto, A., et al. MR imaging-guided focal laser ablation for prostate cancer: Phase I trial. Radiology. 267 (3), 932-940 (2013).
- Lepor, H., Llukani, E., Sperling, D., Fütterer, J. J. Complications, Recovery, and Early Functional Outcomes and Oncologic Control Following In-bore Focal Laser Ablation of Prostate Cancer. European Urology. 68 (6), 924-926 (2015).
- Johnson, D. C., et al. Detection of Individual Prostate Cancer Foci via Multiparametric Magnetic Resonance Imaging. European Urology. 75 (5), 712-720 (2019).
- Johnson, D. C., et al. Do contemporary imaging and biopsy techniques reliably identify unilateral prostate cancer? Implications for hemiablation patient selection. Cancer. 125 (17), 2955-2964 (2019).
- Liu, W., et al. Copy number analysis indicates monoclonal origin of lethal metastatic prostate cancer. Nature Medicine. 15 (5), 559-565 (2009).
- Ahmed, H. U. The Index Lesion and the Origin of Prostate Cancer. New England Journal of Medicine. 361 (17), 1704-1706 (2009).
- Stafford, R. J., et al. Magnetic resonance guided, focal laser induced interstitial thermal therapy in a canine prostate model. Journal of Urology. 184 (4), 1514-1520 (2010).
- Lee, T., Mendhiratta, N., Sperling, D., Lepor, H. Focal laser ablation for localized prostate cancer: principles, clinical trials, and our initial experience. Reviews in urology. 16 (2), 55-66 (2014).
- Johnson, D. E., Cromeens, D. M., Price, R. E. Interstitial laser prostatectomy. Lasers in Surgery and Medicine. 14 (4), 299-305 (1994).
- Eggener, S. E., Yousuf, A., Watson, S., Wang, S., Oto, A. Phase II Evaluation of Magnetic Resonance Imaging Guided Focal Laser Ablation of Prostate Cancer. Journal of Urology. 196 (6), 1670-1675 (2016).
- Bomers, J. G. R. R., et al. MRI-guided focal laser ablation for prostate cancer followed by radical prostatectomy: correlation of treatment effects with imaging. World Journal of Urology. 35 (5), 703-711 (2017).
- Walser, E., et al. Focal Laser Ablation of Prostate Cancer: Results in 120 Patients with Low- to Intermediate-Risk Disease. Journal of Vascular and Interventional Radiology. 30 (3), 401-409 (2019).
- Al-Hakeem, Y., Raz, O., Gacs, Z., Maclean, F., Varol, C. Magnetic resonance image-guided focal laser ablation in clinically localized prostate cancer: safety and efficacy. ANZ Journal of Surgery. 89 (12), 1610-1614 (2019).
- Barqawi, A., Krughoff, K., Li, H., Patel, N. U. Initial Experience of Targeted Focal Interstitial Laser Ablation of Prostate Cancer with MRI Guidance. Current Urology. 8 (4), 199-207 (2014).
- Natarajan, S., et al. Focal Laser Ablation of Prostate Cancer: Phase I Clinical Trial. Journal of Urology. 196 (1), 68-75 (2016).
- Natarajan, S., et al. Focal Laser Ablation of Prostate Cancer: Feasibility of Magnetic Resonance Imaging-Ultrasound Fusion for Guidance. Journal of Urology. 198 (4), 839-847 (2017).
- Priester, A., et al. Magnetic Resonance Imaging Underestimation of Prostate Cancer Geometry: Use of Patient Specific Molds to Correlate Images with Whole Mount Pathology. Journal of Urology. 197 (2), 320-326 (2017).
- Lightner, D. J., Wymer, K., Sanchez, J., Kavoussi, L. Best Practice Statement on Urologic Procedures and Antimicrobial Prophylaxis. Journal of Urology. 203 (2), 351-356 (2020).
- Jones, T. A., Radtke, J. P., Hadaschik, B., Marks, L. S. Optimizing safety and accuracy of prostate biopsy. Current Opinion in Urology. 26 (5), 472-480 (2016).
- Jayadevan, R., Zhou, S., Priester, A. M., Delfin, M., Marks, L. S. Use of MRI-ultrasound fusion to achieve targeted prostate biopsy. Journal of Visualized Experiments. (146), e59231 (2019).
- Zheng, X., et al. Focal Laser Ablation Versus Radical Prostatectomy for Localized Prostate Cancer: Survival Outcomes From a Matched Cohort. Clinical Genitourinary Cancer. 17 (6), 464-469 (2019).
- Lindner, U., et al. Image Guided Photothermal Focal Therapy for Localized Prostate Cancer: Phase I Trial. Journal of Urology. 182, 1371-1377 (2009).
- Lindner, U., et al. Focal Laser Ablation for Prostate Cancer Followed by Radical Prostatectomy: Validation of Focal Therapy and Imaging Accuracy. European Urology. 57 (6), 1111-1114 (2010).
- van Luijtelaar, A., et al. Focal laser ablation as clinical treatment of prostate cancer: report from a Delphi consensus project. World Journal of Urology. 37, 2147-2153 (2019).
- . Use of Laser Interstitial Thermal Therapy in the Focal Treatment of Localized Prostate Cancer - NCT02224911 Available from: https://clinicaltrials.gov/ct2/show/NCT02224911 (2020)
- . Focal Laser Ablation of Prostate Tissue - NCT02357121 Available from: https://clinicaltrials.gov/ct2/show/NCT02357121 (2020)
- . Focal Laser Ablation of Prostate Cancer -NCT04305925 Available from: https://clinicaltrials.gov/ct2/show/NCT04305925 (2020)
- McNICHOLAS, T. A., STEGER, A. C., BOWN, S. G. Interstitial Laser Coagulation of the Prostate An Experimental Study. British Journal of Urology. 71 (4), 439-444 (1993).
- Raz, O., et al. Real-Time Magnetic Resonance Imaging-Guided Focal Laser Therapy in Patients with Low-Risk Prostate Cancer. European Urology. 58 (1), 173-177 (2010).
- . Transrectally delivered, outpatient MRI-guided laser focal therapy of prostate cancer: 9.5 year interim results of NCT #02243033, Presentation at the AdMeTech 4th Global Summit on Precision Diagnosis and Treatment of Prostate Cancer Available from: https://www.admetech.org/wp-content/uploads/2019/08/DMI-FOCAL-Tx-2019-NCT-02243033.FINAL_.pdf (2020)
- Chao, B., Llukani, E., Lepor, H. Two-year Outcomes Following Focal Laser Ablation of Localized Prostate Cancer. European Urology Oncology. 1 (2), 129-133 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados