Method Article
Generación de equivalentes de piel humana vascularizada autoensamblada
En este artículo
Resumen
La meta de este protocolo es describir la generación y el análisis volumétrico de los equivalentes humanos vascularizados de la piel usando las técnicas accesibles y simples para la cultura a largo plazo. En la medida de lo posible, se describe la justificación de los pasos para permitir a los investigadores la capacidad de personalizar en función de sus necesidades de investigación.
Resumen
Los equivalentes de piel humana (HSE) son construcciones de ingeniería tisular que modelan componentes epidérmicos y dérmicos de la piel humana. Estos modelos se han utilizado para estudiar el desarrollo de la piel, la cicatrización de heridas y las técnicas de injerto. Muchos HSE continúan careciendo de vasculatura y se analizan además con la seccionamiento histológico de la poste-cultura que limita el gravamen volumétrico de la estructura. Se presenta aquí un protocolo directo que utiliza materiales accesibles para generar los equivalentes humanos vascularizados de la piel (VHSE); se describen más a fondo las técnicas volumétricas de la proyección de imagen y de la cuantificación de estas construcciones. Brevemente, los VHSE se construyen en 12 inserciones de cultivo de pozos en los que las células dérmicas y epidérmicas se siembran en gel de colágeno tipo I de cola de rata. El compartimento dérmico se compone de fibroblastos y células endoteliales dispersas a lo largo del gel de colágeno. El compartimento epidérmico se compone de queratinocitos (células epiteliales de la piel) que se diferencian en la interfaz aire-líquido. Es importante destacar que estos métodos son personalizables en función de las necesidades del investigador, con resultados que demuestran la generación de VHSE con dos tipos diferentes de células fibroblásticas: fibroblastos dérmicos humanos (hDF) y fibroblastos pulmonares humanos (IMR90s). Los VHSE fueron desarrollados, fotociroscópicos con microscopia confocal, y analizados volumétricamente usando software de cómputo en 4 - y 8 puntos de tiempo de la semana. Un proceso optimizado para fijar, para manchar, para imaginar, para la imagen, y para borrar VHSEs para la examinación volumétrica se describe. Este modelo integral, imágenes y técnicas de análisis son fácilmente personalizables para las necesidades específicas de investigación de laboratorios individuales con o sin experiencia previa en HSE.
Introducción
La piel humana realiza muchas funciones biológicas esenciales, incluyendo actuar como una barrera inmune / mecánica, regular la temperatura corporal, participar en la retención de agua y funciones sensoriales1,2,3,4. Anatómicamente, la piel es el órgano más grande del cuerpo humano y se compone de tres capas principales (epidermis, dermis e hipodermis) y posee un complejo sistema de componentes del estroma, vascular, glandular e inmune/nervioso además de las células epidérmicas. La epidermis en sí está compuesta por cuatro capas de células que se renuevan continuamente para mantener la función de barrera y otras estructuras de la piel nativa (es decir, sudor y glándulas sebáceas, uñas)3. La fisiología de la piel es importante en la función inmune, la cicatrización de heridas, la biología del cáncer y otros campos, lo que lleva a los investigadores a utilizar una amplia gama de modelos, desde monocultivos in vitro hasta modelos animales in vivo. Los modelos animales ofrecen la capacidad de estudiar toda la complejidad de la fisiología de la piel, sin embargo, los modelos animales comúnmente utilizados, como los ratones, tienen diferencias fisiológicas significativas en comparación con los humanos5. Estas limitaciones, y el aumento del costo de los modelos animales, han llevado a muchos investigadores a centrarse en el desarrollo de modelos in vitro que reflejan más de cerca la fisiología de la piel humana1,6. De éstos, uno de los tipos más simples del modelo es el equivalente epidérmico humano (HEE; también referido como modelos epidérmicos de la piel del mitad-grueso) que se componen solamente de keratinocytes epidérmicos en una matriz cutánea acelular, pero capturan la diferenciación y la estratificación epidérmicas consideradas in vivo. Basándose en esto, los modelos que contienen componentes dérmicos y epidérmicos (queratinocitos y fibroblastos) a menudo se conocen como equivalentes de piel humana (HSE), modelos de piel de espesor completo o construcciones de piel organotípicas (OSC). Brevemente, estos modelos se generan encapsulando células dérmicas dentro de matrices de gel y sembrando células epidérmicas en la parte superior. La diferenciación y estratificación epidérmicas pueden lograrse a través de medios especializados y exposición al aire7. Los equivalentes cutáneos se han generado con mayor frecuencia mediante técnicas de autoensamblaje utilizando geles dérmicos hechos de colágeno tipo I (yasea de cola de rata o de origen piel bovina)1,8,pero modelos similares han incorporado otros componentes de la matriz como fibrina9,10,fibroblastos derivados11, 12,membranas des-epidérmicas cadavéricas13,14,15, 16,geles disponibles comercialmente y otros1,12, 13,17,18,19. Actualmente, hay equivalentes de piel disponibles comercialmente (como se revisó anteriormente1,2). Sin embargo, estos se desarrollan principalmente con fines terapéuticos y no se pueden personalizar fácilmente a preguntas de investigación específicas.
Las HSE se han aplicado en estudios de cicatrización de heridas, injertos, toxicología y enfermedades/desarrollos de la piel11,12,13,16,8,20,21,22,23. Aunque el cultivo 3D modela de forma más exhaustiva las funciones del tejido humano en comparación con los cultivos2D 24,la inclusión de diversos tipos celulares que reflejan con mayor precisión la población in vivo permite realizar estudios de coordinación célula-célula en tejidos complejos24,25,26. La mayoría de las HSE sólo incluyen fibroblastos dérmicos y queratinocitos epidérmicos27,aunque el ambiente de la piel in vivo incluye muchos otros tipos de células. Estudios recientes han comenzado a incluir más poblaciones celulares; éstos incluyen las células endoteliales en vasculatura10,28,29,30,31,32,33,34,adipocytes en tejido subcutáneo35,36,componentes del nervio19,21,células madres27,37,38,células inmunes10,39,40,41,42,y otros modelos específicos de la enfermedad/del cáncer16,40,43,44,45,46,47. Particularmente importante entre estos es la vasculatura; mientras que algunos HSE incluyen células vasculares, en general todavía carecen de elementos capilares integrales con conectividad a través de toda la dermis10,29, estabilidad in vitro extendida28,y densidad de vasos adecuada. Además, los modelos de HSE se evalúan típicamente con el seccionamiento histológico de la post-cultura que limita el análisis de la estructura tridimensional de HSE. El análisis tridimensional permite la evaluación volumétrica de la densidad vascular48,49, así como la variación regional del espesor epidérmico y la diferenciación.
Aunque las HSE son uno de los modelos organotípicos más comunes, hay muchos desafíos técnicos en la generación de estas construcciones, incluida la identificación de densidades celulares y de matriz extracelular apropiadas, recetas de medios, procedimientos adecuados de interfaz de líquidos de aire y análisis posterior al cultivo. Además, mientras que los modelos de HEE y de HSE han publicado protocolos, un protocolo detallado que incorpora vasculatura cutánea y proyección de imagen volumétrica algo que análisis histológico no existe. Este trabajo presenta un protocolo accesible para el cultivo de equivalentes de piel humana vascularizados (VHSE) de líneas celulares principalmente comerciales. Este protocolo está escrito para ser fácilmente personalizable, lo que permite una adaptación directa a diferentes tipos de células y necesidades de investigación. En aras de la accesibilidad, la disponibilidad y el costo, se dio prioridad al uso de productos simples y técnicas de generación sobre el uso de productos disponibles comercialmente. Además, se describen métodos volumétricos sencillos de la proyección de imagen y de la cuantificación que permiten el gravamen de la estructura tridimensional del VHSE. La traducción de este procedimiento en un protocolo robusto y accesible permite a los investigadores no especializados aplicar estos importantes modelos en medicina personalizada, ingeniería de tejidos vascularizados, desarrollo de injertos y evaluación de fármacos.
Protocolo
1. Preparación para la cultura 3D
- Preparar caldo de colágeno cola de rata a 8 mg/mL, utilizando los protocolos establecidos50,51,52. Alternativamente, el colágeno de cola de rata se puede comprar a los vendedores (ver lista de materiales) a concentraciones apropiadas.
NOTA: El colágeno se puede preparar o comprar en diferentes concentraciones en el rango de 3-10 mg / mL, o superior50,51,52. Los cálculos del protocolo suponen una concentración de 8 mg/mL pero pueden ajustarse en función de las necesidades del investigador. - Expandir líneas celulares: Las células endoteliales y fibroblásticas deben estar listas para la siembra al comienzo de la generación de componentes dérmicos de colágeno 3D (paso 2). Los queratinocitos deben estar listos el día 7 del cultivo 3D. Una construcción completa de VHSE requiere 7,5 x 105 células endoteliales; 7,5 x 104 fibroblastos; y 1,7 x 105 queratinocitos para generación (Tabla 1).
NOTA: Estas densidades son apropiadas para inserciones de cultivo de tejido permeable de tamaño de 12 pozos o equivalentes. La densidad y el formato celulares se pueden escalar hacia arriba o hacia abajo en función de las necesidades del investigador. Para aclarar, esta cantidad de células endoteliales y fibroblásticas sembrará 1-3 componentes dérmicos, mientras que cada componente epidérmico requiere 1,7 x 105 queratinocitos. - Realice toda la centrifugación de la célula en este protocolo por el minuto 5 en 300 x g,pero esto se puede disminuir para tipos más frágiles de la célula.
2. Generación de colágeno 3D componente dérmico
Nota : paso 2 es un procedimiento sensible al tiempo y debe completarse en una configuración. Se aconseja completar un control de calidad de la culata de colágeno para asegurar la gelificación y homogeneidad adecuadas antes de comenzar la siembra de componentes dérmicos, ver solución de problemas en la discusión.
- Preparación y siembra de la capa de colágeno acelular
- Prepare dos tubos de microcentrífugos capuchados de 1,7 mL, uno para el soporte acelular y otro para la dermis celular. Las cantidades dadas en este paso prepararán 1 mL de colágeno de 3 mg/mL (concentración de colágeno objetivo), suficiente para (3) VHSE de tamaño de 12 pocillos. Las ecuaciones se enumeran si es necesario el ajuste. Tanto el volumen como la densidad se pueden escalar en función de las necesidades del investigador (los números de referencia comunes se dan en la Tabla 2).
- A cada tubo, agregue 100 μL de solución salina tamponada con fosfato (PBS) de grado de cultivo 10x (un tubo producirá 3 VHSE) y agregue 8,6 μL de 1 N NaOH. Coloque los tubos tapados sobre hielo húmedo para enfriar durante al menos 10 min.
Cs = Concentración de cepas de colágeno
Vf = Volumen final de colágeno necesario
Ct = Concentración de colágeno diana
Vs = Volumen de colágeno común necesario para la cantidad deseada (Vf)
Vpbs = Volumen de 10X PBS necesario para la concentración de colágeno diana (Ct)
VNaOH = Volumen de 1N NaOH necesario para Ct
Vmedia = Volumen de medios, suspensión de llamadas o ddH2O necesario para Ct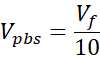
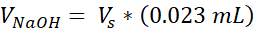
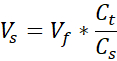
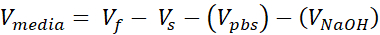
- Preparar pipetas de desplazamiento positivo de 1000 y 250 μL para su uso y reservar. Como los pasos posteriores son sensibles al tiempo, es conveniente cargar puntas de pipeta y establecer volúmenes (375 μL y 125 μL, respectivamente). Además, configure una pipeta normal de 1000 μL para 516 μL.
NOTA: Las pipetas de desplazamiento positivo se pueden sustituir por pipetas normales si es necesario, pero debido a la alta viscosidad del colágeno y la sensibilidad al tiempo / temperatura de este procedimiento, se recomiendan pipetas de desplazamiento positivo para ayudar a producir resultados de siembra consistentes. Si usa pipetas normales, use movimientos lentos. - Prepare las placas del pozo del relleno de la cultura: Utilice las pinzas estériles para colocar tres inserciones de la cultura del tamaño de 12 pocillos en una placa estéril de la cultura del tejido de 12 pocillos, coloque en las columnas centrales.
- Establezca medios fríos apropiados para los tipos de células fibroblásticas y endoteliales.
- Después de enfriar los tubos tapados, coloque un tubo (para el soporte acelular) en un estante con el contenido visible. Deje el otro tubo (para la dermis celular) en hielo.
- Retire 8 mg/mL de colágeno de la refrigeración y colóquelo sobre hielo húmedo.
NOTA: No use hielo congelador o enfriadores de sobremesa de -20 °C, ya que esto congelará el colágeno. - Al tubo tapado en frío, agregue 516 μL de medio e inmediatamente agregue 375 μL de colágeno frío usando la pipeta de desplazamiento positivo de 1000 μL. Dispense colágeno en la solución (no al lado del tubo). Retire inmediatamente la punta de la pipeta vacía y cambie a la pipeta de desplazamiento positivo de 250 μL preparada para mezclar.
- Mezcle rápida pero suavemente para evitar la formación de burbujas, no retire la punta de la solución, si es posible. Mezclar hasta que la solución sea de color homogéneo, que típicamente toma unos 5 ciclos de pipeta o 10 s (si se usan medios con rojo fenol, el color se volverá más claro y uniforme). Al mezclar, asegúrese de dibujar desde diferentes posiciones del tubo (inferior y superior) para una mezcla uniforme.
NOTA: Esto se puede realizar con 516 μL de agua de grado de cultivo celular u otro líquido de grado de cultivo celular, sin embargo, el rojo fenol de la mayoría de los medios es un buen indicador de la mezcla. Utilice fibroblastos o medios endoteliales que se utilizaron para expansiones 2D.
- Mezcle rápida pero suavemente para evitar la formación de burbujas, no retire la punta de la solución, si es posible. Mezclar hasta que la solución sea de color homogéneo, que típicamente toma unos 5 ciclos de pipeta o 10 s (si se usan medios con rojo fenol, el color se volverá más claro y uniforme). Al mezclar, asegúrese de dibujar desde diferentes posiciones del tubo (inferior y superior) para una mezcla uniforme.
- Dispersar inmediatamente 125 μL de colágeno acelular sobre la membrana de cada uno de los tres insertos de cultivo de 12 pocillos. Para asegurar una cobertura uniforme del gel de colágeno acelular, mezcle el plato; si eso no crea una cobertura uniforme de la membrana, use la punta de la pipeta para pintar esencialmente la membrana extendiendo suavemente el colágeno alrededor; evitar aplicar presión a la membrana. La gelificación comienza casi inmediatamente; realice este paso rápidamente para garantizar una cobertura uniforme.
NOTA: Habrá exceso de colágeno acelular. El volumen se puede reducir, sin embargo, la preparación de menos de 1 mL de suspensión de colágeno puede resultar en dificultades para mezclar la solución y una gelificación insuficiente. - Mueva inmediatamente la placa de 12 pocillos a una incubadora de cultivo celular de 37 °C para dejarla en gel durante al menos 20 min (el colágeno acelular puede gelificarse durante más tiempo si es necesario; durante este tiempo de gelificación, continúe con el paso 2.2). Retire la suspensión de colágeno del hielo y vuelva a colocarla en refrigeración (el colágeno es más estable a 4 °C).
- Suspensión celular y preparación para siembra
Nota : para la línea de tiempo de referencia de referencia de este protocolo, esto corresponde al día de inmersión 1 (SD1)- Durante la gelificación de la ayuda acelular del colágeno, tripsinize y cuente las variedades de células endoteliales y del fibroblasto.
- Suspenda 7,5 x 105 células endoteliales y 7,5 x 104 fibroblastos en 258 μL de sus respectivos medios y combine suspensiones celulares para crear una alícuota de 516 μL. Mantenga las suspensiones de la célula en el hielo mojado hasta el uso.
- Preparar pipetas de desplazamiento positivo de 1000 y 250 μL para su uso y reservar. Como los pasos posteriores son sensibles al tiempo, es conveniente cargar puntas de pipeta y volúmenes de ajuste (375 μL y 250 μL, respectivamente). Además, configure una pipeta normal de 1000 μL para 516 μL.
- Sembrado de colágeno cargado de células del compartimento dérmico
- Después del período de gelificación, retire la placa de 12 pocillos de colágeno acelular de la incubadora.
NOTA: Si este colágeno no se gelifica después de 30 minutos, no continúe el procedimiento, ya que es probable que haya habido un error durante la siembra o que la reserva de colágeno pueda tener un problema (consulte la solución de problemas en la discusión). - Retire el tubo tapado de 1,7 mL del hielo húmedo (contiene 10x PBS y NaOH). Coloque el tubo en un bastidor para que el contenido sea visible. Afloje/abra todas las tapas (suspensión celular, tubo tapado en frío).
- Retire el colágeno común (8 mg/mL) de la refrigeración a 4 °C y colóquelo sobre hielo húmedo. Deje la tapa abierta.
- Agregue los 516 μL de suspensión de celda enfriada al tubo tapado en frío. Utilice la pipeta de desplazamiento positivo de 1000 μL para pipetear inmediatamente 375 μL de solución fría de colágeno directamente en la solución del tubo tapado.
- Expulse todo el colágeno de la pipeta en el tubo y deseche la punta de la pipeta de desplazamiento positivo. Cambie inmediatamente a la pipeta de desplazamiento positivo de 250 μL y mezcle la solución de colágeno.
- Mezcle la solución de colágeno como se completó anteriormente (rápidamente pero suavemente para evitar la formación de burbujas), no retire la punta del gel si es posible. Mezclar hasta que la solución sea homogénea (unos 5 ciclos de pipeta o 10 s). Al mezclar, asegúrese de dibujar desde diferentes posiciones del tubo (inferior y superior) para una mezcla uniforme.
- Una vez mezclado, transfiera inmediatamente 250 μL de solución de colágeno celular sobre los soportes de colágeno acelular en cada uno de los tres insertos de cultivo de 12 pocillos. Para asegurar una cobertura uniforme del soporte de colágeno acelular, mezcle el plato y / o use la pipeta de desplazamiento positivo para mover suavemente el colágeno celular recién sembrado sin alterar la capa acelular.
- Mueva inmediatamente la placa de 12 pozos a la incubadora de cultivo celular de 37 °C para dejarla gelificar durante al menos 30 min. Vuelva a colocar el colágeno en la refrigeración de 4 °C después de su uso.
- Después del tiempo de gel de 30 minutos, incline suavemente la placa para evaluar la gelificación. Asegúrese de que el colágeno se solidifique.
- Añadir 500 μL y 1000 μL de medios de mezcla (medio de mantenimiento mitad endotelial y mitad fibroblasto) a la cámara superior y la cámara inferior del inserto, respectivamente (primero arriba, luego abajo para evitar que la presión hidrostática empuje el colágeno hacia arriba). Agregue medios lentamente al lado del pozo, no directamente sobre el gel de colágeno, para minimizar la interrupción del colágeno.
- Asegúrese de que el gel de colágeno esté sumergido, agregue más medios si es necesario. Coloque la placa del pozo en la incubadora celular para la incubación durante la noche. En esta etapa, los medios contienen un 10% de FBS; los medios de mantenimiento normales para cada línea celular (línea de tiempo y esquema dados en la Figura 1,A).
NOTA: Los medios a través del cultivo de VHSE se pueden adaptar para tipos de celdas personalizadas; puede ser necesaria alguna optimización.
- Asegúrese de que el gel de colágeno esté sumergido, agregue más medios si es necesario. Coloque la placa del pozo en la incubadora celular para la incubación durante la noche. En esta etapa, los medios contienen un 10% de FBS; los medios de mantenimiento normales para cada línea celular (línea de tiempo y esquema dados en la Figura 1,A).
- Después del período de gelificación, retire la placa de 12 pocillos de colágeno acelular de la incubadora.
- Cambio de medios del Día 2 de sumersión (SD2)
- Cambiar 10% medios FBS en pozos VHSE a 5% FBS medio fibroblasto, mitad medio endotelial complementado con 100 μg/mL L-ácido ascórbico. Agregue 500 μL a la cámara superior del inserto de cultivo en el lado del pocillo (de nuevo, agregue cuidadosamente a la pared lateral para minimizar la interrupción del colágeno) y agregue 1000 μL a la cámara inferior.
- Renueve los medios cada 2 días (SD4 y SD6) hasta el Día 7 de inmersión (SD7).
- Utilice una pipeta manual para extraer los medios de los pozos. El uso de un aspirador es posible, pero puede resultar en daños o destrucción de la construcción.
NOTA: El ácido L-ascórbico debe ser compuesto fresco cada 2-3 días (se oxida en solución para producir peróxido de hidrógeno, induciendo así estrés oxidativo y eventualmente daño celular53). Así, los medios se deben cambiar cada 2-3 días del SD2 hasta el final de la cultura de VHSE puesto que el ácido L-ascórbico está presente. Es más fácil hacer un stock de medios y agregar una cantidad recién preparada de ácido L-ascórbico a una alícuota de medios todos los días de alimentación. Utilice agua o medio de grado de cultivo como disolvente y prepare ácido L-ascórbico fresco a 100 mg/mL. El ácido L-ascórbico estimula la síntesis de colágeno por fibroblastos a un ritmo adecuado y promueve la estabilidad del colágeno54,55,56; también disminuye la permeabilidad endotelial y mantiene la integridad de la pared del vaso56,57 y además contribuye a la formación de barreras epidérmicas6,58.
3. Siembra del componente epidérmico e inducción de estratificación
- Día 7 de la sumersión (SD7): queratinocitos de semillas
NOTA: Queratinocitos de semilla para establecer la epidermis en SD7. Este punto de tiempo se puede cambiar en función de las necesidades del investigador. La duración del cultivo de sumersión sin queratinocitos no debe exceder los 9 días, ya que una inmersión más larga a menudo conduce a un aumento de la contracción dérmica. Si la contracción ocurre antes de SD7, se recomienda acortar el período de sumersión a 5 días y la epidermis de la semilla en SD5. Optimice el período de sumersión según sea necesario para experimentos específicos (consulte la solución de problemas en la discusión).- Cultivar queratinocitos (N/TERT-120,59 u otras células apropiadas) hasta su límite de confluencia antes de la tripsinización y la siembra en VHSE. Para las células N/TERT-1, la confluencia no debe exceder significativamente el 30% para prevenir la diferenciación no deseada de los queratinocitos en cultivo 2D59. Para otras líneas celulares apropiadas, como los queratinocitos epidérmicos humanos primarios, generalmente se utiliza un límite de confluencia del 75-80%60.
- Después de la tripsinización, contar y suspender 510.000 células en 600 μL de equivalente de piel humana (HSE) medios de diferenciación suplementados con 5% FBS (Tabla 1).
NOTA: 510.000 células en 600 μL permite 170.000 celdas/construcción al sembrar 200 μL por constructo (3 VHSE). - Utilizando una pipeta manual, recoger y desechar los medios que se encuentran actualmente en la cámara inferior y superior para cada pozo de construcción. Asegúrese de recopilar tantos medios como sea posible. Recoja los medios que pueden quedar pegados directamente debajo de la membrana permeable colocando suavemente la punta de la pipeta debajo de la membrana del inserto de cultivo y golpeando el inserto fuera de su lugar temporalmente. Los medios de comunicación pueden haber estado atascados debido a la tensión superficial. Asegúrese de que las inserciones se sientan planas en sus pozos antes de continuar. El uso de un aspirador es posible, pero puede resultar en daños o destrucción de la construcción.
- Agregue 1 mL de medios HSE complementados con FBS al 5% a la cámara inferior de cada pozo. Luego agregue 200 μL de suspensión celular a la cámara superior de cada pozo. Semilla directamente sobre la superficie de construcción dérmica. Deje que los queratinocitos se conformen con 2 h en la incubadora.
- Dos h después de sembrar los queratinocitos, añadir cuidadosamente 300 μL de medios HSE suplementados con 5% de FBS a la cámara superior de cada pozo de construcción; medios de pipeteo lentamente en el lado del inserto de cultivo. Cargue los medios en la cámara superior con mucho cuidado para no molestar a los queratinocitos asentados que pueden no haberse adherido firmemente al gel de colágeno subyacente todavía.
- Después de cargar el medio, coloque la construcción de nuevo en la incubadora.
- Día de inmersión 8/9 (SD8 o SD9)
- Componen medios HSE complementados con 1% de FBS y 100 μg/mL de ácido L-ascórbico.
- Retire los medios de las cámaras superior e inferior con un pipettor manual.
- Agregue primero medios de 500 μL en la cámara superior y luego 1 mL en la cámara inferior. (Este paso se puede hacer en SD8 o SD9)
- Día de inmersión 9/10 (SD9 o SD10, este debe ser el día después del paso 3.2)
- Componer medios de diferenciación de HSE sin suero con 100 μg/mL de ácido L-ascórbico.
- Retire los medios de las cámaras superior e inferior con un pipettor manual.
- Cargue 500 μL en la cámara superior y 1 mL en la cámara inferior.
- Interfaz aire-líquido día 1 (ALI1)
NOTA: ALI se realiza el día después del paso 3.3.- Levante cada construcción a la interfaz aire-líquido (ALI) eliminando los desechos de medios de la cámara superior solamente. Use una pipeta manual para acercarse lo más posible a la capa epidérmica sin tocarla ni dañarla.
- Incline la placa ligeramente en diferentes ángulos para recoger el medio. Quite tantos medios como sea posible en este paso. Agregue aproximadamente 2 mL de agua estéril a los pozos circundantes en la placa para mantener una humedad constante; mantener los pozos llenos de agua durante toda la cultura.
- Compruebe la placa unas h más tarde para asegurarse de que los queratinocitos todavía están en la interfaz aire-líquido. Si hay medios en la cámara alta, retírelo. Lleve un registro de la cantidad de medios que se eliminan para cada pozo VHSE, (El volumen inicial de las cámaras superior e inferior (1500 μL) - medios eliminados = un buen punto de partida para la alimentación de ALI).
NOTA: Las VHSE no requieren necesariamente el mismo nivel de medios para la elevación de aire; por lo general, si los VHSE se siembran juntos, entonces necesitan aproximadamente el mismo nivel de medios para la elevación de aire, pero este no siempre es el caso. Ajuste los volúmenes según sea necesario para mantener ALI, pero asegúrese de que los niveles de medios no sean tan bajos que los VHSE se sequen. Es más seguro ser cauteloso y eliminar pequeñas cantidades de medios diariamente hasta que se haya alcanzado un equilibrio entre la elevación de aire y la hidratación.
- ALI Día 2 (ALI2)
- A partir de este punto, sólo se utilizarán medios HSE sin suero complementados con 100 μg/mL de ácido L-ascórbico. Cambiar de medios en ALI Día 2 (ALI2). Si hay medios en la cámara superior, elimínelo y agréguelo a la cantidad de medios eliminados grabados previamente. Calcule el volumen de medios necesarios utilizando la ecuación del paso anterior. Por ejemplo: Si se quitaron 200 μL de medios de la cámara superior, agregue 1300 μL para establecer ALI (como 1500 μL - 200 μL = 1300 μL)
- Utilice el volumen calculado para cargar en la cámara inferior de cada pozo, luego coloque la placa de nuevo en la incubadora de células. Lleve un registro del volumen utilizado por día. Cuando se utilizan las cantidades de colágeno recomendadas en inserciones de cultivo de 12 pocillos, el rango habitual de valores de LPA cae entre 750 μL y 1300 μL. Por lo general, el volumen disminuye durante la maduración del cultivo y se vuelve constante alrededor de la semana 2/3 de LPA. Dependiendo de las características específicas de la referencia cultural, este número puede cambiar y debe optimizarse (como se describe en 3.4.2 - 4.1).
4. Mantenimiento rutinario del equivalente humano vascular de la piel
- Desde ali día 3 (ALI3) a través de la punto final de cultivo: Renovar los medios de la cámara baja cada 2-3 días utilizando medios de HSE sin suero con 100 μg/mL de ácido L-ascórbico. Continúe ajustando y rastreando el nivel de medios necesario en la cámara inferior para ALI como se describe en el Paso 3.5.2.
- Como la superficie epidérmica debe permanecer en contacto con el aire, compruebe y ajuste el nivel de medios diariamente hasta que se establezcan niveles de LPA consistentes. La capa epidérmica debe verse hidratada, no seca, pero no debe haber medios agrupados en la parte superior de la construcción. Las culturas con 8 semanas de ALI han proporcionado la morfología y la expresión más constantes; sin embargo, dependiendo de la aplicación, los cultivos de 4 a 12 semanas pueden ser apropiados. La duración del cultivo para diferentes condiciones de cultivo y celular puede necesitar ser optimizada.
NOTA: Cambiar de prensa lunes, miércoles, viernes es una buena práctica. Los VHSE están sanos durante el fin de semana, pero los medios deben cambiarse temprano el lunes y tarde el viernes. Después de completar por completo los pasos 1-4, la generación de un VHSE se ha completado. Los pasos 5 del protocolo son técnicas opcionales de procesamiento e imagen que se han optimizado para este tipo de construcción 3D.
5. Fijación y permeabilización de construcciones 3D
Nota : paso 5 se ha optimizado para técnicas de imagen específicas de esta construcción 3D que se describen en el resto del protocolo. Los pasos siguientes no son necesarios para generar un VHSE.
- Fijación/permeabilización
- Retire cuidadosamente todos los medios de las cámaras superior e inferior de cada pozo en el punto final del período de cultivo.
NOTA: La capa epidérmica es posiblemente frágil, maneje con cuidado y no ageje la epidermis con pipeteo agresivo. - Agregue paraformadehído al 4% (PFA) en PBS (pH 6.9) a la pared de la cámara superior (no directamente en la construcción) y luego a la cámara inferior, para pre-arreglar cada construcción. Añadir 1 mL por cámara y exponer durante 5 min a temperatura ambiente.
PRECAUCIÓN: PFA es peligroso y debe manejarse con cuidado y equipo de protección personal (EPP) apropiado, incluida la protección ocular. - Retire la solución de PFA al 4% después de 5 min y agregue la solución Triton X 100 al 0.5% en la solución de PFA al 4% a las cámaras superior e inferior como se describe en el paso anterior. Exponer durante 1 hora a temperatura ambiente; La construcción de VHSE no requiere un ambiente estéril a partir de ahora.
- Después de 1 hora, retire cuidadosamente la solución de permeabilización/fijación de ambas cámaras y lave la muestra 3 veces con 1x PBS.
- Almacenar muestras en PBS en refrigeración a 4 °C o manchar inmediatamente. Para almacenar las muestras, envuelva el plato en una envoltura de plástico y luego foil para minimizar la evaporación y la exposición a la luz
NOTA: Punto de pausa - Después de la fijación y la permeabilización, este procedimiento se puede pausar ya que las muestras son estables durante varias semanas si se preparan como se describe en el paso 5.1.5. Alternativamente, la tinción (como se describe en el paso 6) se puede completar inmediatamente después del paso 5.
- Retire cuidadosamente todos los medios de las cámaras superior e inferior de cada pozo en el punto final del período de cultivo.
6. Tinción inmunofluorescente de construcciones 3D
- Preparación de constructos
NOTA: Los VHSE manchan bien cuando se separan de la membrana porosa del inserto de cultivo; La separación de la membrana es también necesaria para la proyección de imagen un-obstruida y para permitir los volúmenes reducidos para la coloración.- Para preparar la construcción para la tinción inmunofluorescente, gire un inserto al revés y colócalo sobre su pozo en la placa del pozo (si el VHSE cae, caerá en el pozo con PBS) (Figura suplementaria 1A).
- Estabilice el inserto con una mano sobre el pozo mientras usa pórceps de punta fina y/o un cuchillo de precisión para cortar aproximadamente la mitad de la circunferencia de la membrana del inserto. Corte lo más cerca posible de la carcasa de plástico con una mano suave para evitar daños en la construcción de VHSE.
- Usando los pórceps de punta fina, agarre el borde de la aleta de la membrana cortada y desprenda suavemente la membrana porosa del inserto, así como la construcción VHSE. Haga esto con mucho cuidado y lentamente para evitar daños a la estructura de construcción de VHSE. Si la construcción VHSE se separa fácilmente, entonces debe caer en el pozo de abajo, si se queda atascado en el lado de la cámara, use los pórceps de punta fina o una pequeña cápula para moverlo al pozo. Tenga muy en cuenta la capa epidérmica, ya que suele ser frágil (Figura suplementaria 1A).
NOTA: A veces la membrana no se desprende fácilmente o se desprende en pedazos, si esto sucede, utilice las herramientas para separar cuidadosamente la membrana y la construcción de VHSE. Asegúrese de que los VHSE no se sequen durante este proceso sumergiendo en PBS, si es necesario. - Una vez que el VHSE esté en el pozo, deseche cualquier pieza restante de la membrana del inserto y mantenga la carcasa del inserto de cultivo en cada pozo para mantener los VHSE en una posición sumergida durante la tinción.
- tinción
NOTA: Las tinciones y la manipulación/manipulación y lavados asociados deben realizarse con la mayor suavidad posible, ya que los VHSE pueden ser frágiles. Si las porciones de la epidermis se levantan, las piezas se pueden teñir por separado; las capas superiores de la epidermis son frágiles y pasan por la descamación natural4,pero para el análisis es importante mantener la integridad tanto como sea posible.- Prepare las manchas de anticuerpos primarios elegidas en 700 μL de tampón de bloqueo por constructo (por lo general, todos los anticuerpos primarios pueden estar en la misma solución de tinción, pero esto debe confirmarse para nuevos anticuerpos). 700 μL funciona para un tamaño de 12 pozos, pero se puede ajustar para otros formatos de cultivo. Las concentraciones recomendadas de anticuerpos primarios y secundarios con la receta de tampón de bloqueo se dan en la Tabla 3 (la optimización puede ser necesaria).
- Retire cualquier PBS del pozo usando una pipeta manual, tenga cuidado de pipetear lejos de los VHSE (como los VHSE son flotantes, no se recomienda la extracción al vacío).
- Agregue la solución de tinción primaria a cada pozo y coloque la carcasa del inserto de cultivo en el pozo para mantener el VHSE sumergido en fluido (Figura suplementaria 1B). Envuelva la placa del pozo con una envoltura de plástico. Lámina y manchas durante 48 h en refrigeración a 4 °C sin agitación ni balanceo (el balanceo puede dañar la construcción de VHSE).
- Después de 48 h, preparar anticuerpos secundarios y manchas químicas en 700 μL de tampón de bloqueo (por pozo).
- Retire la carcasa del inserto de cultivo y la solución de tinción primaria y lave con 1x PBS, 3x durante 5 min antes de agregar la solución de tinción secundaria. Coloque la carcasa del inserto de cultivo de nuevo en el pozo para mantener la construcción de VHSE sumergida (Figura suplementaria 1B). Exponer durante 48 h en refrigeración a 4 °C sin agitación ni balanceo.
- Después de la exposición de 48 h, retire la solución de tinción con un pipettor manual y lave suavemente 3x con PBS; no pipetee el líquido directamente sobre los VSE, ya que pueden ser frágiles. Rehidrate con el exceso de PBS y coloque la carcasa del inserto de cultivo de nuevo en el pozo para mantener el VHSE sumergido e hidratado durante el almacenamiento (guárdelo envolviendo en una envoltura de plástico y papel de aluminio para minimizar la evaporación y la exposición a la luz)
- Compensación (opcional & terminal)
NOTA: La limpieza es opcional para la creación de imágenes. Si se completa, debe hacerse después de la tinción / imagen de la muestra por completo, ya que la limpieza impide una mayor tinción, puede alterar el rendimiento del fluoróforo y puede dañar la estructura de VHSE. Existen múltiples métodos de limpieza detejidos 49,61,62 y pueden optimizarse para proyectos específicos. El claro del salicilato metílico, descrito abajo, es simple y eficaz para VHSE. La siguiente técnica de limpieza debe completarse en recipientes de vidrio y las puntas de las pipetas deben ser de vidrio o polipropileno (el poliestireno se disolverá en contacto con el salicilato de metilo). Complete todo el procedimiento de limpieza en un área bien ventilada o campana extractora de humos.- Agregue 100% metanol a un pequeño recipiente de vidrio poco profundo (las placas de Petri de vidrio funcionan bien). Utilice el contenedor más pequeño posible que se ajuste a la construcción (para minimizar el desperdicio de reactivos).
- Retire la construcción de la placa del pozo usando fórceps /scoopula (Figura suplementaria 1C) y colótela en el recipiente lleno de metanol. Agregue más metanol si la construcción no está sumergida.
- Deshidratar la construcción de VHSE en metanol durante inmersiones de 3 x 10 min; reemplazar completamente el metanol después de cada inmersión y retirar rápidamente el metanol después del último baño. En el transcurso de este procedimiento, la construcción puede volverse más opaca y reducirse ligeramente.
NOTA: Estas duraciones y repeticiones se han optimizado, pero el metanol y los siguientes procedimientos de salicilato de metilo pueden necesitar ser personalizados, dependiendo del formato de cultivo específico y las manchas. - Inmediatamente después de retirar el metanol, añadir salicilato de metilo y sumergir el VHSE en inmersiones de 5 x 5 min. Substituya completamente el reactivo después de cada inmersión y deje el VHSE en la 5ª solución de inmersión para su almacenamiento. En el transcurso de este procedimiento, la construcción se vuelve transparente.
- Imagen de la construcción o almacén a 4 °C. Después de la limpieza, complete todas las imágenes tan pronto como sea posible, ya que los fluoróforos pueden degradarse en salicilato de metilo en cuestión de días. La limpieza hace que las construcciones se vuelvan frágiles y el almacenamiento prolongado, aunque no se recomienda, necesita una comprobación regular para asegurarse de que hay una cantidad suficiente de salicilato de metilo.
7. Imágenes confocales de construcciones 3D
NOTA: Las imágenes a través del plástico de cultivo de tejidos no producirán la misma calidad de imagen que las imágenes a través de vidrio de cubiertas, este método describe la fabricación de un pozo de fondo de vidrio personalizado para evitar el secado durante las imágenes confocales. Típicamente, esto es suficiente para por lo menos 3 h de proyección de imagen.
- Dos días antes de la toma de imágenes: preparar polidimetilsiloxano (PDMS)
- Preparar PDMS48,63,64 a una concentración sugerida de [9:1], base: reticulador. Preparar 30 g de PDMS total: 27 g de componente base y 3 g de reticulador. Coloque cualquier recipiente de mezcla limpio en una balanza de pesaje y tara la báscula. Añadir la base (27 g) y luego añadir el reticulador (3 g) para conseguir un total de 30 g. Agregue siempre la base antes del reticulador.
- Revuelva la solución vigorosamente durante al menos 4 min; esto creará pequeñas burbujas. Después de mezclar lo suficiente, vierta el PDMS en una placa de Petri de 100 mm, o un recipiente similar resistente al calor de fondo plano.
- Desgaste el PDMS en una cámara de vacío hasta que todas las burbujas de la mezcla desaparezcan y el PDMS esté claro. Suelte el vacío lentamente y retire el PDMS (lentamente). Colocar el plato en un horno para curar durante la noche (50-60 °C); asegúrese de que el plato esté sentado plano para que PDMS cure uniformemente.
NOTA: Después del curado, el PDMS debe ser transparente y la superficie debe ser lisa y no pegajosa (la pegajosidad puede indicar una mezcla inadecuada).
- Un día antes de la toma de imágenes: preparación del pozo PDMS
- Utilizando un punzón de acero o un cuchillo de precisión de mano, perforar o cortar un pozo circular de la hoja pdms preparada en 7.1. El pozo debe tener aproximadamente el mismo tamaño que la construcción de VHSE. Corte un parche cuadrado alrededor del pozo circular para crear un solo pozo PDMS. La cantidad de 30 g pdms preparada debe producir al menos cuatro pozos personalizados.
Nota : el pozo PDMS debe estar cerca del tamaño de la construcción VHSE. Debe restringir el movimiento de la muestra durante la toma de imágenes. Se pueden fabricar varios pozos a la vez y almacenarlos indefinidamente en un contenedor limpio. - Usando una cubierta de vidrio de un tamaño similar al pozo PDMS, agregue pegamento de cianocrilato (por ejemplo, súper pegamento) a la superficie inferior del PDMS (la superficie lisa que estaba en contacto con la placa de Petri) y unte uniformemente con una punta de pipeta desechable. Centro, y presione el PDMS bien sobre el vidrio mientras deja una ventana de vidrio transparente dentro del círculo perforado (asegúrese de que el pegamento no se unta sobre la ventana de visualización).
NOTA: Si está disponible, la unión plasmática del PDMS al cubrebocas es una alternativa65,66,67. - Deje secar el pegamento durante varias horas, o durante la noche, antes de usarlo. Estos son reutilizables hasta que rompen con el desgaste normal.
NOTA: No se recomienda manchar las muestras en el PDMS pegado bien utilizado para la proyección de imagen. Estos pozos retienen el líquido durante varias horas, pero pueden tener fugas durante las tinciones más prolongadas.
- Utilizando un punzón de acero o un cuchillo de precisión de mano, perforar o cortar un pozo circular de la hoja pdms preparada en 7.1. El pozo debe tener aproximadamente el mismo tamaño que la construcción de VHSE. Corte un parche cuadrado alrededor del pozo circular para crear un solo pozo PDMS. La cantidad de 30 g pdms preparada debe producir al menos cuatro pozos personalizados.
- Imágenes de VHSE
NOTA: Si las muestras de imágenes no están claras, use PBS como solución de imágenes. Si toma imágenes con muestras despejadas, use salicilato de metilo (o la solución de limpieza elegida) como solución de diagnóstico por imágenes.- Agregue unas gotas de solución de diagnóstico por imágenes en el pozo PDMS y compruebe si hay fugas (si hay una fuga, repare con un punto / frotis de súper pegamento de cianocrilato o use otro pozo).
- Mantenga bien la solución de imágenes en el PDMS al agregar el VHSE. Usando scoopula o fórceps de punta fina(Figura suplementaria 1C),retire la construcción de la placa de 12 pocillos y colóquela en el pozo PDMS en la cubierta de vidrio. Lugar de construcción con la orientación de interés hacia el objetivo. Por ejemplo, para obtener imágenes de la epidermis usando un microscopio invertido, asegúrese de que la epidermis esté mirando hacia abajo, hacia el vidrio.
- Alternativamente, para un microscopio vertical, enfrénte a la epidermis hacia arriba. Los procedimientos abajo de la proyección de imagen se describen para un microscopio invertido, pero se podrían adaptar fácilmente para un vertical.
NOTA: Tenga cuidado al manipular el VHSE para evitar daños. Transferir sobre la placa del pozo en caso de que el VHSE caiga. Una cápula de punta plana doblada es la forma más fácil de transferir la construcción (Figura suplementaria 1C).
- Alternativamente, para un microscopio vertical, enfrénte a la epidermis hacia arriba. Los procedimientos abajo de la proyección de imagen se describen para un microscopio invertido, pero se podrían adaptar fácilmente para un vertical.
- Asegúrese de que la muestra esté plana en el pozo y que no se doblen porciones de la epidermis o la dermis debajo de la muestra. Si se produce el plegamiento, manipule suavemente la muestra con las fuerzas o una cápula; agregar una solución de imágenes adicional temporalmente para flotar el VHSE puede ayudarlo a enderezar. El plegamiento o arrugado de la muestra se puede ver a simple vista o usando el microscopio.
- Llene el pozo con una solución de imágenes, usando el líquido suficiente para mantener la muestra hidratada; demasiado líquido flotará la muestra, lo que resulta en movimiento durante la toma de imágenes. La construcción debe estar sentada en la ventana de visualización de vidrio; prueba de movimiento inclinando bien el PDMS. Si hay movimiento, retire un poco de líquido; añadir y retirar la gota de líquido sabio hasta que el movimiento se detiene.
- Coloque un portaobjetos de vidrio sobre el pozo para minimizar la evaporación durante la toma de imágenes (Figura suplementaria 1D). Para sesiones de diagnóstico por imágenes más largas, revise la muestra con frecuencia para asegurarse de que los niveles de líquidos sean adecuados. Si es accesible, se puede utilizar una cámara humidificada durante la toma de imágenes (aunque normalmente no es necesaria).
- Coloque la muestra en la etapa del microscopio y la imagen a través de la ventana de la cubierta de vidrio (Figura suplementaria 1D). Esta técnica permite por lo menos 3 h de proyección de imagen confocal continua, pero la hidratación de la muestra se debe comprobar regularmente, con la solución de la proyección de imagen agregada cuando sea necesario.
NOTA: Si se elimina la muestra, el salicilato de metilo degradará el pegamento con el tiempo. El pegamento que une el PDMS se puede volver a aplicar entre las corridas de la proyección de imagen; o la muestra puede ser transferida a nuevos pozos periódicamente. En pozos con unión de plasma, esto no será un problema. - Después de la toma de imágenes, flotar la muestra con líquido de imágenes tanto como sea posible en el pozo. Utilice una cápula o un pórceps de punta fina para transferir la muestra a su pozo de almacenamiento. Realice la transferencia sobre una placa de pozo en caso de que la muestra caiga.
- Cada pozo PDMS y cubiertas de vidrio superior se pueden reutile utilizar hasta que se rompan. Limpie el vidrio inferior antes de tomar imágenes, tanto dentro como fuera del pozo. Antes de volver a usar, siempre verifique si hay fugas y repare con pegamento, según sea necesario.
- Almacene las muestras como se describe en el paso 6.3.6 y agregue PBS cada pocos meses para mantener; si las muestras se eliminan, almacenar en vidrio con salicilato de metilo y comprobar los niveles con regularidad. Las muestras borradas pueden degradarse rápidamente (en cuestión de días) y deben ser fotogradas tan pronto como sea posible.
Resultados
Aquí se presenta un protocolo para la generación de equivalentes de piel humana vascularizados in vitro (VHSE) utilizando transcriptasa inversa de telomerasa (TERT) queratinocitos inmortalizados (N/TERT-120,59),fibroblastos dérmicos humanos adultos (hDF), y células endoteliales microvasculares humanas (HMEC-1)(Figura 1). Además, la naturaleza personalizable de este protocolo se destaca al demostrar también la generación de VHSE y la estabilidad cuando se utilizan fibroblastos pulmonares comúnmente disponibles (IMR90) en lugar de hDF. La generación del VHSE se completa en los pasos 1-4, mientras que los pasos 5-7 son técnicas opcionales de procesamiento de imágenes y punto final que se optimizaron para estos VHSE. Es importante tener en cuenta que los VHSE se pueden procesar de acuerdo con preguntas de investigación específicas y los pasos 5-7 no son necesarios para generar la construcción. La proyección de imagen volumétrica, el análisis, y las representaciones 3D fueron terminados para demostrar un método volumétrico del análisis. Estos protocolos volumétricos de preparación e imágenes de construcción preservan la estructura VHSE tanto a nivel microscópico como macroscópico, lo que permite un análisis 3D completo.
La caracterización de la epidermis y la dermis muestran marcadores inmunofluorescentes apropiados para la piel humana en las construcciones de VHSE(Figura 2,3). La citoqueratina 10 (CK10) es un marcador de queratinocitos de diferenciación temprana que suele marcar todas las capas suprabasales en equivalentes cutáneos18,30,68 (Figura 2). La involucrina y la filaggrina son marcadores de diferenciación tardía en queratinocitos y marcan las capas suprabasales superiores en equivalentescutáneos 12,30,68,69 (Figura 2). Se utilizó un colorante nuclear fluorescente de color rojo lejano (ver lista de materiales) para marcar núcleos tanto en la epidermis como en la dermis, con Col IV marcando la vasculatura de la dermis(Figura 2, Figura 3, Figura 4). Los componentes epidérmicos de la membrana basal (BM) no siempre se expresan adecuadamente en los cultivos de HSE15,16; y la coloración del col IV del BM no se observa constantemente usando este protocolo. Los componentes y la estructura de BM centrados en la investigación se beneficiarían de la optimización adicional de medios, células e imágenes14.
Aunque la proyección de imagen confocal a través del bulto de las culturas de VHSE rinde a menudo las imágenes de alta resolución que son suficientes para el análisis de cómputo de la dermis y de la epidermis, el método del claro descrito permite proyección de imagen más profunda del tejido. El despeje mejora la profundidad de penetración del láser confocal, y las imágenes efectivas en VHSE se pueden lograr a más de 1 mm para muestras despejadas (en comparación con ~ 250 μm para las no aclaradas). La técnica de limpieza descrita (deshidratación de metanol y salicilato de metilo) coincide suficientemente con el índice de refracción en todo el tejido de la muestra de VHSE61. La limpieza de la VHSE permitió obtener imágenes directas a través de todo el constructo sin manipulación (por ejemplo, reorientando el constructo para obtener imágenes de la dermis y la epidermis por separado), (Figura 3).
Las imágenes volumétricas permiten la generación de renderizado 3D para mapear la vasculatura a lo largo de cada construcción (Figura 4). Brevemente, los sistemas confocales de la imagen fueron tomados en cutáneo a la orientación epidérmica de varios sub-volúmenes de VHSEs para detectar la mancha del colágeno IV (paredes del recipiente de la marca) y los núcleos (marcados por un tinte nuclear fluorescente lejos-rojo). Las pilas de imágenes se cargan en software computacional (ver lista de materiales) y se utiliza un algoritmo personalizado (basado en estas fuentes 48,70,71, 72,73,74,75)para la representación y cuantificación 3D como se describió anteriormente48. Este algoritmo segmenta automáticamente el componente vascular basado en la mancha col IV. La segmentación volumétrica se pasa a un algoritmo de esqueletización basado en la marcha rápida75,76,77. La esqueletización encuentra el centro definitivo de cada vaso marcado col IV y los datos resultantes se pueden utilizar para calcular el diámetro del vaso, así como la fracción vascular (Figura 4). La microscopía fluorescente widefield es una opción accesible si la microscopia de barrido láser no está disponible; la red vascular y la epidermis se pueden foto fotor con microscopía fluorescente de campo ancho (Figura suplementaria 2). La cuantificación tridimensional es posible utilizando imágenes de campo ancho de VHSE en lugar de microscopía de barrido láser, aunque puede requerir más filtrado y deconvolución de imágenes debido a la luz fuera del plano.
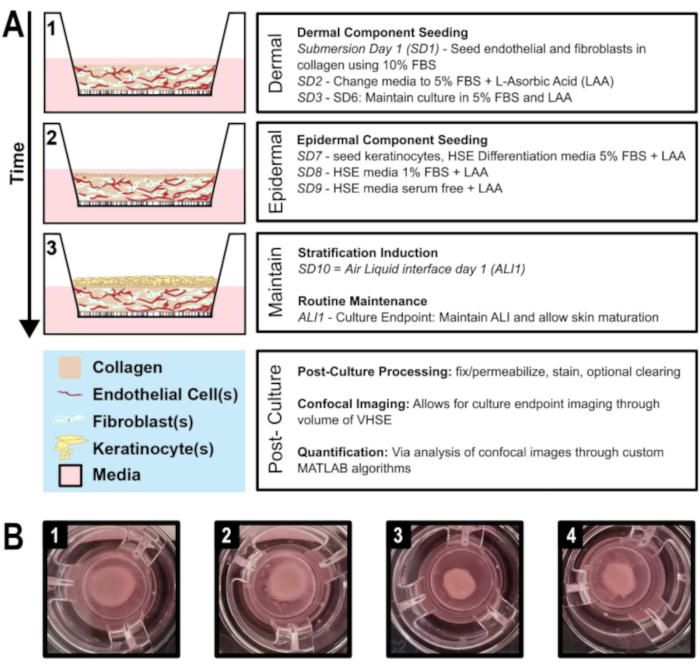
Figura 1:Línea de tiempo esquemática de la generación equivalente de piel humana vascularizada. A) Muestra la progresión del modelo VHSE a partir de 1) siembra de componentes dérmicos, 2) siembra de queratinocitos sobre el componente dérmico, 3) estratificación epitelial a través de la interfaz de líquido de aire y el mantenimiento del cultivo. El procesamiento posterior al cultivo y las imágenes volumétricas se pueden realizar en el punto final del cultivo. B) Imágenes de cámara de la macroestructura HDF VHSE en los insertos de cultivo en su punto final de cultivo, 8 semanas. Varios niveles de contracción son normales para los VHSE; la contracción se puede reducir como el protocolo describe. (1 & 2) Muestras menos contratadas. (3 & 4) Las muestras más contratadas todavía producen elementos adecuados de la piel. Haga clic aquí para ver una versión más amplia de esta figura.
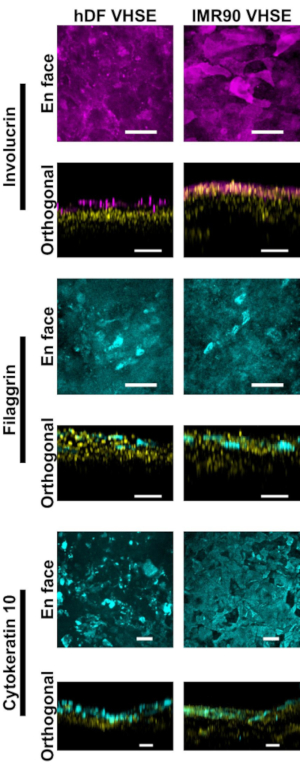
Figura 2: Caracterización epidérmica mediante marcadores inmunofluorescentes. Todas las imágenes fueron tomadas de VHSEs en el timepoint de la cultura de 8 semanas vía microscopia confocal. Los métodos de tinción correspondientes se describen en el paso 6 del protocolo. Los marcadores epiteliales apropiados están presentes en los VHSE del hDF (columna izquierda) y los VHSEs IMR90 (columna derecha). Involucrin y Filaggrin son marcadores tardíos de la diferenciación de keratinocytes y demuestran que la epidermis está estratificada completamente en ambos tipos de VHSE. Cytokeratin 10 es un marcador temprano de la diferenciación que está identificando capas suprabasal en los VHSEs. Los núcleos se muestran en vistas ortogonales en amarillo. Las imágenes de proyección máximas en cara y ortogonales se renderizaron a través de software computacional; Las imágenes se escalan individualmente con resta de fondo y filtrado mediano para mayor claridad. Las barras de escamas son de 100 μm. (Los anticuerpos primarios y secundarios con receta interna de tampón de bloqueo se dan en la Tabla 3). Haga clic aquí para ver una versión más amplia de esta figura.
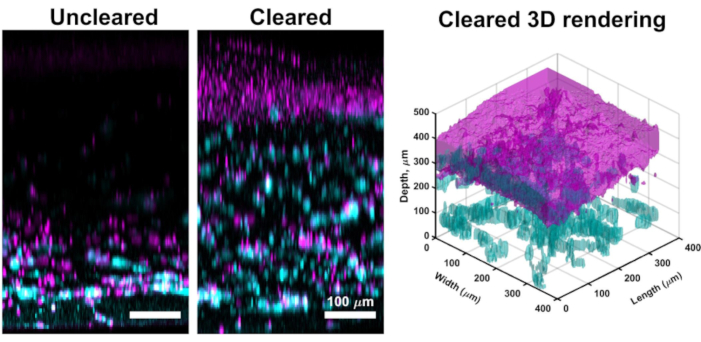
Figura 3: Comparación de VHSE no aclarado vs. Este VHSE fue generado con IMR90s y las imágenes fueron tomadas en el timepoint de la cultura de 4 semanas vía microscopia confocal. El colágeno IV se muestra en cian; Los núcleos se muestran en magenta; magenta en la representación 3D despejada representa la consolidación de núcleos en la capa epidérmica del VHSE. La imagen de VHSE no aclarada es un ejemplo de atenuación láser en construcciones de VHSE más gruesas, a través de la limpieza (metanol y salicilato de metilo) toda la construcción se puede fotograficionar con poca / ninguna atenuación láser desde el lado dérmico de la construcción. Las configuraciones de la proyección de imagen incluyendo la línea del laser, el aumento, y el agujero de alfiler fueron bajados para que VHSE despejado reduzca la sobresaturación. El claro y la proyección de imagen fueron terminados según lo descrito en los pasos 6 y 7 en el protocolo. Las imágenes de proyección máxima ortogonal y el renderizado 3D se completaron con software computacional, el renderizado 3D se generó a partir de imágenes de construcción borradas. Las imágenes se escalan individualmente con resta de fondo y filtrado mediano para mayor claridad. Las barras de escala son de 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
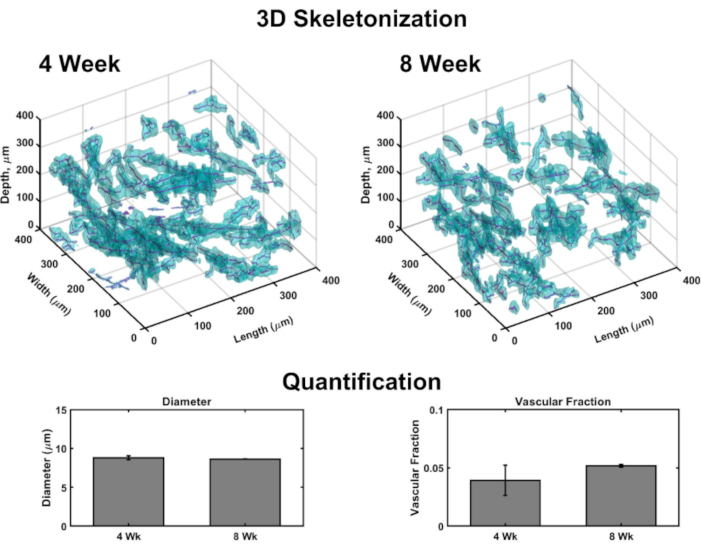
Figura 4: Análisis tridimensional de la vasculatura dentro de las VHSE. Las imágenes volumétricas tomadas vía microscopia confocal permiten la cuantificación de parámetros vasculares en los puntos finales de cultivo a través del análisis computacional de imágenes. A partir de sub-volúmenes VHSE, la detección de la tinción de colágeno IV (cian) marca las paredes endoteliales de la vasculatura y permite la segmentación de vascular en función de la ubicación del colágeno IV; los datos de segmentación se esqueletizan y se encuentra el centro de cada recipiente (magenta). Se muestran ejemplos de esqueletización 3D para muestras de VHSE IMR90 de 4 semanas y 8 semanas, sin borrar. Los datos resultantes de un conjunto de experimentos de VHSE IMR90 se utilizaron para calcular los diámetros de los vasos y las fracciones vasculares para cuatro sub-volúmenes (cada uno de 250 μm en la dirección z) dentro de cada constructo, los datos se promediaron por VHSE y se promediaron aún más por punto de tiempo de cultivo. Estos datos muestran la homeostasis de la red vascular que abarca duraciones de cultivo de 4 y 8 semanas con diámetros relevantes para la piel humana in vivo78,y la fracción vascular dentro del mismo orden que la piel humana in vivo79 (la fracción vascular en construcciones de colágeno se ha demostrado que es personalizable48 y podría optimizarse aún más para el aumento de los valores). Los datos se representan como medias ± media de error estándar (S.E.M); n = 3 para cada punto de tiempo. Haga clic aquí para ver una versión más amplia de esta figura.
| Medio | Componentes |
| Línea celular de fibroblastos dérmicos humanos (hDF) | DMEM hectogramo |
| 5% Suero Fetal Bovino (FBS) | |
| 1% Penicilina/Estreptomicina (P/S) | |
| Línea celular de fibroblastos IMR90 | DMEM/HAM'S F12 50:50 |
| 10% FBS | |
| 1% P/S | |
| Línea celular endotelial HMEC-1 | MCDB131 Medio base |
| 10% FBS | |
| 1% P/S | |
| L-Glutamina [10 mM] | |
| Factor de crecimiento epidérmico (EGF) [10 ng/mL] | |
| Hidrocortisona [10 μg/mL] | |
| Línea celular de queratinocitos N/TERT-1 | Base de medios K-SFM |
| 1% P/S | |
| Extracto pituitario bovino (BPE) [25 μg/mL], del kit del suplemento de K-SFM | |
| Factor de crecimiento epidérmico (EGF) [0.2 ng/mL], del kit de suplemento de K-SFM | |
| CaCl2 [0,3 mM] | |
| Diferenciación equivalente a la piel humana (HSE) | 3:1 DMEM: F12 de Ham |
| 1% P/S | |
| 0,5 μm hidrocortisona | |
| 0,5 μM Isoproterenol | |
| 0,5 μg/mL insulina |
Tabla 1: Recetas de medios. Las recetas de los medios para la cultura 2D de los fibroblastos cutáneos humanos, de los fibroblastos IMR90, de HMEC-1, y de los keratinocytes N/TERT-1 se dan. Estas recetas se utilizaron para expandir las líneas celulares antes de generar VHSE. Los medios de diferenciación equivalentes a la piel humana (HSE) se utilizan para generar VHSE; se da una receta base, durante las porciones de cultivo de sumersión y la inducción de estratificación, se deben agregar cantidades ahusadas de FBS como se describe en el paso de protocolo 3. Receta de HSE basada en estas fuentes11,80.
| Concentración de cepas de colágeno (Cs) : | 8 | mg/mL | ||
| Volumen deseado (Vf): | 1 | Ml | ||
| Normalización del ajuste naOH*: | 1 | éxtasis | ||
| *Cada lote de colágeno necesita ser probado para determinar la cantidad de NaOH necesaria para establecer el pH 7 - 7.4 | ||||
| Concentración de colágeno deseada (mg/mL) | ||||
| 2 | 3 | 4 | 5 | |
| 10X PBS (Vpbs) | 0.1 | 0.1 | 0.1 | 0.1 |
| Caldo de colágeno (Vs) | 0.25 | 0.375 | 0.5 | 0.625 |
| 1N NaOH (VNaOH) | 0.00575 | 0.008625 | 0.0115 | 0.014375 |
| Medios (Vmedios) | 0.64425 | 0.516375 | 0.3885 | 0.260625 |
Tabla 2:Tabla de referencia de cálculo de colágeno. La tabla de referencia da concentraciones de colágeno comúnmente deseadas calculadas suponiendo una concentración de cepa de colágeno de 8 mg/mL y un volumen final deseado de 1 mL; todos los valores están en mL. Las ecuaciones utilizadas para calcular estas cantidades se dan en el paso de protocolo 2.2. Es importante comprobar el pH de cada cepa de colágeno; si es necesario, se deben agregar cantidades de NaOH para lograr pH 7 - 7.4 (después de que se agregue PBS, NaOH, stock de colágeno, medios). El protocolo se ha optimizado para VHSE usando una concentración del colágeno de 3 mg/mL; los cambios en la concentración de colágeno pueden ser necesarios para diferentes líneas celulares/resultados finalesdeseados 48.
| Anticuerpo primario | fuente | concentración | uso |
| Filaggrin (AKH1) ratón igg monoclonal | Santa Cruz; sc-66192 (200 μg/mL) | [1:250] | Marcador de diferenciación tardía15 |
| Involucrina conejo policlonal IgG | Proteintech; 55328-1-AP (30 μg/150 μL) | [1:250] | Marcador de diferenciación terminal tardía15 |
| Cytokeratin 10 (DE-K10) ratón IgG, sobrenadante | Santa Cruz; Sc-52318 | [1:350] | Marcador epidérmico suprabasal14,36,59 |
| Colágeno IV conejo policlonal | Proteintech; 55131-1-AP | [1:500] | Pared vascular endotelial67 |
| DRAQ 7 | Señalización celular; 7406 (0,3 mM) | [1:250] | Marcador nuclear |
| Anticuerpo secundario | fuente | concentración | uso |
| Cabra Anti-Conejo IgG DyLight™ 488 Conjugado | Invitrogen; 35552 (1 mg/mL) | [1:500] | Colágeno IV secundario |
| Anticuerpo Anti-Conejo IgG (H&L) (GOAT), DyLight™ 549 Conjugado | Rockland Immunochemicals; 611-142-002 | [1:500] | Involucrina secundaria |
| Cabra Anti-Ratón IgG (H&L), DyLight™ 488 | Termocientífico; 35502 (1 mg/mL) | [1:500] | Filaggrin o Cytokeratin 10 secundario |
| BÚFER DE BLOQUEO (500 mL) | |||
| Reactivo | importe | ||
| ddH2O | 450 mL | ||
| 10 x PBS | 50 mL | ||
| Albúmina sérica bovina (BSA) | 5 g | ||
| Preadolescente 20 | 0,5 mL | ||
| Gelatina de pescado de agua fría | 1 g | ||
| Azida de sodio (10% azida de sodio en diH2O) | 5 mL (concentración final del 0,1 %) | ||
Tabla 3: Anticuerpos primarios y secundarios con receta de tampón de bloqueo. Los anticuerpos y manchas químicas enumerados se utilizaron para la tinción que se muestra en la Figura 2, Figura 3, Figura 4. La coloración fue completada según lo dado en el paso 6 del protocolo usando la receta del buffer de bloqueo enumerada aquí. Algunas optimizaciones de las concentraciones de tinción y la duración pueden ser necesarias dependiendo de las técnicas de cultivo elegidas y las líneas celulares.
Tabla suplementaria 1: Lista de abreviaturas. Lista de abreviaturas incluida para la comodidad del lector. Haga clic aquí para descargar esta tabla.
Figura complementaria 1:Ayuda técnica VHSE para la manipulación. El manejo de VHSE es un desafío, especialmente durante la fijación, el procesamiento y la tinción. A-D corresponde a las instrucciones de los pasos 5-7. A muestra el manejo técnico de la eliminación de la membrana porosa de un inserto de cultivo para asegurar una tinción adecuada. B muestra cómo mantener cada VHSE sumergido durante la tinción y el almacenamiento. C muestra la forma más segura y fácil de mover construcciones a pozos de imágenes PDMS. D muestra un VHSE sentado en un pozo de imágenes PDMS: el pozo PDMS está pegado a una diapositiva de vidrio en la parte inferior, creando una ventana para la toma de imágenes, una diapositiva de vidrio se coloca en la parte superior para mantener la humedad a través de largas corridas de imágenes. Haga clic aquí para descargar este archivo.
Figura suplementaria 2:La microscopía de fluorescencia estándar de campo ancho se puede utilizar para evaluar las VHSE. Las imágenes de campo ancho se pueden utilizar para la obtención de imágenes volumétricas para la evaluación de rutina cuando la microscopía de barrido láser no está disponible. Como ejemplo, las imágenes de VHSE de los aspectos apicales y basolaterales se muestran como proyecciones máximas en cara y ortogonales (Ortho.). (Arriba) La epidermis fue fotoda usando el involucrin y los núcleos como marcadores. (Abajo) La vasculatura cutánea fue fotoda usando el colágeno IV como marcador. Las imágenes se restan de fondo para mayor claridad. La luz fuera del plano conduce a los artefactos de "rayas" o "llamaradas" evidentes en las vistas ortogonales. Las imágenes de campo ancho se pueden utilizar para la cuantificación, pero pueden requerir más procesamiento de imágenes. Haga clic aquí para descargar este archivo.
Discusión
Este protocolo ha demostrado un método sencillo y repetible para la generación de VHSE y su análisis tridimensional. Es importante destacar que este método se basa en pocas técnicas especializadas o piezas de equipo, por lo que es accesible para una amplia gama de laboratorios. Además, los tipos de células pueden ser reemplazados con cambios limitados en el protocolo, lo que permite a los investigadores adaptar este protocolo a sus necesidades específicas.
La gelificación adecuada del colágeno es un paso desafiador en el establecimiento de la cultura de la piel. Especialmente cuando se usan preparaciones crudas sin purificación, los contaminantes traza podrían influir en el proceso de gelificación. Para ayudar a garantizar la consistencia, se deben realizar grupos de experimentos con el mismo stock de colágeno que se utilizará para la generación de VHSE. Además, la gelificación idealmente debe ocurrir a un pH de 7-7.4, y los contaminantes traza pueden cambiar el pH. Antes de usar cualquier caldo de colágeno, se debe hacer un gel acelular de práctica en la concentración deseada y se debe medir el pH antes de la gelificación. Completar este control de calidad del colágeno antes de comenzar la siembra de componentes dérmicos identificará los problemas con la gelificación adecuada y la homogeneidad del colágeno antes de establecer un experimento completo. En lugar de sembrar colágeno acelular directamente sobre un inserto de cultivo, sembra un poco de colágeno en una tira de pH que evalúa toda la escala de pH y verifica un pH de 7-7.4. La gelificación se puede evaluar aplicando una gotita de la solución de gel de colágeno sobre una placa de pozo de plástico de cultivo de cubrebocas o tejido (se recomienda una placa de pozo para simular los lados confinados de un inserto de cultivo). Después del tiempo de gelificación, el colágeno debe ser sólido, es decir, no debe fluir cuando la placa está inclinada. Bajo microscopía de contraste de fase, el colágeno debe verse homogéneo y claro. Las burbujas ocasionales de la siembra de colágeno son normales, pero las grandes manchas amorfas de colágeno opaco dentro del gel transparente indican un problema probablemente debido a una mezcla insuficiente, un pH incorrecto y / o la falta de mantener el colágeno enfriado durante la mezcla.
Las cantidades y los medios de siembra celulares se pueden ajustar. En el protocolo anterior, las cantidades de células encapsuladas se han optimizado para un inserto de 12 pocillos a 7,5 x10 4 fibroblastos y 7,5 x10 5 células endoteliales por mL de colágeno con 1,7 x 105 queratinocitos sembrados en la parte superior de la construcción dérmica. Las densidades celulares se han optimizado para este protocolo VHSE en base a los estudios preliminares y a las investigaciones previas que investigan la generación de redes vasculares 3D en diversas concentraciones de colágeno48 y HSE de generación22,80,81. En sistemas similares, las densidades endoteliales publicadas de la célula son 1,0 x 106 células/mL colágeno48; las concentraciones del fibroblasto se extienden a menudo a partir de la 0,4 x10 5 células/mL del colágeno22,28,82 a 1 x 105 células/mL del colágeno8,58,83,84,85; y las concentraciones de queratinocitos oscilan entre 0,5 x10 5 [células/cm2]80 a 1 x 105 [células/cm2]8. Las densidades celulares se pueden optimizar para células específicas y preguntas de investigación. Los cultivos tridimensionales con células contráctiles, como los fibroblastos, pueden contraerse, lo que conduce a la reducción de la viabilidad y a la pérdida del cultivo86,87. Los experimentos preliminares se deben terminar para probar la contracción del compartimiento cutáneo (que puede ocurrir con más células cutáneas, más células cutáneas contráctiles, culturas de sumersión más largas, o matrices más suaves) y para probar la cobertura superficial epidérmica. Además, el número de días en la sumersión y el índice de ahusamiento el contenido del suero se pueden también personalizar si la contracción cutánea excesiva está ocurriendo o una diversa tarifa de cobertura del keratinocyte se requiere. Por ejemplo, si la contracción se nota durante el período de sumersión dérmica o mientras queratinocitos están estableciendo una monocapa superficial, moviéndose más rápidamente a través del proceso de ahusado sérico y elevando los VHSE a ALI puede ayudar a prevenir la contracción adicional. Del mismo modo, si la cobertura de queratinocitos no es ideal, cambiar el número de días que el VHSE está sumergido sin suero puede ayudar a aumentar la cobertura de monocapa epidérmica y mitigar la contracción ya que el suero se deja fuera. Los cambios en las densidades celulares u otras sugerencias anteriores deben optimizarse para los cultivos específicos y los objetivos de investigación.
Para establecer una estratificación adecuada de la epidermis durante el período de interfaz de líquido de aire (ALI), es fundamental verificar y mantener regularmente los niveles de líquido en cada pozo para que ali y la hidratación adecuada de cada construcción se mantiene a lo largo de la longitud del cultivo. Los niveles de medios deben ser revisados y rastreados diariamente hasta que se establezcan niveles de ALI consistentes. La capa epidérmica debe verse hidratada, no seca, pero no debe haber piscinas de medios en la construcción. Durante ALI, la construcción desarrollará un color blanco / amarillo opaco que es normal. La capa epidérmica probablemente se desarrollará de manera desigual. Comúnmente, los VHSE están inclinados debido a la siembra de colágeno o contracción dérmica. También es normal observar una porción epidérmica más alta en el medio de la construcción en construcciones más pequeñas (tamaño de 24 pozos) y una formación de cresta alrededor del perímetro del VHSE en tamaño de 12 pozos. La contracción de lasconstrucciones 13 puede cambiar estas formaciones topográficas, y/o puede no ser observada en absoluto.
La coloración y la proyección de imagen de VHSEs introducen la manipulación mecánica a los VHSEs. Es muy importante planificar y limitar la manipulación de cada cultura. Cuando la manipulación sea necesaria, mantenga movimientos suaves al retirar los VHSE de las membranas de inserción, al agregar soluciones de tinción o lavado a la superficie de construcción y al retirar y reemplazar los VHSE en sus pozos de almacenamiento/imágenes durante la preparación de la imagen. Específicamente, las capas apicales del componente epidérmico pueden ser frágiles y están en riesgo de desprenderse de las capas epidérmicas basales. Las capas apicales de la epidermis son frágiles y pasan por descamación incluso en el tejido nativo4,pero para un análisis preciso de la estructura epidérmica es importante minimizar el daño o la pérdida. Si las capas epidérmicas se levantan de la construcción, se pueden obtener imágenes por separado. Las capas basales de la epidermis probablemente todavía están unidas a la dermis, mientras que partes de las capas apicales pueden desprenderse. Para la visualización de la epidermis, una mancha nuclear es provechosa en la observación de esto puesto que los núcleos densos son una característica de capas más bajas y medias de la epidermis.
La proyección de imagen confocal de la post-fijación de VHSE se ha discutido en el protocolo, pero es también posible tomar imágenes de los VHSE a través de la cultura vía la tomografía óptica vertical de la coherencia (OCT)88,89,90,91,92,93. Los VHSE son lo suficientemente estables como para soportar imágenes sin incubación ni humidificación durante al menos dos horas sin efectos notables. Como la OCT está libre de etiquetas y no es invasiva, es posible rastrear el grosor epidérmico durante la maduración. Otras modalidades no invasores de la proyección de imagen se pueden emplear probablemente también.
La proyección de imagen volumétrica de las estructuras cutáneas y epidérmicas combinadas puede ser desafiadora debido a la atenuación del laser más profundamente en el VHSE. Esto puede ser mitigado por la proyección de imagen del constructo en dos orientaciones, del lado epidérmico (Figura 1) y del lado cutáneo (Figura 2), permitiendo una buena resolución de las estructuras vasculares dérmicas y de la epidermis. Además, la muestra se puede borrar, lo que permite imágenes volumétricas de toda la estructura con una atenuación mínima. Varios métodos del claro fueron intentados, sin embargo, el método del salicilato del metanol/del metílico descrito rindió los mejores resultados. Los investigadores interesados en optimizar otros métodos de compensación se dirigen hacia estas revisiones49,61,62. Si se limpia, se sugiere obtener una imagen completa de la muestra antes de la limpieza, ya que el método puede dañar los fluoróforos y / o la estructura. Además, la proyección de imagen se debe terminar tan pronto como sea posible después del claro, pues la fluorescencia puede desvanecerse en cuestión de días.
Por motivos de simplicidad y accesibilidad, este protocolo utilizó las mezclas de medios más simples encontradas en la literatura anterior11,80. Aunque hay muchas ventajas en el uso de mezclas de medios simples, también se reconocen las limitaciones de esta opción. Otros grupos han estudiado los efectos de componentes específicos de los medios sobre la salud epidérmica y dérmica y han encontrado que otros aditivos de medios94,como los ácidos grasos/lípidos libres externos, mejoran el estrato córneo de la epidermis y mejoran la función de barrera cutánea. Aunque nuestros marcadores inmunofluorescentes muestren la diferenciación y la estratificación apropiadas en la epidermis, dependiendo de los estudios que son conducidos, la optimización adicional de los medios puede ser necesaria. Además, un análisis extenso del BM epidérmico no fue conducido al evaluar los VHSE presentados aquí. La integridad del BM es una indicación importante de los equivalentes de la piel; diversos grupos han realizado investigaciones sobre la duración del cultivo y su efecto sobre las marcas de BM95, así como análisis de la presencia de fibroblastos y efectos añadidos del factor de crecimiento sobre la expresión de BM14. Es importante tener en cuenta que el análisis del componente BM debe evaluarse y optimizarse cuando se utiliza este protocolo.
En este protocolo se describe un procedimiento para la generación de VHSE, demostrando resultados después de 8 semanas en ALI. Los cultivos de VHSE se han cultivado hasta 12 semanas en ALI sin cambios notables o pérdida de viabilidad, y es posible que puedan ser viables por más tiempo. Importantemente, este protocolo es fácilmente adaptable a los tipos comúnmente disponibles de la célula, según lo demostrado por el reemplazo de fibroblastos cutáneos por los fibroblastos del pulmón IMR90. Dependiendo de la necesidad del investigador y los recursos disponibles, los tipos de células y las mezclas de medios en el cultivo se pueden ajustar, aunque los tipos de células más disímiles pueden requerir la optimización de medios. En resumen, estos procedimientos están destinados a proporcionar claridad sobre el cultivo de VHSE para el estudio de la biología de la piel y la enfermedad. Para maximizar la accesibilidad, el protocolo se desarrolló de manera simple y robusta utilizando equipos comunes, líneas celulares y reactivos como un enfoque efectivo mínimo que se puede personalizar aún más a las necesidades específicas de los estudios de investigación.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen al Dr. Jim Rheinwald59 y a la Dra. Ellen H. van den Bogaard20 por su generoso regalo de líneas celulares N/TERT. Este trabajo fue apoyado por la Asociación Americana del Corazón (19IPLOI34760636).
Materiales
| Name | Company | Catalog Number | Comments |
| 1 N NaOH | Fisher Chemical | S318-100 | (Dilute from Lab stock) |
| 4% Paraformaldehyde | ACROS Organics | #41678-5000, Lot # B0143461 | Made up using solid Paraformaldehyde in PBS, pH adjusted to 6.9 |
| Autoclaved forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| CaCl2 | Fisher bioreagents | Cat # BP510-250, Lot # 190231 | Rnase, Dnase, Protease-Free |
| Cell line, Endothelial: Microvascular Endothelial Cell (HMEC1) | ATCC | CRL-3243 | SV40 Immortalized microvascular endothelial cell. Note that 750,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: dermal Human fibroblast, adult | ATCC | PCS-201-012 | Primary dermal cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: human lung firbroblast (IMR90) | ATCC | CCL-186 | Primary embryonic cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Keratinocyte: N/TERT-1 | Immortalized via hTERT expression. N/TERT-1 was made using a retroviral vector conferring hygromycin resistance. Cell line established by Dickson et al. 2000. Can be replaced with ATCC PCS-200-010 or PCS-200-011. Note that 170,000 cells were used per construct; N/TERT1 cells must be used from plates that are 30% confluent- two 30% confluent 90 mm tissue culture dishes give more than enough cells.The authors thank Dr. Jim Rheinwald and Dr. Ellen H. van den Bogaard for their generous gift of N/TERT cell lines. | ||
| Centrifuge | Thermo Scientific; Sorvall Legend X1R | (standard lab equipment) | |
| Computational Software | MATLAB | MATLAB 2020a | MathWorks, Natick, MA. |
| Confocal Microscope | Leica TCS SPEII confocal | Laser scanning confocal. Can be replaced with other confocals or deconvolution microscopy. | |
| Cover Glass (22 x 22) | Fisher Scientific | 12-545F | 0.13-0.17 mm No.1 Thickness |
| Cyanoacrylate super glue or silicone grease | Glue Masters | #THI0102 | Glue Masters, THICK, Instant Glue, Cyanoacrylate; super glue is preferred |
| DMEM media base | Corning; Mediatech, Inc | REF # 10-013-CM; Lot # 26119007 | DMEM, 1X (Dulbecco's Modification of Eagle's Medium) with 4.5 g/L glucose, L-glutamine & sodium pyruvate |
| DMEM/F-12 50/50 | Corning; Mediatech, Inc | REF # 10-090-CV; Lot # 21119006 | DMEM/F-12 50/50, 1X (Dulbecco's Mod. Of Eagle's Medium/Ham's F12 50/50 Mix) with L-glutamine |
| Ethanol | Decon Labs | #V1101 | (standard lab reagent) |
| Fetal Bovine Serum | Fisher Scientific | Cat # FB12999102, Lot # AE29451050 | Research Grade Fetal Bovine Serum, Triple 0.1 um sterile filtered |
| Fine tip forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| Human Epidermal Growth Factor (EGF) | Peprotech | Cat # AF-100-15-1MG, Lot # 0318AFC05 D0218 | Made up in 0.1% BSA in PBS |
| Hydrocortisone | Alpha Easar | Lot # 5002F2A | made up in DMSO |
| Insulin (human) | Peprotech | Lot # 9352621 | |
| Inverted Light/Phase Contrast Microscope | VWR | 76317-470 | (standard lab equipment) |
| Isoproterenol | Alfa Aesar | #AAJ6178806 | DL-Isoproterenol hydrochloride, 98% |
| Keratinocyte-SFM (1x) media base | Gibco; Life Technologies Corporation | REF #: 10724-011; Lot # 2085518 | Keratinocyte-SFM (1X); serum free medium |
| L-Ascorbic Acid | Fisher Chemical | Cat # A61-100, Lot # 181977, CAS # 50-81-7 | Crystalline. L-Ascorbic acid can also be purchased as a salt |
| L-glutamine (solid) | Fisher Bioreagents | CAT # BP379-100, LOT # 172183, CAS # 56-85-9 | L-Glutamine, white crystals or Crystalline powder |
| MCDB 131 media base | Gen Depot | CM034-050, Lot # 03062021 | MCDB 131 Medium Base, No L-Glutamine, sterile filtered |
| Metal punches | Sona Enterprises (SE) | 791LP, 12PC | Hollow Leather Punch Set, High Carbon Steel, Hardness: 48HRC; (various sizes including): 1/8", 5/32", 3/16", 7/32", 1/4", 9/32", 5/16", 3/4", 7/16", 1/2", 5/8:, 3/4". This punch set is helpful, but x-acto knife can work as well. Size of metal punch that works well for 12 well transwell VHSE is 3/8" or 1/2". |
| Methanol | Fisher Chemical | CAS # 67-56-1 | (optional). For clearing dehydration step. |
| Methyl Salicylate | Fisher Chemical | O3695-500; Lot # 164535; CAS # 119-36-8 | (optional). For clearing. |
| Microtubes, 1.7 mL | Genesee Scientific Corporation; Olympus Plastics | Cat # 24-282; Lot # 19467 | 1.7 ml Microtubes, Clear; Boilproof, Polypropulene, Certified Rnase, Dnase, DNA, PCR inhibitor and endotoxin-Free |
| PBS, 10x Culture grade or autoclaved | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. |
| PBS, 1x Culture grade, (-) Calcium, (-) magnesium | Genesee Scientific Corporation | Ref # 25-508; Lot # 07171015 | |
| PBS, 1x non-Culture grade | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. Dilute to 1x with water. |
| Penicillin/Streptomycin | Gibco; Life Technologies Corporation | Ref # 15140-122, Lot # 2199839 | Pen Strep (10,000 Units/mL Penicillin; 10,000 ug/mL Streptomycin) |
| Petri Dish, glass, small | Corning | PYREX 316060 | (optional). To be used as a clearing container |
| Petri Dishes, 100 mm | Fisher Scientific | FB0875713 | Use for making up PDMS. |
| Polydimethylsiloxane (PDMS) | Dow Corning | GMID 02065622, Batch # H04719H035 | Sylgard 184 Silicone Elastomer Base, Dow Corning, Midland, MI) |
| Dow Corning | GMID 02065622, Batch # H047JC4003 | DOWSIL 184, Silicone Elastomer Curing Agent | |
| note: PDMS is usually sold as a kit that includes both the base and curing agent components. | |||
| Positive Displacement Pipettes (1000 & 250 uL) | Gilson | 1000 uL: HM05136, M1000. 250 uL: T12269L | M1000 pipette capacity (100-1000 uL); M250 pipette capacity to 250 uL |
| Positive Displacement Tips/Pistons (1000 & 250 uL) | Gilson | 1000 uL: CAT # F148180, BATCH # B01292902S; 250 uL: CAT # F148114, BATCH # B05549718S | Sterilized capillaries and pistons |
| Round tipped scoopula | (optional; standard lab equipment) For manipulation of VHSEs prior to imaging | ||
| Supplements for Keratinocyte-SFM media | Gibco; Life Technologies Corporation | Ref # 37000-015, Lot # 2154180 | Contains EGF Human Recombinant (Cat # 10450-013), Bovine Pituitary Extract (Cat # 13028-014) |
| Tissue Culture Plate Inserts, 12 well size, 3 µm pore size | Corning; Costar | REF # 3462 - Clear; Lot # 14919057 | Transwell; 12 mm Diameter Inserts, 3.0 um pore size, tissue culture treated, polyester membrane, polystyrene plates, |
| Tissue Culture Plates, 12 well size | Greiner Bio-one; CellStar | Cat # 665 180; Lot # E18103QT | 12 well cell culture plate; sterile, with lid; products are sterile, free of detectable Dnase, Rnase, human DNA and pyrogens. Contents non-cytotoxic |
| Tissue Culture Plates, 60.8cm^2 growth area | Genesee Scientific Corporation | Cat # 25-202; Lot No: 191218-177B | Tissue culture dishes; treated, growth area 60.8 cm^2; sterile, Dnase, Rnase, Pyrogen Free; virgin polystyrene |
| Triton x 100 | Ricca Chemical Company | Cat # 8698.5-16, Lot # 4708R34 | Wetting agent |
| Trypsin 0.25% | Corning; Mediatech, Inc | Ref # 25-053-CI | 0.25% Trypsin, 2.21 mM EDTA, 1x [-] sodium bicarbonate |
| Type 1 Collagen isolated from Rat tail | Pel-Freez Biologicals | 56054-1 | Sprauge-Dawley rat tails can be purchased frozen from Pel-Freez or other suppliers. Collagen can be isolated from the tail tendons. Isolation Protocol references [Cross et al.,2010; Rajan et al.,2007; Bornstein, 1958] .Alternatively, high concentration rat-tail collagen can be purchased from suppliers including Corning (Catalog Number: 354249) |
| Vaccum chamber, benchtop | Bel-Art | F42010-0000 | (standard lab equipment) |
| Handheld Precision knife | X-Acto | X3311 | (X-Acto knife optional if purchased steel punches) |
Referencias
- Stojic, M., et al. Skin tissue engineering 3. Biomaterials for Skin Repair and Regeneration. , 59 (2019).
- Shevchenko, R. V., James, S. L., James, S. E. A review of tissue-engineered skin bioconstructs available for skin reconstruction. Journal of The Royal Society Interface. 7 (43), 229-258 (2010).
- Kolarsick, P. A. J., Kolarsick, M. A., Goodwin, C. Anatomy and Physiology of the Skin. Journal of the Dermatology Nurses' Association. 3 (4), (2011).
- McGrath, J. A., Eady, R. A. J., Pope, F. M. Anatomy and organization of human skin. Rook's textbook of dermatology. 10, 9781444317633 (2004).
- Zomer, H. D., Trentin, A. G. Skin wound healing in humans and mice: Challenges in translational research. Journal of Dermatological Science. 90 (1), 3-12 (2018).
- Zhang, Z., Michniak-Kohn, B. B. Tissue Engineered Human Skin Equivalents. Pharmaceutics. 4 (1), (2012).
- Oh, J. W., Hsi, T. -. C., Guerrero-Juarez, C. F., Ramos, R., Plikus, M. V. Organotypic skin culture. The Journal of investigative dermatology. 133 (11), 1-4 (2013).
- El-Ghalbzouri, A., Gibbs, S., Lamme, E., Van Blitterswijk, C. A., Ponec, M. Effect of fibroblasts on epidermal regeneration. British Journal of Dermatology. 147 (2), 230-243 (2002).
- Sun, T., Haycock, J., MacNeil, S. In situ image analysis of interactions between normal human keratinocytes and fibroblasts cultured in three-dimensional fibrin gels. Biomaterials. 27 (18), 3459-3465 (2006).
- Kreimendahl, F., et al. Macrophages significantly enhance wound healing in a vascularized skin model. Journal of Biomedical Materials Research Part A. 107, 1340-1350 (2019).
- El Ghalbzouri, A., Commandeur, S., Rietveld, M. H., Mulder, A. A., Willemze, R. Replacement of animal-derived collagen matrix by human fibroblast-derived dermal matrix for human skin equivalent products. Biomaterials. 30 (1), 71-78 (2009).
- Roger, M., et al. Bioengineering the microanatomy of human skin. Journal of Anatomy. 234, 438-455 (2019).
- Carlson, M. W., Alt-Holland, A., Egles, C., Garlick, J. A. Three-Dimensional Tissue Models of Normal and Diseased Skin. Current Protocols in Cell Biology. 41 (1), 1-17 (2008).
- El Ghalbzouri, A., Jonkman, M. F., Dijkman, R., Ponec, M. Basement Membrane Reconstruction in Human Skin Equivalents Is Regulated by Fibroblasts and/or Exogenously Activated Keratinocytes. Journal of Investigative Dermatology. 124 (1), 79-86 (2005).
- Pruniéras, M., Régnier, M., Woodley, D. Methods for cultivation of keratinocytes with an air-liquid interface. The Journal of Investigative Dermatology. 81, 28-33 (1983).
- Ali, N., Hosseini, M., Vainio, S., Taieb, A., Cario-André, M., Rezvani, H. R. Skin equivalents: skin from reconstructions as models to study skin development and diseases. British Journal of Dermatology. 173 (2), 391-403 (2015).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Innovative tissue models for drug discovery and development. 69-70, 81-102 (2014).
- Mieremet, A., Rietveld, M., Absalah, S., van Smeden, J., Bouwstra, J. A., El Ghalbzouri, A. Improved epidermal barrier formation in human skin models by chitosan modulated dermal matrices. PLOS ONE. 12 (3), 0174478 (2017).
- Vidal, S. E. L., Tamamoto, K. A., Nguyen, H., Abbott, R. D., Cairns, D. M., Kaplan, D. L. 3D biomaterial matrix to support long term, full thickness, immuno-competent human skin equivalents with nervous system components. Organoids and Ex Vivo Tissue On-Chip Technologies. 198, 194-203 (2019).
- Smits, J. P. H., et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models. Scientific Reports. 7 (1), 11838 (2017).
- Lebonvallet, N., et al. Effects of the re-innervation of organotypic skin explants on the epidermis. Experimental Dermatology. 21 (2), 156-158 (2011).
- Van Drongelen, V., et al. Barrier Properties of an N/TERT-Based Human Skin Equivalent. Tissue Engineering Part A. 20 (21-22), 3041-3049 (2014).
- . Establishment and initial characterization of a simple 3D organotypic wound healing model Available from: https://opus.hs-furtwangen.de/frontdoor/index/index/docld/4852 (2018)
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18 (5), 240-249 (2013).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Amelian, A., Wasilewska, K., Megias, D., Winnicka, K. Application of standard cell cultures and 3D in vitro tissue models as an effective tool in drug design and development. Pharmacological Reports. 69 (5), 861-870 (2017).
- Lu, W., et al. Mixture of Fibroblasts and Adipose Tissue-Derived Stem Cells Can Improve Epidermal Morphogenesis of Tissue-Engineered Skin. Cells Tissues Organs. 195 (3), 197-206 (2012).
- Marino, D., Luginbühl, J., Scola, S., Meuli, M., Reichmann, E. Bioengineering Dermo-Epidermal Skin Grafts with Blood and Lymphatic Capillaries. Science Translational Medicine. 6 (221), 221 (2014).
- Martins-Green, M., Li, Q. -. J., Yao, M. A new generation organ culture arising from cross-talk between multiple primary human cell types. The FASEB Journal. 19 (2), 222-224 (2004).
- Kim, B. S., Gao, G., Kim, J. Y., Cho, D. -. W. 3D Cell Printing of Perfusable Vascularized Human Skin Equivalent Composed of Epidermis, Dermis, and Hypodermis for Better Structural Recapitulation of Native Skin. Advanced Healthcare Materials. 8 (7), 1801019 (2019).
- Baltazar, T., et al. 3D bioprinting of a vascularized and perfusable skin graft using human keratinocytes. Tissue Engineering Part A. 26 (5-6), 227-238 (2019).
- Klar, A. S., et al. Tissue-engineered dermo-epidermal skin grafts prevascularized with adipose-derived cells. Biomaterials. 35 (19), 5065-5078 (2014).
- Grebenyuk, S., Ranga, A. Engineering Organoid Vascularization. Frontiers in Bioengineering and Biotechnology. 7, (2019).
- Black, A. F., Berthod, F., L'heureux, N., Germain, L., Auger, F. A. In vitro reconstruction of a human capillary-like network in a tissue-engineered skin equivalent. The FASEB Journal. 12 (13), 1331-1340 (1998).
- Huber, B., Link, A., Linke, K., Gehrke, S. A., Winnefeld, M., Kluger, P. J. Integration of Mature Adipocytes to Build-Up a Functional Three-Layered Full-Skin Equivalent. Tissue Engineering Part C: Methods. 22 (8), 756-764 (2016).
- Monfort, A., Soriano-Navarro, M., García-Verdugo, J. M., Izeta, A. Production of human tissue-engineered skin trilayer on a plasma-based hypodermis. Journal of Tissue Engineering and Regenerative Medicine. 7 (6), 479-490 (2013).
- Shamis, Y., et al. Fibroblasts derived from human embryonic stem cells direct development and repair of 3D human skin equivalents. Stem Cell Research & Therapy. 2 (1), 10 (2011).
- Kim, Y., et al. Establishment of a complex skin structure via layered co-culture of keratinocytes and fibroblasts derived from induced pluripotent stem cells. Stem Cell Research & Therapy. 9 (1), 217 (2018).
- Chau, D. Y. S., Johnson, C., MacNeil, S., Haycock, J. W., Ghaemmaghami, A. M. The development of a 3D immunocompetent model of human skin. Biofabrication. 5 (3), 035011 (2013).
- Vanden Bogaard, E. H., et al. Crosstalk between Keratinocytes and T Cells in a 3D Microenvironment: A Model to Study Inflammatory Skin Diseases. Journal of Investigative Dermatology. 134 (3), 719-727 (2014).
- Linde, N., Gutschalk, C. M., Hoffmann, C., Yilmaz, D., Mueller, M. M. Integrating Macrophages into Organotypic Co-Cultures: A 3D In Vitro Model to Study Tumor-Associated Macrophages. PLOS ONE. 7 (7), 40058 (2012).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical Advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Weinmüllner, R., et al. Organotypic human skin culture models constructed with senescent fibroblasts show hallmarks of skin aging. npj Aging and Mechanisms of Disease. 6 (1), 4 (2020).
- Barker, C. L., et al. The Development and Characterization of an In Vitro Model of Psoriasis. Journal of Investigative Dermatology. 123 (5), 892-901 (2004).
- Larcher, F., Espada, J., Díaz-Ley, B., Jaén, P., Juarranz, A., Quintanilla, M. New Experimental Models of Skin Homeostasis and Diseases. Actas Dermo-Sifiliográficas (English Edition). 106 (1), 17-28 (2015).
- Varkey, M., Ding, J., Tredget, E. E. Fibrotic Remodeling of Tissue-Engineered Skin with Deep Dermal Fibroblasts Is Reduced by Keratinocytes. Tissue Engineering Part A. 20 (3-4), 716-727 (2013).
- Moulin, V. J. Reconstitution of skin fibrosis development using a tissue engineering approach. Methods in Molecular Biology. 961, 287-303 (2013).
- Morgan, J. T., Shirazi, J., Comber, E. M., Eschenburg, C., Gleghorn, J. P. Fabrication of centimeter-scale and geometrically arbitrary vascular networks using in vitro self-assembly. Biomaterials. 189, 37-47 (2019).
- Silvestri, L., Costantini, I., Sacconi, L., Pavone, F. S. Clearing of fixed tissue: a review from a microscopist's perspective. Journal of Biomedical Optics. 21 (8), 1-8 (2016).
- Cross, V. L., et al. Dense type I collagen matrices that support cellular remodeling and microfabrication for studies of tumor angiogenesis and vasculogenesis in vitro. Biomaterials. 31 (33), 8596-8607 (2010).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1, 2753 (2007).
- Bornstein, M. B. Reconstituted rat-tail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Laboratory Investigation. 7 (2), 134-137 (1958).
- Clément, M. -. V., Ramalingam, J., Long, L. H., Halliwell, B. The In Vitro Cytotoxicity of Ascorbate Depends on the Culture Medium Used to Perform the Assay and Involves Hydrogen Peroxide. Antioxidants & Redox Signaling. 3 (1), 157-163 (2001).
- Tajima, S., Pinnell, S. R. Ascorbic acid preferentially enhances type I and III collagen gene transcription in human skin fibroblasts. Journal of Dermatological Science. 11 (3), 250-253 (1996).
- Murad, S., Tajima, S., Johnson, G. R., Sivarajah, A., Pinnell, S. R. Collagen Synthesis in Cultured Human Skin Fibroblasts: Effect of Ascorbic Acid and Its Analogs. Journal of Investigative Dermatology. 81 (2), 158-162 (1983).
- Villacorta, L., Azzi, A., Zingg, J. -. M. Regulatory role of vitamins E and C on extracellular matrix components of the vascular system. Vitamin E: An Overview of Major Research Directions. 28 (5), 507-537 (2007).
- Ashino, H., et al. Novel Function of Ascorbic Acid as an Angiostatic Factor. Angiogenesis. 6 (4), 259-269 (2003).
- Ponec, M., et al. The Formation of Competent Barrier Lipids in Reconstructed Human Epidermis Requires the Presence of Vitamin C. Journal of Investigative Dermatology. 109 (3), 348-355 (1997).
- Dickson, M. A., et al. Human keratinocytes that express hTERT and also bypass a p16(INK4a)-enforced mechanism that limits life span become immortal yet retain normal growth and differentiation characteristics. Molecular and Cellular Biology. 20 (4), 1436-1447 (2000).
- Johansen, C. Generation and Culturing of Primary Human Keratinocytes from Adult Skin. Journal of visualized experiments: JoVE. (130), e56863 (2017).
- Richardson, D. S., Lichtman, J. W. Clarifying Tissue Clearing. Cell. 162 (2), 246-257 (2015).
- Ariel, P. A beginner's guide to tissue clearing. The International Journal of Biochemistry & Cell Biology. 84, 35-39 (2017).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502 (2010).
- Ng, J. M. K., Gitlin, I., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. ELECTROPHORESIS. 23 (20), 3461-3473 (2002).
- Eddings, M. A., Johnson, M. A., Gale, B. K. Determining the optimal PDMS-PDMS bonding technique for microfluidic devices. Journal of Micromechanics and Microengineering. 18 (6), 067001 (2008).
- Markov, D. A., Lillie, E. M., Garbett, S. P., McCawley, L. J. Variation in diffusion of gases through PDMS due to plasma surface treatment and storage conditions. Biomedical microdevices. 16 (1), 91-96 (2014).
- Katzenberg, F. Plasma-bonding of poly(dimethylsiloxane) to glass. e-Polymers. 5 (1), (2005).
- El Ghalbzouri, A., Lamme, E., Ponec, M. Crucial role of fibroblasts in regulating epidermal morphogenesis. Cell and Tissue Research. 310 (2), 189-199 (2002).
- Kanitakis, J. Anatomy, histology and immunohistochemistry of normal human skin. European journal of dermatology: EJD. 12 (4), 390-399 (2002).
- Hessian based Frangi Vesselness filter. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/24409-hessian-based-frangi-vesselness-filter (2010)
- Jerman, T., Pernuš, F., Likar, B. Špiclin Enhancement of Vascular Structures in 3D and 2D Angiographic Images. IEEE Transactions on Medical Imaging. 35 (9), 2107-2118 (2016).
- Kovesi, P. Phase Preserving Denoising of Images. signal. 4, 6 (1999).
- Vincent, L. Morphological grayscale reconstruction in image analysis: applications and efficient algorithms. IEEE Transactions on Image Processing. 2 (2), 176-201 (1993).
- Xie, L., et al. Quantitative susceptibility mapping of kidney inflammation and fibrosis in type 1 angiotensin receptor-deficient mice. NMR in Biomedicine. 26 (12), 1853-1863 (2013).
- Van Uitert, R., Bitter, I. Subvoxel precise skeletons of volumetric data based on fast marching methods. Medical Physics. 34 (2), 627-638 (2007).
- Sethian, J. A. A fast marching level set method for monotonically advancing fronts. Proceedings of the National Academy of Sciences of the United States of America. 93 (4), 1591-1595 (1996).
- Sethian, J. A. Fast Marching Methods. SIAM Review. 41 (2), 199-235 (1999).
- Braverman, I. M. The Cutaneous Microcirculation. Journal of Investigative Dermatology Symposium Proceedings. 5 (1), 3-9 (2000).
- Men, S. J., Chen, C. -. L., Wei, W., Lai, T. -. Y., Song, S. Z., Wang, R. K. Repeatability of vessel density measurement in human skin by OCT-based microangiography. Skin research and technology: official journal of International Society for Bioengineering and the Skin (ISBS) [and] International Society for Digital Imaging of Skin (ISDIS) [and] International Society for Skin Imaging (ISSI). 23 (4), 607-612 (2017).
- Commandeur, S., Ho, S. H., de Gruijl, F. R., Willemze, R., Tensen, C. P., El Ghalbzouri, A. Functional characterization of cancer-associated fibroblasts of human cutaneous squamous cell carcinoma. Experimental Dermatology. 20 (9), 737-742 (2011).
- Thakoersing, V. S., Danso, M. O., Mulder, A., Gooris, G., Ghalbzouri, A. E., Bouwstra, J. A. Nature versus nurture: does human skin maintain its stratum corneum lipid properties in vitro. Experimental Dermatology. 21 (11), 865-870 (2012).
- Thakoersing, V. S., Gooris, G. S., Mulder, A., Rietveld, M., El Ghalbzouri, A., Bouwstra, J. A. Unraveling barrier properties of three different in-house human skin equivalents. Tissue Engineering. Part C, Methods. 18 (1), 1-11 (2012).
- Bouwstra, J. A., Groenink, H. W. W., Kempenaar, J. A., Romeijn, S. G., Ponec, M. Water distribution and natural moisturizer factor content in human skin equivalents are regulated by environmental relative humidity. The Journal of Investigative Dermatology. 128 (2), 378-388 (2008).
- Thakoersing, V. S., van Smeden, J., Mulder, A. A., Vreeken, R. J., El Ghalbzouri, A., Bouwstra, J. A. Increased Presence of Monounsaturated Fatty Acids in the Stratum Corneum of Human Skin Equivalents. Journal of Investigative Dermatology. 133 (1), 59-67 (2013).
- Smola, H., Thiekötter, G., Fusenig, N. Mutual induction of growth factor gene expression by epidermal-dermal cell interaction. The Journal of Cell Biology. 122 (2), 417 (1993).
- Fluck, J., Querfeld, C., Cremer, A., Niland, S., Krieg, T., Sollberg, S. Normal Human Primary Fibroblasts Undergo Apoptosis in Three-Dimensional Contractile Collagen Gels. Journal of Investigative Dermatology. 110 (2), 153-157 (1998).
- Nakagawa, S., Pawelek, P., Grinnell, F. Long-Term Culture of Fibroblasts in Contracted Collagen Gels: Effects on Cell Growth and Biosynthetic Activity. Journal of Investigative Dermatology. 93 (6), 792-798 (1989).
- Smith, L. E., Bonesi, M., Smallwood, R., Matcher, S. J., MacNeil, S. Using swept-source optical coherence tomography to monitor the formation of neo-epidermis in tissue-engineered skin. Journal of Tissue Engineering and Regenerative Medicine. 4 (8), 652-658 (2010).
- Pierce, M. C., Strasswimmer, J., Park, H., Cense, B., De Boer, J. F. Birefringence measurements in human skin using polarization-sensitive optical coherence tomography. Biomed Opt. 2 (2), 287-291 (2004).
- Pierce, M. C., Strasswimmer, J., Hyle Park, B., Cense, B., de Boer, J. F. Advances in Optical Coherence Tomography Imaging for Dermatology. Journal of Investigative Dermatology. 123 (3), 458-463 (2004).
- Yeh, A. T., Kao, B., Jung, W. G., Chen, Z., Nelson, J. S., Tromberg, B. J. Imaging wound healing using optical coherence tomography and multiphoton microscopy in an in vitro skin-equivalent tissue model. Journal of Biomedical Optics. 9 (2), 9 (2004).
- Derr, K., et al. Fully Three-Dimensional Bioprinted Skin Equivalent Contructs with Validated Morphology and Barrier Funtion. Tissue Engineering Part C: Methods. 25 (6), 334-343 (2019).
- Park, B. H., de Boer, J. F. Polarization Sensitive Optical Coherence Tomography. Optical Coherence Tomography: Technology and Applications. , 1055-1101 (2015).
- Batheja, P., Song, Y., Wertz, P., Michniak-Kohn, B. Effects of Growth Conditions on the Barrier Properties of a Human Skin Equivalent. Pharmaceutical Research. 26 (7), 1689-1700 (2009).
- Dos Santos, M., Metral, E., Boher, A., Rousselle, P., Thepot, A., Damour, O. In vitro 3-D model based on extending time of culture for studying chronological epidermis aging. Matrix Biology. 47, 85-97 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados