Method Article
Generierung von selbst zusammengesetzten vaskularisierten äquivalenten menschlicher Haut
In diesem Artikel
Zusammenfassung
Das Ziel dieses Protokolls ist es, die Erzeugung und volumetrische Analyse von vaskularisierten menschlichen Hautäquivalenten unter Verwendung zugänglicher und einfacher Techniken für die Langzeitkultur zu beschreiben. Soweit möglich, wird die Begründung für die Schritte beschrieben, um den Forschern die Möglichkeit zu geben, sich an ihre Forschungsbedürfnisse anzupassen.
Zusammenfassung
Human Skin Equivalents (HSEs) sind gewebegefertigte Konstrukte, die epidermale und dermale Komponenten der menschlichen Haut modellieren. Diese Modelle wurden verwendet, um hautentwicklung, Wundheilung und Transplantationstechniken zu untersuchen. Vielen HSEs fehlt es weiterhin an Vaskulatur und sie werden zusätzlich durch histologische Postkulturschnitte analysiert, die die volumetrische Beurteilung der Struktur einschränken. Hier wird ein einfaches Protokoll vorgestellt, das zugängliche Materialien verwendet, um vaskularisierte menschliche Hautäquivalente (VHSE) zu erzeugen. Weiter beschrieben sind volumetrische Bildgebungs- und Quantifizierungstechniken dieser Konstrukte. Kurz gesagt, VHSEs werden in 12 Well-Culture-Inserts aufgebaut, in denen dermale und epidermale Zellen in Rattenschwanzkollagen Typ I Gel eingesät werden. Das dermale Kompartiment besteht aus Fibroblasten und Endothelzellen, die im Kollagengel verteilt sind. Das epidermale Kompartiment besteht aus Keratinozyten (Hautepithelzellen), die sich an der Luft-Flüssig-Grenzfläche differenzieren. Wichtig ist, dass diese Methoden basierend auf den Bedürfnissen des Forschers anpassbar sind, wobei die Ergebnisse die VHSE-Erzeugung mit zwei verschiedenen Fibroblastenzelltypen zeigen: menschliche dermale Fibroblasten (hDF) und menschliche Lungenfibroblasten (IMR90s). VHSEs wurden entwickelt, durch konfokale Mikroskopie abgebildet und volumetrisch mit Computersoftware zu 4- und 8-Wochen-Zeitpunkten analysiert. Ein optimierter Prozess zum Fixieren, Färben, Abbilden und Löschen von VHSEs für die volumetrische Untersuchung wird beschrieben. Diese umfassenden Modell-, Bildgebungs- und Analysetechniken können leicht an die spezifischen Forschungsanforderungen einzelner Labore mit oder ohne vorherige HSE-Erfahrung angepasst werden.
Einleitung
Die menschliche Haut erfüllt viele wesentliche biologische Funktionen, einschließlich der Funktion als immune / mechanische Barriere, regulierung der Körpertemperatur, Teilnahme an Wassereinlagerungen und sensorischen Rollen1,2,3,4. Anatomisch ist die Haut das größte Organ im menschlichen Körper und besteht aus drei Hauptschichten (Epidermis, Dermis und Hypodermis) und besitzt neben epidermalen Zellen ein komplexes System von Stroma-, Vase-, Drüsen- und Immun- / Nervensystemkomponenten. Die Epidermis selbst besteht aus vier Zellschichten, die kontinuierlich erneuert werden, um die Barrierefunktion und andere Strukturen der nativen Haut (z. B. Schweiß und Talgdrüsen, Nägel)aufrechtzuerhalten 3. Die Hautphysiologie ist wichtig für die Immunfunktion, die Wundheilung, die Krebsbiologie und andere Bereiche, was die Forscher dazu veranlasst, eine breite Palette von Modellen zu verwenden, von In-vitro-Monokulturen bis hin zu In-vivo-Tiermodellen. Tiermodelle bieten die Möglichkeit, die volle Komplexität der Hautphysiologie zu untersuchen, jedoch haben häufig verwendete Tiermodelle wie Mäuse signifikante physiologische Unterschiede im Vergleich zum Menschen5. Diese Einschränkungen und die gestiegenen Kosten für Tiermodelle haben viele Forscher dazu veranlasst, sich auf die Entwicklung von In-vitro-Modellen zu konzentrieren, die die Physiologie der menschlichen Haut besser widerspiegeln1,6. Von diesen ist einer der einfacheren Modelltypen das humane epidermale Äquivalent (HEE; auch als halbdicke Hautmodelle bezeichnet), das nur aus epidermalen Keratinozyten auf einer azellulären dermalen Matrix besteht, aber die epidermale Differenzierung und Schichtung in vivo erfasst. Darauf aufbauend werden Modelle, die dermale und epidermale Komponenten (Keratinozyten und Fibroblasten) enthalten, oft als humane Hautäquivalente (HSE), Hautmodelle mit voller Dicke oder organotypische Hautkonstrukte (OSC) bezeichnet. Kurz gesagt, diese Modelle werden durch Einkapselung von Hautzellen in Gelmatrizen und Aussaat von epidermalen Zellen darüber erzeugt. Epidermale Differenzierung und Schichtung können dann über spezialisierte Medien und Luftexposition erreicht werden7. Hautäquivalente wurden am häufigsten durch Selbstorganisationstechniken unter Verwendung von Hautgelen aus Kollagen Typ I (entweder aus Rattenschwanz oder Rinderhaut)1,8erzeugt, aber ähnliche Modelle haben andere Matrixkomponenten wie Fibrin9,10, Fibroblast abgeleitet11,12, Cadaveric deepidermisierte Membranen13,14,15,16, handelsübliche Gele und andere1,12,13 ,17,18,19. Derzeit gibt es Skin-Äquivalente im Handel erhältlich (wie zuvor überprüft1,2). Diese werden jedoch in erster Linie für therapeutische Zwecke entwickelt und können nicht ohne weiteres an spezifische Forschungsfragen angepasst werden.
HSEs wurden in Studien zur Wundheilung, Transplantation, Toxikologie und Hauterkrankungen / -entwicklung11,12,13,16,8,20,21,22,23angewendet. Obwohl die 3D-Kultur die Funktionen des menschlichen Gewebes im Vergleich zu 2D-Kulturenumfassender modelliert 24,ermöglicht die Einbeziehung verschiedener Zelltypen, die die In-vivo-Population genauer widerspiegeln, Studien zur Zell-Zell-Koordination in komplexen Geweben24,25,26. Die meisten HSEs umfassen nur dermale Fibroblasten und epidermale Keratinozyten27, obwohl die In-vivo-Hautumgebung viele andere Zelltypen umfasst. Jüngste Studien haben begonnen, mehr Zellpopulationen einzubeziehen; Dazu gehören Endothelzellen inGefäßen 10,28,29,30,31,32,33,34, Adipozyten im Subkutangewebe35,36, Nervenkomponenten19,21, Stammzellen27, 37,38, Immunzellen10,39,40,41,42und andere krankheits- / krebsspezifische Modelle16,40,43,44,45,46,47. Besonders wichtig unter diesen ist vaskulatur; Während einige HSEs Gefäßzellen umfassen, fehlen ihnen insgesamt immer noch umfassende Kapillarelemente mit Konnektivität über die gesamte Dermis10,29 , erweiterte In-vitro-Stabilität28und angemessene Gefäßdichte. Darüber hinaus werden HSE-Modelle typischerweise durch histologische Abschnitte nach der Kultur bewertet, die die Analyse der dreidimensionalen Struktur von HSEs begrenzen. Die dreidimensionale Analyse ermöglicht die volumetrische Beurteilung derGefäßdichte 48,49 sowie die regionale Variation der epidermalen Dicke und Differenzierung.
Obwohl HSEs eines der häufigsten organotypischen Modelle sind, gibt es viele technische Herausforderungen bei der Generierung dieser Konstrukte, einschließlich der Identifizierung geeigneter extrazellulärer Matrix- und Zelldichten, Medienrezepturen, geeigneter Luftflüssigkeitsschnittstellenverfahren und Postkulturanalyse. Während HEE- und HSE-Modelle Protokolle veröffentlicht haben, gibt es kein detailliertes Protokoll, das dermale Vaskulatur und volumetrische Bildgebung anstelle einer histologischen Analyse enthält. Diese Arbeit stellt ein zugängliches Protokoll für die Kultur vaskularisierter menschlicher Hautäquivalente (VHSE) aus hauptsächlich kommerziellen Zelllinien dar. Dieses Protokoll ist so geschrieben, dass es leicht anpassbar ist und eine einfache Anpassung an verschiedene Zelltypen und Forschungsbedürfnisse ermöglicht. Im Interesse der Zugänglichkeit, Verfügbarkeit und Kosten wurde der Einsatz einfacher Produkte und Erzeugungstechniken gegenüber der Verwendung kommerziell erhältlicher Produkte priorisiert. Des Weiteren werden einfache volumetrische Bildgebungs- und Quantifizierungsverfahren beschrieben, die eine Beurteilung der dreidimensionalen Struktur der VHSE ermöglichen. Die Umsetzung dieses Verfahrens in ein robustes und zugängliches Protokoll ermöglicht es nicht-spezialisierten Forschern, diese wichtigen Modelle in der personalisierten Medizin, dem vaskularisierten Tissue Engineering, der Transplantatentwicklung und der Arzneimittelbewertung anzuwenden.
Protokoll
1. Vorbereitung auf die 3D-Kultur
- Bereiten Sie rattenschwanzkollagen bei 8 mg / ml unter Verwendung der etablierten Protokolle50,51,52vor. Alternativ kann Rattenschwanzkollagen von Anbietern (siehe Materialliste) in geeigneten Konzentrationen erworben werden.
HINWEIS: Kollagen kann in verschiedenen Konzentrationen im Bereich von 3-10 mg / ml oder höher 50 , 51,52hergestellt oder gekauft werden. Die Berechnungen im Protokoll gehen von einer Konzentration von 8 mg/ml aus, können aber je nach Bedarf des Forschers angepasst werden. - Zelllinien erweitern: Endothel- und Fibroblastenzellen müssen zu Beginn der 3D-Kollagen-Hautkomponentengenerierung (Schritt 2) für die Aussaat bereit sein. Keratinozyten müssen am Tag 7 der 3D-Kultur bereit sein. Ein komplettes VHSE-Konstrukt erfordert 7,5 x10 5 Endothelzellen; 7,5 x 104 Fibroblasten; und 1,7 x 105 Keratinozyten zur Erzeugung (Tabelle 1).
HINWEIS: Diese Dichten sind für durchlässige Gewebekultureinsätze mit einer Größe von 12 Well oder gleichwertig geeignet. Zelldichte und -format können je nach den Bedürfnissen des Forschers nach oben oder unten skaliert werden. Zur Verdeutlichung wird diese Menge an Endothel- und Fibroblastenzellen 1-3 dermale Komponenten säen, während jede epidermale Komponente 1,7 x 105 Keratinozyten benötigt. - Führen Sie alle Zellzentrifugationen in diesem Protokoll für 5 Minuten bei 300 x gdurch, aber dies kann bei zerbrechlicheren Zelltypen verringert werden.
2. Erzeugung einer 3D-Kollagen-Hautkomponente
HINWEIS: Schritt 2 ist ein zeitkritisches Verfahren und muss in einer Einstellung abgeschlossen werden. Es wird empfohlen, eine Qualitätsprüfung des Kollagenbestands durchzuführen, um die richtige Gelierung und Homogenität sicherzustellen, bevor sie mit der Aussaat der hauten Komponente beginnen, siehe Fehlerbehebung in der Diskussion.
- Vorbereitung und Aussaat von azellulären Kollagenschichten
- Bereiten Sie zwei 1,7 ml große Mikrozentrifugenröhrchen vor, eine für die zelluläre Unterstützung und eine für die zelluläre Dermis. Die in diesem Schritt angegebenen Mengen bereiten 1 ml 3 mg / ml Kollagen (Zielkollagenkonzentration) vor, ausreichend für (3) VHSEs mit 12-Well-Größe. Gleichungen werden aufgelistet, wenn eine Anpassung erforderlich ist. Sowohl Volumen als auch Dichte können basierend auf den Bedürfnissen des Forschers skaliert werden (gemeinsame Referenznummern sind in Tabelle 2 angegeben).
- Zu jeder Tube werden 100 μL 10x phosphatgepufferte Kochsalzlösung (PBS) in Kulturqualität gegeben (ein Röhrchen ergibt 3 VHSEs) und 8,6 μL 1 N NaOH hinzugefügt. Legen Sie die verschlossenen Rohre auf nasses Eis, um mindestens 10 Minuten zu kühlen.
Cs = Kollagenbestandskonzentration
Vf = Endgültiges Volumen des benötigten Kollagens
Ct = Zielkollagenkonzentration
Vs = Volumen des Für die gewünschte Menge erforderlichen Kollagens (Vf)
Vpbs = Volumen von 10X PBS, das für die Zielkollagenkonzentration benötigt wird (Ct)
VNaOH = Volumen von 1N NaOH für Ct erforderlich
V-Medium = Medienvolumen, Anrufansetzung oder ddH2O, die für Ct erforderlich sind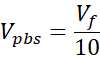
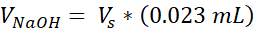
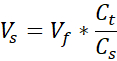
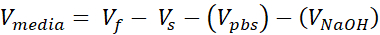
- Bereiten Sie 1000 und 250 μL Verdrängerpipetten für den Gebrauch vor und legen Sie sie beiseite. Da spätere Schritte zeitkritisch sind, ist es praktisch, Pipettenspitzen zu laden und Volumina (375 μL bzw. 125 μL) einzustellen. Richten Sie zusätzlich eine normale 1000 μL Pipette für 516 μL ein.
HINWEIS: Verdrängerpipetten können bei Bedarf durch normale Pipetten ersetzt werden, aber aufgrund der hohen Viskosität von Kollagen und der Zeit- / Temperaturempfindlichkeit dieses Verfahrens werden Verdrängerpipetten empfohlen, um konsistente Aussaatergebnisse zu erzielen. Wenn Sie normale Pipetten verwenden, verwenden Sie langsame Bewegungen. - Kultureinsatz-Well-Platten vorbereiten: Verwenden Sie eine sterile Zette, um drei Kultureinsätze in 12-Well-Größe in eine sterile 12-Well-Gewebekulturplatte zu legen und in die Mittelsäulen zu legen.
- Legen Sie kalte Medien aus, die für Fibroblasten- und Endothelzelltypen geeignet sind.
- Nach dem Abkühlen der verschlossenen Rohre legen Sie ein Rohr (für die azelluläre Unterstützung) auf ein Rack mit sichtbarem Inhalt. Lassen Sie die andere Röhre (für die Zelluläre Dermis) auf Eis.
- 8 mg/ml Kollagenvorrat aus der Kühlung entfernen und auf nasses Eis legen.
HINWEIS: Verwenden Sie kein Gefriereis oder Tischkühler mit -20 °C, da dadurch das Kollagen eingefroren wird. - In das kalt verschlossene Röhrchen werden 516 μL Medien und sofort 375 μL kaltes Kollagen mit der 1000 μL-Verdrängerpipette hinzugefügt. Geben Sie Kollagen in die Lösung (nicht an die Seite der Tube). Entfernen Sie sofort die leere Pipettenspitze und wechseln Sie zum Mischen auf die vorbereitete 250 μL-Verdrängerpipette.
- Mischen Sie schnell, aber vorsichtig, um Blasenbildung zu verhindern, entfernen Sie die Spitze nicht aus der Lösung, wenn möglich. Mischen Sie, bis die Lösung eine homogene Farbe hat, was typischerweise etwa 5 Pipettenzyklen oder 10 s dauert (wenn Medien mit Phenolrot verwendet werden, wird die Farbe heller und gleichmäßiger). Achten Sie beim Mischen darauf, aus verschiedenen Positionen des Rohres (unten und oben) für ein gleichmäßiges Mischen zu ziehen.
HINWEIS: Dies kann mit 516 μL Zellkulturwasser oder einer anderen Zellkulturflüssigkeit durchgeführt werden, jedoch ist Phenolrot der meisten Medien ein guter Indikator für die Vermischung. Verwenden Sie entweder Fibroblasten oder Endothelmedien, die für 2D-Erweiterungen verwendet wurden.
- Mischen Sie schnell, aber vorsichtig, um Blasenbildung zu verhindern, entfernen Sie die Spitze nicht aus der Lösung, wenn möglich. Mischen Sie, bis die Lösung eine homogene Farbe hat, was typischerweise etwa 5 Pipettenzyklen oder 10 s dauert (wenn Medien mit Phenolrot verwendet werden, wird die Farbe heller und gleichmäßiger). Achten Sie beim Mischen darauf, aus verschiedenen Positionen des Rohres (unten und oben) für ein gleichmäßiges Mischen zu ziehen.
- Verteilen Sie sofort 125 μL azelluläres Kollagen auf die Membran jedes der drei 12-Well-Kultureinsätze. Um eine gleichmäßige Abdeckung des azellulären Kollagengels zu gewährleisten, schaukeln Sie die Schüssel; Wenn dies keine gleichmäßige Membranabdeckung erzeugt, verwenden Sie die Pipettenspitze, um die Membran im Wesentlichen zu streichen, indem Sie Kollagen sanft verteilen. Vermeiden Sie es, Druck auf die Membran auszuüben. Die Gelierung beginnt fast sofort; Führen Sie diesen Schritt schnell durch, um eine gleichmäßige Abdeckung zu gewährleisten.
HINWEIS: Es wird überschüssiges azelluläres Kollagen geben. Das Volumen kann reduziert werden, jedoch kann die Herstellung von weniger als 1 ml Kollagensuspension zu Schwierigkeiten beim Mischen der Lösung und unzureichender Gelierung führen. - Bewegen Sie die 12-Well-Platte sofort in einen 37 °C-Zellkultur-Inkubator, um sie mindestens 20 Minuten gelieren zu lassen (azelluläres Kollagen kann bei Bedarf länger gelieren; während dieser Gelierungszeit fahren Sie mit Schritt 2.2 fort). Entfernen Sie die Kollagensuspension aus dem Eis und geben Sie sie wieder in die Kühlung (Kollagen ist bei 4 ° C am stabilsten).
- Zellsuspension & Seeding-Vorbereitung
HINWEIS: Für die Kultur-Timeline dieses Protokolls entspricht dies Submersion Day 1 (SD1)- Während der Gelierung des azellulären Kollagens unterstützen, trypsinisieren und zählen Sie die Endothel- und Fibroblastenzelllinien.
- Suspendieren Sie 7,5 x10 5 Endothelzellen und 7,5 x 104 Fibroblasten in 258 μL ihrer jeweiligen Medien und kombinieren Sie Zellsuspensionen zu einem Aliquot von 516 μL. Halten Sie die Zellsuspensionen bis zum Gebrauch auf nassem Eis.
- Bereiten Sie 1000 und 250 μL Verdrängerpipetten für den Gebrauch vor und legen Sie sie beiseite. Da spätere Schritte zeitkritisch sind, ist es praktisch, Pipettenspitzen zu laden und Volumen (375 μL bzw. 250 μL) einzustellen. Richten Sie zusätzlich eine normale 1000 μL Pipette für 516 μL ein.
- Zellbeladene Kollagenaussaat des Hautkompartiments
- Nach der Gelationszeit die 12-Well-Platte des azellulären Kollagens aus dem Inkubator entfernen.
HINWEIS: Wenn dieses Kollagen nach 30 Minuten nicht geliert ist, setzen Sie den Vorgang nicht fort, da während der Aussaat wahrscheinlich ein Fehler aufgetreten ist oder der Kollagenvorrat ein Problem haben kann (siehe Fehlerbehebung in der Diskussion). - Entfernen Sie das 1,7 ml verschlossene Rohr aus nassem Eis (enthält 10x PBS und NaOH). Legen Sie das Rohr in ein Rack, damit der Inhalt sichtbar ist. Lösen/öffnen Sie alle Kappen (Zellsuspension, kalt verschlossenes Rohr).
- Das Brühkollagen (8 mg/ml) aus der 4 °C-Kühlung entfernen und auf nasses Eis legen. Lassen Sie die Kappe offen.
- Die 516 μL gekühlte Zellsuspension wird in das kalt verschlossene Rohr gegeben. Verwenden Sie die 1000 μL Verdrängerpipette, um sofort 375 μL kalte Kollagenlösung direkt in die Lösung des verschlossenen Röhrchens zu pipetieren.
- Das gesamte Kollagen aus der Pipette in das Röhrchen ausstoßen und die Verdrängerpipettenspitze verwerfen. Wechseln Sie sofort zur 250 μL Verdrängerpipette und mischen Sie die Kollagenlösung.
- Mischen Sie die Kollagenlösung wie zuvor abgeschlossen (schnell, aber schonend, um Blasenbildung zu verhindern), entfernen Sie die Spitze nach Möglichkeit nicht aus dem Gel. Mischen, bis die Lösung homogen ist (ca. 5 Pipettenzyklen oder 10 s). Achten Sie beim Mischen darauf, aus verschiedenen Positionen des Rohres (unten und oben) für eine gleichmäßige Mischung zu ziehen.
- Nach dem Mischen sofort 250 μL zelluläre Kollagenlösung auf die azellulären Kollagenträger in jedem der drei 12-Well-Kultureinsätze übertragen. Um eine gleichmäßige Abdeckung des azellulären Kollagenträgers zu gewährleisten, schaukeln Sie die Schüssel und / oder verwenden Sie die Verdrängerpipette, um das frisch ausgesäte zelluläre Kollagen sanft zu bewegen, ohne die zelluläre Schicht zu stören.
- Bewegen Sie die 12-Well-Platte sofort auf den 37 °C Zellkultur-Inkubator, um sie mindestens 30 Minuten gelieren zu lassen. Kollagen nach Gebrauch wieder in eine 4 °C Kühlung geben.
- Nach der 30-minütigen Gelzeit neigen Sie die Platte vorsichtig, um die Gelierung zu beurteilen. Stellen Sie sicher, dass das Kollagen verfestigt ist.
- Fügen Sie 500 μL bzw. 1000 μL Mischmedien (halb endotheliales und halb fibroblastenhaltiges Erhaltungsmedium) in die obere Kammer bzw. untere Kammer des Einsatzes hinzu (zuerst oben, dann unten, um zu verhindern, dass der hydrostatische Druck Kollagen nach oben drückt). Fügen Sie Medien langsam an der Seite des Brunnens hinzu, nicht direkt auf Kollagengel, um die Störung des Kollagens zu minimieren.
- Stellen Sie sicher, dass das Kollagengel untergetaucht ist, fügen Sie bei Bedarf weitere Medien hinzu. Legen Sie die Well-Platte zur Inkubation über Nacht in den Zellinkubator. Zu diesem Zeitpunkt enthalten Medien 10% FBS; die normalen Wartungsmedien für jede Zelllinie (Zeitleiste und Schaltplan in Abbildung 1, A).
HINWEIS: Medien in der gesamten VHSE-Kultur können für benutzerdefinierte Zelltypen angepasst werden. Eine gewisse Optimierung kann erforderlich sein.
- Stellen Sie sicher, dass das Kollagengel untergetaucht ist, fügen Sie bei Bedarf weitere Medien hinzu. Legen Sie die Well-Platte zur Inkubation über Nacht in den Zellinkubator. Zu diesem Zeitpunkt enthalten Medien 10% FBS; die normalen Wartungsmedien für jede Zelllinie (Zeitleiste und Schaltplan in Abbildung 1, A).
- Nach der Gelationszeit die 12-Well-Platte des azellulären Kollagens aus dem Inkubator entfernen.
- Medienwechsel am Tag 2 (SD2) unterTauchen
- Ändern Sie 10% FBS-Medien in VHSE-Vertiefungen in 5% FBS halb Fibroblast, halb Endothelmedien, ergänzt mit 100 μg/ml L-Ascorbinsäure. Fügen Sie 500 μL in die obere Kammer des Kultureinsatzes an der Seite des Brunnens hinzu (wiederum vorsichtig an die Seitenwand geben, um die Störung des Kollagens zu minimieren) und fügen Sie 1000 μL in die untere Kammer hinzu.
- Erneuern Sie die Medien alle 2 Tage (SD4 und SD6) bis zum Tag 7 (SD7).
- Verwenden Sie eine manuelle Pipette, um Medien aus den Vertiefungen zu entfernen. Die Verwendung eines Absaugers ist möglich, kann aber zu einer Beschädigung oder Zerstörung des Konstrukts führen.
HINWEIS: L-Ascorbinsäure muss alle 2-3 Tage frisch zubereitet werden (sie oxidiert in Lösung, um Wasserstoffperoxid zu produzieren, wodurch oxidativer Stress und schließlich Zellschäden induziert werden53). Daher müssen die Medien alle 2-3 Tage von SD2 bis zum Ende der VHSE-Kultur gewechselt werden, da L-Ascorbinsäure vorhanden ist. Es ist am einfachsten, einen Vorrat an Medien herzustellen und jeden Fütterungstag eine frisch zubereitete Menge L-Ascorbinsäure zu einem Medienaliquot hinzuzufügen. Verwenden Sie Wasser oder Medien in Kulturqualität als Lösungsmittel und bereiten Sie frische L-Ascorbinsäure bei 100 mg / ml vor. L-Ascorbinsäure stimuliert die Kollagensynthese durch Fibroblasten mit angemessener Geschwindigkeit und fördert die Kollagenstabilität54,55,56; Es verringert auch die endotheliale Permeabilität und erhält die Integrität derGefäßwand 56,57 und trägt zusätzlich zur epidermalenBarrierebildung bei 6,58.
3. Aussaat der epidermalen Komponente und Schichtungsinduktion
- Tauchtag 7 (SD7): Samenkeratinozyten
HINWEIS: Samenkeratinozyten, um die Epidermis auf SD7 zu etablieren. Dieser Zeitpunkt kann basierend auf den Bedürfnissen des Forschers verschoben werden. Die Dauer der Submersionskultur ohne Keratinozyten sollte 9 Tage nicht überschreiten, da ein längeres Eintauchen oft zu einer erhöhten Hautkontraktion führt. Wenn die Kontraktion vor SD7 auftritt, wird empfohlen, die Tauchzeit auf 5 Tage und die Samenepidermis auf SD5 zu verkürzen. Optimieren Sie die Tauchzeit nach Bedarf für bestimmte Experimente (siehe Fehlerbehebung in der Diskussion).- Kulturkeratinozyten (N/TERT-120,59 oder andere geeignete Zellen) bis zu ihrer Konfluenzgrenze vor der Trypsinisierung und Aussaat auf VHSEs. Für N/TERT-1-Zellen sollte die Konfluenz 30% nicht signifikant überschreiten, um eine unerwünschte Differenzierung von Keratinozyten in 2D-Kultur zu verhindern59. Für andere geeignete Zelllinien, wie primäre humane epidermale Keratinozyten, wird im Allgemeinen eine Konfluenzgrenze von 75-80% verwendet60.
- Zählen und suspendieren Sie nach der Trypsinisierung 510.000 Zellen in 600 μL Human Skin Equivalent (HSE) Differenzierungsmedien, ergänzt mit 5% FBS (Tabelle 1).
HINWEIS: 510.000 Zellen in 600 μL erlauben 170.000 Zellen/Konstrukt bei der Aussaat von 200 μL pro Konstrukt (3 VHSEs). - Sammeln und entsorgen Sie mit einer manuellen Pipette Medien, die sich derzeit in der unteren und oberen Kammer für jede Konstruktbohrung befinden. Achten Sie darauf, so viele Medien wie möglich zu sammeln. Sammeln Sie Medien, die direkt unter die durchlässige Membran geklebt werden können, indem Sie die Pipettenspitze vorsichtig unter die Kultureinsatzmembran legen und den Einsatz vorübergehend aus dem Platz schlagen. Medien können aufgrund von Oberflächenspannungen stecken geblieben sein. Stellen Sie sicher, dass die Einsätze flach in ihren Vertiefungen sitzen, bevor Sie fortfahren. Die Verwendung eines Absaugers ist möglich, kann aber zu einer Beschädigung oder Zerstörung des Konstrukts führen.
- Fügen Sie 1 ml HSE-Medien, ergänzt mit 5% FBS, in die untere Kammer jeder Vertiefung hinzu. Dann fügen Sie 200 μL Zellsuspension in die obere Kammer jeder Vertiefung hinzu. Säen Sie direkt auf die dermale Konstruktoberfläche. Lassen Sie Keratinozyten für 2 h im Inkubator absetzen.
- Zwei h nach der Aussaat der Keratinozyten vorsichtig 300 μL HSE-Medien mit 5% FBS in die obere Kammer jedes Konstruktsbrunnens geben; Medien langsam auf die Seite des Kultureinsatzes pipetten. Laden Sie Medien sehr vorsichtig in die obere Kammer, um angesiedelte Keratinozyten, die möglicherweise noch nicht fest am darunter liegenden Kollagengel haften, nicht zu stören.
- Nachdem Sie das Medium geladen haben, legen Sie das Konstrukt wieder in den Inkubator.
- Tauchtag 8/9 (SD8 oder SD9)
- Machen Sie HSE-Medien mit 1% FBS und 100 μg / ml L-Ascorbinsäure ergänzt.
- Entfernen Sie die Medien sowohl aus der oberen als auch aus der unteren Kammer mit einem manuellen Pipettierer.
- 500 μL Medien zuerst in die obere Kammer und dann 1 ml in die untere Kammer geben. (Dieser Schritt kann auf SD8 oder SD9 durchgeführt werden)
- Tauchtag 9/10 (SD9 oder SD10, dies sollte der Tag nach Schritt 3.2 sein)
- Serumfreie HSE-Differenzierungsmedien mit 100 μg/ml L-Ascorbinsäure aufschmischen.
- Entfernen Sie die Medien sowohl aus der oberen als auch aus der unteren Kammer mit einem manuellen Pipettierer.
- 500 μL in die obere Kammer und 1 mL in die untere Kammer laden.
- Luft-Flüssigkeits-Schnittstelle Tag 1 (ALI1)
HINWEIS: ALI wird am Tag nach Schritt 3.3 durchgeführt.- Heben Sie jedes Konstrukt auf die Luft-Flüssigkeit-Schnittstelle (ALI), indem Sie nur Medienabfälle aus der oberen Kammer entfernen. Verwenden Sie eine manuelle Pipette, um der epidermalen Schicht so nahe wie möglich zu kommen, ohne sie zu berühren oder zu beschädigen.
- Neigen Sie die Platte leicht in verschiedenen Winkeln, um das Medium zu sammeln. Entfernen Sie in diesem Schritt so viele Medien wie möglich. Fügen Sie etwa 2 ml steriles Wasser zu den umgebenden Brunnen in der Platte hinzu, um eine konstante Feuchtigkeit aufrechtzuerhalten. Halten Sie die Brunnen während der gesamten Kultur mit Wasser gefüllt.
- Überprüfen Sie die Platte einige h später, um sicherzustellen, dass sich die Keratinozyten noch an der Luft-Flüssigkeits-Grenzfläche befinden. Wenn sich Medien in der oberen Kammer befinden, entfernen Sie sie. Verfolgen Sie, wie viel Medium für jede VHSE-Vertiefung entfernt wird (Das Anfangsvolumen der oberen und unteren Kammern (1500 μL) - Medien entfernt = ein guter Ausgangspunkt für die ALI-Zuführung).
HINWEIS: VHSEs benötigen nicht unbedingt das gleiche Medienniveau für lufthebend; Normalerweise, wenn die VHSEs zusammengesät sind, benötigen sie ungefähr das gleiche Maß an Medien für den Luftauftrieb, aber das ist nicht immer der Fall. Passen Sie die Lautstärke nach Bedarf an, um ALI beizubehalten, stellen Sie jedoch sicher, dass die Medienpegel nicht so niedrig sind, dass die VHSEs austrocknen. Es ist sicherer, vorsichtig zu sein und täglich kleine Medienmengen zu entfernen, bis ein Gleichgewicht zwischen Luftauftrieb und Hydratation erreicht ist.
- ALI Tag 2 (ALI2)
- Verwenden Sie ab diesem Zeitpunkt nur noch serumfreie HSE-Medien, die mit 100 μg/ml L-Ascorbinsäure ergänzt sind. Wechseln Sie die Medien am ALI Tag 2 (ALI2). Wenn sich Medien in der oberen Kammer befinden, entfernen Sie sie und fügen Sie sie der Zuvor aufgezeichneten Menge der entfernten Medien hinzu. Berechnen Sie das benötigte Medienvolumen mithilfe der Gleichung im vorherigen Schritt. Zum Beispiel: Wenn 200 μL Medium aus der oberen Kammer entfernt wurden, fügen Sie 1300 μL hinzu, um ALI zu etablieren (als 1500 μL - 200 μL = 1300 μL)
- Verwenden Sie das berechnete Volumen, um in die untere Kammer jedes Brunnens zu laden, und legen Sie die Platte dann wieder in den Zellinkubator. Behalten Sie den Überblick über das pro Tag verwendete Volumen. Bei Verwendung der empfohlenen Kollagenmengen in 12-Well-Kultureinsätzen liegt der übliche Bereich der ALI-Werte zwischen 750 μL und 1300 μL. Typischerweise nimmt das Volumen mit der Kulturreifung ab und wird um Woche 2/3 von ALI konsistent. Je nach Kulturspezifum kann sich diese Zahl ändern und muss optimiert werden (wie in 3.4.2 - 4.1 beschrieben).
4. Routinemäßige Aufrechterhaltung des vaskulären Äquivalents der menschlichen Haut
- Vom ALI-Tag 3 (ALI3) bis zum Kulturendpunkt: Erneuern Sie alle 2-3 Tage Medien der unteren Kammer mit serumfreien HSE-Medien mit 100 μg/ml L-Ascorbinsäure. Fahren Sie mit der Anpassung und Verfolgung des Medienpegels fort, der in der unteren Kammer für ALI benötigt wird, wie in Schritt 3.5.2 beschrieben.
- Da die epidermale Oberfläche in Kontakt mit der Luft bleiben muss, überprüfen und passen Sie den Medienpegel täglich an, bis konsistente ALI-Werte festgelegt sind. Die epidermale Schicht sollte hydratisiert und nicht trocken aussehen, aber es sollten keine Medien auf dem Konstrukt gebündelt sein. Kulturen mit 8 Wochen ALI haben die konsistenteste Morphologie und Expression geliefert; Je nach Anwendung können jedoch Kulturen von 4 bis 12 Wochen angemessen sein. Möglicherweise muss die Kulturdauer für verschiedene Zell- und Kulturbedingungen optimiert werden.
HINWEIS: Medienwechsel Montag, Mittwoch, Freitag ist eine gute Praxis. Die VHSEs sind am Wochenende gesund, aber die Medien sollten am Montag früh und am Freitag spät gewechselt werden. Nach vollständigem Abschluss der Schritte 1-4 ist die Generierung einer VHSE abgeschlossen. Die Schritte 5-End des Protokolls sind optionale Verarbeitungs- und Bildgebungstechniken, die für diese Art von 3D-Konstrukt optimiert wurden.
5. Fixierung und Permeabilisierung von 3D-Konstrukten
HINWEIS: Schritt 5 wurde für bildgebende Verfahren optimiert, die für dieses 3D-Konstrukt spezifisch sind und im Rest des Protokolls beschrieben werden. Die folgenden Schritte sind zum Generieren einer VHSE nicht erforderlich.
- Fixierung/Permeabilisierung
- Entfernen Sie vorsichtig alle Medien aus den oberen und unteren Kammern jedes Brunnens am Endpunkt der Kulturperiode.
HINWEIS: Die epidermale Schicht ist möglicherweise zerbrechlich, vorsichtig behandeln und die Epidermis nicht mit aggressivem Pipettieren aufrühren. - Fügen Sie 4% Paraformaldehyd (PFA) in PBS (pH 6,9) an die obere Kammerwand (nicht direkt am Konstrukt) und dann in die untere Kammer hinzu, um jedes Konstrukt vorzufixieren. Fügen Sie 1 ml pro Kammer hinzu und belichten Sie sie für 5 min bei Raumtemperatur.
ACHTUNG: PFA ist gefährlich und sollte mit Sorgfalt und geeigneter persönlicher Schutzausrüstung (PSA), einschließlich Augenschutz, behandelt werden. - Entfernen Sie 4% PFA-Lösung nach 5 min und fügen Sie die 0,5% Triton X 100 in 4% iger PFA-Lösung in die obere und untere Kammer hinzu, wie im vorherigen Schritt beschrieben. 1 Stunde bei Raumtemperatur exponieren; VHSE-Konstrukt benötigt von nun an keine sterile Umgebung mehr.
- Nach 1 Stunde die Permeabilisierungs-/Fixierungslösung vorsichtig aus beiden Kammern entfernen und die Probe 3 mal mit 1x PBS waschen.
- Bewahren Sie die Proben in PBS in 4 °C Kühlung auf oder verfärben Sie sie sofort. Um die Proben zu lagern, wickeln Sie die Schale in eine Plastikfolie und dann Folie, um Verdunstung und Lichteinwirkung zu minimieren
HINWEIS: Pausenpunkt - Nach der Fixierung und Permeabilisierung kann dieser Vorgang pausiert werden, da die Proben mehrere Wochen lang stabil sind, wenn sie wie in Schritt 5.1.5 beschrieben vorbereitet werden. Alternativ kann die Färbung (wie in Schritt 6 beschrieben) unmittelbar nach Schritt 5 abgeschlossen werden.
- Entfernen Sie vorsichtig alle Medien aus den oberen und unteren Kammern jedes Brunnens am Endpunkt der Kulturperiode.
6. Immunfluoreszierende Färbung von 3D-Konstrukten
- Konstruktvorbereitung
HINWEIS: VHSEs färben gut, wenn sie von der porösen Membran des Kultureinsatzes getrennt sind; Die Trennung von der Membran ist auch für die ungehinderte Bildgebung notwendig und ermöglicht reduzierte Volumina für die Färbung.- Um das Konstrukt für die immunfluoreszierende Färbung vorzubereiten, drehen Sie einen Einsatz auf den Kopf und legen Sie ihn über seinen Brunnen auf die Bohrplatzplatte (wenn die VHSE fällt, fällt sie mit PBS in die Vertiefung) (Ergänzende Abbildung 1A).
- Stabilisieren Sie den Einsatz mit einer Hand über dem Brunnen, während Sie mit einer feinen Spitzenzette und/oder einem Präzisionsmesser etwa die Hälfte des Umfangs der Einsatzmembran schneiden. Schneiden Sie mit einer sanften Hand so nah wie möglich am Kunststoffgehäuse, um eine Beschädigung des VHSE-Konstrukts zu vermeiden.
- Greifen Sie mit der Feinspitzenzette den Rand der geschnittenen Membranklappe und schälen Sie die poröse Membran vorsichtig vom Einsatz sowie vom VHSE-Konstrukt. Tun Sie dies sehr vorsichtig und langsam, um Schäden an der VHSE-Konstruktstruktur zu vermeiden. Wenn sich das VHSE-Konstrukt leicht trennt, sollte es in den Darunterbrunnen fallen, wenn es an der Seite der Kammer stecken bleibt, verwenden Sie die feine Spitzenzette oder eine kleine Schaufel, um es zum Brunnen zu bewegen. Achten Sie sehr auf die epidermale Schicht, da sie normalerweise zerbrechlich ist (Ergänzende Abbildung 1A).
HINWEIS: Manchmal löst sich die Membran nicht leicht oder löst sich in Stücken, wenn dies geschieht, verwenden Sie die Werkzeuge, um die Membran und das VHSE-Konstrukt vorsichtig auseinander zu ziehen. Stellen Sie sicher, dass die VHSEs während dieses Vorgangs nicht austrocknen, indem Sie bei Bedarf pbS eintauchen. - Sobald sich die VHSE im Bohrplatz befindet, entsorgen Sie alle verbleibenden Teile der Einlegemembran und halten Sie das Kultureinsatzgehäuse in jedem Bohrplatz, um die VHSEs während der Färbung in einer untergetauchten Position zu halten.
- Färbung
HINWEIS: Das Färben und die damit verbundene Handhabung/Manipulation und Waschungen sollten so schonend wie möglich durchgeführt werden, da VHSEs zerbrechlich sein können. Wenn Teile der Epidermis abheben, können die Stücke separat gefärbt werden; Die oberen Schichten der Epidermis sind zerbrechlich und durchlaufen eine natürliche Abschämung4, aber für die Analyse ist es wichtig, die Integrität so weit wie möglich zu erhalten.- Bereiten Sie die ausgewählten primären Antikörperfärbungen in 700 μL Blockierpuffer pro Konstrukt gut vor (typischerweise können sich alle primären Antikörper in derselben Färbelösung befinden, dies sollte jedoch für neue Antikörper bestätigt werden). 700 μL funktioniert für 12-Well-Größe, kann aber für andere Kulturformate angepasst werden. Empfohlene Konzentrationen von primären und sekundären Antikörpern mit blockierender Pufferrezeptur sind in Tabelle 3 angegeben (eine Optimierung kann erforderlich sein).
- Entfernen Sie PBS aus dem Brunnen mit einer manuellen Pipette, achten Sie darauf, VHSEs weg zu pipetten (da VHSEs schwimmen, wird eine Vakuumaspiration nicht empfohlen).
- Fügen Sie die primäre Fleckenlösung zu jeder Vertiefung hinzu und legen Sie das Gehäuse des Kultureinsatzes in die Vertiefung, um die VHSE in Flüssigkeit zu tauchen (Ergänzende Abbildung 1B). Wickeln Sie den Brunnenteller mit Plastikfolie ein. Folie und Fleck für 48 h in 4 °C Kühlung ohne Rühren oder Schaukeln (Schaukeln kann das VHSE-Konstrukt beschädigen).
- Nach 48 h sekundäre Antikörper und chemische Flecken in 700 μL Blockierpuffer (pro Vertiefung) vorbereiten.
- Entfernen Sie das Kultureinsatzgehäuse und die primäre Fleckenlösung und waschen Sie es mit 1x PBS, 3x für 5 min, bevor Sie die sekundäre Fleckenlösung hinzufügen. Setzen Sie das Gehäuse des Kultureinsatzes wieder in den Brunnen ein, um das VHSE-Konstrukt unter Wasser zu halten (Ergänzende Abbildung 1B). 48 h in 4 °C Kühlung ohne Rühren oder Schaukeln auslegen.
- Nach 48 h Exposition die Fleckenlösung mit einem manuellen Pipettierer entfernen und 3x vorsichtig mit PBS waschen; Pipetieren Sie keine Flüssigkeit direkt auf die VHSEs, da sie zerbrechlich sein können. Rehydrieren Sie mit überschüssigem PBS und legen Sie das Kultureinsatzgehäuse wieder in den Brunnen, um das VHSE während der Lagerung untergetaucht und hydratisiert zu halten (durch Einwickeln in Plastikfolie und Folie lagern, um Verdunstung und Lichteinwirkung zu minimieren)
- Clearing (optional & Terminal)
HINWEIS: Das Löschen ist für die Bildgebung optional. Wenn es abgeschlossen ist, sollte es nach dem Färben / Abbilden der Probe vollständig durchgeführt werden, da das Reinigen eine weitere Färbung verhindert, die Fluorophorleistung verändern und die VHSE-Struktur beschädigen kann. Es gibt mehrere Gewebereinigungsmethoden49,61,62 und können für spezifische Projekte optimiert werden. Die unten beschriebene Methylsalicylat-Reinigung ist sowohl einfach als auch effektiv für VHSE. Die folgende Räumtechnik muss in Glasbehältern durchgeführt werden und die Pipettenspitzen müssen aus Glas oder Polypropylen bestehen (Polystyrol löst sich in Kontakt mit Methylsalicylat auf). Schließen Sie alle Räumverfahren in einem gut belüfteten Bereich oder Abzug ab.- Fügen Sie 100% Methanol in einen kleinen flachen Glasbehälter hinzu (Glas-Petrischalen funktionieren gut). Verwenden Sie den kleinstmöglichen Behälter, der zum Konstrukt passt (um Reagenzienverschwendung zu minimieren).
- Entfernen Sie das Konstrukt mit einer Zette/Schaufel aus der Bohrplatzplatte (Ergänzende Abbildung 1C) und legen Sie es in den mit Methanol gefüllten Behälter. Fügen Sie mehr Methanol hinzu, wenn das Konstrukt nicht untergetaucht ist.
- Dehydrieren Sie das VHSE-Konstrukt in Methanol für 3 x 10 min Eintauchen; Methanol nach jedem Eintauchen vollständig ersetzen und Methanol nach dem letzten Bad umgehend entfernen. Im Laufe dieses Verfahrens kann das Konstrukt undurchsichtiger werden und leicht schrumpfen.
HINWEIS: Diese Dauer und Wiederholungen wurden optimiert, aber Methanol und die folgenden Methylsalicylatverfahren müssen möglicherweise angepasst werden, abhängig vom spezifischen Kulturformat und den Flecken. - Unmittelbar nach dem Entfernen von Methanol Methylsalicylat hinzufügen und die VHSE in 5 x 5 min Eintauchen tauchen. Ersetzen Sie das Reagenz nach jedem Eintauchen vollständig und lassen Sie die VHSE in der 5. Tauchlösung zur Lagerung. Im Laufe dieses Verfahrens wird das Konstrukt transparent.
- Stellen Sie sich das Konstrukt oder den Speicher bei 4 °C vor. Schließen Sie nach dem Löschen alle Bildgebungen so schnell wie möglich ab, da die Fluorophore innerhalb von Tagen in Methylsalicylat abgebaut werden können. Die Reinigung führt dazu, dass die Konstrukte spröde werden und die erweiterte Lagerung, obwohl nicht empfohlen, eine regelmäßige Überprüfung erfordert, um sicherzustellen, dass eine ausreichende Menge an Methylsalicylat vorhanden ist.
7. Konfokale Abbildung von 3D-Konstrukten
HINWEIS: Die Bildgebung durch Gewebekulturkunststoff liefert nicht die gleiche Bildqualität wie die Bildgebung durch Abdeckglas, diese Methode beschreibt die Herstellung einer benutzerdefinierten Glasbodenbohrung, um das Austrocknen während der konfokalen Bildgebung zu verhindern. Typischerweise reicht dies für mindestens 3 Stunden Bildgebung aus.
- Zwei Tage vor der Bildgebung: Polydimethylsiloxan (PDMS) vorbereiten
- PDMS48,63,64 bei einer vorgeschlagenen Konzentration von [9:1], Basis: Vernetzer vorbereiten. Bereiten Sie insgesamt 30 g PDMS vor: 27 g Basiskomponente und 3 g Vernetzer. Stellen Sie ein sauberes Mischgefäß auf eine Waage und tarieren Sie die Waage. Fügen Sie die Basis (27 g) hinzu und fügen Sie dann den Vernetzer (3 g) hinzu, um insgesamt 30 g zu erreichen. Fügen Sie die Basis immer vor dem Crosslinker hinzu.
- Rühren Sie die Lösung mindestens 4 Minuten lang kräftig um; Dadurch entstehen kleine Blasen. Nach ausreichendem Mischen gießen Sie das PDMS in eine 100-mm-Petrischale oder einen ähnlichen hitzebeständigen Behälter mit flachem Boden.
- Entgasen Sie das PDMS in einer Vakuumkammer, bis alle Blasen aus dem Mischen verschwinden und PDMS klar ist. Lassen Sie das Vakuum langsam los und entfernen Sie das PDMS (langsam). Das Gericht in einen Ofen stellen, um über Nacht auszuhärten (50-60 ° C); Stellen Sie sicher, dass das Gericht flach sitzt, damit PDMS gleichmäßig aushärten kann.
HINWEIS: Nach dem Aushärten sollte PDMS klar sein und die Oberfläche sollte glatt und nicht klebrig sein (Klebrigkeit kann auf eine unzureichende Durchmischung hinweisen).
- Einen Tag vor der Bildgebung: PDMS-Brunnenvorbereitung
- Stanzen oder ausschneiden Sie mit einem Stahlstempel oder einem Handpräzisionsmesser einen kreisförmigen Brunnen aus dem in 7.1 vorbereiteten PDMS-Blatt. Der Brunnen sollte ungefähr die gleiche Größe wie das VHSE-Konstrukt haben. Schneiden Sie einen quadratischen Fleck um den kreisförmigen Brunnen, um einen einzelnen PDMS-Brunnen zu erstellen. Die vorbereitete PDMS-Menge von 30 g sollte mindestens vier kundenspezifische Bohrungen ergeben.
HINWEIS: Die PDMS-Vertiefung muss nahe an der Größe des VHSE-Konstrukts liegen. Es muss die Probenbewegung während der Bildgebung einengen. Mehrere Brunnen können gleichzeitig hergestellt und unbegrenzt in einem sauberen Behälter gelagert werden. - Mit einem Glasdeckel von ähnlicher Größe wie der PDMS-Brunnen Cyanacrylatkleber (z. B. Sekundenkleber) auf die Unterseite des PDMS (die glatte Oberfläche, die mit der Petrischale in Kontakt kam) geben und gleichmäßig mit einer Einwegpipettenspitze verschmieren. Zentrieren Sie und drücken Sie das PDMS gut auf das Glas, während Sie ein klares Glasfenster innerhalb des gestanzten Kreises lassen (stellen Sie sicher, dass der Kleber nicht über das Sichtfenster verschmiert ist).
HINWEIS: Falls verfügbar, ist die Plasmabindung des PDMS an den Abdeckrlip eine Alternative65,66,67. - Lassen Sie den Kleber vor dem Verwenden mehrere Stunden oder über Nacht trocknen. Diese sind wiederverwendbar, bis sie von normalem Verschleiß brechen.
HINWEIS: Es wird nicht empfohlen, die Proben in dem geklebten PDMS zu färben, das gut für die Bildgebung verwendet wird. Diese Vertiefungen halten Flüssigkeit für mehrere Stunden, können aber bei längerer Färbung auslaufen.
- Stanzen oder ausschneiden Sie mit einem Stahlstempel oder einem Handpräzisionsmesser einen kreisförmigen Brunnen aus dem in 7.1 vorbereiteten PDMS-Blatt. Der Brunnen sollte ungefähr die gleiche Größe wie das VHSE-Konstrukt haben. Schneiden Sie einen quadratischen Fleck um den kreisförmigen Brunnen, um einen einzelnen PDMS-Brunnen zu erstellen. Die vorbereitete PDMS-Menge von 30 g sollte mindestens vier kundenspezifische Bohrungen ergeben.
- VHSE-Bildgebung
HINWEIS: Wenn die Bildgebung von Proben nicht gerinnt wurde, verwenden Sie PBS als Bildgebungslösung. Wenn Sie mit gereinigten Proben abbilden, verwenden Sie Methylsalicylat (oder die gewählte Clearinglösung) als Bildgebungslösung.- Fügen Sie ein paar Tropfen Bildgebungslösung in den PDMS-Brunnen hinzu und überprüfen Sie auf Lecks (wenn es ein Leck gibt, reparieren Sie es mit einem Punkt / einem Abstrich von Cyanacrylat-Sekundenkleber oder verwenden Sie einen anderen Brunnen).
- Halten Sie die Imaging-Lösung im PDMS gut, wenn Sie die VHSE hinzufügen. Entfernen Sie mit Scoopula oder feiner Spitzenzette (Ergänzende Abbildung 1C) das Konstrukt von der 12-Well-Platte und legen Sie es in das PDMS-Gut auf den Glasdeckel. Platzieren Sie das Konstrukt mit der Ausrichtung des Interesses auf das Ziel. Um beispielsweise die Epidermis mit einem invertierten Mikroskop abbilden zu können, stellen Sie sicher, dass die Epidermis nach unten zum Glas zeigt.
- Alternativ, für ein aufrechtes Mikroskop, blicken Sie auf die Epidermis nach oben. Die folgenden bildgebenden Verfahren sind für ein invertiertes Mikroskop beschrieben, könnten aber leicht für ein aufrechtes Mikroskop angepasst werden.
HINWEIS: Seien Sie vorsichtig, wenn Sie die VHSE manipulieren, um Schäden zu vermeiden. Übertragen Sie über die Bohrplatte, falls die VHSE fällt. Eine gebogene, flache Spitzenschaufel ist der einfachste Weg, das Konstrukt zu übertragen (Ergänzende Abbildung 1C).
- Alternativ, für ein aufrechtes Mikroskop, blicken Sie auf die Epidermis nach oben. Die folgenden bildgebenden Verfahren sind für ein invertiertes Mikroskop beschrieben, könnten aber leicht für ein aufrechtes Mikroskop angepasst werden.
- Stellen Sie sicher, dass die Probe flach im Brunnen sitzt und dass keine Teile der Epidermis oder Dermis unter der Probe gefaltet sind. Wenn eine Faltung auftritt, manipulieren Sie die Probe vorsichtig mit einer Zette oder einer Schaufel; Das vorübergehende Hinzufügen einer zusätzlichen Bildgebungslösung, um die VHSE zu schweben, kann dazu beitragen, dass sie sich gerade richtet. Falten oder Falten der Probe können mit dem Auge oder mit dem Mikroskop gesehen werden.
- Füllen Sie den Brunnen mit bildgebender Lösung und verwenden Sie gerade genug Flüssigkeit, um die Probe hydratisiert zu halten. Zu viel Flüssigkeit schwimmt die Probe, was zu Bewegungen während der Bildgebung führt. Das Konstrukt sollte auf dem gläsernen Sichtfenster sitzen; Testen Sie die Bewegung, indem Sie das PDMS gut neigen. Wenn es Bewegung gibt, entfernen Sie etwas Flüssigkeit; Fügen Sie Flüssigkeitstropfen hinzu und entfernen Sie sie, bis die Bewegung aufhört.
- Legen Sie einen Glasträger über die Vertiefung, um die Verdunstung während der Bildgebung zu minimieren (Ergänzende Abbildung 1D). Bei längeren Bildgebungssitzungen überprüfen Sie die Probe häufig, um den richtigen Flüssigkeitsstand sicherzustellen. Wenn zugänglich, kann eine befeuchtete Kammer während der Bildgebung verwendet werden (obwohl dies normalerweise nicht erforderlich ist).
- Legen Sie die Probe auf den Mikroskopstand und das Bild durch das Glasabdeckungsfenster (Ergänzende Abbildung 1D). Diese Technik ermöglicht mindestens 3 Stunden kontinuierliche konfokale Bildgebung, aber die Hydratation der Probe sollte regelmäßig überprüft werden, wobei bei Bedarf eine Bildgebungslösung hinzugefügt werden sollte.
HINWEIS: Wenn die Probe gereinigt wird, baut Methylsalicylat den Klebstoff im Laufe der Zeit ab. Die Leimverklebung des PDMS kann zwischen den Bildgebungsläufen erneut aufgetragen werden. oder die Probe kann periodisch in neue Bohrungen überführt werden. In Vertiefungen mit Plasmabindung wird dies kein Problem darstellen. - Nach der Bildgebung die Probe mit Bildflüssigkeit so weit wie möglich in der Vertiefung schweben. Verwenden Sie eine Schaufel oder eine Feine Spitzenzette, um die Probe in ihre Lagerbohrung zu überführen. Führen Sie den Transfer über eine Bohrplatte durch, falls die Probe fällt.
- Jeder PDMS-Brunnen und jeder obere Glasdeckel können wiederverwendet werden, bis sie brechen. Reinigen Sie das Bodenglas vor der Bildgebung, sowohl innerhalb als auch außerhalb des Brunnens. Vor der Wiederverwendung immer auf Lecks prüfen und bei Bedarf mit Klebstoff reparieren.
- Speichern Sie Beispiele wie in Schritt 6.3.6 beschrieben und fügen Sie PBS alle paar Monate zur Wartung hinzu. Wenn die Proben geklärt sind, mit Methylsalicylat in Glas lagern und die Werte regelmäßig überprüfen. Gelöschte Proben können schnell (innerhalb von Tagen) abgebaut werden und sollten so schnell wie möglich abgebildet werden.
Ergebnisse
Hier wird ein Protokoll zur Erzeugung von in vitro vaskularisierten menschlichen Hautäquivalenten (VHSE) unter Verwendung von Telomerase-Reverse-Transkriptase (TERT) immortalisierten Keratinozyten (N / TERT-120,59),adulten menschlichen dermalen Fibroblasten (hDF) und menschlichen mikrovaskulären Endothelzellen (HMEC-1) vorgestellt (Abbildung 1). Darüber hinaus wird die Anpassbarkeit dieses Protokolls durch den Nachweis der VHSE-Erzeugung und -Stabilität bei der Verwendung allgemein verfügbarer Lungenfibroblasten (IMR90) anstelle von hDF unterstrichen. Die Generierung der VHSE erfolgt in den Schritten 1-4, während die Schritte 5-7 optionale Endpunktverarbeitungs- und Bildgebungstechniken sind, die für diese VHSEs optimiert wurden. Es ist wichtig zu beachten, dass die VHSEs nach spezifischen Forschungsfragen verarbeitet werden können und die Schritte 5-7 nicht erforderlich sind, um das Konstrukt zu generieren. Volumetrische Bildgebung, Analyse und 3D-Renderings wurden durchgeführt, um eine volumetrische Analysemethode zu demonstrieren. Diese volumetrischen Konstruktvorbereitungs- und Bildgebungsprotokolle bewahren die VHSE-Struktur sowohl auf mikroskopischer als auch auf makroskopischer Ebene und ermöglichen eine umfassende 3D-Analyse.
Die Charakterisierung der Epidermis und Dermis zeigt geeignete immunfluoreszierende Marker für die menschliche Haut in den VHSE-Konstrukten (Abbildung 2, 3). Cytokeratin 10 (CK10) ist ein Keratinozytenmarker zur Frühdifferenzierung, der normalerweise alle suprabasalen Schichten in den Hautäquivalenten18,30,68 markiert ( Abbildung2). Involucrin und Filaggrin sind späte Differenzierungsmarker in Keratinozyten und markieren die obersten suprabasalen Schichten in den Hautäquivalenten12,30,68,69 ( Abbildung2). Ein weitroter fluoreszierender Kernfarbstoff (siehe Materialliste) wurde verwendet, um Kerne sowohl in der Epidermis als auch in der Dermis zu markieren, wobei Col IV das Gefäßsystem der Dermis markierte (Abbildung 2, Abbildung 3, Abbildung 4). Epidermale Basalmembrankomponenten (BM) werden in HSE-Kulturen nicht immer richtig exprimiert15,16; und Col IV Färbung des BM wird mit diesem Protokoll nicht konsequent beobachtet. Forschungsorientierte BM-Komponenten und -Strukturen würden von zusätzlichen Medien-, Zell- und Bildgebungsoptimierungen profitieren14.
Obwohl die konfokale Bildgebung durch den Großteil der VHSE-Kulturen oft hochauflösende Bilder liefert, die für die computergestützte Analyse der Dermis und Epidermis ausreichen, ermöglicht die beschriebene Clearing-Methode eine tiefere Gewebebildgebung. Das Clearing verbessert die eindringtiefe des konfokalen Lasers, und eine effektive Bildgebung in VHSEs kann für gereinigte Proben auf über 1 mm erreicht werden (verglichen mit ~ 250 μm für ungeklärte). Die beschriebene Clearingtechnik (Methanoldehydratisierung und Methylsalicylat) stimmt ausreichend mit dem Brechungsindex im gesamten VHSE-Probengewebeüberein 61. Das Löschen der VHSE ermöglichte eine einfache Bildgebung des gesamten Konstrukts ohne Manipulation (z. B. Neuausrichtung des Konstrukts, um Dermis und Epidermis separat abbilden zu können) (Abbildung 3).
Volumetrische Bilder ermöglichen die Generierung von 3D-Rendering, um Vaskulaturen in jedem Konstrukt abzubilden (Abbildung 4). Kurz gesagt, konfokale Bildsätze wurden in dermaler bis epidermaler Ausrichtung mehrerer Untervolumina von VHSEs aufgenommen, um Kollagen IV-Flecken (Markierung von Gefäßwänden) und Kerne (gekennzeichnet durch einen weit roten fluoreszierenden Kernfarbstoff) zu erkennen. Bildstapel werden in Computersoftware geladen (siehe Materialliste) und ein benutzerdefinierter Algorithmus (basierend auf diesen Quellen 48,70,71,72,73,74,75) wird für das 3D-Rendering und die Quantifizierung verwendet, wie zuvor beschrieben48. Dieser Algorithmus segmentiert automatisch die vaskuläre Komponente basierend auf dem Col IV-Fleck. Die volumetrische Segmentierung wird an einen Skelettierungsalgorithmus übergeben, der auf dem schnellenMarschieren 75,76,77basiert. Die Skelettierung findet das definitive Zentrum jedes Col IV markierten Gefäßes und die resultierenden Daten können verwendet werden, um den Gefäßdurchmesser sowie den Gefäßanteil zu berechnen (Abbildung 4). Die Weitfeld-Fluoreszenzmikroskopie ist eine zugängliche Option, wenn keine Laserscanning-Mikroskopie verfügbar ist. das Gefäßnetzwerk und die Epidermis können mit Weitfeld-Fluoreszenzmikroskopie abgebildet werden (Ergänzende Abbildung 2). Die dreidimensionale Quantifizierung ist mit weitfeldgestützter Bildgebung von VHSEs anstelle von Laser-Scanning-Mikroskopie möglich, obwohl sie aufgrund von Licht außerhalb der Ebene mehr Filterung und Dekonvolution von Bildern erfordern kann.
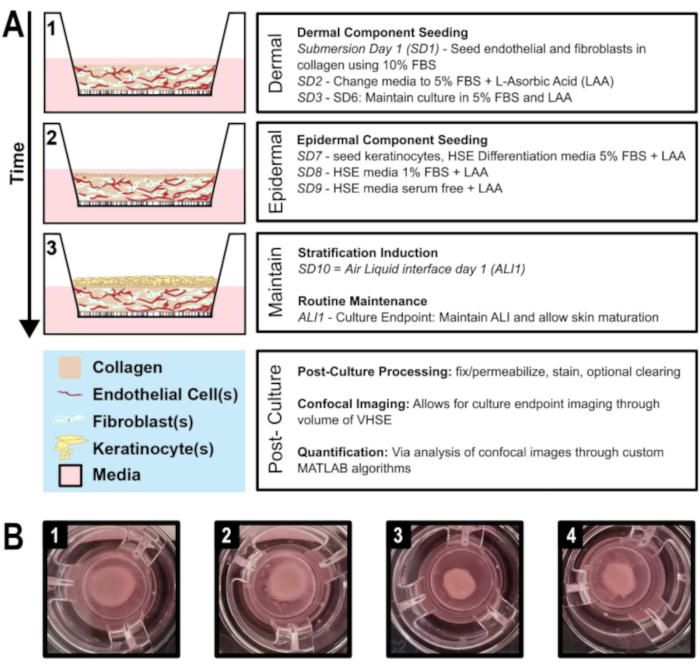
Abbildung 1: Schematische Zeitleiste der vaskularisierten Äquivalenterzeugung menschlicher Haut. A) Zeigt den Verlauf des VHSE-Modells von 1) dermaler Komponentenaussaat, 2) Keratinozytenaussaat auf die dermale Komponente, 3) epithelialer Schichtung über Luftflüssigkeitsschnittstelle und Kulturerhaltung. Postkulturverarbeitung und volumetrische Bildgebung können am Kulturendpunkt durchgeführt werden. B) Kamerabilder der hDF-VHSE-Makrostruktur in den Kultureinfügungen an ihrem Kulturendpunkt, 8 Wochen. Verschiedene Kontraktionsstufen sind für VHSEs normal; Die Kontraktion kann reduziert werden, wie das Protokoll beschreibt. (1 & 2) Weniger kontraktionierte Proben. (3 & 4) Mehr kontraktionierte Proben ergeben immer noch richtige Hautelemente. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
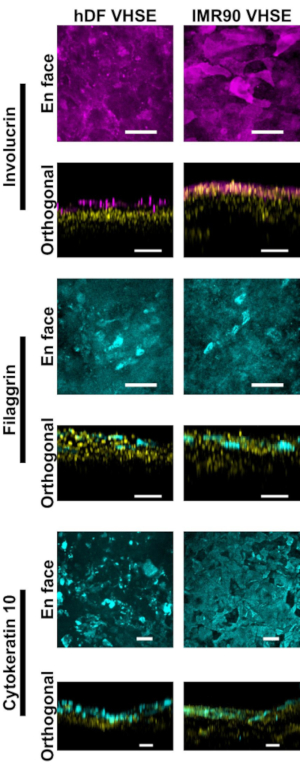
Abbildung 2: Epidermale Charakterisierung mittels immunfluoreszierender Marker. Alle Bilder wurden von VHSEs zum 8wk-Kulturzeitpunkt mittels konfokaler Mikroskopie aufgenommen. Entsprechende Färbemethoden sind im Protokollschritt 6 beschrieben. Richtige Epithelmarker sind sowohl in hDF-VHSEs (linke Spalte) als auch in IMR90-VHSEs (rechte Spalte) vorhanden. Involucrin und Filaggrin sind späte Differenzierungsmarker von Keratinozyten und zeigen, dass die Epidermis bei beiden VHSE-Typen vollständig geschichtet ist. Cytokeratin 10 ist ein früher Differenzierungsmarker, der suprabasale Schichten in den VHSEs identifiziert. Kerne sind in orthogonalen Ansichten gelb dargestellt. En-Face- und orthogonale Max-Projektionsbilder wurden über Eine Computersoftware gerendert; Die Bilder werden aus Gründen der Übersichtlichkeit individuell mit Hintergrundsubtraktion und Medianfilterung skaliert. Skalenriegel sind 100 μm. (Primäre und sekundäre Antikörper mit hauseigenem Blockierpufferrezept sind in Tabelle 3 angegeben). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
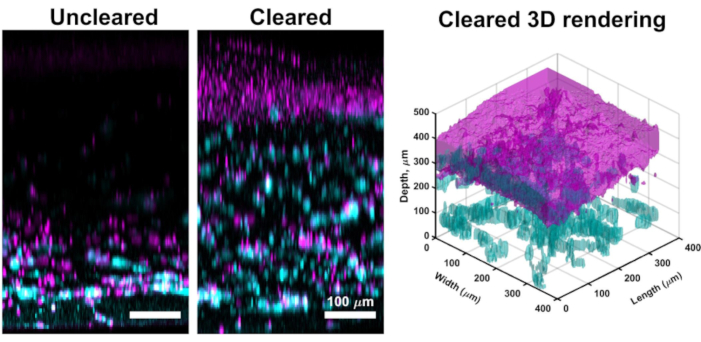
Abbildung 3: Vergleich von ungeklärter vs. gelöschter VHSE. Diese VHSE wurde mit IMR90s erzeugt und Bilder wurden zum Zeitpunkt der 4wk-Kultur mittels konfokaler Mikroskopie aufgenommen. Kollagen IV wird in Cyan gezeigt; Kerne sind in Magenta dargestellt; Magenta im cleared 3D-Rendering stellt die Konsolidierung von Kernen in der epidermalen Schicht der VHSE dar. Das ungeklärte VHSE-Bild ist ein Beispiel für Laserdämpfung in dickeren VHSE-Konstrukten, durch Clearing (Methanol und Methylsalicylat) kann das gesamte Konstrukt mit wenig / keiner Laserdämpfung von der dermalen Seite des Konstrukts abgebildet werden. Die Bildgebungseinstellungen wie Laserlinie, Verstärkung und Loch wurden für die gereinigte VHSE gesenkt, um die Übersättigung zu reduzieren. Die Klärung und Bildgebung wurde wie in den Schritten 6 und 7 des Protokolls beschrieben abgeschlossen. Orthogonale Max-Projektionsbilder und 3D-Rendering wurden mit Computersoftware abgeschlossen, 3D-Rendering wurde aus gelöschten Konstruktbildern generiert. Die Bilder werden aus Gründen der Übersichtlichkeit individuell mit Hintergrundsubtraktion und Medianfilterung skaliert. Maßstabsbalken sind 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
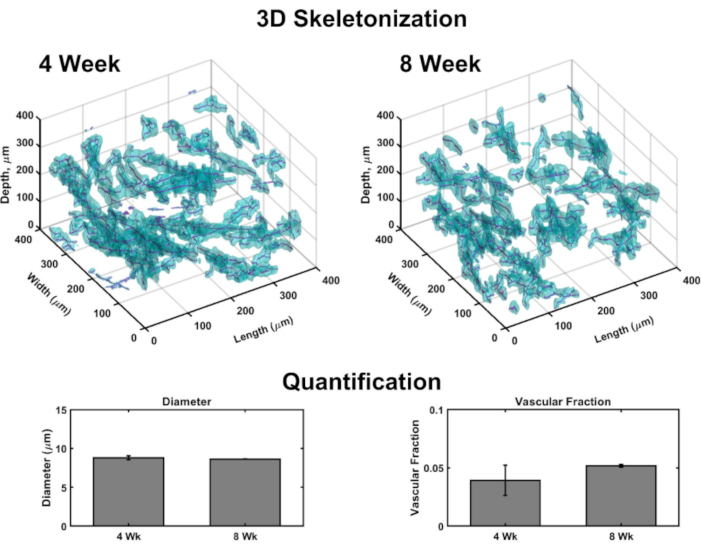
Abbildung 4: Dreidimensionale Analyse von Vaskulaturen innerhalb von VHSEs. Volumetrische Bilder, die mittels konfokaler Mikroskopie aufgenommen wurden, ermöglichen die Quantifizierung vaskulärer Parameter an den Kulturendpunkten durch computergestützte Bildanalyse. Aus VHSE-Untervolumina markiert der Nachweis von Kollagen-IV-Färbung (Cyan) Endothelwände von Gefäßen und ermöglicht die Segmentierung des Gefäßes basierend auf der Kollagen-IV-Position; Segmentierungsdaten werden dann skelettiert und das Zentrum jedes Gefäßes wird gefunden (Magenta). Beispiele für die 3D-Skelettierung werden für 4-wöchige und 8-wöchige IMR90-VHSE-Proben gezeigt, die nicht gelöscht wurden. Die resultierenden Daten eines IMR90 VHSE-Experimentsatzes wurden verwendet, um die Gefäßdurchmesser und die vaskulären Fraktionen für vier Untervolumina (jeweils 250 μm in z-Richtung) innerhalb jedes Konstrukts zu berechnen, die Daten wurden pro VHSE gemittelt und weiter pro Kulturzeitpunkt gemittelt. Diese Daten zeigen die vaskuläre Netzwerk-Homöostase, die 4- und 8-wöchige Kulturdauern mit Durchmessern umfasst, die für die menschliche Haut in vivo relevantsind 78,und die vaskuläre Fraktion in der gleichen Reihenfolge wie in vivo menschliche Haut79 (vaskuläre Fraktion in Kollagenkonstrukten hat sich als anpassbar48 erwiesen und könnte für erhöhte Werte weiter optimiert werden). Daten werden als Mittel ± Standardfehlermittelwerts (S.E.M dargestellt; n = 3 für jeden Zeitpunkt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Medien | Komponenten |
| Humane dermale Fibroblasten-Zelllinie (hDF) | DMEM HG |
| 5% fetales Rinderserum (FBS) | |
| 1% Penicillin/Streptomycin (P/S) | |
| IMR90 Fibroblasten-Zelllinie | DMEM/HAM'S F12 50:50 |
| 10% FBS | |
| 1% P/S | |
| HMEC-1 Endothelzelllinie | MCDB131 Basismedium |
| 10% FBS | |
| 1% P/S | |
| L-Glutamin [10 mM] | |
| Epidermaler Wachstumsfaktor (EGF) [10 ng/ml] | |
| Hydrocortison [10 μg/ml] | |
| N/TERT-1 Keratinozyten-Zelllinie | K-SFM Medienbasis |
| 1% P/S | |
| Rinder-Hypophysenextrakt (BPE) [25 μg/ml], aus K-SFM-Ergänzungskit | |
| Epidermaler Wachstumsfaktor (EGF) [0,2 ng/ml], aus K-SFM Supplement Kit | |
| CaCl2 [0,3 mM] | |
| Differenzierung des Human Skin Equivalent (HSE) | 3:1 DMEM: Hams F12 |
| 1% P/S | |
| 0,5 μM Hydrocortison | |
| 0,5 μM Isoproterenol | |
| 0,5 μg/ml Insulin |
Tabelle 1: Medienrezepte. Medienrezepte für die 2D-Kultur der menschlichen dermalen Fibroblasten, IMR90-Fibroblasten, HMEC-1- und N/TERT-1-Keratinozyten werden gegeben. Diese Rezepte wurden verwendet, um Zelllinien zu erweitern, bevor VHSEs erzeugt wurden. Human Skin Equivalent (HSE) Differenzierungsmedien werden verwendet, um VHSEs zu erzeugen; Ein Basisrezept ist gegeben, während Der Teile der Tauchkultur und der Schichtungsinduktion sollten sich die Mengen an FBS verjüngen, wie in Protokollschritt 3 beschrieben. HSE-Rezept basierend auf diesen Quellen11,80.
| Kollagenbestandskonzentration (Cs) : | 8 | mg/ml | ||
| Gewünschtes Volumen (Vf): | 1 | Ml | ||
| Normalisieren der NaOH-Anpassung*: | 1 | x | ||
| *Jede Menge Kollagen muss getestet werden, um die Menge an NaOH zu bestimmen, die benötigt wird, um pH 7 - 7,4 einzustellen | ||||
| Gewünschte Kollagenkonzentration (mg/ml) | ||||
| 2 | 3 | 4 | 5 | |
| 10X PBS (Vpbs) | 0.1 | 0.1 | 0.1 | 0.1 |
| Kollagenvorrat (Vs) | 0.25 | 0.375 | 0.5 | 0.625 |
| 1N NaOH (VNaOH) | 0.00575 | 0.008625 | 0.0115 | 0.014375 |
| Medien (VMedien) | 0.64425 | 0.516375 | 0.3885 | 0.260625 |
Tabelle 2: Referenztabelle zur Kollagenberechnung. Die Referenztabelle gibt die allgemein gewünschten Kollagenkonzentrationen an, die unter der Annahme einer Kollagenstockkonzentration von 8 mg/ml und eines gewünschten Endvolumens von 1 ml berechnet werden. Alle Werte sind in ml. Die Gleichungen, die zur Berechnung dieser Beträge verwendet werden, sind im Protokollschritt 2.2 angegeben. Es ist wichtig, den pH-Wert für jeden Kollagenvorrat zu überprüfen; Falls erforderlich, sollten NaOH-Mengen hinzugefügt werden, um pH 7 - 7,4 zu erreichen (nach PBS, NaOH, Kollagenbestand, Medien werden hinzugefügt). Das Protokoll wurde für VHSEs mit einer Kollagenkonzentration von 3 mg/ml optimiert; Veränderungen der Kollagenkonzentration können für verschiedene Zelllinien/gewünschte Endergebnisse notwendig sein48.
| Primärer Antikörper | Quelle | Konzentration | gebrauchen |
| Filaggrin (AKH1) Maus monoklonales IgG | Santa Cruz; sc-66192 (200 μg/ml) | [1:250] | Spätdifferenzierungsmarker15 |
| Polyklonales IgG für Involucrinkaninchen | Proteintech; 55328-1-AP (30 μg/150 μL) | [1:250] | Spätterminaler Differenzierungsmarker15 |
| Cytokeratin 10 (DE-K10) Maus IgG, Überstand | Santa Cruz; sc-52318 | [1:350] | Suprabasaler epidermaler Marker14,36,59 |
| Kollagen IV Kaninchen polyklonal | Proteintech; 55131-1-AP | [1:500] | EndothelialeGefäßwand 67 |
| DRAQ 7 | Zellsignalisierung; 7406 (0,3 mM) | [1:250] | Nuklearer Marker |
| Sekundärer Antikörper | Quelle | Konzentration | gebrauchen |
| Ziegen-Anti-Kaninchen IgG DyLight™ 488 Konjugiert | Invitrogen; 35552 (1 mg/ml) | [1:500] | Kollagen IV sekundär |
| Anti-Kaninchen IgG (H&L) (GOAT) Antikörper, DyLight™ 549 konjugiert | Rockland Immunchemikalien; 611-142-002 | [1:500] | Involucrin sekundär |
| Ziegen-Anti-Maus IgG (H&L), DyLight™ 488 | Thermo Scientific; 35502 (1 mg/ml) | [1:500] | Filaggrin oder Cytokeratin 10 sekundär |
| BLOCKIERPUFFER (500 ml) | |||
| Reagenz | Menge | ||
| ddH2O | 450 ml | ||
| 10 x PBS | 50 ml | ||
| Rinderserumalbumin (BSA) | 5 g | ||
| Tween 20 | 0,5 ml | ||
| Kaltwasser Fischgelatine | 1 g | ||
| Natriumazid (10% Natriumazid in diH2O) | 5 ml (0,1 % Endkonzentration) | ||
Tabelle 3: Primäre und sekundäre Antikörper mit Blockierender Pufferrezeptur. Die aufgeführten Antikörper und chemischen Flecken wurden zur Färbungverwendet, die in Abbildung 2, Abbildung 3, Abbildung 4 gezeigtsind. Die Färbung wurde wie in Protokollschritt 6 angegeben mit dem hier aufgeführten Blockierungspufferrezept abgeschlossen. Abhängig von den gewählten Kulturtechniken und den Zelllinien können einige Optimierungen der Färbekonzentrationen und der Dauer erforderlich sein.
Ergänzende Tabelle 1: Abkürzungsliste. Abkürzungsliste für die Bequemlichkeit des Lesers enthalten. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Abbildung 1: Technische Hilfe für die Handhabung von VHSE. Der Umgang mit VHSEs ist besonders bei der Fixierung, Verarbeitung und Färbung eine Herausforderung. A-D entspricht den Anweisungen in den Schritten 5-7. A zeigt die technische Handhabung der Entfernung der porösen Membran von einem Kultureinsatz, um eine ordnungsgemäße Färbung zu gewährleisten. B zeigt, wie jedes VHSE während der Färbung und Lagerung untergetaucht ist. C zeigt den sichersten und einfachsten Weg, Konstrukte in PDMS-Bildgebungsbohrungen zu verschieben. D zeigt eine VHSE, die in einem PDMS-Bildgebungsschacht sitzt: Die PDMS-Vertiefung wird auf einen Glasträger auf der Unterseite geklebt, wodurch ein Fenster für die Bildgebung entsteht, ein Glasobjektträger wird oben platziert, um die Feuchtigkeit durch lange Bildgebungsläufe aufrechtzuerhalten. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Standard-Weitfeld-Fluoreszenzmikroskopie kann zur Beurteilung von VHSEs verwendet werden. Die Weitfeldbildgebung kann für die volumetrische Bildgebung zur Routineuntersuchung verwendet werden, wenn keine Laserscanning-Mikroskopie verfügbar ist. Als Beispiel werden Abbildungen von VHSEs sowohl aus dem apikalen als auch aus dem basolateralen Aspekt als en face und orthogonale (Ortho.) Maximalprojektionen gezeigt. (Nach oben) Die Epidermis wurde mit Involucrin und Kernen als Marker abgebildet. (Unten) Dermale Vaskulatur wurde mit Kollagen IV als Marker abgebildet. Bilder werden aus Gründen der Übersichtlichkeit vom Hintergrund subtrahiert. Licht außerhalb der Ebene führt zu den "streifenden" oder "fackelnden" Artefakten, die in den orthogonalen Ansichten sichtbar sind. Die Weitfeldbildgebung kann zur Quantifizierung verwendet werden, erfordert jedoch möglicherweise mehr Bildverarbeitung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Dieses Protokoll hat eine einfache und wiederholbare Methode zur Erzeugung von VHSEs und deren dreidimensionaler Analyse demonstriert. Wichtig ist, dass diese Methode auf wenigen spezialisierten Techniken oder Ausrüstungsteilen beruht, was sie für eine Reihe von Laboren zugänglich macht. Darüber hinaus können Zelltypen durch begrenzte Änderungen im Protokoll ersetzt werden, so dass forscher dieses Protokoll an ihre spezifischen Bedürfnisse anpassen können.
Die richtige Kollagengelierung ist ein herausfordernder Schritt bei der Etablierung der Hautkultur. Insbesondere bei der Verwendung von Rohpräparaten ohne Reinigung können Spurenverunreinigungen den Gelierungsprozess beeinflussen. Um die Konsistenz zu gewährleisten, sollten Gruppen von Experimenten mit dem gleichen Kollagenbestand durchgeführt werden, der für die VHSE-Erzeugung verwendet wird. Darüber hinaus sollte die Gelierung idealerweise bei einem pH-Wert von 7-7,4 erfolgen, und Spurenverunreinigungen können den pH-Wert verschieben. Vor der Verwendung eines Kollagenvorrats sollte ein azelluläres Übungsgel in der gewünschten Konzentration hergestellt und der pH-Wert vor der Gelierung gemessen werden. Wenn Sie diese Kollagenqualitätsprüfung vor Beginn der aussaat dermalen Komponenten durchführen, werden die Probleme mit der richtigen Gelierung und Kollagenhomogenität identifiziert, bevor ein vollständiges Experiment eingerichtet wird. Anstatt azelluläres Kollagen direkt auf einen Kultureinsatz zu säen, säen Sie etwas Kollagen auf einen pH-Streifen, der die gesamte pH-Skala bewertet und einen pH-Wert von 7-7,4 überprüft. Die Gelierung kann bewertet werden, indem ein Tröpfchen der Kollagengellösung auf eine Abdeck- oder Gewebekultur-Kunststoff-Well-Platte auftät wird (eine Well-Platte wird empfohlen, um die engen Seiten eines Kultureinsatzes zu simulieren). Nach der Gelationszeit sollte das Kollagen fest sein, d.h. es sollte nicht fließen, wenn die Platte geneigt ist. Unter Phasenkontrastmikroskopie sollte das Kollagen homogen und klar aussehen. Gelegentliche Blasen aus der Kollagenaussaat sind normal, aber große amorphe Klumpen von undurchsichtigem Kollagen im klaren Gel weisen auf ein Problem hin - wahrscheinlich aufgrund unzureichender Mischung, falschem pH-Wert und / oder Versagen, das Kollagen während des Mischens gekühlt zu halten.
Die Zellaussaatmengen und -medien können angepasst werden. Im obigen Protokoll wurden die verkapselten Zellmengen für einen 12-Well-Insert bei 7,5 x 104 Fibroblasten und 7,5 x 105 Endothelzellen pro ml Kollagen mit 1,7 x 10 5 Keratinozyten optimiert, die auf dem hautlichenKonstrukt ausgesät sind. Die Zelldichten wurden für dieses VHSE-Protokoll optimiert, basierend auf den Vorstudien und den bisherigen Forschungen, die die 3D-Gefäßnetzwerkerzeugung in verschiedenen Kollagenkonzentrationen48 und der HSE-Generation22,80,81untersuchten. In ähnlichen Systemen betragen die veröffentlichten Endothelzelldichten 1,0 x 106 Zellen/ml Kollagen48; die Fibroblastenkonzentrationen reichen oft von 0,4 x 105 Zellen/ml Kollagen22,28,82 bis 1 x 105 Zellen / ml Kollagen8,58,83,84,85; und die Keratinozytenkonzentrationen reichen von 0,5 x 105 [Zellen/cm2]80 bis 1 x 105 [Zellen/cm2]8. Zelldichten können für bestimmte Zellen und Forschungsfragen optimiert werden. Dreidimensionale Kulturen mit kontraktilen Zellen, wie Fibroblasten, können sich zusammenziehen, was zu einer Verringerung der Lebensfähigkeit und einem Kulturverlust führt86,87. Vorläufige Experimente sollten durchgeführt werden, um die Kontraktion des Hautkompartiments zu testen (was bei mehr hautlichen Zellen, kontraktileren Hautzellen, längeren Tauchkulturen oder weicheren Matrizen auftreten kann) und um die epidermale Oberflächenabdeckung zu testen. Darüber hinaus können die Anzahl der Tage im Untertauchen und die Rate der Verjüngung des Serumgehalts auch angepasst werden, wenn eine übermäßige Hautkontraktion auftritt oder eine andere Keratinozytenabdeckung erforderlich ist. Wenn beispielsweise während der Periode des dermalen Submersions eine Kontraktion bemerkt wird oder während Keratinozyten eine Oberflächenmonoschicht aufbauen, kann eine schnellere Bewegung durch den Serumverjüngungsprozess und das Anheben von VHSEs auf ALI dazu beitragen, zusätzliche Kontraktion zu verhindern. Wenn die Keratinozytenabdeckung nicht ideal ist, kann die Änderung der Anzahl der Tage, an denen die VHSE ohne Serum untergetaucht wird, dazu beitragen, die epidermale Monoschichtabdeckung zu erhöhen und die Kontraktion zu mildern, da das Serum weggelassen wird. Veränderungen der Zelldichten oder andere oben genannte Vorschläge müssen für die spezifischen Kulturen und Forschungsziele optimiert werden.
Um eine ordnungsgemäße Schichtung der Epidermis während der ALI-Periode (Air Liquid Interface) zu erreichen, ist es wichtig, den Flüssigkeitsstand in jeder Vertiefung regelmäßig zu überprüfen und aufrechtzuerhalten, damit ALI und eine angemessene Hydratation jedes Konstrukts während der gesamten Kulturlänge erhalten bleiben. Medienpegel sollten täglich überprüft und verfolgt werden, bis konsistente ALI-Werte festgelegt sind. Die epidermale Schicht sollte hydratisiert aussehen, nicht trocken, aber es sollte keine Medienpools auf dem Konstrukt geben. Während der ALI entwickelt das Konstrukt eine undurchsichtige weiße / gelbe Farbe, die normal ist. Die epidermale Schicht wird sich wahrscheinlich ungleichmäßig entwickeln. Üblicherweise sind die VHSEs aufgrund der Kollagenaussaat oder dermalen Kontraktion geneigt. Es ist auch normal, einen höheren epidermalen Anteil in der Mitte des Konstrukts in kleineren Konstrukten (24 Well-Größe) und eine Ridge-Formation um den Umfang des VHSE in 12 Well-Größe zu beobachten. Die Kontraktion derKonstrukte 13 kann diese topographischen Formationen verändern und/oder überhaupt nicht beobachtet werden.
Die Färbung und Bildgebung von VHSEs führt zu mechanischer Manipulation der VHSEs. Es ist sehr wichtig, die Manipulation jeder Kultur zu planen und zu begrenzen. Wenn eine Manipulation erforderlich ist, sollten Sie beim Entfernen von VHSEs von den Einlegemembranen, beim Hinzufügen von Flecken- oder Waschlösungen zur Konstruktionsoberfläche und beim Entfernen und Ersetzen von VHSEs in ihren Lager- / Bildgebungsbrunnen während der Bildgebungsvorbereitung sanfte Bewegungen beibehalten. Insbesondere die apikalen Schichten der epidermalen Komponente können zerbrechlich sein und laufen Gefahr, die basalen epidermalen Schichten abzusedeln. Apikale Schichten der Epidermis sind zerbrechlich und durchlaufen auch im nativen Gewebe eine Abschämierung4, aber für eine genaue Analyse der epidermalen Struktur ist es wichtig, Schäden oder Verluste zu minimieren. Wenn epidermale Schichten vom Konstrukt abheben, können sie separat abgebildet werden. Die Basalschichten der Epidermis sind höchstwahrscheinlich noch an der Dermis befestigt, während sich Teile der apikalen Schichten lösen können. Für die Visualisierung der Epidermis ist ein Kernfleck hilfreich, um dies zu beobachten, da dichte Kerne ein Merkmal der unteren und mittleren Schichten der Epidermis sind.
Die konfokale Bildgebung der VHSE-Postfixierung wurde im Protokoll diskutiert, aber es ist auch möglich, die VHSEs in der gesamten Kultur über die aufrechte optische Kohärenztomographie (OCT)88 , 89,90,91,92,93abbilden. VHSE sind stabil genug, um der Bildgebung ohne Inkubation oder Befeuchtung für mindestens zwei Stunden ohne spürbare Effekte standzuhalten. Da OCT markierungsfrei und nichtinvasiv ist, ist es möglich, die epidermale Dicke während der Reifung zu verfolgen. Andere nichtinvasive Bildgebungsmodalitäten können wahrscheinlich ebenso eingesetzt werden.
Die volumetrische Bildgebung der kombinierten dermalen und epidermalen Strukturen kann aufgrund der Laserdämpfung tiefer in der VHSE eine Herausforderung darstellen. Dies kann durch die Abbildung des Konstrukts in zwei Orientierungen gemildert werden, von der epidermalen Seite (Abbildung 1) und von dermalen Seite (Abbildung 2), was eine gute Auflösung dermaler vaskulärer Strukturen und der Epidermis ermöglicht. Darüber hinaus kann die Probe gelöscht werden, was volumetrische Bilder der gesamten Struktur mit minimaler Dämpfung ermöglicht. Es wurden mehrere Clearingmethoden versucht, jedoch lieferte die beschriebene Methanol/Methylsalicylat-Methode die besten Ergebnisse. Forscher, die an der Optimierung anderer Clearing-Methoden interessiert sind, werden auf diese Reviews49,61,62gerichtet. Beim Clearing wird empfohlen, die Probe vor dem Clearing vollständig abbilden, da die Methode die Fluorophore und/oder die Struktur beschädigen kann. Weiterhin sollte die Bildgebung so schnell wie möglich nach dem Löschen abgeschlossen sein, da die Fluoreszenz innerhalb von Tagen verblassen kann.
Aus Gründen der Einfachheit und Zugänglichkeit verwendete dieses Protokoll die einfachsten Medienmischungen, die in der vorherigen Literatur11,80zu finden waren. Obwohl die Verwendung einfacher Medienmischungen viele Vorteile bietet, werden auch die Einschränkungen dieser Wahl erkannt. Andere Gruppen haben die Auswirkungen spezifischer Medienkomponenten auf die epidermale und dermale Gesundheit untersucht und festgestellt, dass andere Medienzusätze94, wie externe freie Fettsäuren / Lipide, das Stratum corneum der Epidermis verbessern und die Hautbarrierefunktion verbessern. Obwohl unsere Immunfluoreszenzmarker eine angemessene Differenzierung und Schichtung in der Epidermis zeigen, kann je nach durchgeführten Studien eine zusätzliche Medienoptimierung erforderlich sein. Darüber hinaus wurde bei der Bewertung der hier vorgestellten VHSEs keine umfassende Analyse des epidermalen BM durchgeführt. Die Integrität des BM ist ein wichtiger Hinweis auf Hautäquivalente; Verschiedene Gruppen haben die Kulturdauer und ihre Wirkung auf BM-Markierungen95 sowie die Analyse der Fibroblastenpräsenz und der zusätzlichen Wachstumsfaktoreffekte auf die BM-Expression14 untersucht. Es ist wichtig zu beachten, dass die Analyse der BM-Komponente bei verwendung dieses Protokolls ausgewertet und optimiert werden sollte.
In diesem Protokoll wird ein Verfahren zur VHSE-Erzeugung beschrieben, das Ergebnisse nach 8 Wochen bei ALI zeigt. VHSE-Kulturen wurden bis zu 12 Wochen bei ALI kultiviert, ohne dass sich die Lebensfähigkeit merklich verändert oder verloren hat, und es ist möglich, dass sie länger lebensfähig sind. Wichtig ist, dass dieses Protokoll leicht an allgemein verfügbare Zelltypen angepasst werden kann, wie der Ersatz von dermalen Fibroblasten durch IMR90-Lungenfibroblasten zeigt. Abhängig vom Bedarf des Forschers und den verfügbaren Ressourcen können die Zelltypen und Medienmischungen auf der Kultur angepasst werden, obwohl andere Zelltypen eine Medienoptimierung erfordern können. Zusammenfassend sollen diese Verfahren Klarheit über die Kultur von VHSEs für das Studium der Hautbiologie und -krankheit schaffen. Um die Zugänglichkeit zu maximieren, wurde das Protokoll so einfach und robust mit gängigen Geräten, Zelllinien und Reagenzien als minimaler effektiver Ansatz entwickelt, der weiter an die spezifischen Bedürfnisse von Forschungsstudien angepasst werden kann.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Die Autoren danken Dr. Jim Rheinwald59 und Dr. Ellen H. van den Bogaard20 für ihre großzügige Schenkung von N/TERT-Zelllinien. Diese Arbeit wurde von der American Heart Association (19IPLOI34760636) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 N NaOH | Fisher Chemical | S318-100 | (Dilute from Lab stock) |
| 4% Paraformaldehyde | ACROS Organics | #41678-5000, Lot # B0143461 | Made up using solid Paraformaldehyde in PBS, pH adjusted to 6.9 |
| Autoclaved forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| CaCl2 | Fisher bioreagents | Cat # BP510-250, Lot # 190231 | Rnase, Dnase, Protease-Free |
| Cell line, Endothelial: Microvascular Endothelial Cell (HMEC1) | ATCC | CRL-3243 | SV40 Immortalized microvascular endothelial cell. Note that 750,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: dermal Human fibroblast, adult | ATCC | PCS-201-012 | Primary dermal cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: human lung firbroblast (IMR90) | ATCC | CCL-186 | Primary embryonic cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Keratinocyte: N/TERT-1 | Immortalized via hTERT expression. N/TERT-1 was made using a retroviral vector conferring hygromycin resistance. Cell line established by Dickson et al. 2000. Can be replaced with ATCC PCS-200-010 or PCS-200-011. Note that 170,000 cells were used per construct; N/TERT1 cells must be used from plates that are 30% confluent- two 30% confluent 90 mm tissue culture dishes give more than enough cells.The authors thank Dr. Jim Rheinwald and Dr. Ellen H. van den Bogaard for their generous gift of N/TERT cell lines. | ||
| Centrifuge | Thermo Scientific; Sorvall Legend X1R | (standard lab equipment) | |
| Computational Software | MATLAB | MATLAB 2020a | MathWorks, Natick, MA. |
| Confocal Microscope | Leica TCS SPEII confocal | Laser scanning confocal. Can be replaced with other confocals or deconvolution microscopy. | |
| Cover Glass (22 x 22) | Fisher Scientific | 12-545F | 0.13-0.17 mm No.1 Thickness |
| Cyanoacrylate super glue or silicone grease | Glue Masters | #THI0102 | Glue Masters, THICK, Instant Glue, Cyanoacrylate; super glue is preferred |
| DMEM media base | Corning; Mediatech, Inc | REF # 10-013-CM; Lot # 26119007 | DMEM, 1X (Dulbecco's Modification of Eagle's Medium) with 4.5 g/L glucose, L-glutamine & sodium pyruvate |
| DMEM/F-12 50/50 | Corning; Mediatech, Inc | REF # 10-090-CV; Lot # 21119006 | DMEM/F-12 50/50, 1X (Dulbecco's Mod. Of Eagle's Medium/Ham's F12 50/50 Mix) with L-glutamine |
| Ethanol | Decon Labs | #V1101 | (standard lab reagent) |
| Fetal Bovine Serum | Fisher Scientific | Cat # FB12999102, Lot # AE29451050 | Research Grade Fetal Bovine Serum, Triple 0.1 um sterile filtered |
| Fine tip forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| Human Epidermal Growth Factor (EGF) | Peprotech | Cat # AF-100-15-1MG, Lot # 0318AFC05 D0218 | Made up in 0.1% BSA in PBS |
| Hydrocortisone | Alpha Easar | Lot # 5002F2A | made up in DMSO |
| Insulin (human) | Peprotech | Lot # 9352621 | |
| Inverted Light/Phase Contrast Microscope | VWR | 76317-470 | (standard lab equipment) |
| Isoproterenol | Alfa Aesar | #AAJ6178806 | DL-Isoproterenol hydrochloride, 98% |
| Keratinocyte-SFM (1x) media base | Gibco; Life Technologies Corporation | REF #: 10724-011; Lot # 2085518 | Keratinocyte-SFM (1X); serum free medium |
| L-Ascorbic Acid | Fisher Chemical | Cat # A61-100, Lot # 181977, CAS # 50-81-7 | Crystalline. L-Ascorbic acid can also be purchased as a salt |
| L-glutamine (solid) | Fisher Bioreagents | CAT # BP379-100, LOT # 172183, CAS # 56-85-9 | L-Glutamine, white crystals or Crystalline powder |
| MCDB 131 media base | Gen Depot | CM034-050, Lot # 03062021 | MCDB 131 Medium Base, No L-Glutamine, sterile filtered |
| Metal punches | Sona Enterprises (SE) | 791LP, 12PC | Hollow Leather Punch Set, High Carbon Steel, Hardness: 48HRC; (various sizes including): 1/8", 5/32", 3/16", 7/32", 1/4", 9/32", 5/16", 3/4", 7/16", 1/2", 5/8:, 3/4". This punch set is helpful, but x-acto knife can work as well. Size of metal punch that works well for 12 well transwell VHSE is 3/8" or 1/2". |
| Methanol | Fisher Chemical | CAS # 67-56-1 | (optional). For clearing dehydration step. |
| Methyl Salicylate | Fisher Chemical | O3695-500; Lot # 164535; CAS # 119-36-8 | (optional). For clearing. |
| Microtubes, 1.7 mL | Genesee Scientific Corporation; Olympus Plastics | Cat # 24-282; Lot # 19467 | 1.7 ml Microtubes, Clear; Boilproof, Polypropulene, Certified Rnase, Dnase, DNA, PCR inhibitor and endotoxin-Free |
| PBS, 10x Culture grade or autoclaved | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. |
| PBS, 1x Culture grade, (-) Calcium, (-) magnesium | Genesee Scientific Corporation | Ref # 25-508; Lot # 07171015 | |
| PBS, 1x non-Culture grade | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. Dilute to 1x with water. |
| Penicillin/Streptomycin | Gibco; Life Technologies Corporation | Ref # 15140-122, Lot # 2199839 | Pen Strep (10,000 Units/mL Penicillin; 10,000 ug/mL Streptomycin) |
| Petri Dish, glass, small | Corning | PYREX 316060 | (optional). To be used as a clearing container |
| Petri Dishes, 100 mm | Fisher Scientific | FB0875713 | Use for making up PDMS. |
| Polydimethylsiloxane (PDMS) | Dow Corning | GMID 02065622, Batch # H04719H035 | Sylgard 184 Silicone Elastomer Base, Dow Corning, Midland, MI) |
| Dow Corning | GMID 02065622, Batch # H047JC4003 | DOWSIL 184, Silicone Elastomer Curing Agent | |
| note: PDMS is usually sold as a kit that includes both the base and curing agent components. | |||
| Positive Displacement Pipettes (1000 & 250 uL) | Gilson | 1000 uL: HM05136, M1000. 250 uL: T12269L | M1000 pipette capacity (100-1000 uL); M250 pipette capacity to 250 uL |
| Positive Displacement Tips/Pistons (1000 & 250 uL) | Gilson | 1000 uL: CAT # F148180, BATCH # B01292902S; 250 uL: CAT # F148114, BATCH # B05549718S | Sterilized capillaries and pistons |
| Round tipped scoopula | (optional; standard lab equipment) For manipulation of VHSEs prior to imaging | ||
| Supplements for Keratinocyte-SFM media | Gibco; Life Technologies Corporation | Ref # 37000-015, Lot # 2154180 | Contains EGF Human Recombinant (Cat # 10450-013), Bovine Pituitary Extract (Cat # 13028-014) |
| Tissue Culture Plate Inserts, 12 well size, 3 µm pore size | Corning; Costar | REF # 3462 - Clear; Lot # 14919057 | Transwell; 12 mm Diameter Inserts, 3.0 um pore size, tissue culture treated, polyester membrane, polystyrene plates, |
| Tissue Culture Plates, 12 well size | Greiner Bio-one; CellStar | Cat # 665 180; Lot # E18103QT | 12 well cell culture plate; sterile, with lid; products are sterile, free of detectable Dnase, Rnase, human DNA and pyrogens. Contents non-cytotoxic |
| Tissue Culture Plates, 60.8cm^2 growth area | Genesee Scientific Corporation | Cat # 25-202; Lot No: 191218-177B | Tissue culture dishes; treated, growth area 60.8 cm^2; sterile, Dnase, Rnase, Pyrogen Free; virgin polystyrene |
| Triton x 100 | Ricca Chemical Company | Cat # 8698.5-16, Lot # 4708R34 | Wetting agent |
| Trypsin 0.25% | Corning; Mediatech, Inc | Ref # 25-053-CI | 0.25% Trypsin, 2.21 mM EDTA, 1x [-] sodium bicarbonate |
| Type 1 Collagen isolated from Rat tail | Pel-Freez Biologicals | 56054-1 | Sprauge-Dawley rat tails can be purchased frozen from Pel-Freez or other suppliers. Collagen can be isolated from the tail tendons. Isolation Protocol references [Cross et al.,2010; Rajan et al.,2007; Bornstein, 1958] .Alternatively, high concentration rat-tail collagen can be purchased from suppliers including Corning (Catalog Number: 354249) |
| Vaccum chamber, benchtop | Bel-Art | F42010-0000 | (standard lab equipment) |
| Handheld Precision knife | X-Acto | X3311 | (X-Acto knife optional if purchased steel punches) |
Referenzen
- Stojic, M., et al. Skin tissue engineering 3. Biomaterials for Skin Repair and Regeneration. , 59 (2019).
- Shevchenko, R. V., James, S. L., James, S. E. A review of tissue-engineered skin bioconstructs available for skin reconstruction. Journal of The Royal Society Interface. 7 (43), 229-258 (2010).
- Kolarsick, P. A. J., Kolarsick, M. A., Goodwin, C. Anatomy and Physiology of the Skin. Journal of the Dermatology Nurses' Association. 3 (4), (2011).
- McGrath, J. A., Eady, R. A. J., Pope, F. M. Anatomy and organization of human skin. Rook's textbook of dermatology. 10, 9781444317633 (2004).
- Zomer, H. D., Trentin, A. G. Skin wound healing in humans and mice: Challenges in translational research. Journal of Dermatological Science. 90 (1), 3-12 (2018).
- Zhang, Z., Michniak-Kohn, B. B. Tissue Engineered Human Skin Equivalents. Pharmaceutics. 4 (1), (2012).
- Oh, J. W., Hsi, T. -. C., Guerrero-Juarez, C. F., Ramos, R., Plikus, M. V. Organotypic skin culture. The Journal of investigative dermatology. 133 (11), 1-4 (2013).
- El-Ghalbzouri, A., Gibbs, S., Lamme, E., Van Blitterswijk, C. A., Ponec, M. Effect of fibroblasts on epidermal regeneration. British Journal of Dermatology. 147 (2), 230-243 (2002).
- Sun, T., Haycock, J., MacNeil, S. In situ image analysis of interactions between normal human keratinocytes and fibroblasts cultured in three-dimensional fibrin gels. Biomaterials. 27 (18), 3459-3465 (2006).
- Kreimendahl, F., et al. Macrophages significantly enhance wound healing in a vascularized skin model. Journal of Biomedical Materials Research Part A. 107, 1340-1350 (2019).
- El Ghalbzouri, A., Commandeur, S., Rietveld, M. H., Mulder, A. A., Willemze, R. Replacement of animal-derived collagen matrix by human fibroblast-derived dermal matrix for human skin equivalent products. Biomaterials. 30 (1), 71-78 (2009).
- Roger, M., et al. Bioengineering the microanatomy of human skin. Journal of Anatomy. 234, 438-455 (2019).
- Carlson, M. W., Alt-Holland, A., Egles, C., Garlick, J. A. Three-Dimensional Tissue Models of Normal and Diseased Skin. Current Protocols in Cell Biology. 41 (1), 1-17 (2008).
- El Ghalbzouri, A., Jonkman, M. F., Dijkman, R., Ponec, M. Basement Membrane Reconstruction in Human Skin Equivalents Is Regulated by Fibroblasts and/or Exogenously Activated Keratinocytes. Journal of Investigative Dermatology. 124 (1), 79-86 (2005).
- Pruniéras, M., Régnier, M., Woodley, D. Methods for cultivation of keratinocytes with an air-liquid interface. The Journal of Investigative Dermatology. 81, 28-33 (1983).
- Ali, N., Hosseini, M., Vainio, S., Taieb, A., Cario-André, M., Rezvani, H. R. Skin equivalents: skin from reconstructions as models to study skin development and diseases. British Journal of Dermatology. 173 (2), 391-403 (2015).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Innovative tissue models for drug discovery and development. 69-70, 81-102 (2014).
- Mieremet, A., Rietveld, M., Absalah, S., van Smeden, J., Bouwstra, J. A., El Ghalbzouri, A. Improved epidermal barrier formation in human skin models by chitosan modulated dermal matrices. PLOS ONE. 12 (3), 0174478 (2017).
- Vidal, S. E. L., Tamamoto, K. A., Nguyen, H., Abbott, R. D., Cairns, D. M., Kaplan, D. L. 3D biomaterial matrix to support long term, full thickness, immuno-competent human skin equivalents with nervous system components. Organoids and Ex Vivo Tissue On-Chip Technologies. 198, 194-203 (2019).
- Smits, J. P. H., et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models. Scientific Reports. 7 (1), 11838 (2017).
- Lebonvallet, N., et al. Effects of the re-innervation of organotypic skin explants on the epidermis. Experimental Dermatology. 21 (2), 156-158 (2011).
- Van Drongelen, V., et al. Barrier Properties of an N/TERT-Based Human Skin Equivalent. Tissue Engineering Part A. 20 (21-22), 3041-3049 (2014).
- . Establishment and initial characterization of a simple 3D organotypic wound healing model Available from: https://opus.hs-furtwangen.de/frontdoor/index/index/docld/4852 (2018)
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18 (5), 240-249 (2013).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Amelian, A., Wasilewska, K., Megias, D., Winnicka, K. Application of standard cell cultures and 3D in vitro tissue models as an effective tool in drug design and development. Pharmacological Reports. 69 (5), 861-870 (2017).
- Lu, W., et al. Mixture of Fibroblasts and Adipose Tissue-Derived Stem Cells Can Improve Epidermal Morphogenesis of Tissue-Engineered Skin. Cells Tissues Organs. 195 (3), 197-206 (2012).
- Marino, D., Luginbühl, J., Scola, S., Meuli, M., Reichmann, E. Bioengineering Dermo-Epidermal Skin Grafts with Blood and Lymphatic Capillaries. Science Translational Medicine. 6 (221), 221 (2014).
- Martins-Green, M., Li, Q. -. J., Yao, M. A new generation organ culture arising from cross-talk between multiple primary human cell types. The FASEB Journal. 19 (2), 222-224 (2004).
- Kim, B. S., Gao, G., Kim, J. Y., Cho, D. -. W. 3D Cell Printing of Perfusable Vascularized Human Skin Equivalent Composed of Epidermis, Dermis, and Hypodermis for Better Structural Recapitulation of Native Skin. Advanced Healthcare Materials. 8 (7), 1801019 (2019).
- Baltazar, T., et al. 3D bioprinting of a vascularized and perfusable skin graft using human keratinocytes. Tissue Engineering Part A. 26 (5-6), 227-238 (2019).
- Klar, A. S., et al. Tissue-engineered dermo-epidermal skin grafts prevascularized with adipose-derived cells. Biomaterials. 35 (19), 5065-5078 (2014).
- Grebenyuk, S., Ranga, A. Engineering Organoid Vascularization. Frontiers in Bioengineering and Biotechnology. 7, (2019).
- Black, A. F., Berthod, F., L'heureux, N., Germain, L., Auger, F. A. In vitro reconstruction of a human capillary-like network in a tissue-engineered skin equivalent. The FASEB Journal. 12 (13), 1331-1340 (1998).
- Huber, B., Link, A., Linke, K., Gehrke, S. A., Winnefeld, M., Kluger, P. J. Integration of Mature Adipocytes to Build-Up a Functional Three-Layered Full-Skin Equivalent. Tissue Engineering Part C: Methods. 22 (8), 756-764 (2016).
- Monfort, A., Soriano-Navarro, M., García-Verdugo, J. M., Izeta, A. Production of human tissue-engineered skin trilayer on a plasma-based hypodermis. Journal of Tissue Engineering and Regenerative Medicine. 7 (6), 479-490 (2013).
- Shamis, Y., et al. Fibroblasts derived from human embryonic stem cells direct development and repair of 3D human skin equivalents. Stem Cell Research & Therapy. 2 (1), 10 (2011).
- Kim, Y., et al. Establishment of a complex skin structure via layered co-culture of keratinocytes and fibroblasts derived from induced pluripotent stem cells. Stem Cell Research & Therapy. 9 (1), 217 (2018).
- Chau, D. Y. S., Johnson, C., MacNeil, S., Haycock, J. W., Ghaemmaghami, A. M. The development of a 3D immunocompetent model of human skin. Biofabrication. 5 (3), 035011 (2013).
- Vanden Bogaard, E. H., et al. Crosstalk between Keratinocytes and T Cells in a 3D Microenvironment: A Model to Study Inflammatory Skin Diseases. Journal of Investigative Dermatology. 134 (3), 719-727 (2014).
- Linde, N., Gutschalk, C. M., Hoffmann, C., Yilmaz, D., Mueller, M. M. Integrating Macrophages into Organotypic Co-Cultures: A 3D In Vitro Model to Study Tumor-Associated Macrophages. PLOS ONE. 7 (7), 40058 (2012).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical Advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Weinmüllner, R., et al. Organotypic human skin culture models constructed with senescent fibroblasts show hallmarks of skin aging. npj Aging and Mechanisms of Disease. 6 (1), 4 (2020).
- Barker, C. L., et al. The Development and Characterization of an In Vitro Model of Psoriasis. Journal of Investigative Dermatology. 123 (5), 892-901 (2004).
- Larcher, F., Espada, J., Díaz-Ley, B., Jaén, P., Juarranz, A., Quintanilla, M. New Experimental Models of Skin Homeostasis and Diseases. Actas Dermo-Sifiliográficas (English Edition). 106 (1), 17-28 (2015).
- Varkey, M., Ding, J., Tredget, E. E. Fibrotic Remodeling of Tissue-Engineered Skin with Deep Dermal Fibroblasts Is Reduced by Keratinocytes. Tissue Engineering Part A. 20 (3-4), 716-727 (2013).
- Moulin, V. J. Reconstitution of skin fibrosis development using a tissue engineering approach. Methods in Molecular Biology. 961, 287-303 (2013).
- Morgan, J. T., Shirazi, J., Comber, E. M., Eschenburg, C., Gleghorn, J. P. Fabrication of centimeter-scale and geometrically arbitrary vascular networks using in vitro self-assembly. Biomaterials. 189, 37-47 (2019).
- Silvestri, L., Costantini, I., Sacconi, L., Pavone, F. S. Clearing of fixed tissue: a review from a microscopist's perspective. Journal of Biomedical Optics. 21 (8), 1-8 (2016).
- Cross, V. L., et al. Dense type I collagen matrices that support cellular remodeling and microfabrication for studies of tumor angiogenesis and vasculogenesis in vitro. Biomaterials. 31 (33), 8596-8607 (2010).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1, 2753 (2007).
- Bornstein, M. B. Reconstituted rat-tail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Laboratory Investigation. 7 (2), 134-137 (1958).
- Clément, M. -. V., Ramalingam, J., Long, L. H., Halliwell, B. The In Vitro Cytotoxicity of Ascorbate Depends on the Culture Medium Used to Perform the Assay and Involves Hydrogen Peroxide. Antioxidants & Redox Signaling. 3 (1), 157-163 (2001).
- Tajima, S., Pinnell, S. R. Ascorbic acid preferentially enhances type I and III collagen gene transcription in human skin fibroblasts. Journal of Dermatological Science. 11 (3), 250-253 (1996).
- Murad, S., Tajima, S., Johnson, G. R., Sivarajah, A., Pinnell, S. R. Collagen Synthesis in Cultured Human Skin Fibroblasts: Effect of Ascorbic Acid and Its Analogs. Journal of Investigative Dermatology. 81 (2), 158-162 (1983).
- Villacorta, L., Azzi, A., Zingg, J. -. M. Regulatory role of vitamins E and C on extracellular matrix components of the vascular system. Vitamin E: An Overview of Major Research Directions. 28 (5), 507-537 (2007).
- Ashino, H., et al. Novel Function of Ascorbic Acid as an Angiostatic Factor. Angiogenesis. 6 (4), 259-269 (2003).
- Ponec, M., et al. The Formation of Competent Barrier Lipids in Reconstructed Human Epidermis Requires the Presence of Vitamin C. Journal of Investigative Dermatology. 109 (3), 348-355 (1997).
- Dickson, M. A., et al. Human keratinocytes that express hTERT and also bypass a p16(INK4a)-enforced mechanism that limits life span become immortal yet retain normal growth and differentiation characteristics. Molecular and Cellular Biology. 20 (4), 1436-1447 (2000).
- Johansen, C. Generation and Culturing of Primary Human Keratinocytes from Adult Skin. Journal of visualized experiments: JoVE. (130), e56863 (2017).
- Richardson, D. S., Lichtman, J. W. Clarifying Tissue Clearing. Cell. 162 (2), 246-257 (2015).
- Ariel, P. A beginner's guide to tissue clearing. The International Journal of Biochemistry & Cell Biology. 84, 35-39 (2017).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502 (2010).
- Ng, J. M. K., Gitlin, I., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. ELECTROPHORESIS. 23 (20), 3461-3473 (2002).
- Eddings, M. A., Johnson, M. A., Gale, B. K. Determining the optimal PDMS-PDMS bonding technique for microfluidic devices. Journal of Micromechanics and Microengineering. 18 (6), 067001 (2008).
- Markov, D. A., Lillie, E. M., Garbett, S. P., McCawley, L. J. Variation in diffusion of gases through PDMS due to plasma surface treatment and storage conditions. Biomedical microdevices. 16 (1), 91-96 (2014).
- Katzenberg, F. Plasma-bonding of poly(dimethylsiloxane) to glass. e-Polymers. 5 (1), (2005).
- El Ghalbzouri, A., Lamme, E., Ponec, M. Crucial role of fibroblasts in regulating epidermal morphogenesis. Cell and Tissue Research. 310 (2), 189-199 (2002).
- Kanitakis, J. Anatomy, histology and immunohistochemistry of normal human skin. European journal of dermatology: EJD. 12 (4), 390-399 (2002).
- Hessian based Frangi Vesselness filter. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/24409-hessian-based-frangi-vesselness-filter (2010)
- Jerman, T., Pernuš, F., Likar, B. Špiclin Enhancement of Vascular Structures in 3D and 2D Angiographic Images. IEEE Transactions on Medical Imaging. 35 (9), 2107-2118 (2016).
- Kovesi, P. Phase Preserving Denoising of Images. signal. 4, 6 (1999).
- Vincent, L. Morphological grayscale reconstruction in image analysis: applications and efficient algorithms. IEEE Transactions on Image Processing. 2 (2), 176-201 (1993).
- Xie, L., et al. Quantitative susceptibility mapping of kidney inflammation and fibrosis in type 1 angiotensin receptor-deficient mice. NMR in Biomedicine. 26 (12), 1853-1863 (2013).
- Van Uitert, R., Bitter, I. Subvoxel precise skeletons of volumetric data based on fast marching methods. Medical Physics. 34 (2), 627-638 (2007).
- Sethian, J. A. A fast marching level set method for monotonically advancing fronts. Proceedings of the National Academy of Sciences of the United States of America. 93 (4), 1591-1595 (1996).
- Sethian, J. A. Fast Marching Methods. SIAM Review. 41 (2), 199-235 (1999).
- Braverman, I. M. The Cutaneous Microcirculation. Journal of Investigative Dermatology Symposium Proceedings. 5 (1), 3-9 (2000).
- Men, S. J., Chen, C. -. L., Wei, W., Lai, T. -. Y., Song, S. Z., Wang, R. K. Repeatability of vessel density measurement in human skin by OCT-based microangiography. Skin research and technology: official journal of International Society for Bioengineering and the Skin (ISBS) [and] International Society for Digital Imaging of Skin (ISDIS) [and] International Society for Skin Imaging (ISSI). 23 (4), 607-612 (2017).
- Commandeur, S., Ho, S. H., de Gruijl, F. R., Willemze, R., Tensen, C. P., El Ghalbzouri, A. Functional characterization of cancer-associated fibroblasts of human cutaneous squamous cell carcinoma. Experimental Dermatology. 20 (9), 737-742 (2011).
- Thakoersing, V. S., Danso, M. O., Mulder, A., Gooris, G., Ghalbzouri, A. E., Bouwstra, J. A. Nature versus nurture: does human skin maintain its stratum corneum lipid properties in vitro. Experimental Dermatology. 21 (11), 865-870 (2012).
- Thakoersing, V. S., Gooris, G. S., Mulder, A., Rietveld, M., El Ghalbzouri, A., Bouwstra, J. A. Unraveling barrier properties of three different in-house human skin equivalents. Tissue Engineering. Part C, Methods. 18 (1), 1-11 (2012).
- Bouwstra, J. A., Groenink, H. W. W., Kempenaar, J. A., Romeijn, S. G., Ponec, M. Water distribution and natural moisturizer factor content in human skin equivalents are regulated by environmental relative humidity. The Journal of Investigative Dermatology. 128 (2), 378-388 (2008).
- Thakoersing, V. S., van Smeden, J., Mulder, A. A., Vreeken, R. J., El Ghalbzouri, A., Bouwstra, J. A. Increased Presence of Monounsaturated Fatty Acids in the Stratum Corneum of Human Skin Equivalents. Journal of Investigative Dermatology. 133 (1), 59-67 (2013).
- Smola, H., Thiekötter, G., Fusenig, N. Mutual induction of growth factor gene expression by epidermal-dermal cell interaction. The Journal of Cell Biology. 122 (2), 417 (1993).
- Fluck, J., Querfeld, C., Cremer, A., Niland, S., Krieg, T., Sollberg, S. Normal Human Primary Fibroblasts Undergo Apoptosis in Three-Dimensional Contractile Collagen Gels. Journal of Investigative Dermatology. 110 (2), 153-157 (1998).
- Nakagawa, S., Pawelek, P., Grinnell, F. Long-Term Culture of Fibroblasts in Contracted Collagen Gels: Effects on Cell Growth and Biosynthetic Activity. Journal of Investigative Dermatology. 93 (6), 792-798 (1989).
- Smith, L. E., Bonesi, M., Smallwood, R., Matcher, S. J., MacNeil, S. Using swept-source optical coherence tomography to monitor the formation of neo-epidermis in tissue-engineered skin. Journal of Tissue Engineering and Regenerative Medicine. 4 (8), 652-658 (2010).
- Pierce, M. C., Strasswimmer, J., Park, H., Cense, B., De Boer, J. F. Birefringence measurements in human skin using polarization-sensitive optical coherence tomography. Biomed Opt. 2 (2), 287-291 (2004).
- Pierce, M. C., Strasswimmer, J., Hyle Park, B., Cense, B., de Boer, J. F. Advances in Optical Coherence Tomography Imaging for Dermatology. Journal of Investigative Dermatology. 123 (3), 458-463 (2004).
- Yeh, A. T., Kao, B., Jung, W. G., Chen, Z., Nelson, J. S., Tromberg, B. J. Imaging wound healing using optical coherence tomography and multiphoton microscopy in an in vitro skin-equivalent tissue model. Journal of Biomedical Optics. 9 (2), 9 (2004).
- Derr, K., et al. Fully Three-Dimensional Bioprinted Skin Equivalent Contructs with Validated Morphology and Barrier Funtion. Tissue Engineering Part C: Methods. 25 (6), 334-343 (2019).
- Park, B. H., de Boer, J. F. Polarization Sensitive Optical Coherence Tomography. Optical Coherence Tomography: Technology and Applications. , 1055-1101 (2015).
- Batheja, P., Song, Y., Wertz, P., Michniak-Kohn, B. Effects of Growth Conditions on the Barrier Properties of a Human Skin Equivalent. Pharmaceutical Research. 26 (7), 1689-1700 (2009).
- Dos Santos, M., Metral, E., Boher, A., Rousselle, P., Thepot, A., Damour, O. In vitro 3-D model based on extending time of culture for studying chronological epidermis aging. Matrix Biology. 47, 85-97 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten