Method Article
Поколение самособранных васкуляризированных эквивалентов кожи человека
В этой статье
Резюме
Целью данного протокола является описание генерации и объемного анализа васкуляризированных эквивалентов кожи человека с использованием доступных и простых методов для долгосрочной культуры. Насколько это возможно, обоснование шагов описано, чтобы позволить исследователям настраивать на основе их исследовательских потребностей.
Аннотация
Эквиваленты кожи человека (HSEs) представляют собой тканевые инженерные конструкции, которые моделируют эпидермальные и кожные компоненты кожи человека. Эти модели были использованы для изучения развития кожи, заживления ран и методов пересадки. Многие HSE по-прежнему не имеют сосудистой структуры и дополнительно анализируются с помощью посткультурного гистологического сечения, которое ограничивает объемную оценку структуры. Здесь представлен простой протокол, использующий доступные материалы для создания васкуляризированных эквивалентов кожи человека (VHSE); далее описаны методы объемной визуализации и количественной оценки этих конструкций. Вкратце, VHSEs построены в 12 вставках для культивированием скважин, в которых кожные и эпидермальные клетки засеиваются в коллагеновый гель типа I хвоста крысы. Дермальный компартмент состоит из фибробластов и эндотелиальных клеток, диспергированных по всему коллагеновому гелю. Эпидермальный компартмент состоит из кератиноцитов (эпителиальных клеток кожи), которые дифференцируются на границе раздела воздух-жидкость. Важно отметить, что эти методы настраиваются на основе потребностей исследователя, а результаты демонстрируют генерацию VHSE с двумя различными типами клеток фибробластов: дермальными фибробластами человека (hDF) и фибробластами легких человека (IMR90s). VHSEs были разработаны, визуалированы с помощью конфокальной микроскопии и объемно проанализированы с использованием вычислительного программного обеспечения в 4- и 8-недельных временных точках. Описан оптимизированный процесс фиксации, окрашивания, изображения и очистки VHSEs для объемного исследования. Эта комплексная модель, визуализация и методы анализа легко настраиваются в соответствии с конкретными исследовательскими потребностями отдельных лабораторий с опытом работы в области ОТ, ПБУ или без него.
Введение
Кожа человека выполняет многие важные биологические функции, включая действие в качестве иммунного / механического барьера, регулирующего температуру тела, участвующего в задержке воды и сенсорных ролях1,2,3,4. Анатомически кожа является крупнейшим органом в организме человека и состоит из трех основных слоев (эпидермис, дерма и гиподерма) и обладает сложной системой стромальных, сосудистых, железистых и иммунных / нервных компонентов в дополнение к клеткам эпидермиса. Сам эпидермис состоит из четырех слоев клеток, которые непрерывно обновляются для поддержания барьерной функции и других структур нативной кожи (т.е. потовых и сальных желез, ногтей)3. Физиология кожи важна в иммунной функции, заживлении ран, биологии рака и других областях, что приводит исследователей к использованию широкого спектра моделей, от монокультур in vitro до моделей животных in vivo. Животные модели предлагают возможность изучать всю сложность физиологии кожи, однако обычно используемые животные модели, такие как мыши, имеют значительные физиологические различия по сравнению с людьми5. Эти ограничения и повышенная стоимость животных моделей заставили многих исследователей сосредоточиться на разработке моделей in vitro, которые более точно отражают физиологию кожи человека1,6. Из них одним из более простых типов моделей является эпидермальный эквивалент человека (HEE; также называемый моделями кожи половинной толщины), который состоит только из эпидермальных кератиноцитов на клеточном дермальном матриксе, но захватывает эпидермальную дифференцировку и стратификацию, наблюдаемую in vivo. Основываясь на этом, модели, содержащие кожные и эпидермальные компоненты (кератиноциты и фибробласты), часто называют эквивалентами кожи человека (HSE), моделями кожи полной толщины или органотипическими конструкциями кожи (OSC). Вкратце, эти модели генерируются путем инкапсуляции кожных клеток в гелевые матрицы и посева эпидермальных клеток сверху. Эпидермальная дифференциация и стратификация могут быть достигнуты с помощью специализированных сред и воздействия воздуха7. Кожные эквиваленты чаще всего генерировались с помощью методов самосборки с использованием кожных гелей, изготовленных из коллагена типа I (либо крысиного хвоста, либо бычного происхождения)1,8,но аналогичные модели включали другие компоненты матрицы, такие как фибрин9,10,фибробласт, полученный11, 12,трупные деэпидермизированные мембраны13,14, 15,16,коммерчески доступные гели и другие1,12,13,17,18,19. В настоящее время существуют коммерчески доступные эквиваленты кожи (как ранее рассмотрено1,2). Тем не менее, они в основном разработаны для терапевтических целей и не могут быть легко адаптированы к конкретным исследовательским вопросам.
HSEs были применены в исследованиях заживления ран, пересадки, токсикологии и кожных заболеваний / развития11,12,13,16,8,20,21,22,23. Хотя 3D-культура более комплексно моделирует функции тканей человека по сравнению с 2D-культурами24,включение различных типов клеток, которые более точно отражают популяцию in vivo, позволяет проводить исследования клеточно-клеточной координации в сложных тканях24,25,26. Большинство HSEs включают только дермальные фибробласты и эпидермальные кератиноциты27,хотя среда кожи in vivo включает в себя многие другие типы клеток. Недавние исследования начали включать больше клеточных популяций; к ним относятся эндотелиальные клетки в сосудистойткани 10,28,29,30,31,32,33,34,адипоциты в подкожнойклетчатке 35,36,нервные компоненты19,21,стволовые клетки27,37,38,иммунные клетки10,39,40,41,42и другие специфические для заболевания /рака модели16,40,43,44,45,46,47. Особенно важным среди них является сосудистая азочная; в то время как некоторые HSEs включают сосудистые клетки, в целом им все еще не хватает всеобъемлющих капиллярных элементов с связностью по всей дерме10,29, расширенной стабильностью in vitro28и соответствующей плотностью сосудов. Кроме того, модели ОТ, ПБ и ООС обычно оцениваются с помощью посткультурного гистологического сечения, которое ограничивает анализ трехмерной структуры HSE. Трехмерный анализ позволяет проводить объемную оценку плотности сосудов48,49, а также региональных вариаций толщины и дифференцировки эпидермия.
Хотя HSEs являются одной из наиболее распространенных органотипических моделей, существует много технических проблем в создании этих конструкций, включая идентификацию соответствующего внеклеточного матрикса и плотности клеток, рецепты сред, надлежащие процедуры интерфейса воздушной жидкости и посткультурный анализ. Кроме того, в то время как модели HEE и HSE опубликовали протоколы, подробного протокола, включающего кожную сосудистую систему и объемную визуализацию, а не гистологический анализ, не существует. В данной работе представлен доступный протокол для культивируемых васкуляризированных эквивалентов кожи человека (VHSE) из преимущественно коммерческих клеточных линий. Этот протокол написан так, чтобы быть легко настраиваемым, что позволяет легко адаптироваться к различным типам клеток и потребностям исследований. В интересах доступности, наличия и стоимости использование простых продуктов и методов производства было приоритетом по сравнению с использованием коммерчески доступных продуктов. Далее описываются простые объемные методы визуализации и количественной оценки, позволяющие оценить трехмерную структуру VHSE. Перевод этой процедуры в надежный и доступный протокол позволяет исследователям-неспециалистам применять эти важные модели в персонализированной медицине, васкуляризированной тканевой инженерии, разработке трансплантатов и оценке лекарств.
протокол
1. Подготовка к 3D культуре
- Готовят коллагеновый запас крысиного хвоста по 8 мг/мл, используя установленные протоколы50,51,52. В качестве альтернативы, коллаген крысиного хвоста можно приобрести у продавцов (см. список материалов) в соответствующих концентрациях.
ПРИМЕЧАНИЕ: Коллаген можно приготовить или приобрести в различных концентрациях в диапазоне 3-10 мг/мл или выше50,51,52. Расчеты в протоколе предполагают концентрацию 8 мг/мл, но могут быть скорректированы в зависимости от потребностей исследователя. - Расширение клеточных линий: клетки эндотелия и фибробластов должны быть готовы к посеву в начале генерации 3D-коллагеновых кожных компонентов (шаг 2). Кератиноциты должны быть готовы на 7 день 3D культуры. Для одной полной конструкции VHSE требуется 7,5 x 105 эндотелиальных клеток; 7,5 х 104 фибробластов; и 1,7 х 105 кератиноцитов для генерации(табл. 1).
ПРИМЕЧАНИЕ: Эти плотности подходят для проницаемых тканевых культур размером 12 скважин или эквивалентных. Плотность и формат клеток могут быть увеличены или уменьшены в зависимости от потребностей исследователя. Чтобы уточнить, такое количество эндотелиальных и фибробластных клеток будет сеять 1-3 дермальных компонента, в то время как каждый эпидермальный компонент требует 1,7 х 105 кератиноцитов. - Выполняйте центрифугирование всех клеток в этом протоколе в течение 5 минут при 300 х г,но это может быть уменьшено для более хрупких типов клеток.
2. Генерация 3D коллагенового дермального компонента
ПРИМЕЧАНИЕ: Шаг 2 является чувствительной ко времени процедурой и должен быть выполнен в одном параметре. Рекомендуется пройти проверку качества коллагенового материала, чтобы обеспечить надлежащее гелеобразование и однородность перед началом посева кожных компонентов, см. Устранение неполадок в обсуждении.
- Подготовка и посев слоя ацеллюлярного коллагена
- Подготовьте две трубки микроцентрифуги с крышкой 1,7 мл, одну для бесклеточной поддержки и одну для клеточной дермы. Количества, указанные на этом этапе, будут готовить 1 мл коллагена 3 мг/мл (целевая концентрация коллагена), достаточная для (3) VHSEs размером 12 скважин. Уравнения перечисляются, если необходима корректировка. Как объем, так и плотность могут быть масштабированы в зависимости от потребностей исследователя (общие справочные номера приведены в таблице 2).
- К каждой пробирке добавляют 100 мкл культурального 10x фосфатно-буферного физиологического раствора (PBS) (одна трубка даст 3 VHSEs) и добавляют 8,6 мкл 1 N NaOH. Поместите закрытые трубки на влажный лед для охлаждения в течение не менее 10 минут.
Cs = Концентрация запасов коллагена
Vf = Необходимый окончательный объем коллагена
Ct = целевая концентрация коллагена
Vs = Объем запасного коллагена, необходимого для желаемого количества (Vf)
Vpbs = Объем 10X PBS, необходимый для целевой концентрации коллагена (Ct)
VNaOH = Объем 1N NaOH, необходимый для Ct
Vноситель = Объем носителя, приостановка вызова или ddH2O, необходимый для Ct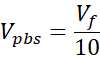
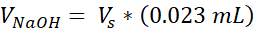
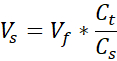
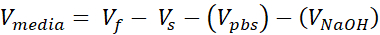
- Подготовьте пипетки с положительным смещением 1000 и 250 мкл для использования и отложите в сторону. Поскольку более поздние этапы чувствительны ко времени, удобно загружать наконечники пипеток и устанавливать объемы (375 мкл и 125 мкл соответственно). Кроме того, установите обычную пипетку 1000 мкл на 516 мкл.
ПРИМЕЧАНИЕ: При необходимости пипетки с положительным смещением могут быть заменены обычными пипетками, но из-за высокой вязкости коллагена и чувствительности к времени / температуре этой процедуры рекомендуется использовать пипетки с положительным смещением, чтобы помочь получить последовательные результаты посева. Если вы используете обычные пипетки, используйте медленные движения. - Подготовьте пластины для посевных колодцев: используйте стерильные щипцы, чтобы поместить три 12-ти скважинных культурных вставок в стерильную 12-скважинную пластину для культивирование ткани, поместите в центральные колонны.
- Установите холодные среды, подходящие для типов фибробластов и эндотелиальных клеток.
- После охлаждения колпачных трубок поместите одну трубку (для бесклеточной поддержки) на стойку с видимым содержимым. Оставьте другую трубку (для клеточной дермы) на льду.
- Удалите 8 мг/мл коллагена из холодильника и поместите на влажный лед.
ПРИМЕЧАНИЕ: Не используйте морозильный лед или настольные охладители -20 °C, так как это заморозит коллаген. - В холодную колпашку добавьте 516 мкл среды и сразу же добавьте 375 мкл холодного коллагена, используя пипетку с положительным смещением 1000 мкл. Дозировать коллаген в раствор (не в сторону трубки). Немедленно снимите пустой наконечник пипетки и переключитесь на приготовленную пипетку с положительным смещением 250 мкл для смешивания.
- Быстро, но осторожно перемешайте, чтобы предотвратить образование пузырьков, не удаляйте кончик из раствора, если это возможно. Перемешивайте до однородного цвета, что обычно занимает около 5 циклов пипетки или 10 с (при использовании среды с фенолом красного цвета цвет станет светлее и однородным). При перемешивке обязательно вытягивайте из разных положений трубки (снизу и сверху) для равномерного перемешивания.
ПРИМЕЧАНИЕ: Это может быть выполнено с 516 мкл воды класса клеточной культуры или другой жидкости класса клеточной культуры, однако фенол красный из большинства сред является хорошим показателем смешивания. Используйте либо фибробласты, либо эндотелиальные среды, которые использовались для 2D-расширений.
- Быстро, но осторожно перемешайте, чтобы предотвратить образование пузырьков, не удаляйте кончик из раствора, если это возможно. Перемешивайте до однородного цвета, что обычно занимает около 5 циклов пипетки или 10 с (при использовании среды с фенолом красного цвета цвет станет светлее и однородным). При перемешивке обязательно вытягивайте из разных положений трубки (снизу и сверху) для равномерного перемешивания.
- Немедленно рассейте 125 мкл клейкового коллагена на мембрану каждой из трех 12-скважинных культурных вставок. Для обеспечения равномерного покрытия бесклеточным коллагеновым гелем, качайте блюдо; если это не создает равномерного покрытия мембраны, то используйте наконечник пипетки, чтобы по существу покрасить мембрану, осторожно распределяя коллаген вокруг; избегайте давления на мембрану. Гелеобразование начинается практически сразу; Выполните этот шаг быстро, чтобы обеспечить равномерное покрытие.
ПРИМЕЧАНИЕ: Будет избыток бесклеточного коллагена. Объем может быть уменьшен, однако приготовление менее 1 мл коллагеновой суспензии может привести к трудностям смешивания раствора и недостаточному гелеобразованию. - Немедленно переместите 12-скважинную пластину в инкубатор клеточной культуры при 37 °C, чтобы она гелеобразовала в течение не менее 20 минут (при необходимости клеточный коллаген может гель дольше; в течение этого времени гелеобразования перейдите к этапу 2.2). Извлеките коллагеновую суспензию со льда и поместите обратно в холодильник (коллаген наиболее стабилен при 4 °C).
- Клеточная суспензия и подготовка к посеву
ПРИМЕЧАНИЕ: Для временной шкалы культур этого протокола соответствует Дню погружения 1 (SD1)- Во время гелеобразования клеточной коллагеновой поддержки трипсинизируют и подсчитывают клеточные линии эндотелия и фибробластов.
- Суспендировать 7,5х 10 5 эндотелиальных клеток и 7,5 х 104 фибробластов в 258 мкл их соответствующих сред и комбинировать клеточные суспензии для создания аликвоты 516 мкл. Выдерживая клеточные суспензии на влажном льду до использования.
- Подготовьте пипетки с положительным смещением 1000 и 250 мкл для использования и отложите в сторону. Поскольку более поздние этапы чувствительны ко времени, удобно загружать наконечники пипеток и устанавливать объемы (375 мкл и 250 мкл соответственно). Кроме того, установите обычную пипетку 1000 мкл на 516 мкл.
- Клеточный коллагенового посева дермального компартмента
- После периода гелеобразования удалите из инкубатора 12-хорошую пластинку ацеллюлярного коллагена.
ПРИМЕЧАНИЕ: Если этот коллаген не гелеобразуется через 30 минут, не продолжайте процедуру, так как во время посева может возникнуть ошибка или у коллагенового запаса может возникнуть проблема (см. Устранение неполадок в обсуждении). - Извлеките из влажного льда трубку с крышкой 1,7 мл (содержит 10 PBS и NaOH). Поместите трубку в стойку так, чтобы содержимое было видно. Ослабьте/откройте все колпачки (клеточная суспензия, трубка с холодной крышкой).
- Извлеките коллаген (8 мг/мл) из холодильника с 4 °C и поместите на влажный лед. Оставьте крышку открытой.
- Добавьте 516 мкл охлаждаемой клеточной суспензии в холодную колпакку. Используйте пипетку с положительным смещением 1000 мкл, чтобы немедленно пипетку 375 мкл холодного коллагенового раствора непосредственно в раствор колпашку трубки.
- Вытолкнуть весь коллаген из пипетки в трубку и отбросить наконечник пипетки с положительным смещением. Немедленно переключитесь на пипетку с положительным смещением 250 мкл и смешайте раствор коллагена.
- Смешайте раствор коллагена, как это было выполнено ранее (быстро, но осторожно, чтобы предотвратить образование пузырьков), не удаляйте кончик из геля, если это возможно. Перемешивать до однородной однородной стоки (около 5 циклов пипетки или 10 с). При смешивании обязательно вытягивайте из разных положений трубку (нижнюю и верхнюю) для равномерного перемешивания.
- После смешивания немедленно перенесите 250 мкл клеточного раствора коллагена на аклеточные коллагеновые опоры в каждой из трех 12-скважинных культурных вставок. Чтобы обеспечить равномерное покрытие бесклеточной коллагеновой опоры, раскачайте тарелку и/или используйте пипетку с положительным смещением, чтобы мягко перемещать свежепосеянный клеточный коллаген, не нарушая бесклеточный слой.
- Немедленно переместите 12-скважинную пластину в инкубатор для культивации клеток с 37 °C, чтобы она гелеобразной в течение не менее 30 минут. Поместите коллаген обратно в охлаждение при 4 °C после использования.
- После 30-минутного гелевого времени осторожно наклоните пластину, чтобы оценить гелеобразование. Убедитесь, что коллаген затвердеет.
- Добавьте 500 мкл и 1000 мкл смешанной среды (половину эндотелиальной и половины фибробластной поддерживающей среды) в верхнюю и нижнюю камеры вставки соответственно (сначала сверху, затем снизу, чтобы предотвратить гидростатическое давление от выталкивания коллагена вверх). Медленно добавляйте жиму в боковую часть колодца, а не непосредственно на коллагеновый гель, чтобы свести к минимуму нарушение коллагена.
- Убедитесь, что коллагеновый гель погружен в море, при необходимости добавьте больше среды. Поместите пластину колодца в клеточный инкубатор для ночной инкубации. На этом этапе носитель содержит 10% FBS; обычный носитель обслуживания для каждой линии ячейки (временная шкала и схема, приведенные на рисунке 1,A).
ПРИМЕЧАНИЕ: Носители во всей культуре VHSE могут быть адаптированы для пользовательских типов клеток; может потребоваться некоторая оптимизация.
- Убедитесь, что коллагеновый гель погружен в море, при необходимости добавьте больше среды. Поместите пластину колодца в клеточный инкубатор для ночной инкубации. На этом этапе носитель содержит 10% FBS; обычный носитель обслуживания для каждой линии ячейки (временная шкала и схема, приведенные на рисунке 1,A).
- После периода гелеобразования удалите из инкубатора 12-хорошую пластинку ацеллюлярного коллагена.
- Погружение День 2 (SD2) Изменение носителей
- Изменить 10% среды FBS в скважинах VHSE на 5% FBS половину фибробластов, половину эндотелиальных сред, дополненных 100 мкг/мл L-аскорбиновой кислоты. Добавьте 500 мкл в верхнюю камеру культурального вкладыша сбоку от колодца (опять же, аккуратно добавьте к боковине, чтобы свести к минимуму нарушение коллагена) и добавьте 1000 мкл в нижнюю камеру.
- Обновляйте носитель каждые 2 дня (SD4 и SD6) до 7-го дня погружения (SD7).
- Используйте ручную пипетку для удаления среды из скважин. Использование аспиратора возможно, но может привести к повреждению или разрушению конструкции.
ПРИМЕЧАНИЕ: L-аскорбиновая кислота должна быть в свежем виде каждые 2-3 дня (она окисляется в растворе с получением перекиси водорода, вызывая таким образом окислительный стресс и, в конечном итоге, повреждение клеток53). Таким образом, носители необходимо менять каждые 2-3 дня от SD2 до конца культуры VHSE, так как присутствует L-аскорбиновая кислота. Проще всего сделать запас среды и добавлять свежеприготовленное количество L-аскорбиновой кислоты в медиааликвотку каждый день кормления. Используйте культуральная вода или среда в качестве растворителя и приготовьте свежую L-аскорбиновую кислоту в 100 мг/мл. L-аскорбиновая кислота стимулирует синтез коллагена фибробластами с соответствующей скоростью и способствует стабильности коллагена54,55,56; он также снижает эндотелиальную проницаемость и сохраняет целостность стенок сосудов56,57 и дополнительно способствует образованию эпидермального барьера6,58.
3. Посев эпидермального компонента и индукция стратификации
- Погружение День 7 (SD7): семенные кератиноциты
ПРИМЕЧАНИЕ: Семена кератиноцитов для установления эпидермиса на SD7. Этот момент времени может быть смещен в зависимости от потребностей исследователя. Продолжительность погружения культуры без кератиноцитов не должна превышать 9 дней, так как более длительное погружение часто приводит к усилению сокращения кожной смолы. Если сокращение происходит до SD7, рекомендуется сократить период погружения до 5 дней и засеять эпидермис на SD5. Оптимизируйте период погружения в соответствии с требованиями конкретных экспериментов (см. раздел Устранение неполадок в обсуждении).- Культивировать кератиноциты (N/TERT-120,59 или другие соответствующие клетки) до предела их спадания перед трипсинизацией и посевом на VHSEs. Для клеток N/TERT-1 слияние не должно значительно превышать 30%, чтобы предотвратить неищущенюю дифференцировку кератиноцитов в 2D культуре59. Для других соответствующих клеточных линий, таких как первичные эпидермальные кератиноциты человека, предел слияния 75-80% обычно используется60.
- После трипсинизации подсчитайте и суспендируют 510 000 клеток в 600 мкл среды дифференцировки эквивалента кожи человека (HSE), дополненной 5% FBS(таблица 1).
ПРИМЕЧАНИЕ: 510 000 клеток в 600 мкл позволяет использовать 170 000 клеток/конструкцию при посеве 200 мкл на конструкцию (3 VHSEs). - Используя ручную пипетку, собирайте и выбрасывайте среды, которые в настоящее время находятся в нижней и верхней камере для каждой конструкции колодца. Обязательно соберите как можно больше медиа. Соберите жимы, которые могут застрять непосредственно под проницаемой мембраной, осторожно поместив наконечник пипетки под мембрану вставки культуры и временно выбив вставку с места. Возможно, носитель застрял из-за поверхностного натяжения. Убедитесь, что вставки находятся в своих колодцах, прежде чем продолжить. Использование аспиратора возможно, но может привести к повреждению или разрушению конструкции.
- Добавьте 1 мл среды ОТ, ПБ и ОУ, дополненной 5% FBS, в нижнюю камеру каждой скважины. Затем добавьте 200 мкл клеточной суспензии в верхнюю камеру каждой скважины. Семена непосредственно на поверхность дермальной конструкции. Дайте кератиноцитам осесть в течение 2 ч в инкубаторе.
- Через два ч после посева кератиноцитов осторожно добавить 300 мкл среды ОТ, ПБ и ООС, дополненных 5% FBS, в верхнюю камеру каждого конструктного колодца; медленно пипетку на боковую часть культуры вставки. Загружайте среды в верхнюю камеру очень осторожно, чтобы не нарушить осевшие кератиноциты, которые, возможно, еще не плотно прилипли к основному коллагенову гелю.
- После загрузки носителя поместите конструкцию обратно в инкубатор.
- День погружения 8/9 (SD8 или SD9)
- Состав HSE среды с добавлением 1% FBS и 100 мкг/мл L-аскорбиновой кислоты.
- Удалите материалы как из верхней, так и из нижней камер с помощью ручного пипетки.
- Сначала добавьте 500 мкл среды в верхнюю камеру, а затем 1 мл в нижнюю камеру. (Этот шаг можно выполнить на SD8 или SD9)
- День погружения 9/10 (SD9 или SD10, это должен быть день после шага 3.2)
- Составляйте свободные от сыворотки свободные от этого среды дифференцировки HSE со 100 мкг/мл L-аскорбиновой кислоты.
- Удалите материалы как из верхней, так и из нижней камер с помощью ручного пипетки.
- Загрузите 500 мкл в верхнюю камеру и 1 мл в нижнюю.
- Воздушно-жидкостный интерфейс День 1 (ALI1)
ПРИМЕЧАНИЕ: АЛИ выполняется на следующий день после шага 3.3.- Поднимите каждую конструкцию на воздушно-жидкостную границу (ALI), удалив отходы среды только из верхней камеры. Используйте ручную пипетку, чтобы максимально приблизиться к эпидермальному слою, не касаясь и не повреждая его.
- Наклоните пластину немного под разными углами, чтобы собрать носитель. Удалите как можно больше носителей на этом шаге. Добавьте приблизительно 2 мл стерильной воды в окружающие колодцы в плите для поддержания постоянной влажности; держите колодцы заполненными водой на протяжении всей культуры.
- Проверьте пластину через несколько часов, чтобы убедиться, что кератиноциты все еще находятся на границе раздела воздух-жидкость. Если в верхней камере есть среда, удалите ее. Отслеживайте, сколько носителей удаляется для каждой скважины VHSE , (Начальный объем верхней и нижней камер (1500 мкл) - удалены носители = хорошая отправная точка для подачи ALI).
ПРИМЕЧАНИЕ: VHSEs не обязательно требуют одинакового уровня среды для воздушной подъемной силы; Обычно, если VHSEs засеяны вместе, то им нужен примерно одинаковый уровень среды для воздушной подъема, но это не всегда так. Отрегулируйте громкость по мере необходимости для поддержания ALI, но убедитесь, что уровни носителей не настолько низки, чтобы VHSEs высохли. Безопаснее быть осторожным и ежедневно удалять небольшие количества среды до тех пор, пока не будет достигнут баланс между воздушным подъемом и гидратацией.
- АЛИ День 2 (АЛИ2)
- С этого момента используйте только сывороточные свободные среды HSE, дополненные 100 мкг/мл L-аскорбиновой кислоты. Смена носителя на ALI День 2 (ALI2). Если в верхней камере есть носитель, удалите его и добавьте к количеству удаленных носителей, записанных ранее. Рассчитайте необходимый объем носителя, используя уравнение на предыдущем шаге. Например: Если 200 мкл среды было удалено из верхней камеры, то добавьте 1300 мкл для установления АЛИ (как 1500 мкл - 200 мкл = 1300 мкл)
- Используйте объем, рассчитанный на загрузку в нижнюю камеру каждой скважины, затем поместите пластину обратно в клеточный инкубатор. Отслеживайте объем, используемый в день. При использовании рекомендуемых количеств коллагена в 12-скважинных культурных вставках обычный диапазон значений ALI находится между 750 мкл и 1300 мкл. Как правило, объем уменьшается по мере созревания культуры и становится последовательным около 2/3 недели ALI. В зависимости от специфики языка и культуры это число может изменяться и должно быть оптимизировано (как описано в 3.4.2 - 4.1).
4. Плановое поддержание сосудистого эквивалента кожи человека
- От ALI Day 3 (ALI3) до конечной точки культуры: Обновление среды нижней камеры каждые 2-3 дня с использованием свободных от сыворотки HSE со 100 мкг/мл L-аскорбиновой кислоты. Продолжайте регулировать и отслеживать уровень среды, необходимый в нижней камере для ALI, как описано в шаге 3.5.2.
- Поскольку поверхность эпидермия должна оставаться в контакте с воздухом, ежедневно проверяйте и регулируйте уровень среды до тех пор, пока не будут установлены постоянные уровни ALI. Эпидермальный слой должен выглядеть гидратированным, а не сухим, но на вершине конструкции не должно быть среды. Культуры с 8 неделями АЛИ обеспечили наиболее последовательную морфологию и экспрессию; однако, в зависимости от применения, могут быть подходящими культуры от 4 до 12 недель. Возможно, потребуется оптимизировать продолжительность культивируемой культуры для различных условий культивируемых культур.
ПРИМЕЧАНИЕ: Смена носителей в понедельник, среду, пятницу является хорошей практикой. VHSEs здоровы в выходные дни, но средства массовой информации должны быть изменены рано утром в понедельник и поздно вечером в пятницу. После полного завершения шагов 1-4 генерация VHSE завершена. Шаги 5-end протокола представляют собой дополнительные методы обработки и визуализации, которые были оптимизированы для этого типа 3D-конструкции.
5. Фиксация и пермеабилизация 3D конструкций
ПРИМЕЧАНИЕ: Шаг 5 был оптимизирован для методов визуализации, специфичных для этой 3D-конструкции, которые описаны в остальной части протокола. Следующие шаги не являются необходимыми для создания VHSE.
- Фиксация/пермеабилизация
- Осторожно удалите все среды из верхней и нижней камер каждой скважины в конечной точке культурного периода.
ПРИМЕЧАНИЕ: Эпидермальный слой, возможно, хрупкий, обращаться с осторожностью и не перемешивать эпидермис агрессивным пипетированием. - Добавьте 4% параформальдегида (PFA) в PBS (pH 6,9) к стене верхней камеры (не непосредственно на конструкции), а затем в нижнюю камеру, чтобы предварительно закрепить каждую конструкцию. Добавьте 1 мл на камеру и выставить в течение 5 мин при комнатной температуре.
ВНИМАНИЕ: PFA опасен и должен обрабатываться с осторожностью и соответствующими средствами индивидуальной защиты (СИЗ), включая защиту глаз. - Удалить 4% раствор PFA через 5 мин и добавить 0,5% Triton X 100 в 4% растворе PFA в верхнюю и нижнюю камеры, как описано на предыдущем этапе. Выставлять в течение 1 часа при комнатной температуре; Конструкция VHSE отныне не требует стерильной среды.
- Через 1 час осторожно удалите раствор для пермеабилизации/фиксации из обеих камер и промыть образец 3 раза 1x PBS.
- Храните образцы в PBS в холодильнике при 4 °C или немедленно окрашивайте. Для хранения образцов заверните блюдо в полиэтиленовую пленку, а затем в фольгу, чтобы свести к минимуму испарение и воздействие света
ПРИМЕЧАНИЕ: Точка паузы - После фиксации и пермеабилизации эта процедура может быть приостановлена, поскольку образцы стабильны в течение нескольких недель, если они подготовлены, как описано в шаге 5.1.5. Альтернативно, окрашивание (как описано на шаге 6) может быть завершено сразу после шага 5.
- Осторожно удалите все среды из верхней и нижней камер каждой скважины в конечной точке культурного периода.
6. Иммунофлуоресцентное окрашивание 3D конструкций
- Подготовка конструкции
ПРИМЕЧАНИЕ: VHSEs хорошо окрашиваются при отделении от пористой мембраны культурального вкладыша; отделение от мембраны также необходимо для беспомощителивого изображения и позволяет уменьшить объемы для окрашивания.- Чтобы подготовить конструкцию к иммунофлуоресцентным окрашиванию, переверните вставку вверх дном и поместите ее над ее колодцей на пластине скважины (если VHSE упадет, он попадет в скважину с PBS)(Дополнительный рисунок 1A).
- Стабилизируем вставку одной рукой над колодецом, используя тонкие щипцы и/или прецизионный нож, чтобы разрезать около половины окружности мембраны вставки. Вырежьте как можно ближе к пластиковому корпусу мягкой рукой, чтобы предотвратить повреждение конструкции VHSE.
- Используя тонкие щипцы наконечника, захватите край клапана разрезанной мембраны и аккуратно отклейте пористую мембрану от вставки, а также конструкции VHSE. Делайте это очень осторожно и медленно, чтобы предотвратить повреждение конструкции конструкции VHSE. Если конструкция VHSE легко отделяется, то она должна упасть в колодец ниже, если она застрянет на стороне камеры, то используйте тонкие наконечники щипцов или небольшую совок, чтобы переместить ее в колодец. Будьте очень внимательны к эпидермальному слою, так как он обычно хрупкий(Дополнительный рисунок 1A).
ПРИМЕЧАНИЕ: Иногда мембрана не отрывается легко или отрывается кусками, если это происходит, используйте инструменты, чтобы аккуратно раздвинуть мембрану и конструкцию VHSE. Убедитесь, что VHSEs не высыхают во время этого процесса, при необходимости погружаясь в PBS. - Как только VHSE будет в скважине, отбросьте все оставшиеся куски мембраны вставки и держите корпус вкладыша культуры в каждой скважине, чтобы удерживать VHSE в подводном положении во время окрашивания.
- окрашивание
ПРИМЕЧАНИЕ: Окрашивание и связанные с ним манипуляции/манипуляции и стирки должны выполняться как можно более мягко, так как VHSEs могут быть хрупкими. Если части эпидермиса отрываются, кусочки можно окрашивать отдельно; верхние слои эпидермиса хрупкие и проходят естественную десквамацию4,но для анализа важно максимально сохранить целостность.- Подготовьте выбранные пятна первичных антител в 700 мкл блокирующего буфера на конструкцию хорошо (как правило, все первичные антитела могут находиться в одном и том же окрашивающем растворе, но это должно быть подтверждено для новых антител). 700 мкл работает для 12-скважинного размера, но может быть скорректирована для других форматов культуры. Рекомендуемые концентрации первичных и вторичных антител с блокирующим буфером приведены в таблице 3 (может потребоваться оптимизация).
- Извлеките PBS из скважины с помощью ручной пипетки, будьте осторожны, чтобы пипетка ушла от VHSEs (поскольку VHSEs плавают, вакуумная аспирация не рекомендуется).
- Добавьте первичный раствор пятна в каждую скважину и поместите корпус вставки культуры в скважину, чтобы VHSE был погружен в жидкость(Дополнительный рисунок 1B). Оберните тарелку колодца полиэтиленовой пленкой. Фольга и окрашивание в течение 48 ч при охлаждении при 4 °C без перемешивания или раскачивания (раскачивание может повредить конструкцию VHSE).
- Через 48 ч готовят вторичные антитела и химические пятна в 700 мкл блокирующего буфера (на скважину).
- Снимите корпус вкладыша культуры и первичный раствор для окрашивания и промыть 1x PBS, 3x в течение 5 мин перед добавлением вторичного раствора для окрашивания. Поместите корпус культуральной вставки обратно в колодец, чтобы конструкция VHSE была погружена в нет(дополнительный рисунок 1B). Выставлять в течение 48 ч при 4 °C охлаждении без перемешивания или раскачивания.
- После 48 ч выдержки удалите раствор пятна с помощью ручного пипетки и аккуратно промыть 3x PBS; не пипетки попадают прямо на VHSEs, так как они могут быть хрупкими. Регидратируйте с избытком PBS и поместите корпус вставки культуры обратно в скважину, чтобы VHSE был погружен и гидратирован во время хранения (храните, завернув в полиэтиленовую пленку и фольгу, чтобы свести к минимуму испарение и воздействие света)
- Клиринг (опционально и терминал)
ПРИМЕЧАНИЕ: Очистка является необязательной для визуализации. Если это завершено, это должно быть сделано после окрашивания / визуализации образца полностью, поскольку очистка предотвращает дальнейшее окрашивание, может изменить характеристики флуорофора и может повредить структуру VHSE. Существует несколько методов очистки тканей49,61,62 и могут быть оптимизированы для конкретных проектов. Очистка метилсалицилата, описанная ниже, проста и эффективна для VHSE. Следующая техника очистки должна быть завершена в стеклянной таре, а наконечники пипеток должны быть стеклянными или полипропиленовыми (полистирол растворяется при контакте с метилсалицилатом). Завершите всю процедуру очистки в хорошо проветриваемом помещении или вытяжке.- Добавьте 100% метанол в небольшую неглубокую стеклянную емкость (стеклянная чашка Петри хорошо работает). Используйте наименьший контейнер, который будет соответствовать конструкции (чтобы минимизировать отходы реагентов).
- Снимите конструкцию с плиты скважины с помощью щипцов/совков(дополнительный рисунок 1С)и поместите в контейнер, наполненный метанолом. Добавьте больше метанола, если конструкция не погружена в море.
- Обезвоживание конструкции VHSE в метаноле в течение 3 х 10 мин погружений; полностью заменяйте метанол после каждого погружения и своевременно удаляйте метанол после последней ванны. В ходе этой процедуры конструкция может стать более непрозрачной и немного сжиматься.
ПРИМЕЧАНИЕ: Эти длительности и повторения были оптимизированы, но метанол и следующие процедуры метилсалицилата, возможно, потребуется настроить в зависимости от конкретного формата культуры и пятен. - Сразу после удаления метанола добавьте метилсалицилат и погружите VHSE в погружения 5 х 5 мин. Полностью заменяйте реагент после каждого погружения и оставляйте VHSE в 5-м погружном растворе для хранения. В ходе этой процедуры конструкция становится прозрачной.
- Изобразить конструкцию или хранить при 4 °C. После очистки завершите все изображения как можно скорее, так как флуорофоры могут разлагаться в метилсалицилате в течение нескольких дней. Очистка приводит к тому, что конструкции становятся хрупкими, а длительное хранение, хотя и не рекомендуется, нуждается в регулярной проверке, чтобы убедиться, что есть достаточное количество метилсалицилата.
7. Конфокальная визуализация 3D-конструкций
ПРИМЕЧАНИЕ: Визуализация через пластик культуры тканей не даст такого же качества изображения, как визуализация через покровное стекло, этот метод описывает изготовление пользовательского стеклянного колодца для предотвращения высыхания во время конфокальной визуализации. Как правило, этого достаточно для получения изображения не менее 3 ч.
- За два дня до визуализации: приготовьте полидиметилсилоксан (PDMS)
- Готовят ФДМС48,63,64 при рекомендуемой концентрации [9:1], основание: сшитый. Готовят 30 г ДПМС всего: 27 г базового компонента и 3 г сшиваемого. Поместите любой чистый смеситель на весы и обложите весы тарой. Добавьте основание (27 г), а затем добавьте сшиватель (3 г), чтобы получить в общей сложности 30 г. Всегда добавляйте базу перед кросслинкером.
- Энергично перемешайте раствор не менее 4 мин; это создаст небольшие пузырьки. После достаточного перемешивания вылейте PDMS в 100-миллиметровую чашку Петри или аналогичный термостойкий контейнер с плоским дном.
- Дегазируйте PDMS в вакуумной камере до тех пор, пока все пузырьки от смешивания не исчезнут и PDMS не очистится. Медленно отпустите вакуум и медленно удалите PDMS. Поместите блюдо в духовку для затвердения на ночь (50-60 °C); убедитесь, что блюдо сидит ровно, чтобы PDMS вылечил равномерно.
ПРИМЕЧАНИЕ: После отверждения PDMS должна быть прозрачной, а поверхность должна быть гладкой и не липкой (липкость может указывать на недостаточное перемешивание).
- За день до визуализации: подготовка скважины PDMS
- Используя стальной перфоратор или ручной прецизионный нож, пробивайте или вырезайте круглую скважину из листа PDMS, приготовленного в 7.1. Скважина должна быть примерно такого же размера, как конструкция VHSE. Вырежьте квадратный участок вокруг круглого колодца, чтобы создать один колодец PDMS. Подготовленное количество PDMS в 30 г должно давать не менее четырех пользовательских скважин.
ПРИМЕЧАНИЕ: Скважина PDMS должна быть близка к размеру конструкции VHSE. Он должен сжимать движение образца во время визуализации. Несколько скважин могут быть изготовлены одновременно и храниться неопределенно долго в чистом контейнере. - Используя стеклянный покровный лист аналогичного размера с колодце PDMS, добавьте цианоакрилатный клей (например, суперклей) на нижнюю поверхность PDMS (гладкая поверхность, которая контактировала с чашкой Петри) и равномерно смажьте одноразовым наконечником пипетки. Центрируйте и хорошо прижмите PDMS к стеклу, оставляя прозрачное стеклянное окно в перфорированном круге (убедитесь, что клей не размазывается по окну просмотра).
ПРИМЕЧАНИЕ: При наличии плазменная связь PDMS с покровным листом является альтернативой65,66,67. - Дайте клею высохнуть в течение нескольких часов или на ночь перед использованием. Они можно многоразово, пока они не сломаются от нормального износа.
ПРИМЕЧАНИЕ: Не рекомендуется окрашивать образцы в клееный PDMS, хорошо используемый для визуализации. Эти скважины удерживают жидкость в течение нескольких часов, но могут протекать во время более длительного окрашивания.
- Используя стальной перфоратор или ручной прецизионный нож, пробивайте или вырезайте круглую скважину из листа PDMS, приготовленного в 7.1. Скважина должна быть примерно такого же размера, как конструкция VHSE. Вырежьте квадратный участок вокруг круглого колодца, чтобы создать один колодец PDMS. Подготовленное количество PDMS в 30 г должно давать не менее четырех пользовательских скважин.
- VHSE визуализация
ПРИМЕЧАНИЕ: Если визуализация неочищена образцами, используйте PBS в качестве решения для визуализации. При визуализации с очищенными образцами используйте метилсалицилат (или выбранный очищающий раствор) в качестве раствора для визуализации.- Добавьте несколько капель раствора для визуализации в колодец PDMS и проверьте наличие утечек (если есть утечка, восстановите ее точкой / мазком цианоакрилатного суперклея или используйте другую скважину).
- Держите решение для обработки изображений в PDMS хорошо при добавлении VHSE. Используя совок или щипцы с тонким наконечником(дополнительный рисунок 1C),снимите конструкцию с 12-скважинной пластины и поместите в колодец PDMS на стеклянную крышку. Конструкция места с ориентацией интереса обращена к цели. Например, чтобы изобразить эпидермис с помощью перевернутого микроскопа, убедитесь, что эпидермис обращен вниз, к стеклу.
- В качестве альтернативы, для вертикального микроскопа, повезжайте эпидермис вверх. Приведенные ниже процедуры визуализации описаны для инвертированного микроскопа, но могут быть легко адаптированы для вертикального.
ПРИМЕЧАНИЕ: Будьте осторожны при манипулировании VHSE, чтобы избежать повреждений. Перенос над плитой скважины в случае падения VHSE. Изогнутый, плоский наконечник совок является самым простым способом переноса конструкции(Дополнительный рисунок 1C).
- В качестве альтернативы, для вертикального микроскопа, повезжайте эпидермис вверх. Приведенные ниже процедуры визуализации описаны для инвертированного микроскопа, но могут быть легко адаптированы для вертикального.
- Убедитесь, что образец находится в колодец и что никакие части эпидермиса или дермы не сложены под образцом. При возникновении складывания осторожно манипулируйте образцом щипцами или совком; Временное добавление дополнительного решения для визуализации для плавающего VHSE может помочь ему выпрямиться. Складывание или сморщивание образца можно увидеть глазом или с помощью микроскопа.
- Заполните скважину раствором для визуализации, используя достаточно жидкости для поддержания гидратации образца; слишком много жидкости будет плавать в образце, что приведет к движению во время визуализации. Конструкция должна сидеть на стеклянном смотровом окне; испытание на движение путем наклона pdms колодца. Если есть движение, удалите немного жидкости; добавляйте и удаляйте жидкость по каплям до тех пор, пока движение не прекратится.
- Поместите стеклянный слайд над скважиной, чтобы свести к минимуму испарение во время визуализации(Дополнительный рисунок 1D). Для более длительных сеансов визуализации часто проверяйте образец, чтобы убедиться в надлежащем уровне жидкости. Если это доступно, можно использовать увлажненную камеру во время визуализации (хотя обычно в этом нет необходимости).
- Поместите образец на ступень микроскопа и изображение через стеклянное покровное окно(Дополнительный рисунок 1D). Этот метод позволяет проводить не менее 3 ч непрерывной конфокальной визуализации, но гидратация образца должна регулярно проверяться, при необходимости добавляя раствор для визуализации.
ПРИМЕЧАНИЕ: Если образец очищен, метилсалицилат со временем разлагает клей. Клей, склеивающий PDMS, может быть повторно применен между запусками визуализации; или образец может периодически переноситься в новые скважины. В скважинах с плазменной связью это не будет проблемой. - После визуализации как можно больше плавайте образец с помощью жидкости для визуализации в скважине. Используйте совок или тонкие щипцы для переноса образца в его хранилище. Выполните перенос над плитой скважины в случае падения образца.
- Каждый колодец PDMS и верхний стеклянный покров можно использовать повторно до тех пор, пока они не сломаются. Очистите нижнее стекло перед визуализацией, как внутри, так и снаружи скважины. Перед повторным использованием всегда проверяйте наличие протечек и ремонтируйте клеем, по мере необходимости.
- Храните образцы, как описано в шаге 6.3.6, и добавляйте PBS каждые несколько месяцев для обслуживания; если образцы очищены, храните в стекле с использованием метилсалицилата и регулярно проверяйте уровни. Очищенные образцы могут быстро разлагаться (в течение нескольких дней) и должны быть получены как можно скорее.
Результаты
Здесь представлен протокол генерации in vitro васкуляризированных эквивалентов кожи человека (VHSE) с использованием теломеразы обратной транскриптазы (TERT), увековеченных кератиноцитов (N/TERT-120,59),кожных фибробластов взрослого человека (hDF) и микрососудистых эндотелиальных клеток человека (HMEC-1)(рисунок 1). Кроме того, настраиваемый характер этого протокола подчеркивается демонстрацией генерации и стабильности VHSE при использовании общедоступных фибробластов легких (IMR90) вместо hDF. Генерация VHSE завершается на шагах 1-4, в то время как шаги 5-7 являются дополнительными методами обработки конечных точек и визуализации, которые были оптимизированы для этих VHSE. Важно отметить, что VHSEs могут быть обработаны в соответствии с конкретными исследовательскими вопросами, и шаги 5-7 не требуются для создания конструкции. Объемная визуализация, анализ и 3D-рендеринг были завершены для демонстрации метода объемного анализа. Эти протоколы подготовки и визуализации объемных конструкций сохраняют структуру VHSE как на микроскопическом, так и на макроскопическом уровнях, что позволяет проводить комплексный 3D-анализ.
Характеристики эпидермиса и дермы показывают соответствующие иммунофлуоресцентные маркеры для кожи человека в конструкциях VHSE(рисунок 2,3). Цитокератин 10 (CK10) является маркером кератиноцитов ранней дифференцировки, который обычно отмечает все надбазальные слои в кожных эквивалентах18,30,68 (Рисунок 2). Инволюкрин и филаггрин являются маркерами поздней дифференцировки в кератиноцитах и отмечают самые верхние надбазальные слои в кожных эквивалентах12,30,68,69 (рисунок 2). Для маркировки ядер как в эпидермисе, так и в дерме использовался дально красный флуоресцентный ядерный краситель (см. список материалов), причем Col IV маркировал сосудистую часть дермы(рисунок 2, рисунок 3, рисунок 4). Компоненты эпидермальной базальной мембраны (БМ) не всегда правильно экспрессируются в культурах НИУ ВШЭ15,16; и окрашивание БМ в кол IV не наблюдается последовательно с использованием этого протокола. Компоненты и структура БМ, ориентированные на исследования, выиграют от дополнительной оптимизации среды, клеток и изображений14.
Хотя конфокальная визуализация через большую часть культур VHSE часто дает изображения с высоким разрешением, достаточные для вычислительного анализа дермы и эпидермиса, описанный метод очистки позволяет более глубокую визуализацию тканей. Очистка улучшает глубину проникновения конфокального лазера, а эффективная визуализация в VHSEs может быть достигнута до более чем 1 мм для очищенных образцов (по сравнению с ~ 250 мкм для неочищеных). Описанная методика очистки (обезвоживание метанола и метилсалицилат) в достаточной степени соответствует индексу преломления по всей ткани образца УВШЭ61. Очистка VHSE позволила получить простую визуализацию всей конструкции без манипуляций (например, переориентировать конструкцию для изображения дермы и эпидермиса отдельно)(рисунок 3).
Объемные изображения позволяют генерацию 3D-рендеринга для отображения сосудистой области по всей конструкции(рисунок 4). Вкратце, конфокальные наборы изображений были взяты в кожной и эпидермальной ориентации нескольких подтомов VHSEs для обнаружения пятна коллагена IV (маркировка стенок сосудов) и ядер (отмеченных дально красным флуоресцентным ядерным красителем). Стеки изображений загружаются в вычислительное программное обеспечение (см. список материалов) и пользовательский алгоритм (основанный на этих источниках 48,70,71, 72,73,74,75)используется для 3D-рендеринга и количественной оценки, как описаноранее 48. Этот алгоритм автоматически сегментирует сосудистый компонент на основе пятна Col IV. Объемная сегментация передается алгоритму скелетонизации, основанному на быстром марше75,76,77. Скелетонизация находит окончательный центр каждого сосуда, отмеченного Col IV, и полученные данные могут быть использованы для расчета диаметра сосуда, а также сосудистой фракции(рисунок 4). Широкоугольная флуоресцентная микроскопия является доступным вариантом, если лазерная сканирующая микроскопия недоступна; сосудистая сеть и эпидермис могут быть изображены с помощью широкоугольной флуоресцентной микроскопии(Дополнительный рисунок 2). Трехмерная количественная оценка возможна с использованием широкоугольной визуализации VHSEs, а не лазерной сканирующей микроскопии, хотя она может потребовать большей фильтрации и деконволюции изображений из-за внеплощадного света.
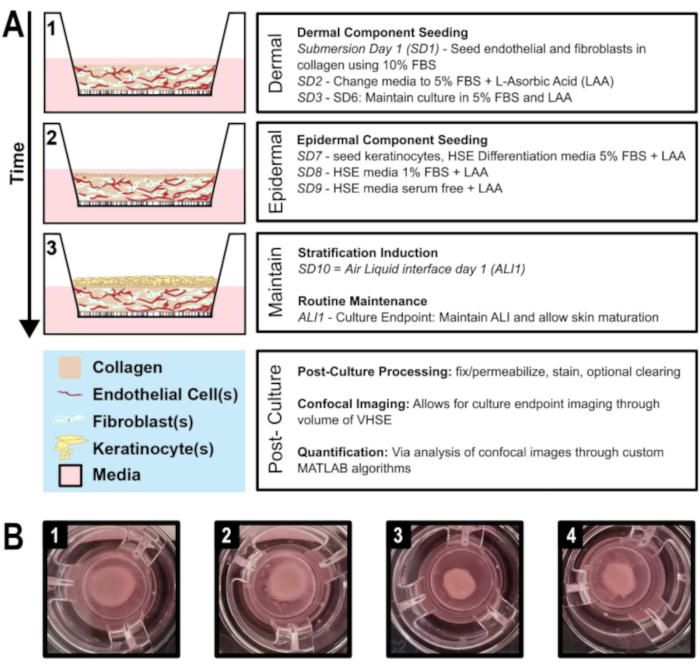
Рисунок 1:Схематическая временная шкала генерации эквивалента васкуляризированной кожи человека. A) Показывает прогрессирование модели VHSE от 1) посева дермального компонента, 2) посева кератиноцитов к дермальному компоненту, 3) эпителиальной стратификации через интерфейс воздушной жидкости и поддержание культуры. Посткультурная обработка и объемная визуализация могут выполняться в конечной точке культуры. B) Изображения с камеры макроструктуры hDF VHSE во вставках языка и культуры в их конечной точке языка и ведения, 8 недель. Различные уровни сокращения являются нормальными для VHSEs; сокращение может быть уменьшено, как описано в протоколе. (1 & 2) Менее контрактные образцы. (3 & 4) Более сжатые образцы по-прежнему дают правильные элементы кожи. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
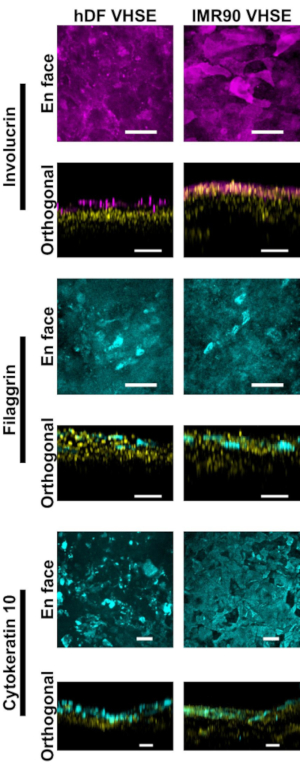
Рисунок 2:Эпидермальная характеристика с помощью иммунофлуоресцентных маркеров. Все изображения были сделаны VHSEs в точке времени культуры 8wk с помощью конфокальной микроскопии. Соответствующие методы окрашивания описаны в протоколе на шаге 6. Правильные эпителиальные маркеры присутствуют как в hDF VHSEs (левый столбец), так и в IMR90 VHSEs (правый столбец). Инволюкрин и Филаггрин являются маркерами поздней дифференцировки кератиноцитов и демонстрируют, что эпидермис полностью стратифицирован в обоих типах VHSE. Цитокератин 10 является ранним маркером дифференцировки, который идентифицирует надбазальные слои в VHSEs. Ядра показаны в ортогональных видах жёлтым цветом. Изображения лица и ортогональной максимальной проекции визуализируются с помощью вычислительного программного обеспечения; Изображения индивидуально масштабируются с вычитанием фона и медианной фильтрацией для четкости. Шкала слитков 100 мкм. (Первичные и вторичные антитела с штатным блокирующим буфером приведены в таблице 3). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
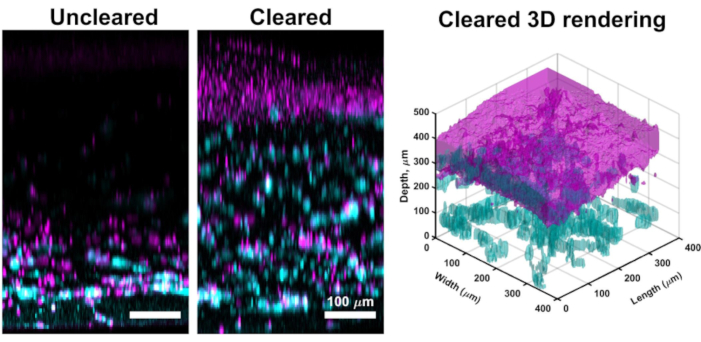
Рисунок 3:Сравнение неочищенным и очищенным VHSE. Этот VHSE был сгенерирован с помощью IMR90s, и изображения были сделаны в точке времени культуры 4wk с помощью конфокальной микроскопии. Коллаген IV показан в циановом; Ядра показаны пурпурным; пурпурный в очищенном 3D-рендеринге представляет собой консолидацию ядер в эпидермальном слое VHSE. Неочищенный VHSE-образ является примером лазерного затухания в более толстых конструкциях VHSE, благодаря очистке (метанол и метилсалицилат) вся конструкция может быть визуалирована с небольшим / без лазерного затухания с кожной стороны конструкции. Настройки изображения, включая лазерную линию, усиление и точечное отверстие, были снижены для очищенного VHSE, чтобы уменьшить перенасыщение. Очистка и визуализация были завершены, как описано в шагах 6 и 7 в протоколе. Ортогональные максимальные проекционные изображения и 3D-рендеринг были дополнены вычислительным программным обеспечением, 3D-рендеринг был сгенерирован из очищенных конструктных изображений. Изображения индивидуально масштабируются с вычитанием фона и медианной фильтрацией для четкости. Шкала 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
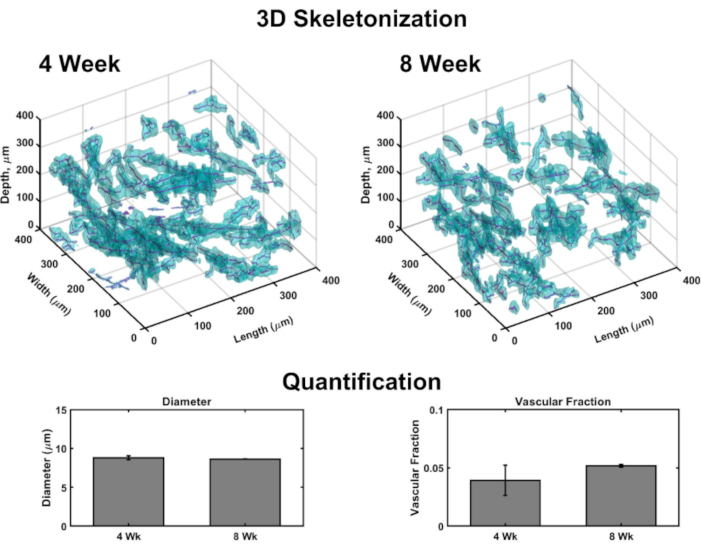
Рисунок 4:Трехмерный анализ сосудистой азкулятуры в VHSEs. Объемные изображения, сделанные с помощью конфокальной микроскопии, позволяют количественно определять параметры сосудов в конечных точках культуры с помощью вычислительного анализа изображений. Из подобъемов VHSE обнаружение коллагенового IV пятна (циана) метит эндотелиальные стенки сосудистой системы и позволяет сегментировать сосуды на основе расположения коллагена IV; Затем данные сегментации скелетонизируются, и центр каждого судна находится (пурпурный). Примеры 3D-скелетонизации показаны для 4-недельных и 8-недельных образцов IMR90 VHSE, не очищенных. Полученные данные экспериментального набора IMR90 VHSE были использованы для расчета диаметров сосудов и сосудистых фракций для четырех подобъемов (каждый 250 мкм в z-направлении) в каждой конструкции, данные были усреднены по VHSE и далее усреднены по точке времени культуры. Эти данные показывают, что гомеостаз сосудистой сети охватывает 4 и 8 недель культуры с диаметрами, относящимися к коже человека in vivo78,и сосудистой фракцией в том же порядке, что и in vivo человеческая кожа79 (было показано, что сосудистая фракция в коллагеновых конструкциях настраиваема48 и может быть дополнительно оптимизирована для увеличения значений). Данные представляются в виде средств ± стандартного значения погрешности (S.E.M); n = 3 для каждой точки времени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| медиа | Компоненты |
| Клеточная линия дермального фибробластов человека (hDF) | ДМЕМ ХГ |
| 5% фетальная бытовая сыворотка (FBS) | |
| 1% Пенициллин/Стрептомицин (P/S) | |
| IMR90 Клеточная линия фибробластов | ДМЕМ/ХЭМ F12 50:50 |
| 10% ФБС | |
| 1% P/S | |
| HMEC-1 Эндотелиальная клеточная линия | MCDB131 Базовая среда |
| 10% ФБС | |
| 1% P/S | |
| L-глютамин [10 мМ] | |
| Эпидермальный фактор роста (EGF) [10 нг/мл] | |
| Гидрокортизон [10 мкг/мл] | |
| N/TERT-1 Клеточная линия кератиноцитов | Медиабаза K-SFM |
| 1% P/S | |
| Экстракт гипофиза крупного рогатого лова (BPE) [25 мкг/мл], из набора добавок K-SFM | |
| Эпидермальный фактор роста (EGF) [0,2 нг/мл], из набора добавок K-SFM | |
| CaCl2 [0,3 мМ] | |
| Дифференциация эквивалента кожи человека (HSE) | 3:1 DMEM: Хэм F12 |
| 1% P/S | |
| 0,5 мкМ Гидрокортизон | |
| 0,5 мкМ изопротеренола | |
| 0,5 мкг/мл инсулина |
Таблица 1: Медиа-рецепты. Приведены рецепты среды для 2D-культуры кожных фибробластов человека, фибробластов IMR90, кератиноцитов HMEC-1 и N/TERT-1. Эти рецепты использовались для расширения клеточных линий перед генерацией VHSEs. Для генерации VHSE используются среды дифференциации эквивалента кожи человека (HSE); приведен базовый рецепт, во время порций погружной культуры и индукции стратификации следует добавлять сужающиеся количества FBS, как описано в этапе 3 протокола. Рецепт НИУ ВШЭ основан на этих источниках11,80.
| Концентрациязапаса коллагена(C s): | 8 | мг/мл | ||
| Желаемый объем (Vf): | 1 | мл | ||
| Нормализация регулировки NaOH*: | 1 | икс | ||
| * Каждая партия коллагена должна быть проверена, чтобы определить количество NaOH, необходимое для установки pH 7 - 7,4 | ||||
| Желаемая концентрация коллагена (мг/мл) | ||||
| 2 | 3 | 4 | 5 | |
| 10X PBS (Vpbs) | 0.1 | 0.1 | 0.1 | 0.1 |
| Коллагеновый запас (Vs) | 0.25 | 0.375 | 0.5 | 0.625 |
| 1N NaOH (VNaOH) | 0.00575 | 0.008625 | 0.0115 | 0.014375 |
| Медиа (Vносители) | 0.64425 | 0.516375 | 0.3885 | 0.260625 |
Таблица 2:Справочная таблица расчета коллагена. Справочная таблица дает обычно желаемые концентрации коллагена, рассчитанные исходя из концентрации коллагена 8 мг/мл и желаемого конечного объема 1 мл; все значения в мл. Уравнения, используемые для расчета этих сумм, приведены в шаге протокола 2.2. Важно проверить pH для каждого запаса коллагена; при необходимости следует добавить количество NaOH для достижения pH 7 - 7,4 (после добавления PBS, NaOH, коллагенового запаса, среды). Протокол был оптимизирован для VHSEs с использованием концентрации коллагена 3 мг/мл; изменения концентрации коллагена могут быть необходимы для различных клеточных линий/желаемых конечных результатов48.
| Первичное антитело | источник | концентрация | использование |
| Филаггрин (AKH1) мыши моноклональный IgG | Санта-Крус; sc-66192 (200 мкг/мл) | [1:250] | Маркер поздней дифференциации15 |
| Инволюкрин кролик поликлональный IgG | Протеинтех; 55328-1-AP (30 мкг/150 мкл) | [1:250] | Маркер поздней терминальной дифференциации15 |
| Цитокератин 10 (DE-K10) мышиный IgG, супернатант | Санта-Крус; sc-52318 | [1:350] | Надбазиальный эпидермальный маркер14,36,59 |
| Коллаген IV кролик поликлональный | Протеинтех; 55131-1-АП | [1:500] | Эндотелиальная сосудистая стенка67 |
| ДРАК 7 | Передача сигналов сотовой связи; 7406 (0,3 мМ) | [1:250] | Ядерный маркер |
| Вторичное антитело | источник | концентрация | использование |
| Коза против кроликов IgG DyLight™ 488 Конъюгированный | Инвитроген; 35552 (1 мг/мл) | [1:500] | Коллаген IV вторичный |
| Антитело против кролика IgG (H & L) (GOAT), DyLight™ 549 Конъюгированный | Иммунохимические вещества Рокленда; 611-142-002 | [1:500] | Инволюкрин вторичный |
| Коза против мыши IgG (H&L), DyLight™ 488 | Термо Научный; 35502 (1 мг/мл) | [1:500] | Филаггрин или Цитокератин 10 вторичный |
| БЛОКИРУЮЩИЙ БУФЕР (500 мл) | |||
| реагент | количество | ||
| ддН2О | 450 мл | ||
| 10 x PBS | 50 мл | ||
| Быцкий сывороточный альбумин (BSA) | 5 г | ||
| Анимация 20 | 0,5 мл | ||
| Холодноводный рыбный желатин | 1 г | ||
| Азид натрия (10% азид натрия в diH2O) | 5 мл (конечная концентрация 0,1 % ) | ||
Таблица 3: Первичные и вторичные антитела с блокирующим буфером рецепта. Перечисленные антитела и химические пятна использовались для окрашивания, показанного на рисунке 2, рисунке 3, рисунке 4. Окрашивание было завершено, как указано в шаге протокола 6, с использованием рецепта блокирующего буфера, указанного здесь. Может потребоваться некоторая оптимизация концентраций окрашивания и продолжительности в зависимости от выбранных методов культивирования и клеточных линий.
Дополнительная таблица 1: Перечень сокращений. Список сокращений включен для удобства читателя. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительный рисунок 1:Техническая помощь VHSE для обработки. Обращение с VHSEs является сложной задачей, особенно во время фиксации, обработки и окрашивания. A-D соответствует инструкциям на шагах 5-7. A показывает техническое обращение с удалением пористой мембраны из культурального вкладыша для обеспечения надлежащего окрашивания. B показывает, как держать каждый VHSE под водой во время окрашивания и хранения. C показывает самый безопасный и простой способ перемещения конструкций в скважины PDMS. D показывает VHSE, сидящий в колодце PDMS-визуализации: PDMS хорошо приклеивается к стеклянному слайду внизу, создавая окно для визуализации, стеклянный слайд помещается сверху для поддержания влажности посредством длительных запусков изображения. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2:Стандартная широкоугольная флуоресцентная микроскопия может использоваться для оценки VHSEs. Широкоугольная визуализация может использоваться для объемной визуализации для рутинной оценки, когда лазерная сканирующая микроскопия недоступна. В качестве примера, визуализация VHSEs как из апикального, так и из базолатерального аспектов показана в виде грани и ортогональных (Ortho.) максимальных проекций. (Наверх) Эпидермис был изображен с использованием инволукрина и ядер в качестве маркеров. (Внизу) Кожная сосудистая асьм была изображена с использованием коллагена IV в качестве маркера. Изображения вычитаются из фона для ясности. Внеплосконный свет приводит к «полосатым» или «вспыхивающим» артефактам, очевидным в ортогональных видах. Широкоугольная визуализация может использоваться для количественной оценки, но может потребовать большей обработки изображений. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Этот протокол продемонстрировал простой и воспроизводимый метод генерации VHSEs и их трехмерного анализа. Важно отметить, что этот метод опирается на несколько специализированных методов или единиц оборудования, что делает его доступным для целого ряда лабораторий. Кроме того, типы клеток могут быть заменены ограниченными изменениями в протоколе, что позволяет исследователям адаптировать этот протокол к своим конкретным потребностям.
Правильное гелеобразование коллагена является сложным шагом в создании культуры кожи. Особенно при использовании сырых препаратов без очистки, следовые загрязняющие вещества могут влиять на процесс гелеобразования. Чтобы обеспечить согласованность, группы экспериментов должны проводиться с тем же запасом коллагена, который будет использоваться для генерации VHSE. Кроме того, гелеобразование в идеале должно происходить при рН 7-7,4, и следовые загрязняющие вещества могут смещать рН. Перед использованием любого коллагенового запаса следует сделать практический бесклеточный гель в желаемой концентрации, а рН следует измерить перед гелеобразованием. Завершение этой проверки качества коллагена перед началом посева кожных компонентов выявит проблемы с правильным гелеобразованием и однородностью коллагена до начала полного эксперимента. Вместо того, чтобы сеять клейкий коллаген непосредственно на культурную вставку, посейте немного коллагена на полоску pH, которая оценивает всю шкалу pH и проверяет рН 7-7,4. Гелеобразование можно оценить, нанеся каплю раствора коллагенового геля на крышку или пластиковую пластину для культуры ткани (для имитации ограниченных сторон культурального вкладыша рекомендуется использовать пластину для колодца). По истечении времени гелеобразования коллаген должен быть твердым, т.е. он не должен течь при наклоне пластины. При фазово-контрастной микроскопии коллаген должен выглядеть однородным и прозрачным. Случайные пузырьки от посева коллагена являются нормальными, но большие аморфные капли непрозрачного коллагена в прозрачном геле указывают на проблему, вероятно, из-за недостаточного смешивания, неправильного рН и / или неспособности сохранить коллаген охлажденным во время смешивания.
Количество посева клеток и среда могут быть скорректированы. В приведенном выше протоколе инкапсулированные количества клеток были оптимизированы для 12-скважинной вставки при 7,5 х 104 фибробластах и 7,5 х 105 эндотелиальных клетках на мл коллагена с 1,7 х 105 кератиноцитами, посеянными поверх дермальной конструкции. Плотность клеток была оптимизирована для этого протокола VHSE на основе предварительных исследований и предыдущих исследований, изучающих генерацию 3D-сосудистой сети в различных концентрациях коллагена48 и HSE поколения22,80,81. В аналогичных системах опубликованная плотность эндотелиальных клеток составляют 1,0 х 106 клеток/мл коллагена48; концентрации фибробластов часто колеблются от 0,4х 10 5 клеток/мл коллагена22,28,82 до 1х 10 5 клеток/мл коллагена8,58,83,84,85; и концентрации кератиноцитов колеются от 0,5 х10 5 [клетки/см2]80 до 1 х 105 [клетки/см2]8. Плотность клеток может быть оптимизирована для конкретных клеток и исследовательского вопроса. Трехмерные культуры со сократительными клетками, такие как фибробласты, могут сокращаться, что приводит к снижению жизнеспособности и потере культуры86,87. Предварительные эксперименты должны быть завершены для проверки сокращения дермального компартмента (которое может происходить с большим количеством кожных клеток, более сократительных кожных клеток, более длинными культурами погружения или более мягкими матрицами) и для проверки покрытия эпидермальной поверхности. Кроме того, количество дней в погружении и скорость сужения содержания сыворотки также могут быть настроены, если происходит чрезмерное сокращение кожной зоны или требуется другая скорость покрытия кератиноцитов. Например, если сокращение замечено в период кожного погружения или когда кератиноциты устанавливают поверхностный монослой, более быстрое прохождение процесса сужения сыворотки и повышение VHSEs до ALI может помочь предотвратить дополнительное сокращение. Аналогичным образом, если покрытие кератиноцитов не является идеальным, изменение количества дней, в течение которого VHSE погружается без сыворотки, может помочь увеличить покрытие эпидермального монослоя и смягчить сокращение, поскольку сыворотка опущена. Изменения плотности клеток или другие предложения, приведенные выше, должны быть оптимизированы для конкретных культур и целей исследования.
Чтобы установить надлежащую стратификацию эпидермиса в течение периода раздела воздушной жидкости (ALI), крайне важно регулярно проверять и поддерживать уровень жидкости в каждой скважине, чтобы ALI и соответствующая гидратация каждой конструкции сохранялись на протяжении всей длины культуры. Уровни носителей должны проверяться и отслеживаться ежедневно до тех пор, пока не будут установлены последовательные уровни ALI. Эпидермальный слой должен выглядеть гидратированным, а не сухим, но на конструкции не должно быть бассейнов сред. Во время ALI конструкция будет развивать непрозрачный белый / желтый цвет, который является нормальным. Эпидермальный слой, скорее всего, будет развиваться неравномерно. Как правило, VHSEs наклоняются из-за посева коллагена или сокращения кожной смолы. Также нормально наблюдать более высокую эпидермальную часть в середине конструкции в меньших конструкциях (размер скважины 24) и формирование хребта по периметру VHSE в размере 12 скважин. Сжатие конструкций13 может изменить эти топографические образования и/или может вообще не наблюдаться.
Окрашивание и визуализация VHSEs вводит механические манипуляции с VHSEs. Очень важно планировать и ограничивать манипулирование каждой культурой. При необходимости манипуляций поддерживайте мягкие движения при удалении VHSEs со вставных мембран, при добавлении окрашивающих или моющих растворов на поверхность конструкции, а также при удалении и замене VHSEs в их хранилищах / визуализационных колодцах во время подготовки визуализации. В частности, апикальные слои эпидермального компонента могут быть хрупкими и подвергаться риску отслаивания базальных эпидермальных слоев. Апикальные слои эпидермиса хрупкие и проходят десквамацию даже в нативнойткани 4,но для точного анализа структуры эпидермиса важно минимизировать повреждение или потерю. Если эпидермальные слои отрываются от конструкции, их можно визуалзировано отдельно. Базальные слои эпидермиса, скорее всего, все еще прикреплены к дерме, в то время как части апикальных слоев могут отсоединяться. Для визуализации эпидермиса при наблюдении за этим полезно ядерное пятно, так как плотные ядра характерны для нижних и средних слоев эпидермиса.
Конфокальная визуализация постфиксации VHSE обсуждалась в протоколе, но также возможно изображение VHSE по всей культуре с помощью вертикальной оптической когерентной томографии (OCT)88,89,90,91,92,93. VHSE достаточно стабильны, чтобы выдерживать визуализацию без инкубации или увлажнения в течение как минимум двух часов без заметных эффектов. Поскольку OCT не содержит меток и неинвазивн, можно отслеживать толщину эпидермиса во время созревания. Вероятно, можно использовать и другие неинвазивные методы визуализации.
Объемная визуализация комбинированных кожных и эпидермальных структур может быть сложной задачей из-за лазерного затухания глубже в VHSE. Это можно смягчить, визуализируя конструкцию в двух ориентациях, с эпидермальной стороны(рисунок 1)и с кожной стороны(рисунок 2),что позволяет обеспечить хорошее разрешение кожных сосудистых структур и эпидермиса. Кроме того, образец может быть очищен, что позволяет получать объемные изображения всей структуры с минимальным затуханием. Было предпринято несколько попыток очистки, однако описанный метод метанола/метилсалицилата дал наилучшие результаты. Исследователи, заинтересованные в оптимизации других методов клиринга, направлены на эти обзоры49,61,62. При очистке рекомендуется полностью изобразить образец до очистки, так как метод может повредить флуорофоры и/или структуру. Кроме того, визуализация должна быть завершена как можно скорее после очистки, так как флуоресценция может исчезнуть в течение нескольких дней.
Для простоты и доступности этот протокол использовал простейший медиа-смеси, найденный в предыдущей литературе11,80. Хотя использование простых медиа-смесей имеет много преимуществ, ограничения этого выбора также признаются. Другие группы изучили влияние специфических компонентов среды на здоровье эпидермиса и кожи и обнаружили, что другие медиа-добавки94,такие как внешние свободные жирные кислоты / липиды, усиливают роговой слой эпидермиса и улучшают барьерную функцию кожи. Хотя наши иммунофлуоресцентные маркеры показывают соответствующую дифференциацию и стратификацию в эпидермисе, в зависимости от проводимых исследований может потребоваться дополнительная оптимизация среды. Кроме того, обширный анализ эпидермального БМ не проводился при оценке VHSEs, представленных здесь. Целостность БМ является важным показателем кожных эквивалентов; различные группы провели исследования продолжительности культуры и ее влияния на маркировку BM95, а также анализ присутствия фибробластов и влияния фактора роста на экспрессиюBM 14. Важно отметить, что анализ компонента БМ должен быть оценен и оптимизирован при использовании этого протокола.
В этом протоколе описана процедура генерации VHSE, демонстрирующая результаты через 8 недель при АЛИ. Культуры VHSE культивировались до 12 недель в ALI без заметных изменений или потери жизнеспособности, и вполне возможно, что они могут быть жизнеспособными дольше. Важно отметить, что этот протокол легко адаптируется к общедоступным типам клеток, о чем свидетельствует замена дермальных фибробластов фибробластами легких IMR90. В зависимости от потребностей исследователя и доступных ресурсов, типы клеток и смеси сред на культуре могут быть скорректированы, хотя более разнородные типы клеток могут потребовать оптимизации среды. Таким образом, эти процедуры призваны обеспечить ясность в культуре VHSEs для изучения биологии кожи и заболеваний. Чтобы максимизировать доступность, протокол был разработан таким простым и надежным с использованием общего оборудования, клеточных линий и реагентов в качестве минимально эффективного подхода, который может быть дополнительно адаптирован к конкретным потребностям исследований.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы благодарят д-ра Джима Райнвальда59 лет и доктора Эллен Х. ван ден Богаард20 за их щедрый подарок клеточных линий N/TERT. Эта работа была поддержана Американской кардиологической ассоциацией (19IPLOI34760636).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 N NaOH | Fisher Chemical | S318-100 | (Dilute from Lab stock) |
| 4% Paraformaldehyde | ACROS Organics | #41678-5000, Lot # B0143461 | Made up using solid Paraformaldehyde in PBS, pH adjusted to 6.9 |
| Autoclaved forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| CaCl2 | Fisher bioreagents | Cat # BP510-250, Lot # 190231 | Rnase, Dnase, Protease-Free |
| Cell line, Endothelial: Microvascular Endothelial Cell (HMEC1) | ATCC | CRL-3243 | SV40 Immortalized microvascular endothelial cell. Note that 750,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: dermal Human fibroblast, adult | ATCC | PCS-201-012 | Primary dermal cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: human lung firbroblast (IMR90) | ATCC | CCL-186 | Primary embryonic cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Keratinocyte: N/TERT-1 | Immortalized via hTERT expression. N/TERT-1 was made using a retroviral vector conferring hygromycin resistance. Cell line established by Dickson et al. 2000. Can be replaced with ATCC PCS-200-010 or PCS-200-011. Note that 170,000 cells were used per construct; N/TERT1 cells must be used from plates that are 30% confluent- two 30% confluent 90 mm tissue culture dishes give more than enough cells.The authors thank Dr. Jim Rheinwald and Dr. Ellen H. van den Bogaard for their generous gift of N/TERT cell lines. | ||
| Centrifuge | Thermo Scientific; Sorvall Legend X1R | (standard lab equipment) | |
| Computational Software | MATLAB | MATLAB 2020a | MathWorks, Natick, MA. |
| Confocal Microscope | Leica TCS SPEII confocal | Laser scanning confocal. Can be replaced with other confocals or deconvolution microscopy. | |
| Cover Glass (22 x 22) | Fisher Scientific | 12-545F | 0.13-0.17 mm No.1 Thickness |
| Cyanoacrylate super glue or silicone grease | Glue Masters | #THI0102 | Glue Masters, THICK, Instant Glue, Cyanoacrylate; super glue is preferred |
| DMEM media base | Corning; Mediatech, Inc | REF # 10-013-CM; Lot # 26119007 | DMEM, 1X (Dulbecco's Modification of Eagle's Medium) with 4.5 g/L glucose, L-glutamine & sodium pyruvate |
| DMEM/F-12 50/50 | Corning; Mediatech, Inc | REF # 10-090-CV; Lot # 21119006 | DMEM/F-12 50/50, 1X (Dulbecco's Mod. Of Eagle's Medium/Ham's F12 50/50 Mix) with L-glutamine |
| Ethanol | Decon Labs | #V1101 | (standard lab reagent) |
| Fetal Bovine Serum | Fisher Scientific | Cat # FB12999102, Lot # AE29451050 | Research Grade Fetal Bovine Serum, Triple 0.1 um sterile filtered |
| Fine tip forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| Human Epidermal Growth Factor (EGF) | Peprotech | Cat # AF-100-15-1MG, Lot # 0318AFC05 D0218 | Made up in 0.1% BSA in PBS |
| Hydrocortisone | Alpha Easar | Lot # 5002F2A | made up in DMSO |
| Insulin (human) | Peprotech | Lot # 9352621 | |
| Inverted Light/Phase Contrast Microscope | VWR | 76317-470 | (standard lab equipment) |
| Isoproterenol | Alfa Aesar | #AAJ6178806 | DL-Isoproterenol hydrochloride, 98% |
| Keratinocyte-SFM (1x) media base | Gibco; Life Technologies Corporation | REF #: 10724-011; Lot # 2085518 | Keratinocyte-SFM (1X); serum free medium |
| L-Ascorbic Acid | Fisher Chemical | Cat # A61-100, Lot # 181977, CAS # 50-81-7 | Crystalline. L-Ascorbic acid can also be purchased as a salt |
| L-glutamine (solid) | Fisher Bioreagents | CAT # BP379-100, LOT # 172183, CAS # 56-85-9 | L-Glutamine, white crystals or Crystalline powder |
| MCDB 131 media base | Gen Depot | CM034-050, Lot # 03062021 | MCDB 131 Medium Base, No L-Glutamine, sterile filtered |
| Metal punches | Sona Enterprises (SE) | 791LP, 12PC | Hollow Leather Punch Set, High Carbon Steel, Hardness: 48HRC; (various sizes including): 1/8", 5/32", 3/16", 7/32", 1/4", 9/32", 5/16", 3/4", 7/16", 1/2", 5/8:, 3/4". This punch set is helpful, but x-acto knife can work as well. Size of metal punch that works well for 12 well transwell VHSE is 3/8" or 1/2". |
| Methanol | Fisher Chemical | CAS # 67-56-1 | (optional). For clearing dehydration step. |
| Methyl Salicylate | Fisher Chemical | O3695-500; Lot # 164535; CAS # 119-36-8 | (optional). For clearing. |
| Microtubes, 1.7 mL | Genesee Scientific Corporation; Olympus Plastics | Cat # 24-282; Lot # 19467 | 1.7 ml Microtubes, Clear; Boilproof, Polypropulene, Certified Rnase, Dnase, DNA, PCR inhibitor and endotoxin-Free |
| PBS, 10x Culture grade or autoclaved | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. |
| PBS, 1x Culture grade, (-) Calcium, (-) magnesium | Genesee Scientific Corporation | Ref # 25-508; Lot # 07171015 | |
| PBS, 1x non-Culture grade | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. Dilute to 1x with water. |
| Penicillin/Streptomycin | Gibco; Life Technologies Corporation | Ref # 15140-122, Lot # 2199839 | Pen Strep (10,000 Units/mL Penicillin; 10,000 ug/mL Streptomycin) |
| Petri Dish, glass, small | Corning | PYREX 316060 | (optional). To be used as a clearing container |
| Petri Dishes, 100 mm | Fisher Scientific | FB0875713 | Use for making up PDMS. |
| Polydimethylsiloxane (PDMS) | Dow Corning | GMID 02065622, Batch # H04719H035 | Sylgard 184 Silicone Elastomer Base, Dow Corning, Midland, MI) |
| Dow Corning | GMID 02065622, Batch # H047JC4003 | DOWSIL 184, Silicone Elastomer Curing Agent | |
| note: PDMS is usually sold as a kit that includes both the base and curing agent components. | |||
| Positive Displacement Pipettes (1000 & 250 uL) | Gilson | 1000 uL: HM05136, M1000. 250 uL: T12269L | M1000 pipette capacity (100-1000 uL); M250 pipette capacity to 250 uL |
| Positive Displacement Tips/Pistons (1000 & 250 uL) | Gilson | 1000 uL: CAT # F148180, BATCH # B01292902S; 250 uL: CAT # F148114, BATCH # B05549718S | Sterilized capillaries and pistons |
| Round tipped scoopula | (optional; standard lab equipment) For manipulation of VHSEs prior to imaging | ||
| Supplements for Keratinocyte-SFM media | Gibco; Life Technologies Corporation | Ref # 37000-015, Lot # 2154180 | Contains EGF Human Recombinant (Cat # 10450-013), Bovine Pituitary Extract (Cat # 13028-014) |
| Tissue Culture Plate Inserts, 12 well size, 3 µm pore size | Corning; Costar | REF # 3462 - Clear; Lot # 14919057 | Transwell; 12 mm Diameter Inserts, 3.0 um pore size, tissue culture treated, polyester membrane, polystyrene plates, |
| Tissue Culture Plates, 12 well size | Greiner Bio-one; CellStar | Cat # 665 180; Lot # E18103QT | 12 well cell culture plate; sterile, with lid; products are sterile, free of detectable Dnase, Rnase, human DNA and pyrogens. Contents non-cytotoxic |
| Tissue Culture Plates, 60.8cm^2 growth area | Genesee Scientific Corporation | Cat # 25-202; Lot No: 191218-177B | Tissue culture dishes; treated, growth area 60.8 cm^2; sterile, Dnase, Rnase, Pyrogen Free; virgin polystyrene |
| Triton x 100 | Ricca Chemical Company | Cat # 8698.5-16, Lot # 4708R34 | Wetting agent |
| Trypsin 0.25% | Corning; Mediatech, Inc | Ref # 25-053-CI | 0.25% Trypsin, 2.21 mM EDTA, 1x [-] sodium bicarbonate |
| Type 1 Collagen isolated from Rat tail | Pel-Freez Biologicals | 56054-1 | Sprauge-Dawley rat tails can be purchased frozen from Pel-Freez or other suppliers. Collagen can be isolated from the tail tendons. Isolation Protocol references [Cross et al.,2010; Rajan et al.,2007; Bornstein, 1958] .Alternatively, high concentration rat-tail collagen can be purchased from suppliers including Corning (Catalog Number: 354249) |
| Vaccum chamber, benchtop | Bel-Art | F42010-0000 | (standard lab equipment) |
| Handheld Precision knife | X-Acto | X3311 | (X-Acto knife optional if purchased steel punches) |
Ссылки
- Stojic, M., et al. Skin tissue engineering 3. Biomaterials for Skin Repair and Regeneration. , 59 (2019).
- Shevchenko, R. V., James, S. L., James, S. E. A review of tissue-engineered skin bioconstructs available for skin reconstruction. Journal of The Royal Society Interface. 7 (43), 229-258 (2010).
- Kolarsick, P. A. J., Kolarsick, M. A., Goodwin, C. Anatomy and Physiology of the Skin. Journal of the Dermatology Nurses' Association. 3 (4), (2011).
- McGrath, J. A., Eady, R. A. J., Pope, F. M. Anatomy and organization of human skin. Rook's textbook of dermatology. 10, 9781444317633 (2004).
- Zomer, H. D., Trentin, A. G. Skin wound healing in humans and mice: Challenges in translational research. Journal of Dermatological Science. 90 (1), 3-12 (2018).
- Zhang, Z., Michniak-Kohn, B. B. Tissue Engineered Human Skin Equivalents. Pharmaceutics. 4 (1), (2012).
- Oh, J. W., Hsi, T. -. C., Guerrero-Juarez, C. F., Ramos, R., Plikus, M. V. Organotypic skin culture. The Journal of investigative dermatology. 133 (11), 1-4 (2013).
- El-Ghalbzouri, A., Gibbs, S., Lamme, E., Van Blitterswijk, C. A., Ponec, M. Effect of fibroblasts on epidermal regeneration. British Journal of Dermatology. 147 (2), 230-243 (2002).
- Sun, T., Haycock, J., MacNeil, S. In situ image analysis of interactions between normal human keratinocytes and fibroblasts cultured in three-dimensional fibrin gels. Biomaterials. 27 (18), 3459-3465 (2006).
- Kreimendahl, F., et al. Macrophages significantly enhance wound healing in a vascularized skin model. Journal of Biomedical Materials Research Part A. 107, 1340-1350 (2019).
- El Ghalbzouri, A., Commandeur, S., Rietveld, M. H., Mulder, A. A., Willemze, R. Replacement of animal-derived collagen matrix by human fibroblast-derived dermal matrix for human skin equivalent products. Biomaterials. 30 (1), 71-78 (2009).
- Roger, M., et al. Bioengineering the microanatomy of human skin. Journal of Anatomy. 234, 438-455 (2019).
- Carlson, M. W., Alt-Holland, A., Egles, C., Garlick, J. A. Three-Dimensional Tissue Models of Normal and Diseased Skin. Current Protocols in Cell Biology. 41 (1), 1-17 (2008).
- El Ghalbzouri, A., Jonkman, M. F., Dijkman, R., Ponec, M. Basement Membrane Reconstruction in Human Skin Equivalents Is Regulated by Fibroblasts and/or Exogenously Activated Keratinocytes. Journal of Investigative Dermatology. 124 (1), 79-86 (2005).
- Pruniéras, M., Régnier, M., Woodley, D. Methods for cultivation of keratinocytes with an air-liquid interface. The Journal of Investigative Dermatology. 81, 28-33 (1983).
- Ali, N., Hosseini, M., Vainio, S., Taieb, A., Cario-André, M., Rezvani, H. R. Skin equivalents: skin from reconstructions as models to study skin development and diseases. British Journal of Dermatology. 173 (2), 391-403 (2015).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Innovative tissue models for drug discovery and development. 69-70, 81-102 (2014).
- Mieremet, A., Rietveld, M., Absalah, S., van Smeden, J., Bouwstra, J. A., El Ghalbzouri, A. Improved epidermal barrier formation in human skin models by chitosan modulated dermal matrices. PLOS ONE. 12 (3), 0174478 (2017).
- Vidal, S. E. L., Tamamoto, K. A., Nguyen, H., Abbott, R. D., Cairns, D. M., Kaplan, D. L. 3D biomaterial matrix to support long term, full thickness, immuno-competent human skin equivalents with nervous system components. Organoids and Ex Vivo Tissue On-Chip Technologies. 198, 194-203 (2019).
- Smits, J. P. H., et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models. Scientific Reports. 7 (1), 11838 (2017).
- Lebonvallet, N., et al. Effects of the re-innervation of organotypic skin explants on the epidermis. Experimental Dermatology. 21 (2), 156-158 (2011).
- Van Drongelen, V., et al. Barrier Properties of an N/TERT-Based Human Skin Equivalent. Tissue Engineering Part A. 20 (21-22), 3041-3049 (2014).
- . Establishment and initial characterization of a simple 3D organotypic wound healing model Available from: https://opus.hs-furtwangen.de/frontdoor/index/index/docld/4852 (2018)
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18 (5), 240-249 (2013).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Amelian, A., Wasilewska, K., Megias, D., Winnicka, K. Application of standard cell cultures and 3D in vitro tissue models as an effective tool in drug design and development. Pharmacological Reports. 69 (5), 861-870 (2017).
- Lu, W., et al. Mixture of Fibroblasts and Adipose Tissue-Derived Stem Cells Can Improve Epidermal Morphogenesis of Tissue-Engineered Skin. Cells Tissues Organs. 195 (3), 197-206 (2012).
- Marino, D., Luginbühl, J., Scola, S., Meuli, M., Reichmann, E. Bioengineering Dermo-Epidermal Skin Grafts with Blood and Lymphatic Capillaries. Science Translational Medicine. 6 (221), 221 (2014).
- Martins-Green, M., Li, Q. -. J., Yao, M. A new generation organ culture arising from cross-talk between multiple primary human cell types. The FASEB Journal. 19 (2), 222-224 (2004).
- Kim, B. S., Gao, G., Kim, J. Y., Cho, D. -. W. 3D Cell Printing of Perfusable Vascularized Human Skin Equivalent Composed of Epidermis, Dermis, and Hypodermis for Better Structural Recapitulation of Native Skin. Advanced Healthcare Materials. 8 (7), 1801019 (2019).
- Baltazar, T., et al. 3D bioprinting of a vascularized and perfusable skin graft using human keratinocytes. Tissue Engineering Part A. 26 (5-6), 227-238 (2019).
- Klar, A. S., et al. Tissue-engineered dermo-epidermal skin grafts prevascularized with adipose-derived cells. Biomaterials. 35 (19), 5065-5078 (2014).
- Grebenyuk, S., Ranga, A. Engineering Organoid Vascularization. Frontiers in Bioengineering and Biotechnology. 7, (2019).
- Black, A. F., Berthod, F., L'heureux, N., Germain, L., Auger, F. A. In vitro reconstruction of a human capillary-like network in a tissue-engineered skin equivalent. The FASEB Journal. 12 (13), 1331-1340 (1998).
- Huber, B., Link, A., Linke, K., Gehrke, S. A., Winnefeld, M., Kluger, P. J. Integration of Mature Adipocytes to Build-Up a Functional Three-Layered Full-Skin Equivalent. Tissue Engineering Part C: Methods. 22 (8), 756-764 (2016).
- Monfort, A., Soriano-Navarro, M., García-Verdugo, J. M., Izeta, A. Production of human tissue-engineered skin trilayer on a plasma-based hypodermis. Journal of Tissue Engineering and Regenerative Medicine. 7 (6), 479-490 (2013).
- Shamis, Y., et al. Fibroblasts derived from human embryonic stem cells direct development and repair of 3D human skin equivalents. Stem Cell Research & Therapy. 2 (1), 10 (2011).
- Kim, Y., et al. Establishment of a complex skin structure via layered co-culture of keratinocytes and fibroblasts derived from induced pluripotent stem cells. Stem Cell Research & Therapy. 9 (1), 217 (2018).
- Chau, D. Y. S., Johnson, C., MacNeil, S., Haycock, J. W., Ghaemmaghami, A. M. The development of a 3D immunocompetent model of human skin. Biofabrication. 5 (3), 035011 (2013).
- Vanden Bogaard, E. H., et al. Crosstalk between Keratinocytes and T Cells in a 3D Microenvironment: A Model to Study Inflammatory Skin Diseases. Journal of Investigative Dermatology. 134 (3), 719-727 (2014).
- Linde, N., Gutschalk, C. M., Hoffmann, C., Yilmaz, D., Mueller, M. M. Integrating Macrophages into Organotypic Co-Cultures: A 3D In Vitro Model to Study Tumor-Associated Macrophages. PLOS ONE. 7 (7), 40058 (2012).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical Advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Weinmüllner, R., et al. Organotypic human skin culture models constructed with senescent fibroblasts show hallmarks of skin aging. npj Aging and Mechanisms of Disease. 6 (1), 4 (2020).
- Barker, C. L., et al. The Development and Characterization of an In Vitro Model of Psoriasis. Journal of Investigative Dermatology. 123 (5), 892-901 (2004).
- Larcher, F., Espada, J., Díaz-Ley, B., Jaén, P., Juarranz, A., Quintanilla, M. New Experimental Models of Skin Homeostasis and Diseases. Actas Dermo-Sifiliográficas (English Edition). 106 (1), 17-28 (2015).
- Varkey, M., Ding, J., Tredget, E. E. Fibrotic Remodeling of Tissue-Engineered Skin with Deep Dermal Fibroblasts Is Reduced by Keratinocytes. Tissue Engineering Part A. 20 (3-4), 716-727 (2013).
- Moulin, V. J. Reconstitution of skin fibrosis development using a tissue engineering approach. Methods in Molecular Biology. 961, 287-303 (2013).
- Morgan, J. T., Shirazi, J., Comber, E. M., Eschenburg, C., Gleghorn, J. P. Fabrication of centimeter-scale and geometrically arbitrary vascular networks using in vitro self-assembly. Biomaterials. 189, 37-47 (2019).
- Silvestri, L., Costantini, I., Sacconi, L., Pavone, F. S. Clearing of fixed tissue: a review from a microscopist's perspective. Journal of Biomedical Optics. 21 (8), 1-8 (2016).
- Cross, V. L., et al. Dense type I collagen matrices that support cellular remodeling and microfabrication for studies of tumor angiogenesis and vasculogenesis in vitro. Biomaterials. 31 (33), 8596-8607 (2010).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1, 2753 (2007).
- Bornstein, M. B. Reconstituted rat-tail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Laboratory Investigation. 7 (2), 134-137 (1958).
- Clément, M. -. V., Ramalingam, J., Long, L. H., Halliwell, B. The In Vitro Cytotoxicity of Ascorbate Depends on the Culture Medium Used to Perform the Assay and Involves Hydrogen Peroxide. Antioxidants & Redox Signaling. 3 (1), 157-163 (2001).
- Tajima, S., Pinnell, S. R. Ascorbic acid preferentially enhances type I and III collagen gene transcription in human skin fibroblasts. Journal of Dermatological Science. 11 (3), 250-253 (1996).
- Murad, S., Tajima, S., Johnson, G. R., Sivarajah, A., Pinnell, S. R. Collagen Synthesis in Cultured Human Skin Fibroblasts: Effect of Ascorbic Acid and Its Analogs. Journal of Investigative Dermatology. 81 (2), 158-162 (1983).
- Villacorta, L., Azzi, A., Zingg, J. -. M. Regulatory role of vitamins E and C on extracellular matrix components of the vascular system. Vitamin E: An Overview of Major Research Directions. 28 (5), 507-537 (2007).
- Ashino, H., et al. Novel Function of Ascorbic Acid as an Angiostatic Factor. Angiogenesis. 6 (4), 259-269 (2003).
- Ponec, M., et al. The Formation of Competent Barrier Lipids in Reconstructed Human Epidermis Requires the Presence of Vitamin C. Journal of Investigative Dermatology. 109 (3), 348-355 (1997).
- Dickson, M. A., et al. Human keratinocytes that express hTERT and also bypass a p16(INK4a)-enforced mechanism that limits life span become immortal yet retain normal growth and differentiation characteristics. Molecular and Cellular Biology. 20 (4), 1436-1447 (2000).
- Johansen, C. Generation and Culturing of Primary Human Keratinocytes from Adult Skin. Journal of visualized experiments: JoVE. (130), e56863 (2017).
- Richardson, D. S., Lichtman, J. W. Clarifying Tissue Clearing. Cell. 162 (2), 246-257 (2015).
- Ariel, P. A beginner's guide to tissue clearing. The International Journal of Biochemistry & Cell Biology. 84, 35-39 (2017).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502 (2010).
- Ng, J. M. K., Gitlin, I., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. ELECTROPHORESIS. 23 (20), 3461-3473 (2002).
- Eddings, M. A., Johnson, M. A., Gale, B. K. Determining the optimal PDMS-PDMS bonding technique for microfluidic devices. Journal of Micromechanics and Microengineering. 18 (6), 067001 (2008).
- Markov, D. A., Lillie, E. M., Garbett, S. P., McCawley, L. J. Variation in diffusion of gases through PDMS due to plasma surface treatment and storage conditions. Biomedical microdevices. 16 (1), 91-96 (2014).
- Katzenberg, F. Plasma-bonding of poly(dimethylsiloxane) to glass. e-Polymers. 5 (1), (2005).
- El Ghalbzouri, A., Lamme, E., Ponec, M. Crucial role of fibroblasts in regulating epidermal morphogenesis. Cell and Tissue Research. 310 (2), 189-199 (2002).
- Kanitakis, J. Anatomy, histology and immunohistochemistry of normal human skin. European journal of dermatology: EJD. 12 (4), 390-399 (2002).
- Hessian based Frangi Vesselness filter. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/24409-hessian-based-frangi-vesselness-filter (2010)
- Jerman, T., Pernuš, F., Likar, B. Špiclin Enhancement of Vascular Structures in 3D and 2D Angiographic Images. IEEE Transactions on Medical Imaging. 35 (9), 2107-2118 (2016).
- Kovesi, P. Phase Preserving Denoising of Images. signal. 4, 6 (1999).
- Vincent, L. Morphological grayscale reconstruction in image analysis: applications and efficient algorithms. IEEE Transactions on Image Processing. 2 (2), 176-201 (1993).
- Xie, L., et al. Quantitative susceptibility mapping of kidney inflammation and fibrosis in type 1 angiotensin receptor-deficient mice. NMR in Biomedicine. 26 (12), 1853-1863 (2013).
- Van Uitert, R., Bitter, I. Subvoxel precise skeletons of volumetric data based on fast marching methods. Medical Physics. 34 (2), 627-638 (2007).
- Sethian, J. A. A fast marching level set method for monotonically advancing fronts. Proceedings of the National Academy of Sciences of the United States of America. 93 (4), 1591-1595 (1996).
- Sethian, J. A. Fast Marching Methods. SIAM Review. 41 (2), 199-235 (1999).
- Braverman, I. M. The Cutaneous Microcirculation. Journal of Investigative Dermatology Symposium Proceedings. 5 (1), 3-9 (2000).
- Men, S. J., Chen, C. -. L., Wei, W., Lai, T. -. Y., Song, S. Z., Wang, R. K. Repeatability of vessel density measurement in human skin by OCT-based microangiography. Skin research and technology: official journal of International Society for Bioengineering and the Skin (ISBS) [and] International Society for Digital Imaging of Skin (ISDIS) [and] International Society for Skin Imaging (ISSI). 23 (4), 607-612 (2017).
- Commandeur, S., Ho, S. H., de Gruijl, F. R., Willemze, R., Tensen, C. P., El Ghalbzouri, A. Functional characterization of cancer-associated fibroblasts of human cutaneous squamous cell carcinoma. Experimental Dermatology. 20 (9), 737-742 (2011).
- Thakoersing, V. S., Danso, M. O., Mulder, A., Gooris, G., Ghalbzouri, A. E., Bouwstra, J. A. Nature versus nurture: does human skin maintain its stratum corneum lipid properties in vitro. Experimental Dermatology. 21 (11), 865-870 (2012).
- Thakoersing, V. S., Gooris, G. S., Mulder, A., Rietveld, M., El Ghalbzouri, A., Bouwstra, J. A. Unraveling barrier properties of three different in-house human skin equivalents. Tissue Engineering. Part C, Methods. 18 (1), 1-11 (2012).
- Bouwstra, J. A., Groenink, H. W. W., Kempenaar, J. A., Romeijn, S. G., Ponec, M. Water distribution and natural moisturizer factor content in human skin equivalents are regulated by environmental relative humidity. The Journal of Investigative Dermatology. 128 (2), 378-388 (2008).
- Thakoersing, V. S., van Smeden, J., Mulder, A. A., Vreeken, R. J., El Ghalbzouri, A., Bouwstra, J. A. Increased Presence of Monounsaturated Fatty Acids in the Stratum Corneum of Human Skin Equivalents. Journal of Investigative Dermatology. 133 (1), 59-67 (2013).
- Smola, H., Thiekötter, G., Fusenig, N. Mutual induction of growth factor gene expression by epidermal-dermal cell interaction. The Journal of Cell Biology. 122 (2), 417 (1993).
- Fluck, J., Querfeld, C., Cremer, A., Niland, S., Krieg, T., Sollberg, S. Normal Human Primary Fibroblasts Undergo Apoptosis in Three-Dimensional Contractile Collagen Gels. Journal of Investigative Dermatology. 110 (2), 153-157 (1998).
- Nakagawa, S., Pawelek, P., Grinnell, F. Long-Term Culture of Fibroblasts in Contracted Collagen Gels: Effects on Cell Growth and Biosynthetic Activity. Journal of Investigative Dermatology. 93 (6), 792-798 (1989).
- Smith, L. E., Bonesi, M., Smallwood, R., Matcher, S. J., MacNeil, S. Using swept-source optical coherence tomography to monitor the formation of neo-epidermis in tissue-engineered skin. Journal of Tissue Engineering and Regenerative Medicine. 4 (8), 652-658 (2010).
- Pierce, M. C., Strasswimmer, J., Park, H., Cense, B., De Boer, J. F. Birefringence measurements in human skin using polarization-sensitive optical coherence tomography. Biomed Opt. 2 (2), 287-291 (2004).
- Pierce, M. C., Strasswimmer, J., Hyle Park, B., Cense, B., de Boer, J. F. Advances in Optical Coherence Tomography Imaging for Dermatology. Journal of Investigative Dermatology. 123 (3), 458-463 (2004).
- Yeh, A. T., Kao, B., Jung, W. G., Chen, Z., Nelson, J. S., Tromberg, B. J. Imaging wound healing using optical coherence tomography and multiphoton microscopy in an in vitro skin-equivalent tissue model. Journal of Biomedical Optics. 9 (2), 9 (2004).
- Derr, K., et al. Fully Three-Dimensional Bioprinted Skin Equivalent Contructs with Validated Morphology and Barrier Funtion. Tissue Engineering Part C: Methods. 25 (6), 334-343 (2019).
- Park, B. H., de Boer, J. F. Polarization Sensitive Optical Coherence Tomography. Optical Coherence Tomography: Technology and Applications. , 1055-1101 (2015).
- Batheja, P., Song, Y., Wertz, P., Michniak-Kohn, B. Effects of Growth Conditions on the Barrier Properties of a Human Skin Equivalent. Pharmaceutical Research. 26 (7), 1689-1700 (2009).
- Dos Santos, M., Metral, E., Boher, A., Rousselle, P., Thepot, A., Damour, O. In vitro 3-D model based on extending time of culture for studying chronological epidermis aging. Matrix Biology. 47, 85-97 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены