Method Article
דור של שווה ערך לעור אנושי בהרכבה עצמית
In This Article
Summary
מטרת פרוטוקול זה היא לתאר את הדור ואת הניתוח הנפחי של שווה ערך לעור אנושי וסקולרי באמצעות טכניקות נגישות ופשוטות לתרבות ארוכת טווח. ככל האפשר, הרציונל לצעדים מתואר כדי לאפשר לחוקרים את היכולת להתאים אישית בהתבסס על צרכי המחקר שלהם.
Abstract
שווה ערך לעור אנושי (HSEs) הם מבנים מהונדסים רקמות המודל רכיבים אפידרמיס עורי של העור האנושי. מודלים אלה שימשו לחקר התפתחות העור, ריפוי פצעים וטכניקות השתלה. HSEs רבים ממשיכים להיות חסרי כלי דם ומנותחים בנוסף באמצעות סעיף היסטולוגי פוסט-תרבותי המגביל הערכה נפחית של המבנה. מוצג כאן הוא פרוטוקול פשוט ניצול חומרים נגישים כדי ליצור שווה ערך לעור אנושי vascularized (VHSE); מתוארים עוד יותר הם טכניקות הדמיה וכימות נפחיות של מבנים אלה. בקצרה, VHSEs בנויים 12 מוסיף תרבות גם שבו תאים עוריים ואפידרמיס הם זרע לתוך סוג קולגן זנב חולדה אני ג'ל. התא העורי מורכב מתאי פיברובלסט ואנדותל המפוזרים בכל ג'ל הקולגן. תא האפידרמיס מורכב מקרטינוציטים (תאי אפיתל בעור) המבדילים בממשק הנוזלי-אוויר. חשוב לציין, שיטות אלה ניתנות להתאמה אישית בהתבסס על הצרכים של החוקר, עם תוצאות המדגימות ייצור VHSE עם שני סוגי תאים פיברובלסטים שונים: פיברובלסטים עוריים אנושיים (hDF) ופיברובלסטים ריאות אנושיים (IMR90s). VHSEs פותחו, צולמו באמצעות מיקרוסקופיה קונפוקלית, ונותחו באופן נפחי באמצעות תוכנה חישובית בנקודות זמן של 4 ו-8 שבועות. מתואר תהליך ממוטב לתיקון, כתם, תמונה ו- VHSEs ברורים לבדיקה נפחית. טכניקות מקיפות אלה של מודל, הדמיה וניתוח ניתנות להתאמה אישית בקלות לצרכי המחקר הספציפיים של מעבדות בודדות עם או בלי ניסיון קודם של HSE.
Introduction
העור האנושי מבצע פונקציות ביולוגיות חיוניות רבות כולל מתנהג כמו מחסום חיסוני / מכני, ויסות טמפרטורת הגוף, השתתפות החזקת מים ותפקידים חושיים1,2,3,4. מבחינה אנטומית, העור הוא האיבר הגדול ביותר בגוף האדם והוא מורכב משלוש שכבות עיקריות (אפידרמיס, דרמיס, hypodermis) ובעל מערכת מורכבת של סטרומה, כלי דם, הבלוטות, ורכיבי מערכת החיסון / מערכת העצבים בנוסף לתאי אפידרמיס. האפידרמיס עצמו מורכב מארבע שכבות של תאים המתחדשים ללא הרף כדי לשמור על תפקוד המחסום ומבנים אחרים של עור מקומי (כלומר, זיעה ובלוטות החלב, ציפורניים)3. פיזיולוגיה של העור חשובה בתפקוד מערכת החיסון, ריפוי פצעים, ביולוגיה של סרטן ותחומים אחרים, מה שמוביל חוקרים להשתמש במגוון רחב של מודלים, ממונוקולטורות במבחנה ועד מודלים של בעלי חיים in vivo. מודלים של בעלי חיים מציעים את היכולת לחקור את המורכבות המלאה של פיזיולוגיית העור, עם זאת, מודלים נפוצים של בעלי חיים כגון עכברים יש הבדלים פיזיולוגיים משמעותיים בהשוואה לבני אדם5. מגבלות אלה, והעלות המוגברת של מודלים של בעלי חיים, הובילו חוקרים רבים להתמקד בפיתוח מודלים במבחנה המשקפים באופן הדוק יותר את הפיזיולוגיה של העור האנושי1,6. מתוכם, אחד מסוגי המודלים הפשוטים יותר הוא המקבילה האפידרמלית האנושית (HEE; המכונה גם מודלים של עור בעובי למחצה) המורכבים רק מקרטינוציטים אפידרמליים במטריצה עורית תאית, אך לוכדים בידול אפידרמלי וריבוד שנראים בוויו. בהתבסס על זה, מודלים המכילים רכיבים עוריים ואפידרמליים (קרטינוציטים ופיברובלסטים) מכונים לעתים קרובות שווה ערך לעור אנושי (HSE), מודלים לעור בעובי מלא, או מבני עור organotypic (OSC). בקצרה, מודלים אלה נוצרים על ידי אנקפסולציות תאים עוריים בתוך מטריצות ג'ל ותאי אפידרמיס זריעה על גבי. לאחר מכן ניתן להשיג בידול וריבוד אפידרמיס באמצעות מדיה מיוחדת וחשיפה לאוויר7. שווה ערך לעור נוצרו לרוב באמצעות טכניקות הרכבה עצמית באמצעות ג'לים עוריים העשויים קולגן מסוג I (אחד של זנב עכברוש או מקור עור שור)1,8, אבל מודלים דומים שילבו רכיבי מטריצה אחרים כגון פיברין9,10, fibroblast נגזר11,12, קרום cadaveric דה epidermized13, 14,15,16, ג'לים זמינים מסחרית ואחרים1,12,13,17,18,19. נכון לעכשיו, ישנם שווה ערך לעור זמין מסחרית (כפי שנסקר בעבר1,2). עם זאת, אלה מפותחים בעיקר למטרות טיפוליות ולא ניתן להתאים אישית בקלות לשאלות מחקר ספציפיות.
HSEs יושמו במחקרים של ריפוי פצעים, השתלה, טוקסיקולוגיה, ומחלות עור / פיתוח11,12,13,16,8,20,21,22,23. למרות שתרבות תלת מימדית מדגמנת באופן מקיף יותר פונקציות של רקמה אנושית בהשוואה לתרביות דו-ממדיות24, הכללת סוגי תאים מגוונים המשקפים בצורה מדויקת יותר את אוכלוסיית ה- in vivo מאפשרת מחקרים של תיאום תאי התא ברקמות מורכבות24,25,26. רוב HSEs כוללים רק פיברובלסטים עוריים וקרטינוציטים אפידרמליים27, אם כי סביבת העור in vivo כוללת סוגי תאים רבים אחרים. מחקרים שנעשו לאחרונה החלו לכלול יותר אוכלוסיות תאים; אלה כוללים תאי אנדותל ב vasculature10,28,29,30,31,32,33,34, adipocytes ברקמה תת עורית35,36, רכיבי עצב19,21, תאי גזע27,37,38, תאים חיסוניים10,39,40,41,42, ומחלות אחרות / סרטן מודלים ספציפיים16,40,43,44,45,46,47. חשוב במיוחד בקרב אלה הוא כלי דם; בעוד כמה HSEs כוללים תאי כלי דם, בסך הכל הם עדיין חסרים אלמנטים נימי מקיף עם קישוריות על פני הדרמיס כולו10,29 , מורחבת יציבות במבחנה28, ואת צפיפות כלי מתאים. יתר על כן, מודלים HSE מוערכים בדרך כלל באמצעות סעיף היסטולוגי פוסט-תרבותי אשר מגביל ניתוח של המבנה התלת מימדי של HSEs. ניתוח תלת מימדי מאפשר הערכה נפחית של צפיפות כלי הדם48,49, כמו גם וריאציה אזורית של עובי אפידרמיס ובידול.
למרות HSEs הם אחד הדגמים organotypic הנפוצים ביותר, ישנם אתגרים טכניים רבים ביצירת מבנים אלה כולל זיהוי של מטריצה חוץ תאית מתאימה צפיפות תאים, מתכונים מדיה, נהלי ממשק נוזלי אוויר נאות, וניתוח שלאחר התרבות. יתר על כן, בעוד מודלים HEE ו- HSE פרסמו פרוטוקולים, פרוטוקול מפורט המשלב vasculature עורי הדמיה נפחית ולא ניתוח היסטולוגי אינו קיים. עבודה זו מציגה פרוטוקול נגיש לתרבות של שווה ערך לעור אנושי וסקולרי (VHSE) מקווי תאים מסחריים בעיקר. פרוטוקול זה נכתב כדי להיות להתאמה אישית בקלות, המאפשר התאמה ישירה קדימה לסוגי תאים שונים וצרכי מחקר שונים. לטובת נגישות, זמינות ועלות, השימוש במוצרים פשוטים ובטכניקות דור קיבל עדיפות על פני שימוש במוצרים מסחריים זמינים. כמו כן, מתוארות שיטות הדמיה וכימות נפחיות פשוטות המאפשרות להעריך את המבנה התלת מימדי של ה- VHSE. תרגום הליך זה לפרוטוקול חזק ונגיש מאפשר לחוקרים שאינם מומחים ליישם מודלים חשובים אלה ברפואה מותאמת אישית, הנדסת רקמות וסקולריות, פיתוח שתלים והערכת תרופות.
Protocol
1. הכנה לתרבות תלת מימדית
- הכן מלאי קולגן זנב עכברוש ב 8 מ"ג / מ"ל, באמצעות פרוטוקולים הוקמה50,51,52. לחלופין, קולגן זנב חולדה ניתן לרכוש מספקים (ראה רשימת חומרים) בריכוזים המתאימים.
הערה: קולגן ניתן להכין או לרכוש בריכוזים שונים בטווח של 3-10 מ"ג / מ"ל, או גבוה יותר50,51,52. החישובים בפרוטוקול מניחים ריכוז של 8 מ"ג/מ"ל אך ניתן להתאים אותם בהתאם לצרכי החוקר. - הרחב קווי תאים: תאי אנדותל ופיברובלסט צריכים להיות מוכנים לזריעת בתחילת יצירת רכיבים עוריים קולגן תלת-ממדי (שלב 2). קרטינוציטים צריכים להיות מוכנים ביום 7 של תרבות 3D. מבנה VHSE שלם אחד דורש 7.5 x 105 תאי אנדותל; 7.5 x 104 פיברובלסטים; ו- 1.7 x 105 קרטינוציטים לדור(טבלה 1).
הערה: צפיפויות אלה מתאימות לתוספות תרבית רקמה חדירה בגודל 12 באר או שווה ערך. ניתן לשנות את צפיפות התא ואת העיצוב למעלה או למטה בהתאם לצרכים של החוקר. כדי להבהיר, כמות זו של תאים אנדותל פיברובלסט יהיה זרע 1-3 רכיבים עוריים, בעוד כל רכיב אפידרמיס דורש 1.7 x 105 קרטינוציטים. - בצע את כל צנטריפוגות התא בפרוטוקול זה במשך 5 דקות ב 300 x g, אבל זה עשוי להיות מופחת עבור סוגי תאים שבירים יותר.
2. יצירת רכיב עורי קולגן תלת מימדי
הערה: שלב 2 הוא פרוצדורה תלוית זמן ויש להשלים אותו בהגדרה אחת. מומלץ להשלים בדיקת איכות של מלאי הקולגן כדי להבטיח ג'לציה נכונה והומוגניות לפני תחילת זריעת רכיב עורי, ראה פתרון בעיות בדיון.
- הכנה וזרע של שכבת קולגן תאית
- הכינו שני צינורות מיקרוצנטריפוגה 1.7 מ"ל, אחד לתמיכה תאית ואחד לדרמיס התאי. כמויות שניתנו בשלב זה יכינו 1 מ"ל של קולגן 3 מ"ג / מ"ל (ריכוז קולגן היעד), מספיק (3) 12-גודל טוב VHSEs. משוואות מפורטות אם יש צורך בהתאמה. ניתן לשנות את קנה המידה והצפיפות הן בהתאם לצרכי החוקר (מספרי אסמכתא נפוצים ניתנים בטבלה 2).
- לכל צינור, להוסיף 100 μL של תרבות כיתה 10x פוספט אגירה מלוחים (PBS) (צינור אחד יניב 3 VHSEs) ולהוסיף 8.6 μL של 1 N NaOH. מניחים צינורות מכוסים על קרח רטוב כדי לצנן לפחות 10 דקות.
Cs = ריכוז מלאי קולגן
Vf = נפח סופי של קולגן נחוץ
Ct = ריכוז קולגן יעד
Vs = נפח קולגן במלאי הדרוש לכמות הרצויה (Vf)
Vpbs = נפח של 10X PBS הדרוש לריכוז קולגן היעד (Ct)
VNaOH = נפח של 1N NaOH הדרוש עבור Ct
V media = נפח מדיה, השעיית שיחה או ddH2O הדרושים עבור Ct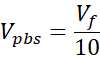
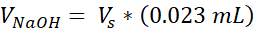
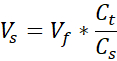
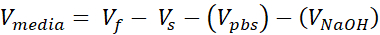
- הכן 1000 ו 250 μL פיפטות תזוזה חיובית לשימוש ולהניח בצד. כמו שלבים מאוחרים יותר הם רגישים לזמן, זה נוח לטעון טיפים פיפטה ולהגדיר כרכים (375 μL ו 125 μL, בהתאמה). בנוסף, הגדרת נורמלי 1000 μL פיפטה עבור 516 μL.
הערה: פיפטות תזוזה חיובית ניתן להחליף פיפטות נורמלי במידת הצורך, אבל בגלל צמיגות גבוהה של קולגן ואת הרגישות זמן / טמפרטורה של הליך זה, פיפטות עקירה חיובית מומלץ לעזור לייצר תוצאות זריעה עקבית. אם אתם משתמשים בפיפטות רגילות, השתמשו בתנועות איטיות. - הכן תרבות להוסיף צלחות היטב: השתמש מלקחיים סטריליים למקם שלוש 12-גודל היטב תרבות מוסיף לתוך צלחת סטרילית 12-באר רקמה תרבות, מקום לתוך העמודים המרכזיים.
- הגדר מדיה קרה המתאימה לסוגי תאים פיברובלסטים ואנדותל.
- לאחר קירור של צינורות כתרים, מניחים צינור אחד (לתמיכה acellular) על מתלה עם התוכן גלוי. השאירו את הצינור השני (עבור הדרמיס התאי) על הקרח.
- מוציאים 8 מ"ג/מ"ל של קולגן מהקירור ומניחים על קרח רטוב.
הערה: אין להשתמש בקרח מקפיא או בצידניות ספסל ב-20°C, שכן הדבר יקפיא את הקולגן. - לצינור קר כתרים, להוסיף 516 μL של מדיה ומיד להוסיף 375 μL של קולגן קר באמצעות פיפטה 1000 μL μL תזוזה חיובית. לפזר קולגן לתוך הפתרון (לא בצד של הצינור). הסר מיד את קצה פיפטה ריק ולעבור פיפט 250 μL תזוזה חיובית מוכן לערבב.
- מערבבים במהירות אך בעדינות כדי למנוע היווצרות בועה, לא להסיר טיפ מהפתרון, אם אפשר. מערבבים עד שהפתרון הוא בצבע הומוגני, אשר בדרך כלל לוקח בערך 5 מחזורי פיפטה או 10 s (אם משתמשים במדיה עם פנול אדום, הצבע יהפוך קל ואחיד). בעת ערבוב, הקפד לצייר מעמדות שונות של הצינור (התחתון והחלק העליון) לערבוב אחיד.
הערה: זה יכול להתבצע עם 516 μL של מים כיתה תרבות התא או נוזלי כיתה תרבות תאים אחרים, עם זאת, פנול אדום של רוב המדיה הוא אינדיקטור טוב של ערבוב. השתמש במדיה פיברובלסטית או אנדותל ששימשה להרחבות דו-ממדיות.
- מערבבים במהירות אך בעדינות כדי למנוע היווצרות בועה, לא להסיר טיפ מהפתרון, אם אפשר. מערבבים עד שהפתרון הוא בצבע הומוגני, אשר בדרך כלל לוקח בערך 5 מחזורי פיפטה או 10 s (אם משתמשים במדיה עם פנול אדום, הצבע יהפוך קל ואחיד). בעת ערבוב, הקפד לצייר מעמדות שונות של הצינור (התחתון והחלק העליון) לערבוב אחיד.
- מיד לפזר 125 μL של קולגן תאי על הממברנה של כל אחד משלושת 12-טוב תרבות מוסיף. כדי להבטיח כיסוי אחיד של ג'ל קולגן תאי, רוק את המנה; אם זה לא יוצר כיסוי קרום אחיד ואז להשתמש בקצה פיפטה כדי לצבוע את הממברנה בעצם על ידי הפצת קולגן בעדינות סביב; הימנע מהפעלת לחץ על הממברנה. ג'לציה מתחילה כמעט מיד; בצע שלב זה במהירות כדי להבטיח כיסוי אחיד.
הערה: יהיה קולגן תאי עודף. נפח יכול להיות מופחת, עם זאת, הכנת פחות מ 1 מ"ל של השעיית קולגן יכול לגרום לקשיים ערבוב הפתרון ג'ל מספיק. - מיד להעביר את צלחת 12-well לחממה 37 מעלות צלזיוס תרבות התא לתת לו ג'ל לפחות 20 דקות (קולגן תאי יכול ג'ל במשך זמן רב יותר במידת הצורך; במהלך זמן זה gelation, להמשיך לשלב 2.2). מוציאים את מתלה הקולגן מקרח ומחזירים לקירור (הקולגן יציב ביותר ב-4 מעלות צלזיוס).
- הכנת השעיית תאים
הערה: עבור ציר הזמן התרבותי של פרוטוקול זה, זה מתאים יום שקיעה 1 (SD1)- במהלך ג'לציה של תמיכת קולגן תאי, לנסות ולספור את קווי התא אנדותל פיברובלסט.
- להשעות 7.5 x 105 תאי אנדותל ו 7.5 x 104 fibroblasts ב 258 μL של המדיה שלהם בהתאמה ולשלב השעיות תאים כדי ליצור aliquot μL 516. לשמור על המתלים התא על קרח רטוב עד השימוש.
- הכן 1000 ו 250 μL פיפטות תזוזה חיובית לשימוש ולהניח בצד. כמו שלבים מאוחרים יותר הם רגישים לזמן, זה נוח לטעון טיפים פיפטה ולהגדיר כרכים (375 μL ו 250 μL, בהתאמה). בנוסף, הגדרת נורמלי 1000 μL פיפטה עבור 516 μL.
- זריעת קולגן עמוסה תאים של תא עורי
- לאחר תקופת הג'לציה, מוציאים מהחממה את צלחת 12 הבאר של קולגן תאי.
הערה: אם קולגן זה אינו gelled לאחר 30 דקות, לא להמשיך את ההליך כפי שהיה סביר טעות במהלך הזריעה או מלאי קולגן עלולה להיות בעיה (ראה פתרון בעיות בדיון). - הסר את הצינור כתרים 1.7 מ"ל מקרח רטוב (מכיל 10x PBS ו NaOH). הנח את הצינור בארון תקשורת כך שהתוכן יהיה גלוי. לשחרר / לפתוח את כל הכובעים (השעיית תא, צינור כתרים קר).
- מוציאים את קולגן המלאי (8 מ"ג/מ"ל) מהקירור של 4 מעלות צלזיוס ומניחים אותו על קרח רטוב. תשאיר את הכובע פתוח.
- מוסיפים את 516 μL של השעיית תא מקורר לצינור מקורר. השתמש פיפטה תזוזה חיובית μL 1000 כדי פיפטה מיד 375 μL של פתרון קולגן קר ישירות לתוך הפתרון של הצינור כתרים.
- לגרש את כל הקולגן מפיפט לתוך הצינור ולזרוק את קצה פיפטה תזוזה חיובית. מיד לעבור פיפטה 250 μL μL תזוזה חיובית ומערבבים את פתרון הקולגן.
- מערבבים את פתרון הקולגן כפי שהושלם קודם לכן (במהירות אך בעדינות כדי למנוע היווצרות בועה), לא להסיר טיפ מג'ל במידת האפשר. מערבבים עד שהפתרון הומוגני (כ-5 מחזורי פיפטה או 10 שניות). בעת ערבוב הקפד לצייר מעמדות שונות של הצינור (התחתון והחלק העליון) עבור ערבוב אחיד.
- לאחר המעורבוב, מעבירים מיד 250 μL של תמיסת קולגן תאית לתמיכת הקולגן התאי בכל אחד משלושת תוספות התרבות של 12 באר. כדי להבטיח כיסוי אחיד של תמיכת הקולגן התאי, נדנדו את המנה ו/או השתמשו בפיפט התזוזה החיובי כדי להזיז בעדינות את הקולגן התאי הטרי מבלי להפריע לשכבה התאית.
- מיד להעביר את צלחת 12-well ל 37 מעלות צלזיוס חממה תרבות התא לתת לו ג'ל לפחות 30 דקות. מחזירים את הקולגן לקירור של 4 מעלות צלזיוס לאחר השימוש.
- לאחר זמן ג'ל של 30 דקות, להטות בעדינות את הצלחת כדי להעריך את הג'לציה. ודאו שהקולגן מוצק.
- הוסף 500 μL ו 1000 μL של מדיה תערובת (חצי אנדותל וחצי fibroblast תחזוקה מדיה) לתא העליון ואת התא התחתון של הכנס, בהתאמה (העליון הראשון, ואז התחתון כדי למנוע לחץ הידרוסטטי דוחף קולגן למעלה). מוסיפים מדיה לאט לצד הבאר, לא ישירות על ג'ל קולגן, כדי למזער את ההפרעה של הקולגן.
- ודאו שג'ל הקולגן שקוע, הוסיפו עוד מדיה במידת הצורך. מניחים את צלחת הבאר באינקובטור התא עבור דגירה לילה. בשלב זה, המדיה מכילה 10% FBS; מדיית התחזוקה הרגילה עבור כל קו תא (ציר זמן וסכמטי הנתון באיור 1, A).
הערה: ניתן להתאים מדיה לאורך כל תרבות VHSE עבור סוגי תאים מותאמים אישית; ייתכן שיהיה צורך במיטוב מסוים.
- ודאו שג'ל הקולגן שקוע, הוסיפו עוד מדיה במידת הצורך. מניחים את צלחת הבאר באינקובטור התא עבור דגירה לילה. בשלב זה, המדיה מכילה 10% FBS; מדיית התחזוקה הרגילה עבור כל קו תא (ציר זמן וסכמטי הנתון באיור 1, A).
- לאחר תקופת הג'לציה, מוציאים מהחממה את צלחת 12 הבאר של קולגן תאי.
- שינוי מדיה של יום שקוע 2 (SD2)
- שנה 10% מדיה FBS בבארות VHSE ל 5% FBS חצי fibroblast, חצי מדיה אנדותל בתוספת 100 מיקרוגרם / מ"ל L-Ascorbic חומצה. הוסף 500 μL לתא העליון של תוספת התרבות בצד של הבאר (שוב, להוסיף בזהירות את sidewall כדי למזער את ההפרעה של הקולגן) ולהוסיף 1000 μL לתא התחתון.
- חדש מדיה כל יומיים (SD4 ו- SD6) עד יום שקיעה 7 (SD7).
- השתמש פיפטה ידנית כדי להסיר מדיה מןבארות. שימוש בשאפתן אפשרי אך עלול לגרום לנזק או הרס של המבנה.
הערה: חומצה L-אסקורבית חייבת להיות מורכבת טרי כל 2-3 ימים (זה מתחמצן בתמיסה לייצר מי חמצן ובכך, גרימת מתח חמצוני ובסופו של דבר נזק תאי53). לכן, התקשורת חייבת להשתנות כל 2-3 ימים מ SD2 עד סוף תרבות VHSE מאז חומצה L-אסקורבית קיים. הכי קל לעשות מלאי של מדיה ולהוסיף כמות מוכנה טרי של חומצה L-ascorbic aliquot התקשורת כל יום האכלה. השתמש תרבות כיתה מים או מדיה כממס ולהכין חומצה L-אסקורבי טרי ב 100 מ"ג / מ"ל. חומצה L-אסקורבית מעוררת סינתזת קולגן על ידי פיברובלסטים בקצב מתאים ומקדמת יציבות קולגן54,55,56; זה גם מקטין חדירות אנדותל ושומר על שלמות קיר כלי56,57 ובנוסף תורם היווצרות מחסום אפידרמיס6,58.
3. זריעה של רכיב אפידרמיס אינדוקציה ריבוד
- יום שקיעה 7 (SD7): קרטינוציטים זרעים
הערה: זרע קרטינוציטים כדי להקים את האפידרמיס על SD7. ניתן להזיז נקודת זמן זו בהתאם לצרכי החוקר. משך של תרבות שקיעה ללא קרטינוציטים לא יעלה על 9 ימים, כמו שקיעה ארוכה יותר מובילה לעתים קרובות התכווצות עורית מוגברת. אם התכווצות מתרחשת לפני SD7, מומלץ לקצר את תקופת הטבילה ל 5 ימים וזרע אפידרמיס על SD5. מטב את תקופת השקיעה כנדרש לניסויים ספציפיים (ראה פתרון בעיות בדיון).- תרבות keratinocytes (N / TERT-120,59 או תאים מתאימים אחרים) למגבלת המפגש שלהם לפני trypsinization וזרע על VHSEs. עבור תאי N/TERT-1, המפגש לא יעלה באופן משמעותי על 30% כדי למנוע בידול לא רצוי של קרטינוציטים בתרבות 2D59. עבור קווי תאים מתאימים אחרים, כגון קרטינוציטים אפידרמיס אנושיים ראשוניים, מגבלת מפגש של 75-80% משמשת בדרך כלל60.
- לאחר טריפסיניזציה, לספור ולהשעות 510,000 תאים ב 600 μL של העור האנושי שווה ערך (HSE) בידול מדיה בתוספת 5% FBS (טבלה 1).
הערה: 510,000 תאים ב 600 μL מאפשר 170,000 תאים / לבנות בעת זריעת 200 μL לכל מבנה (3 VHSEs). - באמצעות פיפטה ידנית, לאסוף ולהשליך מדיה כרגע בתא התחתון העליון עבור כל מבנה היטב. הקפד לאסוף מדיה רבה ככל האפשר. לאסוף מדיה שעשויה להיתקע ישירות מתחת לקרום חדיר על ידי הצבת בעדינות את קצה פיפטה מתחת לתרבות להוסיף קרום ולדפוק את הכנס מחוץ למקום באופן זמני. ייתכן שהתקשורת נתקעה בגלל מתח פנים. ודא כי מוסיף לשבת שטוח בבארות שלהם לפני שתמשיך. שימוש בשאפתן אפשרי אך עלול לגרום לנזק או הרס של המבנה.
- הוסף 1 מ"ל של מדיה HSE בתוספת 5% FBS לתא התחתון של כל באר. לאחר מכן להוסיף 200 μL של השעיית התא לתא העליון של כל באר. זרעו ישירות על משטח המבנה העורי. תן לקרטינוציטים להסתפק ב-2 שעות באינקובטור.
- שתי שעות לאחר זריעת keratinocytes, בזהירות להוסיף 300 μL של מדיה HSE בתוספת 5% FBS לתא העליון של כל מבנה היטב; לאט לאט פיפטה מדיה בצד של תרבות להוסיף. טען את המדיה לתוך התא העליון בזהירות רבה כדי לא להפריע keratinocytes התיישבו שאולי לא דבקו בחוזקה ג'ל קולגן הבסיסית עדיין.
- לאחר טעינת המדיה, הנח את המבנה בחזרה לאינקובטור.
- יום שקיעה 8/9 (SD8 או SD9)
- איפור מדיה HSE בתוספת 1% FBS ו 100 מיקרוגרם / מ"ל L-ascorbic חומצה.
- הסר מדיה הן מהתאים העליונים והן מהתאים התחתונים באמצעות צינור ידני.
- הוסף 500 μL מדיה לתוך התא העליון הראשון ולאחר מכן 1 מ"ל לתוך התא התחתון. (שלב זה יכול להיעשות על SD8 או SD9)
- יום שקיעה 9/10 (SD9 או SD10, זה צריך להיות יום אחרי שלב 3.2)
- להמציא סרום חינם HSE בידול מדיה עם 100 מיקרוגרם / מ"ל L-חומצה אסקורבית.
- הסר מדיה הן מהתאים העליונים והן מהתאים התחתונים באמצעות צינור ידני.
- טען 500 μL לתוך התא העליון ו 1 מ"ל בתא התחתון.
- יום ממשק נוזלי אוויר 1 (ALI1)
הערה: ALI מבוצע יום אחרי שלב 3.3.- הרם כל מבנה לממשק נוזלי אוויר (ALI) על ידי הסרת פסולת מדיה מהתא העליון בלבד. השתמש פיפטה ידנית כדי להתקרב ככל האפשר לשכבת האפידרמיס מבלי לגעת או לפגוע בו.
- להטות את הצלחת מעט בזוויות שונות כדי לאסוף את המדיה. הסר מדיה רבה ככל האפשר בשלב זה. הוסף כ 2 מ"ל של מים סטריליים לבארות שמסביב בצלחת כדי לשמור על לחות עקבית; לשמור על בארות מלאות במים לאורך כל התרבות.
- בדוק את הצלחת כמה שעות מאוחר יותר כדי לוודא keratinocytes הם עדיין בממשק אוויר נוזלי. אם יש מדיה בתא העליון, הסר אותה. עקוב אחר כמות המדיה מוסרת עבור כל באר VHSE, (הנפח הראשוני של התאים העליונים והתחתונים (1500 μL) - המדיה הוסרה = נקודת התחלה טובה להאכלת ALI).
הערה: VHSEs אינם דורשים בהכרח את אותה רמת מדיה עבור מעלית אוויר; בדרך כלל אם VHSEs הם זרע יחד אז הם צריכים בערך באותה רמה של מדיה עבור להרים אוויר, אבל זה לא תמיד המקרה. כוונן את אמצעי האחסון לפי הצורך כדי לשמור על ALI אך ודא שרמות המדיה אינן נמוכות כל כך עד ש- VHSEs יתייבשו. זה בטוח יותר להיות זהיר ולהסיר כמויות מדיה קטנות מדי יום עד איזון בין להרים אוויר לחות כבר נפגשו.
- עלי יום 2 (ALI2)
- מנקודה זו ואילך, יש להשתמש רק במדיית HSE ללא סרום בתוספת חומצה L-ascorbic 100 מיקרוגרם/מ"ל. שנה מדיה ביום עלי 2 (ALI2). אם יש מדיה בתא העליון, הסר אותה והוסף אותה לכמות המדיה שהוסרה שהוקלטה בעבר. חשב את נפח המדיה הדרוש באמצעות המשוואה בשלב הקודם. לדוגמה: אם 200 μL של מדיה הוסר מהתא העליון ולאחר מכן להוסיף 1300 μL כדי להקים עלי (כמו 1500 μL - 200 μL = 1300 μL)
- השתמש בנפח מחושב לטעון לתוך התא התחתון של כל באר, ולאחר מכן למקם את הצלחת בחזרה לתוך החממה התא. עקוב אחר אמצעי האחסון המשמש ליום. בעת שימוש בכמויות קולגן המומלצות 12-טוב תרבות מוסיף, הטווח הרגיל של ערכי עלי נופל בין 750 μL ו 1300 μL. בדרך כלל, נפח פוחתת על התבגרות תרבות הופך עקבי סביב שבוע 2/3 של עלי. בהתאם לפרטי התרבות, מספר זה עשוי להשתנות ויש למטב אותו (כמתואר ב- 3.4.2 - 4.1).
4. תחזוקה שגרתית של שווה ערך לעור אנושי בכלי הדם
- מ ALI יום 3 (ALI3) דרך נקודת קצה תרבות: לחדש את המדיה של התא התחתון כל 2-3 ימים באמצעות מדיה HSE חינם בסרום עם 100 מיקרוגרם / מ"ל L-ascorbic חומצה. המשך להתאים ולעקוב אחר רמת המדיה הדרושה בתא התחתון עבור ALI כמתואר בשלב 3.5.2.
- כמו משטח האפידרמיס חייב לשמור על קשר עם האוויר, לבדוק ולהתאים את רמת המדיה מדי יום עד רמות ALI עקביות הוקמו. שכבת האפידרמיס צריכה להיראות hydrated, לא יבש, אבל לא צריך להיות מדיה בריכה על גבי המבנה. תרבויות עם 8 שבועות של ALI סיפקו את המורפולוגיה והביטוי העקביים ביותר; עם זאת, בהתאם ליישום, תרבויות של 4 עד 12 שבועות עשוי להיות מתאים. ייתכן שיהיה צורך למטב את משך התרבות עבור תנאי תא ותרבות שונים.
הערה: שינוי מדיה בימים שני, רביעי ושישי הוא אימון טוב. VHSEs הם בריאים במהלך סוף השבוע, אבל התקשורת צריכה להשתנות מוקדם ביום שני ומאוחר ביום שישי. לאחר השלמת שלבים 1-4 לחלוטין, הדור של VHSE הושלם. שלבים 5-end של הפרוטוקול הם טכניקות עיבוד והדמיה אופציונליות ממוטבות עבור סוג זה של מבנה תלת-ממדי.
5. קיבוע וחריגה של מבנים תלת-ממדיים
הערה: שלב 5 עבר אופטימיזציה לטכניקות דימות ספציפיות למבנה תלת-ממדי זה המתוארות בשאר הפרוטוקול. השלבים הבאים אינם נחוצים ליצירת VHSE.
- קיבוע/חדירה
- הסר בזהירות את כל המדיה מהתאים העליונים והתחתונים של כל באר בנקודת הסיום של תקופת התרבות.
הערה: שכבת האפידרמיס היא אולי שברירית, לטפל בזהירות ולא להתסיס את האפידרמיס עם pipetting אגרסיבי. - הוסף 4% paraformaldehyde (PFA) ב PBS (pH 6.9) לקיר התא העליון (לא ישירות על המבנה) ולאחר מכן לתא התחתון, כדי לתקן מראש כל מבנה. מוסיפים 1 מ"ל לתא וחושפים במשך 5 דקות בטמפרטורת החדר.
התראה: PFA הוא מסוכן ויש לטפל בו בזהירות ובציוד הגנה אישי מתאים (PPE), כולל הגנה על העיניים. - הסר 4% פתרון PFA לאחר 5 דקות ולהוסיף את 0.5% טריטון X 100 ב 4% פתרון PFA לתאים העליונים והתחתונים כמתואר בשלב הקודם. לחשוף במשך שעה בטמפרטורת החדר; מבנה VHSE אינו דורש סביבה סטרילית מעתה והלאה.
- לאחר שעה אחת, להסיר בזהירות את פתרון חדירה / קיבוע משני התאים ולשטוף את המדגם 3 פעמים עם 1x PBS.
- יש לאחסן דגימות ב-PBS בקירור ב-4 מעלות צלזיוס או בכתם מיידי. כדי לאחסן את הדגימות, לעטוף את המנה בניילון נצמד ולאחר מכן רדיד כדי למזער אידוי וחשיפה לאור
הערה: נקודת השהיה - לאחר קיבעון וחריגה, ניתן להשהות הליך זה מכיוון שהדגימות יציבות במשך מספר שבועות אם הן מוכנות כמתואר בשלב 5.1.5. לחלופין, כתמים (כמתואר בשלב 6) ניתן להשלים מיד לאחר שלב 5.
- הסר בזהירות את כל המדיה מהתאים העליונים והתחתונים של כל באר בנקודת הסיום של תקופת התרבות.
6. כתמים אימונופלואורסצנטיים של מבנים תלת-ממדיים
- בניית הכנה
הערה: VHSEs כתם היטב כאשר מופרדים קרום נקבובי של הכנס התרבות; ההפרדה מהממברנה נחוצה גם להדמיה לא חסומה ומאפשרת נפחים מופחתים לכתמים.- כדי להכין את המבנה עבור כתמים immunofluorescent, להפוך להוסיף במהופך ומניחים אותו על הבאר שלה על צלחת היטב (אם VHSE נופל, זה ייפול לתוך הבאר עם PBS)(איור משלים 1A).
- לייצב את הכנס ביד אחת מעל הבאר תוך שימוש במלקחיים קצה דק ו / או סכין דיוק לחתוך כמחצית היקף קרום הכנס. חותכים קרוב ככל האפשר דיור פלסטיק עם יד עדינה כדי למנוע נזק של מבנה VHSE.
- באמצעות מלקחיים קצה עדין, לתפוס את הקצה של דש קרום לחתוך בעדינות לקלף את הממברנה הנקבובית את הכנס, כמו גם את מבנה VHSE. לעשות זאת בזהירות רבה ולאט כדי למנוע נזק למבנה VHSE. אם מבנה VHSE מפריד בקלות אז זה צריך ליפול לתוך הבאר למטה, אם זה נתקע בצד של התא ואז להשתמש במלקחיים קצה דק או scoopula קטן כדי להעביר אותו לבאר. שימו לב לשכבת האפידרמיס מכיוון שהיא בדרך כללשברירית (איור משלים 1A).
הערה: לפעמים הממברנה לא יורדת בקלות או יורדת בחתיכות, אם זה קורה להשתמש בכלים כדי למשוך בזהירות את הממברנה VHSE לבנות לגזרים. ודא ש- VHSEs אינם מתייבשים במהלך תהליך זה על-ידי טבילה ב- PBS, במידת הצורך. - לאחר VHSE הוא בבאר, להשליך את כל החלקים הנותרים של קרום הכנס ולשמור את התרבות להוסיף דיור בכל באר להחזיק את VHSEs במצב שקוע במהלך הכתמה.
- כתמים וכתמים
הערה: כתמים וטיפול /מניפולציה וכביסה הקשורים צריכים להתבצע בעדינות רבה ככל האפשר מאז VHSEs יכול להיות שביר. אם חלקים של האפידרמיס להרים, החלקים יכולים להיות מוכתמים בנפרד; השכבות העליונות של האפידרמיס שבריריות ועוברות פירוק טבעי4, אך לצורך ניתוח חשוב לשמור על שלמות ככל האפשר.- הכינו את כתמי הנוגדנים העיקריים שנבחרו ב- 700 μL של חיץ חסימה לכל מבנה היטב (בדרך כלל, כל הנוגדנים העיקריים יכולים להיות באותו פתרון כתמים, אך יש לאשר זאת לנוגדנים חדשים). 700 μL עובד עבור גודל 12-well, אבל יכול להיות מותאם עבור פורמטים אחרים תרבות. ריכוזים מומלצים של נוגדנים ראשוניים ומשניים עם מתכון חיץ חסימה ניתנים בטבלה 3 (ייתכן שיהיה צורך באופטימיזציה).
- הסר כל PBS מהבאר באמצעות פיפטה ידנית, היזהר פיפטה הרחק VHSEs (כמו VHSEs צפים, שאיפה ואקום לא מומלץ).
- מוסיפים את פתרון הכתם העיקרי לכל באר ומניחים את התרבות מכניסים דיור לבאר כדי לשמור על ה-VHSE שקוע בנוזל(איור 1B משלים). עוטפים את צלחת הבאר בניילון נצמד. רדיד אלומיניום וכתם עבור 48 שעות בקירור 4 מעלות צלזיוס ללא עצבנות או נדנדה (נדנדה עלולה לגרום נזק למבנה VHSE).
- לאחר 48 שעות, להכין נוגדנים משניים וכתמים כימיים ב 700 μL של חיץ חסימה (לכל באר).
- הסר את התרבות להוסיף דיור ואת פתרון הכתם העיקרי לשטוף עם 1x PBS, 3x במשך 5 דקות לפני הוספת פתרון הכתם המשני. הנח את התרבות להוסיף דיור בחזרה לתוך הבאר כדי לשמור על מבנה VHSE שקוע (איור משלים 1B). יש לחשוף למשך 48 שעות בקירור של 4 מעלות צלזיוס ללא תסיסה או נדנדה.
- לאחר חשיפה של 48 שעות, הסר את תמיסת הכתם באמצעות פיפטור ידני ושטוף בעדינות 3x עם PBS; אין נוזל פיפטה ישר על VHSEs כפי שהם עשויים להיות שבירים. Rehydrate עם PBS עודף ומניחים את התרבות להוסיף דיור בחזרה לתוך הבאר כדי לשמור על VHSE שקוע hydrated במהלך האחסון (לאחסן על ידי עטיפה בניילון נצמד ונייר כסף כדי למזער אידוי וחשיפה לאור)
- סליקה (מסוף אופציונלי)
הערה: סליקה היא אופציונלית להדמיה. אם הושלמה, זה צריך להיעשות לאחר הכתמת / הדמיה המדגם לחלוטין מאז ניקוי מונע כתמים נוספים, עלול לשנות את הביצועים פלואורופור, ועלול לגרום נזק למבנה VHSE. שיטות ניקוי רקמות מרובות קיימות49,61,62 וניתן למטב עבור פרויקטים ספציפיים. סליקת מתיל סליצילט, המתוארת להלן, היא פשוטה ויעילה עבור VHSE. יש להשלים את טכניקת הסליקה הבאה במיכלי זכוכית וטיפים לפיפט חייב להיות זכוכית או פוליפרופילן (פוליסטירן יתמוסס במגע עם מתיל סליצילאט). השלם את כל הליך הסליקה באזור מאוורר היטב או מכסה המנוע אדים.- מוסיפים 100% מתנול למיכל זכוכית רדוד קטן (צלחות פטרי זכוכית עובדות היטב). השתמש במיכל הקטן ביותר האפשרי שיתאים למבנה (כדי למזער את הפסולת ריאגנטית).
- מוציאים את המבנה מלוח הבאר באמצעות מלקחיים/סקופולה(איור 1C משלים)ומניחים במיכל המלא במתנול. הוסף מתנול נוסף אם המבנה אינו שקוע.
- לייבש את מבנה VHSE במתנול במשך 3 x 10 דקות טבילות; החלף מתנול באופן מלא לאחר כל טבילה ומיד להסיר מתנול לאחר האמבטיה האחרונה. במהלך הליך זה, המבנה עשוי להיות אטום יותר להתכווץ מעט.
הערה: משכי זמן וחזרות אלה מוטבו אך ייתכן שיהיה צורך להתאים אישית את מתנול ואת ההליכים הבאים של מתיל סליצילאט, בהתאם לפורמט התרבות הספציפי וכתמים. - מיד לאחר הסרת מתנול, להוסיף מתיל סליצילט להטביע את VHSE ב 5 x 5 דקות טבילות. החלף באופן מלא את ריאגנט לאחר כל טבילה ולהשאיר את VHSE בפתרון טבילה 5 לאחסון. במהלך הליך זה, המבנה הופך להיות שקוף.
- תמונה המבנה או לאחסן ב 4 °C (69 °F). לאחר הסליקה, להשלים את כל ההדמיה בהקדם האפשרי, כמו פלואורופורים עלול להשפיל מתיל סליצילט בתוך ימים. הסליקה גורמת למבנים להיות שבירים והאחסון המורחב, למרות שלא מומלץ, זקוק לבדיקה קבועה כדי לוודא שיש כמות מספקת של מתיל סליצילט.
7. הדמיה קונפוקלית של מבנים תלת-ממדיים
הערה: הדמיה באמצעות פלסטיק תרבית רקמות לא תניב את אותה איכות תמונה כמו הדמיה באמצעות זכוכית coverslip, שיטה זו מתארת ייצור של באר זכוכית תחתית מותאמת אישית כדי למנוע ייבוש במהלך הדמיה confocal. בדרך כלל, זה מספיק לפחות 3 שעות של הדמיה.
- יומיים לפני ההדמיה: הכינו פוליאדימיאתילסילוקסן (PDMS)
- הכן PDMS48,63,64 בריכוז מוצע של [9:1], בסיס: crosslinker. הכן 30 גרם של PDMS סה"כ: 27 גרם של רכיב בסיס ו 3 גרם של crosslinker. מניחים כל כלי ערבוב נקי על איזון שקילה ו tare את קנה המידה. הוסף את הבסיס (27 גרם) ולאחר מכן הוסף את crosslinker (3 גרם) כדי להשיג סך של 30 גרם. הוסף תמיד בסיס לפני קישור צולב.
- מערבבים את הפתרון במרץ לפחות 4 דקות; זה ייצור בועות קטנות. לאחר ערבוב מספיק, יוצקים את ה-PDMS לתבשיל פטרי 100 מ"מ, או למיכל חום שטוח ושטוח דומה.
- בטלו את הגז של ה-PDMS בתא ואקום עד שכל הבועות מהערבוב ייעלמו ו-PDMS יהיה ברור. שחררו את הוואקום באיטיות והסירו את ה-PDMS (לאט). מניחים את המנה לתוך תנור לרפא לילה (50-60 מעלות צלזיוס); ודאו שהמנה יושבת שטוחה כדי ש-PDMS תרפא באופן שווה.
הערה: לאחר ריפוי, PDMS צריך להיות ברור ואת פני השטח צריך להיות חלק ולא דביק (דביק עשוי להצביע על ערבוב לקוי).
- יום אחד לפני ההדמיה: PDMS הכנה טובה
- באמצעות אגרוף פלדה או סכין דיוק כף יד, אגרוף או לגזור באר עגולה מגיליון PDMS מוכן 7.1. הבאר צריכה להיות בערך באותו גודל כמו מבנה VHSE. חותכים תיקון מרובע סביב הבאר המעגלית כדי ליצור באר PDMS אחת. הסכום של 30 גר' PDMS שהוכן אמור להניב לפחות ארבע בארות מותאמות אישית.
הערה: באר PDMS חייבת להיות קרובה לגודל מבנה ה- VHSE. זה חייב להגביל את תנועת הדגימה במהלך ההדמיה. בארות מרובות יכול להיות מפוברק בבת אחת ומאוחסן ללא הגבלת זמן במיכל נקי. - באמצעות כיסוי זכוכית בגודל דומה לבאר PDMS, מוסיפים דבק ציאנואקרילאט (למשל, דבק סופר) למשטח התחתון של ה- PDMS (המשטח החלק שהיה במגע עם צלחת פטרי) ומרוחים באופן שווה עם קצה פיפטה חד פעמי. מרכז, ולחץ על PDMS היטב על הזכוכית תוך השארת חלון זכוכית ברור בתוך העיגול מנוקב (ודא הדבק אינו מרוח על חלון הצפייה).
הערה: אם זמין, מליטה פלזמה של PDMS כדי coverslip היא חלופה65,66,67. - תן את הדבק יבש במשך כמה שעות, או לילה, לפני השימוש. אלה הם לשימוש חוזר עד שהם לשבור מבלאי רגיל.
הערה: לא מומלץ להכתים את הדגימות ב- PDMS המודבק המשמש היטב להדמיה. בארות אלה להחזיק נוזל במשך כמה שעות אבל יכול לדלוף במהלך כתמים ארוכים יותר.
- באמצעות אגרוף פלדה או סכין דיוק כף יד, אגרוף או לגזור באר עגולה מגיליון PDMS מוכן 7.1. הבאר צריכה להיות בערך באותו גודל כמו מבנה VHSE. חותכים תיקון מרובע סביב הבאר המעגלית כדי ליצור באר PDMS אחת. הסכום של 30 גר' PDMS שהוכן אמור להניב לפחות ארבע בארות מותאמות אישית.
- דימות VHSE
הערה: אם הדמיה של דגימות לא ברורות, השתמש ב- PBS כפתרון הדמיה. אם הדמיה עם דגימות מנוקות, השתמש במתיל סליצילאט (או בפתרון הסליקה שנבחר) כפתרון ההדמיה.- הוסף כמה טיפות של פתרון הדמיה לתוך PDMS היטב ולבדוק דליפות (אם יש דליפה, לתקן את זה עם נקודה / מריחה של דבק סופר cyanoacrylate או להשתמש באר אחרת).
- שמור היטב את פתרון ההדמיה ב- PDMS בעת הוספת ה- VHSE. בעזרת כפות מדידה או מלקחיים עדינים(איור 1C משלים),יש להסיר מבנה מצלחת של 12 באר ולמקם היטב את ה-PDMS על מכסה הזכוכית. מקם מבנה עם אוריינטציה של עניין מול המטרה. לדוגמה, כדי לדמיין את האפידרמיס באמצעות מיקרוסקופ הפוך, ודא שהאפידרמיס פונה כלפי מטה, לכיוון הזכוכית.
- לחלופין, עבור מיקרוסקופ זקוף, פנים האפידרמיס למעלה. הליכי ההדמיה הבאים מתוארים עבור מיקרוסקופ הפוך, אך ניתן להתאים אותם בקלות למיקרוסקופ זקוף.
הערה: היזהר בעת מניפולציה VHSE כדי למנוע נזק. העבר מעל צלחת הבאר במקרה VHSE נופל. סקופולה כפופה ושטוחה היא הדרך הקלה ביותר להעביר את המבנה (איור 1C משלים).
- לחלופין, עבור מיקרוסקופ זקוף, פנים האפידרמיס למעלה. הליכי ההדמיה הבאים מתוארים עבור מיקרוסקופ הפוך, אך ניתן להתאים אותם בקלות למיקרוסקופ זקוף.
- ודא המדגם יושב שטוח בבאר וכי אין חלקים של האפידרמיס או הדרמיס מקופלים מתחת לדגימה. במקרה של קיפול, יש לתפעל בעדינות את המדגם בעזרת מלקחיים או כפות מדידה; הוספת פתרון דימות נוסף באופן זמני כדי לצוף VHSE עשוי לעזור לו להתיישר. קיפול או קמטים של המדגם ניתן לראות בעין או באמצעות מיקרוסקופ.
- למלא את הבאר עם פתרון הדמיה, באמצעות נוזל מספיק כדי לשמור על דגימה hydrated; יותר מדי נוזלים יציפו את הדגימה, וכתוצאה מכך תנועה במהלך ההדמיה. המבנה צריך לשבת על חלון הצפייה בזכוכית; בדוק תנועה על-ידי הטיית ה-PDMS היטב. אם יש תנועה, להסיר קצת נוזל; להוסיף ולהסיר נוזל טיפה חכם עד התנועה מפסיקה.
- הנח שקופית זכוכית מעל הבאר כדי למזער את האידוי במהלך ההדמיה (איור משלים 1D). להפעלות דימות ארוכות יותר, בדוק את הדגימה לעתים קרובות כדי להבטיח רמות נוזלים נאותות. אם נגיש, תא לח במהלך ההדמיה ניתן להשתמש (אם כי זה בדרך כלל לא הכרחי).
- מניחים דגימה על במת המיקרוסקופ ותמונה דרך חלון כיסוי הזכוכית(איור משלים 1D). טכניקה זו מאפשרת לפחות 3 שעות של הדמיה קונפוקלית רציפה, אבל הידרציה של המדגם צריך להיבדק באופן קבוע, עם פתרון הדמיה הוסיף בעת הצורך.
הערה: אם המדגם נקי, מתיל סליצילט ישפיל את הדבק לאורך זמן. ניתן להחיל מחדש את הדבק המקשר בין ריצות דימות; או שניתן להעביר את הדגימה לבארות חדשות מעת לעת. בבארות עם מליטה פלזמה, זה לא יהיה בעיה. - לאחר ההדמיה, לצוף את המדגם עם נוזל הדמיה ככל האפשר בבאר. השתמשו בכף מדידה או במלקחיים עדינים כדי להעביר את הדגימה לאחסון היטב. בצע את ההעברה על צלחת באר במקרה המדגם נופל.
- ניתן להשתמש מחדש בכל באר PDMS ובכיסויי זכוכית עליונים עד שהם נשברים. זכוכית תחתונה נקייה לפני ההדמיה, הן בתוך הבאר והן מחוצה לה. לפני השימוש החוזר, תמיד לבדוק דליפות ולתקן עם דבק, לפי הצורך.
- אחסן דוגמאות כמתואר בשלב 6.3.6 והוסף PBS כל כמה חודשים לתחזוקה; אם דגימות מנוקות, לאחסן זכוכית באמצעות מתיל סליצילט ולבדוק את הרמות באופן קבוע. דגימות מנוקות עלולות להיפגע במהירות (בתוך ימים) ויש לדמותן בהקדם האפשרי.
תוצאות
כאן מוצג פרוטוקול ליצירת מקבילות עור אנושיות במבחנה (VHSE) באמצעות תעתיק הפוך של טלומראז (TERT) קרטינוציטים מונצחים (N/TERT-120,59), פיברובלסטים עוריים אנושיים בוגרים (hDF) ותאי אנדותל מיקרו-וסקולריים אנושיים (HMEC-1) ( איור1). בנוסף, האופי הניתן להתאמה אישית של פרוטוקול זה מודגש גם על ידי הפגנת יצירת VHSE ויציבות בעת שימוש פיברובלסטים ריאות זמינים בדרך כלל (IMR90) במקום hDF. יצירת ה- VHSE הושלמה בשלבים 1-4, בעוד ששלבים 5-7 הם טכניקות אופציונליות לעיבוד והדמיה של נקודות קצה שהיו ממוטבות עבור סוגי VHSEs אלה. חשוב לציין כי VHSEs ניתן לעבד על פי שאלות מחקר ספציפיות שלבים 5-7 אינם נדרשים כדי ליצור את המבנה. הדמיה נפחית, ניתוח ועיבוד תלת-ממדי הושלמו כדי להדגים שיטת ניתוח נפחית. פרוטוקולי הכנה והדמיה של מבנים נפחיים אלה משמרים את מבנה VHSE הן ברמה המיקרוסקופית והן ברמה המקרוסקופית, ומאפשרים ניתוח תלת-ממדי מקיף.
אפיון האפידרמיס והדרמיס מראה סמנים אימונופלואורסצנטיים מתאימים לעור האדם במבנים של VHSE(איור 2, 3). ציטוקרטין 10 (CK10) הוא סמן קרטינוציטה לבידול מוקדם אשר בדרך כלל מסמן את כל שכבות suprabasal בעור שווה ערך18,30,68 ( איור2). אינוולוכרין ופילגרין הם סמני בידול מאוחרים בקרטינוציטים ומסמן את השכבות העליונות ביותר של סופרבסל בעור שווה ערך12,30,68,69 ( איור2). צבע גרעיני פלואורסצנטי אדום רחוק (ראו רשימת חומרים) שימש לסימון גרעינים הן באפידרמיס והן בדרמיס, כאשר קול הרביעי מסמן את כלי הדם של הדרמיס(איור 2, איור 3, איור 4). רכיבי קרום מרתף אפידרמיס (BM) לא תמיד באים לידי ביטוי כראוי בתרבויות HSE15,16; וכתם Col IV של ה- BM אינו נצפה באופן עקבי באמצעות פרוטוקול זה. מחקר ממוקד BM רכיבים ומבנה ייהנו מדיה נוספת, תא, אופטימיזציה הדמיה14.
למרות הדמיה confocal דרך החלק הארי של תרבויות VHSE לעתים קרובות מניב תמונות ברזולוציה גבוהה כי הם מספיקים לניתוח חישובי של הדרמיס ואפידרמיס, שיטת הסליקה המתוארת מאפשרת הדמיית רקמות עמוקה יותר. סליקה משפרת את עומק חדירת לייזר confocal, הדמיה יעילה VHSEs ניתן להשיג מעל 1 מ"מ עבור דגימות פינה (לעומת ~ 250 מיקרומטר עבור לא ברור). טכניקת הסליקה המתוארת (התייבשות מתנול ומתיל סליצילאט) תואמת במידה מספקת לאינדקס שבירה לאורך רקמת דגימת VHSE61. ניקוי ה-VHSE איפשר הדמיה פשוטה לאורך כל המבנה ללא מניפולציה (למשל, ארגון מחדש של המבנה כדי לדמות את הדרמיס והאפידרמיס בנפרד),(איור 3).
תמונות נפחיות מאפשרות יצירה של עיבוד תלת-ממדי למיפוי כלי דם בכל מבנה (איור 4). בקצרה, ערכות תמונה קונפוקלית נלקחו באוריינטציה עורית לאפידרמית של מספר תת-כרכים של VHSEs לגילוי כתם קולגן IV (סימון קירות כלי) וגרעינים (המסומנים בצבע גרעיני פלואורסצנטי אדום רחוק). ערימות תמונה נטענות לתוכנה חישובית (ראה רשימת חומרים)ואלגוריתם מותאם אישית (המבוסס על מקורות אלה 48,70,71,72,73,74,75) משמש לעיבוד וכימות תלת מימדי כמתואר לעיל48. אלגוריתם זה מחלק באופן אוטומטי את רכיב כלי הדם בהתבסס על כתם Col IV. פילוח נפחי מועבר לאלגוריתם שלד המבוסס על צעידה מהירה75,76,77. השלד מוצא את המרכז הסופי של כל כלי שיט המסומן של Col IV והנתונים המתקבלים יכולים לשמש לחישוב קוטר כלי השיט וכן לשבר כלי הדם (איור 4). מיקרוסקופיה פלואורסצנטית רחבה היא אפשרות נגישה אם מיקרוסקופ סריקת לייזר אינו זמין; ניתן לדמיין את רשת כלי הדם והאפידרמיס עם מיקרוסקופיה פלואורסצנטית רחבת שדה(איור משלים 2). כימות תלת מימדי אפשרי באמצעות הדמיה רחבה של VHSEs במקום מיקרוסקופיה סריקת לייזר, למרות שזה עשוי לדרוש יותר סינון ו deconvolution של תמונות עקב אור מחוץ למישור.
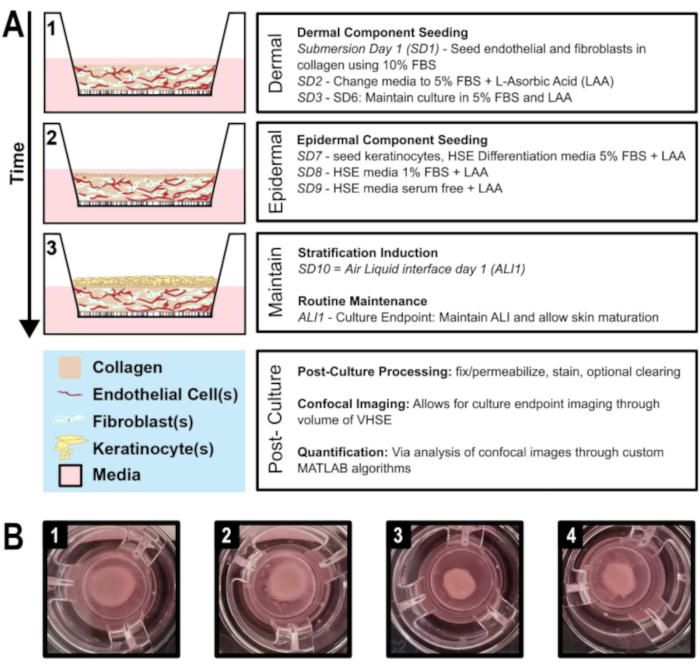
איור 1: ציר זמן סכמטי של ייצור שווה ערך לעור אנושי. א) מראה התקדמות של דגם VHSE מ 1) זריעת רכיב עורי, 2) קרטינוצייט זריעה על המרכיב העורי, 3) ריבוד אפיתל באמצעות ממשק נוזלי אוויר ותחזוקת תרבות. עיבוד פוסט-תרבותי והדמיה נפחית יכולים להתבצע בנקודת הקצה של התרבות. ב) תמונות מצלמה של מבנה מאקרו hDF VHSE בתרבות מוסיף בנקודת הקצה התרבותית שלהם, 8 שבועות. רמות שונות של התכווצות הן נורמליות עבור VHSEs; ניתן לצמצם את ההתכווצות כפי שמתארת הפרוטוקול. (1 & 2) דגימות פחות מכווצות. (3 & 4) דגימות מתכווצות נוספות עדיין מניבות רכיבי עור נאותים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
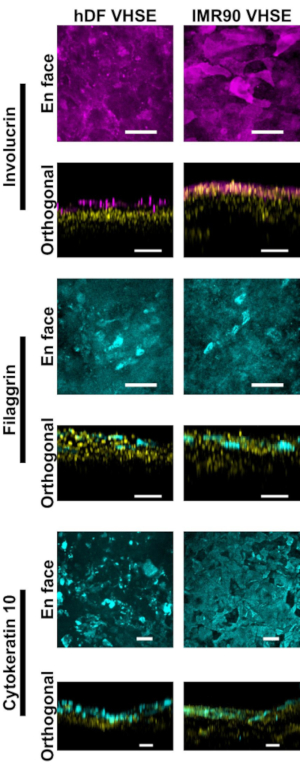
איור 2: אפיאור אפידרמיס באמצעות סמנים אימונופלואורסצנטיים. כל התמונות צולמו של VHSEs בנקודת זמן תרבות 8wk באמצעות מיקרוסקופיה confocal. שיטות הכתמה מתאימות מתוארות בפרוטוקול שלב 6. סמני אפיתל מתאימים קיימים הן ב- VHSEs של hDF (עמודה שמאלית) והן ב- VHSEs של IMR90 (עמודה ימנית). Involucrin ו Filaggrin הם סמני בידול מאוחר של קרטינוציטים ולהוכיח כי האפידרמיס הוא מרובד באופן מלא בשני סוגי VHSE. ציטוקרטין 10 הוא סמן בידול מוקדם המזהה שכבות על-פה ב- VHSEs. גרעינים מוצגים בתצוגות אורתוגונליות בצהוב. תמונות ההקרנה המקסימלית של En ו- orthogonal הוצגו באמצעות תוכנה חישובית; קנה המידה של התמונות משתנה בנפרד עם חיסור רקע וסינון חציוני לבהירות. מוטות סולם הם 100 מיקרומטר. (נוגדנים ראשוניים ומשניים עם מתכון חיץ חסימה בתוך הבית ניתנים בטבלה 3). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
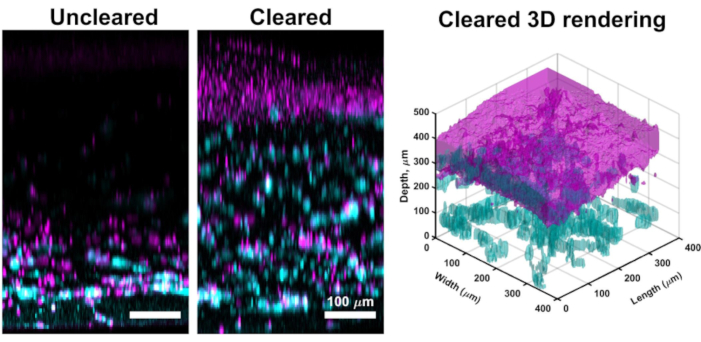
איור 3: השוואה בין VHSE לא ברור לעומת VHSE שנוקה. VHSE זה נוצר עם IMR90s ותמונות צולמו בנקודת זמן של תרבות 4wk באמצעות מיקרוסקופיה קונפוקלית. קולגן IV מוצג ציאן; גרעינים מוצגים במגנטה; מגנטה בעיבוד התלת-ממדי המנוקה מייצג איחוד של גרעינים בשכבת האפידרמיס של ה- VHSE. תמונת VHSE לא ברורה היא דוגמה של הנחתת לייזר במבנים VHSE עבה יותר, באמצעות סליקה (מתנול ומתיל salicylate) המבנה כולו יכול להיות בתמונה עם הנחתת לייזר מעט / ללא מהצד העורי של המבנה. הגדרות דימות כולל קו לייזר, רווח, חור סיכה הורדו עבור VHSE פינה כדי להפחית את רוויית יתר. הסליקה וההדמיה הושלמו כמתואר בשלבים 6 & 7 בפרוטוקול. תמונות הקרנה מרביות אורתוגונליות ועיבוד תלת-ממדי הושלמו עם תוכנה חישובית, עיבוד תלת-ממדי נוצר מתמונות בנייה מנוקות. קנה המידה של התמונות משתנה בנפרד עם חיסור רקע וסינון חציוני לבהירות. סרגלי קנה המידה הם 100 מיקרומטר.
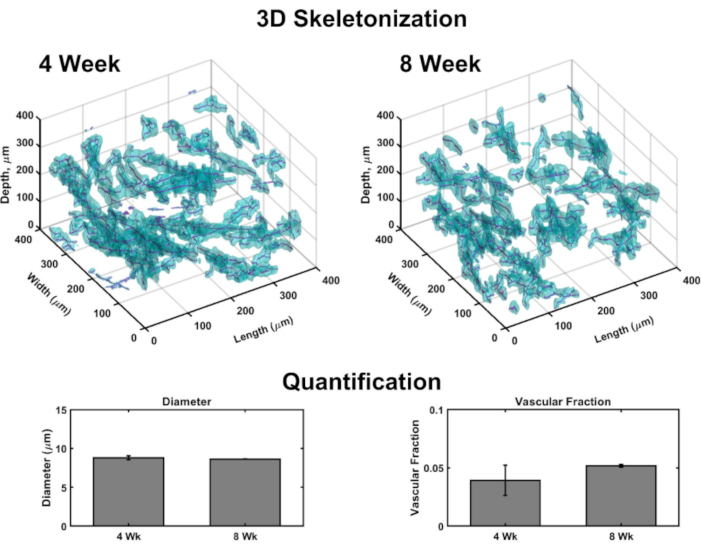
איור 4: ניתוח תלת מימדי של כלי דם בתוך VHSEs. תמונות נפחיות שצולמו באמצעות מיקרוסקופיה קונפוקלית מאפשרות כימות פרמטרי כלי דם בנקודות הקצה של התרבות באמצעות ניתוח תמונה חישובית. מתת-כרכים של VHSE, זיהוי כתם קולגן IV (ציאן) מסמן קירות אנדותל של כלי הדם ומאפשר פילוח של כלי דם בהתבסס על מיקום קולגן IV; לאחר מכן נתוני הפילוח הם שלד, ומרכז כל כלי נמצא (מגנטה). דוגמאות לשלד תלת-ממדי מוצגות עבור דגימות IMR90 VHSE של 4 שבועות ו- 8 שבועות, ללא ניקוי. נתונים שהתקבלו של ערכת ניסויים של IMR90 VHSE שימשו לחישוב קטרים של כלי הדם ואת שברי כלי הדם עבור ארבעה תת-כרכים (כל 250 מיקרומטר בכיוון z) בתוך כל מבנה, הנתונים היו ממוצעים לכל VHSE וממוצע נוסף לכל נקודת זמן של תרבות. נתונים אלה מראים את הומאוסטזיס רשת כלי הדם פורש 4 ו 8 שבועות משכי תרבות עם קטרים רלוונטיים עור אנושי vivo78, ואת שבר כלי הדם באותו סדר כמו עור אנושי vivo79 (שבר כלי דם במבני קולגן הוכח להיות להתאמה אישית48 והוא יכול להיות אופטימיזציה נוספת עבור ערכים מוגברים). הנתונים מיוצגים כאמצעי ± ממוצע שגיאת תקן (S.E.M); n = 3 עבור כל נקודת זמן. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| מדיה | רכיבים |
| קו תאים פיברובלסט עורי אנושי (hDF) | DMEM HG |
| 5% סרום שור עוברי (FBS) | |
| 1% פניצילין/סטרפטומיצין (P/S) | |
| קו תאים פיברובלסט IMR90 | F12 של DMEM/HAM 50:50 |
| 10% FBS | |
| 1% P/S | |
| קו תא אנדותל HMEC-1 | מדיום בסיס MCDB131 |
| 10% FBS | |
| 1% P/S | |
| ל-גלוטמין [10 מ"מ] | |
| גורם גדילה אפידרמלי (EGF) [10 ng/mL] | |
| הידרוקורטיזון [10 מיקרוגרם/ מ"ל] | |
| קו תאים N/TERT-1 קרטינוציט | בסיס מדיה של K-SFM |
| 1% P/S | |
| תמצית בלוטת יותרת המוח שור (BPE) [25 מיקרוגרם / מ"ל], מתוך ערכת תוספת K-SFM | |
| גורם גדילה אפידרמלי (EGF) [0.2 ng/mL], מערכת תוספת K-SFM | |
| CaCl2 [0.3 מ"מ] | |
| בידול שווה ערך לעור האדם (HSE) | 3:1 DMEM: F12 של האם |
| 1% P/S | |
| 0.5 מיקרומטר הידרוקורטיזון | |
| 0.5 מיקרומטרנול מיקרומטרנול | |
| 0.5 מיקרוגרם / מ"ל אינסולין |
טבלה 1: מתכוני מדיה. מתכוני מדיה לתרבות דו-ממדית של הפיברובלסטים העוריים האנושיים, פיברובלסטים IMR90, HMEC-1 ו- N/TERT-1 קרטינוציטים ניתנים. מתכונים אלה שימשו להרחבת קווי התאים לפני יצירת VHSEs. מדיית בידול שווה ערך לעור אנושי (HSE) משמשת ליצירת סוגי VHSEs; מתכון בסיס ניתן, במהלך מנות של תרבות טבילה אינדוקציה ריבוד, כמויות מתחדדות של FBS יש להוסיף כמתואר בפרוטוקול שלב 3. מתכון HSE המבוסס על מקורות אלה11,80.
| ריכוז מלאי קולגן (Cs) : | 8 | מ"ג/מ"ל | ||
| אמצעי אחסון רצוי (Vf): | 1 | מ"ל | ||
| נרמול התאמת NaOH*: | 1 | X | ||
| *כל הרבה קולגן צריך להיבדק כדי לקבוע את כמות NaOH הדרושה כדי להגדיר pH 7 - 7.4 | ||||
| ריכוז קולגן רצוי (מ"ג/מ"ל) | ||||
| 2 | 3 | 4 | 5 | |
| 10X PBS (V pbs) | 0.1 | 0.1 | 0.1 | 0.1 |
| מניית קולגן (Vs) | 0.25 | 0.375 | 0.5 | 0.625 |
| 1N נאוה (VNaoh) | 0.00575 | 0.008625 | 0.0115 | 0.014375 |
| מדיה (V מדיה) | 0.64425 | 0.516375 | 0.3885 | 0.260625 |
טבלה 2: טבלת הפניות לחישוב קולגן. טבלת הפניות נותנת ריכוזי קולגן הרצויים בדרך כלל מחושב בהנחה ריכוז מלאי קולגן 8 מ"ג / מ"ל ונפח הסופי הרצוי של 1 מ"ל; כל הערכים נמצאים ב- mL. המשוואות המשמשות לחישוב סכומים אלה ניתנות בשלב 2.2 של הפרוטוקול. חשוב לבדוק pH עבור כל מניית קולגן; במידת הצורך, יש להוסיף כמויות NaOH כדי להשיג pH 7 - 7.4 (לאחר PBS, NaOH, מלאי קולגן, מדיה מתווספים). הפרוטוקול עבר אופטימיזציה עבור VHSEs באמצעות ריכוז קולגן 3 מ"ג / מ"ל; שינויים בריכוז הקולגן עשויים להיות נחוצים עבור קווי תאים שונים / תוצאות סוף רצויות48.
| נוגדן ראשוני | מקור | ריכוז | שימוש |
| פילגרין (AKH1) עכבר חד שבטי IgG | סנטה קרוס; sc-66192 (200 מיקרוגרם/ מ"ל) | [1:250] | סמן בידול מאוחר15 |
| ארנב אינוולוקרין פוליקלונל IgG | פרוטאיטק; 55328-1-AP (30 מיקרוגרם/150 μL) | [1:250] | סמן בידול מסוף מאוחר15 |
| ציטוקרטין 10 (DE-K10) עכבר IgG, על טבעי | סנטה קרוס; sc-52318 | [1:350] | סמן אפידרמיס סופרבסל14,36,59 |
| פוליקלונל ארנב קולגן IV | פרוטאיטק; 55131-1-AP | [1:500] | קיר כלי דם אנדותל67 |
| דראק 7 | איתות תאים; 7406 (0.3 מ"מ) | [1:250] | סמן גרעיני |
| נוגדן משני | מקור | ריכוז | שימוש |
| עז נגד ארנב IgG DyLight™ 488 מצומד | אינוויטרוגן ( Invitrogen ; 35552 (1 מ"ג/מ"ל) | [1:500] | קולגן IV משני |
| נוגדן IgG נגד ארנבות (H&L), DyLight™ 549 מצומד | רוקלנד אימונוכימיה; 611-142-002 | [1:500] | אינוולוקרין משני |
| עז נגד עכבר IgG (H&L), DyLight™ 488 | תרמו סיינטיפיק; 35502 (1 מ"ג/מ"ל) | [1:500] | פיגרין או ציטוטוקרטין 10 משני |
| חוצץ חסימה (500 מ"ל) | |||
| מגיב | כמות | ||
| ddH2O | 450 מ"ל | ||
| 10 x PBS | 50 מ"ל | ||
| שור סרום אלבומין (BSA) | 5 גר' | ||
| טווין 20 | 0.5 מ"ל | ||
| ג'לטין דגים במים קרים | 1 גרם | ||
| נתרן אזיד (10% נתרן אזיד ב- diH2O) | 5 מ"ל (0.1 % ריכוז סופי) | ||
טבלה 3: נוגדנים ראשוניים ומשניים עם מתכון חיץ חסימה. הנוגדנים והכתמים הכימיים הרשומים שימשו לכתמים המוצגים באיור 2, איור 3, איור 4. הכתם הושלם כפי שניתן בפרוטוקול שלב 6 באמצעות מתכון חיץ החסימה המפורטים כאן. כמה אופטימיזציות של ריכוזי הכתמים ואת משך הזמן עשוי להידרש בהתאם טכניקות התרבות שנבחרו ואת קווי התא.
טבלה משלימה 1: רשימת קיצורים. רשימת קיצורים הכלולה לנוחיות הקורא. אנא לחץ כאן כדי להוריד טבלה זו.
איור משלים 1: סיוע טכני VHSE לטיפול. הטיפול ב- VHSEs מאתגר במיוחד במהלך קיבוע, עיבוד וכתמים. A-D מתאים להוראות בשלבים 5-7. A מראה את הטיפול הטכני של הסרת קרום נקבובי מתוך הכנס תרבות כדי להבטיח כתמים נאותים. B מראה כיצד לשמור על כל VHSE שקוע במהלך הכתמה ואחסון. C מציג את הדרך הבטוחה והקלה ביותר להעביר מבנים לבארות הדמיה PDMS. D מציג VHSE יושב היטב הדמיה PDMS: PDMS גם מודבק שקופית זכוכית בתחתית, יצירת חלון הדמיה, שקופית זכוכית ממוקם על גבי כדי לשמור על הלחות באמצעות ריצות הדמיה ארוכות. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 2: מיקרוסקופיית פלואורסצנטיות רחבה סטנדרטית יכולה לשמש להערכת VHSEs. הדמיה שדה רחב יכול לשמש הדמיה נפחית להערכה שגרתית כאשר מיקרוסקופ סריקת לייזר אינו זמין. כדוגמה, הדמיה של VHSEs הן מההיבטים האפסיים והן מההיבטים הבסיסיים מוצגת כהקרנות פני en ואורתוגונליות (Ortho.) מרביות. (למעלה) האפידרמיס צולם באמצעות אינוולוקרין וגרעינים כסמנים. (למטה) כלי דם עוריים תדמו באמצעות קולגן IV כסמן. תמונות מנוכות ברקע לצורך בהירות. אור מחוץ למישור מוביל לממצאים "פסים" או "התלקחות" הניכרים בנופים האורתוגונליים. הדמיה שדה רחב יכול לשמש לכימות אבל עשוי לדרוש עיבוד תמונה יותר. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
פרוטוקול זה הוכיח שיטה פשוטה וחוזרת על עצמה ליצירת VHSEs וניתוח תלת מימדי שלהם. חשוב לציין, שיטה זו מסתמכת על כמה טכניקות מיוחדות או חתיכות ציוד, מה שהופך אותו נגיש עבור מגוון רחב של מעבדות. כמו כן, ניתן להחליף סוגי תאים בשינויים מוגבלים בפרוטוקול, המאפשרים לחוקרים להתאים פרוטוקול זה לצרכים הספציפיים שלהם.
ג'לת קולגן נכונה היא צעד מאתגר בביסוס תרבות העור. במיוחד בעת שימוש בהכנות גסות ללא טיהור, מזהמי עקבות יכולים להשפיע על תהליך הג'לציה. כדי להבטיח עקביות, יש לבצע קבוצות ניסויים עם אותו מלאי קולגן שישמש לייצור VHSE. כמו כן, הג'לציה צריכה להתרחש באופן אידיאלי ב- pH של 7-7.4, ומזהמי עקבות עשויים להזיז את ה- pH. לפני השימוש בכל מלאי קולגן, ג'ל תאי בפועל צריך להיעשות בריכוז הרצוי ואת ה- pH צריך להימדד לפני ג'ל. השלמת בדיקת איכות קולגן זו לפני תחילת זריעת רכיב עורי תזהה את הבעיות עם ג'לציה נכונה והומוגניות קולגן לפני הקמת ניסוי מלא. במקום לזרוע קולגן תאי ישירות על תוסף תרבות, זרעו קולגן על רצועת pH שמעריכה את כל סולם ה-pH ולאמת pH של 7-7.4. ג'לציה ניתן להעריך על ידי החלת טיפה של פתרון ג'ל קולגן על כיסוי או רקמה תרבות פלסטיק צלחת היטב (צלחת היטב מומלץ לדמות את הצדדים מוגבלים של הכנס תרבות). לאחר זמן הג'לציה, הקולגן צריך להיות מוצק, כלומר, זה לא צריך לזרום כאשר הצלחת מוטה. תחת מיקרוסקופיית ניגוד פאזה, הקולגן צריך להיראות הומוגני וברור. בועות מזדמנות של זריעת קולגן הן כתמים אמורפיים רגילים אך גדולים של קולגן אטום בתוך הג'ל הצלול מצביעות על בעיה-סבירה בשל ערבוב לא מספיק, pH שגוי, ו / או כישלון לשמור על קולגן מצונן במהלך ערבוב.
ייתכן שכמויות הזרמת התאים והמדיה מותאמות. בפרוטוקול לעיל, כמויות התאים שעברו אנקפסולציה עברו אופטימיזציה להוספת 12 באר ב- 7.5 x 104 פיברובלסטים ו- 7.5 x 105 תאי אנדותל ל- mL של קולגן עם 1.7 x 105 קרטינוציטים שנזרעו על גבי המבנה העורי. צפיפות התאים עברה אופטימיזציה לפרוטוקול VHSE זה בהתבסס על המחקרים הראשוניים והמחקר הקודם החוקר את ייצור רשת כלי הדם בתלת-ממד בריכוזי קולגן שונים48 ודור HSE22,80,81. במערכות דומות, צפיפות תאי האנדותל שפורסמה היא 1.0 x 106 תאים / מ"ל קולגן48; ריכוזי פיברובלסט לעתים קרובות נע בין 0.4 x 105 תאים / מ"ל של קולגן22,28,82 כדי 1 x 105 תאים / מ"ל של קולגן8,58,83,84,85; וריכוזי הקרטינוציט נעים בין 0.5 x 105 [תאים/ס"מ2]80 עד 1 x 105 [תאים/ס"מ2]8. צפיפות תאים יכולה להיות ממוטבת עבור תאים ספציפיים ושאלת מחקר. תרבויות תלת מימדיות עם תאים מתכווצים, כגון fibroblasts, יכול להתכווץ המוביל להפחתת הכדאיות ואובדן תרבות86,87. יש להשלים ניסויים ראשוניים כדי לבדוק התכווצות של התא העורי (אשר יכול להתרחש עם תאים עוריים יותר, תאים עוריים התכווצות יותר, תרבויות טבילה ארוכות יותר, או מטריצות רכות יותר) ולבדוק כיסוי פני השטח אפידרמיס. בנוסף, מספר הימים בשקיעה ואת קצב התחדדות התוכן בסרום יכול גם להיות מותאם אישית אם התכווצות עורית מוגזמת מתרחשת או שיעור שונה של כיסוי קרטינוציטים נדרש. לדוגמה, אם התכווצות הוא הבחין במהלך התקופה של שקיעה עורית או בעוד keratinocytes יוצרים monolayer פני השטח, נע מהר יותר דרך תהליך מתחדד בסרום והעלאת VHSEs ל ALI יכול לסייע במניעת התכווצות נוספת. באופן דומה, אם כיסוי keratinocyte אינו אידיאלי, שינוי מספר הימים כי VHSE הוא שקוע ללא סרום עשוי לעזור להגדיל את כיסוי monolayer אפידרמיס ולהפחית את ההתכווצות מאז סרום נשאר בחוץ. שינויים בצפיפויות התא או הצעות אחרות לעיל חייבים להיות ממוטבים עבור תרבויות ספציפיות ויעדי מחקר.
כדי ליצור ריבוד נכון של האפידרמיס במהלך תקופת ממשק נוזלי האוויר (ALI), זה קריטי כדי לבדוק באופן קבוע ולשמור על רמות הנוזלים בכל באר, כך ALI והידרציה מתאימה של כל מבנה נשמר לאורך כל אורך התרבות. יש לבדוק ולעקוב אחר רמות המדיה מדי יום עד שייווצרו רמות ALI עקביות. שכבת האפידרמיס צריכה להיראות hydrated, לא יבש, אבל לא צריך להיות בריכות של מדיה על המבנה. במהלך ALI, המבנה יפתח צבע לבן / צהוב אטום שהוא נורמלי. שכבת האפידרמיס תתפתח בצורה לא אחידה. בדרך כלל, VHSEs מוטים עקב זריעת קולגן או התכווצות עורית. זה גם נורמלי להתבונן חלק אפידרמיס גבוה יותר באמצע המבנה במבנים קטנים יותר (24 גודל טוב) היווצרות רכס סביב ההיקף של VHSE ב 12 גודל טוב. התכווצות המבנים13 עשויה לשנות תצורות טופוגרפיות אלה, ו/או שלא ניתן לצפות בהן כלל.
כתמים והדמיה של VHSEs מציג מניפולציה מכנית VHSEs. חשוב מאוד לתכנן ולהגביל את המניפולציה של כל תרבות. כאשר יש צורך במניפולציה, לשמור על תנועות עדינות בעת הסרת VHSEs מן הקרומים הכנס, בעת הוספת פתרונות כתמים או לשטוף למשטח הבנייה, וכאשר הסרת והחלפה VHSEs בבארות אחסון / הדמיה שלהם במהלך הכנת הדמיה. באופן ספציפי, השכבות apical של רכיב האפידרמיס עשוי להיות שביר נמצאים בסיכון של sloughing את שכבות אפידרמיס הבסיס. שכבות apical של האפידרמיס הם שבירים לעבור desquamation אפילו ברקמה מקומית4, אבל לניתוח מדויק של מבנה האפידרמיס חשוב למזער נזק או אובדן. אם שכבות אפידרמיס להרים את המבנה, הם יכולים להיות בתמונה בנפרד. השכבות הבסיסיות של האפידרמיס ככל הנראה עדיין מחוברות לדרמיס בעוד שחלקים מהשכבות האפיקליות עשויות להתנתק. להדמיה של האפידרמיס, כתם גרעיני מועיל בהתבוננות זו מאז גרעינים צפופים הוא מאפיין של שכבות נמוכות ובינוניות של האפידרמיס.
הדמיה Confocal של VHSE לאחר הקיבעון נדון בפרוטוקול, אבל אפשר גם לדמיין את VHSEs לאורך כל התרבות באמצעות טומוגרפיה קוהרנטיות אופטית מבוססת זקוף (OCT)88,89,90,91,92,93. VHSE יציבים מספיק כדי לעמוד בהדמיה ללא דגירה או לחות למשך שעתיים לפחות ללא השפעות מורגשות. כמו OCT הוא תווית חינם ולא פולשני, ניתן לעקוב אחר עובי האפידרמיס במהלך התבגרות. סביר להניח שניתן יהיה להעסיק גם אופני הדמיה לא פולשניים אחרים.
הדמיה נפחית של המבנים העוריים והאפידרמליים המשולבים יכולה להיות מאתגרת עקב הנחתת לייזר עמוק יותר ב- VHSE. ניתן למתן זאת על ידי הדמיית המבנה בשני כיוונים, מהצד האפידרמלי (איור 1) ומהצד העורי (איור 2), המאפשר רזולוציה טובה של מבני כלי דם עוריים והאפידרמיס. בנוסף, ניתן לנקות את המדגם, המאפשר תמונות נפחיות של המבנה כולו עם הנחתה מינימלית. עם זאת, נעשה ניסיון למספר שיטות סליקה, אולם שיטת מתנול/מתיל סליצילאט המתוארת הניבה את התוצאות הטובות ביותר. חוקרים המעוניינים אופטימיזציה של שיטות סליקה אחרות מופנים כלפי ביקורות אלה49,61,62. במקרה של סליקה, מומלץ לדמות את הדגימה במלואה לפני הסליקה, שכן השיטה עלולה לגרום נזק לפלואורופורים ו/או למבנה. כמו כן, יש להשלים את ההדמיה בהקדם האפשרי לאחר הסליקה, שכן הפלואורסצנטיות עלולה לדעוך בתוך ימים.
עבור פשטות ונגישות, פרוטוקול זה השתמש בתערובות המדיה הפשוטות ביותר שנמצאו בספרותהקודמת 11,80. למרות שיש יתרונות רבים לשימוש בתערובות מדיה פשוטות, המגבלות של בחירה זו מוכרות גם כן. קבוצות אחרות חקרו את ההשפעות של רכיבי מדיה ספציפיים על בריאות האפידרמיס והדרמלית ומצאו כי תוספי מדיה אחרים94, כגון חומצות שומן / שומנים חופשיים חיצוניים, לשפר את הקרנית השכבה של האפידרמיס ולשפר את תפקוד מחסום העור. למרות הסמנים האימונופלואורסצנטיים שלנו מראים בידול וריבוד מתאימים באפידרמיס, בהתאם למחקרים המתבצעים, ייתכן שיהיה צורך באופטימיזציה נוספת של המדיה. יתר על כן, ניתוח מקיף של BM אפידרמיס לא נערך בעת הערכת VHSEs המוצגים כאן. השלמות של BM היא אינדיקציה חשובה של שווה ערך לעור; קבוצות שונות עשו מחקר על משך התרבות והשפעתה על סימוני BM95, כמו גם ניתוח של נוכחות פיברובלסט והשפעות גורם גדילה הוסיף על ביטוי BM14. חשוב לציין כי יש להעריך ולמטב ניתוח של רכיב BM בעת שימוש בפרוטוקול זה.
בפרוטוקול זה מתואר הליך עבור יצירת VHSE, המדגים תוצאות לאחר 8 שבועות ב ALI. תרבויות VHSE כבר מתורבת עד 12 שבועות ב ALI ללא שינוי מורגש או אובדן הכדאיות, וזה אפשרי כי הם עשויים להיות קיימא יותר. חשוב לציין, פרוטוקול זה ניתן להתאמה בקלות לסוגי תאים זמינים בדרך כלל, כפי שהוכח על ידי החלפת fibroblasts עורי עם FIBROBLasts ריאות IMR90. בהתאם לצורך של החוקר ולמשאבים הזמינים, ניתן להתאים את סוגי התאים והתמזגויות המדיה בתרבות, אם כי סוגי תאים שונים יותר עשויים לדרוש אופטימיזציה של מדיה. לסיכום, הליכים אלה נועדו לספק בהירות על התרבות של VHSEs לחקר ביולוגיה של העור ומחלות. כדי למקסם את הנגישות, הפרוטוקול פותח זה פשוט וחזק באמצעות ציוד משותף, קווי תאים, ריאגנטים כגישה יעילה מינימלית שניתן להתאים אישית עוד יותר לצרכים הספציפיים של מחקרים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מודים לד"רג'ים ריינוולד 59 ולד"ר אלן ה. ואן דן בוגארד20 על מתנתם הנדיבה של קווי תאים N/TERT. עבודה זו נתמכה על ידי איגוד הלב האמריקאי (19IPLOI34760636).
Materials
| Name | Company | Catalog Number | Comments |
| 1 N NaOH | Fisher Chemical | S318-100 | (Dilute from Lab stock) |
| 4% Paraformaldehyde | ACROS Organics | #41678-5000, Lot # B0143461 | Made up using solid Paraformaldehyde in PBS, pH adjusted to 6.9 |
| Autoclaved forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| CaCl2 | Fisher bioreagents | Cat # BP510-250, Lot # 190231 | Rnase, Dnase, Protease-Free |
| Cell line, Endothelial: Microvascular Endothelial Cell (HMEC1) | ATCC | CRL-3243 | SV40 Immortalized microvascular endothelial cell. Note that 750,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: dermal Human fibroblast, adult | ATCC | PCS-201-012 | Primary dermal cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: human lung firbroblast (IMR90) | ATCC | CCL-186 | Primary embryonic cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Keratinocyte: N/TERT-1 | Immortalized via hTERT expression. N/TERT-1 was made using a retroviral vector conferring hygromycin resistance. Cell line established by Dickson et al. 2000. Can be replaced with ATCC PCS-200-010 or PCS-200-011. Note that 170,000 cells were used per construct; N/TERT1 cells must be used from plates that are 30% confluent- two 30% confluent 90 mm tissue culture dishes give more than enough cells.The authors thank Dr. Jim Rheinwald and Dr. Ellen H. van den Bogaard for their generous gift of N/TERT cell lines. | ||
| Centrifuge | Thermo Scientific; Sorvall Legend X1R | (standard lab equipment) | |
| Computational Software | MATLAB | MATLAB 2020a | MathWorks, Natick, MA. |
| Confocal Microscope | Leica TCS SPEII confocal | Laser scanning confocal. Can be replaced with other confocals or deconvolution microscopy. | |
| Cover Glass (22 x 22) | Fisher Scientific | 12-545F | 0.13-0.17 mm No.1 Thickness |
| Cyanoacrylate super glue or silicone grease | Glue Masters | #THI0102 | Glue Masters, THICK, Instant Glue, Cyanoacrylate; super glue is preferred |
| DMEM media base | Corning; Mediatech, Inc | REF # 10-013-CM; Lot # 26119007 | DMEM, 1X (Dulbecco's Modification of Eagle's Medium) with 4.5 g/L glucose, L-glutamine & sodium pyruvate |
| DMEM/F-12 50/50 | Corning; Mediatech, Inc | REF # 10-090-CV; Lot # 21119006 | DMEM/F-12 50/50, 1X (Dulbecco's Mod. Of Eagle's Medium/Ham's F12 50/50 Mix) with L-glutamine |
| Ethanol | Decon Labs | #V1101 | (standard lab reagent) |
| Fetal Bovine Serum | Fisher Scientific | Cat # FB12999102, Lot # AE29451050 | Research Grade Fetal Bovine Serum, Triple 0.1 um sterile filtered |
| Fine tip forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| Human Epidermal Growth Factor (EGF) | Peprotech | Cat # AF-100-15-1MG, Lot # 0318AFC05 D0218 | Made up in 0.1% BSA in PBS |
| Hydrocortisone | Alpha Easar | Lot # 5002F2A | made up in DMSO |
| Insulin (human) | Peprotech | Lot # 9352621 | |
| Inverted Light/Phase Contrast Microscope | VWR | 76317-470 | (standard lab equipment) |
| Isoproterenol | Alfa Aesar | #AAJ6178806 | DL-Isoproterenol hydrochloride, 98% |
| Keratinocyte-SFM (1x) media base | Gibco; Life Technologies Corporation | REF #: 10724-011; Lot # 2085518 | Keratinocyte-SFM (1X); serum free medium |
| L-Ascorbic Acid | Fisher Chemical | Cat # A61-100, Lot # 181977, CAS # 50-81-7 | Crystalline. L-Ascorbic acid can also be purchased as a salt |
| L-glutamine (solid) | Fisher Bioreagents | CAT # BP379-100, LOT # 172183, CAS # 56-85-9 | L-Glutamine, white crystals or Crystalline powder |
| MCDB 131 media base | Gen Depot | CM034-050, Lot # 03062021 | MCDB 131 Medium Base, No L-Glutamine, sterile filtered |
| Metal punches | Sona Enterprises (SE) | 791LP, 12PC | Hollow Leather Punch Set, High Carbon Steel, Hardness: 48HRC; (various sizes including): 1/8", 5/32", 3/16", 7/32", 1/4", 9/32", 5/16", 3/4", 7/16", 1/2", 5/8:, 3/4". This punch set is helpful, but x-acto knife can work as well. Size of metal punch that works well for 12 well transwell VHSE is 3/8" or 1/2". |
| Methanol | Fisher Chemical | CAS # 67-56-1 | (optional). For clearing dehydration step. |
| Methyl Salicylate | Fisher Chemical | O3695-500; Lot # 164535; CAS # 119-36-8 | (optional). For clearing. |
| Microtubes, 1.7 mL | Genesee Scientific Corporation; Olympus Plastics | Cat # 24-282; Lot # 19467 | 1.7 ml Microtubes, Clear; Boilproof, Polypropulene, Certified Rnase, Dnase, DNA, PCR inhibitor and endotoxin-Free |
| PBS, 10x Culture grade or autoclaved | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. |
| PBS, 1x Culture grade, (-) Calcium, (-) magnesium | Genesee Scientific Corporation | Ref # 25-508; Lot # 07171015 | |
| PBS, 1x non-Culture grade | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. Dilute to 1x with water. |
| Penicillin/Streptomycin | Gibco; Life Technologies Corporation | Ref # 15140-122, Lot # 2199839 | Pen Strep (10,000 Units/mL Penicillin; 10,000 ug/mL Streptomycin) |
| Petri Dish, glass, small | Corning | PYREX 316060 | (optional). To be used as a clearing container |
| Petri Dishes, 100 mm | Fisher Scientific | FB0875713 | Use for making up PDMS. |
| Polydimethylsiloxane (PDMS) | Dow Corning | GMID 02065622, Batch # H04719H035 | Sylgard 184 Silicone Elastomer Base, Dow Corning, Midland, MI) |
| Dow Corning | GMID 02065622, Batch # H047JC4003 | DOWSIL 184, Silicone Elastomer Curing Agent | |
| note: PDMS is usually sold as a kit that includes both the base and curing agent components. | |||
| Positive Displacement Pipettes (1000 & 250 uL) | Gilson | 1000 uL: HM05136, M1000. 250 uL: T12269L | M1000 pipette capacity (100-1000 uL); M250 pipette capacity to 250 uL |
| Positive Displacement Tips/Pistons (1000 & 250 uL) | Gilson | 1000 uL: CAT # F148180, BATCH # B01292902S; 250 uL: CAT # F148114, BATCH # B05549718S | Sterilized capillaries and pistons |
| Round tipped scoopula | (optional; standard lab equipment) For manipulation of VHSEs prior to imaging | ||
| Supplements for Keratinocyte-SFM media | Gibco; Life Technologies Corporation | Ref # 37000-015, Lot # 2154180 | Contains EGF Human Recombinant (Cat # 10450-013), Bovine Pituitary Extract (Cat # 13028-014) |
| Tissue Culture Plate Inserts, 12 well size, 3 µm pore size | Corning; Costar | REF # 3462 - Clear; Lot # 14919057 | Transwell; 12 mm Diameter Inserts, 3.0 um pore size, tissue culture treated, polyester membrane, polystyrene plates, |
| Tissue Culture Plates, 12 well size | Greiner Bio-one; CellStar | Cat # 665 180; Lot # E18103QT | 12 well cell culture plate; sterile, with lid; products are sterile, free of detectable Dnase, Rnase, human DNA and pyrogens. Contents non-cytotoxic |
| Tissue Culture Plates, 60.8cm^2 growth area | Genesee Scientific Corporation | Cat # 25-202; Lot No: 191218-177B | Tissue culture dishes; treated, growth area 60.8 cm^2; sterile, Dnase, Rnase, Pyrogen Free; virgin polystyrene |
| Triton x 100 | Ricca Chemical Company | Cat # 8698.5-16, Lot # 4708R34 | Wetting agent |
| Trypsin 0.25% | Corning; Mediatech, Inc | Ref # 25-053-CI | 0.25% Trypsin, 2.21 mM EDTA, 1x [-] sodium bicarbonate |
| Type 1 Collagen isolated from Rat tail | Pel-Freez Biologicals | 56054-1 | Sprauge-Dawley rat tails can be purchased frozen from Pel-Freez or other suppliers. Collagen can be isolated from the tail tendons. Isolation Protocol references [Cross et al.,2010; Rajan et al.,2007; Bornstein, 1958] .Alternatively, high concentration rat-tail collagen can be purchased from suppliers including Corning (Catalog Number: 354249) |
| Vaccum chamber, benchtop | Bel-Art | F42010-0000 | (standard lab equipment) |
| Handheld Precision knife | X-Acto | X3311 | (X-Acto knife optional if purchased steel punches) |
References
- Stojic, M., et al. Skin tissue engineering 3. Biomaterials for Skin Repair and Regeneration. , 59(2019).
- Shevchenko, R. V., James, S. L., James, S. E. A review of tissue-engineered skin bioconstructs available for skin reconstruction. Journal of The Royal Society Interface. 7 (43), 229-258 (2010).
- Kolarsick, P. A. J., Kolarsick, M. A., Goodwin, C. Anatomy and Physiology of the Skin. Journal of the Dermatology Nurses' Association. 3 (4), (2011).
- McGrath, J. A., Eady, R. A. J., Pope, F. M. Anatomy and organization of human skin. Rook's textbook of dermatology. 10, 9781444317633(2004).
- Zomer, H. D., Trentin, A. G. Skin wound healing in humans and mice: Challenges in translational research. Journal of Dermatological Science. 90 (1), 3-12 (2018).
- Zhang, Z., Michniak-Kohn, B. B. Tissue Engineered Human Skin Equivalents. Pharmaceutics. 4 (1), (2012).
- Oh, J. W., Hsi, T. -C., Guerrero-Juarez, C. F., Ramos, R., Plikus, M. V. Organotypic skin culture. The Journal of investigative dermatology. 133 (11), 1-4 (2013).
- El-Ghalbzouri, A., Gibbs, S., Lamme, E., Van Blitterswijk, C. A., Ponec, M. Effect of fibroblasts on epidermal regeneration. British Journal of Dermatology. 147 (2), 230-243 (2002).
- Sun, T., Haycock, J., MacNeil, S. In situ image analysis of interactions between normal human keratinocytes and fibroblasts cultured in three-dimensional fibrin gels. Biomaterials. 27 (18), 3459-3465 (2006).
- Kreimendahl, F., et al. Macrophages significantly enhance wound healing in a vascularized skin model. Journal of Biomedical Materials Research Part A. 107, 1340-1350 (2019).
- El Ghalbzouri, A., Commandeur, S., Rietveld, M. H., Mulder, A. A., Willemze, R. Replacement of animal-derived collagen matrix by human fibroblast-derived dermal matrix for human skin equivalent products. Biomaterials. 30 (1), 71-78 (2009).
- Roger, M., et al. Bioengineering the microanatomy of human skin. Journal of Anatomy. 234, 438-455 (2019).
- Carlson, M. W., Alt-Holland, A., Egles, C., Garlick, J. A. Three-Dimensional Tissue Models of Normal and Diseased Skin. Current Protocols in Cell Biology. 41 (1), 1-17 (2008).
- El Ghalbzouri, A., Jonkman, M. F., Dijkman, R., Ponec, M. Basement Membrane Reconstruction in Human Skin Equivalents Is Regulated by Fibroblasts and/or Exogenously Activated Keratinocytes. Journal of Investigative Dermatology. 124 (1), 79-86 (2005).
- Pruniéras, M., Régnier, M., Woodley, D. Methods for cultivation of keratinocytes with an air-liquid interface. The Journal of Investigative Dermatology. 81, 1 Suppl 28-33 (1983).
- Ali, N., Hosseini, M., Vainio, S., Taieb, A., Cario-André, M., Rezvani, H. R. Skin equivalents: skin from reconstructions as models to study skin development and diseases. British Journal of Dermatology. 173 (2), 391-403 (2015).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Innovative tissue models for drug discovery and development. 69-70, 81-102 (2014).
- Mieremet, A., Rietveld, M., Absalah, S., van Smeden, J., Bouwstra, J. A., El Ghalbzouri, A. Improved epidermal barrier formation in human skin models by chitosan modulated dermal matrices. PLOS ONE. 12 (3), 0174478(2017).
- Vidal, S. E. L., Tamamoto, K. A., Nguyen, H., Abbott, R. D., Cairns, D. M., Kaplan, D. L. 3D biomaterial matrix to support long term, full thickness, immuno-competent human skin equivalents with nervous system components. Organoids and Ex Vivo Tissue On-Chip Technologies. 198, 194-203 (2019).
- Smits, J. P. H., et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models. Scientific Reports. 7 (1), 11838(2017).
- Lebonvallet, N., et al. Effects of the re-innervation of organotypic skin explants on the epidermis. Experimental Dermatology. 21 (2), 156-158 (2011).
- Van Drongelen, V., et al. Barrier Properties of an N/TERT-Based Human Skin Equivalent. Tissue Engineering Part A. 20 (21-22), 3041-3049 (2014).
- Hensler, S., Kühlbach, C., Parente, J. D., Krüger-Ziolek, S., Möller, K., Müller, M. Establishment and initial characterization of a simple 3D organotypic wound healing model. , Available from: https://opus.hs-furtwangen.de/frontdoor/index/index/docld/4852 (2018).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18 (5), 240-249 (2013).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Amelian, A., Wasilewska, K., Megias, D., Winnicka, K. Application of standard cell cultures and 3D in vitro tissue models as an effective tool in drug design and development. Pharmacological Reports. 69 (5), 861-870 (2017).
- Lu, W., et al. Mixture of Fibroblasts and Adipose Tissue-Derived Stem Cells Can Improve Epidermal Morphogenesis of Tissue-Engineered Skin. Cells Tissues Organs. 195 (3), 197-206 (2012).
- Marino, D., Luginbühl, J., Scola, S., Meuli, M., Reichmann, E. Bioengineering Dermo-Epidermal Skin Grafts with Blood and Lymphatic Capillaries. Science Translational Medicine. 6 (221), 221(2014).
- Martins-Green, M., Li, Q. -J., Yao, M. A new generation organ culture arising from cross-talk between multiple primary human cell types. The FASEB Journal. 19 (2), 222-224 (2004).
- Kim, B. S., Gao, G., Kim, J. Y., Cho, D. -W. 3D Cell Printing of Perfusable Vascularized Human Skin Equivalent Composed of Epidermis, Dermis, and Hypodermis for Better Structural Recapitulation of Native Skin. Advanced Healthcare Materials. 8 (7), 1801019(2019).
- Baltazar, T., et al. 3D bioprinting of a vascularized and perfusable skin graft using human keratinocytes. Tissue Engineering Part A. 26 (5-6), 227-238 (2019).
- Klar, A. S., et al. Tissue-engineered dermo-epidermal skin grafts prevascularized with adipose-derived cells. Biomaterials. 35 (19), 5065-5078 (2014).
- Grebenyuk, S., Ranga, A. Engineering Organoid Vascularization. Frontiers in Bioengineering and Biotechnology. 7, (2019).
- Black, A. F., Berthod, F., L'heureux, N., Germain, L., Auger, F. A. In vitro reconstruction of a human capillary-like network in a tissue-engineered skin equivalent. The FASEB Journal. 12 (13), 1331-1340 (1998).
- Huber, B., Link, A., Linke, K., Gehrke, S. A., Winnefeld, M., Kluger, P. J. Integration of Mature Adipocytes to Build-Up a Functional Three-Layered Full-Skin Equivalent. Tissue Engineering Part C: Methods. 22 (8), 756-764 (2016).
- Monfort, A., Soriano-Navarro, M., García-Verdugo, J. M., Izeta, A. Production of human tissue-engineered skin trilayer on a plasma-based hypodermis. Journal of Tissue Engineering and Regenerative Medicine. 7 (6), 479-490 (2013).
- Shamis, Y., et al. Fibroblasts derived from human embryonic stem cells direct development and repair of 3D human skin equivalents. Stem Cell Research & Therapy. 2 (1), 10(2011).
- Kim, Y., et al. Establishment of a complex skin structure via layered co-culture of keratinocytes and fibroblasts derived from induced pluripotent stem cells. Stem Cell Research & Therapy. 9 (1), 217(2018).
- Chau, D. Y. S., Johnson, C., MacNeil, S., Haycock, J. W., Ghaemmaghami, A. M. The development of a 3D immunocompetent model of human skin. Biofabrication. 5 (3), 035011(2013).
- Vanden Bogaard, E. H., et al. Crosstalk between Keratinocytes and T Cells in a 3D Microenvironment: A Model to Study Inflammatory Skin Diseases. Journal of Investigative Dermatology. 134 (3), 719-727 (2014).
- Linde, N., Gutschalk, C. M., Hoffmann, C., Yilmaz, D., Mueller, M. M. Integrating Macrophages into Organotypic Co-Cultures: A 3D In Vitro Model to Study Tumor-Associated Macrophages. PLOS ONE. 7 (7), 40058(2012).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical Advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Weinmüllner, R., et al. Organotypic human skin culture models constructed with senescent fibroblasts show hallmarks of skin aging. npj Aging and Mechanisms of Disease. 6 (1), 4(2020).
- Barker, C. L., et al. The Development and Characterization of an In Vitro Model of Psoriasis. Journal of Investigative Dermatology. 123 (5), 892-901 (2004).
- Larcher, F., Espada, J., Díaz-Ley, B., Jaén, P., Juarranz, A., Quintanilla, M. New Experimental Models of Skin Homeostasis and Diseases. Actas Dermo-Sifiliográficas (English Edition). 106 (1), 17-28 (2015).
- Varkey, M., Ding, J., Tredget, E. E. Fibrotic Remodeling of Tissue-Engineered Skin with Deep Dermal Fibroblasts Is Reduced by Keratinocytes. Tissue Engineering Part A. 20 (3-4), 716-727 (2013).
- Moulin, V. J. Reconstitution of skin fibrosis development using a tissue engineering approach. Methods in Molecular Biology. 961, Clifton, N.J. 287-303 (2013).
- Morgan, J. T., Shirazi, J., Comber, E. M., Eschenburg, C., Gleghorn, J. P. Fabrication of centimeter-scale and geometrically arbitrary vascular networks using in vitro self-assembly. Biomaterials. 189, 37-47 (2019).
- Silvestri, L., Costantini, I., Sacconi, L., Pavone, F. S. Clearing of fixed tissue: a review from a microscopist's perspective. Journal of Biomedical Optics. 21 (8), 1-8 (2016).
- Cross, V. L., et al. Dense type I collagen matrices that support cellular remodeling and microfabrication for studies of tumor angiogenesis and vasculogenesis in vitro. Biomaterials. 31 (33), 8596-8607 (2010).
- Rajan, N., Habermehl, J., Coté, M. -F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1, 2753(2007).
- Bornstein, M. B. Reconstituted rat-tail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Laboratory Investigation. 7 (2), 134-137 (1958).
- Clément, M. -V., Ramalingam, J., Long, L. H., Halliwell, B. The In Vitro Cytotoxicity of Ascorbate Depends on the Culture Medium Used to Perform the Assay and Involves Hydrogen Peroxide. Antioxidants & Redox Signaling. 3 (1), 157-163 (2001).
- Tajima, S., Pinnell, S. R. Ascorbic acid preferentially enhances type I and III collagen gene transcription in human skin fibroblasts. Journal of Dermatological Science. 11 (3), 250-253 (1996).
- Murad, S., Tajima, S., Johnson, G. R., Sivarajah, A., Pinnell, S. R. Collagen Synthesis in Cultured Human Skin Fibroblasts: Effect of Ascorbic Acid and Its Analogs. Journal of Investigative Dermatology. 81 (2), 158-162 (1983).
- Villacorta, L., Azzi, A., Zingg, J. -M. Regulatory role of vitamins E and C on extracellular matrix components of the vascular system. Vitamin E: An Overview of Major Research Directions. 28 (5), 507-537 (2007).
- Ashino, H., et al. Novel Function of Ascorbic Acid as an Angiostatic Factor. Angiogenesis. 6 (4), 259-269 (2003).
- Ponec, M., et al. The Formation of Competent Barrier Lipids in Reconstructed Human Epidermis Requires the Presence of Vitamin C. Journal of Investigative Dermatology. 109 (3), 348-355 (1997).
- Dickson, M. A., et al. Human keratinocytes that express hTERT and also bypass a p16(INK4a)-enforced mechanism that limits life span become immortal yet retain normal growth and differentiation characteristics. Molecular and Cellular Biology. 20 (4), 1436-1447 (2000).
- Johansen, C. Generation and Culturing of Primary Human Keratinocytes from Adult Skin. Journal of visualized experiments: JoVE. (130), e56863(2017).
- Richardson, D. S., Lichtman, J. W. Clarifying Tissue Clearing. Cell. 162 (2), 246-257 (2015).
- Ariel, P. A beginner's guide to tissue clearing. The International Journal of Biochemistry & Cell Biology. 84, 35-39 (2017).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502(2010).
- Ng, J. M. K., Gitlin, I., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. ELECTROPHORESIS. 23 (20), 3461-3473 (2002).
- Eddings, M. A., Johnson, M. A., Gale, B. K. Determining the optimal PDMS-PDMS bonding technique for microfluidic devices. Journal of Micromechanics and Microengineering. 18 (6), 067001(2008).
- Markov, D. A., Lillie, E. M., Garbett, S. P., McCawley, L. J. Variation in diffusion of gases through PDMS due to plasma surface treatment and storage conditions. Biomedical microdevices. 16 (1), 91-96 (2014).
- Katzenberg, F. Plasma-bonding of poly(dimethylsiloxane) to glass. e-Polymers. 5 (1), (2005).
- El Ghalbzouri, A., Lamme, E., Ponec, M. Crucial role of fibroblasts in regulating epidermal morphogenesis. Cell and Tissue Research. 310 (2), 189-199 (2002).
- Kanitakis, J. Anatomy, histology and immunohistochemistry of normal human skin. European journal of dermatology: EJD. 12 (4), 390-399 (2002).
- Kroon, D. -J. Hessian based Frangi Vesselness filter. MATLAB Central File Exchange. , Available from: https://www.mathworks.com/matlabcentral/fileexchange/24409-hessian-based-frangi-vesselness-filter (2010).
- Jerman, T., Pernuš, F., Likar, B. Špiclin Enhancement of Vascular Structures in 3D and 2D Angiographic Images. IEEE Transactions on Medical Imaging. 35 (9), 2107-2118 (2016).
- Kovesi, P. Phase Preserving Denoising of Images. signal. 4, 6(1999).
- Vincent, L. Morphological grayscale reconstruction in image analysis: applications and efficient algorithms. IEEE Transactions on Image Processing. 2 (2), 176-201 (1993).
- Xie, L., et al. Quantitative susceptibility mapping of kidney inflammation and fibrosis in type 1 angiotensin receptor-deficient mice. NMR in Biomedicine. 26 (12), 1853-1863 (2013).
- Van Uitert, R., Bitter, I. Subvoxel precise skeletons of volumetric data based on fast marching methods. Medical Physics. 34 (2), 627-638 (2007).
- Sethian, J. A. A fast marching level set method for monotonically advancing fronts. Proceedings of the National Academy of Sciences of the United States of America. 93 (4), 1591-1595 (1996).
- Sethian, J. A. Fast Marching Methods. SIAM Review. 41 (2), 199-235 (1999).
- Braverman, I. M. The Cutaneous Microcirculation. Journal of Investigative Dermatology Symposium Proceedings. 5 (1), 3-9 (2000).
- Men, S. J., Chen, C. -L., Wei, W., Lai, T. -Y., Song, S. Z., Wang, R. K. Repeatability of vessel density measurement in human skin by OCT-based microangiography. Skin research and technology: official journal of International Society for Bioengineering and the Skin (ISBS) [and] International Society for Digital Imaging of Skin (ISDIS) [and] International Society for Skin Imaging (ISSI). 23 (4), 607-612 (2017).
- Commandeur, S., Ho, S. H., de Gruijl, F. R., Willemze, R., Tensen, C. P., El Ghalbzouri, A. Functional characterization of cancer-associated fibroblasts of human cutaneous squamous cell carcinoma. Experimental Dermatology. 20 (9), 737-742 (2011).
- Thakoersing, V. S., Danso, M. O., Mulder, A., Gooris, G., Ghalbzouri, A. E., Bouwstra, J. A. Nature versus nurture: does human skin maintain its stratum corneum lipid properties in vitro. Experimental Dermatology. 21 (11), 865-870 (2012).
- Thakoersing, V. S., Gooris, G. S., Mulder, A., Rietveld, M., El Ghalbzouri, A., Bouwstra, J. A. Unraveling barrier properties of three different in-house human skin equivalents. Tissue Engineering. Part C, Methods. 18 (1), 1-11 (2012).
- Bouwstra, J. A., Groenink, H. W. W., Kempenaar, J. A., Romeijn, S. G., Ponec, M. Water distribution and natural moisturizer factor content in human skin equivalents are regulated by environmental relative humidity. The Journal of Investigative Dermatology. 128 (2), 378-388 (2008).
- Thakoersing, V. S., van Smeden, J., Mulder, A. A., Vreeken, R. J., El Ghalbzouri, A., Bouwstra, J. A. Increased Presence of Monounsaturated Fatty Acids in the Stratum Corneum of Human Skin Equivalents. Journal of Investigative Dermatology. 133 (1), 59-67 (2013).
- Smola, H., Thiekötter, G., Fusenig, N. Mutual induction of growth factor gene expression by epidermal-dermal cell interaction. The Journal of Cell Biology. 122 (2), 417(1993).
- Fluck, J., Querfeld, C., Cremer, A., Niland, S., Krieg, T., Sollberg, S. Normal Human Primary Fibroblasts Undergo Apoptosis in Three-Dimensional Contractile Collagen Gels. Journal of Investigative Dermatology. 110 (2), 153-157 (1998).
- Nakagawa, S., Pawelek, P., Grinnell, F. Long-Term Culture of Fibroblasts in Contracted Collagen Gels: Effects on Cell Growth and Biosynthetic Activity. Journal of Investigative Dermatology. 93 (6), 792-798 (1989).
- Smith, L. E., Bonesi, M., Smallwood, R., Matcher, S. J., MacNeil, S. Using swept-source optical coherence tomography to monitor the formation of neo-epidermis in tissue-engineered skin. Journal of Tissue Engineering and Regenerative Medicine. 4 (8), 652-658 (2010).
- Pierce, M. C., Strasswimmer, J., Park, H., Cense, B., De Boer, J. F. Birefringence measurements in human skin using polarization-sensitive optical coherence tomography. Biomed Opt. 2 (2), 287-291 (2004).
- Pierce, M. C., Strasswimmer, J., Hyle Park, B., Cense, B., de Boer, J. F. Advances in Optical Coherence Tomography Imaging for Dermatology. Journal of Investigative Dermatology. 123 (3), 458-463 (2004).
- Yeh, A. T., Kao, B., Jung, W. G., Chen, Z., Nelson, J. S., Tromberg, B. J. Imaging wound healing using optical coherence tomography and multiphoton microscopy in an in vitro skin-equivalent tissue model. Journal of Biomedical Optics. 9 (2), 9(2004).
- Derr, K., et al. Fully Three-Dimensional Bioprinted Skin Equivalent Contructs with Validated Morphology and Barrier Funtion. Tissue Engineering Part C: Methods. 25 (6), 334-343 (2019).
- Park, B. H., de Boer, J. F. Polarization Sensitive Optical Coherence Tomography. Optical Coherence Tomography: Technology and Applications. , 1055-1101 (2015).
- Batheja, P., Song, Y., Wertz, P., Michniak-Kohn, B. Effects of Growth Conditions on the Barrier Properties of a Human Skin Equivalent. Pharmaceutical Research. 26 (7), 1689-1700 (2009).
- Dos Santos, M., Metral, E., Boher, A., Rousselle, P., Thepot, A., Damour, O. In vitro 3-D model based on extending time of culture for studying chronological epidermis aging. Matrix Biology. 47, 85-97 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved