Method Article
Geração de Equivalentes de Pele Humana Vascularizada Auto-montado
Neste Artigo
Resumo
O objetivo deste protocolo é descrever a geração e a análise volumosa de equivalentes vascularizados da pele humana utilizando técnicas acessíveis e simples para a cultura de longo prazo. Na medida do possível, a lógica das etapas é descrita para permitir aos pesquisadores a capacidade de personalizar com base em suas necessidades de pesquisa.
Resumo
Os equivalentes de pele humana (HSEs) são construções de tecido projetados que modelam componentes epidérmicos e dérmicos da pele humana. Esses modelos têm sido usados para estudar o desenvolvimento da pele, a cicatrização de feridas e técnicas de enxerto. Muitas HSEs continuam sem vasculatura e são ainda analisadas por meio de seção histológica pós-cultura que limita a avaliação volumosa da estrutura. Apresentado aqui é um protocolo simples utilizando materiais acessíveis para gerar equivalentes vascularizados de pele humana (VHSE); descritas ainda são técnicas volumosas de imagem e quantificação desses construtos. Resumidamente, os VHSEs são construídos em 12 inserções de cultura de poços nas quais células dérmicas e epidérmicas são semeadas em colágeno de cauda de rato tipo I gel. O compartimento dérmico é composto de fibroblasto e células endoteliais dispersas ao longo do gel de colágeno. O compartimento epidérmico é composto de queratinócitos (células epiteliais da pele) que se diferenciam na interface ar-líquido. É importante ressaltar que esses métodos são personalizáveis com base nas necessidades do pesquisador, com resultados demonstrando a geração de VHSE com dois tipos diferentes de células fibroblastos: fibroblastos dérmicos humanos (hDF) e fibroblastos pulmonares humanos (IMR90s). As VHSEs foram desenvolvidas, imagens por meio de microscopia confocal e analisadas volumétricamente usando software computacional em pontos de tempo de 4 e 8 semanas. Um processo otimizado para corrigir, manchar, imagem e VHSEs claras para exame volumoso é descrito. Este modelo abrangente, técnicas de imagem e análise são facilmente personalizáveis às necessidades específicas de pesquisa de laboratórios individuais com ou sem experiência prévia de HSE.
Introdução
A pele humana desempenha muitas funções biológicas essenciais, incluindo atuar como uma barreira imune/mecânica, regular a temperatura corporal, participar da retenção de água e dos papéis sensoriais1,2,3,4. Anatomicamente, a pele é o maior órgão do corpo humano e é composta por três camadas principais (epiderme, derme e hipoderme) e possui um complexo sistema de componentes do sistema estroma, vascular, glandular e imunológico/nervoso, além de células epidérmicas. A epiderme em si é composta por quatro camadas de células que são continuamente renovadas para manter a função de barreira e outras estruturas de pele nativa (ou seja, glândulas de suor e sebáceos, unhas)3. A fisiologia da pele é importante na função imunológica, cicatrização de feridas, biologia do câncer e outros campos, levando os pesquisadores a usar uma ampla gama de modelos, desde monoculturas in vitro até modelos in vivo animais. Modelos animais oferecem a capacidade de estudar toda a complexidade da fisiologia da pele, no entanto, modelos animais comumente usados, como camundongos, têm diferenças fisiológicas significativas quando comparados aos humanos5. Essas limitações, e o aumento do custo dos modelos animais, levaram muitos pesquisadores a se concentrarem no desenvolvimento de modelos in vitro que refletem mais de perto a fisiologia da pele humana1,6. Destes, um dos tipos de modelos mais simples é o equivalente epidérmico humano (HEE; também referido como modelos de pele de meia espessura) que são compostos apenas de queratinócitos epidérmicos em uma matriz dérmica acelular, mas capturam diferenciação epidérmica e estratificação vistas in vivo. Com base nisso, modelos contendo componentes dérmicos e epidérmicos (queratinócitos e fibroblastos) são frequentemente referidos como equivalentes de pele humana (HSE), modelos de pele de espessura total ou construtos de pele organotípicas (OSC). Resumidamente, esses modelos são gerados encapsulando células dérmicas dentro de matrizes de gel e semeando células epidérmicas no topo. A diferenciação epidérmica e a estratificação podem então ser alcançadas através da mídia especializada e da exposição ao ar7. Os equivalentes de pele têm sido gerados na maioria das vezes através de técnicas de auto-montagem usando géis dérmicos feitos de colágeno tipo I (de cauda de rato ou origem bovina)1,8, mas modelos semelhantes incorporaram outros componentes matriciais, como fibrina9,10, fibroblast dederivados 11,12, membranas subêmias desepinômicas13,14,15,16, géis comercialmente disponíveis e outros1,12,13,17,18,19. Atualmente, existem equivalentes de pele disponíveis comercialmente (conforme revisado anteriormente1,2). No entanto, estes são desenvolvidos principalmente para fins terapêuticos e não podem ser facilmente personalizados para questões específicas de pesquisa.
As ESH foram aplicadas em estudos de cicatrização de feridas, enxertos, toxicologia e doença/desenvolvimento da pele11,12,13,16,8,20,21,22,23. Embora a cultura 3D modele de forma mais abrangente as funções do tecido humano em comparação com as culturas 2D24,a inclusão de diversos tipos de células que refletem com mais precisão a população in vivo permite estudos de coordenação celular-célula em tecidos complexos24,25,26. A maioria dos HSEs incluem apenas fibroblastos dérmicos e queratinócitos epidérmicos27,embora o ambiente de pele in vivo inclua muitos outros tipos de células. Estudos recentes começaram a incluir mais populações de células; estas incluem células endoteliais na vasculatura10,28,29,30,31,32,33,34, adipócitos em tecido subcoojoano35,36, componentes nervosos19,21, células-tronco27,37,38, células imunes10,39,40,41,42, e outros modelos específicos da doença/câncer16,40,43,44,45,46,47. Particularmente importante entre eles é a vasculatura; enquanto algumas HSEs incluem células vasculares, no geral elas ainda carecem de elementos capilares abrangentes com conectividade em toda a derme10,29 , estabilidade in vitro estendida28e densidade adequada do vaso. Além disso, os modelos de HSE são tipicamente avaliados através de seção histológica pós-cultura que limita a análise da estrutura tridimensional das HSEs. A análise tridimensional permite a avaliação volumosa da densidade vascular48,49, bem como variação regional da espessura e diferenciação epidérmica.
Embora os HSEs sejam um dos modelos organotípicos mais comuns, existem muitos desafios técnicos na geração desses construtos, incluindo identificação de matriz extracelular apropriada e densidades celulares, receitas de mídia, procedimentos adequados de interface líquida de ar e análise pós-cultura. Além disso, embora os modelos HEE e HSE tenham publicado protocolos, um protocolo detalhado incorporando vasculatura dérmica e imagem volutiva em vez de análise histológica não existe. Este trabalho apresenta um protocolo acessível para a cultura de equivalentes vascularizados de pele humana (VHSE) a partir principalmente de linhas celulares comerciais. Este protocolo é escrito para ser facilmente personalizável, permitindo uma adaptação direta a diferentes tipos de células e necessidades de pesquisa. No interesse da acessibilidade, disponibilidade e custo, o uso de produtos simples e técnicas de geração foi priorizado sobre o uso de produtos disponíveis comercialmente. Além disso, são descritos métodos de imagem volutrica e quantificação volumosas simples que permitem a avaliação da estrutura tridimensional do VHSE. Traduzir esse procedimento em um protocolo robusto e acessível permite que pesquisadores não especialistas apliquem esses modelos importantes em medicina personalizada, engenharia de tecidos vascularizados, desenvolvimento de enxertos e avaliação de medicamentos.
Protocolo
1. Preparação para a cultura 3D
- Prepare o estoque de colágeno de cauda de rato a 8 mg/mL, utilizando protocolos estabelecidos50,51,52. Alternativamente, o colágeno rabo de rato pode ser comprado de fornecedores (ver lista de materiais) em concentrações apropriadas.
NOTA: O colágeno pode ser preparado ou adquirido em diferentes concentrações na faixa de 3-10 mg/mL, ou superiora 50,51,52. Os cálculos no protocolo assumem uma concentração de 8 mg/mL, mas podem ser ajustados com base nas necessidades do pesquisador. - Expandir as linhas celulares: As células endoteliais e fibroblastos precisam estar prontas para semeadura no início da geração de componentes dérmicos de colágeno 3D (passo 2). Os queratinócitos precisam estar prontos no 7º dia da cultura 3D. Uma construção VHSE completa requer 7,5 x 105 células endoteliais; 7,5 x 104 fibroblastos; e 1,7 x 105 queratinócitos para geração(Tabela 1).
NOTA: Essas densidades são apropriadas para inserções de cultura de tecido permeável de 12 poços ou equivalentes. A densidade e o formato celular podem ser dimensionados para cima ou para baixo com base nas necessidades do pesquisador. Para esclarecer, essa quantidade de células endoteliais e fibroblastos irá semear 1-3 componentes dérmicos, enquanto cada componente epidérmico requer 1,7 x 105 queratinócitos. - Realize toda a centrifugação celular neste protocolo por 5 min a 300 x g,mas isso pode ser diminuído para tipos celulares mais frágeis.
2. Geração de componente dérmico de colágeno 3D
NOTA: A etapa 2 é um procedimento sensível ao tempo e deve ser concluída em uma configuração. Aconselhável concluir uma verificação de qualidade do estoque de colágeno para garantir a gelação adequada e a homogeneidade antes de iniciar a semeadura de componentes dérmicos, ver solução de problemas em discussão.
- Preparação e semeadura da camada de colágeno acelular
- Prepare dois tubos de microcentrifuge tampados de 1,7 mL, um para o suporte acelular e outro para a dermis celular. Os valores dados nesta etapa prepararão 1 mL de colágeno de 3 mg/mL (concentração de colágeno alvo), suficiente para (3) VHSEs tamanho 12 poços. Equações são listadas se o ajuste for necessário. Tanto o volume quanto a densidade podem ser dimensionados com base nas necessidades do pesquisador (os números de referência comuns são dados na Tabela 2).
- A cada tubo, adicione 100 μL de soro fisiológico tamponado de fosfato de cultura 10x (PBS) (um tubo produzirá 3 VHSEs) e adicione 8,6 μL de 1 N NaOH. Coloque tubos tampados no gelo molhado para esfriar por pelo menos 10 minutos.
Cs = Concentração de Estoque de Colágeno
Vf = Volume Final de Colágeno Necessário
Ct = Concentração de Colágeno Alvo
Vs = Volume de colágeno de estoque necessário para a quantidade desejada (Vf)
Vpbs = Volume de PBS de 10X necessário para concentração de colágeno alvo (Ct)
VNaOH = Volume de 1N NaOH necessário para Ct
Vmídia = Volume de mídia, suspensão de chamadas ou ddH2O necessário para Ct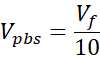
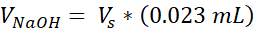
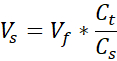
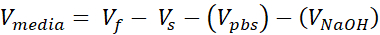
- Prepare as pipetas de deslocamento positivas de 1000 e 250 μL para uso e reserve. Como as etapas posteriores são sensíveis ao tempo, é conveniente carregar pontas de pipeta e definir volumes (375 μL e 125 μL, respectivamente). Além disso, configure uma pipeta normal de 1000 μL para 516 μL.
NOTA: As pipetas de deslocamento positiva podem ser substituídas por pipetas normais, se necessário, mas devido à alta viscosidade do colágeno e à sensibilidade tempo/temperatura deste procedimento, as pipetas de deslocamento positiva são recomendadas para ajudar a produzir resultados consistentes de semeadura. Se usar pipetas normais, use movimentos lentos. - Prepare as placas de cultura: Use fórceps estéreis para colocar três inserções de cultura de 12 poços em uma placa de cultura de tecido estéril de 12 poços, coloque nas colunas centrais.
- Estabelecer mídia fria apropriada para tipos de fibroblasto e células endoteliais.
- Após o resfriamento dos tubos tampados, coloque um tubo (para o suporte acelular) em um rack com o conteúdo visível. Deixe o outro tubo (para a dermis celular) no gelo.
- Remova o caldo de colágeno de 8 mg/mL da refrigeração e coloque no gelo molhado.
NOTA: Não use gelo congelador ou refrigeradores de bancada de -20 °C, pois isso congelará o colágeno. - Ao tubo de tampa fria, adicione 516 μL de mídia e adicione imediatamente 375 μL de colágeno frio usando a pipeta de deslocamento positivo de 1000 μL. Distribua colágeno na solução (não para o lado do tubo). Remova imediatamente a ponta de pipeta vazia e mude para a pipeta de deslocamento positiva preparada de 250 μL para misturar.
- Misture rapidamente, mas suavemente para evitar a formação de bolhas, não remova a ponta da solução, se possível. Misture até que a solução seja de cor homogênea, que normalmente leva cerca de 5 ciclos de pipeta ou 10 s (se usar mídia com vermelho fenol, a cor ficará mais clara e uniforme). Ao misturar, certifique-se de desenhar de diferentes posições do tubo (inferior e superior) para a mistura uniforme.
NOTA: Isso pode ser realizado com 516 μL de água de grau de cultura celular ou outro líquido de grau de cultura celular, no entanto, o fenol vermelho da maioria dos meios de comunicação é um bom indicador da mistura. Use fibroblasto ou mídia endotelial que foi usada para expansões 2D.
- Misture rapidamente, mas suavemente para evitar a formação de bolhas, não remova a ponta da solução, se possível. Misture até que a solução seja de cor homogênea, que normalmente leva cerca de 5 ciclos de pipeta ou 10 s (se usar mídia com vermelho fenol, a cor ficará mais clara e uniforme). Ao misturar, certifique-se de desenhar de diferentes posições do tubo (inferior e superior) para a mistura uniforme.
- Disperse imediatamente 125 μL de colágeno acelular na membrana de cada uma das três inserções de cultura de 12 poços. Para garantir a cobertura uniforme do gel de colágeno acelular, arrase no prato; se isso não criar cobertura uniforme de membrana, então use a ponta da pipeta para essencialmente pintar a membrana espalhando suavemente o colágeno; evite aplicar pressão na membrana. A gelação começa quase imediatamente; executar esta etapa rapidamente para garantir a cobertura uniforme.
NOTA: Haverá excesso de colágeno acelular. O volume pode ser reduzido, no entanto, preparar menos de 1 mL de suspensão de colágeno pode resultar em dificuldades para misturar a solução e a gelação insuficiente. - Mova imediatamente a placa de 12 poços para uma incubadora de cultura celular de 37 °C para deixá-la gel por pelo menos 20 min (o colágeno acelular pode gelar por mais tempo, se necessário; durante este tempo de gelação, prossiga para a etapa 2.2). Retire a suspensão do colágeno do gelo e coloque de volta na refrigeração (o colágeno é mais estável a 4 °C).
- Suspensão celular e preparação de semeadura
NOTA: Para a linha do tempo cultural deste protocolo, isso corresponde ao Submersão Dia 1 (SD1)- Durante a gelação do suporte de colágeno acelular, trippsinize e conte as linhas celulares endoteliais e fibroblastos.
- Suspender 7,5 x 105 células endoteliais e 7,5 x 104 fibroblastos em 258 μL de suas respectivas mídias e combinar suspensões celulares para criar uma alíquota de 516 μL. Mantenha as suspensões das células em gelo molhado até usar.
- Prepare as pipetas de deslocamento positivas de 1000 e 250 μL para uso e reserve. Como as etapas posteriores são sensíveis ao tempo, é conveniente carregar pontas de pipeta e definir volumes (375 μL e 250 μL, respectivamente). Além disso, configure uma pipeta normal de 1000 μL para 516 μL.
- Semeadura de colágeno carregado de células do compartimento dérmico
- Após o período de gelação, remova a placa de 12 poços de colágeno acelular da incubadora.
NOTA: Se este colágeno não for gelado após 30 min, não continue o procedimento, pois provavelmente houve um erro durante a semeadura ou o estoque de colágeno pode ter um problema (ver solução de problemas na discussão). - Remova o tubo tampado de 1,7 mL do gelo molhado (contém PBS 10x e NaOH). Coloque o tubo em um rack para que o conteúdo seja visível. Solte/abra todas as tampas (suspensão celular, tubo com tampa fria).
- Retire o colágeno de caldo (8 mg/mL) da refrigeração de 4 °C e coloque-o em gelo molhado. Deixe a tampa aberta.
- Adicione os 516 μL de suspensão celular resfriada ao tubo de tampa fria. Use a pipeta de deslocamento positivo de 1000 μL para imediatamente pipeta 375 μL de solução de colágeno frio diretamente na solução do tubo tampado.
- Expulse todo o colágeno da pipeta para dentro do tubo e descarte a ponta de pipeta de deslocamento positiva. Mude imediatamente para a pipeta de deslocamento positivo de 250 μL e misture a solução de colágeno.
- Misture a solução de colágeno como concluída anteriormente (rápida, mas suavemente para evitar a formação de bolhas), não remova a ponta do gel, se possível. Misture até que a solução seja homogênea (cerca de 5 ciclos de pipeta ou 10 s). Ao misturar, certifique-se de desenhar de diferentes posições do tubo (inferior e superior) para a mistura uniforme.
- Uma vez misturado, transfira imediatamente 250 μL de solução de colágeno celular para o colágeno acelular suporta em cada uma das três pastilhas de cultura de 12 poços. Para garantir uma cobertura uniforme do suporte acelular de colágeno, balance o prato e/ou use a pipeta de deslocamento positiva para mover suavemente o colágeno celular recém-semeado ao redor sem perturbar a camada acelular.
- Mova imediatamente a placa de 12 poços para a incubadora de cultura celular de 37 °C para deixá-la gel por pelo menos 30 min. Coloque o colágeno de volta em refrigeração de 4 °C após o uso.
- Após o tempo de gel de 30 minutos, incline suavemente a placa para avaliar a gelação. Certifique-se de que o colágeno está solidificado.
- Adicione 500 μL e 1000 μL de mídia de mistura (metade endotelial e metade da mídia de manutenção do fibroblasto) à câmara superior e câmara inferior da inserção, respectivamente (primeiro superior, depois inferior para evitar que a pressão hidrostática empurre o colágeno para cima). Adicione a mídia lentamente ao lado do poço, não diretamente no gel de colágeno, para minimizar a interrupção do colágeno.
- Certifique-se de que o gel de colágeno está submerso, adicione mais mídia, se necessário. Coloque a placa do poço na incubadora celular para incubação durante a noite. Nesta fase, a mídia contém 10% de FBS; a mídia de manutenção normal para cada linha celular (linha do tempo e esquema dado na Figura 1,A).
NOTA: A mídia em toda a cultura VHSE pode ser adaptada para tipos de células personalizadas; alguma otimização pode ser necessária.
- Certifique-se de que o gel de colágeno está submerso, adicione mais mídia, se necessário. Coloque a placa do poço na incubadora celular para incubação durante a noite. Nesta fase, a mídia contém 10% de FBS; a mídia de manutenção normal para cada linha celular (linha do tempo e esquema dado na Figura 1,A).
- Após o período de gelação, remova a placa de 12 poços de colágeno acelular da incubadora.
- Submersão Dia 2 (SD2) mudança de mídia
- Mude 10% de mídia FBS em poços VHSE para 5% FBS meio fibroblasto, metade mídia endotelial suplementada com ácido L-Ascórbico 100 μg/mL. Adicione 500 μL à câmara superior da inserção de cultura na lateral do poço (novamente, adicione cuidadosamente à parede lateral para minimizar a interrupção do colágeno) e adicione 1000 μL à câmara inferior.
- Renove a mídia a cada 2 dias (SD4 e SD6) até o Submersão Dia 7 (SD7).
- Use uma pipeta manual para remover a mídia dos poços. O uso de um aspirador é possível, mas pode resultar em danos ou destruição da construção.
NOTA: O ácido L-ascórbico deve ser composto fresco a cada 2-3 dias (oxida em solução para produzir peróxido de hidrogênio assim, induzindo o estresse oxidativo e eventualmente danos celulares53). Assim, a mídia deve ser alterada a cada 2-3 dias de SD2 até o fim da cultura VHSE, uma vez que o ácido L-ascórbico está presente. É mais fácil fazer um estoque de mídia e adicionar uma quantidade recém-preparada de ácido L-ascórbico a uma alíquota de mídia todos os dias de alimentação. Use água ou mídia de grau de cultura como solvente e prepare ácido L-ascórbico fresco a 100 mg/mL. O ácido L-ascórbico estimula a síntese de colágeno por fibroblastos a uma taxa adequada e promove a estabilidade do colágeno54,55,56; também diminui a permeabilidade endotelial e mantém a integridade da parede da embarcação56,57 e contribui adicionalmente para a formação de barreiras epidérmicas6,58.
3. Semeadura de componente epidérmico e indução de estratificação
- Submersão Dia 7 (SD7): queratinócitos de sementes
NOTA: Queratinócitos de sementes para estabelecer a epiderme em SD7. Esse ponto de tempo pode ser deslocado com base nas necessidades do pesquisador. A duração da cultura de submersão sem queratinócitos não deve exceder 9 dias, pois uma submersão mais longa muitas vezes leva ao aumento da contração dérmica. Se a contração ocorrer antes do SD7, recomenda-se encurtar o período de submersão para 5 dias e a epiderme de sementes em SD5. Otimize o período de submersão conforme necessário para experimentos específicos (veja solução de problemas em discussão).- Queratinócitos de cultura (N/TERT-120,59 ou outras células apropriadas) ao seu limite de confluência antes da experimentação e semeadura em VHSEs. Para as células N/TERT-1, a confluência não deve exceder significativamente 30% para evitar a diferenciação não desejada de queratinócitos na cultura 2D59. Para outras linhas celulares apropriadas, como queratinócitos epidérmicos primários, um limite de confluência de 75-80% é geralmente usado60.
- Após a experimentação, conte e suspenda 510.000 células em 600 μL de Mídia de diferenciação equivalente à pele humana (HSE) complementada com 5% de FBS (Tabela 1).
NOTA: 510.000 células em 600 μL permite 170.000 células/construção ao semear 200 μL por construção (3 VHSEs). - Usando uma pipeta manual, colete e descarte as mídias atualmente na câmara inferior e superior para cada bem construído. Certifique-se de coletar o máximo de mídia possível. Colete mídias que podem ser presas diretamente sob a membrana permeável colocando suavemente a ponta da pipeta sob a membrana de inserção de cultura e derrubando a inserção fora do lugar temporariamente. A mídia pode ter ficado presa devido à tensão superficial. Certifique-se de que as pastilhas ficam planas em seus poços antes de prosseguir. O uso de um aspirador é possível, mas pode resultar em danos ou destruição da construção.
- Adicione 1 mL de mídia HSE suplementada com 5% de FBS à câmara inferior de cada poço. Em seguida, adicione 200 μL de suspensão celular à câmara superior de cada poço. Sementes diretamente na superfície de construção dérmica. Deixe os queratinócitos se contentarem com 2h na incubadora.
- Duas h após a semeadura dos queratinócitos, adicione cuidadosamente 300 μL de mídia HSE suplementada com 5% de FBS à câmara superior de cada poço de construção; mídia de pipeta lentamente para o lado da cultura inserir. Carregue a mídia na câmara superior com muito cuidado para não perturbar os queratinócitos resolvidos que podem não ter aderido firmemente ao gel de colágeno subjacente ainda.
- Depois de carregar a mídia, coloque a construção de volta na incubadora.
- Dia de Submersão 8/9 (SD8 ou SD9)
- Coma a mídia HSE suplementada com 1% de FBS e ácido L-ascórbico 100 μg/mL.
- Remova a mídia das câmaras superior e inferior com um pipettor manual.
- Adicione 500 μL de mídia na câmara superior primeiro e depois 1 mL na câmara inferior. (Esta etapa pode ser feita em SD8 ou SD9)
- Dia de Submersão 9/10 (SD9 ou SD10, este deve ser o dia seguinte ao passo 3.2)
- Coma mídia de diferenciação HSE gratuita com ácido L-ascórbico l-ascórbico de 100 μg/mL.
- Remova a mídia das câmaras superior e inferior com um pipettor manual.
- Carregue 500 μL na câmara superior e 1 mL na câmara inferior.
- Interface Ar-Líquido Dia 1 (ALI1)
NOTA: A ALI é realizada no dia seguinte ao passo 3.3.- Levante cada construção para interface ar-líquido (ALI) removendo resíduos de mídia apenas da câmara superior. Use uma pipeta manual para chegar o mais perto possível da camada epidérmica sem tocá-la ou danificá-la.
- Incline a placa ligeiramente em ângulos diferentes para coletar a mídia. Remova o máximo de mídia possível nesta etapa. Adicione aproximadamente 2 mL de água estéril aos poços circundantes na placa para manter umidade consistente; manter os poços cheios de água em toda a cultura.
- Verifique a placa um pouco mais tarde para ter certeza de que os queratinócitos ainda estão na interface ar-líquido. Se houver mídia na câmara superior, remova-a. Acompanhe a quantidade de mídia removida para cada poço VHSE (O volume inicial de câmaras superiores e inferiores (1500 μL) - mídia removida = um bom ponto de partida para alimentação ALI).
NOTA: Os VHSEs não exigem necessariamente o mesmo nível de mídia para o elevador de ar; geralmente, se os VHSEs são semeados juntos, então eles precisam do mesmo nível de mídia para o levantamento aéreo, mas isso nem sempre é o caso. Ajuste os volumes conforme necessário para manter o ALI, mas certifique-se de que os níveis de mídia não são tão baixos que os VHSEs secam. É mais seguro ser cauteloso e remover pequenas quantidades de mídia diariamente até que um equilíbrio entre o elevador de ar e a hidratação tenha sido cumprido.
- ALI Dia 2 (ALI2)
- A partir deste ponto, use apenas a mídia HSE livre de soro suplementada com ácido L-ascórbico l-ascórbico de 100 μg/mL. Alterar mídia no ALI Day 2 (ALI2). Se houver mídia na câmara superior, remova-a e adicione-a à quantidade de mídia removida registrada anteriormente. Calcule o volume de mídia necessário usando a equação na etapa anterior. Por exemplo: Se 200 μL de mídia foi removido da câmara superior, então adicione 1300 μL para estabelecer ALI (como 1500 μL - 200 μL = 1300 μL)
- Use o volume calculado para carregar na câmara inferior de cada poço e, em seguida, coloque a placa de volta na incubadora celular. Acompanhe o volume utilizado por dia. Ao usar as quantidades recomendadas de colágeno em pastilhas de cultura de 12 poços, a faixa usual de valores ALI cai entre 750 μL e 1300 μL. Normalmente, o volume diminui sobre o amadurecimento da cultura e se torna consistente em torno da semana 2/3 da ALI. Dependendo das especificidades da cultura, esse número pode mudar e deve ser otimizado (conforme descrito em 3.4.2 - 4.1).
4. Manutenção de rotina do equivalente da pele humana vascular
- A partir do ALI Day 3 (ALI3) até o ponto final da cultura: Renove a mídia da câmara inferior a cada 2-3 dias usando mídia HSE livre de soro com ácido L-ascórbico L-ascórbico de 100 μg/mL. Continue a ajustar e acompanhar o nível de mídia necessário na câmara inferior para ALI, conforme descrito na Etapa 3.5.2.
- Como a superfície epidérmica deve permanecer em contato com o ar, verifique e ajuste o nível de mídia diariamente até que os níveis de ALI consistentes sejam estabelecidos. A camada epidérmica deve parecer hidratada, não seca, mas não deve haver mídia agrupada em cima da construção. Culturas com 8 semanas de ALI forneceram a morfologia e expressão mais consistentes; no entanto, dependendo da aplicação, culturas de 4 a 12 semanas podem ser apropriadas. A duração da cultura para diferentes condições de células e culturas pode precisar ser otimizada.
NOTA: Mudar de mídia segunda, quarta, sexta-feira é uma boa prática. Os VHSEs estão saudáveis durante o fim de semana, mas a mídia deve ser alterada mais cedo na segunda-feira e no final da sexta-feira. Depois de completar completamente os passos 1-4, a geração de um VHSE está completa. As etapas 5 do protocolo são técnicas opcionais de processamento e imagem que foram otimizadas para este tipo de construção 3D.
5. Fixação e permeabilização de construções 3D
NOTA: O passo 5 foi otimizado para técnicas de imagem específicas deste construto 3D que estão delineados no restante do protocolo. As etapas a seguir não são necessárias para gerar um VHSE.
- Fixação/permeabilização
- Remova cuidadosamente todas as mídias das câmaras superiores e inferiores de cada poço no ponto final do período cultural.
NOTA: A camada epidérmica é possivelmente frágil, manuseia com cuidado e não agita a epiderme com tubulação agressiva. - Adicione 4% de paraformaldeído (PFA) em PBS (pH 6.9) à parede da câmara superior (não diretamente sobre a construção) e, em seguida, à câmara inferior, para pré-fixar cada construção. Adicione 1 mL por câmara e exponha por 5 minutos à temperatura ambiente.
ATENÇÃO: A PFA é perigosa e deve ser tratada com cuidados e equipamentos de proteção individual (EPI) adequados, incluindo proteção ocular. - Remova a solução PFA de 4% após 5 min e adicione a solução Triton X 100 0,5% em 4% pfa para as câmaras superior e inferior, conforme descrito na etapa anterior. Expor por 1 hora em temperatura ambiente; A construção VHSE não requer um ambiente estéril a partir de agora.
- Após 1 hora, remova cuidadosamente a solução de permeabilização/fixação de ambas as câmaras e lave a amostra 3 vezes com 1x PBS.
- Armazene amostras em PBS em refrigeração de 4 °C ou manche imediatamente. Para armazenar as amostras, enrole o prato em um plástico e, em seguida, papel alumínio para minimizar a evaporação e exposição à luz
NOTA: Ponto de pausa - Após fixação e permeabilização, este procedimento pode ser pausado, uma vez que as amostras são estáveis por várias semanas se preparadas como delineado na etapa 5.1.5. Alternativamente, a coloração (conforme descrito na etapa 6) pode ser concluída imediatamente após a etapa 5.
- Remova cuidadosamente todas as mídias das câmaras superiores e inferiores de cada poço no ponto final do período cultural.
6. Coloração imunofluorescente de construções 3D
- Preparação para construção
NOTA: VHSEs mancham bem quando separados da membrana porosa da inserção de cultura; a separação da membrana também é necessária para imagens não obstruídas e permitem volumes reduzidos para coloração.- Para preparar o construto para coloração imunofluorescente, gire uma inserção de cabeça para baixo e coloque-a sobre seu poço na placa do poço (se o VHSE cair, ele cairá no poço com PBS) (Figura Suplementar 1A).
- Estabilize a pastilha com uma mão sobre o poço enquanto usa fórceps finos de ponta e/ou uma faca de precisão para cortar cerca de metade da circunferência da membrana de inserção. Corte o mais próximo possível da carcaça de plástico com uma mão suave para evitar danos à construção VHSE.
- Usando os fórceps finos da ponta, pegue a borda do retalho da membrana cortada e retire delicadamente a membrana porosa da inserção, bem como a construção VHSE. Faça isso com muito cuidado e lentamente para evitar danos à estrutura de construção VHSE. Se a construção VHSE se separar facilmente, então ela deve cair no poço abaixo, se ficar presa na lateral da câmara, então use os fórceps finos ou uma pequena scoopula para movê-lo para o poço. Tenha muita consciência da camada epidérmica, pois é geralmente frágil(Figura Suplementar 1A).
NOTA: Às vezes a membrana não sai facilmente ou sai em pedaços, se isso acontecer use as ferramentas para puxar cuidadosamente a membrana e a construção VHSE. Certifique-se de que os VHSEs não sequem durante este processo mergulhando em PBS, se necessário. - Uma vez que o VHSE esteja no poço, descarte quaisquer pedaços restantes da membrana de inserção e mantenha a carcaça de inserção de cultura em cada poço para manter os VHSEs em uma posição submersa durante a coloração.
- Mancha
NOTA: A coloração e manipulação/manipulação associadas devem ser realizadas da forma mais suave possível, uma vez que os VHSEs podem ser frágeis. Se as porções da epiderme decolarem, as peças podem ser manchadas separadamente; as camadas superiores da epiderme são frágeis e passam pela dessaquamação natural4,mas para análise é importante manter a integridade o máximo possível.- Prepare as manchas de anticorpos primárias escolhidas em 700 μL de tampão de bloqueio por bem construído (normalmente, todos os anticorpos primários podem estar na mesma solução de coloração, mas isso deve ser confirmado para novos anticorpos). 700 μL funciona para tamanho de 12 poços, mas pode ser ajustado para outros formatos de cultura. As concentrações recomendadas de anticorpos primários e secundários com receita tampão de bloqueio são dadas na Tabela 3 (pode ser necessária otimização).
- Remova qualquer PBS do poço usando uma pipeta manual, tenha cuidado para se afastar das VHSEs (como vhses estão flutuando, aspiração de vácuo não é recomendada).
- Adicione a solução de mancha primária a cada poço e coloque a carcaça de inserção de cultura no poço para manter o VHSE submerso em fluido(Figura Suplementar 1B). Enrole a placa do poço com plástico. Folha e mancha por 48 h em refrigeração de 4 °C sem agitação ou balanço (balançar pode danificar a construção VHSE).
- Após 48 h, prepare anticorpos secundários e manchas químicas em 700 μL de tampão de bloqueio (por poço).
- Remova a carcaça de inserção de cultura e a solução de mancha primária e lave com 1x PBS, 3x por 5 minutos antes de adicionar a solução de mancha secundária. Coloque a cultura inserindo a carcaça de volta no poço para manter a construção VHSE submersa(Figura Suplementar 1B). Exponha por 48 h em refrigeração de 4 °C sem agitação ou balanço.
- Após a exposição de 48 horas, remova a solução de manchas com um pipettor manual e lave suavemente 3x com PBS; não pipeta fluido direto para os VHSEs, pois eles podem ser frágeis. Reidratar com o excesso de PBS e colocar a cultura inserindo a carcaça de volta no poço para manter o VHSE submerso e hidratado durante o armazenamento (armazenar embrulhando em plástico e papel alumínio para minimizar a evaporação e exposição à luz)
- Compensação (opcional & terminal)
NOTA: A limpeza é opcional para imagens. Se concluída, deve ser feita após a coloração/imagem da amostra completamente, uma vez que a limpeza evita novas manchas, pode alterar o desempenho do fluoróforo e pode danificar a estrutura VHSE. Existem múltiplos métodos de limpeza tecidual49,61,62 e podem ser otimizados para projetos específicos. A limpeza de salicílato de metila, descrita abaixo, é simples e eficaz para vhse. A seguinte técnica de compensação deve ser completada em recipientes de vidro e as pontas de pipeta devem ser de vidro ou polipropileno (poliestireno se dissolverá em contato com salicilato de metila). Complete todo o procedimento de limpeza em uma área bem ventilada ou capô de fumaça.- Adicione 100% de metanol a um pequeno recipiente de vidro raso (as placas de vidro Petri funcionam bem). Use o menor recipiente possível que se encaixe na construção (para minimizar o desperdício de reagente).
- Remova a construção da placa do poço usando fórceps/scoopula(Figura Suplementar 1C) e coloque no recipiente cheio de metanol. Adicione mais metanol se a construção não estiver submersa.
- Desidratar a construção VHSE em metanol para imersões de 3 x 10 min; substitua totalmente o metanol após cada imersão e remova prontamente o metanol após o último banho. Ao longo deste procedimento, a construção pode se tornar mais opaca e encolher ligeiramente.
NOTA: Essas durações e repetições foram otimizadas, mas o metanol e os seguintes procedimentos de salicilato de metila podem precisar ser personalizados, dependendo do formato de cultura específico e das manchas. - Imediatamente após a remoção do metanol, adicione salicilato de metila e submerse o VHSE em imersões de 5 x 5 min. Substitua totalmente o reagente após cada imersão e deixe o VHSE na 5ª solução de imersão para armazenamento. Ao longo desse procedimento, a construção torna-se transparente.
- Imagem da construção ou armazenamento a 4 °C. Após a limpeza, complete todas as imagens o mais rápido possível, pois os fluoroforos podem se degradar em salicilato de metila dentro de dias. A limpeza faz com que os construtos fiquem frágeis e o armazenamento estendido, embora não recomendado, precisa de uma verificação regular para garantir que haja uma quantidade suficiente de salicilato de metila.
7. Imagem confocal de construções 3D
NOTA: A imagem através da cultura tecidual plástico não produzirá a mesma qualidade de imagem que a imagem através do vidro de deslizamento de cobertura, este método descreve a fabricação de um poço de fundo de vidro personalizado para evitar a secagem durante a imagem confocal. Normalmente, isso é suficiente para pelo menos 3h de imagem.
- Dois dias antes da imagem: prepare polidimimetilsiloxano (PDMS)
- Prepare PDMS48,63,64 em uma concentração sugerida de [9:1], base: crosslinker. Prepare 30 g de PDMS total: 27 g de componente base e 3 g de crosslinker. Coloque qualquer recipiente de mistura limpo em um equilíbrio de pesagem e coloque a balança. Adicione a base (27 g) e, em seguida, adicione o crosslinker (3 g) para alcançar um total de 30 g. Adicione sempre base antes do crosslinker.
- Mexa a solução vigorosamente por pelo menos 4 minutos; isso criará pequenas bolhas. Depois de misturar o suficiente, despeje o PDMS em uma placa de Petri de 100 mm ou recipiente resistente ao calor plano similar.
- Desaparar o PDMS em uma câmara de vácuo até que todas as bolhas da mistura desapareçam e pDMS esteja limpo. Solte o vácuo lentamente e remova o PDMS (lentamente). Coloque o prato em um forno para curar durante a noite (50-60 °C); garantir que o prato está sentado plano para PDMS para curar uniformemente.
NOTA: Após a cura, o PDMS deve ser claro e a superfície deve ser lisa e não pegajosa (a pegajosa pode indicar mistura inadequada).
- Um dia antes da imagem: Preparação do poço PDMS
- Usando um soco de aço ou uma faca de precisão portátil, soque ou corte um poço circular da folha PDMS preparado em 7.1. O poço deve ser do mesmo tamanho da construção VHSE. Corte um patch quadrado ao redor do poço circular para criar um único PDMS bem. O valor PDMS de 30 g preparado deve render pelo menos quatro poços personalizados.
NOTA: O poço PDMS deve estar próximo do tamanho da construção VHSE. Deve restringir o movimento da amostra durante a imagem. Vários poços podem ser fabricados ao mesmo tempo e armazenados indefinidamente em um recipiente limpo. - Usando uma mancha de vidro de tamanho semelhante ao poço PDMS, adicione cola cianoacrilato (por exemplo, super cola) à superfície inferior do PDMS (a superfície lisa que estava em contato com a placa de Petri) e esfregue uniformemente com uma ponta de pipeta descartável. Centralizar e pressionar bem o PDMS sobre o vidro, deixando uma janela de vidro transparente dentro do círculo perfurado (certifique-se de que a cola não está manchada sobre a janela de visualização).
NOTA: Se disponível, a ligação plasmática do PDMS ao deslizamento de cobertura é uma alternativa65,66,67. - Deixe a cola secar por várias horas, ou durante a noite, antes de usar. Estes são reutilizáveis até que se romam do desgaste normal.
NOTA: Não é recomendável manchar as amostras no PDMS colado bem utilizado para imagens. Estes poços seguram fluido por várias horas, mas podem vazar durante uma coloração mais longa.
- Usando um soco de aço ou uma faca de precisão portátil, soque ou corte um poço circular da folha PDMS preparado em 7.1. O poço deve ser do mesmo tamanho da construção VHSE. Corte um patch quadrado ao redor do poço circular para criar um único PDMS bem. O valor PDMS de 30 g preparado deve render pelo menos quatro poços personalizados.
- Imagem VHSE
NOTA: Se a imagem não for amostra, use PBS como solução de imagem. Se a imagem com amostras limpas, use salicílato de metila (ou a solução de compensação escolhida) como solução de imagem.- Adicione algumas gotas de solução de imagem no poço PDMS e verifique se há vazamentos (se houver um vazamento, repare-o com um ponto/mancha de super cola cianoacrilato ou use outro poço).
- Mantenha bem a solução de imagem no PDMS ao adicionar o VHSE. Utilizando fórceps de colherula ou ponta fina(Figura Suplementar 1C),remova a construção da placa de 12 poços e coloque no PDMS bem na tampa do vidro. Construa a construção com a orientação de interesse voltado para o objetivo. Por exemplo, para imaginar a epiderme usando um microscópio invertido, certifique-se de que a epiderme está voltada para baixo, em direção ao vidro.
- Alternativamente, para um microscópio vertical, enfrente a epiderme. Os procedimentos de imagem abaixo são descritos para um microscópio invertido, mas podem ser prontamente adaptados para uma vertical.
NOTA: Tenha cuidado ao manipular o VHSE para evitar danos. Transfira a placa do poço caso o VHSE caia. Uma scoopula de ponta plana e dobrada é a maneira mais fácil de transferir a construção (Figura Suplementar 1C).
- Alternativamente, para um microscópio vertical, enfrente a epiderme. Os procedimentos de imagem abaixo são descritos para um microscópio invertido, mas podem ser prontamente adaptados para uma vertical.
- Certifique-se de que a amostra está sentada plana no poço e que nenhuma porção da epiderme ou derme são dobradas sob a amostra. Se ocorrer dobra, manipule suavemente a amostra com fórceps ou uma scoopula; adicionar solução de imagem extra temporariamente para flutuar o VHSE pode ajudá-lo a endireitar. Dobrar ou enrugar a amostra pode ser visto pelo olho ou usando o microscópio.
- Encha o poço com solução de imagem, usando apenas fluido suficiente para manter a amostra hidratada; muito fluido flutuará a amostra, resultando em movimento durante a imagem. A construção deve estar sentada na janela de visualização de vidro; teste para o movimento inclinando bem o PDMS. Se houver movimento, remova algum fluido; adicionar e remover a queda do fluido sábio até que o movimento pare.
- Coloque um deslizamento de vidro sobre o poço para minimizar a evaporação durante a imagem(Figura Suplementar 1D). Para sessões de imagem mais longas, verifique a amostra com frequência para garantir níveis adequados de fluidos. Se acessível, uma câmara umidificada durante a imagem pode ser usada (embora normalmente não seja necessário).
- Coloque a amostra no estágio do microscópio e na imagem através da janela de deslizamento de vidro(Figura Suplementar 1D). Esta técnica permite pelo menos 3h de imagem confocal contínua, mas a hidratação da amostra deve ser verificada regularmente, com solução de imagem adicionada quando necessário.
NOTA: Se a amostra for limpa, o salicilato de metila degradará a cola ao longo do tempo. A cola que liga o PDMS pode ser reapridamente entre as corridas de imagem; ou a amostra pode ser transferida para novos poços periodicamente. Em poços com ligação plasmática, isso não será um problema. - Após a imagem, flutue a amostra com fluido de imagem o máximo possível no poço. Use uma colherula ou fórceps finos para transferir bem a amostra para o seu armazenamento. Realize a transferência sobre uma placa de poço no caso da amostra cair.
- Cada tampa de vidro PDMS e top pode ser reutilizada até que se quebrem. Limpe o vidro inferior antes da imagem, dentro e fora do poço. Antes de reutilizar, verifique sempre se há vazamentos e repare com cola, conforme necessário.
- Armazene amostras conforme descrito na etapa 6.3.6 e adicione PBS a cada poucos meses para manter; se as amostras forem limpas, armazene em vidro usando salicílato de metila e verifique os níveis regularmente. As amostras limpas podem se degradar rapidamente (dentro de dias) e devem ser imagens o mais rápido possível.
Resultados
Aqui é apresentado um protocolo para geração de equivalentes de pele humana in vitro vascularizados (VHSE) utilizando transcritos reversos telomerase (TERT) queratinócitos imortalizados (N/TERT-120,59),fibroblastos dérmicos humanos adultos (hDF) e células endoteliais microvasculares humanas (HMEC-1)(Figura 1). Além disso, a natureza personalizável deste protocolo é destacada por também demonstrar a geração e estabilidade do VHSE ao usar fibroblastos pulmonares comumente disponíveis (IMR90) em vez de hDF. A geração do VHSE é concluída nas etapas 1-4, enquanto as etapas 5-7 são técnicas opcionais de processamento de ponto final e de imagem que foram otimizadas para esses VHSEs. É importante notar que os VHSEs podem ser processados de acordo com questões específicas de pesquisa e as etapas 5-7 não são necessárias para gerar a construção. Imagens volumosas, análises e renderizações 3D foram concluídas para demonstrar um método de análise volumosa. Esses protocolos de preparação e imagem de construção volumosa preservam a estrutura VHSE nos níveis microscópico e macroscópico, permitindo uma análise 3D abrangente.
Caracterização da epiderme e derme mostram marcadores imunofluorescentes apropriados para a pele humana nos construtos VHSE(Figura 2,3). Cytokeratin 10 (CK10) é um marcador de queratinócito de diferenciação precoce que geralmente marca todas as camadas suprabásais em equivalentes de pele18,30,68 (Figura 2). Involucrina e filaggrina são marcadores de diferenciação tardia em queratinócitos e marcam as camadas suprabásas mais altas em equivalentes de pele12,30,68,69 (Figura 2). Um corante nuclear fluorescente distante (ver lista de materiais) foi usado para marcar núcleos tanto na epiderme quanto na derme, com o Col IV marcando a vasculatura da derme(Figura 2, Figura 3, Figura 4). Os componentes da membrana epidérmica do porão (BM) nem sempre são expressos adequadamente nas culturas HSE15,16; e a coloração do Col IV do BM não é observada consistentemente usando este protocolo. Os componentes e estrutura de BM focados na pesquisa se beneficiariam de otimização adicional de mídia, células e imagens14.
Embora a imagem confocal através da maior parte das culturas VHSE muitas vezes produz imagens de alta resolução que são suficientes para a análise computacional da derme e epiderme, o método de compensação descrito permite imagens teciduais mais profundas. A limpeza melhora a profundidade de penetração do laser confocal, e imagens eficazes em VHSEs podem ser alcançadas a mais de 1 mm para amostras limpas (em comparação com ~250 μm para não descoberto). A técnica de compensação descrita (desidratação de metanol e salicilato de metila) corresponde suficientemente ao índice de refração em todo o tecido amostral VHSE61. A limpeza do VHSE permitiu uma imagem simples durante toda a construção sem manipulação (por exemplo, reorientando a construção para a imagem da derme e epiderme separadamente),(Figura 3).
Imagens volumosas permitem a geração de renderização 3D para mapear vasculatura em cada construção (Figura 4). Brevemente, conjuntos de imagens confocal foram levados em dermal à orientação epidérmica de vários sub-volumes de VHSEs para detectar a mancha de colágeno IV (marcando paredes de vasos) e núcleos (marcados por um corante nuclear fluorescente distante). As pilhas de imagens são carregadas em software computacional (ver lista de materiais)e um algoritmo personalizado (com base nessas fontes 48,70,71,72,73,74,75) é usado para renderização e quantificação 3D como descrito anteriormente48. Este algoritmo segmenta automaticamente o componente vascular com base na mancha de Col IV. A segmentação volumosa é passada para um algoritmo de esqueletização baseado na marcha rápida75,76,77. A esqueletização encontra o centro definitivo de cada vaso marcado por Col IV e os dados resultantes podem ser usados para calcular o diâmetro do vaso, bem como a fração vascular(Figura 4). A microscopia fluorescente widefield é uma opção acessível se a microscopia de varredura a laser não estiver disponível; a rede vascular e a epiderme podem ser imagens com microscopia fluorescente de campo largo(Figura Suplementar 2). A quantificação tridimensional é possível usando imagens widefield de VHSEs em vez de microscopia de varredura a laser, embora possa exigir mais filtragem e desconvolução de imagens devido à luz fora do avião.
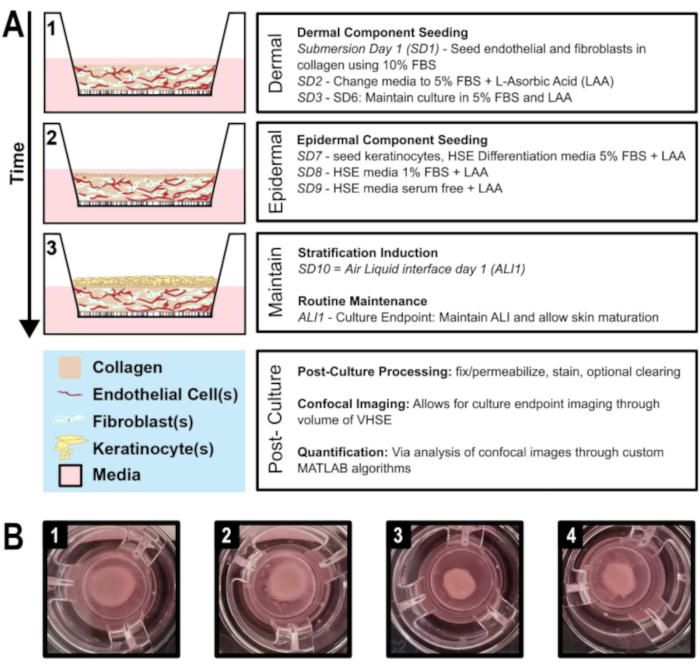
Figura 1: Linha do tempo esquemática da geração equivalente da pele humana vascularizada. A) Mostra a progressão do modelo VHSE a partir de 1) semeadura de componentes dérmicos, 2) semeadura de queratinócitos no componente dérmico, 3) estratificação epitelial através da interface líquida do ar e manutenção da cultura. O processamento pós-cultura e a imagem volumosa podem ser realizados no ponto final da cultura. B) Imagens de câmera da macroestrutura hDF VHSE na cultura se insere em seu ponto final de cultura, 8 semanas. Vários níveis de contração são normais para VHSEs; a contração pode ser reduzida como o protocolo descreve. (1 & 2) Amostras menos contraídas. (3 & 4) Mais amostras contraídas ainda produzem elementos de pele adequados. Clique aqui para ver uma versão maior desta figura.
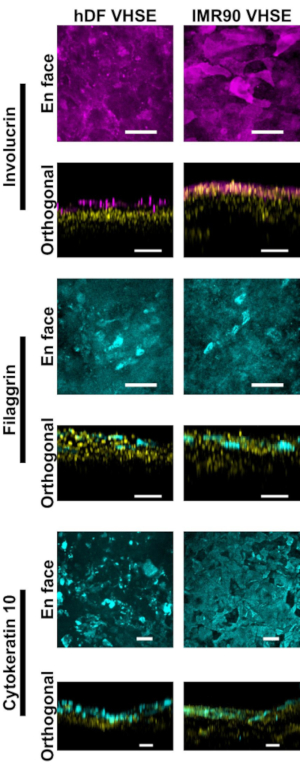
Figura 2: Caracterização epidérmica através de marcadores imunofluorescentes. Todas as imagens foram tiradas de VHSEs no ponto de tempo da cultura de 8wk via microscopia confocal. Os métodos de coloração correspondentes estão descritos no protocolo passo 6. Marcadores epiteliais adequados estão presentes tanto em VHSEs hDF (coluna esquerda) quanto em VHSEs IMR90 (coluna direita). Involucrina e Filaggrin são marcadores de diferenciação tardio de queratinócitos e demonstram que a epiderme é totalmente estratificada em ambos os tipos de VHSE. Cytokeratin 10 é um marcador de diferenciação inicial que está identificando camadas suprabásiais nos VHSEs. Núcleos são mostrados em vistas ortogonais em amarelo. As imagens de projeção máxima en face e ortogonal foram renderizadas via software computacional; As imagens são dimensionadas individualmente com subtração de fundo e filtragem mediana para clareza. As barras de escala são de 100 μm. (Anticorpos primários e secundários com receita tampão de bloqueio interna são dados na Tabela 3). Clique aqui para ver uma versão maior desta figura.
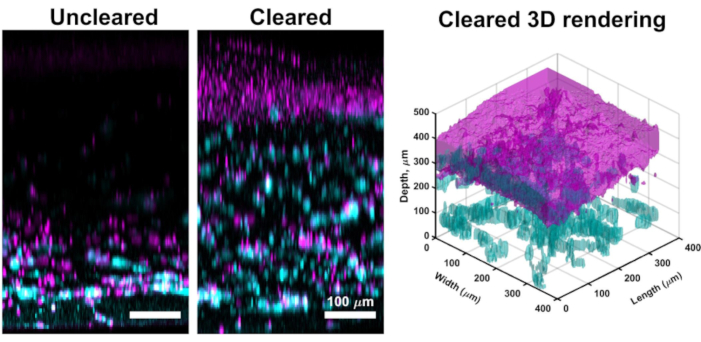
Figura 3: Comparação de VHSE não claramente limpo. Este VHSE foi gerado com IMR90s e imagens foram tiradas no ponto de tempo da cultura de 4wk via microscopia confocal. O colágeno IV é mostrado em ciano; Núcleos são mostrados em magenta; magenta na renderização 3D limpa representa a consolidação de núcleos na camada epidérmica do VHSE. A imagem VHSE não clara é um exemplo de atenuação a laser em construções VHSE mais espessas, através da clareira (metanol e salicilato de metila) toda a construção pode ser imagem com pouca/nenhuma atenuação laser do lado dérmico da construção. As configurações de imagem, incluindo linha laser, ganho e pinhole foram reduzidas para vhse limpo para reduzir a sobressaturação. A limpeza e a imagem foram concluídas conforme descrito nas etapas 6 e 7 do protocolo. Imagens de projeção máxima ortogonal e renderização 3D foram concluídas com software computacional, renderização 3D foi gerada a partir de imagens de construção limpas. As imagens são dimensionadas individualmente com subtração de fundo e filtragem mediana para clareza. As barras de escala são de 100 μm. Por favor, clique aqui para ver uma versão maior desta figura.
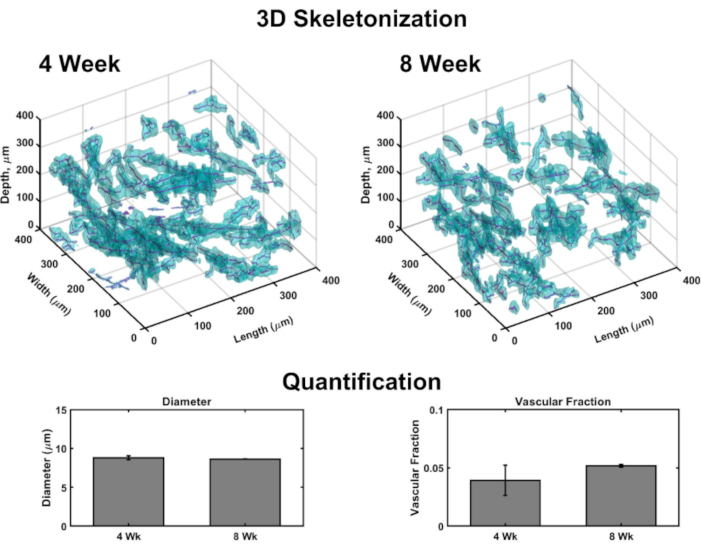
Figura 4: Análise tridimensional da vasculatura dentro das VHSEs. Imagens volumétricas tiradas através de microscopia confocal permitem quantificação de parâmetros vasculares nos pontos finais da cultura através da análise de imagem computacional. A partir de sub-volumes VHSE, a detecção de mancha de colágeno IV (ciano) marca paredes endoteliais de vasculatura e permite a segmentação vascular com base na localização do colágeno IV; os dados de segmentação são então esqueletos, e o centro de cada navio é encontrado (magenta). Exemplos de esquelização 3D são mostrados durante amostras de 4 semanas e 8 semanas de IMR90 VHSE, não limpas. Os dados resultantes de um conjunto de experimentos IMR90 VHSE foram utilizados para calcular os diâmetros do vaso e as frações vasculares para quatro sub-volumes (cada 250 μm na direção z) dentro de cada construção, os dados foram mediados por VHSE e mais mediados por ponto de tempo de cultura. Esses dados mostram a homeostase da rede vascular abrangendo durações culturais de 4 e 8 semanas com diâmetros relevantes para a pele humana in vivo78, e a fração vascular dentro da mesma ordem que a pele humana in vivo79 (fração vascular em construções de colágeno tem se mostrado personalizável48 e poderia ser ainda mais otimizada para maiores valores). Os dados são representados como meios ± média de erro padrão (S.E.M); n = 3 para cada ponto de tempo. Clique aqui para ver uma versão maior desta figura.
| mídia | Componentes |
| Linha celular de fibroblasto dermal humano (hDF) | DMEM HG |
| 5% soro bovino fetal (FBS) | |
| Penicilina/Estreptomicina de 1% (P/S) | |
| Linha celular iMR90 Fibroblast | DMEM/HAM's F12 50:50 |
| 10% FBS | |
| P/S de 1% | |
| Linha celular endotelial HMEC-1 | Meio base MCDB131 |
| 10% FBS | |
| P/S de 1% | |
| L-Glutamina [10 mM] | |
| Fator de Crescimento Epidérmico (EGF) [10 ng/mL] | |
| Hidrocortisona [10 μg/mL] | |
| Linha celular de queratinócito N/TERT-1 | Base de mídia K-SFM |
| P/S de 1% | |
| Extrato de Pituitário Bovino (BPE) [25 μg/mL], do kit de suplemento K-SFM | |
| Fator de Crescimento Epidérmico (EGF) [0,2 ng/mL], do kit de suplemento K-SFM | |
| CaCl2 [0,3 mM] | |
| Diferenciação equivalente da pele humana (HSE) | 3:1 DMEM: F12 de Ham |
| P/S de 1% | |
| 0,5 μM hidrocortisona | |
| Isoproterenol 0,5 μM | |
| Insulina 0,5 μg/mL |
Tabela 1: Receitas de mídia. Receitas de mídia para a cultura 2D dos fibroblastos dérmicos humanos, fibroblastos IMR90, HMEC-1 e queratinócitos N/TERT-1 são dadas. Essas receitas foram usadas para expandir linhas celulares antes de gerar VHSEs. A mídia de diferenciação equivalente à pele humana (HSE) é usada para gerar VHSEs; uma receita base é dada, durante porções de cultura de submersão e indução de estratificação, quantidades afuniladas de FBS devem ser adicionadas conforme descrito no protocolo passo 3. Receita de HSE baseada nessas fontes11,80.
| Concentração de estoque de colágeno (Cs): | 8 | mg/mL | ||
| Volume desejado (Vf): | 1 | Ml | ||
| Normalização do ajuste naoh*: | 1 | X | ||
| *Cada lote de colágeno precisa ser testado para determinar a quantidade de NaOH necessária para definir pH 7 - 7.4 | ||||
| Concentração de colágeno desejada (mg/mL) | ||||
| 2 | 3 | 4 | 5 | |
| 10X PBS (Vpbs) | 0.1 | 0.1 | 0.1 | 0.1 |
| Estoque de colágeno(Vs) | 0.25 | 0.375 | 0.5 | 0.625 |
| 1N Naoh (vNaoh) | 0.00575 | 0.008625 | 0.0115 | 0.014375 |
| Mídia (mídiaV) | 0.64425 | 0.516375 | 0.3885 | 0.260625 |
Tabela 2: Tabela de referência de cálculo de colágeno. A tabela de referência fornece concentrações de colágeno comumente desejadas calculadas assumindo uma concentração de estoque de colágeno de 8 mg/mL e um volume final desejado de 1 mL; todos os valores estão em mL. As equações utilizadas para calcular esses valores são dadas na etapa 2.2 do protocolo. É importante verificar pH para cada estoque de colágeno; se necessário, os valores de NaOH devem ser adicionados para alcançar pH 7 - 7.4 (depois de PBS, NaOH, estoque de colágeno, mídia são adicionados). O protocolo foi otimizado para VHSEs utilizando uma concentração de colágeno de 3 mg/mL; alterações na concentração de colágeno podem ser necessárias para diferentes linhas celulares/resultados finais desejados48.
| Anticorpo primário | fonte | concentração | usar |
| IgG monoclonal do rato Filaggrin (AKH1) | Santa Cruz; sc-66192 (200 μg/mL) | [1:250] | Marcador de diferenciação tardia15 |
| IgG policlonal de coelho involucrin | Proteintech; 55328-1-AP (30 μg/150 μL) | [1:250] | Marcador de diferenciação do terminal tardio15 |
| Cytokeratin 10 (DE-K10) mouse IgG, supernante | Santa Cruz; sc-52318 | [1:350] | Marcador epidérmico suprabásal14,36,59 |
| Policlonal de coelho de colágeno IV | Proteintech; 55131-1-AP | [1:500] | Parede vascular endotelial67 |
| DRAQ 7 | Sinalização celular; 7406 (0,3 mM) | [1:250] | Marcador nuclear |
| Anticorpo secundário | fonte | concentração | usar |
| Cabra Anti-Coelho IgG DyLight™ 488 Conjugados | Invitrogen; 35552 (1 mg/mL) | [1:500] | Colágeno IV secundário |
| Anticorpo anti-coelho IgG (H&L) (CABRA) , DyLight™ 549 Conjugados | Imunoquímicos de Rockland; 611-142-002 | [1:500] | Involucrin secundário |
| Goat Anti-Mouse IgG (H&L), DyLight™ 488 | Termo Científico; 35502 (1 mg/mL) | [1:500] | Filaggrin ou Cytokeratin 10 secundários |
| BUFFER DE BLOQUEIO (500 mL) | |||
| Reagente | quantidade | ||
| ddH2O | 450 mL | ||
| 10 x PBS | 50 mL | ||
| Albumina de soro bovino (BSA) | 5 g | ||
| Tween 20 | 0,5 mL | ||
| Gelatina de peixe de água fria | 1 g | ||
| Azida de Sódio (10% de Azida de Sódio em diH2O) | 5 mL (concentração final de 0,1 % ) | ||
Tabela 3: Anticorpos primários e secundários com receita tampão de bloqueio. Os anticorpos listados e manchas químicas foram utilizados para coloração mostrada na Figura 2, Figura 3, Figura 4. A coloração foi concluída conforme dado na etapa 6 do protocolo usando a receita de tampão de bloqueio listada aqui. Algumas otimizações das concentrações de coloração e da duração podem ser necessárias dependendo das técnicas de cultura escolhidas e das linhas celulares.
Tabela Suplementar 1: Lista de abreviaturas. Lista de abreviaturas incluídas para a conveniência do leitor. Clique aqui para baixar esta tabela.
Figura suplementar 1: Auxílio técnico VHSE para manuseio. O manuseio de VHSEs é desafiador especialmente durante a fixação, processamento e coloração. A-D corresponde às instruções nas etapas 5-7. A mostra o manuseio técnico da remoção da membrana porosa de uma inserção cultural para garantir a coloração adequada. B mostra como manter cada VHSE submerso durante a coloração e armazenamento. C mostra a maneira mais segura e fácil de mover construções para poços de imagem PDMS. D mostra um VHSE sentado em um poço de imagem PDMS: O poço PDMS é colado a um deslizamento de vidro na parte inferior, criando uma janela para imagem, um slide de vidro é colocado em cima para manter a umidade através de longas imagens. Clique aqui para baixar este arquivo.
Figura suplementar 2: A microscopia de fluorescência widefield padrão pode ser usada para avaliar VHSEs. Imagens widefield podem ser usadas para imagens volumosas para avaliação de rotina quando a microscopia de varredura a laser não estiver disponível. Como exemplo, imagens de VHSEs dos aspectos apical e basolateral são mostradas como projeções máximas de face e ortogonal (Ortho.). (Topo) A epiderme foi imagem usando involucrina e núcleos como marcadores. (Inferior) A vasculatura dérmica foi imagem usando colágeno IV como marcador. As imagens são subtraídas para clareza. A luz fora do avião leva aos artefatos "streaking" ou "flare" evidentes nas vistas ortogonais. Imagens widefield podem ser usadas para quantificação, mas podem exigir mais processamento de imagem. Clique aqui para baixar este arquivo.
Discussão
Este protocolo demonstrou um método simples e repetível para a geração de VHSEs e sua análise tridimensional. É importante ressaltar que este método conta com poucas técnicas especializadas ou peças de equipamento, tornando-o acessível para uma gama de laboratórios. Além disso, os tipos de células podem ser substituídos por mudanças limitadas no protocolo, permitindo que os pesquisadores adaptem este protocolo às suas necessidades específicas.
A gelação de colágeno adequada é um passo desafiador no estabelecimento da cultura da pele. Especialmente quando se usam preparações brutas sem purificação, os contaminantes de traços podem influenciar o processo de gelação. Para ajudar a garantir a consistência, grupos de experimentos devem ser realizados com o mesmo estoque de colágeno que será usado para a geração VHSE. Além disso, a gelação deve ocorrer idealmente em um pH de 7-7.4, e os contaminantes de traços podem mudar o pH. Antes de usar qualquer caldo de colágeno, deve-se fazer um gel acelular prática na concentração desejada e o pH deve ser medido antes da gelação. Completar esta verificação de qualidade de colágeno antes de iniciar a semeadura de componentes dérmicos identificará os problemas com a homogeneidade adequada de gelação e colágeno antes de configurar um experimento completo. Em vez de semear colágeno acelular diretamente em uma inserção de cultura, semeou um pouco de colágeno em uma tira de pH que avalia toda a escala de pH e verifica um pH de 7-7.4. A gelação pode ser avaliada aplicando uma gota da solução de gel de colágeno em uma placa de plástico de cultura de tecido ou cultura de tecido (uma placa de poço é recomendada para simular os lados confinados de uma inserção de cultura). Após o tempo de gelação, o colágeno deve ser sólido, ou seja, não deve fluir quando a placa estiver inclinada. Sob microscopia de contraste de fase, o colágeno deve parecer homogêneo e claro. Bolhas ocasionais de sementes de colágeno são normais, mas grandes bolhas amorfas de colágeno opaco dentro do gel claro indica um problema provável devido à mistura insuficiente, pH errado e/ou falha em manter o colágeno refrigerado durante a mistura.
As quantidades de semeadura de células e a mídia podem ser ajustadas. No protocolo acima, as quantidades de células encapsuladas foram otimizadas para uma inserção de 12 poços em 7,5 x 104 fibroblastos e 7,5 x 105 células endoteliais por mL de colágeno com 1,7 x 105 queratinócitos semeados em cima da construção dérmica. As densidades celulares foram otimizadas para este protocolo VHSE com base nos estudos preliminares e na pesquisa anterior que investigou a geração de rede vascular 3D em várias concentrações de colágeno48 e HSE geração22,80,81. Em sistemas semelhantes, as densidades de células endoteliais publicadas são 1,0 x 106 células/mL colágeno48; as concentrações do fibroblasto muitas vezes variam de 0,4 x 105 células/mL de colágeno22,28,82 a 1 x 105 células/mL de colágeno8,58,83,84,85; e as concentrações de queratinócitos variam de 0,5 x 105 [células/cm2]80 a 1 x 105 [células/cm2]8. As densidades celulares podem ser otimizadas para células específicas e questões de pesquisa. Culturas tridimensionais com células contratuais, como fibroblastos, podem se contrair levando à redução da viabilidade e perda de cultura86,87. Experimentos preliminares devem ser concluídos para testar a contração do compartimento dérmico (que pode ocorrer com mais células dérmicas, mais células dérmicas contratuais, culturas de submersão mais longas ou matrizes mais macias) e testar a cobertura epidérmica da superfície. Além disso, o número de dias em submersão e a taxa de afunilamento do conteúdo do soro também podem ser personalizados se a contração dérmica excessiva estiver ocorrendo ou uma taxa diferente de cobertura de queratinócitos for necessária. Por exemplo, se a contração for notada durante o período de submersão dérmica ou enquanto os queratinócitos estão estabelecendo uma monocamada superficial, movendo-se mais rapidamente através do processo de afunilamento do soro e levantando VHSEs para ALI pode ajudar na prevenção de contração adicional. Da mesma forma, se a cobertura de queratinócitos não for ideal, alterar o número de dias em que o VHSE está submerso sem soro pode ajudar a aumentar a cobertura epidérmica de monocamadas e mitigar a contração, uma vez que o soro é deixado de fora. Mudanças nas densidades celulares ou outras sugestões acima devem ser otimizadas para as culturas específicas e objetivos de pesquisa.
Para estabelecer uma estratificação adequada da epiderme durante o período de interface líquida de ar (ALI), é fundamental verificar e manter regularmente os níveis de fluidos em cada poço para que a ALI e a hidratação apropriada de cada construção sejam mantidas durante todo o comprimento da cultura. Os níveis de mídia devem ser verificados e rastreados diariamente até que os níveis consistentes de ALI sejam estabelecidos. A camada epidérmica deve parecer hidratada, não seca, mas não deve haver piscinas de mídia na construção. Durante a ALI, a construção desenvolverá uma cor branca/amarela opaca que é normal. A camada epidérmica provavelmente se desenvolverá de forma desigual. Comumente, os VHSEs são inclinados devido à semeadura de colágeno ou contração dérmica. Também é normal observar uma porção epidérmica mais alta no meio do construto em construções menores (24 de tamanho) e uma formação de cume em torno do perímetro do VHSE em 12 tamanhos. A contração dos construtos13 pode alterar essas formações topográficas e/ou não ser observada.
A coloração e a imagem dos VHSEs introduzem manipulação mecânica aos VHSEs. É muito importante planejar e limitar a manipulação de cada cultura. Quando a manipulação for necessária, mantenha movimentos suaves ao remover VHSEs das membranas de inserção, ao adicionar soluções de coloração ou lavagem à superfície do construto e ao remover e substituir VHSEs em seus poços de armazenamento/imagem durante a preparação de imagens. Especificamente, as camadas apical do componente epidérmico podem ser frágeis e correm o risco de tirar as camadas epidérmicas basais. As camadas apical da epiderme são frágeis e passam por desquamação mesmo no tecido nativo4,mas para análise precisa da estrutura epidérmica é importante minimizar danos ou perdas. Se as camadas epidérmicas decolarem da construção, elas podem ser imagens separadamente. As camadas basais da epiderme provavelmente ainda estão ligadas à derme, enquanto porções das camadas apical podem se desprender. Para visualização da epiderme, uma mancha nuclear é útil para observar isso, uma vez que núcleos densos são uma característica de camadas inferiores e médias da epiderme.
A imagem confocal da pós-fixação VHSE foi discutida no protocolo, mas também é possível imaginar os VHSEs em toda a cultura através da tomografia de coerência óptica baseada em vertical (OUT)88,89,90,91,92,93. VHSE são estáveis o suficiente para suportar imagens sem incubação ou umidificação por pelo menos duas horas sem efeitos perceptíveis. Como o OCT é livre de rótulos e não invasivo, é possível rastrear a espessura epidérmica durante a maturação. Outras modalidades de imagem não invasivas também podem ser empregadas.
A imagem volumosa das estruturas dérmicas e epidérmicas combinadas pode ser desafiadora devido à atenuação a laser mais profunda no VHSE. Isso pode ser mitigado por imagem do construto em duas orientações, do lado epidérmico(Figura 1) e do lado dérmico(Figura 2),permitindo uma boa resolução das estruturas vasculares dérmicas e da epiderme. Além disso, a amostra pode ser limpa, permitindo imagens volumosas de toda a estrutura com atenuação mínima. No entanto, foram tentados vários métodos de compensação, no entanto, o método de salicilato de metanol/metila descrito produziu os melhores resultados. Pesquisadores interessados em otimizar outros métodos de compensação são direcionados para essas revisões49,61,62. Se for limpa, é sugerido a imagem completa da amostra antes da limpeza, pois o método pode danificar os fluoroforos e/ou a estrutura. Além disso, a imagem deve ser concluída o mais rápido possível após a clareira, pois a fluorescência pode desaparecer em poucos dias.
Para simplicidade e acessibilidade, este protocolo utilizou as misturas de mídia mais simples encontradas na literatura anterior11,80. Embora existam muitas vantagens em usar misturas de mídia simples, as limitações dessa escolha também são reconhecidas. Outros grupos estudaram os efeitos de componentes específicos da mídia sobre a saúde epidérmica e dérmica e descobriram que outros aditivos de mídia94, como ácidos graxos/lipídios livres externos, melhoram o corneum estrato da epiderme e melhoram a função da barreira cutânea. Embora nossos marcadores imunofluorescentes mostrem diferenciação e estratificação adequadas na epiderme, dependendo dos estudos que estão sendo conduzidos, pode ser necessária otimização adicional da mídia. Além disso, não foi realizada uma extensa análise da BM epidérmica ao avaliar as VHSEs aqui apresentadas. A integridade do BM é uma importante indicação de equivalentes de pele; vários grupos fizeram pesquisas sobre a duração da cultura e seu efeito sobre as marcas de MMC95, bem como a análise da presença do fibroblasto e adicionados efeitos do fator de crescimento na expressão BM14. É importante ressaltar que a análise do componente BM deve ser avaliada e otimizada ao utilizar este protocolo.
Neste protocolo é descrito um procedimento para a geração VHSE, demonstrando resultados após 8 semanas na ALI. As culturas VHSE foram cultivadas até 12 semanas na ALI sem mudanças perceptíveis ou perda de viabilidade, e é possível que elas possam ser viáveis por mais tempo. É importante ressaltar que este protocolo é prontamente adaptável aos tipos de células comumente disponíveis, como demonstrado pela substituição de fibroblastos dérmicos por fibroblastos pulmonares IMR90. Dependendo da necessidade do pesquisador e dos recursos disponíveis, os tipos de células e misturas de mídia sobre a cultura podem ser ajustados, embora tipos de células mais diferentes possam exigir otimização da mídia. Em resumo, esses procedimentos visam fornecer clareza sobre a cultura das VHSEs para o estudo da biologia da pele e da doença. Para maximizar a acessibilidade, o protocolo foi desenvolvido tão simples e robusto utilizando equipamentos comuns, linhas celulares e reagentes como uma abordagem mínima e eficaz que pode ser ainda mais personalizada às necessidades específicas de estudos de pesquisa.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores agradecem ao Dr. Jim Rheinwald59 e à Dra. Este trabalho foi apoiado pela American Heart Association (19IPLOI34760636).
Materiais
| Name | Company | Catalog Number | Comments |
| 1 N NaOH | Fisher Chemical | S318-100 | (Dilute from Lab stock) |
| 4% Paraformaldehyde | ACROS Organics | #41678-5000, Lot # B0143461 | Made up using solid Paraformaldehyde in PBS, pH adjusted to 6.9 |
| Autoclaved forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| CaCl2 | Fisher bioreagents | Cat # BP510-250, Lot # 190231 | Rnase, Dnase, Protease-Free |
| Cell line, Endothelial: Microvascular Endothelial Cell (HMEC1) | ATCC | CRL-3243 | SV40 Immortalized microvascular endothelial cell. Note that 750,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: dermal Human fibroblast, adult | ATCC | PCS-201-012 | Primary dermal cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: human lung firbroblast (IMR90) | ATCC | CCL-186 | Primary embryonic cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Keratinocyte: N/TERT-1 | Immortalized via hTERT expression. N/TERT-1 was made using a retroviral vector conferring hygromycin resistance. Cell line established by Dickson et al. 2000. Can be replaced with ATCC PCS-200-010 or PCS-200-011. Note that 170,000 cells were used per construct; N/TERT1 cells must be used from plates that are 30% confluent- two 30% confluent 90 mm tissue culture dishes give more than enough cells.The authors thank Dr. Jim Rheinwald and Dr. Ellen H. van den Bogaard for their generous gift of N/TERT cell lines. | ||
| Centrifuge | Thermo Scientific; Sorvall Legend X1R | (standard lab equipment) | |
| Computational Software | MATLAB | MATLAB 2020a | MathWorks, Natick, MA. |
| Confocal Microscope | Leica TCS SPEII confocal | Laser scanning confocal. Can be replaced with other confocals or deconvolution microscopy. | |
| Cover Glass (22 x 22) | Fisher Scientific | 12-545F | 0.13-0.17 mm No.1 Thickness |
| Cyanoacrylate super glue or silicone grease | Glue Masters | #THI0102 | Glue Masters, THICK, Instant Glue, Cyanoacrylate; super glue is preferred |
| DMEM media base | Corning; Mediatech, Inc | REF # 10-013-CM; Lot # 26119007 | DMEM, 1X (Dulbecco's Modification of Eagle's Medium) with 4.5 g/L glucose, L-glutamine & sodium pyruvate |
| DMEM/F-12 50/50 | Corning; Mediatech, Inc | REF # 10-090-CV; Lot # 21119006 | DMEM/F-12 50/50, 1X (Dulbecco's Mod. Of Eagle's Medium/Ham's F12 50/50 Mix) with L-glutamine |
| Ethanol | Decon Labs | #V1101 | (standard lab reagent) |
| Fetal Bovine Serum | Fisher Scientific | Cat # FB12999102, Lot # AE29451050 | Research Grade Fetal Bovine Serum, Triple 0.1 um sterile filtered |
| Fine tip forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| Human Epidermal Growth Factor (EGF) | Peprotech | Cat # AF-100-15-1MG, Lot # 0318AFC05 D0218 | Made up in 0.1% BSA in PBS |
| Hydrocortisone | Alpha Easar | Lot # 5002F2A | made up in DMSO |
| Insulin (human) | Peprotech | Lot # 9352621 | |
| Inverted Light/Phase Contrast Microscope | VWR | 76317-470 | (standard lab equipment) |
| Isoproterenol | Alfa Aesar | #AAJ6178806 | DL-Isoproterenol hydrochloride, 98% |
| Keratinocyte-SFM (1x) media base | Gibco; Life Technologies Corporation | REF #: 10724-011; Lot # 2085518 | Keratinocyte-SFM (1X); serum free medium |
| L-Ascorbic Acid | Fisher Chemical | Cat # A61-100, Lot # 181977, CAS # 50-81-7 | Crystalline. L-Ascorbic acid can also be purchased as a salt |
| L-glutamine (solid) | Fisher Bioreagents | CAT # BP379-100, LOT # 172183, CAS # 56-85-9 | L-Glutamine, white crystals or Crystalline powder |
| MCDB 131 media base | Gen Depot | CM034-050, Lot # 03062021 | MCDB 131 Medium Base, No L-Glutamine, sterile filtered |
| Metal punches | Sona Enterprises (SE) | 791LP, 12PC | Hollow Leather Punch Set, High Carbon Steel, Hardness: 48HRC; (various sizes including): 1/8", 5/32", 3/16", 7/32", 1/4", 9/32", 5/16", 3/4", 7/16", 1/2", 5/8:, 3/4". This punch set is helpful, but x-acto knife can work as well. Size of metal punch that works well for 12 well transwell VHSE is 3/8" or 1/2". |
| Methanol | Fisher Chemical | CAS # 67-56-1 | (optional). For clearing dehydration step. |
| Methyl Salicylate | Fisher Chemical | O3695-500; Lot # 164535; CAS # 119-36-8 | (optional). For clearing. |
| Microtubes, 1.7 mL | Genesee Scientific Corporation; Olympus Plastics | Cat # 24-282; Lot # 19467 | 1.7 ml Microtubes, Clear; Boilproof, Polypropulene, Certified Rnase, Dnase, DNA, PCR inhibitor and endotoxin-Free |
| PBS, 10x Culture grade or autoclaved | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. |
| PBS, 1x Culture grade, (-) Calcium, (-) magnesium | Genesee Scientific Corporation | Ref # 25-508; Lot # 07171015 | |
| PBS, 1x non-Culture grade | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. Dilute to 1x with water. |
| Penicillin/Streptomycin | Gibco; Life Technologies Corporation | Ref # 15140-122, Lot # 2199839 | Pen Strep (10,000 Units/mL Penicillin; 10,000 ug/mL Streptomycin) |
| Petri Dish, glass, small | Corning | PYREX 316060 | (optional). To be used as a clearing container |
| Petri Dishes, 100 mm | Fisher Scientific | FB0875713 | Use for making up PDMS. |
| Polydimethylsiloxane (PDMS) | Dow Corning | GMID 02065622, Batch # H04719H035 | Sylgard 184 Silicone Elastomer Base, Dow Corning, Midland, MI) |
| Dow Corning | GMID 02065622, Batch # H047JC4003 | DOWSIL 184, Silicone Elastomer Curing Agent | |
| note: PDMS is usually sold as a kit that includes both the base and curing agent components. | |||
| Positive Displacement Pipettes (1000 & 250 uL) | Gilson | 1000 uL: HM05136, M1000. 250 uL: T12269L | M1000 pipette capacity (100-1000 uL); M250 pipette capacity to 250 uL |
| Positive Displacement Tips/Pistons (1000 & 250 uL) | Gilson | 1000 uL: CAT # F148180, BATCH # B01292902S; 250 uL: CAT # F148114, BATCH # B05549718S | Sterilized capillaries and pistons |
| Round tipped scoopula | (optional; standard lab equipment) For manipulation of VHSEs prior to imaging | ||
| Supplements for Keratinocyte-SFM media | Gibco; Life Technologies Corporation | Ref # 37000-015, Lot # 2154180 | Contains EGF Human Recombinant (Cat # 10450-013), Bovine Pituitary Extract (Cat # 13028-014) |
| Tissue Culture Plate Inserts, 12 well size, 3 µm pore size | Corning; Costar | REF # 3462 - Clear; Lot # 14919057 | Transwell; 12 mm Diameter Inserts, 3.0 um pore size, tissue culture treated, polyester membrane, polystyrene plates, |
| Tissue Culture Plates, 12 well size | Greiner Bio-one; CellStar | Cat # 665 180; Lot # E18103QT | 12 well cell culture plate; sterile, with lid; products are sterile, free of detectable Dnase, Rnase, human DNA and pyrogens. Contents non-cytotoxic |
| Tissue Culture Plates, 60.8cm^2 growth area | Genesee Scientific Corporation | Cat # 25-202; Lot No: 191218-177B | Tissue culture dishes; treated, growth area 60.8 cm^2; sterile, Dnase, Rnase, Pyrogen Free; virgin polystyrene |
| Triton x 100 | Ricca Chemical Company | Cat # 8698.5-16, Lot # 4708R34 | Wetting agent |
| Trypsin 0.25% | Corning; Mediatech, Inc | Ref # 25-053-CI | 0.25% Trypsin, 2.21 mM EDTA, 1x [-] sodium bicarbonate |
| Type 1 Collagen isolated from Rat tail | Pel-Freez Biologicals | 56054-1 | Sprauge-Dawley rat tails can be purchased frozen from Pel-Freez or other suppliers. Collagen can be isolated from the tail tendons. Isolation Protocol references [Cross et al.,2010; Rajan et al.,2007; Bornstein, 1958] .Alternatively, high concentration rat-tail collagen can be purchased from suppliers including Corning (Catalog Number: 354249) |
| Vaccum chamber, benchtop | Bel-Art | F42010-0000 | (standard lab equipment) |
| Handheld Precision knife | X-Acto | X3311 | (X-Acto knife optional if purchased steel punches) |
Referências
- Stojic, M., et al. Skin tissue engineering 3. Biomaterials for Skin Repair and Regeneration. , 59 (2019).
- Shevchenko, R. V., James, S. L., James, S. E. A review of tissue-engineered skin bioconstructs available for skin reconstruction. Journal of The Royal Society Interface. 7 (43), 229-258 (2010).
- Kolarsick, P. A. J., Kolarsick, M. A., Goodwin, C. Anatomy and Physiology of the Skin. Journal of the Dermatology Nurses' Association. 3 (4), (2011).
- McGrath, J. A., Eady, R. A. J., Pope, F. M. Anatomy and organization of human skin. Rook's textbook of dermatology. 10, 9781444317633 (2004).
- Zomer, H. D., Trentin, A. G. Skin wound healing in humans and mice: Challenges in translational research. Journal of Dermatological Science. 90 (1), 3-12 (2018).
- Zhang, Z., Michniak-Kohn, B. B. Tissue Engineered Human Skin Equivalents. Pharmaceutics. 4 (1), (2012).
- Oh, J. W., Hsi, T. -. C., Guerrero-Juarez, C. F., Ramos, R., Plikus, M. V. Organotypic skin culture. The Journal of investigative dermatology. 133 (11), 1-4 (2013).
- El-Ghalbzouri, A., Gibbs, S., Lamme, E., Van Blitterswijk, C. A., Ponec, M. Effect of fibroblasts on epidermal regeneration. British Journal of Dermatology. 147 (2), 230-243 (2002).
- Sun, T., Haycock, J., MacNeil, S. In situ image analysis of interactions between normal human keratinocytes and fibroblasts cultured in three-dimensional fibrin gels. Biomaterials. 27 (18), 3459-3465 (2006).
- Kreimendahl, F., et al. Macrophages significantly enhance wound healing in a vascularized skin model. Journal of Biomedical Materials Research Part A. 107, 1340-1350 (2019).
- El Ghalbzouri, A., Commandeur, S., Rietveld, M. H., Mulder, A. A., Willemze, R. Replacement of animal-derived collagen matrix by human fibroblast-derived dermal matrix for human skin equivalent products. Biomaterials. 30 (1), 71-78 (2009).
- Roger, M., et al. Bioengineering the microanatomy of human skin. Journal of Anatomy. 234, 438-455 (2019).
- Carlson, M. W., Alt-Holland, A., Egles, C., Garlick, J. A. Three-Dimensional Tissue Models of Normal and Diseased Skin. Current Protocols in Cell Biology. 41 (1), 1-17 (2008).
- El Ghalbzouri, A., Jonkman, M. F., Dijkman, R., Ponec, M. Basement Membrane Reconstruction in Human Skin Equivalents Is Regulated by Fibroblasts and/or Exogenously Activated Keratinocytes. Journal of Investigative Dermatology. 124 (1), 79-86 (2005).
- Pruniéras, M., Régnier, M., Woodley, D. Methods for cultivation of keratinocytes with an air-liquid interface. The Journal of Investigative Dermatology. 81, 28-33 (1983).
- Ali, N., Hosseini, M., Vainio, S., Taieb, A., Cario-André, M., Rezvani, H. R. Skin equivalents: skin from reconstructions as models to study skin development and diseases. British Journal of Dermatology. 173 (2), 391-403 (2015).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Innovative tissue models for drug discovery and development. 69-70, 81-102 (2014).
- Mieremet, A., Rietveld, M., Absalah, S., van Smeden, J., Bouwstra, J. A., El Ghalbzouri, A. Improved epidermal barrier formation in human skin models by chitosan modulated dermal matrices. PLOS ONE. 12 (3), 0174478 (2017).
- Vidal, S. E. L., Tamamoto, K. A., Nguyen, H., Abbott, R. D., Cairns, D. M., Kaplan, D. L. 3D biomaterial matrix to support long term, full thickness, immuno-competent human skin equivalents with nervous system components. Organoids and Ex Vivo Tissue On-Chip Technologies. 198, 194-203 (2019).
- Smits, J. P. H., et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models. Scientific Reports. 7 (1), 11838 (2017).
- Lebonvallet, N., et al. Effects of the re-innervation of organotypic skin explants on the epidermis. Experimental Dermatology. 21 (2), 156-158 (2011).
- Van Drongelen, V., et al. Barrier Properties of an N/TERT-Based Human Skin Equivalent. Tissue Engineering Part A. 20 (21-22), 3041-3049 (2014).
- . Establishment and initial characterization of a simple 3D organotypic wound healing model Available from: https://opus.hs-furtwangen.de/frontdoor/index/index/docld/4852 (2018)
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18 (5), 240-249 (2013).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Amelian, A., Wasilewska, K., Megias, D., Winnicka, K. Application of standard cell cultures and 3D in vitro tissue models as an effective tool in drug design and development. Pharmacological Reports. 69 (5), 861-870 (2017).
- Lu, W., et al. Mixture of Fibroblasts and Adipose Tissue-Derived Stem Cells Can Improve Epidermal Morphogenesis of Tissue-Engineered Skin. Cells Tissues Organs. 195 (3), 197-206 (2012).
- Marino, D., Luginbühl, J., Scola, S., Meuli, M., Reichmann, E. Bioengineering Dermo-Epidermal Skin Grafts with Blood and Lymphatic Capillaries. Science Translational Medicine. 6 (221), 221 (2014).
- Martins-Green, M., Li, Q. -. J., Yao, M. A new generation organ culture arising from cross-talk between multiple primary human cell types. The FASEB Journal. 19 (2), 222-224 (2004).
- Kim, B. S., Gao, G., Kim, J. Y., Cho, D. -. W. 3D Cell Printing of Perfusable Vascularized Human Skin Equivalent Composed of Epidermis, Dermis, and Hypodermis for Better Structural Recapitulation of Native Skin. Advanced Healthcare Materials. 8 (7), 1801019 (2019).
- Baltazar, T., et al. 3D bioprinting of a vascularized and perfusable skin graft using human keratinocytes. Tissue Engineering Part A. 26 (5-6), 227-238 (2019).
- Klar, A. S., et al. Tissue-engineered dermo-epidermal skin grafts prevascularized with adipose-derived cells. Biomaterials. 35 (19), 5065-5078 (2014).
- Grebenyuk, S., Ranga, A. Engineering Organoid Vascularization. Frontiers in Bioengineering and Biotechnology. 7, (2019).
- Black, A. F., Berthod, F., L'heureux, N., Germain, L., Auger, F. A. In vitro reconstruction of a human capillary-like network in a tissue-engineered skin equivalent. The FASEB Journal. 12 (13), 1331-1340 (1998).
- Huber, B., Link, A., Linke, K., Gehrke, S. A., Winnefeld, M., Kluger, P. J. Integration of Mature Adipocytes to Build-Up a Functional Three-Layered Full-Skin Equivalent. Tissue Engineering Part C: Methods. 22 (8), 756-764 (2016).
- Monfort, A., Soriano-Navarro, M., García-Verdugo, J. M., Izeta, A. Production of human tissue-engineered skin trilayer on a plasma-based hypodermis. Journal of Tissue Engineering and Regenerative Medicine. 7 (6), 479-490 (2013).
- Shamis, Y., et al. Fibroblasts derived from human embryonic stem cells direct development and repair of 3D human skin equivalents. Stem Cell Research & Therapy. 2 (1), 10 (2011).
- Kim, Y., et al. Establishment of a complex skin structure via layered co-culture of keratinocytes and fibroblasts derived from induced pluripotent stem cells. Stem Cell Research & Therapy. 9 (1), 217 (2018).
- Chau, D. Y. S., Johnson, C., MacNeil, S., Haycock, J. W., Ghaemmaghami, A. M. The development of a 3D immunocompetent model of human skin. Biofabrication. 5 (3), 035011 (2013).
- Vanden Bogaard, E. H., et al. Crosstalk between Keratinocytes and T Cells in a 3D Microenvironment: A Model to Study Inflammatory Skin Diseases. Journal of Investigative Dermatology. 134 (3), 719-727 (2014).
- Linde, N., Gutschalk, C. M., Hoffmann, C., Yilmaz, D., Mueller, M. M. Integrating Macrophages into Organotypic Co-Cultures: A 3D In Vitro Model to Study Tumor-Associated Macrophages. PLOS ONE. 7 (7), 40058 (2012).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical Advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Weinmüllner, R., et al. Organotypic human skin culture models constructed with senescent fibroblasts show hallmarks of skin aging. npj Aging and Mechanisms of Disease. 6 (1), 4 (2020).
- Barker, C. L., et al. The Development and Characterization of an In Vitro Model of Psoriasis. Journal of Investigative Dermatology. 123 (5), 892-901 (2004).
- Larcher, F., Espada, J., Díaz-Ley, B., Jaén, P., Juarranz, A., Quintanilla, M. New Experimental Models of Skin Homeostasis and Diseases. Actas Dermo-Sifiliográficas (English Edition). 106 (1), 17-28 (2015).
- Varkey, M., Ding, J., Tredget, E. E. Fibrotic Remodeling of Tissue-Engineered Skin with Deep Dermal Fibroblasts Is Reduced by Keratinocytes. Tissue Engineering Part A. 20 (3-4), 716-727 (2013).
- Moulin, V. J. Reconstitution of skin fibrosis development using a tissue engineering approach. Methods in Molecular Biology. 961, 287-303 (2013).
- Morgan, J. T., Shirazi, J., Comber, E. M., Eschenburg, C., Gleghorn, J. P. Fabrication of centimeter-scale and geometrically arbitrary vascular networks using in vitro self-assembly. Biomaterials. 189, 37-47 (2019).
- Silvestri, L., Costantini, I., Sacconi, L., Pavone, F. S. Clearing of fixed tissue: a review from a microscopist's perspective. Journal of Biomedical Optics. 21 (8), 1-8 (2016).
- Cross, V. L., et al. Dense type I collagen matrices that support cellular remodeling and microfabrication for studies of tumor angiogenesis and vasculogenesis in vitro. Biomaterials. 31 (33), 8596-8607 (2010).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1, 2753 (2007).
- Bornstein, M. B. Reconstituted rat-tail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Laboratory Investigation. 7 (2), 134-137 (1958).
- Clément, M. -. V., Ramalingam, J., Long, L. H., Halliwell, B. The In Vitro Cytotoxicity of Ascorbate Depends on the Culture Medium Used to Perform the Assay and Involves Hydrogen Peroxide. Antioxidants & Redox Signaling. 3 (1), 157-163 (2001).
- Tajima, S., Pinnell, S. R. Ascorbic acid preferentially enhances type I and III collagen gene transcription in human skin fibroblasts. Journal of Dermatological Science. 11 (3), 250-253 (1996).
- Murad, S., Tajima, S., Johnson, G. R., Sivarajah, A., Pinnell, S. R. Collagen Synthesis in Cultured Human Skin Fibroblasts: Effect of Ascorbic Acid and Its Analogs. Journal of Investigative Dermatology. 81 (2), 158-162 (1983).
- Villacorta, L., Azzi, A., Zingg, J. -. M. Regulatory role of vitamins E and C on extracellular matrix components of the vascular system. Vitamin E: An Overview of Major Research Directions. 28 (5), 507-537 (2007).
- Ashino, H., et al. Novel Function of Ascorbic Acid as an Angiostatic Factor. Angiogenesis. 6 (4), 259-269 (2003).
- Ponec, M., et al. The Formation of Competent Barrier Lipids in Reconstructed Human Epidermis Requires the Presence of Vitamin C. Journal of Investigative Dermatology. 109 (3), 348-355 (1997).
- Dickson, M. A., et al. Human keratinocytes that express hTERT and also bypass a p16(INK4a)-enforced mechanism that limits life span become immortal yet retain normal growth and differentiation characteristics. Molecular and Cellular Biology. 20 (4), 1436-1447 (2000).
- Johansen, C. Generation and Culturing of Primary Human Keratinocytes from Adult Skin. Journal of visualized experiments: JoVE. (130), e56863 (2017).
- Richardson, D. S., Lichtman, J. W. Clarifying Tissue Clearing. Cell. 162 (2), 246-257 (2015).
- Ariel, P. A beginner's guide to tissue clearing. The International Journal of Biochemistry & Cell Biology. 84, 35-39 (2017).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502 (2010).
- Ng, J. M. K., Gitlin, I., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. ELECTROPHORESIS. 23 (20), 3461-3473 (2002).
- Eddings, M. A., Johnson, M. A., Gale, B. K. Determining the optimal PDMS-PDMS bonding technique for microfluidic devices. Journal of Micromechanics and Microengineering. 18 (6), 067001 (2008).
- Markov, D. A., Lillie, E. M., Garbett, S. P., McCawley, L. J. Variation in diffusion of gases through PDMS due to plasma surface treatment and storage conditions. Biomedical microdevices. 16 (1), 91-96 (2014).
- Katzenberg, F. Plasma-bonding of poly(dimethylsiloxane) to glass. e-Polymers. 5 (1), (2005).
- El Ghalbzouri, A., Lamme, E., Ponec, M. Crucial role of fibroblasts in regulating epidermal morphogenesis. Cell and Tissue Research. 310 (2), 189-199 (2002).
- Kanitakis, J. Anatomy, histology and immunohistochemistry of normal human skin. European journal of dermatology: EJD. 12 (4), 390-399 (2002).
- Hessian based Frangi Vesselness filter. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/24409-hessian-based-frangi-vesselness-filter (2010)
- Jerman, T., Pernuš, F., Likar, B. Špiclin Enhancement of Vascular Structures in 3D and 2D Angiographic Images. IEEE Transactions on Medical Imaging. 35 (9), 2107-2118 (2016).
- Kovesi, P. Phase Preserving Denoising of Images. signal. 4, 6 (1999).
- Vincent, L. Morphological grayscale reconstruction in image analysis: applications and efficient algorithms. IEEE Transactions on Image Processing. 2 (2), 176-201 (1993).
- Xie, L., et al. Quantitative susceptibility mapping of kidney inflammation and fibrosis in type 1 angiotensin receptor-deficient mice. NMR in Biomedicine. 26 (12), 1853-1863 (2013).
- Van Uitert, R., Bitter, I. Subvoxel precise skeletons of volumetric data based on fast marching methods. Medical Physics. 34 (2), 627-638 (2007).
- Sethian, J. A. A fast marching level set method for monotonically advancing fronts. Proceedings of the National Academy of Sciences of the United States of America. 93 (4), 1591-1595 (1996).
- Sethian, J. A. Fast Marching Methods. SIAM Review. 41 (2), 199-235 (1999).
- Braverman, I. M. The Cutaneous Microcirculation. Journal of Investigative Dermatology Symposium Proceedings. 5 (1), 3-9 (2000).
- Men, S. J., Chen, C. -. L., Wei, W., Lai, T. -. Y., Song, S. Z., Wang, R. K. Repeatability of vessel density measurement in human skin by OCT-based microangiography. Skin research and technology: official journal of International Society for Bioengineering and the Skin (ISBS) [and] International Society for Digital Imaging of Skin (ISDIS) [and] International Society for Skin Imaging (ISSI). 23 (4), 607-612 (2017).
- Commandeur, S., Ho, S. H., de Gruijl, F. R., Willemze, R., Tensen, C. P., El Ghalbzouri, A. Functional characterization of cancer-associated fibroblasts of human cutaneous squamous cell carcinoma. Experimental Dermatology. 20 (9), 737-742 (2011).
- Thakoersing, V. S., Danso, M. O., Mulder, A., Gooris, G., Ghalbzouri, A. E., Bouwstra, J. A. Nature versus nurture: does human skin maintain its stratum corneum lipid properties in vitro. Experimental Dermatology. 21 (11), 865-870 (2012).
- Thakoersing, V. S., Gooris, G. S., Mulder, A., Rietveld, M., El Ghalbzouri, A., Bouwstra, J. A. Unraveling barrier properties of three different in-house human skin equivalents. Tissue Engineering. Part C, Methods. 18 (1), 1-11 (2012).
- Bouwstra, J. A., Groenink, H. W. W., Kempenaar, J. A., Romeijn, S. G., Ponec, M. Water distribution and natural moisturizer factor content in human skin equivalents are regulated by environmental relative humidity. The Journal of Investigative Dermatology. 128 (2), 378-388 (2008).
- Thakoersing, V. S., van Smeden, J., Mulder, A. A., Vreeken, R. J., El Ghalbzouri, A., Bouwstra, J. A. Increased Presence of Monounsaturated Fatty Acids in the Stratum Corneum of Human Skin Equivalents. Journal of Investigative Dermatology. 133 (1), 59-67 (2013).
- Smola, H., Thiekötter, G., Fusenig, N. Mutual induction of growth factor gene expression by epidermal-dermal cell interaction. The Journal of Cell Biology. 122 (2), 417 (1993).
- Fluck, J., Querfeld, C., Cremer, A., Niland, S., Krieg, T., Sollberg, S. Normal Human Primary Fibroblasts Undergo Apoptosis in Three-Dimensional Contractile Collagen Gels. Journal of Investigative Dermatology. 110 (2), 153-157 (1998).
- Nakagawa, S., Pawelek, P., Grinnell, F. Long-Term Culture of Fibroblasts in Contracted Collagen Gels: Effects on Cell Growth and Biosynthetic Activity. Journal of Investigative Dermatology. 93 (6), 792-798 (1989).
- Smith, L. E., Bonesi, M., Smallwood, R., Matcher, S. J., MacNeil, S. Using swept-source optical coherence tomography to monitor the formation of neo-epidermis in tissue-engineered skin. Journal of Tissue Engineering and Regenerative Medicine. 4 (8), 652-658 (2010).
- Pierce, M. C., Strasswimmer, J., Park, H., Cense, B., De Boer, J. F. Birefringence measurements in human skin using polarization-sensitive optical coherence tomography. Biomed Opt. 2 (2), 287-291 (2004).
- Pierce, M. C., Strasswimmer, J., Hyle Park, B., Cense, B., de Boer, J. F. Advances in Optical Coherence Tomography Imaging for Dermatology. Journal of Investigative Dermatology. 123 (3), 458-463 (2004).
- Yeh, A. T., Kao, B., Jung, W. G., Chen, Z., Nelson, J. S., Tromberg, B. J. Imaging wound healing using optical coherence tomography and multiphoton microscopy in an in vitro skin-equivalent tissue model. Journal of Biomedical Optics. 9 (2), 9 (2004).
- Derr, K., et al. Fully Three-Dimensional Bioprinted Skin Equivalent Contructs with Validated Morphology and Barrier Funtion. Tissue Engineering Part C: Methods. 25 (6), 334-343 (2019).
- Park, B. H., de Boer, J. F. Polarization Sensitive Optical Coherence Tomography. Optical Coherence Tomography: Technology and Applications. , 1055-1101 (2015).
- Batheja, P., Song, Y., Wertz, P., Michniak-Kohn, B. Effects of Growth Conditions on the Barrier Properties of a Human Skin Equivalent. Pharmaceutical Research. 26 (7), 1689-1700 (2009).
- Dos Santos, M., Metral, E., Boher, A., Rousselle, P., Thepot, A., Damour, O. In vitro 3-D model based on extending time of culture for studying chronological epidermis aging. Matrix Biology. 47, 85-97 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados